
Abstrak
Peningkatan efisiensi fotokatalis yang terkenal dalam reaksi evolusi hidrogen bergantung pada pengembangan ko-katalis yang hemat biaya dan sangat efisien. Rekombinasi cepat muatan yang dihasilkan foto dalam bahan semikonduktor, seperti SrTiO3 ( STO), menghasilkan efisiensi fotokatalitik yang berkurang. Untuk mengatasi hal ini, ko-katalis berbasis tembaga telah menarik perhatian besar karena biayanya yang relatif rendah, kelimpahan alami konstituen, dan reaktivitas yang menjanjikan. Dalam penelitian ini, heterojunction p-Cu(OH) 2 /n-SrTiO3 disiapkan untuk produksi hidrogen fotokatalitik yang efisien. Fotokatalis SrTiO3 dengan morfologi seperti bunga yang dihiasi dengan Cu(OH) 2 pada persentase berat Cu yang berbeda (0,1, 0,5, 1, 2, dan 5 wt.%) berhasil disiapkan menggunakan proses solvotermal dan fotodeposisi sederhana. Komposit p-Cu(OΗ) 2 /n-SrTiO 3 dengan kandungan 1 wt.% Cu menunjukkan peningkatan signifikan terhadap produksi hidrogen fotokatalitik dibandingkan dengan STO murni, mencapai laju ∼139 µmol h −1 (∼6950 µmol g −1 h −1 aktivitas massa) di bawah iradiasi cahaya λ > 360 nm yang ≈3,5 kali lebih tinggi daripada STO komponen tunggal. Studi spektroskopi fotoelektron sinar-X menunjukkan pembentukan fase Cu(OH) 2. Selain itu, studi evaluasi UV–vis/NIR, spektroskopi EIS, dan fotokatalitik menunjukkan bahwa peningkatan kinerja fotokatalitik muncul dari pembentukan sambungan pn pada antarmuka Cu(OH) 2 /STO yang mendorong peningkatan transfer pembawa muatan dan pemisahan dalam heterojunction.
1 Pendahuluan
Produksi hidrogen fotokatalitik melalui pemisahan air telah menarik perhatian besar sebagai teknologi yang ramah lingkungan, aman, dan ekonomis untuk mengubah energi matahari menjadi bahan bakar kimia. Masalah lingkungan yang disebabkan oleh penggunaan bahan bakar fosil dan meningkatnya permintaan energi dapat diatasi dengan teknik ini. [ 1 ] Pendekatan ini menggunakan bahan semikonduktor untuk menghasilkan pasangan elektron-lubang melalui penyerapan sinar matahari. Selanjutnya, elektron dan lubang yang dihasilkan foto ini dapat mengambil bagian dalam reaksi redoks termasuk pemisahan air dan degradasi polutan.
Beberapa bahan semikonduktor telah dieksplorasi dalam beberapa tahun terakhir untuk meningkatkan produksi molekul hidrogen (H 2 ) dari air di bawah penyinaran matahari atau cahaya tampak. [ 1 – 4 ] Salah satu semikonduktor yang terkenal di antaranya adalah strontium titanat tipe perovskit (SrTiO 3 atau STO), yang terus menarik minat yang tumbuh dalam domain pemisahan air, konversi energi, dan degradasi polutan karena sifat elektronik dan optiknya yang menguntungkan, stabilitas fotokimia, ketahanan fotokorosi yang tinggi, stabilitas termal, tidak beracun, dan biaya rendah. [ 5 ] Salah satu keuntungan utama STO adalah tingkat energi pita konduksi yang tinggi (−1,4 V vs SCE pada pH 13), [ 6 ] yang memungkinkan transfer elektron tereksitasi yang efisien ke akseptor elektron [ 7 ] yang dapat meningkatkan produksi H 2 . [ 8 – 11 ] Namun, keterbatasan utama semikonduktor STO dianggap sebagai celah pita yang lebar (Eg = 3,1–3,3 eV), yang hanya memerlukan eksitasi cahaya ultraviolet, dan rekombinasi cepat pembawa muatan yang dihasilkan foto. Oleh karena itu, perlambatan rekombinasi muatan diperlukan untuk meningkatkan kinerja fotokatalitiknya. Beberapa upaya telah dicoba untuk memperluas penyerapan cahayanya ke daerah tampak dan meningkatkan kinetika pembawa muatan yang dihasilkan foto, seperti doping ion logam, penyesuaian permukaan kristal, konstruksi heterostruktur, dan pemuatan ko-katalis. [ 12 – 16 ] Yang terakhir memiliki potensi untuk mempercepat kinetika reaksi dengan meningkatkan pemisahan pasangan elektron-lubang dan mengurangi hambatan energi yang terkait dengan proses redoks permukaan. Dalam heterostruktur semikonduktor, penyelarasan pita dan arah transfer muatan ditentukan oleh fungsi kerja (Φ), yang memainkan peran penting dalam mengatur interaksi elektronik di antarmuka sambungan. Misalnya, secara umum diketahui bahwa elektron dari bahan dengan fungsi kerja rendah lebih disukai ditransfer ke bahan dengan fungsi kerja tinggi melalui antarmuka kontaknya. Oleh karena itu, penambahan nanopartikel logam mulia dengan fungsi kerja tinggi, seperti Pt [ 17 ] (5.65), [ 18 ] Au (5.10), [ 19 ] Ag (4.26) [ 20 ] dan Pd (5.12), [ 21 ]pada permukaan STO mendorong pemisahan dan migrasi pasangan elektron–lubang yang tereksitasi foto melalui pembentukan sambungan Schottky, sehingga mengarah pada peningkatan evolusi H 2 fotokatalitik .
Karena nanopartikel logam mulia (seperti Pt) langka dan mahal, sehingga menghambat penerapannya secara luas dalam skala yang lebih besar, maka akan menguntungkan untuk mengeksplorasi opsi yang lebih ekonomis dengan memanfaatkan lebih banyak unsur yang melimpah di bumi. Dari perspektif ini, katalis berbasis tembaga (Cu) muncul sebagai pengganti logam mulia yang menjanjikan, yang berpotensi berfungsi sebagai ko-katalis alternatif yang efisien untuk SrTiO3 dalam evolusi hidrogen fotokatalitik. Misalnya, Bui et al. [ 22 ] menyiapkan nanopartikel SrTiO3 yang dimuat Cu dan mencapai produksi hidrogen sebesar 2433 µmol g −1 h −1 pada suhu 25 °C. Selain itu, Qin et al. [ 23 ] mensintesis serangkaian fotokatalis SrTiO3 yang dimuat dengan ko-katalis bimetalik Cu-Pt. Khususnya, STO/Cu95-Pt5 menunjukkan aktivitas fotokatalitik hidrogen tertinggi dengan laju 12 313 µmol g −1 h −1 . Lebih jauh, Mai et al. [ 24 ] menyiapkan SrTiO 3 bermuatan CuO dengan metode impregnasi yang mencapai laju 2150 µmol h −1 g −1 pada suhu 25 °C.
Di sini, kami menyelidiki efek modifikasi tembaga (Cu) pada aktivitas fotokatalitik fotokatalis STO yang disintesis dengan morfologi seperti bunga untuk evolusi H 2 . Modifikasi tembaga pada permukaan STO dicapai dengan menggunakan metode fotodeposisi sederhana, prosedur langsung yang tidak melibatkan langkah-langkah rumit atau kondisi eksperimen yang keras. Selain itu, dengan menggunakan kombinasi pengukuran penyerapan optik dan spektroskopi impedansi elektrokimia, kami memperoleh beberapa wawasan tentang perilaku fotoelektrokimia dari katalis STO murni dan yang dihiasi Cu. Temuan kami mengungkapkan bahwa peningkatan kinerja fotokatalitik katalis STO yang dihiasi Cu dalam produksi H 2 bergantung pada pembentukan heterojunction p-Cu(OH) 2 /n-STO dengan penyelarasan pita yang menguntungkan, yang mendorong pemisahan dan pengangkutan pembawa yang dihasilkan secara efektif di bawah iluminasi cahaya matahari. Sejauh pengetahuan kami, ini adalah studi pertama yang memanfaatkan katalis STO yang dihiasi dengan Cu(OH)₂ melalui metode fotodeposisi sederhana sebagai fotokatalis untuk produksi hidrogen di bawah penyinaran matahari.
2 Hasil dan Pembahasan
2.1 Sifat Struktur STO dan STO Berdekorasi Cu
Gambar 1 menunjukkan pola XRD STO yang dikaitkan dengan pola referensi STO (kartu JCPDS No. 089–4934) dan TiO 2 (kartu JCPDS No. 076–1937). Dari analisis XRD komparatif dapat disimpulkan bahwa STO yang disiapkan tidak sepenuhnya mengalami fase murni, karena kontribusi kecil dari puncak pengotor TiO 2 juga dapat dideteksi dalam pola difraksi. Secara khusus, puncak yang lebih menonjol pada 22,7°, 32,3°, 39,9°, 46,4°, 52,3°, 57,7°, 67,8°, 72,5°, dan 77,1° dapat dengan yakin ditetapkan ke refleksi (100), (110), (111), (200), (210), (211), (220), (221), dan (310) dari struktur kristal kubik perovskit SrTiO3. [ 25 ] Namun , puncak kecil tapi terselesaikan pada sudut hamburan 25,2°, 25,8°, dan 36,2° dapat dikaitkan dengan refleksi dari bidang kristal (210), (111), dan (102) dari TiO2 ortorombik . [ 26 ] Untuk katalis Cu-STO dengan kandungan Cu yang berbeda, pola XRD mereka (Gambar 1 ) tidak mengungkapkan puncak apa pun yang dikaitkan dengan fase tembaga kristal, tembaga hidroksida, atau tembaga oksida, mungkin karena jumlah muatan rendah, ukuran butiran kecil, dan dispersi tinggi spesies Cu yang diendapkan pada permukaan STO.
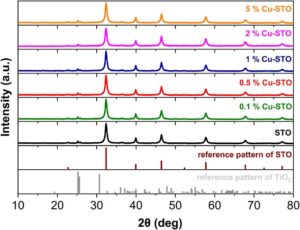
Komposisi unsur dari sampel yang disiapkan diverifikasi melalui spektroskopi sinar-X dispersif energi (EDS). Kehadiran Sr dan Ti dikonfirmasi oleh spektrum EDS, dengan rasio atom Sr/Ti mendekati 1:1, yang sejalan dengan stoikiometri SrTiO₃ yang diharapkan (Gambar S1 , Informasi Pendukung). Spektrum EDS dari sampel yang dihias Cu juga memverifikasi keberadaan atom Cu pada rasio Cu/Sr yang berbeda, yang sesuai dengan pemuatan Cu antara ≈0,1 dan 5 wt.% (seperti yang ditunjukkan pada Tabel 1 ). Komposisi nominal katalis sangat cocok dengan kandungan Cu yang ditentukan oleh EDS, yang menunjukkan pengendapan lengkap spesies Cu ke dukungan SrTiO₃.
| Mencicipi | Persentase atom Sr:Cu | Kandungan Cu a (% berat) | Kesenjangan energi b |
| BERHENTI | – | – | 3.26 |
| 0,1% Cu-STO | 45,74: 0,14 | 0.11 | 3.25 |
| 0,5% Cu-STO | 44,64: 0,60 | 0.47 | 3.23 |
| 1% Cu-STO | 44.85: 1.27 | 0,97 | 3.21 |
| 2% Cu-STO | 44.16: 3.06 | 2.34 | 3.14 |
| 5% Cu-STO | 45.67: 7.27 | 5.22 | 3.10 |
| 1% Cu-STO@campuran | 45.91: 1.30 | 0,98 | 3.17 |
a) Berdasarkan analisis EDS, (Catatan Kaki Tabel);
b) Celah pita energi diperoleh dari plot Tauc yang sesuai
Gambar SEM untuk STO ( Gambar 2 a,b ) mengungkapkan keberadaan mikrosfer seperti bola dengan ukuran rata-rata ≈1,5 µm. Gambar perbesaran yang lebih tinggi pada Gambar 2a menunjukkan bahwa mikrosfer STO memiliki morfologi seperti bunga seperti yang dilambangkan oleh Zhou et al. [ 10 ] Zhou et al. menghubungkan pembentukan berbagai morfologi dengan rasio V EG / V H2O . Adsorpsi etilen glikol pada permukaan partikel secara signifikan mempengaruhi pertumbuhan permukaan kristal dan keseluruhan proses kristalisasi. Lebih jauh, EG dapat menstabilkan kristal yang baru terbentuk juga. Dekorasi Cu pada permukaan STO dengan metode fotodeposisi tampaknya tidak mengubah bentuk, ukuran, dan keseluruhan morfologi fotokatalis SrTiO 3 (Gambar 2c,d ). Pada Gambar 2e , pemetaan SEM—EDS menunjukkan dispersi seragam unsur Ti, Cu, Sr, dan O, yang menunjukkan distribusi seragam Cu(OH) 2 pada fotokatalis SrTiO 3 .

Untuk menganalisis lebih lanjut komposisi unsur dan keadaan kimia katalis Cu-STO, spektroskopi fotoelektron sinar-X (XPS) digunakan. Pada Gambar S2 (Informasi Pendukung), spektrum survei XPS dari sampel STO berhias Cu dengan kandungan 1 wt.% Cu (yaitu, sampel 1% Cu-STO), yang merupakan katalis berkinerja terbaik dari seri ini, mengonfirmasi keberadaan unsur Sr, Ti, O, dan Cu sesuai dengan analisis EDS. Spektrum Sr 3d resolusi tinggi dari sampel 1% Cu-STO ( Gambar 3 a ) menunjukkan dua puncak utama pada energi pengikatan 132,4 dan 134,1 eV, yang dapat dikaitkan dengan komponen spin-orbit Sr 3d 5/2 dan Sr 3d 3/2 , masing-masing. Puncak-puncak ini menunjukkan strontium dalam keadaan Sr 2+ dan dikaitkan dengan atom-atom Sr dalam struktur perovskit SrTiO 3 . [ 27 ] Selain itu, Gambar 3b menampilkan dua komponen puncak menonjol dalam spektrum Ti 2p, khususnya pada energi pengikatan 458,3 dan 463,9 eV, yang dapat ditugaskan dengan baik ke puncak Ti 2p3/2 dan Ti 2p1/2 masing-masing dari Ti 4+ dalam struktur perovskit STO. [ 28 ] Selain itu, puncak lemah yang diamati pada 457,3 dan 462,3 eV dikaitkan dengan masing-masing komponen 2p3/2 dan 2p1/2 dari keadaan Ti 3+ , yang sesuai dengan keberadaan spesies Ti-O dan Ti-OOH tereduksi pada permukaan STO. [ 29 ] Selain itu, dua puncak yang terdeteksi pada tingkat inti O 1s pada energi pengikatan 529,2 dan 532,1 eV masing-masing dapat dikaitkan dengan oksigen kisi (Sr-O) dan gugus hidroksil permukaan (ikatan ─OH) (Gambar S3 , Informasi Pendukung). [ 30 ] Pada Gambar 3c , spektrum Cu 2p XPS mengungkap puncak berbeda untuk Cu 2p3/2 dan Cu 2p1/2 pada 933,3 dan 953,1 eV, masing-masing, yang mewakili keadaan energi pengikatan ion Cu 2+ dalam Cu(OH) 2 . [ 31 – 37 ] Lebih jauh lagi, puncak satelit yang jelas pada ≈942,5 eV mengonfirmasi keberadaan Cu 2+ paramagnetik , yang selanjutnya mendukung pembentukan spesies Cu(OH) 2 (bukan Cu metalik) pada permukaan STO selama proses fotodeposisi.

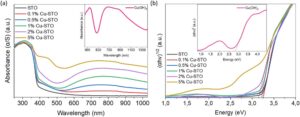
Spektroskopi serapan optik UV–vis/NIR digunakan untuk menyelidiki struktur elektronik STO dan sampel STO yang dihias Cu. Pada Gambar 4a , STO menampilkan tepi serapan pada panjang gelombang yang sedikit lebih pendek dari 400 nm (∼380 nm) yang sesuai dengan transisi elektron dari pita valensi (VB), yang dibentuk oleh orbital O 2 _ (2p), ke pita konduksi (CB), yang dibentuk oleh orbital Ti 4+ (3d) dalam SrTiO 3. [ 38 ] Dibandingkan dengan STO yang tidak dimodifikasi, spektrum UV–vis/NIR sampel Cu-STO menunjukkan dua fitur serapan tambahan dalam rentang panjang gelombang 400–1000 nm, yang kemungkinan disebabkan oleh fase Cu(OH) 2 yang terbentuk pada permukaan STO. Sebagai bukti konsep, kami menyiapkan sampel kontrol Cu(OH) 2 murni (lihat bagian eksperimen untuk detailnya) dan mengukur spektrum serapan optiknya untuk perbandingan. Gambar S4 (Informasi Pendukung) menampilkan pola XRD dari sampel Cu(OH) 2 yang disiapkan sebagaimana mestinya , mengonfirmasi pembentukan Cu(OH) 2 fase murni dengan struktur kristal ortorombik (COD no.9011547). [ 39 ] Seperti yang ditunjukkan pada sisipan Gambar 4a , Cu(OH) 2 murni menampilkan pita serapan di bawah 500 nm, yang bertepatan dengan bahu serapan yang diamati pada rentang panjang gelombang 400–500 nm dalam spektrum sampel STO yang dimodifikasi Cu. Selain itu, puncak serapan lebar dari 550 hingga 800 nm dalam spektrum Cu-STO sangat cocok dengan puncak masing-masing Cu(OH) 2 murni , yang sesuai dengan transisi elektronik d–d dari Cu2 + dalam Cu(OH) 2 . Khususnya, intensitas penyerapan kedua fitur ini meningkat secara progresif dengan kandungan Cu dalam sampel, yang selanjutnya mengonfirmasi asal mereka dari fase Cu(OH) 2 yang diendapkan pada permukaan STO. Perlu dicatat bahwa sistem Cu(OH)₂/STO merepresentasikan heterostruktur semikonduktor komposit dan bukan material fase tunggal. Oleh karena itu, tepi penyerapan optik yang diamati dalam plot Tauc mencerminkan respons optik nyata dari heterojunction dan tidak boleh ditafsirkan sebagai celah pita intrinsik dari material semikonduktor tunggal. Dari plot Tauc yang sesuai (Gambar 4b ) untuk semikonduktor celah tidak langsung [yaitu, plot (αhv 1/2 ) vs hv, di mana α adalah koefisien penyerapan dan hv adalah energi foton insiden], celah pita optik (E g ) dari STO murni dan material Cu-STO dihitung dan hasil yang diperoleh tercantum dalam Tabel 1. E g yang diukuruntuk STO yang disiapkan ditemukan sebesar ∼3,26 eV, yang merupakan nilai celah pita khas semikonduktor SrTiO3 . [ 12 ] Untuk sampel yang dihiasi Cu, pergeseran merah sistematis dalam nilai Eg dari 3,25 menjadi 3,1 eV diamati dengan peningkatan kandungan Cu, yang menunjukkan interaksi elektronik antarmuka yang kuat antara komponen STO dan Cu(OH) 2 dalam heterojunction yang terbentuk. Selain itu, dari perhitungan plot Tauc untuk transisi langsung (yaitu, αhv2 vs hv), celah pita Cu(OH) 2 murni diukur sebesar 2,8 eV yang mendekati nilai ∼3,0 eV yang dilaporkan dalam literatur [ 36 , 40 ]
2.2 Aktivitas Fotokatalitik Produksi H 2
Kinerja fotokatalitik katalis yang kami siapkan untuk produksi H 2 dievaluasi di bawah iradiasi cahaya matahari menggunakan lampu Xe 300W sebagai sumber cahaya. Kami memulai penyelidikan kami dengan memeriksa efek reaktivitas lubang permukaan pada reduksi air, menggunakan STO yang disiapkan sebagai katalis dengan adanya berbagai donor elektron, termasuk metanol, trietanolamin (TEOA), dan Na 2 S/Na 2 SO 3 . Seperti yang ditunjukkan pada Gambar S5 (Informasi Pendukung), di antara donor elektron yang diperiksa, TEOA (20% v/v) terbukti menjadi pemulung lubang yang paling efisien untuk evolusi H 2 , mencapai laju ≈38 µmoles h −1 . Untuk menilai dampak Cu(OH) 2 pada aktivitas produksi H 2 dari STO, fotoaktivitas katalis Cu-STO dipelajari di bawah penyinaran cahaya matahari (λ > 360 nm), dengan konsentrasi katalis tetap (20 mg) dan TEOA (20% v/v) sebagai pemulung lubang. Hasil yang diperoleh dibandingkan dalam Gambar 5 a,b . Seperti yang ditunjukkan dalam Gambar 5a , semua sampel menunjukkan hubungan linier dari waktu ke waktu dalam evolusi H 2 , yang menunjukkan kinetika reaksi yang stabil dalam kondisi yang diperiksa. Selain itu, modifikasi Cu memiliki efek menonjol pada aktivitas fotokatalitik STO, yang diwujudkan dengan peningkatan kinerja produksi H 2 dari komposit yang dimodifikasi Cu. Lebih khusus lagi, aktivitas fotokatalitik heterostruktur meningkat secara progresif dengan meningkatnya kandungan Cu (Gambar 5b ) dan mencapai laju evolusi H 2 maksimum ~140 µmoles h −1 pada 1 wt.% Cu (sampel 1% Cu-STO). Aktivitas ini ≈3,5 kali lebih tinggi daripada STO komponen tunggal. Hingga saat ini, berbagai heterostruktur berbasis STO-Cu telah disintesis, termasuk SrTiO3 bermuatan CuO , Cu-SrTiO3 , dan kokatalis bimetalik Cu-Pt pada SrTiO3 . Namun, penelitian ini merupakan contoh pertama penggunaan katalis STO yang dihiasi dengan Cu(OH) 2 melalui metode fotodeposisi langsung sebagai fotokatalis untuk produksi hidrogen di bawah iradiasi matahari. Perbandingan aktivitas produksi H₂ fotokatalitik dari berbagai fotokatalis SrTiO₃ berbasis Cu disajikan dalam Tabel S1 (Informasi Pendukung), di mana katalis STO termodifikasi Cu(OH)₂ kami dengan kandungan Cu 1 wt.% menunjukkan salah satu aktivitas evolusi H₂ tertinggi yang dilaporkan. Peningkatan lebih lanjut kandungan Cu menjadi 2 dan 5 wt.% menyebabkan penurunan bertahap dalam H2produksi masing-masing sebesar 44% dan 60%. Seperti yang akan dibahas di bawah, kinerja katalitik yang berkurang dari sampel yang mengandung muatan Cu yang lebih tinggi mungkin disebabkan oleh dinamika transfer muatan yang lebih buruk dan hilangnya pembawa fotogenerasi karena rekombinasi pada antarmuka antara Cu(OH) 2 dan STO. [ 22 ]
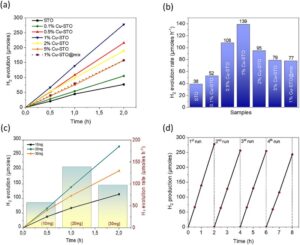
Untuk tujuan perbandingan, campuran fisik partikel Cu(OH) 2 dan SrTiO3 dengan muatan setara 1 wt.% Cu juga disiapkan (diberi label sebagai 1% Cu-STO@mix) dan diperiksa dalam evolusi H2 dalam kondisi yang identik. Analisis EDS dari sampel 1% Cu-STO@mix (ditunjukkan dalam Tabel 1 ) mengonfirmasi keberadaan atom Cu, konsisten dengan muatan Cu sebesar 0,98 wt.%. Dari pengukuran UV/vis, celah pita energi 1% Cu-STO@mix diperkirakan sebesar ∼ 3,17 eV (seperti yang ditunjukkan dalam Tabel 1 dan Gambar S6 , Informasi Pendukung). Khususnya, seperti yang disajikan dalam Gambar 5b , laju evolusi H2 secara signifikan lebih rendah untuk katalis 1% Cu-STO@mix (77 µmoles h −1 ) dibandingkan dengan 1% Cu-STO. Peningkatan kinerja fotokatalitik katalis 1% Cu-STO relatif terhadap campuran fisik dapat dikaitkan dengan kontak dekat dan interaksi antarmuka yang lebih baik antara STO dan spesies Cu(OH) 2 yang diendapkan secara fotokimia pada permukaannya. Konfigurasi ini mengurangi rekombinasi pembawaan yang diinduksi foto dan memfasilitasi transfer muatan antarmuka yang efektif, yang mendorong pemisahan pasangan elektron-lubang di heterojunction. Akibatnya, sampel 1% Cu-STO menunjukkan efisiensi kuantum nyata yang signifikan sebesar 4,6% di bawah penyinaran cahaya monokromatik pada λ = 365 nm.
Efek konsentrasi katalis pada aktivitas evolusi H2 dinilai dengan menggunakan berbagai pemuatan massa katalis 1% Cu-STO dalam larutan berair TEOA 20% v/v. Seperti yang ditunjukkan pada Gambar 5c , evolusi H₂ meningkat dengan konsentrasi katalis yang lebih tinggi, mencapai maksimum pada 1 mg mL −1 (yaitu, pemuatan katalis 20 mg). Peningkatan produksi H₂ ini dikaitkan dengan peningkatan penyerapan cahaya oleh partikel katalis. Untuk pemuatan katalis yang lebih tinggi (30 mg), evolusi H₂ yang berkurang kemungkinan besar disebabkan oleh efek hamburan cahaya yang disebabkan oleh jumlah partikel yang berlebihan. Katalis 1% Cu-STO juga menunjukkan stabilitas yang sangat baik di bawah kondisi reaksi yang dioptimalkan (yaitu, konsentrasi katalis 1 mg mL −1 dalam larutan berair TEOA 20% v/v dan penyinaran cahaya matahari Xe 300W). Secara khusus, stabilitas katalis diperiksa dengan melakukan empat uji fotokatalitik 2 jam berturut-turut. Setelah setiap pengujian, katalis diisolasi dari campuran reaksi dengan sentrifugasi, dicuci beberapa kali dengan air deionisasi, dan didispersikan kembali dalam larutan reaksi baru. Sebelum setiap pengujian fotokatalitik, sel reaksi dideaerasi dengan membersihkan dengan argon hingga H 2 dan O 2 dihilangkan sepenuhnya (menurut analisis GC). Seperti yang diilustrasikan dalam Gambar 5d , evolusi fotokatalitik hidrogen tetap hampir tidak berubah setelah empat kali pengulangan, menunjukkan stabilitas katalitik yang baik. Perlu dicatat bahwa hilangnya massa katalis selama prosedur pemulihan/penggunaan kembali mungkin menjadi alasan untuk sedikit penurunan laju evolusi H 2 setelah empat siklus katalitik. Sesuai dengan hasil katalitik, data EDS tidak menunjukkan penurunan persentase Cu, sedangkan pola XRD tidak mengungkapkan perubahan dalam struktur kristal katalis yang digunakan kembali empat kali (lihat Gambar S7 dan S8 , Informasi Pendukung). Sampel yang dipulihkan dianalisis lebih lanjut menggunakan XPS. Spektrum XPS dari daerah Sr 3d dan Ti 2p (Gambar S9 , Informasi Pendukung) tidak menunjukkan perubahan signifikan dalam keadaan kimia Sr dan Ti. Selain itu, spektrum Cu 2p yang diperoleh tidak menunjukkan perbedaan dalam atribut kimia spesies Cu, yang memperlihatkan puncak tingkat inti Cu 2p3/2 dan 2p1/2 pada 933,2 dan 952,8 eV, dan puncak satelit karakteristik pada ≈942,4 eV, sehingga menunjukkan stabilitas kimia katalis kami yang sangat baik.
2.3 Pengaruh Cu(OH) 2 terhadap Aktivitas Fotokatalitik
Untuk mendapatkan wawasan tentang peran spesies Cu(OH) 2 yang diendapkan melalui foto pada peningkatan aktivitas produksi H2 dari katalis yang dihiasi Cu, kami memeriksa sifat elektrokimia dari bahan yang disiapkan menggunakan spektroskopi impedansi elektrokimia (EIS). Plot Mott-Schottky dari STO murni, Cu(OH) 2 , dan sampel STO yang dihiasi Cu dengan berbagai muatan Cu (yaitu, 0,5, 1, dan 5 wt.%), bersama dengan 1% Cu-STO@mix ditunjukkan pada Gambar 6. Untuk STO murni dan semua sampel yang dihiasi Cu , kemiringan positif dari daerah linier plot MS (Gambar 6a ) menunjukkan bahwa bersifat konduktif tipe-n. Dari perpotongan sumbu-x dari lereng MS masing-masing (pada C −2 = 0), potensial pita datar dari sampel STO, STO berhias Cu, dan 1% Cu-STO@mix terukur berada dalam rentang −1,49 hingga −1,16 V vs RHE pada pH = 7. Untuk banyak semikonduktor tipe-n, potensial tepi pita konduksi (E CB ) dapat diperkirakan dari pengukuran potensial pita datar (E FB ), karena E FB biasanya terletak 0,1–0,2 V lebih positif daripada E CB . [ 41 ] Oleh karena itu, level maksimum pita valensi (VB) (E VB ) untuk sampel STO murni dan STO termodifikasi Cu diperkirakan dengan menambahkan nilai celah pita energi (E g ) masing-masing ke nilai E CB (E VB = E CB + E g ). Potensial tepi pita yang dihitung dirangkum dalam Tabel 2 , dan diagram pita representatif untuk setiap katalis dibuat dan diilustrasikan dalam Gambar 6b . Beberapa kesimpulan penting dapat diturunkan dari diagram tepi pita ini. Khususnya, level E CB dari semua katalis yang disiapkan berada di atas potensial reduksi air (−0,41 V vs RHE pada pH = 7), yang mengonfirmasi bahwa material ini memiliki kemampuan termodinamika untuk menghasilkan H 2 dari air. Selain itu, tren umum dapat diidentifikasi dari hasil ini: peningkatan kandungan Cu dalam STO menyebabkan pergeseran positif bertahap (pergeseran anodik) dari posisi E FB . Kami mengaitkan penurunan E FB ini dengan pembentukan sambungan pn antara spesies Cu(OH) 2 tipe-p yang tumbuh di permukaan matriks inang STO tipe-n. Interpretasi ini dikuatkan oleh plot MS Cu(OH) 2 murni (Gambar 6c ), di mana kemiringan MS negatif dengan jelas menyimpulkan konduktivitas tipe-p untuk spesies Cu(OH) 2 , yang memiliki E FBlevel pada ca. 1,15 V vs RHE (pH = 7). Lebih jauh, analisis XPS (lihat Gambar 3 ) mengonfirmasi keberadaan Cu dalam keadaan Cu 2 ⁺ sebagai bagian dari fase Cu(OH)₂, dengan puncak satelit karakteristik yang mendukung pembentukan fase Cu(OH)₂ yang menurut literatur memiliki konduktivitas tipe-p. [ 42 ] Karena level Fermi yang lebih rendah dari Cu(OH) 2 tipe-p yang terbentuk pada permukaan STO tipe-n, elektron dapat mengurangi energinya dengan mengalir dari semikonduktor tipe-n ke tipe-p hingga level Fermi mereka mencapai kesetimbangan di antarmuka. Efek bersih dari proses ini akan menghasilkan pergeseran anodik E FB STO pada pengendapan spesies Cu(OH) 2 , seperti yang diamati oleh hasil Mott-Schottky di atas. Pengukuran densitas donor dari katalis yang diperiksa selanjutnya mengonfirmasi aliran elektron dari STO ke Cu(OH)₂ di antarmuka. Saat muatan Cu meningkat, nilai N D dari STO menurun secara konsisten, mencapai minimum pada kandungan Cu 1 wt.% Akan tetapi, saat muatan Cu ditingkatkan menjadi 5 wt.%, nilai ND untuk sampel 5% Cu-STO menunjukkan peningkatan relatif, yang menunjukkan kontak antarmuka dan transfer elektron yang kurang efisien antara spesies STO dan Cu(OH)₂ dalam sampel ini. Akibatnya, aktivitas katalitik menurun, dan efisiensi transfer muatan berkurang. Kesimpulan yang sama juga dapat disimpulkan dari nilai N D yang lebih rendah (2,10 × 10 15 cm −3 ) dari sampel 1% Cu-STO@mix dibandingkan dengan 1% Cu-STO, di mana kontak antarmuka yang buruk antara Cu(OH) 2 dan STO dalam campuran fisik menghasilkan transfer elektron yang lebih rendah dan pergeseran anoda yang lebih kecil dari potensi E FB -nya (−1,3 V vs −1,16 V untuk 1% Cu-STO). Tabel 2 merangkum semua nilai EFB dan ND yang diperkirakan yang diperoleh dari analisis Mott-Schottky dari katalis yang diperiksa.
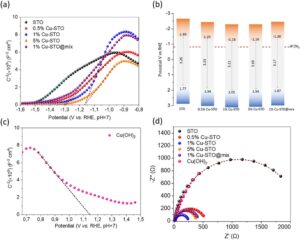
Kinetika pemindahan muatan pada antarmuka katalis/cairan diselidiki lebih lanjut melalui spektroskopi impedansi elektrokimia (EIS) dan dianalisis menggunakan analisis plot Nyquist. Gambar 6d membandingkan plot Nyquist yang diperoleh untuk sampel STO dan Cu(OH) 2 murni , bersama dengan sampel komposit yang dimodifikasi Cu dengan 0,5, 1, dan 5 wt.% kandungan Cu (drop-cast pada substrat FTO) dan sampel 1% Cu-STO@mix. Data EIS dipasang menggunakan model rangkaian ekivalen Randles ( sisipan Gambar 6d ), untuk menghitung resistansi pemindahan muatan (R ct ) dari setiap katalis. Semua nilai R ct yang dihitung dan hasil EIS yang disimulasikan tercantum dalam Tabel 2 dan Tabel S2 (Informasi Pendukung). Singkatnya, analisis EIS menunjukkan nilai R ct yang jauh lebih rendah (∼229 Ω) untuk 1% Cu-STO dibandingkan dengan STO murni (2184 Ω), 0,5% Cu-STO (517 Ω), 5% Cu-STO (369 Ω), dan katalis Cu(OH) 2 (3091 Ω). Secara umum, resistansi transfer muatan yang lebih rendah diharapkan menghasilkan efek transfer muatan yang lebih efisien dan lebih halus melalui kerangka katalis ke antarmuka katalis/elektrolit, sehingga meningkatkan kinetika reaksi dan aktivitas katalitik secara keseluruhan. Jelas, katalis yang dimuat dengan 1 wt.% Cu [sebagai spesies Cu(OH) 2 ] memberikan jalur yang kurang resistif, dan karenanya, transfer antarmuka pembawa muatan yang lebih efisien, yang berkorelasi baik dengan aktivitas evolusi H 2 fotokatalitiknya yang ditingkatkan .
Selain itu, dibandingkan dengan 1% Cu-STO, campuran sederhana STO dengan partikel Cu(OH) 2 yang telah dibentuk sebelumnya (yaitu, sampel 1% Cu-STO@mix) menunjukkan R ct yang hampir 2 kali lebih tinggi (415,4 Ω), meskipun memiliki komposisi kimia yang sama. Hal ini menunjukkan pentingnya metode deposisi fotokimia dalam meningkatkan konektivitas antarmuka dan dinamika perpindahan muatan dalam katalis Cu-STO kami. Heterojunction Cu(OH) 2 /STO yang diendapkan foto menunjukkan evolusi hidrogen fotokatalitik yang ditingkatkan secara signifikan dibandingkan dengan campuran fisik karena kontak antarmuka yang dekat dari fotodeposisi memfasilitasi pembentukan sambungan p–n yang terdefinisi dengan baik antara Cu(OH)₂ tipe-p dan SrTiO₃ tipe-n. Medan listrik bawaan yang dihasilkan memungkinkan pemisahan muatan yang cepat dan terarah, dan oleh karena itu rekombinasi elektron–lubang ditekan secara efektif. Efek sinergis ini menghasilkan aktivitas fotokatalitik keseluruhan ≈3,5 kali lebih tinggi daripada STO, menunjukkan potensi sistem Cu-STO kami sebagai fotokatalis yang murah dan efisien untuk produksi hidrogen.
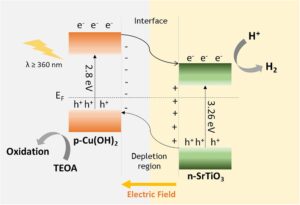
Berdasarkan hasil yang disebutkan di atas, kami mengusulkan mekanisme yang mungkin untuk transfer muatan dan produksi H 2 fotokatalitik melalui katalis heterojunctional pn Cu(OH) 2 /STO kami ( Gambar 7 ). Sebelum penyinaran cahaya, elektron yang terletak di dekat antarmuka p–n semikonduktor SrTiO 3 tipe-n cenderung bermigrasi ke semikonduktor Cu(OH) 2 tipe-p yang berdekatan , yang mengarah pada pembentukan daerah bermuatan positif dalam STO (daerah penipisan). Sebaliknya, pada sisi p- Cu(OH) 2 antarmuka, akumulasi elektron akan menciptakan daerah bermuatan negatif (daerah akumulasi). Redistribusi muatan antarmuka ini konsisten dengan temuan dari analisis Mott-Schottky dan berlanjut hingga sistem mencapai kesetimbangan dalam hal kadar Fermi. Akibatnya, setelah kesetimbangan, daerah bermuatan dengan muatan berlawanan akan terbentuk berdekatan dengan antarmuka p–n, menciptakan medan listrik internal yang kuat dengan arah dari STO ke spesies Cu(OH) 2 . Bahasa Indonesia: Setelah penyinaran cahaya, semikonduktor tipe-p dan tipe-n mengalami eksitasi, yang menghasilkan pembentukan pasangan elektron-lubang. Pembawa fotogenerasi ini kemudian akan bermigrasi dan terpisah secara spasial, dengan bergerak ke arah yang berlawanan di bawah pengaruh medan listrik internal. Secara khusus, elektron bergerak dan terakumulasi ke pita konduksi (CB) semikonduktor n-SrTiO3 yang mengecualikan kemungkinan bahwa beberapa dari mereka dapat ditransfer ke TiO₂ karena pita konduksinya lebih rendah daripada SrTiO₃, sementara lubang bermigrasi dan berkumpul di pita valensi (VB) spesies p-Cu(OH) 2 . Dengan demikian, TiO₂ tidak memberikan kontribusi apa pun yang besar dalam hal memengaruhi atau meningkatkan dinamika transpor muatan sistem kami dan antarmuka aktif yang paling penting tetap menjadi heterojunction Cu(OH)₂/SrTiO₃. Hal ini juga dikonfirmasi oleh hasil STO tanpa Cu, yang menunjukkan aktivitas katalitik yang berkurang. Aktivitas katalitik yang ditingkatkan dari sampel komposit menunjukkan bahwa oksidasi oleh lubang yang dihasilkan foto merupakan langkah penentu, dengan Cu(OH)₂ memainkan peran kunci. Oleh karena itu, pasangan elektron-lubang dipisahkan secara efektif di seluruh antarmuka sambungan p-Cu(OH) 2 /n-SrTiO3 . Jalur pemisahan muatan yang dimediasi Cu(OH) 2 ini , yang disebabkan oleh pembentukan sambungan pn skala nano, jelas memiliki dampak positif pada kinerja fotokatalitik katalis Cu-STO kami. Model mekanistik yang diusulkan memungkinkan elektron dalam CB STO tetap aktif untuk jangka waktu yang lama, memfasilitasi reduksi katalitik H2O untuk menghasilkan H2Secara bersamaan, lubang yang terakumulasi dalam pita valensi (VB) Cu(OH) 2 secara efisien mengoksidasi pemulung lubang TEOA yang dikorbankan, sehingga meningkatkan aktivitas fotokatalitik katalis secara keseluruhan.
3 Kesimpulan
Singkatnya, fotokatalis SrTiO3 yang dihiasi dengan Cu(OH) 2 pada persentase berat Cu yang berbeda (0,1, 0,5, 1, 2, dan 5 wt.%) telah disintesis untuk pertama kalinya menggunakan proses solvotermal dan fotodeposisi sederhana. Melalui optimalisasi Cu(OH) 2 , katalis Cu(OH) 2 /STO pada 1 wt.% Cu, menunjukkan laju evolusi H2 fotokatalitik yang ditingkatkan secara signifikan sebesar ∼139 µmoles h −1 (∼6950 µmoles g −1 h −1 ) di bawah penyinaran cahaya λ > 360 nm, yang menunjukkan stabilitas fotokimia yang baik. Dengan menggunakan kombinasi teknik impedansi surya dan elektrokimia, kami menunjukkan bahwa peningkatan efisiensi evolusi H2 dari sistem ini menghasilkan pembentukan pn pada antarmuka Cu(OH) 2 /STO dengan konektivitas antarmuka yang baik. Interaksi elektronik antarmuka yang kuat antara komponen STO dan Cu(OH) 2 dalam heterojunction yang terbentuk, mendorong peningkatan transfer dan pemisahan pembawa muatan, sehingga menghasilkan peningkatan laju evolusi H 2 . Pekerjaan ini memberikan potensi penggunaan heterojunction Cu(OH) 2 /STO sebagai fotokatalis yang efektif untuk produksi hidrogen. Selain itu, hal ini berkontribusi pada pemahaman yang lebih mendalam tentang dinamika kompleks yang terlibat dalam transfer muatan pada antarmuka Cu(OH) 2 /STO.
4 Bagian Eksperimen
Bahan
Semua bahan kimia yang digunakan dalam prosedur sintetis dan percobaan fotokatalitik digunakan tanpa pemurnian lebih lanjut. Sr(NO₃)₂ (99%) dan titanium butoksida (TBOT) (97%), prekursor logam untuk mensintesis SrTiO₃ (STO), dibeli dari Sigma–Aldrich. Etilen glikol HOCH₂CH₂OH (EG) (99,5%), dibeli dari Honeywell, digunakan sebagai pelarut, sedangkan pelet natrium hidroksida (NaOH) (98,0%) dibeli dari Sigma–Aldrich. Cu(NO 3 ) 2 3H 2 O diperoleh dari Sigma–Aldrich. Reagen pengorbanan yang digunakan dalam percobaan fotodeposisi dan fotokatalitik, termasuk metanol, trietanolamin (TEOA), natrium sulfida nonahidrat (Na₂S·9H₂O), dan natrium sulfit (Na₂SO₃), juga dibeli dari Sigma–Aldrich.
Sintesis SrTiO3 ( STO)
SrTiO3 disiapkan menurut prosedur literatur. [ 10 ] Pertama, 1,7 gr (5 mmol) TBOT dilarutkan dalam 60 mL EG dengan pengadukan kuat selama 15 menit. Ke dalam larutan ini, 10 mL larutan 0,5 m Sr (NO3 ) 2 kemudian ditambahkan tetes demi tetes, diikuti dengan penambahan 5 mL larutan NaOH (5 m ). Campuran akhir dipindahkan ke autoklaf baja tahan karat berlapis Teflon dan dipanaskan pada suhu 180 °C selama 24 jam, setelah diaduk selama 1 jam pada suhu kamar. Ketika autoklaf mencapai suhu kamar, endapan dikumpulkan melalui sentrifugasi, dicuci tiga kali dengan air deionisasi dan etanol absolut, dan dikeringkan semalaman pada suhu 60 °C.
Deposisi Fotokimia Cu pada STO
Sintesis nanopartikel STO berhias Cu dilakukan menggunakan metode fotodeposisi yang mudah. Dalam prosedur yang umum, 100 mg STO didispersikan dalam larutan berair 20 mL yang mengandung 12,5% (v/v) TEOA dengan sonikasi selama 5 menit. Selanjutnya, alikuot yang sesuai dari 1 mg mL −1 larutan berair Cu(NO 3 ) 2 (sesuai dengan muatan Cu yang diinginkan) ditambahkan ke dispersi di atas dengan pengadukan terus-menerus dan kemudian dipindahkan ke reaktor kaca Pyrex kedap udara. Setelah itu, campuran reaksi dideaerasi dengan aliran gas Ar selama 30 menit dan akhirnya diiradiasi selama 1 jam dengan lampu busur Xe 300 W dengan pengadukan terus-menerus pada suhu kamar. Untuk studi perbandingan, sampel Cu(OH) 2 juga disiapkan menggunakan metode sol-gel yang umum. [ 39 ] Dalam proses ini, larutan NaOH (15 mmol, 20 mL) ditambahkan perlahan ke dalam larutan pengaduk Cu(NO 3 ) 2 (3 mmol, 20 mL). Kemudian campuran dibiarkan sambil diaduk terus-menerus selama 4 jam sehingga menghasilkan pembentukan suspensi berwarna hijau kebiruan. Setelah sentrifugasi, sampel akhir Cu(OH)₂ dicuci dengan air deionisasi dan etanol absolut, lalu dikeringkan semalaman pada suhu 60 °C.
Campuran fisik STO yang telah terbentuk sebelumnya dan Cu(OH) 2 juga disiapkan untuk perbandingan. Alikuot yang tepat dari dispersi berair 20 mL Cu(OH) 2, yang dibentuk melalui ultrasonikasi selama 20 menit dan sesuai dengan 1% berat Cu yang setara (diberi label sebagai 1% Cu-STO@mix), ditambahkan perlahan-lahan ke dalam dispersi berair 20 mL STO. Suspensi yang dihasilkan diaduk pada suhu kamar selama ≈24 jam, kemudian dipisahkan melalui sentrifugasi dan dipanaskan semalaman pada suhu 60 °C.
Evolusi Hidrogen Fotokatalitik
Percobaan fotokatalitik untuk produksi hidrogen dilakukan dalam reaktor kaca Pyrex kedap udara, menggunakan simulator surya (Mega Lab, model MegCeraX10) yang dilengkapi dengan lampu xenon 300 W, dan Filter Global Air Mass 1.5 yang mensimulasikan radiasi surya. Dalam percobaan yang umum, 20 mg katalis didispersikan dalam 20 mL air/larutan TEOA (8:2 v/v) sambil diaduk, dan campuran yang dihasilkan dibersihkan dengan gas Ar selama minimal 30 menit untuk memastikan pembuangan udara secara menyeluruh. Semua percobaan dilakukan pada suhu 25 ± 2 °C menggunakan sistem pendingin penangas air. Gas yang dihasilkan dianalisis menggunakan kromatografi gas (Shimadzu GC-2014) yang dilengkapi dengan detektor konduktivitas termal (TCD). Selain itu, efisiensi kuantum nyata (AQE) dievaluasi menggunakan cahaya monokromatik pada λ = 365 nm menurut persamaan berikut:
![]()
Intensitas cahaya insiden diukur menggunakan radiometer StarLite yang digabungkan dengan detektor termal FL400A-BB-50 yang dikalibrasi (Ophir Optronics Ltd) dan ditemukan sebesar 0,66 mW cm −2 .
Karakterisasi Fisikokimia
Pola difraksi sinar-X (XRD) dari sampel yang telah disiapkan dikumpulkan menggunakan difraktometer anoda tembaga Bruker AXS D8 Advance (radiasi CuKa), dilengkapi dengan monokromator foil Nikel yang dioperasikan pada 40 kV dan 40 mA pada rentang pengumpulan 2θ 10°–80°. Analisis mikroprobe unsur dilakukan oleh mikroskop elektron pemindaian (SEM) JEOL JSM-6390LV yang dilengkapi dengan detektor spektroskopi sinar-X dispersif energi (EDS) Oxford INCA PentaFETx3 (Oxfordshire, Inggris). Akuisisi data dilakukan setidaknya lima kali untuk setiap sampel menggunakan tegangan percepatan 20 kV dan waktu akumulasi 100 detik.
Spektrum UV-vis/near-IR reflektansi difus diperoleh pada spektrofotometer optik Perkin-Elmer Lambda 950 dalam rentang panjang gelombang 200–2500 nm. Bubuk BaSO4 digunakan sebagai standar reflektansi 100% dan bahan dasar yang melapisi sampel bubuk. Data reflektansi difus diubah menjadi serapan menggunakan fungsi Kubelka-Munk α/S = (1–R) 2 /(2R), di mana R adalah reflektansi terukur dan α, S adalah koefisien serapan dan hamburan, berturut-turut. Pengukuran Spektroskopi Fotoelektron Sinar-X (XPS) dilakukan pada spektrometer SPECs (SPECS Surface Nanon Analysis, Berlin, Jerman) yang dilengkapi dengan penganalisis elektron Phoibos 100 1D-DLD, menggunakan radiasi monokromatik Al Kα (1486,6 eV). Untuk memastikan keakuratan, energi pengikatan dikoreksi relatif terhadap sinyal C 1s karbon adventif, ditetapkan pada 284,8 eV dalam semua kasus.
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan menggunakan potensiostat/galvanostat saluran tunggal Princeton Applied Research VersaSTAT 4 yang dilengkapi dengan sel tiga elektroda. Sel tersebut terdiri dari kaca oksida timah terdoping fluor (FTO, 10 Ω/sq) berlapis sampel (1,0 × 2,5 cm 2 ) sebagai elektroda kerja, elektroda referensi Ag/AgCl (KCl jenuh), dan elektroda lawan Pt-mesh. Untuk membuat elektroda kerja, tinta katalis disiapkan dengan mendispersikan 10 mg setiap sampel dalam 1 mL etanol, diikuti dengan ultrasonikasi selama 30 menit dan pengadukan selama 24 jam. Setelah suspensi seragam terbentuk, 100 µL larutan diteteskan ke permukaan konduktif elektroda kaca FTO yang bersih (permukaan efektif 1 cm 2 ). Film kemudian dikeringkan pada suhu 40–50 °C selama 1 jam dan kemudian dipanaskan pada suhu 150 °C selama 1 jam sebelum uji elektrokimia.
Untuk plot Mott-Schottky (MS), kapasitansi muatan-ruang (C SC ) dari antarmuka elektroda/elektrolit diukur dalam elektrolit 0,5 m Na 2 SO 4 (pH = 7), pada frekuensi 1 kHz, menggunakan amplitudo tegangan AC 10 mV, dan potensial pita datar yang diperoleh diubah ke skala elektroda hidrogen reversibel (RHE, pH = 7) menggunakan rumus E RHE = E Ag/AgCl + 0,197, di mana E RHE adalah potensial dalam skala RHE dan E Ag/AgCl adalah potensial terukur dalam skala Ag/AgCl.
Kepadatan donor (N D ) dari bahan yang disiapkan diperkirakan dari kemiringan bagian linier plot Mott-Schottky, menggunakan persamaan Mott–Schottky (MS):
![]()
di mana N D adalah densitas donor bahan elektroda, E adalah potensial yang diberikan, E FB adalah potensial pita datar, C SC adalah kapasitansi muatan ruang, ε o adalah permitivitas dielektrik, e o adalah muatan elementer dan ε adalah konstanta dielektrik relatif dari bahan yang diuji. Konstanta-konstanta tersebut adalah sebagai berikut: ε o = 8,8542 × 10 −12 F/m = 8,8542 × 10 −10 F/cm, e o = 1,602 × 10 −19 C dan ε = 340 untuk STO menurut laporan literatur. [ 43 , 44 ]
Dalam persamaan MS, suku (EE FB )⋅ C sc 2 merupakan kebalikan dari kemiringan ( k ) dari plot Mott-Schottky. Oleh karena itu, persamaan ini dapat disederhanakan menjadi:
![]()
Spektroskopi impedansi elektrokimia (EIS) Plot Nyquist direkam dalam elektrolit 0,5 m Na 2 SO 4 (pH = 7) pada rentang frekuensi dari 1 Hz hingga 100 kHz pada potensi −1,3 V (vs Ag/AgCl, KCl jenuh) dan di bawah pengaruh gangguan AC sebesar 10 mV. Data EIS dianalisis dan dipasang menggunakan perangkat lunak ZView ke model rangkaian Randles sederhana yang setara, yang terdiri dari resistansi elektrolit (R s ), resistansi transfer muatan (R ct ) dan kapasitansi lapisan ganda (C dl ).

