
ABSTRAK
Batang Dendrobium chrysotoxum merupakan tanaman obat tradisional yang terkenal, dan bunganya berpotensi untuk digunakan sebagai sumber makanan baru atau obat tradisional Tiongkok. Akan tetapi, komposisi kimia, keamanan pangan, dan kapasitas antioksidan bunga D. chrysotoxum belum memadai. Dalam penelitian ini, kami mengumpulkan 49 sampel bunga D. chrysotoxum dari 49 lokasi budidaya di lima provinsi selatan Tiongkok. Logam berat dan residu pestisida dalam bunga D. chrysotoxum ditentukan. Lebih jauh, percobaan ini melakukan penilaian keamanan toksikologi sistematis, menganalisis komposisi kimia, dan mengevaluasi kapasitas antioksidan bunga D. chrysotoxum . Hasil penelitian menunjukkan bahwa tidak satu pun dari 49 sampel bunga D. chrysotoxum menimbulkan risiko keamanan terkait lima logam berat dan 33 residu pestisida yang dilarang. Penilaian keamanan toksikologi mengonfirmasi bahwa tidak ada toksisitas yang teramati pada tikus pada dosis oral akut 30,0 g kg −1 . Ekstrak bunga D. chrysotoxum tidak menunjukkan efek mutagenik pada tikus. Dalam kisaran dosis 6,67 g kg −1 , ekstrak bunga D. chrysotoxum tidak menginduksi mikronuklei dalam eritrosit sumsum tulang tikus atau menyebabkan aberasi kromosom pada spermatosit tikus. Selain itu, dalam kisaran dosis 10 g kg −1 , ekstrak bunga D. chrysotoxum tidak menunjukkan toksisitas subkronis pada tikus. Sebanyak 2.047 metabolit diidentifikasi dalam bunga D. chrysotoxum dan diklasifikasikan menjadi 15 superkelas menggunakan metode metabolomik yang ditargetkan secara luas. Enam belas asam amino diukur menggunakan kromatografi cair kinerja tinggi. Studi ini menunjukkan bahwa bunga D. chrysotoxum aman untuk dikonsumsi manusia pada dosis yang dianjurkan. Lebih jauh lagi, bunga D. chrysotoxum mengandung berbagai senyawa fungsional dengan sifat antioksidan, membuatnya cocok untuk pengembangan dan penggunaan sebagai bunga yang dapat dimakan.
1 Pendahuluan
Dendrobium adalah genus terbesar kedua dalam Orchidaceae, dengan 78 spesies yang dilaporkan, terutama tersebar di negara-negara Asia dan Eropa (Hu et al. 2023 ). Anggrek Dendrobium sangat dihargai karena warnanya yang cerah, bunga yang tahan lama, dan wangi yang menyenangkan, yang semuanya berkontribusi pada daya tarik hiasnya. Studi yang sedang berlangsung tentang Dendrobium telah mengungkapkan adanya banyak komponen kimia yang menawarkan manfaat kesehatan bagi manusia. Penggunaan tradisional Dendrobium meliputi pengobatan untuk gangguan dermatologis, sindrom metabolik, gangguan sistem saraf, dan gangguan sistem muskuloskeletal (Li et al. 2023 ). Studi farmakologis modern telah menunjukkan bahwa Dendrobium memiliki berbagai efek farmakologis, termasuk antitumor, antifatigue, antioksidan, anti-penuaan, anti-inflamasi, perlindungan hati, perlindungan gastrointestinal, antidiabetik, dll. (Chen et al. 2021 ; Li et al. 2023 ; Wang 2021 ). Aktivitas farmakologis Dendrobium berkaitan dengan kandungan alkaloid, polisakarida, bibenzil, senyawa fenantrena, senyawa fenolik, dan seskuiterpenoid yang tinggi (Li et al. 2023 ; Yang et al. 2023 ). Komposisi kimia dan aktivitas farmakologis berbagai organ spesies Dendrobium selalu menjadi fokus utama penelitian Dendrobium , yang bertujuan untuk mengembangkan obat-obatan alami dan agen pelengkap dengan efek samping minimal bagi pasien.
Saat ini, spesies Dendrobium yang paling banyak dibudidayakan adalah D. officinale , D. huoshanense , D. chrysotoxum , D. nobile , dan D. moniliforme (Wang 2021 ). D. chrysotoxum terutama tersebar di Yunnan, Tiongkok, India timur laut, dan Asia Tenggara, dengan luas tanam sekitar 4000 ha di Tiongkok (Hu et al. 2023 ). Dalam Farmakope Tiongkok, hanya batang Dendrobium yang diizinkan sebagai bahan obat (Wang 2021 ). Oleh karena itu, dalam produksi Dendrobium obat , daun dan bunganya biasanya dibuang (Wang 2021 ). Saat ini, luas areal budidaya Dendrobium di Tiongkok melebihi 30.000 ha (Yang et al. 2022 ), dengan hampir 4000 ha didedikasikan untuk D. chrysotoxum , yang menghasilkan sekitar 1200 ton bunga segar (Hu et al. 2023 ). Pemanfaatan bunga D. chrysotoxum tidak hanya dapat mengurangi pemborosan sumber daya tetapi juga meningkatkan efisiensi ekonomi (Hu et al. 2023 ).
Tiongkok memiliki sejarah panjang dalam mengonsumsi bunga Dendrobium yang dapat dimakan , dan saat ini, bunga D. officinale dikonsumsi melalui berbagai metode, termasuk menyeduh teh, merendam dalam alkohol, merebus sup, minuman, salad, permen, dan jeli (Cheng et al. 2019 ; Ketsa dan Warrington 2023 ; Zhang et al. 2019 ; Zhao et al. 2021 ). Bunga ini juga dapat digunakan sebagai bahan baku produk farmasi dan kosmetik (Kanlayavattanakul et al. 2018 ). Lebih jauh lagi, jeli yang dibuat terutama dari bunga-bunga ini memenuhi standar kebersihan dan keamanan pangan melalui pengujian mikrobiologi (Yang et al. 2021 ). Bunga D. chrysotoxum berpotensi untuk digunakan sebagai obat tradisional Tiongkok atau makanan baru. Akan tetapi, literatur saat ini tidak memiliki laporan lebih lanjut tentang penerapan bunga D. chrysotoxum sebagai makanan.
Dalam beberapa tahun terakhir, penelitian telah menemukan bahwa daun dan bunga D. huoshanense (Liu et al. 2020 ) dan D. officinale (Wen et al. 2021 ) memiliki komposisi kimia dan aktivitas farmakologis yang mirip dengan batangnya. Seperti batangnya, bunga D. officinale juga mengandung berbagai zat antioksidan seperti antosianin (Zhang et al. 2018 ), flavonoid total (Miao et al. 2019a ), dan polisakarida (Miao et al. 2019b ; Nie et al. 2022 ). Ada beberapa laporan tentang komposisi kimia bunga D. chrysotoxum . Huang menemukan bahwa bunga D. officinale , D. nobile , D. thyrsiflorum , dan D. chrysotoxum semuanya memiliki kadar polisakarida, flavonoid total, dan asam amino yang tinggi (Huang et al. 2017 ). Robustelli menganalisis komponen utama minyak atsiri dari bunga D. chrysotoxum yang berasal dari Degerndorf, Jerman, dan komponen tersebut meliputi ester, hidrokarbon jenuh, terpena teroksigenasi, alkohol, aldehida, dan terpena (Robustelli et al. 2021 ). Hu melaporkan jenis dan kandungan flavonoid dalam ekstrak bunga kering D. chrysotoxum dari Kota Baoshan, Tiongkok (Hu et al. 2023 ). Diperlukan penelitian lebih lanjut tentang jenis dan kandungan komponen kimia dalam bunga D. chrysotoxum . Studi farmakologi modern telah menunjukkan bahwa bunga D. officinale dapat meringankan cedera hati alkoholik pada tikus (Liang et al. 2018 ) dan menurunkan tekanan darah pada tikus dengan hipertensi yang disebabkan oleh konsumsi alkohol gula tinggi dan lemak tinggi (Yang et al. 2024 ). Tiongkok telah memulai uji coba di beberapa provinsi untuk mengembangkan batang, daun, dan bunga Dendrobium sebagai bahan makanan baru dan produk kesehatan khusus lokal (Yang et al. 2022 ). Batang, daun, dan bunga D. officinale telah disetujui oleh Komisi Kesehatan Nasional Tiongkok sebagai bahan makanan baru masing-masing pada tahun 2013, 2017, dan 2018 (Cheng et al. 2019 ; Zhang et al. 2019 ). Keamanan D. officinale telah dipelajari secara ekstensif (Chen et al. 2021 ). Uji toksisitas akut (12,0 g kg −1 ), uji toksisitas genetik, dan uji pemberian makan 90 hari (1,08, 1,67, dan 5,00 g kg −1 ) pada tikus menunjukkan bahwa D. officinaletidak menunjukkan tanda-tanda toksisitas, toksisitas genetik, atau mutagenisitas yang nyata dalam rentang dosis yang diuji (Li et al. 2019 ). Demikian pula, pemberian oral dengan daun dan bunga D. officinale pada dosis 0, 2,0, 4,0, dan 6,4 g kg −1 selama 90 hari tidak menunjukkan efek samping yang nyata pada kualitas sperma dan morfologi jaringan testis pada induk dan keturunan tikus (Fu et al. 2017 ; Fu et al. 2020 ). Evaluasi toksikologi terhadap batang D. taiseed tosnobile dan D. moniliforme juga telah dilaporkan (Lee et al. 2016 ; Yang et al. 2018 ). Namun, saat ini terdapat kesenjangan dalam evaluasi yang aman terhadap batang, daun, dan bunga D. chrysotoxum—sementara penelitian tentang logam berat dan residu pestisida pada Dendrobium terutama berfokus pada batang dan daun, laporan tentang logam berat dan residu pestisida pada bunga Dendrobium jarang (Liu et al. 2023 ; Zhang et al. 2022 ).
Untuk menganalisis secara kuantitatif komposisi kimia bunga D. chrysotoxum dan mengisi kesenjangan dalam evaluasi keamanan bunga D. chrysotoxum . Penelitian ini mengumpulkan 49 sampel bunga D. chrysotoxum dari lokasi budidaya utama di Tiongkok dan mendeteksi kadar logam berat dan residu pestisida terlarang di setiap sampel. Selain itu, evaluasi toksisitas, analisis metabolomik, dan evaluasi kapasitas antioksidan bunga D. chrysotoxum dilakukan. Hasil makalah ini memberikan dasar teoritis bagi bunga D. chrysotoxum sebagai bahan makanan baru yang tidak beracun dan multifungsi.
2 Bahan dan Metode
2.1 Bahan dan Reagen
Sebanyak 49 sampel bunga dikumpulkan pada bulan Mei 2022 dari D. chrysotoxum berumur dua tahun yang dibudidayakan secara artifisial di lokasi budidaya yang representatif di seluruh Tiongkok (Tabel 1 ). Prosedur pengumpulan yang terstandarisasi diikuti secara ketat selama proses pengambilan sampel. Secara khusus, waktu pengumpulan dipilih selama periode puncak pembungaan untuk memastikan keterwakilan dan kualitas sampel yang dikumpulkan. Selain itu, alat yang steril digunakan untuk pengumpulan guna menghindari kontaminasi selama proses pengambilan sampel. Setelah pengumpulan, sampel segera diangkut dan disimpan dengan tepat untuk menjaga kesegaran dan integritasnya. Setiap sampel diberi nomor spesimen unik untuk tujuan identifikasi dan pelacakan. Spesimen saat ini disimpan dalam lingkungan yang terkendali di laboratorium Universitas Pertanian Yunnan.
| Nomor situs | Garis bujur | Lintang | Jenis tanah | Suhu tahunan rata-rata | Pengendapan | |
|---|---|---|---|---|---|---|
| °Timur Timur | °LU | suhu udara | satuan | |||
| 1 | 99.49994 | 24.43325 | Laterit | 18 | 1.200 | |
| 2 | 99.44834 | 24.80358 | Laterit | 23 | 1.300 orang | |
| 3 | 103.4295 | 23.34617 | Tanah coklat | 21 | 1.000 | |
| 4 | 99.59503 | 22.33432 | Biji loess | 17 | 1.100 orang | |
| 5 | 101.2553 | 21.94129 | Laterit | 17.5 | 1.000 | |
| 6 | Nomor telepon 100.05819 | 21.70253 | Laterit | 15.9 | 1.384 orang | |
| 7 | Nomor telepon 104.70955 | 23.13159 | Laterit | 15.9 | 1.384 orang | |
| 8 | 100.09544 | 23.89047 | Laterit | 19 | 1.361 orang | |
| 9 | 99.25272 | 23.15288 | Biji loess | 22.3 | 1.100 orang | |
| 10 | 99.40945 | 23.54505 | Biji loess | 14.9 | 1.253 orang | |
| 11 | Nomor telepon 102.50244 | 23.712 | Laterit | 16.9 | 1.463 tahun | |
| 12 | 100.62879 | 23.74012 | Laterit | 14.5 | 1.302 orang | |
| 13 | Nomor telepon 100.80644 | 22.017 | Laterit | 21 | 1.310 tahun | |
| 14 | Nomor telepon 103.16652 | 23.36494 | Laterit | 16.4 | 890 | |
| 15 | 99.24327 | 24.42862 | Laterit | 21.2 | 1.085 | |
| 16 | 107.25949 | 24.14732 | Tanah sawah | 17.7 | 1.021 tahun | |
| 17 | 107.54748 | 24.98185 | Laterit | 17 | 1.070 orang | |
| 18 | 99.17211 | 25.12765 | Laterit | 16.2 | tahun 967 | |
| 19 | Nomor telepon 104.60231 | 30.84263 | Laterit | 15.6 | 1.120 tahun | |
| 20 | Nomor telepon 104.40041 | 23.01899 | Laterit | 15.5 | 1.120 tahun | |
| 21 | Nomor telepon 109.43442 | 24.33196 | Tanah coklat | 14.5 | 2.100 orang | |
| 22 | 98.83216 | 24.70123 | Laterit | 15 | 2.000 | |
| 23 | Nomor telepon 106.56092 | 28.60749 | Laterit | 16.9 | 1.900 | |
| 24 | 106.75855 | 25.43084 | Laterit | 16.5 | 1.444 tahun | |
| 25 | Nomor telepon 105.00849 | 25.51054 | Tanah hitam | 13.3 | 2.200 | |
| 26 | 103.49155 | 29.60698 | Laterit | 10.5 | 1.800 orang | |
| 27 | 99.04627 | 24.32563 | Laterit | 20.6 | 1.450 orang | |
| 28 | 100.17308 | 25.70164 | Laterit | 16.4 | 2.100 orang | |
| 29 | 98.76833 | 24.15595 | Laterit | 18 | 1.250 | |
| 30 | 98.45436 | Nomor telepon 25.02419 | Laterit | 15.2 | 1.520 tahun | |
| 31 | 100.59228 | 22.50461 | Laterit | 17.8 | 1.500 | |
| 32 | 100.84872 | 24.44269 | Tanah coklat | 18.3 | 1.087 tahun | |
| 33 | 108.37345 | 22.82261 | Laterit | 19.7 | 1.363 tahun | |
| 34 | 99.9385 | 22.56194 | Laterit | 19 | 1.400 orang | |
| 35 | Nomor telepon 101.05215 | 23.05462 | Laterit | 12 | 1.414 tahun | |
| 36 | 100.12953 | 24.44281 | Laterit | 16 | 1.367 orang | |
| 37 | Nomor telepon 117.60103 | 28.93683 | Laterit | 17.4 | 1.283 orang | |
| 38 | 98.83187 | 23.76832 | Laterit | 18.9 | 1.626 orang | |
| 39 | 117.94946 | 28.46063 | Laterit | 19.5 | 2.050 tahun | |
| 40 | 99.9317 | 24.58939 | Laterit | 16.5 | 1.307 orang | |
| 41 | 98.41255 | 24.39881 | Laterit | 19.6 | 1.655 orang | |
| 42 | 97.86249 | Nomor telepon 24.02282 | Laterit | 20 | 1.453 orang | |
| 43 | 97.79853 | 24.18947 | Laterit | 18.9 | 1.595 tahun | |
| 44 | 98.30313 | 24.81078 | Laterit | 18.3 | 1.437 orang | |
| 45 | 97.94994 | 24.69746 | Laterit | 19.3 | 1.464 tahun | |
| 46 | 105.88798 | 28.52633 | Tanah ungu | 18.1 | 1.196 orang | |
| 47 | 103.57841 | 29.74385 | Tanah ungu | 17.1 | 1.375 tahun | |
| 48 | 114.97096 | 25.82548 | Laterit | 19.8 | 1.319 tahun | |
| 49 | 102.6155 | 24.79063 | Laterit | 15.1 | 1.100 orang | |
Tikus SD tingkat SPF, disediakan oleh Liaoning Changsheng Biotechnology Co. Ltd., dengan 10 jantan dan 10 betina (sertifikat mutu No: 1107262011000885), nomor lisensi produksi: SCXK (Liao) 2015-0001, untuk uji toksisitas oral akut; Tikus Kunming tingkat SPF, disediakan oleh SBF (Beijing) Biotechnology Co. Ltd., dengan 55 betina dan 55 jantan (sertifikat mutu No: 1103242011018470), 70 jantan (sertifikat mutu No: 1103242011018471), nomor lisensi produksi: SCXK (Jing) 2019-0010, untuk uji mikronukleus eritrosit mamalia dan uji aberasi kromosom sel spermatogonia tikus; Tikus SD dengan SPF, disediakan oleh SBF (Beijing) Biotechnology Co. Ltd., dengan 53 jantan dan 53 betina (sertifikat mutu No: 110324200102502642), lisensi produksi No: SCXK (Jing) 2019-0010, untuk uji toksisitas oral selama 90 hari. Semua hewan diaklimatisasi selama 3–5 hari.
Fasilitas hewan percobaan beroperasi dalam sistem penghalang dengan nomor lisensi SYXK (Shaanxi) 2016-007, menjaga suhu 20°C–26°C dan kelembapan relatif antara 40% dan 70%. Pakan pemeliharaan hewan disediakan oleh Jiangsu Synergy Pharmaceutical Biotechnology Co. Ltd., dengan nomor lisensi produksi Su Feed (2019) 01008, dan sertifikat mutu pakan bernomor 120200528004, 120200707005, 120200927016, dan 120201024038. Alas tongkol jagung untuk hewan percobaan disediakan oleh Dezhou Gumei Agricultural Technology Co. Ltd., dengan nomor batch produksi GMCC201903257-2, GMCC202007693, dan GMCC202008704.
Semua reagen dan bahan kimia yang digunakan untuk ekstraksi adalah bermutu komersial. Reagen dan bahan kimia untuk pengujian in vitro dan kultur sel bermutu analitis kecuali dinyatakan lain. Standar dan pelarut untuk analisis UPLC bermutu HPLC. Strain TA98, TA100, TA102, TA1535, dan TA1537 dibeli dari Shanghai Baolu Biotechnology Co. Ltd. (Shanghai, Tiongkok). Enzim Mikrosomal Hati Tikus (S9) dibeli dari CHI Scientific Biotechnology Co. Ltd. 2-Aminoanthracene (nomor batch 10197304) dan Siklofosfamid (CP) (nomor batch 5003M28N) dibeli dari Alfa Aesar Chemical Co. Ltd. Dixon (nomor batch 4030165-01) dibeli dari Accustandard Biotechnology Co. Ltd. Sodium azide (nomor batch 20160720) dibeli dari Tianjin Fengchuan Chemical Reagent Technology Co. Ltd. 2-Aminofluorene (nomor batch 929A031) dibeli dari Beijing Solarbio Science and Technology Co. Ltd. 9-Aminoacridine (nomor batch BCBT2829) dibeli dari Sigma-Aldrich Co. Ltd. 1,8-Dihydroxyanthraquinone (nomor batch C1523115) dibeli dari Kuer Bioengineering Co. Ltd. Bahan kimia lainnya seperti parafin, kolkisin, pewarna Giemsa, 2,4,6-trinitrofenol, gliserin, dan alizarin merah dibeli dari Xi’an United Nations Quality Detection Technology Co. Ltd. (Xi’an, Cina).
Fotometer fluoresensi atom (AFS-933), Fotometer serapan atom (ZEEnit650P), Spektrometer Massa Plasma yang Diinduksi (CPMS-2030), Inkubator biokimia (SPX-250B-Z), Penganalisis biokimia otomatis (BS-330E), Penganalisis hematologi otomatis (ADVIA2120i), Penganalisis Urin (URIT-500B), Penganalisis koagulasi otomatis (COMPACT MAX), Dehidrator jaringan otomatis (Histo Core PEARL). Asam aspartat (Asp), treonin (Thr), serin (Ser), asam glutamat (Glu), prolin (Pro), glisin (Gly), alanin (Ala), valin (Val), metionin (Met), isoleusin (ILe), leusin (Leu), tirosin (Tirosin, Tyr) Produk standar Fenilalanin (Phe), Histidin (His), Lisin (Lys), dan Arginin (Arg) dibeli dari Agilent di Amerika Serikat. Bahasa Indonesia: Kit pengujian pemulungan radikal kationik ABTS (nomor batch: G0127W), kit pengujian pemulungan radikal DPPH (nomor batch: G0128W), kit pengujian pemulungan anion superoksida (nomor batch: G0116W), dan kit pengujian pemulungan radikal hidroksil (nomor batch: G0125W) dibeli dari Suzhou Grace Biotechnology Co. Ltd. Semua reagen lainnya disediakan oleh United Nations Quality Detection Technology Co. Ltd. (Xi’an, Tiongkok), termasuk Folin, metanol, natrium karbonat, asam fotografik, ninhidrin, antron, target besi, asam sulfonat, parafin, kolkisin, pewarna giemsa, 2,4,6-trinitrofenol, gliserin, dan alizarin merah.
Fotometer fluoresensi atom (AFS-933), Fotometer serapan atom (ZEEnit650P), spektrometer massa plasma kopling induktif (CPMS-2030), Inkubator biokimia (SPX-250B-Z), Penganalisis biokimia otomatis (BS-330E), Penganalisis hematologi otomatis (ADVIA2120i), Penganalisis urin (URIT-500B), Penganalisis koagulasi otomatis (COMPACT MAX), Dehidrator jaringan otomatis (Histo Core PEARL), spektrofotometer UV-tampak (756CRT), sistem kromatografi cair kecepatan tinggi (Tedia Company Inc., AS), Neraca analitik elektronik (A13204-N); Pembaca enzim (MD190), centrifuge suhu rendah (TLG-16); Oven pengering udara panas elektrik (DHG-9140); Pengering vakum (YZG-FZG); Mesin pengering beku vakum (FD-1A-50), Pembaca Mikroplat Thermo Scientific (Multiskan GO).
2.2 Evaluasi Keamanan
49 bunga D. chrysotoxum segar mengalami perlakuan pengeringan udara panas 60°C, dan terdeteksi kandungan pestisida terlarang dan logam berat.
2.2.1 Pestisida yang Dilarang
Menurut metode “Penentuan Jumlah Residu Pestisida Terlarang dalam Materia Medica Tiongkok dan Potongan Rebusan (Jenis Tanaman)” dari Farmakope Tiongkok edisi 2020 (2.341), kandungan 33 pestisida terlarang dalam sampel ditentukan (Wang et al. 2021 ).
2.2.2 Logam Berat
Pengukuran residu logam berat seperti Cd, As, Hg, Cu, dan Pb dilakukan dengan menggunakan Spektrometer Massa Plasma Induktif mengikuti metode yang diuraikan oleh Yuan et al. ( 2023 ).
2.3 Penelitian Toksikologi
Pilih secara acak satu dari 49 bunga D. chrysotoxum untuk evaluasi toksikologi, analisis komposisi kimia, dan penentuan aktivitas antioksidan. Merujuk pada dosis oral D. officinale yang direkomendasikan , ditetapkan pada 3,0 g hari -1 , dihitung berdasarkan berat orang dewasa 60 kg, dosis ekivalennya adalah 0,05 g kg -1 BB -1 hari -1 . Untuk persiapan sampel, 1500 g bunga D. chrysotoxum direndam dalam 15 L air murni pada tekanan atmosfer dan suhu 80°C–90°C selama 30 menit, diekstraksi dua kali, dan cairan ekstrak digabungkan dan dipekatkan menjadi 1 L untuk penggunaan lebih lanjut. Setiap 1 mL ekstrak pekat setara dengan 1,5 g sampel asli. Tingkat dosis yang digunakan dalam evaluasi toksikologi ditentukan berdasarkan standar yang ditetapkan oleh John Timbrell dalam “Introduction to Toxicology” (Timbrell dan Barile 2023 ).
2.3.1 Uji Toksisitas Oral Akut
Setelah masa adaptasi, dipilih 20 ekor tikus SD, setengah jantan dan setengah betina, dengan berat pascapuasa 180–220 g. Desain dosis: Ekstrak pekat diberikan secara oral kepada hewan dengan dosis 20 mL kg −1 BB −1 (setara dengan 30,0 g kg −1 BB −1 bunga D. chrysotoxum ). Setelah pemberian oral, hewan diobservasi untuk melihat tanda-tanda toksisitas dan kematian selama 14 hari berturut-turut. Berat badan tikus diukur pada awal percobaan, pada hari ke-7, dan pada hari ke-14. Pada akhir percobaan, hewan disuntik mati untuk dibedah kasar.
2.3.2 Uji Mutasi Balik Bakteri
Dengan menggunakan strain TA98, TA100, TA102, TA1535, dan TA1537 yang diautentikasi, uji penggabungan pelat standar dilakukan dengan dan tanpa campuran S9 hati tikus (pada volume 0,5 mL dish −1 ) untuk dua percobaan. Desain dosis untuk percobaan pertama mencakup lima kelompok dosis: 5000, 1581, 500, 158, dan 50 μL dish −1 , beserta air suling steril yang digunakan sebagai kelompok kontrol pelarut (SC), kelompok revertan spontan (SR), dan kelompok kontrol positif (PC). Untuk percobaan kedua, dosisnya adalah 5000, 1000, 200, 40, dan 8 μL dish −1 , beserta kelompok kontrol pelarut (air suling steril), kelompok revertan spontan, dan kelompok kontrol positif.
Persiapan sampel: 1 mL ekstrak pekat diencerkan dengan air suling hingga 20 mL untuk mendapatkan larutan 5%. Untuk percobaan pertama, pengenceran berikutnya dilakukan dengan
pengenceran lipat dimulai dari larutan 5%. Untuk percobaan kedua, pengenceran berikutnya dilakukan dengan pengenceran lima kali lipat dimulai dari larutan 5%. Semua sampel uji yang disiapkan menjalani autoklaf pada tekanan tinggi (0,103 MPa, 20 menit).
Selama percobaan, 0,1 mL larutan dengan konsentrasi masing-masing ditambahkan ke pelat sebagai dosis sampel yang berbeda, dengan setiap dosis diuji dalam pelat rangkap tiga. Untuk pengujian tanpa campuran S9, kontrol positifnya adalah 1,5 μg natrium azida (untuk TA100 dan TA1535), 50,0 μg deksametason (untuk TA98 dan TA102), dan 50,0 μg 9- aminoakridina (untuk TA1537). Untuk pengujian dengan campuran S9, kontrol positifnya adalah 20,0 μg 2 -aminofluorena (untuk TA98 dan TA100), 50,0 μg 1,8 -dihidroksiantrakuinon (untuk TA102), dan 2,0 μg 2-aminofluorena (untuk TA1535 dan TA1537 ). Volume kontrol positif yang ditambahkan ke setiap cawan adalah 0,1 mL.
2.3.3 Uji Mikronukleus Eritrosit Mamalia
Lima puluh tikus Kunming, dengan berat 25–35 g, setengah jantan dan setengah betina, dipilih. Tikus dibagi secara acak menjadi 5 kelompok, masing-masing terdiri dari 10 tikus, dengan jumlah jantan dan betina yang sama. Desain dosis mencakup tiga kelompok dosis: 6,67 mL kg −1 BB −1 , 3,33 mL kg −1 BB −1 , dan 1,67 mL kg −1 BB −1 , bersama dengan kelompok kontrol pelarut (air murni) dan kelompok kontrol positif siklofosfamid (CP, 40 mg kg −1 BB −1 ). Persiapan sampel melibatkan pengukuran 6,67 mL, 3,33 mL, dan 1,67 mL konsentrat, menambahkan air murni ke 20 mL, dan mencampur dengan baik untuk membuat larutan dengan konsentrasi masing-masing 33,35%, 16,65%, dan 8,35%, dan 0,04 g CP dilarutkan dalam 20 mL air murni. Volume gavage ditetapkan pada 20 mL kg −1 BW −1 , dan pengujian dilakukan dengan menggunakan metode gavage 30 jam, dengan interval 24 jam antara dua pemberian. Hewan di-eutanasia dengan dislokasi serviks 6 jam setelah dosis kedua sampel uji, dan apusan sumsum tulang femoralis diambil, difiksasi, dan diwarnai Giemsa. Di bawah perendaman minyak, jumlah sel berinti mikro di antara 2.000 eritrosit polikromatik (PCE) dihitung untuk setiap tikus untuk menghitung frekuensi mikronukleus per seribu. Pengamatan terhadap 200 eritrosit dilakukan untuk menghitung proporsi PCE dalam total eritrosit, yaitu rasio PCE/RBC. NCE merupakan singkatan dari eritrosit normokromatik. Jumlah tikus yang diuji adalah 5 ekor, dan jumlah PCE yang diuji adalah 2.000 x 5 pada setiap kelompok.
2.3.4 Uji Aberasi Kromosom Spermatogonia Tikus
Tiga puluh tikus Kunming jantan, dengan berat 25–35 g, dipilih dan dibagi secara acak menjadi 5 kelompok, dengan kelompok dosis tinggi berisi 10 dan kelompok sisanya masing-masing berisi 5. Dosis ekstrak bunga dan kelompok kontrol dan metode persiapan konsisten dengan uji mikronukleus eritrosit mamalia. Volume gavage ditetapkan pada 20 mL kg −1 BW −1 , dan sampel uji diberikan secara oral dalam gavage tunggal. Selain itu, 0,04 g CP diambil, dilarutkan dalam 10 mL injeksi natrium klorida 0,9% untuk menyiapkan larutan 0,4%, dan diberikan sebagai injeksi intraperitoneal tunggal pada 10 mL kg −1 BW −1 . Hewan dalam kelompok dosis tinggi di-eutanasia untuk pengambilan sampel pada 24 jam dan 48 jam setelah pemberian terakhir ekstrak bunga, dengan 5 hewan pada setiap titik waktu pengambilan sampel. Hewan dalam kelompok lain dieutanasia untuk pengambilan sampel 24 jam setelah pemberian terakhir ekstrak bunga. Semua hewan disuntik secara intraperitoneal dengan larutan kolkisin (dosis: 5 mg kg -1 BB -1 , volume injeksi: 10 mL kg -1 BB -1 ) 5 jam sebelum eutanasia. Hewan dieutanasia dengan dislokasi serviks, dan testis dikeluarkan, ditempatkan dalam larutan natrium sitrat 1% untuk pembuangan membran, pemisahan tubulus seminiferus, dan perawatan hipotonik dalam penangas air 37°C selama 30 menit. Setelah dengan hati-hati membuang larutan hipotonik dan menjalani siklus fiksasi-sentrifus-fiksasi-sentrifus-fiksasi, supernatan dibuang, menyisakan 0,5–1,0 mL suspensi sel untuk diteteskan pada slide dingin. Setelah kering, slide diwarnai Giemsa. Dalam kondisi direndam dalam minyak, 100 sel metafase dihitung untuk setiap hewan guna mencatat jenis, jumlah, dan tingkat sel abnormal kromosom. 1.000 sel per hewan diamati untuk menentukan indeks mitosis spermatogonia, yang dalam kelompok dosis tinggi tidak boleh kurang dari 50% dari kelompok kontrol. Jumlah tikus yang diuji adalah 5, jumlah sel yang diamati adalah 1000 × 5, dan jumlah metamielosit yang terdeteksi selama pemeriksaan adalah 100 × 5 di setiap kelompok.
2.3.5 Uji Toksisitas Oral 90 Hari
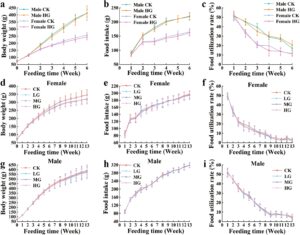
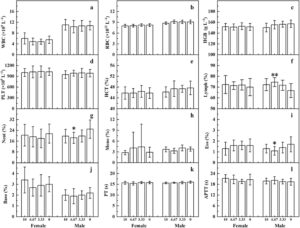
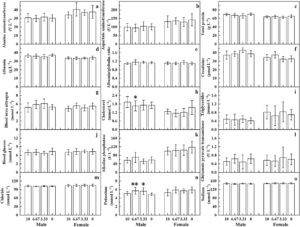
Seratus tikus SD yang disapih, setengah jantan dan setengah betina, dengan berat 61–83 g, dipilih dan dibagi secara acak ke dalam empat kelompok uji utama dan dua kelompok observasi tengah semester. Setiap kelompok uji utama memiliki 20 hewan, setengah jantan dan setengah betina, dan setiap kelompok observasi tengah semester memiliki 10 hewan, setengah jantan dan setengah betina. Desain uji: Kelompok uji menggunakan dosis 10,00 mL kg −1 BW −1 (konsentrat sampel murni), 6,67 mL kg −1 BW −1 , dan 3,33 mL kg −1 BW −1 , dengan kelompok kontrol pelarut tambahan (air murni); kelompok observasi tengah semester ditetapkan pada dosis 10,00 mL kg −1 BW −1 dan kelompok kontrol pelarut (air murni), dengan volume gavage 10 mL kg −1 BW −1. Persiapan sampel: Konsentrat murni digunakan untuk dosis tinggi, dan 66,7 dan 33,3 mL konsentrat masing-masing diencerkan dengan air murni hingga 100 mL untuk membuat larutan dengan konsentrasi masing-masing 66,7% dan 33,3%. Pemberian makanan lewat mulut dilakukan 6 hari seminggu; kelompok uji utama dipelihara selama 90 hari, di mana pengamatan harian terhadap penampilan umum, perilaku, gejala keracunan, dan kematian hewan dilakukan. Berat badan diukur dua kali seminggu selama 4 minggu pertama dan seminggu sekali setelahnya. Asupan makanan mingguan dan jumlah sisa diukur untuk menghitung tingkat efisiensi makanan mingguan dan total. Pemeriksaan oftalmologi dilakukan pada kelompok kontrol dosis tinggi dan pelarut dari uji utama dan kelompok observasi jangka menengah sebelum dan sesudah pengujian. Di tengah pengujian (Hari ke-43), indikator hematologi, biokimia, dan urin diukur untuk hewan kelompok observasi jangka menengah. Setelah berpuasa selama 16 jam di akhir pengujian, berat puasa dicatat. Darah diambil dari aorta abdominal di bawah anestesi untuk parameter hematologi menggunakan alat analisis darah otomatis, penanda koagulasi waktu protrombin dan waktu tromboplastin parsial teraktivasi menggunakan koagulometer otomatis, dan parameter biokimia aspartat aminotransferase, alanin aminotransferase, alkali fosfatase, gamma-glutamiltransferase, urea serum, protein total, albumin, trigliserida, kreatinin, kolesterol total, glukosa, kalium, natrium, klorida menggunakan alat analisis biokimia otomatis. Indikator urin diukur menggunakan alat analisis urin. Hewan dibedah untuk mengamati perubahan organ internal, dan berat hati, ginjal, limpa, kelenjar adrenal, otak, jantung, timus, rahim, ovarium, testis, dan epididimis dicatat, menghitung rasio berat organ/tubuh mereka. Jaringan dari otak, kelenjar pituitari, tiroid, timus, paru-paru, jantung, hati, limpa, ginjal, kelenjar adrenal, lambung, duodenum, jejunum, ileum, usus besar, rektum, pankreas, kelenjar getah bening mesenterika, ovarium, rahim, testis, epididimis, prostat, dan kandung kemih dikumpulkan untuk pemeriksaan histopatologi. Hewan memiliki akses bebas terhadap makanan dan air selama periode pengujian.
2.4 Uji Metabolomik yang Ditargetkan Secara Luas
Metode persiapan untuk ekstrak sampel campuran adalah: 1 g bunga D. chrysotoxum diekstraksi dengan 100 mL air suling pada 80°C selama 2 jam dan disaring melalui kertas saring. Analisis senyawa kimia dan evaluasi aktivitas antioksidan menggunakan metode ekstraksi sampel yang sama. Metabolit dalam bunga D. chrysotoxum dideteksi dan dianalisis menggunakan pendekatan metabolomik yang ditargetkan secara luas, yang dilakukan melalui UPLC-MS/MS oleh Maiwei Metabolic Biotechnology Co. Ltd. ( www.metware.cn/ , Wuhan, Tiongkok). Ekstraksi sampel, kondisi UPLC, metode spektrometri massa perangkap ion linier-triple quadrupole-ionisasi semprotan elektron (ESI), dan analisis data metabolit mematuhi prosedur standar mereka seperti yang sebelumnya dirinci oleh Cao et al. Analisis kontrol kualitas (QC) dilakukan untuk memastikan keandalan data. Sampel QC, yang dibuat dengan mencampur ekstrak, dimasukkan secara berkala setiap 10 sampel untuk memantau variasi dalam analisis berulang.
2.5 Analisis Senyawa Kimia
Kuantifikasi polisakarida dalam bunga D. chrysotoxum mengikuti panduan dari (He et al. 2022 ). Reaksi fenol-asam sulfat dilakukan: larutan fenol 5% (1,0 mL) dan asam sulfat pekat (5,0 mL) ditambahkan secara berurutan ke ekstrak bunga D. chrysotoxum (1,0 mL), dikocok dengan cepat, dipanaskan dalam air mendidih selama 20 menit, segera diangkat, dan direndam dalam es selama 5 menit. Absorbansi larutan reaksi diukur pada 488 nm. Kandungan gula terlarut dideteksi dengan metode kolorimetri anthrone (Zhou et al. 2023 ). Dalam metode ini, 1 mL larutan ekstraksi dicampur dengan 1 mL air suling, 0,5 mL anthrone etil asetat, dan 5 mL asam sulfat pekat, dan kadar gula terlarut dihitung dengan absorbansi pada 630 nm menggunakan Thermo Scientific Microplate Reader (Multiskan GO). Total kandungan polifenol sampel ditentukan menggunakan metode Folin–Ciocalteu (Man et al. 2016 ). Secara singkat, larutan ekstraksi (50 μL) dicampur dengan 850 μL dd H 2 O dan 50 μL reagen Folin–Ciocalteu. Selanjutnya, 150 μL larutan Na 2 CO 3 10% ditambahkan ke campuran dan ditempatkan dalam gelap pada suhu kamar selama 20 menit. Absorbansi campuran reaksi dibaca pada 560 nm terhadap air deionisasi sebagai blanko. Kandungan karotenoid dalam ekstrak bunga D. chrysotoxum ditentukan dengan sistem kromatografi cair kinerja tinggi (HPLC) mengikuti metode Kan et al. ( 2018 ). Total kandungan alkaloid bunga D. chrysotoxum ditentukan dengan menggunakan metode kolorimetri pewarna asam yang dijelaskan sebelumnya oleh Tian et al. Secara singkat, 1,0 mL larutan ekstrak (200 μg mL −1 ) dicampur dengan 5 mL larutan buffer NaOAc/AcOH (pH 3,5) dan 5 mL indikator bromokresol hijau. Campuran dikocok selama 3 menit, kemudian 5 mL Triklorometana (CHCl 3 ) ditambahkan dan dikocok selama 2 menit setelah pencampuran. Campuran dipertahankan selama 30 menit sebelum menghilangkan lapisan CHCl 3 , kemudian absorbansi campuran pada 420 nm ditentukan dengan spektrofotometer UV. Kandungan alkaloid total bunga D. chrysotoxum ditentukan menggunakan metode kolorimetri pewarna asam yang dijelaskan sebelumnya oleh Rao et al. ( 2022 ). Secara singkat, setiap larutan ekstrak 0,5 mL dicampur dengan larutan natrium nitrit 5% 0,15 mL selama 6 menit. Larutan tersebut dicampur dengan larutan aluminium nitrat 10% 0,15 mL selama 6 menit. Larutan tersebut selanjutnya dicampur dengan larutan natrium hidroksida 4% 2 mL dan air suling 2,2 mL selama 3 menit. Absorbansi ditentukan pada 508 nm. Jumlah asam amino dalam D. chrysotoxumBunga diukur menggunakan metode kromatografi cair kinerja tinggi dengan deteksi fluoresensi (HPLC–FLD) dengan derivatisasi o-ftaldehida (OPA) daring sesuai dengan penelitian kami sebelumnya (Zhao et al. 2021 ).
2.6 Evaluasi Aktivitas Antioksidan
Menggunakan kit pengujian komersial yang disediakan oleh Suzhou Grace Bio-tech Co. Ltd. (Suzhou, Tiongkok), kapasitas pembersihan radikal bebas hidroksil, anion superoksida, radikal bebas ABTS, dan radikal bebas DPPH dalam ekstrak bunga D. chrysotoxum ditentukan sesuai dengan petunjuk produsen (Zhao et al. 2021 ).
2.7 Analisis Statistik
Uji mikronukleus eritrosit mamalia menggunakan uji χ 2 , sedangkan uji aberasi kromosom spermatogonia tikus menggunakan uji jumlah pangkat. Data dari uji toksisitas oral 90 hari menjalani uji homogenitas varians; jika variansnya homogen, ANOVA dilakukan, dan jika nilai-P kurang dari 0,05, metode Dunnett digunakan untuk perbandingan berpasangan. Jika variansnya tidak homogen, transformasi data dilakukan; jika homogenitas masih belum tercapai, uji-t sampel independen atau uji jumlah pangkat digunakan. Jika nilai-P kurang dari 0,05, metode T3 Dunnett digunakan untuk perbandingan berpasangan. Semua analisis statistik dilakukan menggunakan perangkat lunak SPSS 26.
3 Hasil
3.1 Evaluasi Keamanan
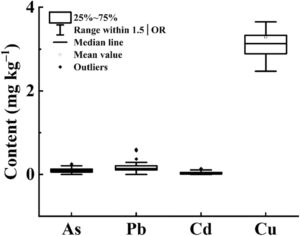
Di antara 49 sampel bunga D. chrysotoxum , kandungan arsenik berkisar antara 0 hingga 0,26 mg kg −1 , Pb berkisar antara 0 hingga 0,77 mg kg −1 , Hg tidak terdeteksi, Cd berkisar antara 0 hingga 0,14 mg kg −1 , dan Cu berkisar antara 2,47 hingga 12,40 mg kg −1 (Gambar 1 ). Tingkat kelima logam berat ini semuanya berada dalam batas yang diizinkan. Selain itu, tidak satu pun dari 49 sampel bunga D. chrysotoxum menunjukkan residu yang terdeteksi dari 33 pestisida yang dilarang (Data yang tidak terdeteksi tidak ditampilkan). Secara keseluruhan, tidak ada tingkat residu pestisida yang terdeteksi atau residu di atas ambang batas aman dalam sampel yang diuji.
3.2 Penelitian Toksikologi
3.2.1 Uji Toksisitas Oral Akut
Setelah pemberian ekstrak bunga D. chrysotoxum secara oral kepada tikus SD dengan dosis 30,0 g kg −1 BW −1 (setara dengan 600 kali dosis yang direkomendasikan untuk manusia), hewan tersebut menunjukkan pertumbuhan yang baik, tanpa dampak yang nyata pada berat badan. Tidak ada tanda-tanda toksisitas yang dapat diamati, dan selama periode pengamatan 14 hari, tidak ada kematian pada hewan tersebut (Tabel S1 ). Setelah percobaan, setelah membedah hewan, pemeriksaan kasar organ-organ utama seperti hati, ginjal, limpa, paru-paru, dan usus tidak menunjukkan perubahan abnormal yang signifikan (Gambar S1 ).
3.2.2 Uji Mutasi Balik Bakteri
Terlepas dari ada atau tidaknya aktivasi S9, jumlah koloni yang kembali pada semua kelompok dosis tidak melebihi dua kali jumlah koloni yang kembali spontan (Gambar 2 ). Lebih jauh, tidak ada hubungan dosis-respons yang diamati. Temuan ini menunjukkan bahwa hasil uji mutagenik dari ekstrak bunga D. chrysotoxum negatif.

3.2.3 Uji Mikronukleus Eritrosit Mamalia
Membandingkan frekuensi mikronukleus sel sumsum tulang pada tikus di semua kelompok dosis dengan kelompok kontrol pelarut, tidak ada perbedaan signifikan (Tabel 2 ). Frekuensi mikronukleus dalam kelompok kontrol positif siklofosfamid berbeda secara signifikan dari yang ada dalam kelompok kontrol pelarut. Nilai PCE/RBC dalam semua kelompok dosis berada dalam kisaran normal, dan proporsi PCE dalam total eritrosit tidak kurang dari 20% dari yang ada dalam kelompok kontrol pelarut, tanpa perbedaan signifikan yang diamati. Hasil ini menunjukkan bahwa sampel tersebut diuji negatif dalam uji mikronukleus eritrosit mamalia.
| Jenis kelamin | Dosis (g kg −1 BB −1 ) | Jumlah mikronukleus | Tingkat mikronukleus (%) | komputer pribadi | Bahasa Inggris | PCE/RBC |
|---|---|---|---|---|---|---|
| Perempuan | 6.67 | 10 | 1,00 ± 0,35 | 103,8 ± 6,4 | 96,2 ± 6,4 | 0,52 ± 0,03 |
| 3.33 | 9 | 0,90 ± 0,42 | 99,6 ± 6,9 | 100,4 ± 6,9 | 0,50 ± 0,03 | |
| 1.67 | 11 | 1,10 ± 0,42 | 100,4 ± 5,9 | 99,6 ± 5,9 | 0,50 ± 0,03 | |
| angka 0 | 11 | 1,10 ± 0,22 | 104,4 ± 5,8 | 95,6 ± 5,8 | 0,52 ± 0,03 | |
| CP | 257** | 25,70 ± 2,08** | 97,8 ± 5,9 | 102,2 ± 5,9 | 0,49 ± 0,03 | |
| Pria | 6.67 | 10 | 1,00 ± 0,35 | 101,6 ± 5,9 | 98,4 ± 5,9 | 0,51 ± 0,03 |
| 3.33 | 12 | 1,20 ± 0,27 | 105,6 ± 4,7 | 94,4 ± 4,7 | 0,53 ± 0,02 | |
| 1.67 | 9 | 0,90 ± 0,42 | 98,4 ± 5,1 | 101,6 ± 5,1 | 0,49 ± 0,03 | |
| angka 0 | 10 | 1,00 ± 0,35 | 103,0 ± 5,8 | 97,0 ± 5,8 | 0,52 ± 0,03 | |
| CP | 252** | 25,20 ± 1,68** | 95,4 ± 5,3 | 104,6 ± 5,3 | 0,48 ± 0,03 |
Catatan: Kehadiran “**” setelah data menunjukkan perbedaan yang signifikan antara perlakuan ini dan perlakuan lainnya.
3.2.4 Uji Aberasi Kromosom Spermatogonia Tikus
Indeks mitosis sel spermatogonia dalam kelompok dosis tinggi tidak turun di bawah 50% dari kontrol pelarut (Tabel 3 ). Perbandingan tingkat sel abnormal dan tingkat aberasi kromosom di seluruh kelompok dosis dengan kelompok kontrol pelarut tidak menunjukkan perbedaan signifikan, sedangkan kelompok kontrol positif siklofosfamid secara signifikan lebih tinggi daripada kelompok kontrol pelarut. Jenis utama aberasi kromosom yang diamati adalah patahan dan fragmen (Tabel 2 ). Hasil ini menunjukkan bahwa sampel diuji negatif dalam uji aberasi kromosom spermatogonia tikus.
| Dosis | Indeks mitosis | Jumlah sel abnormal | Tingkat sel abnormal | Aberasi kromosom | Aberasi total | Tingkat aberasi kromosom | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| g kg −1 berat badan −1 | % | % | Istirahat | Fragmen | Cincin | Beberapa sentromer | Pertukaran monad | Cincin asentris | Mikronuklei | (%) | ||
| 6.67 (24 jam) | 31,4 ± 0,9 | 1 | 0,2 ± 0,5 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 1 | 0,2 ± 0,5 |
| 6,67 (48 jam) | 30,8 ± 1,2 | 2 | 0,4 ± 0,6 | 1 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 2 | 0,4 ± 0,6 |
| 3.33 | 33,1 ± 1,8 | 1 | 0,2 ± 0,5 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 1 | 0,2 ± 0,5 |
| 1.67 | 32,6 ± 1,6 | 2 | 0,4 ± 0,6 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 1 | 2 | 0,4 ± 0,6 |
| angka 0 | 31,8 ± 1,3 | 2 | 0,4 ± 0,6 | 1 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 2 | 0,4 ± 0,6 |
| CP (0,04 gram) | 32,1 ± 1,0 | 43** | 8,6 ± 1,1** | 21** | 17** | angka 0 | angka 0 | angka 0 | angka 0 | 17** | 55** | 11,0 ± 1,6** |
Catatan: Kehadiran “**” setelah data menunjukkan perbedaan yang signifikan antara perlakuan ini dan perlakuan lainnya.
3.2.5 Uji Toksisitas Oral 90 Hari
Selama uji toksisitas oral selama 90 hari, hewan tetap dalam kondisi sehat, dengan pertambahan berat badan terus-menerus, dan tidak ada tanda-tanda toksisitas yang diamati setelah pemberian oral harian berbagai dosis ekstrak bunga D. chrysotoxum dalam setiap kelompok dosis (Gambar 3 ). Selain itu, kami telah mengamati bahwa pemeriksaan oftalmologi pada kelompok kontrol dosis tinggi dan pelarut dalam kelompok uji utama dan kelompok observasi jangka menengah tidak menunjukkan perubahan abnormal pada kornea, lensa, konjungtiva, atau iris.
Dibandingkan dengan kelompok kontrol pelarut, tidak ada perbedaan signifikan dalam parameter hematologi, biokimia, dan parameter urin pada kelompok dosis tinggi tikus jantan dan betina dalam kelompok observasi jangka menengah (Gambar S2 , S3 , dan Tabel S2 ). Pada kelompok uji utama, perbedaan signifikan diamati dalam beberapa parameter hematologi, biokimia, dan parameter urin pada kelompok dosis tertentu tikus jantan dan betina, tetapi perbedaan ini berada dalam kisaran data latar belakang laboratorium ini dan tidak memiliki signifikansi biologis (Gambar 4 , 5 , dan Tabel S2 ). Parameter lain tidak menunjukkan perbedaan signifikan.
Berat basah organ dan rasio berat organ/tubuh tikus jantan dan betina pada setiap kelompok dosis kelompok uji utama tidak menunjukkan perbedaan yang signifikan dibandingkan dengan kelompok kontrol pelarut (Tabel S3 dan S4 ). Setelah eutanasia hewan pada akhir percobaan dan melakukan pembedahan kasar, tidak ada perubahan abnormal yang diamati secara makroskopis. Oleh karena itu, pemeriksaan histopatologi hanya dilakukan pada otak, kelenjar pituitari, kelenjar tiroid, timus, paru-paru, jantung, hati, limpa, ginjal, kelenjar adrenal, lambung, duodenum, jejunum, ileum, kolon, rektum, pankreas, kelenjar getah bening mesenterika, ovarium, uterus, testis, epididimis, prostat, dan kandung kemih pada kelompok dosis tinggi dan kontrol pelarut. Hasil pemeriksaan histopatologi menunjukkan steatosis hepatoseluler ringan pada 3 tikus betina dan 5 tikus jantan pada kelompok dosis tinggi dan 4 tikus dari setiap jenis kelamin pada kelompok kontrol pelarut. Pankreas menunjukkan perubahan vakuolar yang signifikan pada 2 tikus betina dan 2 tikus jantan dalam kelompok dosis tinggi dan 1 tikus betina dan 2 tikus jantan dalam kelompok kontrol pelarut. Hiperplasia alveolar paru diamati pada 5 tikus dari setiap jenis kelamin dalam kelompok dosis tinggi dan 6 tikus betina dan 4 tikus jantan dalam kelompok kontrol pelarut. Sedimen kandung kemih diamati pada 2 tikus jantan dalam kelompok dosis tinggi dan 4 tikus jantan dalam kelompok kontrol pelarut. Lesi jaringan ini dianggap sebagai lesi ringan spontan pada hewan. Tidak ada perubahan patologis signifikan lainnya yang diamati pada jaringan yang tersisa.
Kesimpulannya, tidak ada bukti kerusakan patologis toksik yang diamati pada hewan yang diberi dosis tinggi sampel.
3.3 Komposisi Kimia
Di sini, 2047 metabolit diidentifikasi dalam bunga D. chr ysotoxum dengan metode metabolomik yang ditargetkan secara luas (Gambar 6a ). Metabolit ini dikategorikan ke dalam 15 superkelas menurut sistem klasifikasi The Human Metabolome Database. Kelas utama meliputi 95 asam organik, 104 lignan dan kumarin, 66 nukleotida dan turunannya, 275 asam amino dan turunannya, 1 gliserida, 199 alkaloid, 5 steroid, 194 lipid, 108 terpena, 274 asam fenolik, 65 kuinon, 1 sphingolipid, 4 tanin, 374 flavonoid, dan 282 zat lainnya.
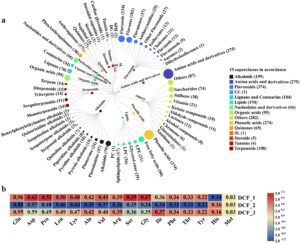
Kami mendeteksi kandungan enam senyawa umum dalam bunga D. chrysotoxum , di antaranya kandungan polisakarida (%) sebesar 25,25 ± 1,36, kandungan gula terlarut (%) sebesar 52,09 ± 1,47, kandungan polifenol (%) sebesar 2,67 ± 0,07, kandungan karotenoid (%) sebesar 0,06 ± 0,01, total kandungan alkaloid (mg kg −1 ) sebesar 1,51 ± 0,02, dan total kandungan flavonoid (mg g −1 ) sebesar 4,50 ± 0,20. Analisis HPLC mengungkapkan bahwa kandungan asam amino bebas dalam bunga D. chrysotoxum sebesar 0,77% ± 0,01%. Enam belas asam amino terdeteksi pada bunga D. chrysotoxum (Gambar 6b ), dengan kandungan tertinggi diamati pada glutamat, sebesar 0,93 mg g −1 , dan aspartat, sebesar 0,60 mg g −1 .
3.4 Evaluasi Aktivitas Antioksidan
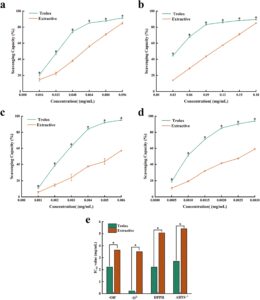
Ekstrak bunga D. chrysotoxum kaya akan nutrisi dan komponen aktif, termasuk polisakarida, polifenol, asam amino, dan multivitamin, dll. Uji in vitro, ekstrak bunga D. chrysotoxum menunjukkan aktivitas pemulungan (SA) yang baik untuk radikal hidroksil (Gambar 7a ), radikal anion superoksida (Gambar 7b ), DPPH (Gambar 7c ), dan ABTS + (Gambar 7d ) dengan perilaku tergantung dosis. EC50 untuk SA dari radikal ·OH − , radikal ·O 2− , radikal DPPH, dan radikal ABTS· + masing-masing adalah 3,64, 3,5, 5,07 dan 5,42 mg mL −1 (Gambar 7e ).
4 Diskusi
4.1 Tingkat Residu Logam Berat dan Pestisida
Bunga Dendrobium memiliki potensi nilai baik sebagai tanaman obat maupun bahan kuliner, mirip dengan batang Dendrobium (Liu et al. 2020 ). Memahami komposisi kimia, keamanan, dan kemampuan antioksidan bunga D. chrysotoxum kondusif bagi pengembangan industri Dendrobium yang terstandarisasi dan berkelanjutan . Kontaminasi logam berat dan residu pestisida merupakan perhatian utama dalam keamanan pangan (van Boxstael et al. 2013 ). Saat ini, penelitian tentang residu logam berat dan pestisida pada Dendrobium terutama difokuskan pada batang atau daun. Zhang melaporkan bahwa tidak ada risiko kesehatan bagi orang dewasa dan anak-anak dari tingkat 8 logam berat dan 24 residu pestisida pada batang D. officinale di Provinsi Zhejiang (Zhang et al. 2022 ). Liu menentukan tingkat residu pestisida pada 137 batang dan 82 daun D. officinale di Provinsi Zhejiang (Liu et al. 2023 ). Ditemukan bahwa beberapa residu pestisida terdeteksi pada 52,56% sampel batang dan 54,88% sampel daun. Namun, penilaian risiko kesehatan kronis dan akut menunjukkan bahwa residu pestisida dalam D. officinale menimbulkan risiko jangka pendek, jangka panjang, dan kumulatif yang dapat diabaikan bagi kesehatan manusia. Gu mengukur kadar residu pestisida dalam 40 sampel batang D. officinale dari delapan provinsi di Tiongkok (Gu et al. 2021 ), sementara Xu menilai kadar residu pestisida dalam sampel batang atau daun D. officinale dari Zhejiang, Yunnan, dan Guangzhou (Xu et al. 2021 ), dan melalui penilaian risiko kesehatan kronis dan akut, ditemukan bahwa residu pestisida dalam D. officinale tidak akan menimbulkan masalah kesehatan yang serius bagi masyarakat. Yan menemukan bahwa waktu paruh 12 pestisida dalam batang D. officinale berkisar antara 0,9 hingga 14,4 hari, dan batang D. officinale yang dipanen lebih dari 42 hari setelah aplikasi pestisida menimbulkan risiko makanan yang rendah bagi populasi (Fu et al. 2021 ). Studi ini adalah yang pertama melaporkan tingkat logam berat dan residu pestisida dalam bunga D. chrysotoxum . Studi ini mengumpulkan bunga D. chrysotoxum dari 49 lokasi penanaman di lima provinsi selatan Tiongkok dan menemukan bahwa tingkat 5 logam berat dan 33 residu pestisida yang dilarang berada dalam batas aman. Sejauh yang kami ketahui, petani menghindari penggunaan pestisida selama periode pembungaan D. chrysotoxum , sehingga mencegah kontak langsung antara bunga dan pestisida. Ketika D. chrysotoxumsedang berbunga, pestisida di lingkungan kemungkinan besar telah terdegradasi sebagian besar, sehingga menghasilkan tingkat residu pestisida yang rendah pada bunga D. chrysotoxum .
Di Provinsi Yunnan, tanah mengandung kadar logam berat yang berlebihan, yang menyebabkan kadar logam berat yang lebih tinggi pada tanaman dengan kemampuan untuk mengakumulasikannya, seperti Dendrobium . Bao melakukan meta-analisis dan menemukan bahwa total kontaminasi sembilan logam berat di batang Dendrobium adalah 0,30 mg kg −1 (Huihui et al. 2023 ). Selain itu, ada heterogenitas yang signifikan dalam tingkat 7 kelas kontaminasi logam berat di batang Dendrobium dari berbagai daerah (Huihui et al. 2023 ). Dalam penelitian kami, kadar lima logam berat dalam bunga D. chrysotoxum berada dalam batas aman. Wu melaporkan bahwa sekuestrasi kadmium dalam vakuola dan bagian terlarut lainnya adalah mekanisme detoksifikasi utama akar D. officinale (Jiang et al. 2020 ). Mungkin, dalam jalur pengangkutan logam berat dari akar ke batang, daun, dan bunga, berbagai bagian tanaman memiliki tingkat imobilisasi logam berat yang berbeda-beda, sehingga mengurangi kandungan logam berat dalam bunga. Hasil kadar residu logam berat dan pestisida menunjukkan bahwa bunga D. chrysotoxum mungkin lebih cocok untuk dikonsumsi dalam hal keamanan dibandingkan dengan batang atau daun.
4.2 Penilaian Toksikologi
Penilaian keamanan toksikologi pangan dapat memprediksi toksisitas dan potensi bahaya pangan tertentu bagi manusia (Ververis et al. 2020 ). Dalam studi ini, hasil uji toksisitas oral akut mengindikasikan bahwa bunga D. chrysotoxum (30,0 g kg −1 ) tidak beracun bagi tikus jika diberikan secara oral. Demikian pula, Fu menyelidiki toksisitas oral akut bubuk bunga D. officinale pada tiga dosis, 2,0, 4,0, dan 6,4 g kg −1 , pada tikus hamil dan keturunannya sebelum lahir, tidak menemukan efek samping yang signifikan (Jianyun et al. 2020 ). Zhou melakukan uji toksisitas oral akut pada tikus menggunakan dosis 12,5 g kg −1 bubuk batang D. officinale (Wen et al. 2022 ), sementara Lu melakukan uji serupa pada tikus menggunakan dosis 10 g bubuk daun D. officinale (Lipin et al. 2022 ), tanpa gejala merugikan yang signifikan yang diamati pada tikus. Uji mutasi balik bakteri telah menjadi metode yang disukai untuk menyaring efek mutagenik bahan kimia (Hamel et al. 2016 ). Uji mikronukleus eritrosit mamalia terutama digunakan untuk mendeteksi kerusakan yang disebabkan oleh faktor kimia atau fisik pada kromosom atau aparatus spindel (Wen et al. 2022 ). Uji aberasi kromosom spermatogonia tikus lebih berfokus pada evaluasi mutagenisitas zat uji pada sel reproduksi jantan (Wen et al. 2022 ). Zhou (Wen et al. 2022 ) dan Lu (Lipin et al. 2022 ) melakukan uji mutasi balik bakteri, uji mikronukleus eritrosit mamalia, dan uji aberasi kromosom spermatogonia tikus pada bubuk batang dan bubuk daun D. officinale , menemukan bahwa D. officinale tidak menunjukkan efek mutagenik, tidak ada induksi mikronukleus pada sel sumsum tulang tikus, dan tidak ada induksi aberasi kromosom pada sel spermatogonia tikus. Gu menggunakan uji mikronukleus eritrosit polikromatik sumsum tulang tikus dan uji aberasi kromosom fibroblas paru-paru hamster Cina untuk menilai genotoksisitas batang D. officinale segar (Fang-Fang et al. 2016 ). Hasil penelitian menunjukkan bahwa D. officinale segar tidak menunjukkan genotoksisitas dalam kisaran dosis yang diuji. Studi kami juga tidak menemukan efek mutagenik dari ekstrak bunga D. chrysotoxum pada tikus. Uji mikronukleus sel darah merah mamalia dan uji aberasi kromosom spermatosit tikus yang dilakukan pada dosis 1,67, 3,33, dan 6,67 g kg −1 menunjukkan bahwa ekstrak D. chrysotoxumbunga tidak menginduksi mikronuklei dalam eritrosit sumsum tulang tikus atau menyebabkan aberasi kromosom pada spermatosit tikus.
Wang melakukan percobaan toksisitas oral 90 hari pada tikus menggunakan bubuk batang D. officinale pada tiga dosis 2,0, 4,0, dan 8,0 g kg −1 , dan tidak menemukan kelainan pada aktivitas dan pertumbuhan tikus, dengan nilai biokimia urin, hematologi, dan darah semuanya dalam kisaran fisiologis normal (Yu et al. 2020 ). Yang mengevaluasi studi toksisitas oral 90 hari pada tikus menggunakan ekstrak air batang D. Taiseed Tosnobile pada tiga dosis 0,8, 1,6, dan 2,4 g kg −1 , tidak menemukan perubahan dalam status mata, kondisi klinis, berat badan, konsumsi makanan, atau efisiensi makanan. Meskipun perubahan signifikan diamati dalam beberapa parameter hematologi dan biokimia dalam kelompok perlakuan yang menerima ekstrak batang D. Taiseed Tosnobile oral , nilai-nilai ini tetap dalam kisaran normal dan tidak menunjukkan ketergantungan dosis (Yang et al. 2018 ). Dalam penelitian ini, kami melakukan percobaan toksisitas oral 90 hari pada tikus menggunakan empat dosis bunga D. chrysotoxum pada 0, 3,33, 6,67, dan 10 g kg −1 . Hasilnya tidak menunjukkan perbedaan signifikan dalam pertumbuhan, aktivitas, dan status oftalmik di antara kelompok dosis yang berbeda. Meskipun parameter hematologi, biokimia, dan urin tertentu menunjukkan perbedaan signifikan antara beberapa kelompok dosis, perbedaan ini tetap dalam kisaran normal. Lebih jauh lagi, hasil pemeriksaan histopatologi menunjukkan bahwa ada sangat sedikit perbedaan individu antara kelompok dosis tertentu, yang dapat dianggap sebagai lesi ringan spontan pada hewan, dan tidak ada perubahan patologis yang terkait dengan zat uji yang ditemukan. Hasil ini menunjukkan bahwa bunga D. chrysotoxum tidak menunjukkan toksisitas akut, genotoksisitas, atau toksisitas subkronis pada manusia dalam kisaran dosis yang aman.
4.3 Komposisi Kimia dan Penilaian Kapasitas Antioksidan
Meningkatnya farmakologi modern telah memicu minat yang semakin besar di antara para peneliti di seluruh dunia dalam mengeksplorasi pengobatan alami untuk pencegahan penyakit. Senyawa membentuk landasan pendekatan pengobatan dalam pengobatan tradisional Tiongkok, dengan para peneliti berfokus pada keragaman kimia yang kaya yang ditemukan dalam tanaman alami. Khususnya, penelitian tentang Dendrobium telah melihat lonjakan perhatian. Sebuah tinjauan baru-baru ini merangkum total 450 senyawa yang diidentifikasi dari genus Dendrobium , yang meliputi 45 alkaloid, 21 flavonoid, 83 bibenzil, 79 senyawa fenantrena, 52 senyawa fenolik, 25 senyawa lignan, 8 senyawa fluorenon, 8 kumarin, 33 polisakarida, 52 seskuiterpenoid, 17 elemen jejak, dan 17 senyawa lainnya (Li et al. 2023 ). Namun, di antara lima spesies Dendrobium yang didokumentasikan dalam “Farmakope Tiongkok,” semua bagian obatnya adalah batang; dengan demikian, penelitian sebelumnya tentang komposisi kimia Dendrobium terutama difokuskan pada batangnya. Namun, Tang membandingkan komposisi kimia batang, daun, bunga, dan akar D. officinale dan menemukan bahwa kandungan polisakarida dalam batang lebih tinggi daripada dalam bunga, tetapi kandungan flavonoid dan alkaloid lebih rendah daripada dalam bunga (Wen et al. 2021 ). Liu menemukan bahwa kandungan polisakarida D. huoshanense mengikuti urutan: batang > bunga > akar > daun (Liu et al. 2020 ). Laporan sebelumnya menunjukkan bahwa bunga Dendrobium mungkin memiliki komposisi kimia dan aktivitas farmakologis yang mirip dengan batang Dendrobium . Penelitian kami sebelumnya menunjukkan bahwa bunga D. huoshanense mengandung berbagai senyawa fungsional, dengan kandungan polisakarida tinggi sebesar 2,53 ± 0,14 g kg −1 dan kandungan gula terlarut tinggi sebesar 5,21 ± 0,15 g kg −1 . Dalam studi ini, kami melakukan analisis komprehensif terhadap komposisi kimia bunga D. huoshanense menggunakan pendekatan metabolomik tertarget yang luas, mengidentifikasi total 2.047 metabolit yang dapat diklasifikasikan ke dalam 15 superkelas. Robustelli melaporkan perbedaan dalam komposisi kimia minyak esensial dari bunga D. huoshanense dibandingkan dengan temuan kami (Robustelli et al. 2021 ). Perbedaan ini dapat disebabkan oleh variasi kondisi iklim, karakteristik tanah, praktik budidaya, periode pertumbuhan, dan waktu pengambilan sampel, atau dapat disebabkan oleh perubahan dalam metode pemrosesan yang memengaruhi konstituen kimia D. huoshanense.bunga. Dengan mengidentifikasi asam amino dan metabolit tertentu yang terkait dengan aktivitas antioksidan, kita dapat lebih memahami mekanisme yang digunakan bunga ini untuk memberikan manfaat kesehatan. Pengetahuan ini tidak hanya meningkatkan pemahaman kita tentang potensi D. chrysotoxum sebagai makanan fungsional, tetapi juga membuka jalan bagi penelitian masa depan tentang aplikasi terapeutiknya.
Kapasitas antioksidan batang, daun, dan bunga berbagai spesies Dendrobium telah banyak dilaporkan, termasuk bunga D. huoshanense (Chen et al. 2021 ; Li et al. 2023 ). Temuan kami konsisten dengan penelitian sebelumnya, yang menunjukkan bahwa kemampuan bunga D. huoshanense untuk membersihkan radikal hidroksil, anion superoksida, radikal ABTS, dan radikal DPPH meningkat seiring dengan peningkatan konsentrasi ekstrak bunga. Kapasitas antioksidan bunga D. chrysotoxum mungkin terkait dengan kandungan polisakaridanya yang tinggi (Nie et al. 2020 ).
5 Kesimpulan
Melalui penentuan kadar 5 logam berat dan 33 residu pestisida terlarang pada bunga D. chrysotoxum , serta penilaian keamanan toksikologi pangan, penelitian kami telah menunjukkan bahwa bunga D. chrysotoxum tidak menimbulkan toksisitas atau potensi bahaya bagi manusia. Selain itu, total 2047 metabolit yang dapat diklasifikasikan ke dalam 15 superkelas telah diidentifikasi pada bunga D. chrysotoxum . Kami telah menunjukkan bahwa bunga D. chrysotoxum memiliki kapasitas antioksidan. Temuan penelitian kami memberikan bukti teoritis untuk nilai potensial bunga D. chrysotoxum sebagai ramuan obat dan bahan kuliner.

