ABSTRAK
Pemahaman yang komprehensif tentang bagaimana sifat gluten mempengaruhi tekstur mi masih terbatas. Studi ini meneliti dampak sifat fisikokimia dan struktural gluten pada tekstur mi. Tujuh varietas gandum dari Tiongkok, Prancis, Kanada, dan Australia digunakan. Hasil penelitian menunjukkan bahwa peningkatan hidrofobisitas permukaan dan kandungan β-sheet yang lebih tinggi yang ditentukan berdasarkan kadar relatif setiap sifat di antara varietas yang diuji mengurangi retensi air gluten, menurunkan daya rekat mi. Hidrofobisitas permukaan yang lebih besar juga meningkatkan stabilitas termal gluten, meningkatkan kekenyalan, kekerasan, dan sifat tarik mi. Sebaliknya, kandungan α-helix yang lebih tinggi meningkatkan kelarutan, sementara proporsi subunit gluten berat molekul tinggi (HMW-GS) yang lebih besar memperkuat jaringan gluten, meningkatkan kekerasan dan elastisitas. Di antara varietas yang diuji, gandum durum Australia (AD) menunjukkan elastisitas yang unggul dan tekstur yang seimbang, dengan kekerasan (376,43 g), kekenyalan (267,13 g), daya rekat (27,49), dan ketahanan (0,815). Sifat-sifat ini dikaitkan dengan kapasitas menahan air yang tinggi (3,03 g/g), kelarutan (0,3 mg/mL), dan stabilitas termal ( T d = 58,18°C). Temuan ini memperjelas peran gluten dalam tekstur mi dan menetapkan kriteria berbasis protein untuk pemilihan gandum dalam pengolahan.
1 Pendahuluan
Mi adalah makanan yang populer secara global karena harganya yang murah, rasanya yang lezat, dan kemudahan dalam persiapannya (Kaur et al. 2016 ). Tepung terigu adalah bahan utama untuk membuat mi, dengan bahan tambahan seperti air dan garam (Dewan et al. 2022 ). Seiring dengan peningkatan standar hidup, orang-orang semakin memprioritaskan tidak hanya penampilan, rasa, dan kandungan gizi mi tetapi juga tekstur dan kualitas sensoris (Zhang et al. 2022 ). Tekstur mi yang dimasak memengaruhi rasa dan pengalaman menyantapnya (Yao et al. 2020 ), dan karakteristik tekstur berkontribusi secara signifikan untuk menilai sifat mi dan menentukan penerimaan konsumen (Zang et al. 2022 ; Y. Zhang et al. 2020 ). Namun, mekanisme yang mendasari bagaimana tepung memengaruhi tekstur mi dan cara mengaturnya masih belum jelas.
Bahasa Indonesia: Menyumbang 80%–85% kandungan protein gandum, gluten sangat penting dalam membentuk karakteristik fungsional tepung terigu. Gluten terutama terdiri dari dua fraksi utama: glutenin, yang tidak dapat larut dalam larutan hidroalkohol, sementara gliadin, yang menunjukkan kelarutan di dalamnya (Zhao et al. 2020 ). Glutenin terdiri dari subunit protein yang terhubung melalui ikatan disulfida antar dan intramolekul, yang membentuk kerangka struktural gluten. Glutenin dicirikan oleh subunit gluten berat molekul rendah (LMW-GS) dan subunit gluten berat molekul tinggi (HMW-GS) (Li et al. 2021 ). Glutenin menjadi kental dan elastis saat menyerap air, sehingga berkontribusi pada integritas struktural dan sifat elastis mi (An et al. 2022 ). Sebaliknya, gliadin adalah protein monomerik yang dipolimerisasi melalui ikatan disulfida intra-rantai, yang memberikan sifat lengket dan dapat diperpanjang pada adonan setelah penyerapan air (Wang et al. 2020 ).
Banyak laporan sebelumnya menunjukkan bahwa kandungan komponen protein memberikan pengaruh penting pada karakteristik tekstur mi, termasuk kekerasan, kekompakan, dan elastisitas (Barak et al. 2014 ). Ketika kandungan gluten bervariasi dalam kisaran 8%–12%, kekerasan mi tetap stabil, sementara di atas 14%, kekerasan meningkat secara signifikan (Yao et al. 2020 ). Selain itu, faktor signifikan dalam karakteristik fisik mi adalah rasio LMW-GS terhadap HMW-GS (Zhou et al. 2023 ). Misalnya, persentase HMW-GS yang tinggi menghasilkan struktur adonan yang lebih keras, sehingga menciptakan tekstur mi yang lebih kencang (Li et al. 2019 ). Studi lain mengonfirmasi bahwa rasio LMW-GS terhadap HMW-GS yang lebih rendah menurunkan karakteristik ketahanan termal gluten, yang berdampak buruk pada kekuatan gluten serta kekencangan dan tekstur mi (Zhou et al. 2023 ).
Fungsionalitas gluten dibentuk oleh struktur bawaannya. Dalam proses memasak mi, glutenin dan gliadin dalam gluten membentuk arsitektur jaringan gluten kovalen dan nonkovalen, yang juga merupakan bagian integral dari pembentukan tekstur mi (Li et al. 2021 ). Dalam proses perebusan, pembentukan ikatan disulfida semakin memperkuat proses ikatan silang antara gluten dan gliadin, memengaruhi agregasi gluten dan akhirnya memengaruhi karakteristik mi (Gao et al. 2020 ). Bukti ekstensif mengonfirmasi bahwa tingkat perkembangan gluten selama produksi mi mengatur kekerasan permukaan mi yang dimasak (Wang et al. 2023 ). Investigasi Fourier Transform Infrared Spectrometer (FTIR) menunjukkan bahwa struktur β-sheet dalam gluten gandum sangat penting untuk kualitas gluten (Sun et al. 2021 ). Kontak hidrofobik dan ikatan disulfida diidentifikasi sebagai jaringan gluten oleh tekanan intermolekul (Zhou et al. 2022 ). Tingkat β-sheets dan ikatan disulfida dalam gluten mencerminkan kualitas gandum, sedangkan distribusi fraksi HMW-GS, yang memengaruhi struktur sekunder gluten, merupakan kunci kualitas adonan (Zhou et al. 2022 ). Temuan ini menunjukkan bahwa sifat gluten memengaruhi tekstur mi. Meskipun demikian, studi komprehensif yang secara sistematis menghubungkan sifat gluten dengan tekstur mi masih kurang.
Studi ini berhipotesis bahwa sifat fisikokimia dan struktural protein gluten dari berbagai varietas gandum merupakan penentu penting kualitas tekstur mi. Untuk memvalidasi hal ini, gluten dari tujuh varietas gandum yang berasal dari Tiongkok, Prancis, Kanada, dan Australia dikarakterisasi secara sistematis. Pada bagian pertama studi ini, kapasitas menahan air, kelarutan, sifat termal, hidrofobisitas, dan struktur sekunder protein gluten dinilai. Pada bagian kedua, metode statistik, termasuk analisis korelasi, analisis komponen utama, dan analisis kluster, diterapkan untuk mengeksplorasi hubungan antara sifat gluten dan atribut tekstur mi. Selain itu, varietas gandum yang optimal untuk produksi mi diidentifikasi dari tujuh varietas yang diperiksa.
2 Bahan dan Metode
2.1 Bahan
Varietas gandum yang diuji adalah Jiaxi Chunmai (JX), Yongliang No. 4 (YL), Youmai 02-1 (YM), Local Xinpu (LX), Australian Durum Wheat (AD), Australian White Wheat (AW), dan French Wheat (FW), yang diperoleh dari Jinmailang Foods Company (Xingtai, Provinsi Hebei, Tiongkok). Varietas ini dipilih berdasarkan asal geografisnya yang berbeda (Tiongkok, Australia, dan Prancis), yang memengaruhi sifat kualitas, termasuk kandungan gluten, komposisi protein, dan fungsionalitas penggunaan akhir (Munch et al. 2025 ). Setelah kadar airnya disesuaikan menjadi sekitar 25°C, gandum digiling menggunakan penggiling laboratorium Chopin (Model CD1, Villeneuve la Garenne, Prancis). Tepung yang dihasilkan disimpan pada suhu 4°C. Komposisi protein dan gluten basah dari tepung gandum disajikan dalam Tabel 1 , yang ditentukan menggunakan metode standar (AACC 2000 ). Asam 8-Anilino-1-naftalena sulfonat (ANS) diperoleh dari Beijing Solarbio Company (Beijing, Cina), dan zat lainnya bersumber dari Beijing Chemical Works (Beijing, Cina).
| Varietas | Kandungan protein | Kandungan gluten basah |
|---|---|---|
| JX | 12,4 ± 0,14 satuan | 36,70 ± 0,40 miliar |
| YL | 12,0 ± 0,11 miliar | 36,80 ± 0,79 miliar |
| YM | 11,7 ± 0,10 detik | 39,83 ± 0,47 jam |
| Bahasa Indonesia: LX | 10,9 ± 0,08 hari | 34,00 ± 0,46 detik |
| IKLAN | 10,5 ± 0,14 e | 34,33 ± 0,78 detik |
| AW | 8,23 ± 0,09 derajat Fahrenheit | 26,30 ± 0,10 hari |
| FW | 8,01 ± 0,45 gram | 24,43 ± 0,12 |
Catatan: Rata-rata ± simpangan baku (SD), superskrip menunjukkan perbedaan signifikan menggunakan p < 0,05. Singkatan: AD, Gandum Durum Australia; AW, Gandum Putih Australia; FW, Gandum Prancis; JX, Jiaxi Chunmai; LX, Xinpu Lokal; YL, Yongliang No. 4; YM, Youmai 02-1
2.2 Persiapan, Tekstur, dan Analisis Sensori Mie
Proses pembuatan mi dilakukan dengan mengikuti metode yang diuraikan oleh Soojeong Jeon (Jeon et al. 2019 ) dengan sedikit perubahan. Secara umum, 100 g sampel tepung dan 36 g air dicampur dengan baik dan diaduk hingga terbentuk flokulan. Flokulan didiamkan selama 15 menit, kemudian digilas enam kali dengan mesin pres untuk membuat mi setebal 1,0 mm yang seragam. Kemudian, mi dipotong-potong menjadi potongan selebar 1,0 mm menggunakan pemotong, dan 800 mL air suling ditambahkan ke panci masak. Selanjutnya, potongan-potongan tersebut dimasak hingga air mendidih, kemudian segera dipindahkan ke air dingin dan direndam dalam air selama 5 menit dalam corong. Proses standar ini memastikan bahwa kondisi pembuatan mi konsisten di semua varietas gandum, yang memungkinkan perbandingan yang adil dari kualitas teksturnya.
Mi diperiksa menggunakan penganalisa tekstur TA-XT2i (Stable Micro Systems, Scarsdale, NY, AS). Selama uji analisis profil tekstur (TPA), tiga mi diambil dan diletakkan di atas meja pembawa pada interval yang sesuai, memastikan bahwa mereka diposisikan sejajar satu sama lain dengan sisi lebar menghadap ke atas. Untuk uji tarik, satu mi diambil pada satu waktu dan dililitkan di kedua ujung probe untuk memastikannya terpasang dengan aman. Setiap kelompok sampel diuji 5–10 kali. Sesuai dengan Standar Nasional Tiongkok (GB/T 35875-2018), kualitas mi dievaluasi berdasarkan skor total 15 poin untuk setiap indikator. Skor penerimaan tekstur dihitung sebagai jumlah dari empat indikator yang tersisa, dikalikan dengan koefisien 0,25. Evaluasi sensoris dilakukan oleh panel yang terdiri dari 10 penilai terlatih.
2.3 Ekstraksi Gluten, Glutenin, dan Gliadin
Sampel tepung 100 g dicampur dengan 52 mL larutan NaCl 0,4 mol/L dan diremas selama 8 menit. Setelah dicuci dengan 1 L larutan NaCl 0,4 mol/L, adonan dibilas dengan air deionisasi hingga reagen kalium pati iodida tidak menunjukkan perubahan warna. Gluten basah dikeringkan beku dalam vakum selama 72 jam, digiling menjadi bubuk halus, dan diayak melalui saringan 80 mesh. Ekstraksi berulang dilakukan menggunakan 15 mL diklorometana per gram pada suhu 25°C selama 1 jam, tiga kali, untuk mengurangi bubuk gluten.
Bubuk gluten yang diawetkan dengan metode liofilisasi dilarutkan dalam etanol 70%, diaduk selama 3 jam pada suhu 25°C, dan disentrifugasi pada kecepatan 1000 × g selama 30 menit pada suhu 4°C. Supernatan dikumpulkan, dan endapan diekstraksi lebih lanjut dengan etanol. Supernatan yang telah digabung dipekatkan menggunakan rotary evaporator dan dikeringkan dengan metode beku untuk memperoleh fraksi gliadin dan glutenin, yang disimpan pada suhu 4°C untuk analisis.
2.4 Kalorimetri pemindaian diferensial
Lima miligram sampel protein gluten gandum ditempatkan dalam wadah peleburan, dengan kotak aluminium kosong digunakan sebagai kontrol. Differential Scanning Calorimetry (DSC) (Q5000IR, TA Instruments, AS) dilakukan di bawah aliran nitrogen yang dipertahankan pada laju 40 mL/menit, pemindaian dari 20°C hingga 120°C. Suhu inisiasi ( T ₀), suhu puncak ( T d ), dan energi termal (Δ H ) ditentukan menggunakan data dari perangkat lunak pemrosesan instrumen (Chian et al. 2021 ).
2.5 Kapasitas Penampungan Air
Untuk menilai kapasitas menahan air (WHC), massa tabung sentrifus kosong 10 mL dicatat. Kemudian, 100 mg gluten didispersikan dalam 8 mL air suling, diaduk selama 2 menit pada suhu 25°C, dan didiamkan selama 1 jam. Campuran disentrifus pada kecepatan 4500 rpm selama 10 menit, dan massa total endapan dan tabung dicatat. WHC dihitung menggunakan Persamaan ( 1 ).
![]()
di mana M 1 melambangkan berat tabung sentrifus, M 2 melambangkan massa sampel gluten, dan M 3 melambangkan massa total sedimen beserta tabung sentrifus.
2.6 Kelarutan Protein
Untuk menilai kelarutan protein (PS), 200 mg gluten dilarutkan dalam 20 mL buffer fosfat (0,01 mol/L, pH 7) dan dikocok selama 1 jam pada suhu 25°C. Supernatan diencerkan, dan konsentrasi proteinnya diukur menggunakan kit uji protein Bradford. PS dinyatakan sebagai persentase kandungan protein dalam supernatan relatif terhadap sampel awal.
2.7 Hidrofobisitas Permukaan
Hidrofobisitas ( H₀ ) pada permukaan gluten gandum diukur menggunakan metode probe fluoresensi ANS (Akharume et al. 2020 ). Suspensi protein (10 mg/mL) dalam 0,01 mol/L buffer fosfat (pH 7,0) diaduk selama 30 menit pada ~25°C dan kemudian disentrifugasi pada 6000 × g selama 10 menit. Konsentrasi protein supernatan ditentukan melalui uji Bradford dan diencerkan menjadi 0,002–0,01 mg/mL.
Sampel yang diencerkan (4 mL) diinkubasi dengan 20 μL larutan ANS (8 mmol/L dalam 0,1 mol/L buffer fosfat) dalam gelap selama 15 menit. Intensitas fluoresensi (FI) diukur (eksitasi: 390 nm, emisi: 540 nm) menggunakan spektrofluorometer (EH54-7DQ, Edinburgh Instruments, Inggris). Hidrofobisitas permukaan diperoleh dari kemiringan awal FI sebagai fungsi konsentrasi protein.
2.8 Pemisahan Berbasis Gel Poliakrilamid Sodium Dodecyl Sulfate
Elektroforesis gel poliakrilamid-natrium dodecyl sulfate (SDS-PAGE) dilakukan menggunakan gel penumpukan 5% dan gel pengencer 12%. Setelah sampel dicampur dengan buffer pemuatan (3:1) dan dipanaskan dalam penangas air selama 5 menit, 15 μL masing-masing sampel dimuat ke dalam gel. Elektroforesis dilakukan menggunakan sistem Bio-Rad (Richmond, CA, AS). Gel kemudian diwarnai dengan Coomassie Brilliant Blue R-250 selama 20 menit dan dihilangkan pewarnaannya dengan air suling hingga pita protein bening terlihat.
2.9 Kandungan Kelompok Sulfhidril Bebas dan Ikatan Disulfida
Kandungan sulfhidril bebas dalam protein gluten gandum diukur dengan melarutkan 30 mg protein dalam 10 mL buffer Tris-Gly, menambahkan 50 μL reagen Ellman, dan menginkubasi selama 1 jam pada suhu 25°C dalam gelap. Absorbansi pada 412 nm diukur setelah sentrifugasi (6000 × g , 15 menit).
Untuk kandungan sulfhidril total, 15 mg protein yang larut dalam alkohol dilarutkan dalam 10 mL buffer Tris-Gly dengan 100 μL β-Mercaptoethanol, diinkubasi selama 1 jam dalam gelap, dan disentrifugasi (8000 × g , 10 menit). Endapan dicuci dengan 12% TCA, disuspensikan kembali, diperlakukan dengan reagen Ellman, dan absorbansi diukur pada 412 nm (Jiang et al. 2021 ). Kandungan sulfhidril dihitung menggunakan Persamaan ( 2 ).
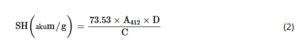
di mana A412 menyatakan absorbansi pada 412 nm, C merupakan konsentrasi protein (mg/mL), dan D menyatakan faktor pengenceran.
Kandungan S–S dihitung menggunakan Persamaan ( 3 ).
![]()
2.10 Penentuan Struktur Sekunder
Untuk menganalisis sifat permukaan gluten gandum, 6 mg gluten beku-kering dicampur dengan KBr (tingkat spektral) pada rasio 1:100. Campuran ini digiling secara menyeluruh menggunakan mortar onyx dan ditekan menjadi serpihan tembus cahaya menggunakan cetakan (Hossain Brishti et al. 2021 ). Analisis FTIR dilakukan menggunakan spektrometer inframerah Fourier pada spektrum 4000–400 cm −1 dengan rentang spektrum 4000–400 cm −1 , resolusi 4 cm − ¹, dan 64 pemindaian.
2.11 Analisis Statistik
Data disajikan dalam bentuk mean ± simpangan baku dan dianalisis menggunakan ANOVA diikuti dengan uji perbandingan berganda Duncan ( p < 0,05) dengan SPSS Statistics 19. Klasifikasi dan analisis data dilakukan menggunakan pengelompokan hierarkis dan analisis komponen utama (PCA) dengan Origin 2021. Percobaan dilakukan dalam rangkap tiga demi keandalan, kecuali untuk analisis sensorik dan tekstur mi, yang rincian replikasinya telah disebutkan sebelumnya.
3 Hasil dan Pembahasan
3.1 Sifat Tekstur Mie
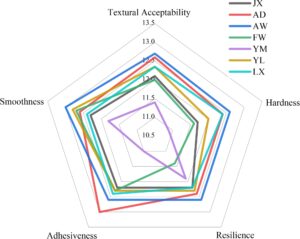
Elastisitas dan kekencangan yang dirasakan dalam evaluasi sensoris sesuai dengan pengukuran yang diperoleh dari penganalisa tekstur (Kurotobi et al. 2018 ; Paula dan Conti-Silva 2014 ). Seperti yang ditunjukkan pada Gambar 1 , penerimaan tekstur mi diklasifikasikan menjadi empat tingkatan berdasarkan skor evaluasi sensoris: AD dan AW adalah yang paling enak (≥ 12,50); YL, LX, dan JX enak (12,00–12,49); FW rata-rata (11,50–11,99); dan YM tidak enak (< 11,50).
Uji TPA terutama mensimulasikan deformasi fisik makanan yang terjadi di mulut atau selama menelan (Li et al. 2017 ), dan parameter utama yang diukur meliputi kekerasan, daya rekat, kekenyalan, kekenyalan, dan ketahanan (Yao et al. 2020 ). Tabel 2 menyajikan sifat tekstur mi, dan perbedaan signifikan ( p < 0,05) diamati di semua atribut yang diukur. Secara khusus, dua varietas dengan nilai terendah (setara dengan persentil ke-25) dan dua dengan nilai tertinggi (setara dengan persentil ke-75) masing-masing diklasifikasikan sebagai kelompok rendah dan tinggi, sedangkan tiga sisanya membentuk kelompok sedang. Klasifikasi ini memastikan ukuran kelompok yang seimbang dan konsisten dengan hasil evaluasi sensoris. Kekerasan spesimen mi mengikuti urutan ini: YM > FW > AW > JX > AD > LX > YL. Di antara mereka, spesimen AD menunjukkan daya rekat sedang (27,493 g.sec) dan ketahanan (0,815). Meskipun AD dan AW menunjukkan kualitas sensoris yang unggul, AW memiliki gaya tarik yang lebih rendah (10,37 g), sehingga lebih rentan pecah dan menghasilkan kekuatan mi yang lebih rendah dibandingkan dengan AD. Dalam analisis komprehensif, AD memiliki penerimaan tekstur yang baik dan karakteristik profil tekstur terbaik, dengan elastisitas, keuletan, kekerasan sedang, daya rekat, kekenyalan, kekenyalan, dan ketahanan yang unggul.
| Varietas | HD/g | AD/g.detik | Bahasa Inggris | C6H5/gram | ULANG | TS/g | Ukuran TTD/mm |
|---|---|---|---|---|---|---|---|
| JX | 408.807 ± 30,68 detik | 27.610 ± 7,41 SM | 0,870 ± 0,01 ab | 285.841 ± 17,38 detik | 0,714 ± 0,02c | 13,43 ± 0,79 miliar | 48,67 ± 2,44 miliar |
| YL | 217.119 ± 18,75 hari | 24.271 ± 5,91 SM | 0,817 ± 0,02 ab | 149.132 ± 9,93 hari | 1,003 ± 0,08 satu | 9,96 ± 0,07 e | 36,21 ± 1,79 detik |
| YM | 518.398 ± 16,28 jam | 35.502 ± 2,81 miliar | 0,811 ± 0,06b | 364.992 ± 15,19 tahun | 0,795 ± 0,02 SM | 12,79 ± 0,42 SM | 29,93 ± 3,28 hari |
| Bahasa Indonesia: LX | 360.454 ± 35.35 detik | 18.834 ± 4,19 detik | 0,875 ± 0,01 satu | 261.551 ± 18,03 detik | 0,845 ± 0,00 b | 10,95 ± 0,05 hari | 27,11 ± 1,25 detik |
| IKLAN | 376.425 ± 2,46 detik | 27.493 ± 2,53 SM | 0,857 ± 0,00 ab | 267.134 ± 0,34 detik | 0,815 ± 0,01b | 14,58 ± 0,08 satu | 67,55 ± 1,25 per menit |
| AW | 411.715 ± 1,93 detik | 49.092 ± 9,19 tahun | 0,833 ± 0,00 ab | 273.429 ± 11,21 detik | 0,870 ± 0,04 b | 10,37 ± 0,48 detik | 22,68 ± 0,81 hari |
| FW | 465.316 ± 18,22 miliar | 33.485 ± 3,16 miliar | 0,856 ± 0,00 ab | 323.496 ± 11,11 miliar | 0,805 ± 0,01b | 12,03 ± 0,26 detik | 36,20 ± 1,36 detik |
Catatan: Semua data menunjukkan rata-rata ± simpangan baku, n = 3. Rata-rata ± simpangan baku (SD), superskrip menunjukkan perbedaan signifikan menggunakan p < 0,05. Singkatan: AD, Daya Rekat; AD, Gandum Durum Australia; AW, Gandum Putih Australia; CH, Kekenyalan; FW, Gandum Prancis; HD, Kekerasan; JX, Jiaxi Chunmai; LX, Xinpu Lokal; RE, Ketahanan; SP, Kelenturan; TD, jarak tarik; TS, Kekuatan tarik; YL, Yongliang No. 4; YM, Youmai 02-1.
3.2 Karakterisasi Sifat Fisikokimia
3.2.1 Sifat Termal
Differential Scanning Calorimetry (DSC) adalah teknik yang banyak digunakan untuk menilai stabilitas termal, perilaku memasak, dan karakteristik termal protein, termasuk gluten gandum (Liu et al. 2023 ). Stabilitas termal gluten terkait erat dengan gaya tarik mi, dengan gaya yang lebih tinggi menunjukkan jaringan gluten yang lebih seragam, padat, dan kuat. Tabel 3 merangkum sifat termal protein gluten gandum. YM menunjukkan suhu awal tertinggi ( T ₀ ) pada 50,89 °C, diikuti oleh JX (49,73 °C) dan AD (49,34 °C), yang mencerminkan ketahanan yang lebih besar terhadap denaturasi termal. Sebaliknya, AW menunjukkan T ₀ terendah (39,95 °C), yang menunjukkan bahwa jaringan glutennya lebih rentan terhadap gangguan termal. Lebih jauh lagi, suhu transisi ( T d ) dan perubahan entalpi ( ΔH ) dari YM (59,23°C, 1,88 J/g) dan AD (58,18°C, 1,94 J/g) juga merupakan yang tertinggi, memperkuat stabilitas termal yang lebih unggul dibandingkan dengan AW (54,97°C, 1,32 J/g), yang menunjukkan nilai terendah. Temuan-temuan ini menunjukkan bahwa struktur glutenin dalam AD menunjukkan stabilitas termal yang lebih besar daripada yang ada di AW, membuatnya kurang rentan terhadap gangguan struktural selama pemrosesan mi dan dengan demikian meningkatkan retensi bentuk yang lebih baik. Interpretasi mekanistik ini sejalan dengan kerangka kerja yang diusulkan Zhang (Zhang et al. 2025 ), di mana stabilitas termal yang lebih rendah (seperti yang terlihat di AW) menyebabkan pecahnya jaringan gluten sebelum waktunya, sehingga mengakibatkan gangguan struktural dan akhirnya mengganggu retensi bentuk.
| Varietas | Sifat termal | Kandungan ikatan sulfhidril dan disulfida | Struktur kedua | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Suhu 0 /°C | Td /° C | △ H /J/g | SH F /(μmol/g) | Jumlah mol SH T /(μmol/g) | SS/(μmol/gram) | Lembar β/% | Kumparan acak/% | α-Heliks/% | β-Putar/% | |
| JX | 49,73 ± 0,26 miliar | 57,72 ± 0,13 miliar | 1,84 ± 0,01 miliar | 0,98 ± 0,05 kDa | 86,82 ± 1,61 miliar | 42,92 ± 0,81 miliar | 36,80 ± 0,26 per menit | 22,23 ± 0,45 detik | 23,57 ± 0,31 SM | 17,4 ± 0,36 satuan |
| YL | 48,82 ± 0,41 detik | 57,05 ± 1,32 SM | 1,60 ± 0,03 detik | 1,17 ± 0,08 pon | 84,65 ± 1,67 miliar | 41,74 ± 0,87 miliar | 34,60 ± 0,53 detik | 22,63 ± 0,35 detik | 24,83 ± 0,58 per menit | 17,93 ± 0,38 per menit |
| YM | 50,89 ± 0,52 per menit | 59,23 ± 0,39 per menit | 1,88 ± 0,01 pon | 0,90 ± 0,07 hari | 85,40 ± 0,95 miliar | 42,25 ± 0,48 miliar | 36,93 ± 0,51 satuan | 23,73 ± 0,51 inci | 21,27 ± 0,51 hari | 18,07 ± 0,51 satuan |
| Bahasa Indonesia: LX | 47,95 ± 0,58 hari | 56,33 ± 0,43 detik | 1,40 ± 0,05 hari | 0,90 ± 0,09 hari | 80,85 ± 1,25 detik | 39,97 ± 0,59 detik | 36,77 ± 0,25 per menit | 23,03 ± 0,67 SM | 22,33 ± 0,42 hari | 17,87 ± 0,91 per menit |
| IKLAN | 49,34 ± 0,40 SM | 58,18 ± 0,78 inci | 1,94 ± 0,08 satuan | 1,08 ± 0,04 SM | 81,25 ± 1,70 detik | 40,09 ± 0,83 detik | 35,37 ± 0,55 miliar | 23,70 ± 0,56 inci | 22,90 ± 0,26 kDa | 18,03 ± 0,47 per menit |
| AW | 39,95 ± 0,50 derajat Fahrenheit | 54,97 ± 0,61 hari | 1,32 ± 0,04 e | 1,05 ± 0,04 detik | 93,75 ± 0,80 per menit | 46,35 ± 0,42 jam | 35,53 ± 0,32 miliar | 23,93 ± 0,38 inci | 22,77 ± 0,68 kDa | 17,77 ± 0,42 jam |
| FW | 46,24 ± 0,29 hari | 56,17 ± 0,75 cd | 1,37 ± 0,01 detik | 1,24 ± 0,04 satuan | 92,76 ± 1,68 jam | 45,76 ± 0,86 per menit | 33,53 ± 0,31 hari | 24,37 ± 0,55 satu | 23,73 ± 0,12 miliar | 18,37 ± 0,84 per menit |
Catatan: Semua data menunjukkan rata-rata ± simpangan baku, n = 3. Rata-rata ± simpangan baku (SD), superskrip menunjukkan perbedaan signifikan menggunakan p < 0,05. Singkatan: AD, Gandum Durum Australia; AW, Gandum Putih Australia; FW, Gandum Prancis; JX, Jiaxi Chunmai; LX, Xinpu Lokal; YL, Yongliang No. 4; YM, Youmai 02-1.
3.2.2 Kapasitas Penampungan Air
Kapasitas menahan air (WHC) mengacu pada kemampuan protein untuk menahan air di bawah gaya gravitasi, memberikan wawasan tentang interaksi protein-air yang memengaruhi sifat fungsionalnya (Zhang et al. 2021 ). Kapasitas menahan air dari protein gluten gandum ditunjukkan pada Gambar 2 . Secara umum, AD memiliki kapasitas menahan air sedang (3,03 g/g), YM memiliki kapasitas yang relatif rendah (2,82 g/g), dan AW memiliki kapasitas lebih besar (3,58 g/g). Interaksi protein-air memengaruhi distribusi air mi dan dengan demikian sifat teksturnya (Ding et al. 2024 ; Wang et al. 2023 ). Dalam penelitian kami, kapasitas menahan air sedang (sekitar 3,03 g/g) menunjukkan keseimbangan optimal di mana protein gluten menyerap air yang cukup untuk membentuk jaringan yang seragam dan stabil, namun menghindari hidrasi berlebihan yang dapat menyebabkan lengket berlebihan dan tekstur mi yang terganggu (Xiao et al. 2021 ). Berdasarkan analisis korelasi (Gambar 5 ), protein gluten dengan kapasitas menahan air sedang akan mengikat air secara seragam dan kuat sehingga menghasilkan tekstur mie yang halus, sedangkan kapasitas menahan air yang berlebihan akan menyebabkan mie menjadi terlalu lengket.

3.2.3 Kelarutan Protein
Kelarutan gluten bersifat hidrofilik dan dapat diemulsikan, membantu dispersinya yang seragam dalam air (Grossmann dan McClements 2023 ; Xu et al. 2024 ). Hasil pada Gambar 2 menunjukkan bahwa AW dan YL menunjukkan kelarutan protein gluten tertinggi, keduanya mencapai 0,38 mg/mL, sedangkan AD sedang (0,3 mg/mL) dan YM memiliki kelarutan terendah (0,24 mg/mL). Sejalan dengan temuan ini, mi yang terbuat dari AW dan YL juga menunjukkan kekuatan tarik terendah. Menurut analisis korelasi (Gambar 5 ), molekul protein dengan kelarutan lebih rendah lebih mungkin untuk beragregasi dan membentuk jaringan gluten yang rapat, yang meningkatkan kekuatan tarik mi. Setelah protein terlarut dalam air, proses pembentukan jaringan selanjutnya memerlukan reagregasi melalui interaksi hidrofobik dan ikatan disulfida (Zhang et al. 2022 , 2024 ).
3.2.4 Hidrofobisitas Permukaan
Probe fluoresensi ANS digunakan untuk menilai hidrofobisitas permukaan protein, yang menunjukkan distribusi dan kuantitas daerah hidrofobik pada permukaan gluten (Yao et al. 2020 ; Zhang et al. 2010 ). Peningkatan rasio hidrofilisitas terhadap hidrofobisitas meningkatkan pembentukan gel dan memperbaiki kekerasan, kekompakan, dan kekenyalan gel protein (Shao et al. 2025). Seperti yang ditunjukkan pada Gambar 2 , AD memiliki hidrofobisitas sedang (451171), sedangkan FW (40807), dan YM (601949) masing-masing memiliki tingkat rendah dan tinggi. Hidrofobisitas permukaan yang optimal menyeimbangkan interaksi hidrofobik dan hidrofilik, memfasilitasi jaringan protein yang stabil namun fleksibel. Hal ini meningkatkan interaksi protein-protein dan pembentukan gel, meningkatkan kekerasan dan elastisitas mi sekaligus mencegah hidrofobisitas berlebihan yang mengganggu pengikatan air dan meningkatkan daya rekat (Iwaki et al. 2021 ). Menariknya, sifat hidrofobisitas yang tinggi dan struktur protein yang sangat padat dari YM (Lambrecht et al. 2018 ) berkontribusi terhadap kekerasan dan kekenyalan mie yang nyata, yang pada akhirnya membuatnya kurang enak. Ini menyiratkan bahwa sifat hidrofobisitas permukaan yang optimal meningkatkan rasa dan tekstur mie. Meskipun kandungan dan karakteristik protein gluten dapat menjelaskan perbedaan dalam kualitas mie, alasan perbedaan dalam karakteristik protein adalah struktur protein, dan untuk menggali alasan perbedaan tersebut. Oleh karena itu, pada bagian berikut, kami selanjutnya melakukan karakterisasi struktural gluten, untuk mendapatkan wawasan yang lebih dalam tentang dampaknya terhadap sifat-sifat.
3.3 Sifat Struktural Gluten
3.3.1 Analisis SDS-PAGE
Glutenin dan gliadin adalah protein utama yang membentuk gluten gandum. Subunit gluten dengan berat molekul tinggi (HMW-GS) (80~140 kDa) dan subunit gluten dengan berat molekul rendah (LMW-GS) (10~70 kDa) adalah dua komponen gluten. Gliadin memiliki berat molekul berkisar antara 25 hingga 100 kDa dan diklasifikasikan menjadi α, β, γ, dan ω-gliadin berdasarkan mobilitas elektroforesis dan data genetik (Nadeem et al. 2016 ). Hanya ω-gliadin (40~75 kDa) yang berinteraksi dengan adonan melalui ikatan hidrogen, karena tidak memiliki residu sistein dan tidak dapat membentuk ikatan disulfida. Profil SDS-PAGE glutenin dan gliadin disajikan pada Gambar 3 . Struktur domain berulang yang unik dari HMW-GS memfasilitasi pembentukan struktur β-sheet yang diperluas melalui ikatan hidrogen antar rantai, yang memberikan sifat elastisitas pada jaringan gluten selama deformasi adonan (Yang et al. 2025 ). Kandungan asam glutamat yang tinggi dalam HMW-GS mendorong pembentukan ikatan hidrogen intramolekul dan intermolekul, meningkatkan kekuatan gluten dan, sebagai hasilnya, memperbaiki viskoelastisitas mi (Dizlek dan Awika 2023 ). Tidak adanya pita dalam kisaran 75–100 kDa dalam plot YL menunjukkan ekspresi protein yang tidak mencukupi, yang sesuai dengan kekenyalan, kekerasan, dan kekuatan tarik mi YL yang lebih rendah. AW mengandung protein ω-gliadin tingkat yang lebih tinggi, sejalan dengan temuan Cho et al. ( 2018 ). AD memiliki kandungan HMW-GS yang lebih tinggi dan lebih banyak α, β, dan γ-gliadin yang mampu membentuk ikatan disulfida, yang kondusif untuk meningkatkan tekstur mie (Li et al. 2024 ).
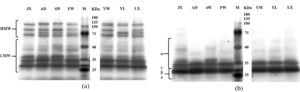
3.3.2 Kandungan Ikatan Sulfhidril dan Disulfida
Kelompok sulfhidril adalah gugus fungsi dalam asam amino yang mengandung sulfur (misalnya, sisteina), dan dua gugus sulfhidril dalam protein dapat membentuk ikatan disulfida melalui oksidasi. Secara umum, jumlah dan distribusi gugus sulfhidril secara langsung memengaruhi struktur spasial protein dan interaksinya dengan air (Lagrain et al. 2008 ). Seperti yang ditunjukkan dalam Tabel 3 , AW dan FW memiliki kandungan ikatan disulfida terbesar (masing-masing 46,35 dan 45,76 μmol/g) dan total sulfhidril (masing-masing 93,75 dan 92,76 μmol/g), sementara FW memiliki kandungan sulfhidril bebas tertinggi (1,24 μmol/g). Kadar sulfhidril bebas yang lebih tinggi dalam gluten meningkatkan kemampuannya untuk menahan air (Zhang et al. 2023 ). AW memiliki kandungan sulfhidril bebas yang lebih tinggi dan menghasilkan mi dengan daya rekat yang lebih tinggi. FW dan AW memiliki kandungan ikatan disulfida yang lebih tinggi, dan ini memperkuat interaksi antara molekul protein. Hal ini menjelaskan mengapa mi yang dibuat dengan YL memiliki kekenyalan yang lebih rendah meskipun mengandung gluten yang lebih tinggi. Menariknya, meskipun FW memiliki kandungan ikatan disulfida yang tinggi, mi yang dihasilkan memiliki kekuatan tarik yang rendah, yang disebabkan oleh interaksi hidrofobik FW yang rendah (40807).
3.3.3 Struktur Kedua
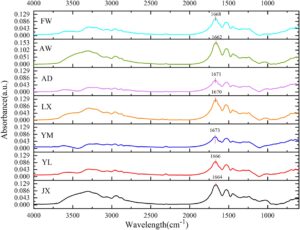
Pita amida I dalam spektrum inframerah transformasi Fourier (FTIR), biasanya dalam kisaran 1600–1700 cm −1 , dapat digunakan untuk mengkarakterisasi perubahan dalam struktur sekunder protein (Wang et al. 2021 ). Struktur sekunder protein gluten mencakup β-sheets (1600–1640 cm −1 ), random coils (1640–1650 cm −1 ), α-helices (1650–1660 cm −1 ), dan β-turns (1660–1700 cm −1 ). Di antara ini, β-sheets dianggap sebagai konformasi protein yang paling stabil, jaringan ikatan hidrogen yang luas, dan susunan untai antiparalel/paralel, yang membentuk domain kaku dan teratur yang penting untuk kekakuan matriks gluten dan elastisitas adonan (Cai et al. 2023 ). Spektrum FTIR ditunjukkan pada Gambar 4 , dan kandungan struktur sekunder yang terperinci dirangkum dalam Tabel 3. Diamati bahwa varietas gandum FW (33,53%) dan YL (34,6%) menunjukkan kandungan β-sheet yang lebih rendah. Dengan demikian, pita HMW-GS dari FW relatif dangkal, dan YL tidak memiliki HMW-GS tertentu. Temuan ini menunjukkan bahwa kandungan gluten secara signifikan memengaruhi keteraturan struktur sekunder, konsisten dengan hasil yang dilaporkan oleh Wang et al. ( 2023 ). Struktur α-helix dicirikan sebagai lunak dan dapat diregangkan, memungkinkannya untuk mengakomodasi deformasi dan tegangan (Li et al. 2024 ). Hasil menunjukkan bahwa varietas AD memiliki kandungan β-sheet sedang pada 35,37% dan kandungan α-helix pada 22,90% secara sinergis mengoptimalkan fungsionalitas gluten: β-sheet berkontribusi pada integritas dan elastisitas struktural, sementara α-helix meningkatkan ekstensibilitas adonan selama pemrosesan. Keseimbangan tersebut meminimalkan pencucian pati selama perebusan dan memastikan kekenyalan yang diinginkan pada produk akhir (Lambrecht et al. 2018 ).
3.4 Analisis Korelasi, Komponen Utama, dan Cluster
Bagian ini bertujuan untuk menjelaskan korelasi antara sifat protein, struktur, dan kualitas tekstur mie dengan cara yang lebih spesifik dan kuantitatif. Seperti yang ditunjukkan pada Gambar 5 , sifat fisikokimia gluten menunjukkan korelasi signifikan dengan tekstur mie. Suhu transisi ( T d ) gluten menunjukkan korelasi positif dengan kekuatan tarik ( r = 0,67) dan jarak tarik ( r = 0,49) mie. Lebih jauh lagi, perubahan entalpi ( ΔH ) menunjukkan korelasi positif yang kuat dengan kekuatan tarik ( r = 0,78) dan jarak tarik ( r = 0,71) Sebaliknya, kelarutan gluten berkorelasi negatif dengan kekerasan mie ( r = −0,71), kekenyalan ( r = −0,76), dan gaya tarik ( r = −0,68). Korelasi ini menunjukkan bahwa stabilitas termal yang lebih tinggi (tercermin dari peningkatan T d dan ΔH ) mendorong pembentukan jaringan gluten yang kuat yang meningkatkan sifat tarik, sementara kelarutan yang lebih tinggi menunjukkan keadaan protein yang kurang teragregasi, sehingga menghasilkan jaringan yang lebih lemah. Oleh karena itu, kekerasan, kekenyalan, dan kekenyalan mi dipengaruhi oleh kekuatan gluten, yang dimodulasi oleh stabilitas termal dan kelarutannya (Kovacs et al. 2004 ; Lambrecht et al. 2017 ).
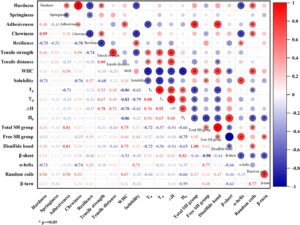
Selain itu, kapasitas retensi air gluten berkorelasi positif dengan daya rekat mi ( r = 0,58), yang menunjukkan bahwa retensi air sedang (3,03 g/g) menghasilkan mi dengan daya rekat seimbang dan tekstur halus. Struktur sekunder gluten secara signifikan memengaruhi sifat fisikokimia dan, akibatnya, tekstur mi. Secara khusus, kandungan β-sheet berkorelasi terbalik dengan retensi air ( r = −0,53), yang menunjukkan bahwa β-sheet menghalangi interaksi air-protein dan merusak penyerapan air, sehingga mengurangi kehalusan mi (Zhang et al. 2017 ). Sebaliknya, kandungan α-helix berkorelasi negatif dengan kekerasan mi ( r = −0,71) dan kekenyalan mi ( r = −0,74) tetapi positif dengan kelarutan ( r = 0,71). Meskipun peningkatan struktur α-helix meningkatkan kelarutan, konfigurasinya yang lebih lembut dan longgar mengurangi integritas struktural dalam mi.
Sifat struktural gluten secara signifikan memengaruhi sifat fisikokimia dan, akibatnya, atribut tekstur mi. Korelasi negatif antara kandungan β-sheet dan retensi air ( r = −0,53) menunjukkan bahwa kadar β-sheet yang lebih tinggi menghambat interaksi air–protein, sehingga mengurangi penyerapan air dan mengorbankan kehalusan mi. Sebaliknya, kandungan α-helix menunjukkan korelasi negatif dengan kekerasan mi ( r = −0,71) dan kekenyalan mi ( r = −0,74), tetapi korelasi positif dengan kelarutan ( r = 0,71). Ini menunjukkan bahwa sementara peningkatan kandungan α-helix meningkatkan kelarutan, konfigurasinya yang lebih lembut dan longgar mengurangi kekakuan yang diperlukan untuk jaringan mi yang kuat (Zhang et al. 2023 ).
Kandungan sulfhidril total bebas dari gluten berkorelasi positif dengan kapasitas menahan air ( r = 0,4475) dan daya rekat mi ( r = 0,81). Sebagai gugus hidrofilik, sulfhidril membentuk ikatan hidrogen dengan air, sehingga meningkatkan kapasitas menahan air dan memengaruhi daya rekat (Mune Mune et al. 2018 ). Selain itu, hidrofobisitas permukaan gluten menunjukkan korelasi positif dengan suhu transisi ( T d ) ( r = 0,65) dan perubahan entalpi (ΔH) ( r = 0,68), tetapi korelasi negatif yang kuat dengan kapasitas menahan air ( r = −0,86). Peningkatan hidrofobisitas mengintensifkan interaksi di antara molekul gluten, yang mengarah ke nilai T d dan Δ H yang lebih tinggi dan stabilitas termal yang lebih baik. Namun, hidrofobisitas yang berlebihan menghambat pembentukan ikatan hidrogen dengan air, sehingga mengurangi kapasitas menahan air dan mengurangi daya rekat mi (Ma et al. 2019 ).
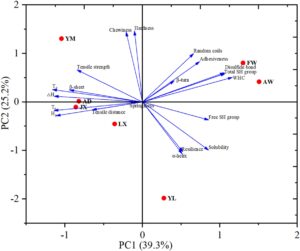
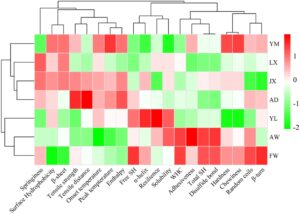
Gambar 6 menyajikan analisis komponen utama (PCA) dari sifat gluten gandum tentang karakteristik tekstur mi. Dua komponen utama pertama menjelaskan 64,5% dari total varians (PC1: 39,3%; PC2: 25,2%) (Zhang et al. 2023 ). PC1 terutama menangkap dinamika hidrasi gluten dan stabilitas struktural, yang sangat terkait dengan kapasitas menahan air (WHC), kandungan ikatan disulfida, total gugus sulfhidril, dan daya rekat. PC2 berkorelasi dengan atribut tekstur, terutama kekerasan dan kekenyalan. PCA secara efektif membedakan tujuh varietas gandum berdasarkan sifat gluten yang berbeda, yang mencerminkan variasi signifikan dalam perilaku hidrasi, stabilitas termal, dan struktur sekunder protein (Pestorić et al. 2019 ). Khususnya, AD dan JX menunjukkan profil gluten yang sebanding, meskipun AD menunjukkan ketahanan mi yang lebih unggul, yang mungkin disebabkan oleh peningkatan WHC dan suhu denaturasi termal ( T d ) (Li et al. 2024 ). Analisis pengelompokan hierarkis komplementer (Gambar 7 ) memisahkan varietas menjadi dua kelompok fungsional: AD dan JX membentuk kelompok kohesif dengan struktur gluten yang analog, sementara AW dan FW mengelompok secara terpisah, ditandai dengan daya rekat yang tinggi dan kekuatan tarik yang berkurang. Temuan-temuan ini secara kolektif menunjukkan hubungan struktur-fungsi yang kuat antara sifat makromolekul gluten dan atribut kualitas mi.