
Abstrak
Oksidasi dalam tepung ikan (FM) dapat menghasilkan panas yang cukup untuk memicu pembakaran, sehingga penting untuk menilai risiko penyalaan sendiri sebelum transportasi untuk mencegah kebakaran. Ethoxyquin, yang umumnya digunakan untuk mengurangi risiko ini, telah dilarang di beberapa pasar karena genotoksisitasnya, yang mendorong pencarian antioksidan alternatif. Metode tradisional untuk mengevaluasi risiko ini, uji SW-846 1050, mahal dan memakan waktu. Kami menggunakan metode OXITEST yang lebih sederhana dan lebih murah untuk menilai stabilitas oksidatif FM dengan membandingkan konsumsi oksigen dalam FM dengan dan tanpa antioksidan. FM segar tanpa antioksidan digunakan, yang disimpan pada suhu −30°C selama 6 bulan. FM mengandung 7,2% air, 18,8% abu, 64,3% protein, dan 9,7% lemak kasar; dari lipid, 75% bersifat netral, dan 25% adalah fosfolipid. Profil asam lemak dari lipid menunjukkan kadar EPA dan DHA yang tinggi, dengan rasio DHA/EPA lebih besar dari 1, yang membuat FM lebih rentan terhadap oksidasi dibandingkan dengan minyak ikan teri. Hasil awal menunjukkan konsumsi oksigen dalam sampel FM, meskipun titik infleksi (IP) tidak terdeteksi. Pada langkah kedua, setelah mengoptimalkan volume sampel (50 g), suhu (80°C), dan waktu (4 jam), konsumsi oksigen dievaluasi oleh OXITEST dalam sampel FM dengan peningkatan konsentrasi etoksikuin, yang menunjukkan korelasi terbalik antara konsentrasi etoksikuin dan konsumsi oksigen (linier Pearson). Akhirnya, kami mengevaluasi sampel FM dengan berbagai antioksidan komersial dan membandingkan area di bawah kurva untuk tekanan oksigen versus waktu menggunakan FM sendiri sebagai kontrol negatif dan FM dengan 750 ppm etoksikuin sebagai kontrol positif. Pengukuran OXITEST menunjukkan perbedaan dalam laju kehilangan tekanan oksigen di antara agen yang dipelajari, yang menawarkan ukuran komparatif efisiensi antioksidan. Metode OXITEST dapat digunakan sebagai metode yang cepat dan hemat biaya untuk mengevaluasi stabilitas oksidatif dan efektivitas antioksidan dalam FM.
1. Pendahuluan
Saat ini, produksi tepung ikan (FM) global mencapai sekitar 5 juta ton, dengan Peru sebagai pemasok utama, yang menyumbang 20% dari produksi dunia. Sumber utamanya berasal dari ikan teri Peru atau “anchoveta” ( Engraulis ringens ). Antara tahun 2010 dan 2022, produksi tahunannya mencapai rata-rata 1,02 juta ton ( https://www.indexmundi.com/agriculture/ ).
Kontrol industri penangkapan ikan teri untuk FM dan produksi minyak ikan (FO) disinkronkan dengan periode pemijahan. Ini beroperasi selama dua musim penangkapan per tahun, mendahului puncak pemijahan, di mana peningkatan kandungan lemak kasar diamati di seluruh spesimen [ 1 ]. FM dan FO diperoleh secara industri dengan menekan massa basah ikan yang dimasak [ 2 ]. Produk yang dihasilkan dikeringkan dan digiling untuk produksi FM, sementara cairan pengepresan disentrifugasi untuk memisahkan minyak. Minyak ini berasal dari akumulasi lemak subkutan dan terutama terdiri dari lipid netral (trigliserida [TG]) [ 3 ]. FM ikan teri biasanya mengandung 8%–10% lemak kasar, yang ditandai dengan kandungan tinggi asam lemak tak jenuh ganda omega-3 ( Ω -3 PUFA), terutama asam eikosapentaenoat (EPA, C20:5 Ω -3) dan asam dokosaheksaenoat (DHA, C22:6 Ω -3) [ 4 ]. Selama produksi FM, PUFA Ω -3 ini mengalami proses oksidatif di seluruh tahapan seperti pemasakan, pengeringan, dan penggilingan [ 5 ]. PUFA yang ada dalam produk akhir tetap sangat rentan terhadap oksidasi lebih lanjut, yang menyebabkan pelepasan panas dan meningkatkan risiko pembakaran sendiri dan penyalaan. Oleh karena itu, praktik manajemen yang efektif sangat penting untuk meminimalkan risiko penyalaan selama transportasi, terutama mengingat waktu penyimpanan yang lama di ruang kargo kapal dalam rantai pasokan [ 6 ].
Industri FM mengatasi masalah ini dengan menggabungkan antioksidan, menghambat rantai reaksi oksidatif eksotermik. Antioksidan ini meliputi etoksikuin, butilat hidroksitoluena (BHT), butilat hidroksianisol (BHA), dan tokoferol tertentu. Etoksikuin terbukti menjadi yang paling efisien dan berfungsi sebagai standar terhadap efek stabilisasi antioksidan lain yang diukur [ 7 – 9 ]. Setelah proses pembuatan, penambahannya menandai kemajuan signifikan bagi industri FM, menghasilkan produk dengan reaksi eksotermik yang diatur sambil mempertahankan nilai gizinya ( https://www.iffo.com/antioxidants-and-fishmeal ). Akibatnya, FM yang diperkaya dengan antioksidan dimasukkan dalam Kode Barang Berbahaya Maritim Internasional (IMDG), yang mengizinkan persyaratan penyimpanan dan ventilasi yang lebih longgar selama transportasi laut. Itu dikategorikan sebagai zat berbahaya, Kelas 9: PBB No. 2216 sebagaimana telah diubah 24-86 [ 10 ].
Saat antioksidan dalam FM melakukan fungsinya, antioksidan tersebut akan berkurang, yang menggarisbawahi pentingnya kuantifikasinya. Pada tahun 1950-an, Organisasi Tepung Ikan dan Minyak Ikan Internasional (IFFO) menetapkan konsentrasi residu etoksikuin, menetapkan kadar yang direkomendasikan di atas ambang batas yang diperlukan untuk mencegah pembakaran sendiri, yang masih diterima oleh beberapa negara Asia. Namun, sejak tahun 2019, Uni Eropa telah melarang penggunaan etoksikuin karena potensi genotoksisitasnya [ 11 , 12 ] dan deteksi peningkatan kadar residu etoksikuin pada hewan yang diberi FM tersebut [ 13 , 14 ]. Akibatnya, upaya sedang dilakukan untuk mengidentifikasi antioksidan alternatif yang mampu mencegah pembakaran sendiri [ 15 ].
Penilaian pembakaran sendiri FM biasanya melibatkan berbagai metodologi, dengan [ 16 ] “Uji C: Limbah pemanasan sendiri,” menjadi yang paling sering digunakan. Namun, metode ini memerlukan peralatan khusus dan waktu pelaksanaan yang lama, sehingga tidak praktis untuk sejumlah besar penelitian tentang antioksidan FM baru. Oleh karena itu, ada kebutuhan untuk mengembangkan uji baru yang cepat dan hemat biaya, yang memungkinkan penyaringan untuk pemilihan antioksidan yang paling tepat untuk penilaian pembakaran sendiri berikutnya.
Ada uji oksidasi yang dipercepat, dengan Rancimat dan OXITEST menjadi metode yang paling umum digunakan untuk mengukur stabilitas oksidatif lemak makanan dalam jangka waktu yang singkat, semuanya tanpa memerlukan reagen yang mahal atau beracun [ 17 ]. Metode Rancimat (Metrohm, Swiss) menilai konduktivitas, yang meningkat karena konsentrasi zat volatil yang terlarut dalam air dari lemak yang teroksidasi pada suhu tinggi. Pendekatan ini memerlukan praperlakuan sampel untuk ekstraksi lemak atau minyak. Metode OXITEST (VELP Scientifica, Usmate [MI], Italia) bergantung pada perekaman tekanan oksigen saat sampel yang terpapar suhu tinggi dalam ruang tertutup mengonsumsi oksigen. Ini menghasilkan metode yang lebih cepat dan lebih ramah lingkungan [ 18 ] [ 19 ]. Peralatan OXITEST mengukur stabilitas oksidatif bahan mentah dan produk jadi tanpa memerlukan ekstraksi lemak sebelumnya, menghasilkan hasil yang memuaskan untuk mengevaluasi produk makanan [ 20 ] [ 21 ]. Respons peralatan adalah titik infleksi (IP), yang menunjukkan “waktu stabilitas” sebelum oksidasi lemak dan sesuai dengan penurunan tekanan O 2 karena konsumsinya oleh sampel.
Penelitian ini bertujuan untuk memanfaatkan peralatan OXITEST guna mengukur stabilitas oksidatif FM yang diolah dengan berbagai antioksidan, membandingkannya dengan FM yang mengandung etoksikuin (Kontrol+) dan dengan FM tanpa antioksidan. Hal ini dilakukan untuk menetapkan metode penyaringan yang memungkinkan pemilihan antioksidan yang paling tepat secara cepat dan hemat biaya untuk pencarian alternatif baru yang akan digunakan dalam FM.
2. Bahan dan Metode
2.1. Bahan Baku
Ikan teri FM yang baru diproduksi, tanpa tambahan antioksidan, dibagi ke dalam kantong polietilen sekitar 1 kg, disegel vakum, dan disimpan pada suhu -30°C hingga dianalisis. Selain itu, FO juga diambil sampelnya pada tanggal perkiraan. Bahan baku dipasok oleh Pesquera Diamante SAC
2.2. Uji Fisikokimia
Kadar air ditentukan dengan pengeringan oven pada suhu 101°C menggunakan oven Memmert UE 400 hingga berat konstan [ 22 ]. Kadar abu ditentukan dalam muffle furnace pada suhu 500°C (Barnstead/Thermolyne 48000) hingga berat konstan [ 23 ]. Protein kasar ditentukan dengan metode Kjeldahl menggunakan sistem Kjeldatherm/Turbosog/Vapodest (C. Gerhardt GmbH & Co. KG) dengan faktor konversi total nitrogen (TN) terhadap protein sebesar 6,25 [ 24 ]. Lemak kasar diperoleh dengan menggunakan heksana sebagai pelarut ekstraksi dengan peralatan Soxtherm (C. Gerhardt GmbH & Co. KG) [ 25 ].
Untuk menganalisis komposisi lipid, lipid diekstraksi dari FM segar (LT) menggunakan metodologi Bligh dan Dyer [ 26 ], memisahkan fraksi netral, kaya TG, dari fraksi polar, kaya fosfolipid (PL). Selain itu, total lipid diekstraksi dari FM teroksidasi (LTox). Fraksi TG dan PL diperoleh dengan mengaduk 2 g LT dalam 50 mL aseton selama 90 menit, diikuti dengan periode istirahat 16 jam pada suhu 4 °C [ 27 ]. Endapan yang dihasilkan sesuai dengan fraksi kaya lipid polar (PL), sedangkan fase terlarut mengandung lipid netral terutama, terutama TG.
Profil persentase asam lemak dari setiap fraksi, serta minyak ikan teri (FO) untuk tujuan perbandingan, ditentukan dengan kromatografi gas (GC). Untuk analisis ini, lipid dihidrolisis dengan 2 N NaOH dalam metanol dan selanjutnya diesterifikasi dalam media metanol 2 N HCl untuk memperoleh metil ester asam lemak (FAME), mengikuti metode yang dijelaskan oleh Kyriakidis dan Dionysopoulos [ 28 ]. FAME diidentifikasi dengan membandingkan waktu retensinya dengan campuran standar yang berasal dari laut menggunakan kromatografi gas PerkinElmer Autosystem XL GC System. Sistem ini dilengkapi dengan kolom SUPELCOWAX 10 (ID 30 m × 0,32 mm, ketebalan film 0,25 μ m) dan detektor ionisasi nyala. Kondisi injeksi diatur pada 250°C, dengan suhu detektor 270°C. Program suhu oven dimulai pada 170°C, ditingkatkan pada kecepatan 1°C/menit, dan mencapai suhu akhir 220°C. Semua analisis dilakukan secara duplikasi, dan hasilnya dinyatakan sebagai persentase (%) dari total asam lemak.
2.3. Persiapan Sampel untuk Evaluasi OXITEST
Setiap kantong FM ditempa pada suhu 25°C selama 2 jam, diletakkan di atas nampan, dan disemprot dengan antioksidan yang diencerkan dalam 30 mL etil eter. FM dicampur selama 25–30 menit menggunakan saringan dengan diameter mata jaring 1 mm untuk memastikan distribusi antioksidan yang homogen dan penguapan etil eter. Campuran ini kemudian diletakkan di dalam peralatan untuk evaluasi.
2.4. Analisis Stabilitas Oksidatif
Analisis dilakukan menggunakan OXITEST, yang terdiri dari dua ruang titanium yang dipanaskan dan disegel secara hermetis, yang masing-masing mampu menampung hingga tiga tempat sampel titanium. Alat ini dipasangkan dengan PC yang menjalankan perangkat lunak OXISoft untuk pemrosesan data (VELP Scientifica, Usmate, Italia). OXITEST mengukur penurunan tekanan dalam ruang oksidasi yang diakibatkan oleh konsumsi oksigen sampel, dengan responsnya berupa IP, yang diperkirakan secara grafis oleh OXISoft.
2.5. Tes Awal
Pengujian awal dilakukan untuk menetapkan kondisi kerja, termasuk kuantitas FM dan suhu. Manual peralatan menyarankan kuantitas sampel yang bervariasi berdasarkan kandungan PUFA yang ada sekaligus merekomendasikan suhu kerja tidak melebihi 90°C untuk menghindari gangguan dari autoksidasi lipid. Pengujian acak dilakukan dengan bobot dan suhu yang bervariasi, pada tekanan oksigen awal 6 bar, dipantau selama 12 jam. Semua tempat sampel digunakan di setiap ruang reaktor. Hasilnya mengungkap beberapa keanehan, yang mendorong ekstraksi data dari perangkat lunak untuk analisis, yang kemudian ditransfer ke lembar Excel.
Selain itu, pengujian dilakukan menggunakan minyak ikan teri segar (FO) dan makanan ikan teri yang dioksidasi dengan pemanasan pada suhu 90°C selama 12 jam (FM ox-12h ) untuk membandingkan dan memverifikasi respons OXITEST.
2.6. Evaluasi Ethoxyquin FM
Untuk mengevaluasi hubungan antara konsumsi oksigen (diukur berdasarkan tekanan) dan aktivitas antioksidan, etoksikuin ditambahkan ke FM pada konsentrasi 0, 50, 100, 350, dan 750 mg/kg. Sampel-sampel ini kemudian dianalisis menggunakan OXITEST. Konsentrasi etoksikuin 750 mg/kg, yang umum digunakan dalam produksi FM, berfungsi sebagai Kontrol+, sedangkan FM tanpa antioksidan hanya menerima 30 mL etil eter. Kondisi pengujian adalah 50 g sampel, 80°C selama 4 jam, dengan tekanan oksigen awal 6 bar.
2.7. Evaluasi FM Agen Antioksidan
Dua puluh antioksidan yang tersedia di pasar lokal dievaluasi, dilarutkan dalam 30 mL etil eter dalam jumlah yang direkomendasikan oleh lembar data mereka. Antioksidan, baik kimia maupun alami, termasuk BHT, BHA, sitrat, tokoferol, lesitin, propil galat, dan ekstrak rosemary, serta campuran dari semua ini. Respons setiap agen antioksidan yang dievaluasi dihitung dengan mengintegrasikan persamaan yang sesuai dengan setiap kurva yang dihasilkan dalam grafik tekanan versus waktu.
2.8. Statistik
Karakterisasi proksimat FM dan kandungan lipidnya, serta uji awal respons OXITEST dalam FO, dilakukan dalam rangkap dua. Pengukuran OXITEST berikutnya dilakukan dalam rangkap tiga. Untuk menilai korelasi antara konsentrasi etoksikuin dan konsumsi oksigen (diukur sebagai kehilangan tekanan), korelasi Pearson digunakan. Untuk studi korelasi, analisis komponen utama (PCA) dilakukan untuk menentukan hubungan timbal balik antara variabel respons (tekanan akhir, luas, dan efisiensi) dan berbagai antioksidan yang dievaluasi. Plot PCA dibuat menggunakan perangkat lunak statistik Statistica, Versi 12.
3. Hasil dan Pembahasan
3.1. Uji Fisikokimia
FM mengandung 7,2% air, 18,8% abu, 64,3% protein, dan 9,7% lemak kasar. Kandungan lipid yang diekstraksi menggunakan metode Bligh dan Dyer (LT) adalah 9,3%. Dalam LT, fraksi kaya PL mencapai 21,6%, dan fraksi kaya lipid netral (TG) mencapai 73,6%, yang merupakan nilai yang konsisten dengan yang dilaporkan dalam literatur [ 29 ]. Profil asam lemak FO dan LT menunjukkan persentase EPA dan DHA yang tinggi (Tabel 1 ), yang merupakan karakteristik ikan teri. Dalam FO, kandungan EPA lebih tinggi daripada DHA, sedangkan dalam lipid FM (LT), DHA mendominasi, khususnya dalam fraksi kaya PL (Gambar 1 ) [ 30 , 31 ].
| Asam lemak | FO | Bahasa Indonesia: SEBELUMNYA | Tg | Bahasa Inggris | FM ox-12h | Kontrol+ | FM ox-4h |
|---|---|---|---|---|---|---|---|
| C 14:0 (asam miristat) | 8.27 | Jam 8.30 | 8.91 | 3.85 | 12.48 | 8.42 | 11.71 |
| C 16:0 (asam palmitat) | 16.85 | 21.56 | 21.26 | Tanggal 25.01 | 31.92 | 21.46 | Tanggal 29.12 |
| C 16:1 (asam palmitoleat) | 9.16 | 8.24 | 9.18 | 4.35 | Tanggal 12.29 | 8.42 | 11.28 |
| C 18:0 (asam stearat) | 3.43 | 4.83 | 4.58 | 8.14 | 7.68 | 4.86 | 6.55 |
| C 18:1 w-9 (asam oleat) | 7.17 | Tanggal 8.07 | 7.94 | 11.69 | 12.49 | 8.22 | 10.84 |
| C 18:1 w-7 (asam vaksinat) | 3.03 | 2.91 | 3.08 | 3.39 | 4.58 | 2.97 | 3.88 |
| C 18:2 w-6 (asam linoleat) | 0.81 | 1.62 | 1.77 | 1.05 | 1.66 | 1.66 | 1.76 |
| C 20:5 w-3 (EPA) | 20.50 | 13.51 | 13.73 | 7.35 | 3.68 | 13.68 | 7.16 |
| C 22:5 w-3 (asam klupanodonat) | 2.77 | 2.01 | 1.88 | 2.03 | 0.48 | 2.03 | 1.05 |
| K 22:6 w-3 (DHA) | 10.77 | 15.72 | 13.76 | tanggal 22.11 | 2.26 | 14.91 | 5.67 |
| Total | 82.73 | 86.77 | 86.06 | 88.95 | 89.49 | 86.63 | 89.02 |
| Jenuh | 28.55 | 34.69 | 34.74 | 36.99 | 52.07 | 34.74 | 47.38 |
| Tak jenuh tunggal | 19.35 | tanggal 19.22 | Tanggal 20.19 | 19.43 | 29.35 | 19.61 | pukul 26.00 |
| tak jenuh ganda | 34.84 | 32.86 | 31.13 | 32.53 | Tanggal 8.07 | 32.28 | 15.64 |
| Asam lemak tak jenuh tunggal (EPA) dan asam lemak tak jenuh ganda (DHA) | 31.27 | 29.23 | 27.49 | 29.46 | 5.94 | 28.59 | 12.83 |
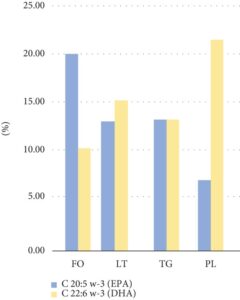
FO terutama terdiri dari lipid netral dan menampilkan rasio DHA/EPA < 1. Pola ini diamati secara serupa dalam data historis yang dikumpulkan antara tahun 1997 dan 2000 [ 32 ], di mana rasio DHA/EPA berkisar antara 0,50 hingga 0,65. Sebaliknya, FM, yang mengandung proporsi lipid struktural yang lebih tinggi (terutama PL), menunjukkan rasio DHA/EPA > 1, serupa dengan nilai yang ditemukan dalam jaringan otot ikan teri yang gelap dan terang [ 33 ], dengan rasio berkisar antara 1,34 hingga 2,42, dan yang dilaporkan dalam lipid yang diekstraksi dari ikan teri yang sangat segar [ 34 ] yang menunjukkan rasio 2,13. Dalam penelitian kami, rasio DHA/EPA dalam FO adalah 0,53, sedangkan dalam LT, adalah 1,11. Hal ini menunjukkan bahwa kandungan DHA dalam FM cepat terpengaruh selama pemrosesan, yang menyebabkan penurunan persentase PUFA, meskipun tetap mempertahankan konsentrasi yang cukup untuk mempertahankan oksidasi yang sedang berlangsung. Perlakuan suhu tinggi dalam kondisi oksidatif secara signifikan mengurangi kandungan PUFA tetapi tidak menghilangkannya sepenuhnya, seperti yang ditunjukkan oleh profil lipid FM yang teroksidasi (LTox dalam Tabel 1 ).
Penting untuk dicatat bahwa FM adalah campuran kering yang terdiri dari otot, kepala, jeroan, dan tulang belakang [ 35 ]. Akibatnya, kandungan lemaknya mencakup sebagian besar lipid struktural, terutama PL. Lipid struktural ini menarik karena bioavailabilitasnya yang ditingkatkan dan ketahanannya yang lebih besar terhadap oksidasi dibandingkan dengan TG. Namun, proporsi dan distribusi PUFA dalam tulang punggung gliserol tetap menjadi topik diskusi yang sedang berlangsung [ 36 ]. Dalam penelitian kami, kandungan PUFA yang tinggi dalam lipid FM kemungkinan meningkatkan kerentanannya terhadap oksidasi, terutama ketika mengalami suhu pemasakan dan pengeringan yang tinggi.
3.2. Tes Awal
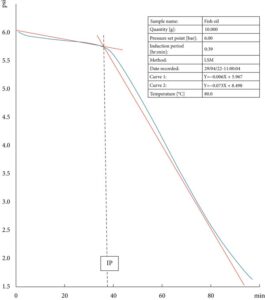
Untuk menilai respons OXITEST terhadap sampel dengan kandungan PUFA tinggi, 10 g FO segar dimasukkan ke dalam ruang oksidasi dan dipaparkan pada suhu 80°C. Peralatan tersebut secara otomatis mendeteksi IP pada menit ke-38, disertai dengan kurva yang konsisten dengan perilaku yang diharapkan untuk produk lemak yang tidak teroksidasi (Gambar 2 ). Pemantauan tekanan oksigen yang digambarkan pada Gambar 2 menggambarkan infleksi kurva yang bertepatan dengan IP. IP didefinisikan sebagai waktu yang diperlukan untuk memulai kaskade oksidasi, yang menunjukkan perubahan mendadak dalam laju oksidasi. IP yang lebih panjang berarti lebih stabil terhadap oksidasi.
Selanjutnya, untuk menentukan jumlah FM yang tepat dalam OXITEST, antara 30 dan 50 g FM ditempatkan secara acak di ruang yang dikenakan suhu antara 60°C dan 90°C. Respons OXITEST menampilkan grafik yang berbeda dari yang diantisipasi dan tidak menunjukkan IP. Namun, konsumsi oksigen terlihat jelas (Gambar 3 ). Grafik-grafik ini menggambarkan penurunan tekanan oksigen yang lebih signifikan pada awal pengukuran, diikuti oleh perlambatan bertahap. Perpotongan garis-garis itu tidak terlihat, dan nilai-nilai IP yang dilaporkan oleh perangkat lunak bervariasi tanpa konsistensi logis. Akibatnya, data diekstraksi dari program OXISoft dan dianalisis ulang menggunakan spreadsheet (Excel). Meskipun makanan ikan teri mengandung konsentrasi PUFA yang cukup untuk mengonsumsi oksigen di dalam ruang, tidak adanya IP menunjukkan bahwa kaskade oksidasi dalam FM telah dimulai sebelum dimasukkan ke dalam reaktor.
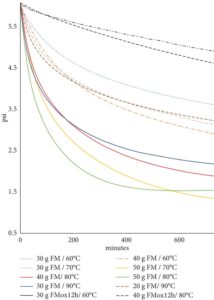
Grafik tekanan oksigen (Gambar 3 ) menunjukkan bahwa jumlah sampel yang lebih besar menyediakan lebih banyak tempat reaktif untuk oksidasi, yang mengarah ke penurunan tekanan yang lebih jelas (garis padat) dibandingkan dengan sampel dengan jumlah yang lebih kecil (garis putus-putus). Sebaliknya, sampel yang sangat teroksidasi (FM ox-12h dalam Tabel 1 ) menunjukkan konsumsi oksigen minimal (garis putus-putus hitam). Penurunan tekanan yang paling menonjol diamati saat menggunakan 50 g sampel pada suhu 80°C selama 4 jam pertama, yang memandu pemilihan kondisi ini untuk evaluasi antioksidan.
3.3. Evaluasi Ethoxyquin FM
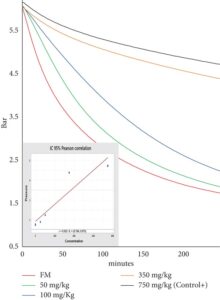
Konsumsi oksigen dalam FM dengan peningkatan konsentrasi ethoxyquin dievaluasi menggunakan OXITEST. Grafik menunjukkan korelasi terbalik antara konsentrasi ethoxyquin dan konsumsi oksigen (Gambar 4 ), yang menunjukkan bahwa ethoxyquin sebagian mengurangi oksidasi sampel. Setelah 4 jam, konsumsi oksigen terendah diamati dalam sampel yang diobati dengan 750 ppm ethoxyquin (Kontrol+). Sebaliknya, tidak adanya antioksidan dalam FM mengakibatkan konsumsi oksigen yang lebih tinggi dan penurunan tekanan yang lebih cepat.
Profil asam lemak dari lipid yang diekstrak dari Control+, setelah mengalami kondisi OXITEST, menunjukkan keefektifan ethoxyquin dalam melindungi PUFA. Ia mempertahankan konsentrasi EPA dan DHA pada tingkat yang sebanding dengan yang ada dalam total lipid (LT) dari bahan mentah segar (Tabel 1 ), menegaskan kembali perannya sebagai antioksidan referensi. Sementara itu, FM yang mengalami OXITEST selama 4 jam (FM ox-4h ) menunjukkan pengurangan signifikan dalam kandungan PUFA, dengan DHA menjadi yang paling terpengaruh karena tingkat ketidakjenuhannya yang lebih tinggi. Sepanjang penelitian, pengukuran berkala FM dan Control+ dilakukan untuk memverifikasi konsistensi dan respons peralatan.
3.4. Evaluasi FM Agen Antioksidan
Luas area di bawah kurva tekanan oksigen versus waktu ditentukan untuk setiap pengujian. Luas area yang diperoleh untuk setiap antioksidan dibandingkan dengan Control+, yang dianggap 100%, dan dengan FM, yang dianggap 0%. Efisiensi relatif setiap antioksidan dihitung menggunakan persamaan berikut:
![]()
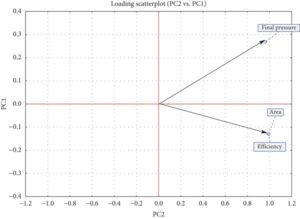
Antioksidan yang berbeda pada dosis yang berbeda menunjukkan respons yang berbeda (Tabel 2 ). PCA dilakukan pada matriks berskala yang terdiri dari 32 perlakuan dan tiga variabel respons (tekanan akhir, luas, dan efisiensi) untuk mengevaluasi pengaruh antioksidan pada konsentrasi yang berbeda. Analisis mengidentifikasi dua komponen utama (PC) dengan nilai eigen 2,8939 dan 0,1061, yang masing-masing mencakup 96,46% dan 3,54% dari total varians. Gambar 5 mengilustrasikan bahwa tekanan akhir, luas, dan efisiensi menunjukkan nilai positif dan korelasi yang kuat pada kedua komponen.
| Perlakuan | Prinsip aktif | Dosis (mg/kg) | Tekanan akhir (bar) | Daerah (U2) | Efisiensi (%) |
|---|---|---|---|---|---|
| AOX 1 | BHT mengkristal | 500 | 4,07 ± 0,01 | 2,57 ± 0,00 | 39.9 |
| AOX 2 | Dispersi air BHT | tahun 1240 | 1,81 ± 0,01a | 0,68 ± 0,00a | 1.2 |
| tahun 2000 | 2,26 ± 0,08b | 0,96 ± 0,04b | 6.9 | ||
| AOX 3 | BHT + BHA | tahun 1550 | 2,90 ± 0,01 | 1,33 ± 0,00 | 14.6 |
| AOX 4 | BHT + BHA + Sitrat | tahun 2493 | 4,01 ± 0,07 | 2,48 ± 0,08 | 37.9 |
| AOX 5 | BHT + BHA + asam sitrat | tahun 2810 | 3,76 ± 0,01c | 2,13 ± 0,01c | 30.9 |
| 3750 | 3,94 ± 0,04 hari | 2,42 ± 0,05 hari | 36.8 | ||
| AOX 6 | BHT + BHA + asam sitrat | 3333 | 3,82 ± 0,14 | 2,17 ± 0,13 | 31.7 |
| AOX 7 | BHT + BHA + asam sitrat | tahun 2632 | 3,81 ± 0,01 | 2,20 ± 0,04 | 32.2 |
| AOX 8 | BHT + propil galat | 3000 | 3,85 ± 0,04 | 2,27 ± 0,05 | 33.7 |
| AOX 9 | BHT + BHA + propil galat | tahun 2917 | 3,69 ± 0,01 | 2,04 ± 0,00 | 29.1 |
| AOX 10 | BHT + BHA + sitrat + propil galat | 4170 | 4,61 ± 0,05 | 3,76 ± 0,05 | 64.1 |
| AOX 11 | BHT + BHA + sitrat + propil galat | tahun 1745 | 3,52 ± 0,00 | 1,87 ± 0,00 | 25.5 |
| AOX 12 | Tokoferol | 4444 | 3,01 ± 0,03 | 1,42 ± 0,02 | 16.5 |
| AOX 13 | Tokoferol + ekstrak rosemary | tahun 2400 | 4,42 ± 0,00 | 3,24 ± 0,00 | 53.6 |
| AOX 14 | Tokoferol + ekstrak rosemary | tahun 1579 | 3,95 ± 0,01 | 2,40 ± 0,01 | 36.4 |
| AOX 15 | Tokoferol + ekstrak rosemary | tahun 2400 | 2,79 ± 0,02e | 1,26 ± 0,01e | 13.1 |
| 4000 | 4,15 ± 0,01 f | 2,71 ± 0,03 f | 42.8 | ||
| AOX 16 | Tokoferol + propil galat + sitrat | 4000 | 4,52 ± 0,00 | 3,60 ± 0,03 | 60.8 |
| AOX 17 | Tokoferol + propil galat + sitrat | tahun 2400 | 4,59 ± 0,03 | 3,79 ± 0,04 | 64.7 |
| AOX 18 | Campurkan tokoferol–minyak kedelai | 860 | 3,03 ± 0,03 gram | 1,42 ± 0,02 gram | 16.4 |
| tahun 1430 | 3,49 ± 0,02 jam | 1,81 ± 0,00 jam | 24.3 | ||
| 2860 | 3,49 ± 0,11 jam | 1,86 ± 0,12 jam | 25.3 | ||
| AOX 19 | Tokoferol–minyak kedelai | 860 | 2,93 ± 0,09i | 1,37 ± 0,06i | 15.4 |
| tahun 1430 | 3,30 ± 0,08j | 1,66 ± 0,07j | 21.3 | ||
| 2860 | 3,63 ± 0,03 ribu | 1,98 ± 0,00 ribu | 27.9 | ||
| AOX 20 | α -Tokoferol + pati dimodifikasi | tahun 2069 | 3,04 ± 0,00 liter | 1,44 ± 0,00 liter | 16.8 |
| 3448 | 3,36 ± 0,02m | 1,71 ± 0,00m | 22.3 | ||
| 5813 | 3,43 ± 0,03m | 1,76 ± 0,03m | 23.3 | ||
| 8621 | 3,60 ± 0,01n | 1,94 ± 0,01n | 27.0 | ||
| Kontrol+ | Etoksikuin 95% | 750 | 5,03 ± 0,01 | 5,52 ± 0,12 | 100.0 |
| FM | Tanpa antioksidan | angka 0 | 1,79 ± 0,04 | 0,62 ± 0,01 | 0.0 |
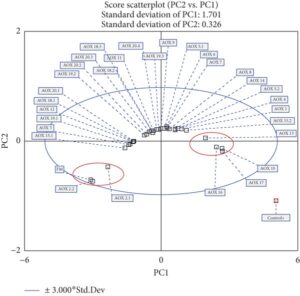
Analisis Gambar 6 mengungkap pembentukan tiga kelompok berbeda berdasarkan variabel yang dievaluasi: tekanan akhir, area, dan efisiensi. Elips biru yang mewakili interval kepercayaan 95% diterapkan pada plot skor PCA, yang mencakup semua sampel dalam batas-batasnya. Sebagian besar sampel terletak di dekat pusat sumbu PC1 dan PC2, sementara dua kelompok yang terdefinisi dengan baik, disorot dengan elips merah, menonjol dan terutama diwakili oleh PC2. Kelompok-kelompok ini sesuai dengan FM, AOX 2.2, dan AOX 2.1 (sisi kiri) dan AOX 10, AOX 13, AOX 16, dan AOX 17 (sisi kanan), yang menunjukkan nilai terendah dan tertinggi dari tekanan akhir, area, dan efisiensi, masing-masing (Tabel 2 ). Dalam konteks ini, PCA menunjukkan bahwa AOX 10, AOX 13, AOX 16, dan AOX 17 menunjukkan kinerja terbaik dalam hal stabilitas oksidatif dibandingkan dengan sampel lainnya.
Konsentrasi bahan aktif harus dipertimbangkan di masa mendatang karena bahan aktif cenderung kehilangan kapasitas reaktifnya. Beberapa campuran antioksidan mungkin bersifat sinergis dan meningkatkan kapasitas antioksidan, sementara yang lain mungkin terhambat. Penelitian saat ini akan berfungsi sebagai metode evaluasi awal untuk antioksidan dalam FM menggunakan OXITEST untuk menyaring antioksidan dengan kapasitas antioksidan yang lebih baik dengan cara yang lebih ekonomis dan lebih cepat. Setelah antioksidan dengan efektivitas yang lebih baik dipilih, antioksidan tersebut akan dievaluasi menggunakan metodologi yang telah divalidasi.
4. Kesimpulan
OXITEST adalah teknik yang digunakan untuk mengevaluasi stabilitas oksidatif produk makanan, yang dicirikan oleh IP, yang menunjukkan periode stabilitas sebelum dimulainya kaskade oksidasi lipid. Tahap ini diidentifikasi oleh perubahan yang nyata pada penurunan tekanan O2 di dalam ruang reaksi. Ketika minyak ikan teri dievaluasi menggunakan OXITEST pada suhu 80°C, perangkat lunak melaporkan IP selama 38 menit. Sebaliknya, ketika FM ikan teri dianalisis, penurunan tekanan langsung diamati tanpa IP yang jelas, yang menunjukkan bahwa kaskade oksidasi dalam lipid FM telah dimulai, sehingga mempersulit penentuan IP menggunakan teknik ini. Meskipun demikian, penurunan tekanan yang diamati menunjukkan bahwa konsumsi oksigen masih berlangsung. Ketika 750 mg/kg etoksikuin ditambahkan ke FM, laju penurunan tekanan melambat. Ketika konsentrasi etoksikuin dikurangi, laju penurunan tekanan meningkat, dengan sampel bebas antioksidan (FM) menunjukkan penurunan tekanan tercepat.
Kondisi optimal untuk mengamati variasi tekanan dalam OXITEST ditetapkan pada 50 g FM pada suhu 80°C selama 4 jam. Beberapa antioksidan yang tersedia di pasar lokal diuji, menunjukkan pola penurunan tekanan yang berbeda, yang menunjukkan variasi dalam kapasitasnya untuk menghambat oksidasi. Efisiensi setiap antioksidan diukur dengan menghitung area di bawah kurva plot tekanan versus waktu dan membandingkan area ini dengan yang diperoleh untuk kontrol positif (Kontrol+) dan sampel bebas antioksidan (FM). Secara keseluruhan, diamati bahwa, dalam FM, antioksidan berbeda yang dievaluasi menunjukkan respons yang bervariasi dalam hal stabilitas oksidatif, di mana sampel AOX 10, AOX 13, AOX 16, dan AOX 17 memberikan stabilitas oksidatif yang lebih baik.
Studi ini menunjukkan bahwa metode OXITEST dapat digunakan sebagai alat yang efektif untuk mengevaluasi efisiensi antioksidan dalam FM, menyediakan pendekatan awal untuk mengidentifikasi senyawa antioksidan yang paling menjanjikan, yang nantinya dapat menjadi subjek studi validasi yang lebih komprehensif.

