ABSTRAK
Efek antimikroba dan antioksidan sinergis dari asam glutarat (GLA) dengan asam sorbat (SoA) atau natrium bisulfit (SoB) dievaluasi untuk menentukan konsentrasi dan rasio optimalnya untuk kemanjuran maksimum. Hasilnya mengungkapkan bahwa kombinasi ini menunjukkan sifat antimikroba yang kuat, dengan GLA-SoB juga menunjukkan aktivitas antioksidan yang signifikan. Temuan ini konsisten di seluruh evaluasi in vitro dan model pangan (menggunakan salmon). Kombinasi tersebut secara efektif memperpanjang masa simpan dan menjaga kesegaran saat diaplikasikan pada salmon yang diiris dan dicincang. GLA, GLA-SoA (2:1), dan GLA-SoB (1:2) sangat efektif dalam mempertahankan warna, menstabilkan pH dan tingkat kelembapan, dan mengurangi penanda pembusukan seperti total nitrogen basa volatil (TVB-N), nilai peroksida (POV), kadar asam tiobarbiturat (TBA), dan jumlah mikroba. Studi ini menyoroti efektivitas GLA-SoB (1:2) dan GLA-SoA (2:1) yang sebanding dalam menghambat pertumbuhan mikroba dan memperpanjang masa simpan salmon dalam kondisi dingin. Kedua kombinasi menunjukkan kemanjuran yang bergantung pada dosis dalam menjaga kualitas dan keamanan, menjadikannya kandidat yang menjanjikan untuk meningkatkan stabilitas penyimpanan produk salmon.
1 Pendahuluan
Salmon, yang terkenal karena nilai komersialnya yang tinggi, sangat dihargai karena kualitasnya yang luar biasa dan manfaat nutrisinya, yang menjadikannya pilihan populer dalam berbagai aplikasi kuliner (Chen et al. 2023 ). Karena sifatnya yang mudah rusak dan masa simpan yang terbatas, salmon sering dibekukan dan disimpan dalam kondisi beku selama distribusi, terutama untuk transportasi jarak jauh seperti ekspor ke negara lain. Untuk melayani konsumen yang mencari salmon segar, pengecer biasanya mencairkan ikan beku dan menawarkannya dalam berbagai bentuk, seperti irisan salmon atau salmon cincang. Salmon yang dicairkan biasanya disimpan pada suhu antara 0 °C dan 4 °C untuk menjaga kualitasnya dan memastikan keamanannya untuk dikonsumsi hingga mencapai konsumen. Namun, pembusukan dapat terjadi selama penyimpanan berpendingin karena aktivitas enzimatik, pertumbuhan mikroba, dan degradasi autolitik (Yan et al. 2022 ). Akibatnya, teknik pengawetan kimia sangat penting untuk memperpanjang masa simpan dan menjaga kualitas salmon yang didinginkan. Metode ini membantu mempertahankan atribut penting, seperti tekstur, warna, rasa, nilai gizi, dan keamanan mikrobiologis (Yan et al. 2022 ). Meskipun banyak digunakan, bahan pengawet kimia harus mematuhi standar peraturan setempat untuk melindungi konsumen dari potensi efek samping (Nagasinduja dan Shahitha 2019 ).
Di Malaysia, Peraturan Pangan (1985) mengizinkan penggunaan bahan pengawet tertentu yang diizinkan, termasuk sulfur dioksida (atau sulfit) dan asam sorbat (atau garam natrium, kalsium, atau kaliumnya), dalam produk daging olahan mentah, tidak termasuk burger daging (Mavani et al. 2024 ). Bahan pengawet konvensional ini telah digunakan secara luas oleh industri makanan untuk waktu yang lama dan tetap lazim dalam praktik kontemporer di bawah pengawasan ketat dari otoritas setempat. Meskipun berkhasiat, bahan tambahan ini dapat menimbulkan risiko kesehatan, terutama bagi individu yang rentan, seperti penderita asma, bahkan dalam batas yang diizinkan (Lamas et al. 2016 ).
Asam organik (OA) semakin dikenal sebagai alternatif yang hemat biaya untuk pengawetan daging, baik sebagai agen mandiri atau dalam kombinasi dengan aditif lainnya. Aplikasinya umumnya tidak memerlukan langkah-langkah pemrosesan tambahan, menjadikannya pilihan praktis untuk industri makanan (Ben Braïek dan Smaoui 2021 ). OA banyak digunakan sebagai antimikroba alami untuk menghambat pertumbuhan mikroorganisme patogen berbahaya seperti Escherichia coli O157: H7 dan Listeria monocytogenes . Garamnya juga dimasukkan ke dalam produk siap saji untuk mengendalikan patogen dan diterapkan melalui pencucian, penyemprotan, atau pencelupan untuk membersihkan permukaan makanan segar (İrkin et al. 2015 ). Meskipun OA secara historis telah digunakan untuk tujuan ini, kemanjuran dan keberlanjutan jangka panjangnya memerlukan evaluasi dan pengoptimalan lebih lanjut. Khususnya, menggabungkan dua atau lebih zat antimikroba dapat meningkatkan pengawetan melalui efek aditif atau sinergis, sehingga meningkatkan keamanan dan kualitas produk daging (Ben Braïek dan Smaoui 2021 ). Di antara berbagai OA, asam glutarat (GLA) telah muncul sebagai senyawa yang menjanjikan karena sifatnya yang meningkatkan rasa dan menstabilkan (Hartwig et al. 2020 ). Namun, kemanjuran GLA dalam kombinasi dengan asam sorbat (SoA) atau natrium bisulfit (SoB) dalam mengurangi pembusukan dan kerusakan oksidatif pada daging masih belum pasti.
Studi ini menyelidiki efek sinergis GLA, SoA, SoB, dan kombinasi GLA dengan SoA atau SoB pada sifat antimikroba dan antioksidannya. Melalui pendekatan in vitro, kombinasi yang paling efektif diidentifikasi. Selanjutnya, kemanjurannya pada stabilitas mikroba dan kualitas pengawetan dievaluasi menggunakan dua sistem model: irisan dan cincangan salmon yang didinginkan. Berbeda dengan penggunaan pengawet konvensional (SoA dan SoB) secara tunggal dalam pengawetan daging, penambahan GLA dapat mengurangi ketergantungan pada pengawet konvensional ini, meningkatkan keamanan pangan, dan membangun landasan ilmiah untuk eksplorasi lebih lanjut dalam spektrum produk daging yang lebih luas.
2 Bahan dan Metode
2.1 Bahan
Enam galur mikroba yang digunakan untuk mengevaluasi aktivitas antimikroba adalah Bacillus cereus (EMCC 1006), Staphylococcus aureus (ATCC 25923), Streptococcus pyogenes (EMCC 1772), Candida albicans (EMCC 105), Salmonella enterica (ATCC 43972), dan Escherichia coli (ATCC 25922). Semua reagen kimia (termasuk GLA, SoA, dan SoB) dan pelarut yang digunakan dalam penelitian ini bermutu analitis dan bersumber dari Sigma Aldrich (AS).
2.2 Penentuan Konsentrasi Hambat Minimal (KHM)
MIC ditentukan mengikuti protokol yang dijelaskan oleh Ben Akacha et al. ( 2022 ). Metode kaldu mikrodilusi menggunakan pelat mikro 96 sumur untuk menilai nilai MIC untuk setiap zat yang diuji (GLA, SoA, dan SoB). Untuk setiap sumur, suspensi sel 100 μL dicampur dengan larutan uji yang mengandung zat yang diuji. MIC didefinisikan sebagai konsentrasi terendah zat yang menghambat pertumbuhan mikroba yang terlihat. Untuk mengonfirmasi hasil, 25 μL tiazolil biru tetrazolium bromida (MTT) (0,5 mg/mL) ditambahkan setelah 30 menit inkubasi. Sumur dengan pertumbuhan yang terhambat tetap jernih, yang menunjukkan tidak ada aktivitas metabolisme mikroba yang diuji.
2.3 Khasiat Antimikroba dengan Uji Papan Catur
Efek sinergis dari kombinasi yang diuji (GLA dikombinasikan dengan SoA atau SoB) dievaluasi menggunakan metode mikrodilusi papan catur standar, seperti yang dijelaskan oleh Xin et al. ( 2021 ). Galur uji dikultur dalam kaldu Mueller-Hinton (MH) pada suhu 37°C hingga mencapai fase pertumbuhan eksponensial. Selanjutnya, mereka diencerkan hingga konsentrasi akhir 2 × 106 CFU /mL dalam kaldu MH segar. Matriks 11 × 7 disiapkan dalam pelat mikrotiter 96 sumur dengan mengencerkan secara serial satu komponen kombinasi (komponen A) di sepanjang baris (50 μL dalam kaldu MH) dan komponen lainnya (komponen B) di sepanjang kolom (50 μL dalam kaldu MH). Inokulum mikroba 50 μL ditambahkan ke setiap sumur, dan pelat diinkubasi pada suhu 37°C selama 18 jam. Setelah inkubasi, 50 μL larutan iodonitrotetrazolium klorida (INT) yang baru disiapkan ditambahkan ke setiap sumur, dan pelat diinkubasi lebih lanjut selama 2 jam pada suhu 37°C. Nilai MIC untuk setiap kombinasi ditentukan. Konsentrasi penghambatan fraksional (FIC) dihitung sebagai berikut:
FIC A = MIC kombinasi A/MIC A saja.
FIC B = MIC kombinasi B/MIC B saja.
Indeks FIC gabungan (∑FIC) dihitung sebagai berikut:
![]()
Interpretasi nilai ∑FIC adalah sebagai berikut:
∑FIC ≤ 0,5: Sinergi, dengan sinergi yang lebih kuat saat nilai mendekati nol.
0,5 < ∑FIC ≤ 1: Aditivitas.
1 < ∑FIC ≤ 2: Ketidakpedulian.
Metode ini memungkinkan evaluasi kuantitatif interaksi antara kombinasi yang diuji.
2.4 Aktivitas Antioksidan
2.4.1 Uji Penangkal Radikal DPPH (2,2-Difenil-1-Pikrilhidrazil)
Aktivitas penangkal radikal DPPH ditentukan menurut metode yang dijelaskan oleh Hlima et al. ( 2021 ). Sesuai Bagian 3.2 , potensi interaksi sinergis antara GLA dengan SoA atau SoB diukur menggunakan indeks ∑FIC, dengan nilai yang mendekati 0 menunjukkan sinergi yang lebih kuat. Akibatnya, untuk setiap galur, kombinasi yang paling efektif dipilih berdasarkan nilai ∑FIC kurang dari 0,5, yang menunjukkan efek sinergis yang kuat.
Berbagai rasio kombinasi GLA-SoB (1:1, 1:2, 2:1, 4:1) dan GLA-SoA (2:1, 1:2, 1:4, 1:16) disiapkan berdasarkan proporsi berat komponen A dan B. Setiap kombinasi yang diuji, dengan total 4000 μg, dilarutkan dalam 1 mL etanol 99,5%, dengan asam askorbat (AsA) sebagai kontrol positif. Untuk pengujian, 500 μL larutan kombinasi (atau 500 μL air suling sebagai kontrol negatif) ditambahkan ke setiap sumur mikroplat dan dicampur dengan 125 μL DPPH 0,02% dalam etanol 99,5%. AsA diuji dengan cara yang sama. Sebanyak 375 μL etanol 99,5% ditambahkan untuk mencapai volume akhir 1 mL, sehingga menghasilkan konsentrasi larutan sebesar 2000 μg/mL. Demikian pula, larutan pada 500 μg/mL dan 16.000 μg/mL disiapkan untuk analisis lebih lanjut. Campuran reaksi diinkubasi dalam gelap selama 60 menit pada suhu ruangan. Setelah inkubasi, absorbansi diukur pada 517 nm dengan etanol sebagai blanko menggunakan spektrofotometer UV-visibel (PG Instruments, T70, Shanghai, Tiongkok). Sampel kontrol disiapkan dengan mencampur larutan DPPH dengan etanol. Aktivitas penangkal radikal DPPH dihitung menggunakan rumus berikut:
![]()
Di mana, A C mewakili absorbansi kontrol negatif (air suling), dan A S adalah absorbansi sampel.
2.4.2 Aktivitas Penangkapan Nitrit In Vitro
Uji aktivitas pembersihan nitrit dilakukan menurut protokol yang diuraikan oleh Choi et al. ( 2019 ). Sebanyak 1 mL setiap larutan sampel (mengandung 9 mg zat yang diteliti dalam 1 mL etanol 99,5%) atau 1 mL etanol 99,5% (berfungsi sebagai blanko) dicampur dengan 1 mL buffer asam sitrat (pH 3) dan 1 mL larutan nitrat 5 mg/L. Campuran yang dihasilkan diinkubasi pada suhu 37°C selama 30 menit. Selanjutnya, 1 mL larutan asam amino benzena sulfonat natrium 4 g/L (dalam asam klorida 20%) dan 0,5 mL larutan naftalena etilendiamin hidroklorida 2 g/L (dalam air) ditambahkan untuk mencapai konsentrasi akhir 2000 μg/mL. Larutan dengan konsentrasi 500 dan 16.000 μg/mL disiapkan dengan cara yang sama. Reaksi didiamkan selama 15 menit sebelum mengukur absorbansi pada 538 nm. AsA digunakan sebagai kontrol positif, dan percobaan dilakukan dalam rangkap tiga. Kapasitas pembersihan nitrit dihitung menggunakan persamaan berikut:
![]()
Di mana, A S adalah absorbansi sampel dan A B adalah absorbansi blanko.
2.5 Uji Kombinasi Perlakuan Menggunakan Salmon sebagai Model Sistem
2.5.1 Sistem Model Irisan Salmon
Persiapan sampel irisan salmon mengikuti metode yang diuraikan oleh Yan et al. ( 2022 ). Salmon segar ( Salmo salar ), yang bersumber dari peternakan ikan Norwegia (Bremnes Seashore AS, Bømlo), dibeli dari pasar lokal (Lotus’s, Pulau Pinang, Malaysia). Salmon kemudian diiris dengan dimensi seragam sekitar 41,0 ± 4,3 mm panjangnya, 19,0 ± 2,9 mm lebarnya, dan 6,0 ± 0,3 mm tebalnya. Sampel dibagi menjadi 17 kelompok untuk perlakuan: Kelompok 1–3 (diperlakukan dengan SoB), Kelompok 4–6 (diperlakukan dengan SoA), Kelompok 7–9 (diperlakukan dengan GLA), Kelompok 10–12 (diperlakukan dengan GLA-SoB 1:2), dan Kelompok 13–15 (diperlakukan dengan GLA-SoA 2:1), dengan masing-masing kelompok menerima perlakuan pada konsentrasi 500, 1000, dan 2000 μg/mL. Kelompok 16 diperlakukan dengan etanol 40% sebagai kontrol kosong, sedangkan Kelompok 17 tidak diperlakukan sebagai kontrol negatif. Setiap irisan kemudian direndam dalam larutan perlakuan masing-masing (dilarutkan dalam etanol 40%) selama 1 menit, diikuti dengan pengeringan udara pada suhu 35°C selama 15 menit menggunakan oven pengering (Thermo Scientific, Heratherm, Waltham, AS). Sampel yang diberi perlakuan dan kontrol kemudian disimpan pada suhu 4°C dalam inkubator berpendingin (Thermo Scientific, FYCD-290, Waltham, AS), dan analisis kualitas dan keamanan dilakukan pada hari ke-1, ke-3, ke-6, ke-9, dan ke-12.
2.5.2 Studi Model Ikan Salmon Cincang
Berat rata-rata setiap sampel irisan salmon ditetapkan sekitar 3 g, sesuai dengan prosedur yang diuraikan dalam Bagian 2.5.1 . Berat ( M ) setiap kombinasi yang diuji (dalam μg) yang diaplikasikan per 30 g salmon cincang dihitung menggunakan persamaan berikut:
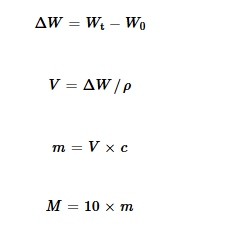
di mana, W t dan W 0 masing-masing melambangkan berat (dalam g) irisan yang diberi dan tidak diberi perlakuan, ∆ W melambangkan berat larutan yang melekat pada permukaan irisan salmon (dalam g), ρ melambangkan massa jenis relatif etanol 40% (0,92 g/mL), V melambangkan volume larutan (dalam mL), c melambangkan konsentrasi larutan (dalam μg/mL), dan m melambangkan berat kombinasi yang diuji yang melekat pada satu irisan (dalam μg).
Sampel salmon cincang disiapkan menurut metode yang diuraikan oleh Pakawatkai et al. ( 2009 ). Salmon cincang segar diperoleh dari pasar Lotus dan dibagi menjadi 22 kelompok uji: Kelompok 1–4 (SoB), Kelompok 5–8 (SoA), Kelompok 9–12 (GLA), Kelompok 13–16 (GLA-SoB 1:2), dan Kelompok 17–20 (GLA-SoA 2:1), dengan masing-masing kelompok diperlakukan pada konsentrasi 182, 364, 728, dan 1456 μg/g. Kelompok 21 berfungsi sebagai kontrol kosong dengan etanol 40%, dan Kelompok 22 adalah kontrol negatif yang tidak diobati. Setiap kelompok uji diperlakukan dengan 5 mL larutan yang sesuai dengan etanol 40% sebagai pelarut. Sampel disimpan pada suhu 4°C dalam inkubator berpendingin FYCD-290, dan evaluasi kualitas dan keamanan sampel dilakukan pada hari ke-1, ke-3, ke-6, ke-9, dan ke-12.
2.6 Penilaian Kualitas dan Keamanan Sampel Salmon
2.6.1 Analisis Mikroba
Analisis mikroba dilakukan mengikuti Abdel-Wahab et al. ( 2020 ). Sampel salmon seberat 25 g dihomogenisasi pada suhu ruangan selama 90 detik menggunakan stomacher (Autoscience, ATBM-400B, Tianjin, Tiongkok). Sebagian 10 g homogenat dicampur dengan 90 mL larutan pepton steril (25,5 g/L), dan 100 μL campuran ini ditanam pada berbagai media untuk penghitungan mikroba menggunakan pengenceran serial dari 10 −1 hingga 10 −7 . Jumlah total yang hidup (TVC) ditentukan pada Plate Count Agar yang diinkubasi pada suhu 37°C selama 48 jam. Jumlah bakteri psikrotrofik (PTC) ditentukan pada Plate Count Agar yang diinkubasi pada suhu 7°C selama 10 hari. Jumlah ragi dan jamur ditentukan pada Potato Dextrose Agar yang diinkubasi pada suhu 25°C selama 96 jam. Jumlah Enterobacteriaceae ditentukan pada Violet Red Bile Glucose Agar yang diinkubasi pada suhu 37°C selama 48 jam.
2.6.2 Sifat Kolorimetri
Karakteristik warna sampel salmon, termasuk kecerahan ( L *), kemerahan ( a *), dan kekuningan ( b *), dievaluasi menggunakan kolorimeter (Konica Minolta, CR-200, Tokyo, Jepang).
2.6.3 Pengukuran pH
Tingkat pH sampel salmon ditentukan menggunakan pH meter terkalibrasi (Lutron, YK-21PH, Taiwan, Tiongkok). Untuk persiapan sampel, 3 g salmon yang dihomogenkan dicampur dengan 30 mL air suling. pH filtrat yang dihasilkan diukur menurut prosedur yang diuraikan oleh Hsouna et al. ( 2022 ).
2.6.4 Penentuan Penurunan Berat Badan
Berat awal ( W i ) dan berat akhir ( W f ) sampel salmon dicatat sebelum dan setelah masa penyimpanan. Persentase kehilangan berat dihitung menggunakan persamaan berikut:
![]()
2.6.5 Penentuan Total Volatile Base Nitrogen (TVB-N)
Tingkat TVB-N dalam sampel salmon dianalisis mengikuti prosedur yang dijelaskan oleh Jia et al. ( 2021 ). Sampel dihomogenkan dalam stomacher (Seward, 400 sq., West Sussex, British) dengan air suling pada rasio 1:10 (w/v). Aliquot 5 mL dari supernatan dicampur dengan 5 mL larutan MgO 10 g/L dan disuling menggunakan penganalisa nitrogen Kjeldahl (Alva Instrument, KN-520, Jinan, Tiongkok). Distilat dikumpulkan dalam larutan asam borat (20 mL, 0,02 g/L) yang mengandung indikator campuran (merah metil dan biru metilen, masing-masing 1 g/L dalam etanol). Larutan tersebut kemudian dititrasi dengan HCl 0,01 M. Sampel kosong menggunakan 5 mL air suling sebagai pengganti sampel salmon juga diuji. Kandungan TVB-N dihitung menggunakan persamaan berikut:
![]()
Di mana, m menyatakan berat sampel (dalam g), V1 dan V2 menyatakan volume (dalam mL ) HCl yang digunakan untuk sampel dan blanko, masing-masing, 0,01 menyatakan konsentrasi larutan HCl (dalam mol/L), dan 50 menyatakan volume total sampel (dalam mL) dalam campuran.
2.6.6 Penentuan Nilai Asam Thiobarbiturat (TBA)
Nilai TBA dari sampel salmon ditentukan menurut metode yang diuraikan oleh Dirpan dan Hidayat ( 2023 ). Sampel salmon 3 g dicampur dengan 50 mL air suling dan dihomogenkan dalam stomacher 400 sq. selama 2 menit. Homogenat dipindahkan ke dalam labu destilasi 1000 mL dan dibilas dengan tambahan 48,5 mL air suling. HCl (1,5 mL) ditambahkan, dan campuran dipanaskan selama 10 menit, menghasilkan 50 mL distilat. Distilat disaring dan dicampur dengan 5 mL reagen TBA (asam tiobarbiturat 0,02 M dalam asam asetat glasial 90%). Larutan ini dipanaskan dalam penangas air mendidih (PWB-4, Boeco, Stuttgart, Jerman) selama 35 menit untuk meningkatkan reaksi, diikuti dengan pendinginan dalam air dingin. Absorbansi larutan diukur pada 528 nm menggunakan spektrofotometer T70, dengan sampel kosong sebagai garis dasar.
2.6.7 Penentuan Produk Oksidasi Primer Menggunakan Nilai Peroksida (POV)
Sampel salmon diekstraksi untuk memperoleh supernatan sebelum penentuan POV berdasarkan prosedur yang dilakukan sebelumnya oleh Manihuruk et al. ( 2017 ). Awalnya, sampel salmon (50 g) dihomogenkan dalam stomacher 400 sq. dengan metanol absolut pada rasio 1:5 (b/v) selama 20 detik pada suhu ruangan. Homogenat disaring menggunakan kertas saring untuk memperoleh supernatan, yang kemudian disimpan dalam botol tertutup pada suhu -20°C hingga dilakukan analisis lebih lanjut.
Untuk pemisahan lipid, digunakan sistem pelarut bifasik yang terdiri dari air, metanol, dan kloroform dalam rasio 25:100:100, mengikuti metode ekstraksi lipid Wu et al. ( 2016 ). Supernatan yang disimpan dicampur dengan sistem pelarut ini dan dikocok dengan kuat untuk mempercepat pemisahan fase. Setelah didiamkan, terbentuk dua lapisan berbeda: fase berair bagian atas yang mengandung senyawa yang larut dalam air dan fase organik bagian bawah yang kaya akan lipid yang terlarut dalam kloroform. Fase organik yang mengandung lipid dikumpulkan dengan hati-hati dan dipindahkan ke wadah terpisah untuk dipekatkan.
Lipid yang diekstraksi dipekatkan menggunakan rotary evaporator (Yarong Biochemical Analysis Instrument, RE-5220, Shanghai, Cina) untuk menghilangkan pelarut di bawah tekanan rendah. Sebagian 1 g lipid pekat kemudian dilarutkan dalam 6 mL larutan asam asetat/kloroform (3:2). Untuk memulai reaksi, 0,1 mL kalium iodida jenuh ditambahkan, dan campuran dibiarkan bereaksi dalam gelap selama 10 menit. Selanjutnya, 10 mL air suling dan 0,1 mL larutan kanji 1% dimasukkan. Campuran tersebut kemudian dititrasi dengan 0,01 M natrium tiosulfat (Na2S2O3 ) hingga menjadi tidak berwarna . POV dihitung dan dinyatakan dalam miliekivalen (meq) per kilogram lipid, sesuai persamaan berikut:
![]()
Dimana , N menyatakan normalitas Na2S2O3 , V menyatakan volume Na2S2O3 , dan W menyatakan berat ekstrak lipid .
2.7 Analisis Statistik
Analisis statistik dilakukan menggunakan GraphPad Prism (versi 6.01). Analisis varians satu arah (ANOVA) diikuti oleh uji post hoc Tukey digunakan untuk beberapa perbandingan. Semua eksperimen dilakukan dalam rangkap tiga ( n = 3), dan hasilnya disajikan sebagai rata-rata ± simpangan baku (SD). Signifikansi statistik dianggap pada p < 0,05.
3 Hasil dan Pembahasan
3.1 Aktivitas Antimikroba dari Berbagai Kombinasi yang Diuji
Tabel 1 menyajikan nilai MIC dari zat yang diuji terhadap mikroorganisme tertentu. Di antara mereka, SoA menunjukkan MIC tertinggi (2000 μg/mL) untuk sebagian besar mikroorganisme, kecuali Streptococcus pyogenes . Ini diikuti oleh GLA, yang menunjukkan MIC 1000 μg/mL terhadap Candida albicans . Terakhir, SoB menunjukkan MIC 500 μg/mL terhadap Escherichia coli , Bacillus cereus , dan Candida albicans . Temuan ini menyoroti pentingnya memilih zat antimikroba yang sesuai yang disesuaikan dengan mikroorganisme target, karena tingkat resistensi dapat berbeda secara signifikan. Ini menggarisbawahi perlunya perawatan yang tepat, konsentrasi optimal, atau kombinasi strategis untuk mencapai penghambatan yang efektif.
| Zat yang diteliti | Salmonella enterica ATCC 43972 | Escherichia coli ATCC 25922 | Streptococcus pyogenes EMCC 1772 | Bakteri Bacillus cereus EMCC 1006 | Stafilokokus aureus ATCC 25923 | Kandida albicans EMCC 105 |
|---|---|---|---|---|---|---|
| Menangis | 250 | 500 | 250 | 500 | 125 | 500 |
| Bagus | 500 | 250 | 500 | 250 | 250 | 1000 |
| SoA | tahun 2000 | tahun 2000 | 1000 | tahun 2000 | tahun 2000 | tahun 2000 |
Catatan: Pengujian dilakukan sebanyak tiga kali ( n = 3).
Sebelumnya, Seo et al. ( 2023 ) mengidentifikasi Escherichia coli , Salmonella enterica , dan Staphylococcus aureus sebagai bakteri yang paling resistan terhadap SoA, dengan MIC sebesar 2000 μg/mL. Sebaliknya, penelitian sebelumnya menunjukkan bahwa nilai MIC mikroorganisme ini untuk SoB berkisar antara 300 hingga 50.000 μg/mL (Brennan et al. 1999 ; Lamas et al. 2016 ; Pardeshi et al. 2015 ; Quoc 2018 ; Rojo-Bezares et al. 2007 ). Perbedaan potensial dalam hasil ini dapat dikaitkan dengan mekanisme resistensi yang terkait dengan paparan sebelumnya terhadap bahan pengawet atau antibiotik (Krishnamoorthy et al. 2021 ), yang menyebabkan variasi yang nyata dibandingkan dengan temuan dalam penelitian ini. Selain itu, sejauh pengetahuan kami, belum ada penelitian yang melaporkan nilai MIC mikroorganisme yang diuji terhadap GLA (Tabel 1 ), yang menggarisbawahi perlunya penelitian lebih lanjut tentang sifat penghambatannya.
Aktivitas antimikroba dari kombinasi ganda (GLA dengan SoA atau SoB) dinilai terhadap berbagai galur mikroba (Tabel 2 ). Dalam kasus di mana ∑FIC kurang dari 0,5, MIC masing-masing zat berkurang hingga serendah 1/4 dari MIC agen tunggalnya, atau bahkan lebih rendah. Indeks ∑FIC yang mendekati 0 menunjukkan efek sinergis yang lebih substansial. Kombinasi yang menjanjikan meliputi GLA-SoB pada rasio 1:1, 1:2, 2:1, dan 4:1, serta GLA-SoA pada rasio 1:2, 1:4, 1:16, dan 2:1.
| Ketegangan | Zat kombinasi | Parameter | |||||||
|---|---|---|---|---|---|---|---|---|---|
| A | B | Sebuah:B sebuah | MIC A (μg/mL) dalam kombinasi | MIC B (μg/mL) dalam kombinasi | FIC Sebuah | FIC B | ∑ FIC | Interaksi | |
| Bakteri Gram− | |||||||||
| Salmonella enterica ATCC 43972 | Bagus | Menangis | 1:2 | 7.8125 | 15.625 | 0,016 | 0,063 tahun | 0,079 tahun | Sinergisme |
| 1:2 | 15.625 | 31.25 | 0,031 | 0,125 | 0.156 | Sinergisme | |||
| Bagus | SoA | 8:1 | 125 | 15.625 | 0,25 | 0,008 | 0,258 | Sinergisme | |
| 2:1 | 62.5 | 31.25 | 0,125 | 0,016 | 0.141 | Sinergisme | |||
| Escherichia coli ATCC 25922 | Bagus | Menangis | 4:1 | 62.5 | 15.625 | 0,25 | 0,031 | 0.281 | Sinergisme |
| 1:2 | 31.25 | 62.5 | 0,125 | 0,125 | 0,25 | Sinergisme | |||
| Bagus | SoA | 8:1 | 125 | 15.625 | 0.5 | 0,008 | 0,508 tahun | Aditivitas | |
| 1:2 | 62.5 | 125 | 0,25 | 0,063 tahun | 0.313 | Sinergisme | |||
| Bakteri Gram+ | |||||||||
| Streptococcus pyogenes EMCC 1772 | Bagus | Menangis | 1:2 | 7.8125 | 15.625 | 0,016 | 0,063 tahun | 0,079 tahun | Sinergisme |
| Bagus | SoA | 4:1 | 62.5 | 15.625 | 0,125 | 0,008 | 0.133 | Sinergisme | |
| 1:4 | 31.25 | 125 | 0,063 tahun | 0,063 tahun | 0.126 | Sinergisme | |||
| Stafilokokus aureus ATCC 25923 | Bagus | Menangis | 1:1 | 31.25 | 31.25 | 0,125 | 0,25 | 0,375 tahun | Sinergisme |
| 1:1 | 15.625 | 15.625 | 0,063 tahun | 0,125 | 0.188 | Sinergisme | |||
| Bagus | SoA | 8:1 | 125 | 15.625 | 0.5 | 0,016 | 0.516 | Aditivitas | |
| 1:2 | 62.5 | 125 | 0,25 | 0,125 | 0,375 tahun | Sinergisme | |||
| jam 1:16 | 31.25 | 500 | 0,125 | 0.5 | 0,625 | Aditivitas | |||
| Bakteri Bacillus cereus EMCC 1006 | Bagus | Menangis | 8:1 | 125 | 15.625 | 0.5 | 0,031 | 0.531 | Aditivitas |
| 2:1 | 62.5 | 31.25 | 0,25 | 0,063 tahun | 0.313 | Sinergisme | |||
| 1:4 | 31.25 | 125 | 0,125 | 0,25 | 0,375 tahun | Sinergisme | |||
| jam 1:16 | 15.625 | 250 | 0,063 tahun | 0.5 | 0,563 tahun | Aditivitas | |||
| Bagus | SoA | 8:1 | 125 | 15.625 | 0.5 | 0,008 | 0,508 tahun | Aditivitas | |
| 2:1 | 62.5 | 31.25 | 0,25 | 0,016 | 0.266 | Sinergisme | |||
| 1:2 | 31.25 | 62.5 | 0,125 | 0,031 | 0.156 | Sinergisme | |||
| jam 1:16 | 7.8125 | 125 | 0,031 | 0,063 tahun | 0,094 tahun | Sinergisme | |||
| Ragi | |||||||||
| Kandida albicans EMCC 105 | Bagus | Menangis | 4:1 | 62.5 | 15.625 | 0,063 tahun | 0,031 | 0,094 tahun | Sinergisme |
| Bagus | SoA | 2:1 | 62.5 | 31.25 | 0,063 tahun | 0,063 tahun | 0.126 | Sinergisme | |
| 1:2 | 31.25 | 62.5 | 0,031 | 0,125 | 0.156 | Sinergisme | |||
| skala 1:8 | 15.625 | 125 | 0,016 | 0,25 | 0.266 | Sinergisme | |||
Catatan: Pengujian dilakukan sebanyak tiga kali ( n = 3). Rasio berat.
Semua kombinasi yang diuji menunjukkan efek yang hampir sinergis atau aditif terhadap mikroba yang dipilih. Temuan ini sejalan dengan temuan Kim dan Rhee ( 2013 ), yang melaporkan bahwa empat asam lemak rantai pendek yang berbeda dan tiga asam lemak rantai menengah, termasuk asam kaprilat, menunjukkan efek sinergis terhadap bakteri patogen seperti Escherichia coli . Hal ini terbukti dari pengurangan populasi mikroba yang lebih signifikan dibandingkan dengan perawatan individu. Saat ini, belum ada penelitian yang mengeksplorasi mekanisme yang mendasari sinergisme antara GLA dan SoA atau SoB. Namun, beberapa mekanisme telah diusulkan, seperti (a) penghambatan berurutan dari beberapa langkah dalam jalur biokimia, (b) penekanan enzim pelindung, dan (c) interaksi dengan dinding sel atau membran yang meningkatkan penyerapan agen antimikroba lainnya (Chaichi et al. 2021 ). Efek sinergis yang diamati dalam penelitian ini dapat dihasilkan dari beragam zat dalam kombinasi yang diterapkan, masing-masing bekerja pada target kritis yang berbeda di dalam atau di dinding sel, sehingga meningkatkan kontrol mikroba. Interaksi antara GLA dan SoA secara khusus dapat dikaitkan dengan peningkatan bentuk asam yang tidak terdisosiasi, yang memperkuat pelepasan proton. Efek kumulatif ini membanjiri sistem penyangga dan transportasi mikroba, yang mengarah pada tindakan penghambatan yang lebih baik daripada asam tunggal (Ben Braïek dan Smaoui 2021 ). Demikian pula, berbagai kombinasi GLA-SoB dapat menargetkan beberapa mekanisme, seperti mengganggu pH intraseluler, merusak fungsi protein, mengganggu kestabilan membran sel, dan akhirnya menghambat pertumbuhan mikroba secara sinergis (Dhakal et al. 2019 ). Kombinasi GLA dapat mencapai ∑FIC kurang dari 0,1 terhadap Salmonella enterica , Streptococcus pyogenes , dan Candida albicans , yang menunjukkan peningkatan sensitivitas terhadap akumulasi mereka. Sebaliknya, mikroba lain yang tercantum dalam Tabel 2 tampak lebih toleran, mungkin karena kemampuannya untuk memasukkan GLA eksogen ke dalam proses metabolisme, yang dapat mengurangi efikasinya (Chaichi et al. 2021 ).
Selain itu, menggabungkan zat-zat yang diuji menawarkan keuntungan dalam mengurangi konsentrasi yang dibutuhkan dari setiap komponen untuk mencapai aktivitas antimikroba yang efektif. Pendekatan ini dapat memberikan manfaat yang signifikan, meningkatkan kemanjuran sekaligus berpotensi mengurangi biaya dan meminimalkan efek samping dari dosis SoB dan SoA yang lebih tinggi.
3.2 Evaluasi Aktivitas Antioksidan dari Kombinasi yang Diuji
Kapasitas pembersihan nitrit dan uji DPPH digunakan untuk mengevaluasi aktivitas antioksidan total dari kombinasi yang diuji (Tabel 3 ). Kedua uji antioksidan menghasilkan hasil yang sebanding. Uji tersebut menunjukkan bahwa kombinasi GLA-SoA menunjukkan efek antioksidan sinergis yang paling substansial pada rasio 2:1. Sebaliknya, kombinasi GLA-SoB menunjukkan aktivitas antioksidan sinergis tertinggi pada rasio 1:2.
| Proporsi kombinasi | Zat yang diteliti | Aktivitas pemulungan DPPH pada 500 μg/mL (%) | Aktivitas pemulungan DPPH pada 2000 μg/mL (%) | Aktivitas pemulungan DPPH pada 16.000 μg/mL (%) | Pembersihan nitrit pada 500 μg/mL (%) | Pembersihan nitrit pada 2000 μg/mL (%) | Pembersihan nitrit pada 16.000 μg/mL (%) |
|---|---|---|---|---|---|---|---|
| SebagaiA | 82,38 ± 1,97 menit | 91,15 ± 2,64 jam | 98,71 ± 0,90 per menit | 96,99 ± 1,73 per menit | 98,13 ± 0,43 satu | 98,28 ± 0,36 satu | |
| Menangis | 75,92 ± 1,05 jam | 88,52 ± 1,95 inci | 98,76 ± 0,25 satu | 95,51 ± 1,21 jam | 95,84 ± 1,71 menit | 98,20 ± 0,28 satu | |
| Bagus | 15,01 ± 3,71 derajat Fahrenheit | 16,34 ± 4,08 detik | 28,34 ± 0,64 hari | 50,91 ± 1,93 derajat Fahrenheit | 53,91 ± 1,88 hari | 55,86 ± 2,88 detik | |
| SoA | 10,51 ± 1,23 saya | 11,38 ± 1,45 hari | 18,38 ± 1,45 gram | 30,62 ± 0,68 saya | 31,29 ± 1,35 gram | 35,00 ± 1,93 jam | |
| 1:1 | GLA-SoB | 63,62 ± 1,02 hari | 74,62 ± 2,84 SM | 95,28 ± 0,51 miliar | 90,11 ± 0,80 detik | 89,11 ± 1,86 miliar | 88,09 ± 1,40 miliar |
| 2:1 | GLA-SoB | 42,29 ± 1,65 tahun | 70,13 ± 3,42 detik | 86,43 ± 1,04 detik | 65,86 ± 2,30 hari | 71,86 ± 0,74 detik | 63,30 ± 1,69 detik |
| 4:1 | GLA-SoB | 21,77 ± 1,50 derajat Fahrenheit | 66,10 ± 6,33 detik | 76,22 ± 1,79 detik | 51,66 ± 1,74 tahun | 54,66 ± 2,25 hari | 58,42 ± 1,06 hari |
| 1:2 | GLA-SoB | 69,65 ± 1,33 detik | 80,38 ± 4,52 miliar | 97,71 ± 0,62 jam | 94,22 ± 1,31 miliar | 95,55 ± 1,58 jam | 96,16 ± 1,52 detik |
| 2:1 | GLA-SoA | 12,84 ± 1,81 gram | 18,67 ± 3,92 hari | 23,01 ± 3,16 derajat Fahrenheit | 44,23 ± 1,79 gram | 51,89 ± 4,07 detik | 57,80 ± 1,79 hari |
| 1:2 | GLA-SoA | 12,01 ± 2,01 gram | 16,32 ± 4,92 detik | 18,94 ± 0,43 gram | 41,96 ± 1,81 gram | 47,29 ± 2,97 dpl | 54,07 ± 1,53 tahun |
| 1:4 | GLA-SoA | 11,65 ± 1,17 gram | 16,11 ± 4,46 detik | 17,65 ± 4,35 gram | 39,57 ± 1,23 jam | 45,76 ± 1,73 derajat Fahrenheit | 50,03 ± 0,63 derajat Fahrenheit |
| jam 1:16 | GLA-SoA | 10,94 ± 2,11 gram | 12,27 ± 3,43 detik | 16,44 ± 5,31 gram | 38,76 ± 1,73 jam | 45,23 ± 1,50 derajat Fahrenheit | 41,01 ± 1,25 gram |
Catatan: Pengujian dilakukan sebanyak tiga kali ( n = 3). Perubahan signifikan ( p < 0,05) ditunjukkan dengan huruf yang berbeda selama pengujian yang sama.
Baik SoB maupun GLA, ketika hadir pada konsentrasi 500 μg/mL, secara efektif menghambat sebagian besar mikroorganisme yang diuji (Tabel 1 ). Khususnya, ketiga zat yang diuji menunjukkan efek penghambatan pada konsentrasi 2000 μg/mL secara in vitro. SoA dan garamnya diklasifikasikan sebagai aditif GRAS (Umumnya Diakui Aman). Sementara bahan pengawet ini merupakan pilihan yang aman, ada potensi masalah keamanan untuk populasi rentan tertentu (Stopforth dan Kudron 2020 ). Menurut Komisi Kesehatan Nasional Republik Rakyat Tiongkok dan Administrasi Negara untuk Pengaturan Pasar ( 2024 ), konsentrasi maksimum SoA yang diizinkan dalam produk daging adalah 1500 μg/g. Konsentrasi pengujian sebesar 500, 2000, dan 16.000 μg/mL (setara dengan 1456 μg/g, yang termasuk dalam batas legal) dihitung dalam Bagian 2.5.2 dan memberikan wawasan berharga mengenai kisaran aplikasi yang layak dari zat-zat ini dalam model penyimpanan daging salmon berikutnya.
Meskipun SoA banyak digunakan karena sifat antimikrobanya, ia tidak memiliki kemampuan antioksidan seperti asam askorbat (vitamin C) atau tokoferol (vitamin E) (Meyer et al. 2002 ). Antioksidan biasanya memiliki gugus fungsi, seperti gugus hidroksil (-OH), yang memfasilitasi donasi elektron atau transfer atom hidrogen untuk menetralkan radikal bebas dan mengganggu reaksi berantai oksidatif. Sebaliknya, SoA tidak memiliki gugus reaktif ini dan tidak mampu terlibat dalam reaksi redoks untuk menstabilkan radikal bebas (Meyer et al. 2002 ). Akibatnya, SoA sering dikombinasikan dengan antioksidan dalam pengawetan makanan dan minuman ketika stabilitas oksidatif sangat penting (Stopforth dan Kudron 2020 ). GLA memiliki keterbatasan yang sama. Strukturnya, yang dicirikan dengan hanya adanya dua gugus karboksil (-COOH), tidak memiliki substituen yang mampu berpartisipasi dalam reaksi redoks dengan radikal bebas, sehingga tidak efektif dalam mencegah reaksi berantai oksidatif (Liao et al. 2024 ). Oleh karena itu, kombinasi GLA dengan SoA tidak secara signifikan meningkatkan kapasitas antioksidan. Sebaliknya, SoB menunjukkan perilaku yang berbeda. Sebagai agen pereduksi, SoB dapat menyumbangkan elektron untuk menetralkan senyawa pengoksidasi, yang secara efektif menghentikan reaksi berantai oksidatif. Ketika SoB dikombinasikan dengan GLA, campuran yang dihasilkan menunjukkan peningkatan kapasitas antioksidan, dengan efek yang menjadi lebih jelas saat konsentrasi SoB meningkat (Vellanki et al. 2013 ).
3.3 Pengawetan Produk Salmon
3.3.1 Evaluasi Parameter Mutu pada Ikan Salmon Iris yang Diolah dengan Kombinasi Uji
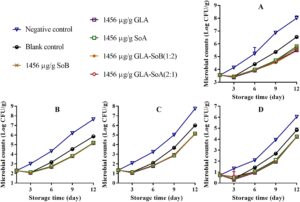
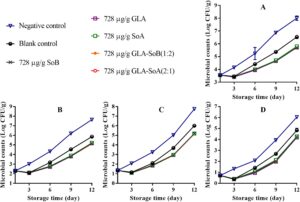
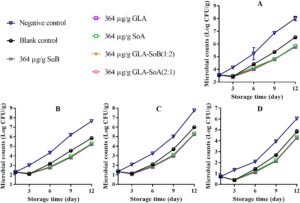
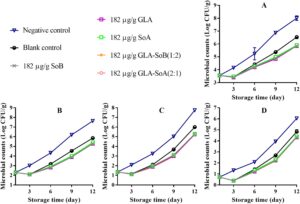
Gambar 1 – 3 mengilustrasikan perubahan dalam TVC, PTC, jumlah Enterobacteriaceae, dan jumlah ragi dan jamur selama penyimpanan irisan salmon dalam lemari es. TVC awal irisan salmon berkisar antara 3,52 hingga 3,60 log 10 CFU/g, yang menunjukkan kualitas tinggi salmon yang digunakan dalam penelitian ini. Selama penyimpanan, TVC, PTC, jumlah Enterobacteriaceae, dan jumlah ragi dan jamur menunjukkan variasi di seluruh kelompok eksperimen. Khususnya, jumlah mikroba dalam kelompok kontrol negatif dan kosong menunjukkan peningkatan yang signifikan ( p < 0,05) dibandingkan dengan yang ada dalam kelompok eksperimen setelah hari ke-9. Khususnya, TVC dalam kelompok kontrol negatif dan kosong melampaui batas yang dapat diterima yaitu 7,0 log 10 CFU/g (Wu et al. 2016 ) masing-masing sekitar hari ke-9 dan ke-12. Sebaliknya, perlakuan GLA-SoB (1:2) dan GLA-SoA (2:1) menunjukkan penghambatan mikroba yang sebanding ( p > 0,05) dengan SoB, GLA, dan SoA pada akhir periode penyimpanan. Lebih jauh lagi, TVC dalam kelompok eksperimen ini tetap berada di bawah batas yang dapat diterima yaitu 7,0 log 10 CFU/g selama 12 hari setelah penyimpanan dimulai. Temuan ini menunjukkan bahwa zat yang diuji, khususnya kombinasi GLA-SoB (1:2) dan GLA-SoA (2:1), memperpanjang masa simpan mikrobiologis salmon yang diiris setidaknya 3 hari dibandingkan dengan kontrol negatif.
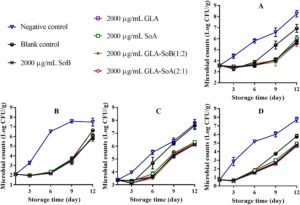
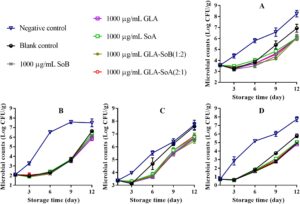
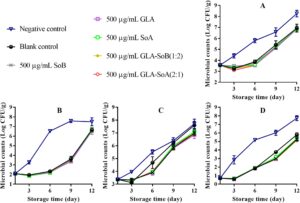
Temuan-temuan ini selaras dengan laporan-laporan sebelumnya. Karami et al. ( 2020 ) mengamati bahwa sampel ikan trout cincang yang dilapisi dengan film lendir kitosan-biji rami menunjukkan pengurangan populasi mikroba sebesar 0,35–4,91 log 10 CFU/g dibandingkan dengan sampel kontrol setelah 16 hari pendinginan, konsisten dengan temuan-temuan penelitian ini. Demikian pula, Olivas et al. ( 2003 ) menunjukkan bahwa perendaman dalam larutan berair yang mengandung 1% asam askorbat, 0,25% kalsium klorida, dan 0,1% kalium sorbat memberikan efek bakteriostatik dan memperpanjang masa simpan sampel-sampel yang diolah. Lebih jauh lagi, pengolahan yang melibatkan larutan SoB 3%, baik sendiri atau dikombinasikan dengan 200 μg/mL asam perasetat, yang diaplikasikan melalui pencelupan selama 15 detik pada paha ayam secara efektif mengurangi keberadaan Salmonella . Penurunan ini terbukti setelah 3 hari pendinginan, yang menunjukkan bahwa aksi gabungan SoB dan asam perasetat secara efektif mengendalikan pertumbuhan Salmonella selama penyimpanan (Dittoe et al. 2019 ). Temuan ini mendukung kemanjuran antimikroba SoB ketika digunakan sendiri, yang menunjukkan bahwa menggabungkan SoB dengan OA dapat meningkatkan dampaknya. Sifat antimikroba OA dipengaruhi oleh panjang rantai, tingkat percabangan, dan proporsi bentuk yang tidak terdisosiasi. Pengasaman, sebagian karena ion bisulfit (HSO 3− ) yang dilepaskan oleh SoB, berkontribusi pada peningkatan aktivitas antimikrobanya. Mekanisme ini telah didokumentasikan secara luas dalam literatur (İrkin et al. 2015 ). Kombinasi OA memainkan peran penting dalam pengawetan dengan menurunkan pH, yang memperkuat efektivitas antimikroba. Penurunan jumlah mikroorganisme berkorelasi langsung dengan penurunan pembusukan makanan, karena aktivitas mikroba merupakan pendorong utama kerusakan (Dittoe et al. 2019 ). Khususnya, ketika SoA dan SoB dikombinasikan dengan GLA, konsentrasi yang dibutuhkan untuk mengawetkan irisan salmon dan memperpanjang masa simpannya berkurang secara signifikan dibandingkan dengan penggunaan SoA atau SoB saja.
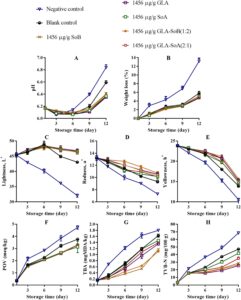
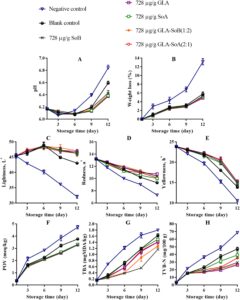
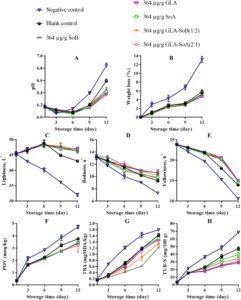
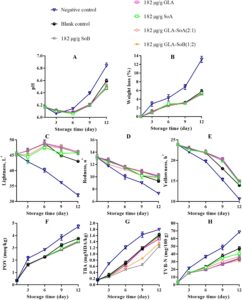
pH irisan salmon menunjukkan peningkatan bertahap di semua perlakuan selama penyimpanan berpendingin, dengan besarnya peningkatan ini lebih jelas pada kelompok kontrol negatif dan kosong (Gambar 4A , 5A , dan 6A ). Peningkatan pH ini dapat dikaitkan dengan akumulasi senyawa alkali yang dihasilkan oleh aktivitas mikroba selama fase pasca-rigor. Khususnya, kombinasi yang diuji menunjukkan kapasitas untuk mengurangi kerusakan pasca-mortem melalui efek antimikrobanya (Bagian 3.1 ). Mengikuti penelitian sebelumnya yang dilakukan oleh Alves et al. ( 2018 ), sampel salmon umumnya cenderung meningkat pH-nya selama penyimpanan berpendingin. Namun, sampel yang diobati dengan kombinasi GLA menunjukkan nilai pH rendah secara konsisten selama periode penyimpanan, kemungkinan karena pelepasan ion H + dari GLA dan SoA. Hubungan ketergantungan dosis diamati, dengan konsentrasi yang lebih rendah, khususnya 500 μg/mL, menunjukkan stabilitas yang berkurang dalam mempertahankan kadar pH. Hal ini menunjukkan bahwa kombinasi GLA-SoB (1:2) dan GLA-SoA (2:1) secara efektif meminimalkan peningkatan pH. Penurunan pH memainkan peran penting dalam mengawetkan matriks makanan dengan menciptakan lingkungan yang lebih asam yang menghambat pertumbuhan mikroba dan aktivitas enzimatik. Tingkat pH yang lebih rendah secara efektif menghambat proliferasi organisme pembusuk dan bakteri patogen, sehingga menjaga tekstur, rasa, dan kualitas makanan secara keseluruhan (Alves et al. 2018 ). Lebih jauh lagi, lingkungan asam yang stabil dapat menambah kemanjuran pengawet dan antioksidan tertentu, sehingga memperpanjang umur simpan dan memastikan keamanan pangan selama penyimpanan (Dittoe et al. 2019 ).
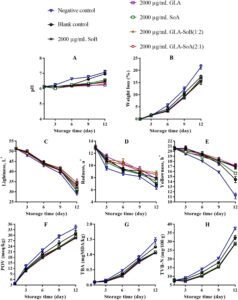
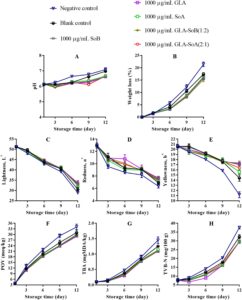
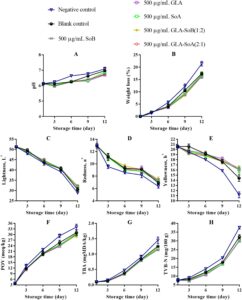
Dalam semua perlakuan, kehilangan berat menurun secara progresif selama periode penyimpanan berpendingin (Gambar 4B , 5B dan 6B ). Pengurangan kehilangan berat ini berhubungan dengan denaturasi protein dan paparan gugus hidrofobik berikutnya. Tren serupa telah diamati oleh Molina et al. ( 2014 ) pada fillet ikan bass laut yang dibudidayakan ( Dicentrarchus labrax ) dan oleh Christensen et al. ( 2017 ) pada pinggang makarel. Sampel yang diobati dengan SoB, GLA, SoA, GLA-SoB (1:2), dan GLA-SoA (2:1) menunjukkan kehilangan berat yang secara signifikan ( p < 0,05) lebih rendah dibandingkan dengan kelompok kontrol negatif selama periode penyimpanan. Tidak ada perbedaan signifikan ( p > 0,05) dalam kehilangan berat yang terdeteksi di antara sampel yang diobati dengan lima perlakuan ini, yang menunjukkan kemanjuran yang sebanding dalam meminimalkan kehilangan berat selama penyimpanan berpendingin.
Denaturasi protein dalam daging yang didinginkan secara tidak langsung terkait dengan pembusukan mikroba. Aktivitas mikroba menghasilkan produk sampingan metabolisme, seperti enzim proteolitik, yang mendegradasi protein (Anas et al. 2019 ). Selain itu, denaturasi protein selama pendinginan dapat mengurangi kapasitas menahan air, yang mengakibatkan kehilangan tetesan. Ini menciptakan permukaan lembap yang mendorong pertumbuhan mikroba dan mempercepat pembusukan (Ismail dan Huda 2024 ). Pengurangan kehilangan berat mendukung integritas struktural matriks makanan, yang menunjukkan bahwa retensi kelembaban dipertahankan, yang penting untuk mempertahankan tekstur dan kualitas (Ismail dan Huda 2024 ). Stabilitas ini juga menunjukkan bahwa aktivitas mikroba ditekan secara efektif, karena banyak mikroorganisme pembusuk memecah nutrisi utama seperti protein dan lemak, yang menyebabkan degradasi, kehilangan air, dan perubahan tekstur. Dengan menghambat pertumbuhan mikroba, makanan mempertahankan komposisi aslinya untuk waktu yang lebih lama, mencegah penguapan air yang berlebihan dan kerusakan nutrisi, yang pada akhirnya meningkatkan masa simpan dan kesegarannya (Lerfall et al. 2016 ).
Protein dalam daging juga rentan terhadap kerusakan oksidatif yang disebabkan oleh spesies oksigen reaktif (ROS) (Domínguez et al. 2021 ). SoB, bila dikombinasikan dengan GLA, menetralkan ROS, mengurangi modifikasi oksidatif protein yang dapat menyebabkan denaturasi. Antioksidan menangkal kerusakan oksidatif dan sering kali menunjukkan sifat antimikroba, yang selanjutnya mengurangi aktivitas mikroba dan produksi enzim proteolitik terkait (Domínguez et al. 2021 ). Selain efek antimikrobanya, SoB juga dapat membantu menstabilkan warna irisan salmon bila digunakan bersama dengan GLA, yang berkontribusi pada pelestarian kualitas secara keseluruhan selama penyimpanan.
Pengukuran warna semua sampel dilakukan pada hari ke-1, ke-3, ke-6, ke-9, dan ke-12 (Gambar 4C−E , 5C−E , dan 6C−E ). Nilai kecerahan ( L *) menunjukkan penurunan progresif selama penyimpanan, dengan pengurangan yang lebih cepat diamati pada kelompok kontrol negatif dan kosong. Sebaliknya, sampel yang dirawat menunjukkan kontrol pengurangan L * yang lebih baik setelah hari ke-1. Nilai kemerahan ( a *) menurun secara bertahap selama penyimpanan, dengan laju penurunan paling menonjol pada kelompok kontrol negatif, diikuti oleh kelompok kontrol kosong dan kelompok eksperimen. Perbedaan signifikan ( p < 0,05) terdeteksi di antara semua sampel yang dirawat sebelum dan sesudah penyimpanan. Pada hari ke-12, GLA-SoB (1:2) pada 2000 μg/mL mempertahankan tingkat kemerahan tertinggi, diikuti oleh GLA-SoA (2:1) pada 2000 μg/mL, dan selanjutnya oleh masing-masing perlakuan GLA, SoB, dan SoA pada 2000 μg/mL. Nilai kekuningan ( b *) juga menurun secara signifikan ( p < 0,05) selama penyimpanan. Namun, sampel yang diolah mempertahankan retensi nilai b * yang lebih unggul dibandingkan dengan kontrol yang tidak diolah, yang menguatkan dengan temuan sebelumnya pada daging salmon (Christensen et al. 2017 ). Hasil ini menggarisbawahi kemanjuran kombinasi yang diuji dalam menjaga kualitas warna salmon selama penyimpanan dalam lemari es.
Baik aksi antioksidan dan penghambatan mikroba memainkan peran penting dalam meningkatkan dan mempertahankan warna daging ikan selama pendinginan. Degradasi oksidatif lipid menghasilkan produk sampingan yang berinteraksi dengan protein dan pigmen, yang berdampak buruk pada warna (Comi 2017 ). Dengan mengurangi oksidasi lipid, SoB, dalam kombinasi dengan GLA, secara efektif mempertahankan tampilan alami irisan salmon. Bakteri pembusuk berkontribusi terhadap perubahan warna dengan menghasilkan metabolit, seperti hidrogen sulfida, dan enzim yang mendegradasi protein dan pigmen. Mengendalikan pertumbuhan mikroba mencegah proses ini, mempertahankan tampilan yang lebih segar dan lebih estetis (Comi 2017 ). Efek sinergis SoB dan GLA meningkatkan pengawetan, karena tindakan komplementernya mengatasi jalur oksidatif dan mikroba yang menyebabkan perubahan warna. Sebaliknya, penggunaan gabungan SoA dan GLA memperkuat efek sinergisnya, terutama menargetkan jalur mikroba yang bertanggung jawab atas perubahan warna salmon. Pendekatan tindakan ganda ini menunjukkan kemanjuran luar biasa dalam melindungi warna dan kualitas irisan salmon yang didinginkan.
Oksidasi lipid dalam produk makanan laut biasanya diukur dengan metode POV dan TBA. Dampak perlakuan terhadap oksidasi lipid salmon digambarkan dalam Gambar 4F , 5F dan 6F . POV awal dari sampel kontrol negatif dan kosong menunjukkan peningkatan yang signifikan ( p < 0,05) selama periode penyimpanan. Sebaliknya, sampel yang diberi perlakuan, termasuk yang terpapar etanol 40% saja, menunjukkan ketahanan yang lebih kuat terhadap oksidasi ( p < 0,05) dibandingkan dengan kelompok kontrol negatif. Analisis TBA, yang menunjukkan kandungan produk oksidasi lipid sekunder, mengungkapkan peningkatan bertahap dalam nilai TBA di semua kelompok seiring berjalannya waktu (Gambar 4G , 5G dan 6G ). Salmon irisan yang diberi perlakuan menunjukkan nilai TBA yang secara signifikan ( p < 0,05) lebih rendah dibandingkan dengan kontrol, terutama setelah hari ke-9 selama periode penyimpanan 12 hari. Efek ini lebih jelas pada konsentrasi perlakuan 2000 dan 1000 μg/mL. Konsisten dengan hasil POV, sampel yang diobati dengan kombinasi yang diuji, yaitu GLA-SoB (1:2) dan GLA-SoA (2:1), menunjukkan nilai TBA yang rendah pada akhir penyimpanan, yang menunjukkan mitigasi oksidasi lipid yang efektif.
Penelitian sebelumnya telah menetapkan korelasi antara kadar POV dan pertumbuhan bakteri psikrotrofik. Bakteri ini menghasilkan enzim lipase dan fosfolipase selama pendinginan, memfasilitasi oksidasi asam lemak rantai pendek yang dilepaskan (Li et al. 2021 ). Lebih jauh lagi, perbedaan yang diamati dalam nilai TBA antara perlakuan dengan kombinasi yang diuji dan kontrol negatif kemungkinan besar dikaitkan dengan efek bakterisida, antioksidan, atau gabungannya. Pengamatan ini sejalan dengan temuan oleh Basavegowda dan Baek ( 2021 ), yang menunjukkan bahwa senyawa yang menunjukkan sifat bakterisida atau antioksidan dapat menghambat pembentukan dan oksidasi lemak tak jenuh, pendorong utama ketengikan dalam produk makanan. Dengan mengurangi oksidasi, kombinasi yang diuji secara efektif menjaga kualitas dan stabilitas irisan salmon selama penyimpanan, mencegah ketengikan dan memperpanjang umur simpan.
Gambar 4H , 5H dan 6H menyajikan nilai TVB-N, penanda dekomposisi bakteri dalam daging ikan, dalam kaitannya dengan periode penyimpanan. Kadar TVB-N awal dalam irisan salmon berkisar antara 7,05 hingga 7,71 mg N/100 g. Perkembangan nilai TVB-N diamati pada semua sampel, dengan perbedaan signifikan ( p < 0,05) muncul antara kelompok kontrol dan kelompok perlakuan setelah hari ke-3. Laju peningkatan TVB-N secara signifikan lebih lambat dalam sampel yang diperlakukan dengan kombinasi yang diuji pada 2000 dan 1000 μg/mL, yaitu GLA-SoB (1:2) dan GLA-SoA (2:1). Sebelum hari ke-12, nilai TVB-N dari kontrol negatif melebihi 35 mg/100 g, melampaui ambang batas maksimum yang ditetapkan sebelumnya. Seperti yang dilaporkan oleh Alves et al. ( 2018 ), tingkat TVB-N sebesar 35 mg/100 g dianggap sebagai batas atas untuk kesegaran salmon yang dapat diterima. Sebaliknya, pada hari ke-12, kelompok yang diberi perlakuan ini menunjukkan nilai TVB-N yang secara signifikan ( p < 0,05) lebih rendah dibandingkan dengan kontrol, yang dikaitkan dengan efikasi antimikrobanya yang tinggi (Bagian 3.1 ). Korelasi yang kuat diamati antara nilai TVB-N, PTC, dan TVC, yang selanjutnya memperkuat efikasi perlakuan ini dalam menjaga kualitas salmon selama penyimpanan dalam lemari es (Jia et al. 2021 ). Ketika hasil ini diintegrasikan dengan hasil yang disajikan dalam Gambar 1 – 3 , kombinasi yang diuji secara efektif mengurangi TVC, PTC, dan jumlah mikroba lainnya. Ini sejalan dengan penurunan yang diamati dalam TVB-N, TBA, dan POV, yang menunjukkan adanya korelasi potensial. Selain itu, pengurangan parameter ini juga dapat dikaitkan dengan penekanan katabolisme mikroba (Basavegowda dan Baek 2021 ).
3.3.2 Evaluasi Parameter Mutu Ikan Salmon Cincang yang Diolah dengan Kombinasi Uji
Selama periode penyimpanan 12 hari, analisis mikroba mengungkapkan variasi dalam TVC, PTC, jumlah Enterobacteriaceae, dan jumlah ragi dan jamur di antara sampel salmon cincang yang disimpan pada suhu 4 °C (Gambar 7 – 10 ). Awalnya, jumlah mikroba untuk kontrol kosong dan kelompok eksperimen berkurang setelah penambahan etanol 40%, zat yang diuji, dan kombinasinya. Namun, jumlah ini meningkat secara progresif seiring waktu penyimpanan. TVC, PTC, dan jumlah ragi dan jamur dari sampel kontrol negatif melebihi batas yang dapat diterima sekitar hari ke-9 hingga ke-10. Sebaliknya, sampel kontrol kosong dan kelompok eksperimen mempertahankan jumlah mikroba di bawah batas yang dapat diterima selama periode penyimpanan 12 hari. Khususnya, sampel kelompok eksperimen menunjukkan jumlah mikroba yang secara signifikan ( p <0,05) lebih rendah dibandingkan dengan kelompok kontrol kosong. Pengurangan ini dapat dikaitkan dengan efek penghambatan dari kombinasi yang diuji, yang kemungkinan memperpanjang fase jeda pertumbuhan mikroba. Lebih jauh lagi, efek penghambatan menjadi lebih jelas dengan konsentrasi zat yang lebih tinggi, yang secara efektif menunda proliferasi mikroba dan menjaga kualitas salmon selama penyimpanan dalam lemari es. Hasil serupa dilaporkan oleh Eghbalian et al. ( 2021 ), yang menunjukkan jumlah mikroba yang berkurang pada ikan trout yang diobati dengan natrium kaseinat-gelatin yang dikombinasikan dengan magnesium oksida (MgO) dan minyak atsiri spearmint ( Mentha spicata L.). Demikian pula, Wu et al. ( 2016 ) secara berkala menilai TVC dan PTC dalam sampel ikan bawal perak ( Pampus argentus ) yang diobati dengan konjugat kitosan-asam galat (CS-GA) (kitosan galat, CS-g-GA) selama penyimpanan dalam lemari es pada suhu 4°C selama 15 hari. Temuan mereka menunjukkan bahwa CS-g-GA menunjukkan aktivitas antimikroba yang lebih tinggi, menghasilkan populasi mikroba 1,50–3,00 log 10 CFU/g lebih rendah daripada yang ada dalam sampel kontrol setelah 15 hari penyimpanan. Hasil ini sesuai dengan temuan penelitian ini.