ABSTRAK
Total fenol dari daun Cinnamomum longepaniculatum yang telah dihilangkan minyaknya (DCL-TP) merupakan senyawa fenolik yang menunjukkan berbagai aktivitas biologis yang kuat, terutama aktivitas antioksidan karena karakteristik struktur hidroksil fenoliknya, sehingga DCL-TP memperoleh peningkatan relevansi dan penerimaan. Akan tetapi, kurangnya informasi toksikologi membatasi penerapannya. Penelitian ini bertujuan untuk menilai profil toksikologi DCL-TP, melalui studi toksisitas akut, studi toksisitas oral 28 hari, dan tiga uji toksisitas genetik, yang meletakkan dasar bagi pengembangan DCL-TP sebagai oksidan antilipid dan menyediakan dasar bagi penerapan farmakologis. Dalam studi toksisitas akut, 10 tikus KM betina dan 10 tikus KM jantan diberikan DCL-TP melalui gavage oral 10 g/kg berat badan (bwt) selama 14 hari. Dalam uji mutasi balik bakteri (uji Ames), mutagenisitas DCL-TP diselidiki dengan metode infiltrasi pelat dengan jumlah mutasi balik bakteri sebagai indeks pengamatan. Uji mikronukleus eritrosit mamalia pada 25 tikus KM betina dan 25 tikus KM jantan serta uji aberasi kromosom spermatosit pada 25 tikus KM jantan secara acak dimasukkan ke dalam lima kelompok (dosis oral harian 5, 2,5 dan 1,25 g/kg bb). Dalam studi toksisitas oral selama 28 hari, 20 tikus SD betina dan 20 tikus SD jantan secara acak dimasukkan ke dalam empat kelompok (dosis oral harian 2,5, 1,25 dan 0,625 g/kg bb). Tidak terjadi kematian, keracunan dan tidak ada efek samping yang diamati, yang menunjukkan LD50 lebih tinggi dari 10 g/kg bb. Uji Ames menunjukkan bahwa DCL-TP tidak memiliki mutagenisitas. Tidak ada perbedaan signifikan dalam jumlah mikronukleus eritrosit mamalia dan kromosom spermatosit antara DCL-TP dan kelompok kontrol negatif ( p > 0,05). Dalam studi toksisitas oral selama 28 hari, tidak ditemukan kerusakan signifikan atau kelainan organ dibandingkan dengan kontrol negatif. Konsumsi makanan, berat badan, berat organ, urinalisis, indeks rutin darah, indeks biokimia darah, dan histopatologi menunjukkan histologi normal yang sebanding dengan kelompok kontrol ( p > 0,05). Studi ini mengungkapkan bahwa DCL-TP tidak menunjukkan efek toksik yang signifikan dan tidak ada potensi mutagenisitas genotoksisitas. Evaluasi toksikologi kronis lebih lanjut diperlukan untuk menentukan keamanan dan nilai aplikasinya.
1 Pendahuluan
Dalam beberapa tahun terakhir, keamanan pangan telah berhubungan langsung dengan kesehatan fisik dan keselamatan hidup. Dengan meningkatnya permintaan untuk kesehatan, keamanan bahan tambahan pangan, khususnya oksidan antilipid, telah menarik lebih banyak perhatian. Selain itu, masalah keamanan seperti teratogenik dan karsinogenik dengan oksidan antilipid sintetis menambah minat pada oksidan antilipid alami. Perawatan kesehatan saat ini tampaknya beralih ke pengobatan tradisional dengan keamanan (Kahl dan Kappus 1993 ). Dalam penelitian sebelumnya dari kelompok penelitian, fungsi antioksidan dan antioksidasi lipid in vitro dari DCL-TP (Total fenol dari daun Cinnamomum longepaniculatum yang dihilangkan minyaknya ) dipelajari, yang menunjukkan potensi kuat dalam antioksidasi lipid bahan tambahan pangan.
C. longepaniculatum merupakan tanaman kemenyan berkayu penting yang telah dibudidayakan secara luas di Yibin, Provinsi Sichuan, Tiongkok. Tanaman ini tersebar di Jiangxi, Guangxi, Guangdong, Hunan, Yunnan, dan tempat-tempat lain (Lin 2020 ; Zhou dan Lian 2020 ). Zat-zat yang diisolasi dari tanaman ini meliputi proantosianidin (Hu et al. 2019 ), minyak atsiri (Yuan 2021 ), polisakarida (Du et al. 2015 ), flavonoid (Du et al. 2016 ), kumarin, glikosida, asam organik (Hu, Luo, dan Dai 2019 ), protein, dan komponen kimia lainnya (Du et al. 2014 ). Studi farmakologi modern telah menunjukkan bahwa komponen kimia dalam daun C. longepaniculatum yang telah dihilangkan minyaknya memiliki berbagai aktivitas fisiologis seperti antibakteri (Feng et al. 2023 ), antiinflamasi (Tao 2011 ), analgesik (Chao et al. 2013 ), antikanker (Zhou et al. 2022 ), dan antioksidan (Chen et al. 2021 ). Saat ini, penelitian tentang daun C. longepaniculatum yang telah dihilangkan minyaknya di dalam dan luar negeri terutama berfokus pada minyak atsiri, proses ekstraksi minyak atsiri, dan analisis komposisi kimianya (Ying et al. 2020 ). Total fenol merupakan salah satu bahan aktif penting dalam daun C. longepaniculatum yang telah dihilangkan minyaknya . Oleh karena itu, daun C. longepaniculatum yang telah dihilangkan minyaknya dapat digunakan sebagai sumber utama fenol. Daun ini murah dan kaya akan bahan baku, serta memiliki nilai penelitian dan pengembangan yang penting. Akan tetapi, hanya ada sedikit penelitian tentang komponen efektif minyak nonesensial seperti total fenol dari daun C. longepaniculatum yang telah dihilangkan minyaknya dan evaluasi keamanannya, dan masih kurangnya laporan tentang evaluasi toksikologi terhadap keamanan DCL-TP yang dapat dimakan sebagai oksidan antilipid.
Oleh karena itu, dalam studi ini, studi pendahuluan tentang keamanan DCL-TP, dan percobaan toksikologi dilakukan menurut prosedur evaluasi toksikologi keamanan pangan Standar Keamanan Pangan Nasional (Komite Administrasi Standardisasi Nasional, Tiongkok, GB 15193.1–2014) (Prosedur Evaluasi Toksikologi Keamanan Pangan Standar Keamanan Pangan Nasional 2014 ). Uji toksisitas oral akut pada tikus, tiga uji toksisitas genetik (uji mutasi balik bakteri, uji mikronukleus eritrosit mamalia, dan uji aberasi kromosom spermatosit tikus), dan uji toksisitas oral 28 hari pada tikus diberikan suspensi DCL-TP secara gavage kepada tikus KM dan tikus SD, yang menyediakan dasar eksperimental untuk DCL-TP sebagai aditif makanan antioksidasi lipid.
2 Bahan dan Metode
2.1 Bahan
Siklofosfamid (F131S206786), karboksimetil selulosa (C14322016), dimetil sulfoksida (DMSO) (1121E0323), serum anak sapi (220308), larutan pewarna Giemsa (Giemsa) (2306001), dan larutan pewarna Eosin (YE2080) masing-masing dibawa dari Shanghai Yuanye Biotechnology Co. Ltd., Shanghai McLean Biochemical Technology Co. Ltd., Beijing Soleibao Technology Co. Ltd., Guangzhou Hongquan Biotechnology Co. Ltd., Beijing Soleibao Technology Co. Ltd., dan Bomei Biotechnology Company. Inkubator biokimia (SPX-150), Sentrifus berpendingin kecepatan rendah (KDC-2046), Pengiris putar (Leica-2016), dan Mesin penyisipan jaringan (BMJ-A) dibeli dari Pabrik Instrumen dan Peralatan Shanghai Haixiang, Anhui Zhongke Zhongjia Scientific Instrument Co. Ltd., Leica, Jerman, dan Pabrik Instrumen Elektronik Zhongwei di Pinggiran Kota Changzhou.
2.2 Bahan Tanaman
Daun C. longepaniculatum yang telah dihilangkan minyaknya dibawa dari Yibin (Sichuan, Cina), yang diautentikasi oleh Prof. Pixian Shui, Sekolah Farmasi, Universitas Kedokteran Barat Daya (Nomor spesimen voucher SMU/220215–1).
2.3 Ekstraksi, Pemurnian, dan Identifikasi DCL-TP
Dalam prosedur ekstraksi, eksperimen faktor tunggal dikombinasikan dengan metode eksperimen ortogonal (Zhou, Jiang, dan Yuan 2024 ) digunakan untuk menyelidiki parameter proses ekstraksi DCL-TP dengan ekstraksi refluks pemanasan. Menurut Tabel 1 , eksperimen faktor tunggal dilakukan dengan metode ekstraksi refluks pemanasan. Kemudian, berdasarkan eksperimen faktor tunggal, ekstraksi DCL-TP dilakukan menurut eksperimen ortogonal L 18 (3 7 ), dan tingkat faktor ditunjukkan pada Tabel 2 .
| Faktor | Tingkat | Tetapkan kondisi |
|---|---|---|
| Konsentrasi etanol (%) | 30,40,50,60,70,80,90 | 20 mL/g 80°C. 1,5 jam 1 kali |
| B rasio cairan terhadap material (mL/g) | 10.15.20.25.30.35.40.45 | 60%. 80°C. 1,5 jam. 1 kali |
| Suhu ekstraksi C (°C) | 50,60,70,80,90,95 | 60%. 35 mL/g. 1,5 jam. 1 kali |
| Waktu ekstraksi D (jam) | 0,5.1.1.5.2.2.5.3 | 60%. 35 mL/g. 90°C. 1 kali |
| Waktu ekstraksi E | 1. 2. 3 | 60%. 35 mL/g. 90°C. 2,5 jam |
| Tingkat | A (%) | B (ml/gram) | Suhu (°C) | D (h) | E (kali) |
|---|---|---|---|---|---|
| Konsentrasi etanol | Rasio cairan terhadap material | Suhu | Waktu | Waktu | |
| 1 | 50 | 30 | 80 | 2 | 1 |
| 2 | 60 | 35 | 90 | 2.5 | 2 |
| 3 | 70 | 40 | 95 | 3 | 3 |
Isolasi DCL-TP dilakukan melalui proses pemurnian asam fenolik pada akar Salvia deserta di Xinjiang (Ren et al. 2021 ). Resin HPD-600 dipilih untuk pemurnian dan pemisahan DCL-TP selanjutnya. Kinetika adsorpsi DCL-TP oleh resin HPD-600 dan parameter statis (pH larutan sampel; konsentrasi sampel) dan parameter dinamis (laju aliran sampel; laju aliran elusi; pH elusi; konsentrasi eluen; volume elusi) diselidiki.
Untuk identifikasi fenol tanaman, di antara metode yang umum digunakan, metode Folin-Ciocalteu (Wang et al. 2016 ) digunakan untuk penentuan kadar fenol total. Metode kolorimetri Folin-Ciocalteu adalah metode yang paling umum digunakan untuk penentuan kadar fenol total dalam metode Folin-Ciocalteu. Dalam metode kolorimetri Folin-Ciocalteu, sebagian besar kurva standar digambar dengan asam galat sebagai zat standar, dan kadar fenol total dinyatakan sebagai ekuivalen asam galat. Ketika HPD-600 digunakan untuk memisahkan dan memurnikan DCL-TP, reaksi ninhidrin negatif, yang menunjukkan bahwa pengotor asam amino dan polipeptida telah dihilangkan. Reaksi Molish dari eluen negatif dan jernih, yang menunjukkan bahwa pengotor polisakarida pada dasarnya telah dihilangkan. Metode Folin-Ciocalteus digunakan untuk menentukan kandungan DCL-TP. Larutan referensi asam galat 0,5 mL dimasukkan ke dalam labu ukur 10 mL, dan ditambahkan larutan uji Folin-Ciocalteu sebanyak 0,6 mL. Setelah 3 menit, ditambahkan larutan natrium karbonat 10% sebanyak 1,2 mL, dikocok sepenuhnya, volume konstan, penangas air 30°C selama 1 jam, dan pelarut yang sesuai digunakan sebagai blanko. Pemindaian dilakukan pada kisaran 500–900 nm, dan pemindaian UV ekstrak DCL-TP dilakukan dengan cara yang sama. Kurva standar dibuat untuk menentukan jumlah total ekstraksi fenol dan dilakukan uji presisi, uji pengulangan, uji stabilitas, dan uji pemulihan sampel.
2.4 Hewan
Komite Tinjauan Etika Universitas Kedokteran Southwest (SMUERC, nomor persetujuan etik: 20221005–005) memberikan persetujuan izin etik untuk penelitian ini. Tikus KM bebas patogen spesifik (SPF) dengan berat badan rata-rata 18–22 g dan 50–100 g untuk tikus SD, dibeli dari Pusat Hewan Eksperimen Universitas Kedokteran Southwest (lisensi Sichuan Tiongkok No. SYXK 2023–0017; lisensi fasilitas percobaan hewan No. SYXK 2023–0065), laboratorium hewan SPF disediakan oleh Pusat Hewan Eksperimen Universitas Kedokteran Southwest sebagai lokasi percobaan dengan suhu ruangan 23°C–25°C, kelembapan relatif 49%–51%, dan siklus terang–gelap 12 jam, dan pakan disediakan oleh pusat hewan percobaan.
2.5 Studi Toksisitas Akut
Dalam studi toksisitas akut, 20 tikus dialokasikan secara acak ke dalam dua kelompok (10 per jenis kelamin) dan dipuasakan selama 16 jam sebelum pemberian. Protokol studi dilakukan sesuai dengan metode terbatas (Standar Keamanan Pangan Nasional Uji Toksisitas Oral Akut 2014 ). DCL-TP disiapkan menjadi suspensi konsentrasi maksimum 125 mg/mL dengan 0,7% CMC. Semua hewan diberi gavage dua kali dalam 24 jam, dengan interval 6 jam. Volume gavage adalah 0,4 mL/10 g bwt, dan dosis total adalah 10 g/kg bwt. Tanda-tanda klinis toksisitas dipantau secara ketat selama 1, 3, dan 6 jam setelah pemberian, dan semua tikus dipantau dua kali sehari selama 14 hari. Berat badan dicatat sebelum pemberian dan pada hari ke-2, ke-7, dan ke-14. Pada hari ke-15, tikus dikorbankan dengan dislokasi serviks dan dilakukan pemeriksaan makroskopis, kemudian perubahan patologis pada organ-organ utama seperti hati, jantung, limpa, ginjal dicatat, dan koefisien organ dihitung. Koefisien organ dihitung dengan membagi berat basah organ dengan berat badan dan dikalikan dengan 100, dan total toksisitas fenol dinilai dengan menggabungkan tabel konversi dosis berat badan manusia dan hewan dan tabel klasifikasi dosis tingkat toksisitas.
![]()
2.6 Tiga Uji Toksisitas Genotoksisitas
2.6.1 Uji Ames
Uji Ames dilakukan sesuai dengan Standar Keamanan Pangan Nasional Uji mutasi balik bakteri (Komite Administrasi Standardisasi Nasional, Tiongkok, GB 15193.4–2014) (Standar Keamanan Pangan Nasional Uji Mutasi Balik Bakteri 2014 ). Menurut metode infiltrasi pelat, lima tingkat dosis ditetapkan sebagai 50, 158, 500, 1158, dan 5000 μg/pelat, dengan tiga pelat untuk setiap dosis. Zat uji diencerkan langkah demi langkah
kali terhadap konsentrasi masing-masing kelompok dosis. Pada saat yang sama, kelompok kontrol negatif (NC), kelompok kontrol pelarut DMSO (SC), dan kelompok kontrol positif (mutagen standar kit Ames) disiapkan. Tiga pengujian paralel dilakukan pada masing-masing kelompok dosis dengan dan tanpa adanya sistem aktivasi metabolisme S 9 sesuai dengan petunjuk kit, dan jarak antara kelompok dosis uji disesuaikan dari
kali menjadi 5 kali. Plat diinkubasi selama 48 jam pada suhu 37°C. Jumlah koloni dihitung. Hasil positif ditentukan ketika jumlah koloni revertan TA97A, TA98, TA100, WP2uvrA (pKM101) lebih besar dari 2 kali lipat, dan jumlah koloni revertan TA1535 lebih besar dari 3 kali lipat daripada SC. Sebaliknya, hasilnya negatif dan kemudian uji verifikasi dilakukan sesuai dengan interval dosis 5 kali.
2.6.2 Uji Mikronukleus Eritrosit Mamalia
Protokol penelitian dilakukan pada tikus dari kedua jenis kelamin sesuai dengan uji mikronukleus eritrosit mamalia Standar Keamanan Pangan Nasional (Komite Administrasi Standardisasi Nasional, Tiongkok, GB 15193.5–2014) (Standar Keamanan Pangan Nasional Uji aberasi kromosom spermatogonia atau spermatosit pada tikus 2014 ). 50 tikus KM, berusia 7–10 minggu, 22–28 g, secara acak dimasukkan ke dalam lima kelompok (25 jantan dan 25 betina): tiga kelompok dosis dibentuk, yaitu masing-masing 5, 2,5, dan 1,25 g/kg bwt; pada saat yang sama, CMC 0,7% dan siklofosfamid (CYP) sebagai kelompok NC dan kelompok kontrol positif (PC). Tikus diberi 0,4 mL/10 g bwt dua kali dengan metode uji 30 jam dengan interval 24 jam, kemudian dikorbankan 6 jam setelah pemberian terakhir; sumsum tulang femoralis diambil, dan forsep hemostatik digunakan untuk mengeluarkan sumsum tulang. Setelah dicampur dengan serum anak sapi, apusan difiksasi dan diwarnai dengan Giemsa. Ketika sampel sumsum tulang setiap hewan dianalisis, setidaknya 200 sel darah merah (RBC) sumsum tulang diamati, dan persentase eritrosit polikromatik (PCE) terhadap total RBC dihitung. 2000 PCE setiap tikus dihitung di bawah lensa minyak, dan laju mikronukleus dihitung dengan membagi jumlah sel yang mengandung mikronukleus dengan jumlah PCE dan mengalikannya dengan 1000.

2.6.3 Uji Aberasi Kromosom Spermatosit Tikus
Protokol penelitian dilakukan pada tikus jantan sesuai dengan Standar Keamanan Pangan Nasional Uji aberasi kromosom spermatosit tikus (Komite Administrasi Standardisasi Nasional, Tiongkok, GB 15193.8–2014) (Standar Keamanan Pangan Nasional Uji Aberasi Kromosom Spermatosit Tikus 2014 ). 25 tikus KM jantan, berusia 7–10 minggu dan berat 21–30 g, secara acak dimasukkan ke dalam lima kelompok (25 jantan): tiga kelompok dosis ditetapkan, yaitu masing-masing 5, 2,5, dan 1,25 g/kg bwt; pada saat yang sama, CMC 0,7% dan siklofosfamid (CYP) sebagai kelompok NC dan kelompok PC. Tikus dalam kelompok PC disuntik dengan siklofosfamid secara intraperitoneal.
Setiap kelompok dosis diberi suspensi DCL-TP oral sekali sehari selama 5 hari berturut-turut. Pada hari ke-13 setelah pemberian gavage oral terakhir, tikus dikorbankan 4 jam setelah injeksi intraperitoneal kolkisin 6 mg/kg bb. Testis pada kedua sisi diangkat, dengan perlakuan larutan hipotonik, kemudian tubulus seminiferus dipisahkan dengan hati-hati, dan larutan trisodium sitrat 1% ditiup dan didiamkan. Testis diambil, tubulus seminiferus diekstraksi kemudian ditiup dan didiamkan, difiksasi 2 kali dengan metanol, disentrifugasi, dihisap dan dikeluarkan cairan bening bagian atas, kemudian diteteskan pada slide air es, dikeringkan secara alami, dan diwarnai dengan Giemsa. Ketika sel-sel metafase diamati di bawah mikroskop minyak, 100 sel per hewan, 500 sel di setiap kelompok, kelainan dan jumlah aberasi struktur kromosom dihitung.
2.7 Studi Toksisitas Oral 28 Hari
Desain eksperimen studi toksisitas oral 28 hari, 40 tikus SD dialokasikan secara acak ke dalam empat kelompok (20 per jenis kelamin). Protokol studi dilakukan pada tikus dari kedua jenis kelamin sesuai dengan uji toksisitas oral 28 hari Standar Keamanan Pangan Nasional (Komite Administrasi Standardisasi Nasional, Tiongkok, GB 15193.22–2014) (Uji Toksisitas Oral 28 Hari Standar Keamanan Pangan Nasional 2014 ). Dosis DCL-TP (0,625, 1,25, dan 2,5 g/kg bwt) dan 0,7% CMC (digunakan sebagai kontrol) diberikan melalui gavage oral sekali sehari selama 28 hari berturut-turut.
Selama percobaan, semua tikus dibiarkan minum dengan bebas. Perilaku, aktivitas umum, tanda dan gejala toksisitas, serta kematian tikus diamati secara teratur setiap hari. Berat badan tikus dan total asupan makanan per kandang yang diukur setiap hari Kamis dan Minggu dinyatakan dalam rasio pemanfaatan makanan total per kandang, yang dihitung dengan membagi total pertambahan berat badan per kandang per minggu dengan total asupan makanan mingguan per kandang dan dikalikan dengan 100.

Pada akhir percobaan, urin rutin menggunakan Automatic Urine Analyzer (Model Mindray AVE752 Aiwei Technology Co. Ltd., Chin): glukosa urin (GLU), protein urin (PRO), darah samar urin (BLD), alkalinitas asam urat (pH), dan berat jenis urin (SG) diukur dalam urin tikus selama 12 jam. Selama 16 jam puasa tetapi dibiarkan minum, tikus dibius. Sampel darah diambil dari aorta perut untuk menentukan indikator hematologi menggunakan Penganalisis Haemotologi Otomatis (Model MindrayBC-680, Shenzhen Mindray Biomedical Co. Ltd., Cina): sel darah merah, sel darah putih (WBC), hemoglobin (HGB), persentase neutrofil (NEU-R), persentase limfosit (LYM-R), trombosit (PLT), hematokrit (HCT), dan indikator biokimia darah menggunakan Penganalisis Biokimia Otomatis (Model MindrayBS-2200 M, Shenzhen Mindray Biomedical Co. Ltd., Cina): alanine aminotransferase (ALT), aspartate aminotransferase (AST), urea (Urea), kreatinin (Crea), glukosa darah (Glu), kolesterol total (TC), trigliserida (TG), dan asam urat (UA). Selanjutnya dilakukan pencatatan perubahan pada organ-organ utama seperti hati, jantung, limpa dan ginjal. Perhitungan koefisien organ dilakukan dengan cara membagi berat basah organ dengan berat tubuh dikalikan 100. Selanjutnya hati dan ginjal difiksasi dalam paraformaldehida 4% untuk pewarnaan HE dan pencatatan perubahan patologisnya.
![]()
2.8 Analisis Statistik
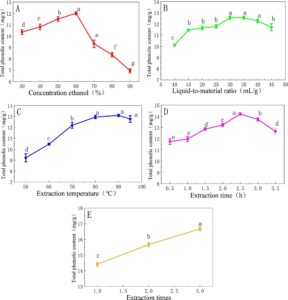
Semua nilai yang diperoleh dalam penelitian ini dinyatakan dalam mean ± SD (standard error of the mean). Data hasil pengukuran sesuai dengan distribusi normal, dan homogenitas varians dianalisis dengan one-way analysis of variance (ANOVA). Uji LSD digunakan untuk perbandingan ganda post hoc. Uji T sampel independen digunakan untuk perbandingan antara dua sampel. Uji jumlah peringkat nonparametrik (Mann–Whitney U) atau uji distribusi binomial digunakan untuk data yang tidak memenuhi syarat. Hasil nilai probabilitas dengan ( p < 0,05) dianggap sebagai perbedaan yang signifikan. 3 Hasil 3.1 Hasil Pemeriksaan Faktor Tunggal dan Percobaan Ortogonal Pada Gambar 1A , tren ekstraksi DCL-TP pertama kali meningkat dan kemudian menurun. Ketika konsentrasi etanol 60%, total ekstraksi fenol adalah yang tertinggi. Pada Gambar 1B , jumlah ekstraksi DCL-TP meningkat terlebih dahulu dan kemudian cenderung stabil dan terakhir menurun dalam kisaran 10–45 mL/g. Pada 35 mL/g, jumlah ekstraksi DCL-TP adalah yang tertinggi. Tidak ada perbedaan yang signifikan dalam jumlah ekstraksi DCL-TP antara 30 dan 40 mL/g ( p > 0,05). Suhu ekstraksi dapat dilihat dari Gambar 1C , tren ekstraksi DCL-TP pertama kali meningkat dan kemudian menurun dalam kisaran 50°C–95°C. Jumlah ekstraksi total fenol adalah yang tertinggi pada 90°C ( p > 0,05). Waktu ekstraksi ditunjukkan pada Gambar 1D . Jumlah ekstraksi DCL-TP meningkat terlebih dahulu dan kemudian menurun dalam kisaran 0,5–3,5 jam, dan DCL-TP tertinggi pada 2,5 jam. Pengaruh waktu ekstraksi Pada Gambar 1E , dapat dilihat bahwa jumlah ekstraksi DCL-TP meningkat secara bertahap dengan peningkatan waktu ekstraksi. Peningkatan waktu ekstraksi dapat meningkatkan jumlah DCL-TP.
Berdasarkan percobaan faktor tunggal, ekstraksi DCL-TP dilakukan menurut desain uji ortogonal L 18 (3 7 ). Hasilnya ditunjukkan pada Tabel 3 , dan analisis varians ditunjukkan pada Tabel 4 .
| Nomor tes | A (%) | B (ml/gram) | Suhu (°C) | D (h) | Bahasa Inggris | Jumlah ekstraksi |
|---|---|---|---|---|---|---|
| Konsentrasi etanol | Rasio cairan terhadap material | Suhu | Waktu | Waktu | (mg/gram) | |
| 1 | 1 | 1 | 1 | 1 | 1 | 13.53 |
| 2 | 1 | 2 | 2 | 2 | 2 | 16.73 |
| 3 | 1 | 3 | 3 | 3 | 3 | tanggal 18.17 |
| 4 | 2 | 1 | 1 | 2 | 2 | 14.60 |
| 5 | 2 | 2 | 2 | 3 | 3 | tanggal 17.07 |
| 6 | 2 | 3 | 3 | 1 | 1 | tanggal 14.02 |
| 7 | 3 | 1 | 2 | 1 | 3 | 15.49 |
| 8 | 3 | 2 | 3 | 2 | 1 | 12.96 |
| 9 | 3 | 3 | 1 | 3 | 2 | tanggal 14.23 |
| 10 | 1 | 1 | 3 | 3 | 2 | tanggal 17.07 |
| 11 | 1 | 2 | 1 | 1 | 3 | tanggal 16.09 |
| 12 | 1 | 3 | 2 | 2 | 1 | 15.59 |
| 13 | 2 | 1 | 2 | 3 | 1 | 14.44 |
| 14 | 2 | 2 | 3 | 1 | 2 | tanggal 16.06 |
| 15 | 2 | 3 | 1 | 2 | 3 | 15.54 |
| 16 | 3 | 1 | 3 | 2 | 3 | 16.50 |
| 17 | 3 | 2 | 1 | 3 | 1 | Jam 12.00 |
| 18 | 3 | 3 | 2 | 1 | 2 | 15.65 |
| K1 | tanggal 16.19 | 15.27 | 14.33 | Tanggal 15.14 | 13.76 | / |
| K2 | Tanggal 15.29 | pukul 15.15 | 15.83 | 15.32 | 15.72 | / |
| K3 | 14.47 | 15.53 | 15.80 | 15.50 | 16.48 | / |
| R | 1.72 | 0.38 | 1.5 | 0.36 | 2.72 | / |
| Faktor | SST | DF | MS | F | P |
|---|---|---|---|---|---|
| A | 8.935 | 2 | 4.468 | 40.160 | < 0,05 |
| B | 0.457 | 2 | 0.229 | 2.054 | > 0,05 |
| C | 8.774 | 2 | 4.387 | 39.437 | < 0,05 |
| D | 0.382 | 2 | 0.191 | 1.715 | > 0,05 |
| Bahasa Inggris | 23.667 | 2 | 11.834 | 106.374 | < 0,05 |
| Kesalahan | 0,779 tahun | 7 | 0.111 | 1 |
Catatan: F0,05(2,7) = 4,74.
Proses ekstraksi refluks pemanasan DCL-TP dioptimalkan dengan eksperimen ortogonal. Proses ekstraksi refluks pemanasan optimum adalah sebagai berikut: konsentrasi etanol 50%, rasio cairan-padat 30 mL/g, suhu 90°C, waktu 120 menit, 2 kali. Jumlah ekstraksi rata-rata DCL-TP adalah 15,63 mg/g, dan RSD adalah 1,15%.
3.2 Parameter Pemurnian DCL-TP
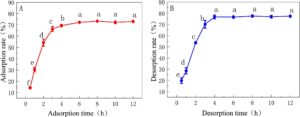
Kinetika adsorpsi resin HPD-600 pada DCL-TP ditunjukkan pada Gambar 2A , yang menunjukkan bahwa laju adsorpsi resin HPD-600 pada DCL-TP, tren ekstraksi DCL-TP, pertama kali meningkat kemudian stabil dan mencapai kesetimbangan adsorpsi dalam 6 jam; oleh karena itu, pemilihan waktu adsorpsi statis adalah 6 jam, dan laju adsorpsi dapat mencapai 72,27%. Pada Gambar 2B , laju desorpsi resin HPD-600 pada DCL-TP meningkat paling cepat dalam 4 jam, cenderung stabil setelah 4 jam, dan pada dasarnya mencapai kesetimbangan resolusi, sehingga pemilihan waktu resolusi adalah 4 jam, dan laju resolusi dapat mencapai 76,74%.
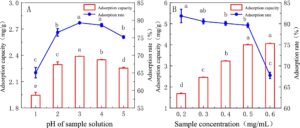
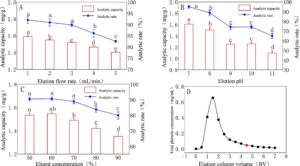
Pengaruh pH larutan sampel terhadap adsorpsi statis ditunjukkan pada Gambar 3A . Dengan peningkatan pH larutan sampel, kapasitas adsorpsi dan laju adsorpsi meningkat terlebih dahulu kemudian menurun, dan kapasitas adsorpsi terbesar pada pH = 3 ( p < 0,05). Pengaruh konsentrasi sampel terhadap adsorpsi statis ditunjukkan pada Gambar 3B . Dengan peningkatan konsentrasi sampel, kapasitas adsorpsi meningkat secara bertahap, tetapi ketika konsentrasi sampel 0,5–0,6 mg/mL, kapasitas adsorpsi cenderung stabil, dan laju adsorpsi menurun secara signifikan dengan peningkatan konsentrasi ( p < 0,05). Untuk menghindari kebocoran berlebihan dan pemborosan bahan baku, konsentrasi sampel optimum adalah 0,5 mg/mL.
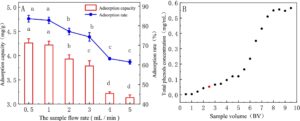
Parameter dinamis (laju alir sampel) pada Gambar 4A menunjukkan bahwa kapasitas adsorpsi dan laju adsorpsi DCL-TP menurun dengan peningkatan laju alir sampel tetapi dalam kisaran 0,5–1 mL/menit ( p > 0,05). Efek volume sampel pada efek adsorpsi dinamis ditunjukkan pada Gambar 4B , yang melihat konsentrasi total fenol cenderung stabil setelah 8BV. Ketika 2,5 BV, konsentrasi total fenol mendekati 1/10 dari konsentrasi larutan sampel, yang menunjukkan bahwa resin HPD-600 pada dasarnya telah mencapai saturasi adsorpsi larutan total fenol. Untuk menghemat biaya material, 2,5 BV dipilih sebagai volume sampel terbaik.
Hasil laju alir elusi ditunjukkan pada Gambar 5A , dengan peningkatan laju alir elusi, jumlah desorpsi menurun secara signifikan ( p < 0,05), dan laju alir resolusi optimal adalah 1 mL/menit. pH elusi ditunjukkan pada Gambar 5B . Jumlah dan laju desorpsi menurun secara signifikan dengan peningkatan pH ( p < 0,05); oleh karena itu, pH elusi dipilih sebesar 7. Menurut Gambar 5C , jumlah desorpsi dan laju resolusi tertinggi ketika konsentrasi eluen adalah 60% ( p < 0,05). Pada Gambar 5D , ketika efluen adalah 1,5 BV, konsentrasi total fenol mencapai maksimum, dan kemudian secara bertahap menurun. Ketika efluen adalah 7 BV, total fenol pada dasarnya terurai. Namun, dengan mempertimbangkan biaya dan waktu eluen, efisiensi elusi ditingkatkan, sehingga 4,5 BV dipilih sebagai volume elusi.
Berdasarkan hasil parameter pemurnian di atas, proses optimum untuk pemurnian DCL-TP dengan resin HPD-600 ditentukan sebagai berikut: konsentrasi larutan sampel 0,5 mg/mL, pH larutan sampel 3, volume sampel 2,5 BV, laju alir sampel 1 mL/menit, konsentrasi elusi etanol 60%, pH elusi 7, laju alir elusi 1 mL/menit, dan eluen terkumpul 4,5 BV. Tiga batch uji verifikasi dilakukan. Kemurnian rata-rata DCL-TP 26,40%, RSD 1,7%, dan kemurnian DCL-TP meningkat dari 12,51% menjadi 26,40%. Hal ini menunjukkan bahwa proses pemurnian stabil dan wajar.
3.3 Identifikasi DCL-TP
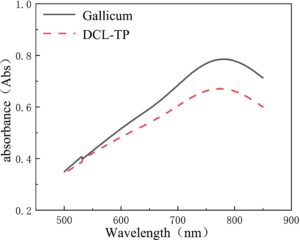
Zhang, Shi, dan Yang ( 2017 ) mengeksplorasi kondisi optimum untuk penentuan kandungan DCL-TP dengan metode Folin-Ciocalteu: reaksi warna dilakukan pada suhu 40°C selama 20 menit, dan absorbansi diukur pada 778 nm (Gambar 6 ). Pada kondisi ini, persamaan liniernya adalah: Y = 0,1223X + 0,0110, r = 0,9997 (Gambar 7 ). Ketika konsentrasi asam galat berada pada kisaran 1,276–8,932 mg/L, terdapat hubungan linier yang baik antara absorbansi dan konsentrasi. Zhang dkk. ( 2016 ) mengoptimalkan kondisi penentuan metode kolorimetri Folin-Ciocalteu, dan menentukan kandungan DCL-TP sebesar 15,79 mg/g (dihitung dengan asam galat).
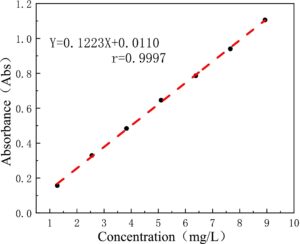
Pada uji presisi, nilai absorbansi adalah 0,644, 0,644, 0,646, 0,646, 0,646, 0,646, dan 0,644. Nilai rata-rata adalah 0,645, dan nilai RSD adalah 0,17% ( n = 6), yang menunjukkan bahwa presisi instrumen baik. Pada uji pengulangan, hasil ekstraksi DCL-TP adalah 15,85, 15,75, 16,29, 15,82, 15,46, dan 15,60 mg/g, nilai rata-rata adalah 15,79 mg/g, dan nilai RSD adalah 1,78% ( n = 6), yang menunjukkan bahwa metode tersebut memiliki pengulangan yang baik. Pada uji stabilitas, ekstrak diukur setiap 15 menit. Hasilnya adalah 15,85, 15,95, 16,05, 16,18, 16,28, 16,54, 16,49, 16,54 mg/g, nilai rata-ratanya adalah 16,19 mg/g, dan nilai RSD-nya adalah 1,61% ( n =7), yang menunjukkan bahwa larutan uji stabil dalam waktu 90 menit. Hasil uji perolehan kembali ditunjukkan pada Tabel 5 , dengan nilai rata-rata 97,61% dan nilai RSD 2,30% ( n =6), yang menunjukkan bahwa laju perolehan kembali metode ini baik.
| Volume sampel (g) | Volume asli (mg) | Menambahkan volume (mg) | Volume terukur (mg) | Tingkat pemulihan (%) | Berarti (%) | RSD (%) |
|---|---|---|---|---|---|---|
| 0.5011 | 7.83 | 7.82 | 15.64 | 99.82 | 97.61 | Jam 2.30 |
| 0,5044 tahun | 7.88 | 7.89 | 15.64 | 98.28 | ||
| 0.5019 | 7.84 | 7.85 | 15.33 | 95.37 | ||
| 0.5028 | 7.86 | 7.80 | 15.38 | 96.46 | ||
| 0,5087 tahun | 7.95 | 7.96 | 15.54 | 95.28 | ||
| 0,5051 tahun | 7.89 | 7.91 | 15.84 | 100.47 |
3.4 Studi Toksisitas Akut
Dalam studi toksisitas akut, tidak ada hewan yang mati dalam kelompok dosis 10 g/kg bwt. Selama periode pengamatan 14 hari, tidak ada gejala toksisitas dan kematian yang diamati pada hewan. Oleh karena itu, LD 50 tikus > 10 g/kg bwt. Menurut Tabel 6 , dosis 10 g/kg bwt pada tikus setara dengan dosis 7 g/kg bwt pada tikus 200 g, yang termasuk dalam tingkat tidak beracun sebenarnya menurut standar Tabel 7 .
| Koefisien konversi W | Sejenis hewan manusia | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tikus 0,02 kg | Tikus 0,2 kg | Marmut 0,4 kg | Kelinci 1,5 kg | Kucing 2,0 kg | Anjing 12 kg | Dewasa 60 kg | |||
| B jenis hewan manusia | Mouse | 0,02 kg | 1.0 | 1.6 | 1.4 | 2.7 | 3.2 | 4.8 | 9.01 |
| Tikus | 0,2 kg | 0.7 | 1.0 | 1.14 | 1.88 | 2.3 | 3.6 | 6.25 | |
| Marmot | 0,4 kg | 0.61 | 0,87 | 1.0 | 1.65 | 2.05 | 3.0 | 5.55 | |
| Kelinci | 1,5 kg | 0.37 | 0.52 | 0.6 | 1.0 | 1.23 | 1.76 | Jam 2.30 | |
| Kucing | 2,0 kg | 0.30 | 0.42 | 0.48 | 0.81 | 1.0 | 1.44 | 2.70 | |
| Anjing | 12 kg | 0.21 | 0.28 | 0.34 | 0.56 | 0,07 | 1.0 | 1.88 | |
| Dewasa | 60 kg | 0.11 | 0.16 | 0.18 | 0.30 | 0.37 | 0.53 | 1.0 | |
| Standar | LD50 oral tikus (mg/kg) | Setara dengan dosis mematikan bagi manusia | |
|---|---|---|---|
| (mg/kg) | (g/orang) | ||
| Sangat beracun | < 1 | Sedikit rasa | 0,05 |
| Beracun | 1 ~ 50 | 500 ~ 4000 | 0.5 |
| Toksisitas sedang | 51 ~ 500 | 4000 ~ 30.000 | 5 |
| Toksisitas rendah | 501 ~ 5000 | 30.000 ~ 250.000 | 50 |
| Tidak beracun | > 5000 | 250.000 ~ 500.000 | 500 |
Selama percobaan, berat tikus di setiap kelompok meningkat sampai batas tertentu. Pertambahan berat tikus ditunjukkan pada Tabel 8. Pertambahan berat tikus jantan lebih tinggi daripada tikus betina. Koefisien organ tikus ditunjukkan pada Tabel 9. Koefisien organ hati, jantung, dan limpa tikus jantan tidak berbeda secara statistik dari tikus betina ( p > 0,05), dan koefisien organ ginjal jantan secara statistik berbeda dari tikus betina ( p < 0,05), yang sejalan dengan pertumbuhan dan perkembangan normal tikus. Demikian pula, tidak ada patologi signifikan yang diamati di semua organ dalam kisaran dosis 10 g/kg bwt.
| Kelompok | D 0 berat (g) | Berat D 7 (g) | Berat D 14 (g) | Total keuntungan (g) |
|---|---|---|---|---|
| Perempuan | 20,9 ± 1,1 | 26. ± 1,3 | 35,9 ± 2,1 | 15,0 ± 1,8 |
| Pria | 21,6 ± 2,0 | 28,8 ± 2,5 | 41,5 ± 3,3 | 19,8 ± 3,3 |
| Kelompok | Hati (%) | Jantung (%) | Limpa (%) | Ginjal (%) |
|---|---|---|---|---|
| Perempuan | 5,10 ± 0,25 | 0,51 ± 0,06 | 0,39 ± 0,07 | 1,13 ± 0,09 |
| Pria | 5,30 ± 0,37 | 0,51 ± 0,05 | 0,35 ± 0,04 | 1,44 ± 0,20* |
Catatan: Perbandingan dengan kelompok perempuan, * p < 0,05, ** p < 0,01.
3.5 Uji Mutasi Balik Bakteri
Jumlah strain TA97a, TA98, TA100, WP2uvrA (pKM101), dan TA1535 dicatat dalam Tabel 10 , 11. Jumlah koloni terbalik pada setiap kelompok PC lebih dari 2 kali lipat dari kelompok NC, dan terdapat perbedaan yang signifikan ( p < 0,01), yang menunjukkan bahwa kondisi uji stabil dan hasilnya kredibel. Jumlah rata-rata koloni terbalik pada setiap kelompok dosis DCL-TP tidak lebih dari 2 kali lipat dari kelompok TA97A, TA98 dan TA100 WP2uvrA (pKM101) SC, dan tidak lebih dari 3 kali lipat dari kelompok TA1535 SC ( p > 0,05). Dalam kasus berbagai konsentrasi DCL-TP dengan atau tanpa S9, jumlah koloni terbalik pada setiap kelompok dosis galur TA97a, TA98, dan TA1535 tidak berbeda secara signifikan dari yang ada pada kelompok SC ( p > 0,05), dan tidak ada hubungan dosis-respons. Namun, jumlah koloni terbalik galur TA100 dan WP2uvrA (pKM101) pada kelompok dosis tinggi (5000 μg/plat) secara signifikan lebih rendah daripada yang ada pada kelompok SC ( p < 0,05).
| Kelompok | Dosis | TA97a | TA98 | TA100 | WP2uvrA (pKM101) | TA1535 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| (μg/piring) | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | |
| Kontrol | angka 0 | 110,7 ± 14,0 | 104,0 ± 12,8 | 26,3 ± 3,2 | 32,3 ± 6,7 | 126,7 ± 4,6 | 152,0 ± 4,0 | 126,3 ± 22,9 | 140,0 ± 14,0 | 13,0 ± 3,0 | 12,7 ± 1,2 |
| DMSO | angka 0 | 112,7 ± 16,3 | 95,3 ± 7,6 | 25,3 ± 2,1 | 33,3 ± 8,4 | 116,3 ± 8,5 | 150,0 ± 8,7 | 130,0 ± 6,0 | 140,3 ± 11,0 | 11,0 ± 1,0 | 12,0 ± 1,0 |
| DCL-TP | 50 | 139,0 ± 20,8 | 105,3 ± 5,8 | 34,0 ± 4,4 | 43,3 ± 8,0 | 126,7 ± 10,1 | 158,0 ± 10,4 | 138,3 ± 6,8 | 151,0 ± 20,1 | 12,3 ± 0,6 | 13,0 ± 1,7 |
| 158 | 131,3 ± 32 | 143,3 ± 33,0 | 32,3 ± 8,0 | 44,3 ± 3,5 | 147,3 ± 13,3 | 166,7 ± 17,5 | 136,3 ± 10,1 | 157,0 ± 9,8 | 14,3 ± 2,9 | 15,3 ± 1,2 | |
| 500 | 129,3 ± 18,5 | 123,7 ± 22,8 | 26,7 ± 5,8 | 37,7 ± 7,2 | 126,0 ± 9,5 | 179,3 ± 12,1 | 141,0 ± 18,2 | 148,0 ± 17,4 | 13,3 ± 2,9 | 14,3 ± 2,9 | |
| tahun 1580 | 141,3 ± 16,3 | 108,3 ± 12,5 | 28,7 ± 9,6 | 38,0 ± 9,2 | 122,0 ± 14,0 | 151,0 ± 7,5 | 131,0 ± 16,6 | 138,0 ± 13,0 | 16,0 ± 1,0 | 14,7 ± 2,5 | |
| 5000 | 128,0 ± 28,8 | 115,3 ± 14,4 | 29,3 ± 2,1 | 37,7 ± 6,4 | 89,7 ± 8,7 # | 120,3 ± 8,1 # | 103,7 ± 25,7 # | 121,3 ± 18,9 # | 12,7 ± 2,3 | 13,3 ± 0,6 | |
| Dekson | 50 | 1891,3 ± 167,7 ** | 976,7 ± 122,2** | ||||||||
| 2-aminofluorena | 20 | 1549,0 ± 165,2** | 3993,0 ± 321,1** | 1068,3 ± 328,1** | |||||||
| Metil metansulfonat | 1 mikroliter | 881,7 ± 46,8** | 935,7 ± 213,0** | ||||||||
| 2-Aminoantrasena | 2 | 450,7 ± 118,0** | 584,0 ± 122,9** | ||||||||
| Natrium azida | 1.5 | 743,7 ± 95,5** | |||||||||
Catatan: Dibandingkan dengan kelompok negatif, * p < 0,05, ** p < 0,01; dibandingkan dengan kelompok pelarut, # p < 0,05, ## p < 0,01.
| Kelompok | Dosis | TA97a | TA98 | TA100 | WP2uvrA (pKM101) | TA1535 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| (μg/ piring) | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | -S9 | +S9 | |
| Kontrol | angka 0 | 116,3 ± 9,7 | 116,7 ± 9,5 | 23,7 ± 2,3 | 33,3 ± 4,5 | 138,0 ± 9,2 | 146,0 ± 15,6 | 143,7 ± 20,7 | 152,0 ± 19,1 | 11,7 ± 2,3 | 13,0 ± 2,0 |
| DMSO | angka 0 | 112,0 ± 10,6 | 111,3 ± 10,3 | 23,3 ± 2,3 | 27,0 ± 1,0 | 134,0 ± 7,2 | 143,3 ± 15,3 | 137,7 ± 13,1 | 145,7 ± 17,8 | 10,3 ± 2,1 | 11,0 ± 1,0 |
| DCL-TP | 8 | 127,3 ± 13,3 | 113,7 ± 10,6 | 23,7 ± 2,1 | 26,7 ± 3,1 | 136,3 ± 5,7 | 149,3 ± 16,2 | 140,7 ± 8,1 | 140,0 ± 19,1 | 11,3 ± 1,5 | 12,7 ± 2,1 |
| 40 | 120,0 ± 5,3 | 138,7 ± 12,2 | 25,7 ± 2,1 | 34,7 ± 11,9 | 156,0 ± 21,2 | 168,7 ± 21,5 | 143,3 ± 15,3 | 157,3 ± 15,1 | 13,7 ± 2,5 | 13,3 ± 0,6 | |
| 200 | 136,3 ± 11,0 | 143,7 ± 4,5 | 24,7 ± 5,0 | 36,3 ± 8,5 | 148,7 ± 4,7 | 168,0 ± 17,1 | 159,3 ± 24,2 | 166,0 ± 28,0 | 12,7 ± 1,2 | 13,3 ± 3,2 | |
| 1000 | 152,7 ± 13,3 | 148,0 ± 23,1 | 30,3 ± 3,2 | 36,7 ± 3,8 | 134,7 ± 9,5 | 148,7 ± 7,6 | 146,7 ± 18,0 | 148,0 ± 18,1 | 15,0 ± 2,0 | 16,3 ± 2,3 | |
| 5000 | 139,3 ± 12,1 | 135,0 ± 7,9 | 33,0 ± 5,2 | 34,7 ± 4,9 | 115,7 ± 10,0# | 122,3 ± 8,3# | 114,0 ± 15,7# | 124,0 ± 10,0# | 13,3 ± 2,3 | 15,0 ± 2,0 | |
| Dekson | 50 | 2168,0 ± 373,9** | 1107,3 ± 63,1** | ||||||||
| 2-Aminofluoren | 20 | 1483,7 ± 99,7** | 4219,3 ± 114,3** | 1226,3 ± 229,1** | |||||||
| Metil metansulfonat | 1 mikroliter | 881,7 ± 46,8** | 1061,7 ± 102,7** | ||||||||
| 2-Aminoantrasena | 2 | 492,0 ± 65,2** | 529,0 ± 62,3** | ||||||||
| Natrium azida | 1.5 | 938,7 ± 105,3** | |||||||||
Catatan: Dibandingkan dengan kelompok negatif, * p < 0,05, ** p < 0,01; dibandingkan dengan kelompok pelarut, # p < 0,05, ## p < 0,01.
3.6 Uji Mikronukleus Eritrosit Mamalia
Nilai PCE/RBC tikus betina dan jantan yang diobati dengan DCL-TP pada kelompok dosis 1,25, 2,5, dan 5 g/kg bwt, 20% lebih tinggi daripada kelompok NC. Efek DCL-TP pada laju mikronukleus sumsum tulang tikus ditunjukkan pada Tabel 12. Tidak ada perbedaan signifikan dalam laju mikronukleus antara kelompok dosis jantan dan betina yang diobati dengan DCL-TP dan kelompok NC ( p > 0,05). Laju mikronukleus kelompok PC jantan dan betina yang diobati dengan CYP secara signifikan lebih tinggi daripada kelompok NC ( p < 0,01), yang menunjukkan bahwa DCL-TP tidak memiliki efek mutagenik pada laju mikronukleus sel sumsum tulang tikus.
| Kelompok | Mengandung mikronukleus PCE ( N ) | Jumlah PCE | Frekuensi mikronukleus | PCE/RBC |
|---|---|---|---|---|
| ( N ) | (‰) | (%) | ||
| Perempuan | ||||
| Kontrol | 29 | 10.000 | 2,9 ± 0,7 | 53,3 ± 0,8 |
| Siklofosfamid | 36 | 10.000 | 3,6 ± 0,4 | 51,4 ± 0,4 |
| 1,25 g/kg berat badan | 31 | 10.000 | 3,1 ± 0,2 | 51,8 ± 0,6 |
| 2,50 g/kg berat badan | 37 | 10.000 | 3,7 ± 0,6 | 50,2 ± 0,6 |
| 5 g/kg berat badan | 198 | 10.000 | 19,8 ± 0,9 ** | 48,4 ± 0,4 |
| Pria | ||||
| Kontrol | 32 | 10.000 | 3,2 ± 0,8 | 52,9 ± 0,8 |
| Siklofosfamid | 35 | 10.000 | 3,5 ± 0,5 | 52,0 ± 0,5 |
| 1,25 g/kg berat badan | 31 | 10.000 | 3,1 ± 0,2 | 52,0 ± 0,8 |
| 2,50 g/kg berat badan | 36 | 10.000 | 3,6 ± 0,7 | 51,3 ± 0,3 |
| 5 g/kg berat badan | 196 | 10.000 | 19,6 ± 1,0 ** | 48,2 ± 0,6 |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
3.7 Uji Aberasi Kromosom Spermatosit Tikus
Pengaruh DCL-TP terhadap uji aberasi kromosom spermatosit pada mencit ditunjukkan pada Tabel 13. Tidak terdapat perbedaan bermakna laju sel aberasi antara kelompok yang diberi DCL-TP dengan kelompok negatif ( p > 0,05). Akan tetapi, laju sel aberasi pada kelompok yang diberi PC (CYP) secara bermakna lebih tinggi dibandingkan kelompok NC (p < 0,01), yang membuktikan bahwa DCL-TP tidak menimbulkan aberasi kromosom spermatosit pada mencit pada kisaran dosis 5 g/kg bbt.
| Kelompok | Aberasi struktural | Monovalen | Jumlah sel terdistorsi | Frekuensi sel distorsi | ||
|---|---|---|---|---|---|---|
| Fragmen | Menggantikan | Kromosom autosom | Kromosom seks | ( N ) | (%) | |
| Kontrol | 5 | angka 0 | 4 | 2 | 5 | 1 |
| Siklofosfamid | 4 | angka 0 | 5 | 3 | 4 | 0.8 |
| 1,25 g/kg berat badan | 5 | angka 0 | 6 | 2 | 5 | 1 |
| 2,50 g/kg berat badan | 7 | angka 0 | 5 | 3 | 7 | 1.4 |
| 5 g/kg berat badan | 37 | 2 | 43 | 9 | 39 | 7.8 ** |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
3.8 Studi Toksisitas Oral 28 Hari
3.8.1 Observasi Klinis, Berat Badan, dan Konsumsi Makanan Rata-rata
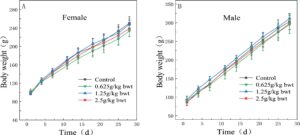
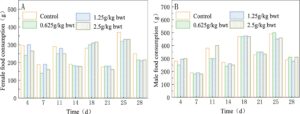
Selama periode pemberian dosis 28 hari, tidak ada hewan yang mati dan tidak ada perilaku abnormal atau tanda-tanda toksisitas yang nyata yang diamati pada tikus di setiap kelompok dosis. Dibandingkan dengan kelompok kontrol, tidak ada perbedaan yang signifikan secara statistik dalam hal air minum, makan, warna bulu, perilaku, feses, ekskresi urin, berat badan, total konsumsi makanan, dan total pemanfaatan makanan di setiap kelompok ( p > 0,05) (Gambar 8 , 9 , Tabel 14 ).
| Kelompok | Tingkat pemanfaatan total (%) | ||||
|---|---|---|---|---|---|
| D. 1 | Hari ke 14 | D 21 | Hari ke 28 | Berarti | |
| Perempuan | |||||
| Kontrol | 48.3 | 44.6 | 29.4 | 30.3 | 37.7 |
| 0,625 g/kg berat badan | 47.8 | 41.7 | 28.5 | 30.3 | 36.2 |
| 1,25 g/kg berat badan | 48.9 | 43.5 | 29.4 | 30.2 | 37.7 |
| 2,5 g/kg berat badan | 49.2 | 42.8 | 29.5 | 28.6 | 36.7 |
| Pria | |||||
| Kontrol | 52.1 | 47.4 | 35.7 | 31.5 | 40.2 |
| 0,625 g/kg berat badan | 47.0 | 50.6 | 34.6 | 31.5 | 39.0 |
| 1,25 g/kg berat badan | 55.1 | 51.6 | 35.2 | 33.2 | 41.8 |
| 2,5 g/kg berat badan | 51.6 | 44 | 33.8 | 32.9 | 39.1 |
3.8.2 Hematologi dan Biokimia Darah
Hasil analisis hematologi ditunjukkan pada Tabel Tambahan 15. Di akhir percobaan, tidak terdapat perbedaan signifikan pada indeks hematologi antara kelompok dosis tikus betina dan jantan yang diberi DCL-TP serta kelompok NC ( p > 0,05), yang menunjukkan bahwa DCL-TP tidak memberikan efek signifikan terhadap indeks hematologi utama tikus pada kisaran dosis 2,5 g/kg bwt.
| Kelompok | sel darah putih | BARU-R | LYM-R | Sel darah merah | HGB | HCT | PLT |
|---|---|---|---|---|---|---|---|
| (10 9 /liter) | (%) | (%) | (10 12 /liter) | (gram/liter) | (II) | (10 9 /liter) | |
| Perempuan | |||||||
| Kontrol | 5,66 ± 0,52 | 16,25 ± 2,53 | 81,10 ± 2,65 | 6,48 ± 0,22 | 144,50 ± 3,11 | 0,47 ± 0,00 | 900,25 ± 51,68 |
| 0,625 g/kg berat badan | 4,24 ± 2,07 | 13.30 ± 2.77 | 82,38 ± 2,32 | 6,95 ± 0,44 | 146,50 ± 11,15 | 0,46 ± 0,004 | 808,50 ± 124,74 |
| 1,25 g/kg berat badan | 6,71 ± 1,66 | 18,03 ± 5,74 | 77,43 ± 5,82 | 6,98 ± 0,25 | 148,50 ± 2,38 | 0,47 ± 0,01 | 744,25 ± 112,47 |
| 2,5 g/kg berat badan | 5,16 ± 1,79 | 20,15 ± 11,79 | 74,70 ± 12,15 | 6,99 ± 0,60 | 147,50 ± 12,45 | 0,47 ± 0,04 | 873,50 ± 119,83 |
| Pria | |||||||
| Kontrol | 6,39 ± 1,02 | 21,65 ± 3,30 | 74,75 ± 3,89 | 6,73 ± 0,27 | 141,75 ± 6,40 | 0,46 ± 0,03 | 846,25 ± 70,28 |
| 0,625 g/kg berat badan | 7,75 ± 0,64 | 15,55 ± 6,64 | 81,48 ± 6,47 | 7,02 ± 0,50 | 151,25 ± 4,27 | 0,48 ± 0,01 | 782,00 ± 152,84 |
| 1,25 g/kg berat badan | 5,33 ± 1,32 | 13.30 ± 1.24* | 81,78 ± 2,49 | 7,30 ± 0,55 | 151,75 ± 5,50 | 0,48 ± 0,01 | 678,75 ± 305,75 |
| 2,5 g/kg berat badan | 7,43 ± 2,08 | 16,93 ± 5,58 | 78,53 ± 6,27 | 7,02 ± 0,43 | 148,00 ± 10,68 | 0,47 ± 0,03 | 731,25 ± 192,53 |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
Hasil analisis kimia klinis ditunjukkan pada Tabel 16 , dan tidak ada perbedaan signifikan dalam indeks biokimia darah antara kelompok wanita yang diobati dengan DCL-TP dan kelompok NC ( p > 0,05). Dengan pengecualian indeks Crea pada pria dosis tinggi (5 g/kg bwt) yang lebih tinggi daripada kontrol ( p < 0,05), tidak ada perbedaan signifikan dalam hasil indeks biokimia darah lainnya pada kelompok pria dan kelompok NC ( p > 0,05). Namun, perbedaan ini dianggap tidak berarti karena berada dalam rentang normal yang sesuai dan perbedaan rata-rata hanya 4,3 μmol/L (Xiao et al. 2021 ).
| Kelompok | ALT | Bahasa Inggris | Urea | Universitas Negeri Amerika | Menciptakan | TC | Tg | GLU |
|---|---|---|---|---|---|---|---|---|
| (U/L) | (U/L) | Jumlah mol/liter | Jumlah mol/liter | Jumlah mol/liter | Jumlah mol/liter | Jumlah mol/liter | Jumlah mol/liter | |
| Perempuan | ||||||||
| Kontrol | 43,13 ± 16,36 | 171,30 ± 56,80 | 6,08 ± 2,12 | 153,58 ± 17,49 | 23,13 ± 11,70 | 1,81 ± 0,15 | 0,37 ± 0,14 | 6,26 ± 0,80 |
| 0,625 g/kg berat badan | 37,63 ± 14,74 | 138,03 ± 47,59 | 7,09 ± 1,25 | 142,48 ± 10,24 | 29,90 ± 10,62 | 2,04 ± 0,56 | 0,34 ± 0,17 | 6,16 ± 1,10 |
| 1,25 g/kg berat badan | 33,85 ± 11,66 | 120,95 ± 25,81 | 8,14 ± 1,11 | 139,85 ± 29,15 | 33,75 ± 4,71 | 1,92 ± 0,31 | 0,25 ± 0,04 | 6,58 ± 0,41 |
| 2,5 g/kg berat badan | 27,38 ± 1,85 | 116,73 ± 24,79 | 6,86 ± 1,27 | 148,55 ± 10,28 | 28,50 ± 3,65 | 1,77 ± 0,32 | 0,29 ± 0,08 | 7,28 ± 0,75 |
| Pria | ||||||||
| Kontrol | 41,60 ± 5,18 | 148,75 ± 41,50 | 6,36 ± 1,27 | 137,20 ± 31,71 | 24,85 ± 3,14 | 2,35 ± 0,33 | 0,69 ± 0,39 | 6,68 ± 0,80 |
| 0,625 g/kg berat badan | 38,28 ± 4,64 | 155,18 ± 28,88 | 5,86 ± 1,02 | 154,00 ± 36,71 | 21,70 ± 2,08 | 2,05 ± 0,60 | 0,50 ± 0,14 | 7,49 ± 1,29 |
| 1,25 g/kg berat badan | 43,48 ± 15,10 | 205,18 ± 45,03 | 6,91 ± 0,64 | 140,45 ± 30,62 | 22,73 ± 1,03 | 1,89 ± 0,38 | 0,60 ± 0,22 | 7,03 ± 1,02 |
| 2,5 g/kg berat badan | 37,20 ± 3,66 | 110,33 ± 9,18 | 6,19 ± 1,14 | 134,40 ± 11,37 | 29,15 ± 1,32* | 2,16 ± 0,14 | 0,58 ± 0,14 | 6,97 ± 0,85 |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
3.8.3 Koefisien Organ dan Temuan Makroskopik
Koefisien organ utama (hati, jantung, limpa, dan ginjal) ditunjukkan pada Tabel 17 , pada akhir percobaan, tidak terdapat perbedaan yang signifikan pada hasil koefisien organ utama pada setiap kelompok dosis yang diobati dengan DCL-TP dan kelompok kontrol negatif ( p > 0,05), yang menunjukkan bahwa DCL-TP tidak memiliki efek yang signifikan terhadap koefisien organ utama tikus dalam kisaran dosis 2,5 g/kg bwt selama 28 hari. Dalam pemeriksaan makroskopis, tidak ada tanda-tanda patologi makroskopis di semua kelompok.
| Kelompok | Koefisien hati (%) | Koefisien jantung (%) | Koefisien limpa (%) | Koefisien ginjal koefisien (%) |
|---|---|---|---|---|
| Perempuan | ||||
| Kontrol | 3,48 ± 0,17 | 0,41 ± 0,04 | 0,26 ± 0,01 | 0,94 ± 0,04 |
| 0,625 g/kg berat badan | 3,14 ± 0,19 | 0,40 ± 0,03 | 0,22 ± 0,02 | 0,83 ± 0,04 |
| 1,25 g/kg berat badan | 3,38 ± 0,60 | 0,40 ± 0,04 | 0,24 ± 0,06 | 0,83 ± 0,15 |
| 2,5 g/kg berat badan | 3,28 ± 0,31 | 0,37 ± 0,03 | 0,23 ± 0,01 | 0,83 ± 0,06 |
| Pria | ||||
| Kontrol | 3,08 ± 0,19 | 0,39 ± 0,04 | 0,21 ± 0,01 | 0,78 ± 0,01 |
| 0,625 g/kg berat badan | 3,19 ± 0,25 | 0,43 ± 0,07 | 0,24 ± 0,03 | 0,85 ± 0,07 |
| 1,25 g/kg berat badan | 3,03 ± 0,11 | 0,39 ± 0,04 | 0,20 ± 0,03 | 0,81 ± 0,06 |
| 2,5 g/kg berat badan | 2,86 ± 0,20 | 0,40 ± 0,04 | 0,21 ± 0,02 | 0,80 ± 0,03 |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
3.8.4 Urinalisis
Hasil urinalisis (glukosa urin, protein urin, darah samar urin, pH, dan SG urin) ditunjukkan pada Tabel 18 , dan tidak terdapat perbedaan bermakna hasil urinalisis pada kelompok dosis pria dan wanita dengan kelompok DCL-TP dan NC ( P > 0,05), yang menunjukkan DCL-TP tidak memberikan pengaruh bermakna terhadap indeks urin pada dosis tinggi 2,5 g/kg bbt.
| Indeks | Derajat | Betina ( N = 4) | Laki-laki ( N = 4) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Dosis (mg/kg berat badan) | Dosis (mg/kg berat badan) | ||||||||
| angka 0 | 625 | tahun 1250 | 2500 | angka 0 | 625 | tahun 1250 | 2500 | ||
| GLU | — | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 |
| + − | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| 1+ | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| 2+ | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| PRO | — | angka 0 | 4 | 4 | 4 | angka 0 | angka 0 | 4 | 4 |
| + − | 1 | angka 0 | angka 0 | angka 0 | 2 | 4 | angka 0 | angka 0 | |
| 1+ | 3 | angka 0 | angka 0 | angka 0 | 2 | angka 0 | angka 0 | angka 0 | |
| 2+ | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| BLD | — | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 |
| + − | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| 1+ | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| 2+ | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| SG | 1.000 | angka 0 | 4 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 |
| 1.005 | angka 0 | angka 0 | 4 | 4 | angka 0 | 4 | angka 0 | angka 0 | |
| 1.010 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | 4 | 3 | |
| 1.015 | 4 | angka 0 | angka 0 | angka 0 | 4 | angka 0 | angka 0 | 1 | |
| 1.020 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| Tingkat keasaman (pH) | 6.5 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 |
| 7.0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | angka 0 | |
| 7.5 | 3 | 4 | 4 | 4 | 4 | 3 | 4 | 4 | |
| 8.0 | 1 | angka 0 | angka 0 | angka 0 | angka 0 | 1 | angka 0 | angka 0 | |
Catatan: Perbandingan dengan kelompok negatif, * p < 0,05, ** p < 0,01.
3.8.5 Histopatologi
Pemeriksaan anatomi kasar pada organ vital (hati, ginjal, jantung, paru-paru, limpa, dan testis) dalam studi toksisitas oral 28 hari tidak menemukan adanya lesi patologis kasar dalam warna, morfologi, dan ukuran.
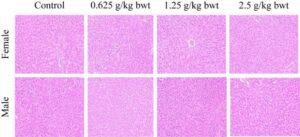
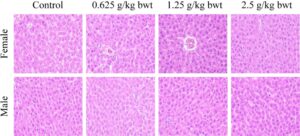
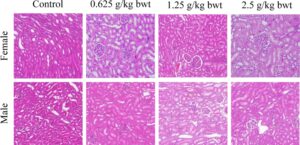
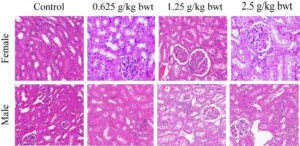
Hati dan ginjal merupakan organ penting untuk metabolisme dan transformasi total fenol pada tikus. Oleh karena itu, foto jaringan patologis hati dari tikus betina dan jantan untuk kelompok kontrol, dosis tinggi (2,5 g/kg bwt), dosis sedang (1,25 g/kg bwt), dan dosis rendah (0,625 g/kg bwt) ditunjukkan pada Gambar 10 , 11 . Potongan jaringan diwarnai dengan HE. Kemudian pada Biomikroskop (Model Mindray CX40; Ningbo Shunyu Intelligent Technology Co. Ltd., Tiongkok) sel-sel hati tersusun secara radial dengan teratur, setiap bagian lobulus terlihat jelas, tidak ada infiltrasi sel inflamasi yang jelas, struktur jaringan hati normal, nukleolus sel hati jernih, tidak ada akumulasi tetesan lipid yang jelas dalam sel-sel hati. Ginjal menunjukkan struktur morfologi normal di antara berbagai tingkat dosis, dan kontrol serta foto jaringan patologis ditunjukkan pada Gambar 12 , 13 . Struktur korteks dan jaringan medula ginjal normal saat diperiksa menggunakan biomikroskop. Tidak ditemukan kerusakan atau lesi pada glomerulus dan tubulus ginjal, dan tidak ada infiltrasi sel inflamasi yang jelas pada interstitium ginjal.