
Abstrak
Hipertensi merupakan faktor risiko utama berbagai penyakit dan menimbulkan ancaman signifikan terhadap kesehatan manusia. Enzim pengubah angiotensin-I (ACE) merupakan karboksipeptidase logam yang mengkatalisis konversi angiotensin I menjadi angiotensin II, yang meningkatkan hipertensi. Meskipun penghambat ACE efektif mengelola hipertensi, penggunaan jangka panjangnya dapat menyebabkan efek samping, sehingga memerlukan alternatif yang lebih aman. Peptida antihipertensi yang berasal dari makanan, terutama peptida pendek, menunjukkan potensi besar karena toksisitasnya yang rendah, bioaktivitasnya yang tinggi, dan penyerapannya yang baik, namun potensi terapeutiknya masih belum dieksplorasi. Dalam penelitian ini, kami menggunakan strategi penyaringan virtual untuk mengevaluasi secara sistematis semua kemungkinan tetrapeptida (160.000 sekuens) dan menganalisis interaksinya dengan ACE. Hasilnya mengungkapkan bahwa peptida yang mengandung Y, F, R, dan W merupakan asam amino karakteristik untuk penghambat ACE. Interaksi yang meliputi interaksi hidrofobik, ikatan hidrogen, jembatan garam, penumpukan pi–pi, dan kation pi semuanya berkontribusi pada pengikatan erat peptida ke ACE. Tujuh peptida (RWRW, FWRR, WWRR, YWRR, RWRF, RWRY, dan RWRR) disintesis untuk menentukan efek penghambatan ACE, sehingga memvalidasi metode penyaringan virtual. Hasil penelitian menunjukkan bahwa peptida ini memiliki aktivitas penghambatan ACE yang baik, dengan nilai IC50 berkisar antara 18,28 hingga 145,00 μM. Studi ini memberikan dukungan teoretis dan eksperimental untuk penyaringan dan pengembangan peptida alami.
1. PENDAHULUAN
Hipertensi merupakan faktor risiko utama untuk stroke, penyakit jantung iskemik, penyakit kardiovaskular lainnya, dan penyakit ginjal kronis, yang menyebabkan lebih dari 10 juta kematian di seluruh dunia setiap tahun. 1 Banyak bukti telah menunjukkan bahwa mengendalikan hipertensi secara signifikan terkait dengan penurunan kejadian dan mortalitas penyakit kardiovaskular. 2 Sistem renin-angiotensin (RAS) dan sistem kinin-kallikrein (KKS) merupakan faktor pengatur utama dalam pengendalian tekanan darah. Enzim pengubah angiotensin (ACE), dipeptidyl carboxypeptidase tipe I yang terikat membran, memainkan peran penting dalam RAS dengan mengkatalisis konversi angiotensin I yang tidak aktif menjadi angiotensin II, yang merupakan vasokonstriktor kuat. Di dalam KKS, ACE juga memetabolisme bradikinin, suatu vasodilator. 3 Angiotensinogen hati, setelah dihidrolisis oleh renin menjadi Ang I, memiliki residu asam amino C-terminal His-Leu yang dibelah oleh ACE untuk menghasilkan Ang II. Ang II meningkatkan tekanan darah dengan meningkatkan aktivitas sistem saraf simpatik, meningkatkan sekresi aldosteron, dan mendorong retensi garam. 4 Meskipun bradikinin KKS menginduksi vasodilatasi melalui pelepasan NO dan prostaglandin dari sel endotel, ACE dapat menghidrolisis bradikinin menjadi fragmen yang tidak aktif, yang selanjutnya meningkatkan tekanan darah. 5 Dengan demikian, menghambat ACE merupakan pendekatan berbasis gaya hidup utama untuk menurunkan tekanan darah.
ACE inhibitor seperti Captopril, Enalapril, Ramipril, Lisinopril, Tekturna, dan Rasilez banyak digunakan dalam pengobatan hipertensi. 6 Namun, penggunaan jangka panjang obat sintetis ini dikaitkan dengan berbagai efek samping, termasuk batuk kering, sakit kepala, pusing, pingsan, dan gangguan fungsi ginjal. 7 – 9 Akibatnya, peptida antihipertensi alami yang ada dalam makanan semakin dikenal karena keamanannya yang tinggi, bioaktivitas yang kuat, dan biayanya yang rendah. 10 Berbagai sumber makanan menyediakan peptida penghambat ACE. Peptida antihipertensi yang berasal dari hewan terutama ditemukan dalam susu, 11 telur, 12 daging kelinci, 13 dan ikan kerapu kuning, 14 sedangkan peptida yang berasal dari tumbuhan dapat ditemukan dalam kacang kedelai, 15 brokoli, 16 bawang putih, 17 dan nasi. 18 Mikroorganisme seperti Chlorella, 19 Spirulina, 20 dan ragi Max Krüger 21 juga merupakan sumber penting peptida antihipertensi. Peptida kecil, khususnya dipeptida, tripeptida, dan tetrapeptida, sangat diminati dalam penelitian karena ketahanannya terhadap pencernaan dan penyerapannya yang unggul ke dalam aliran darah. 22 , 23
Metode tradisional untuk memperoleh peptida bioaktif, termasuk pencernaan enzim, pemisahan dan pemurnian, sering kali memakan waktu, padat karya, dan dapat menyebabkan inaktivasi peptida karena stabilitas yang buruk selama pemrosesan. Penyaringan peptida bioaktif dengan bantuan komputer menunjukkan potensi yang besar. 24 Perluasan berkelanjutan dari basis data struktur protein (reseptor) dan molekul kecil (ligan), bersama dengan metode docking yang lebih akurat, kerangka docking reseptor-ligan yang efisien dan berthroughput tinggi, dan teknik simulasi molekuler yang kuat, telah sepenuhnya merevolusi bidang penemuan peptida bioaktif. 25 Perlu dicatat bahwa analisis mekanika kuantum/mekanik molekuler (QM/MM) dari kompleks ACE-peptida telah mengungkapkan bahwa tetrapeptida cukup untuk mengikat ACE secara efektif, dan bahwa menambahkan lebih banyak asam amino tidak secara signifikan meningkatkan afinitas pengikatan. 26 Temuan ini menyoroti potensi tetrapeptida antihipertensi untuk penyelidikan dan pengembangan lebih lanjut. Dalam penelitian ini, kami menerapkan strategi penyaringan virtual berbasis docking molekuler untuk mengevaluasi semua tetrapeptida (total 160.000 sekuens), menilai skor docking dan interaksinya dengan ACE. Analisis tersebut memberikan informasi terperinci tentang sekuens peptida, karakteristik ikatan, situs pengikatan utama, dan preferensi asam amino untuk pengikatan ACE. Berdasarkan temuan ini, kami melakukan uji penghambatan ACE in vitro untuk memvalidasi peptida yang diprediksi. Penelitian ini menawarkan panduan teoritis dan bukti eksperimental untuk penyaringan peptida antihipertensi alami.
2 BAHAN DAN METODE
2.1 Bahan dan bahan kimia
Enzim pengubah angiotensin (0,25 UN) dan substratnya N-[3-(2-Furyl)akriloil]-l-fenilalanil-glisil-glisin (FAPGG, kemurnian ≥99%) dibeli dari Sigma-Aldrich (St. Louis, AS). Peptida penghambat ACE (kemurnian ≥98%) yang digunakan untuk identifikasi dan penyaringan disintesis oleh Nanjing Peptide Synthesis Co. Ltd. (Nanjing, Tiongkok). Kemurnian dan massa molekul peptida yang disintesis dikonfirmasi dengan kromatografi cair kinerja tinggi (HPLC) dan kromatografi cair-spektrometri massa (LC-MS). Semua larutan disiapkan menggunakan air Milli-Q.
2.2 Persiapan struktur 3D peptida dan protein
Mengikuti studi kami sebelumnya, 27 pustaka berisi 160.000 sekuens tetrapeptida dibuat menggunakan skrip Python dan fungsi EmbedMolecule (algoritma Geometri Jarak Pengetahuan Dasar Torsi-Eksperimental) dalam modul Chem. AllChem dari perangkat RDKit 2020.9.1. 28 Selanjutnya, perangkat Open Babel digunakan untuk menambahkan hidrogen dan muatan gasteiger ke peptida dan melakukan minimisasi energi. 29 Struktur 3D ACE diperoleh dari Worldwide Protein Data Bank (PDB ID: 1O8A). Ligan asli dan molekul air kristalisasi dikeluarkan dari kompleks kristal, dan atom hidrogen ditambahkan untuk membuat molekul reseptor ACE.
2.3 Docking molekular
Docking molekular dilakukan menggunakan AutoDock Vina v1.1.2 30 untuk mengevaluasi interaksi antara tetrapeptida dan ACE. Hasil docking dilaporkan sebagai skor (kkal/mol) dengan nilai yang lebih rendah (negatif) yang menunjukkan afinitas pengikatan yang lebih kuat. Ukuran kotak docking ditetapkan menjadi 80 Å × 80 Å × 80 Å, dan koordinat situs aktif ditetapkan sebagai ( X = 40,790, Y = 33,610, Z = 43,380). 31 Hasil docking dianalisis lebih lanjut menggunakan PLIP v2.2.0. 32
2.4 Analisis hasil docking ACE-tetrapeptide
Situs pengikatan ACE dan karakteristik struktural peptida yang terikat dianalisis untuk membandingkan pola interaksi peptida dengan skor pengikatan yang berbeda dan untuk memperjelas karakteristik pengikatan ACE dengan tetrapeptida. Dengan memeriksa interaksi antara sembilan situs residu aktif dan peptida, peran dominan masing-masing residu diidentifikasi.
Hasil docking dari 160.000 peptida dikategorikan ke dalam tiga kelompok afinitas berdasarkan skor docking (kkal/mol): tinggi (−20 hingga −14), sedang (−14 hingga −8), dan rendah (−8 hingga −1). Preferensi asam amino pada setiap posisi dalam peptida dalam tiga rentang skor ini dianalisis. Rentang skor optimal (−20 hingga −14) dipilih untuk penyelidikan terperinci. Selain itu, hubungan antara ikatan utama dan jenis asam amino dalam tiga interval dianalisis, dan selanjutnya diklarifikasi jenis asam amino mana yang dapat bermanfaat untuk memasuki situs aktif selama proses pengikatan peptida dan ACE.
2.5 Penyaringan peptida penghambat ACE dan uji aktivitas in vitro
Peptida penghambat ACE yang potensial disaring menggunakan kombinasi tiga metode komputasi. Pertama, docking molekuler digunakan untuk menghasilkan konformasi pengikatan ACE–tetrapeptida. Peptida dari interval docking dengan skor tinggi dipilih untuk analisis lebih lanjut. Langkah kedua melibatkan penyaringan peptida dengan skor docking lebih rendah dari -14 kkal/mol, diikuti oleh analisis kelarutan menggunakan alat Innovagen ( http://pepcalc.com/ ). Akhirnya, sifat ADMET dari peptida yang dipilih, termasuk penetrasi sawar darah-otak, penyerapan usus manusia, karsinogenisitas, dan toksisitas oral akut, dievaluasi menggunakan alat prediksi ADMET admetSAR. 33
Peptida dengan kelarutan air yang lebih baik dan karakteristik ADMET yang baik, sambil mengikuti hubungan struktur-aktivitas (SAR) untuk penghambat ACE dan reseptor, disintesis untuk perbandingan aktivitas in vitro mereka. Berdasarkan metode yang dijelaskan oleh Cao et al. 34 , aktivitas penghambatan ACE diukur menggunakan uji pelat 96-sumur. Larutan peptida sintetis disiapkan pada konsentrasi yang berbeda, dan 40 μL larutan peptida dicampur dengan 50 μL larutan penyangga FAPGG (1,0 mM, mengandung 0,3 M NaCl, dan 80 mM HEPES, pH = 8,3), dan 10 μL larutan ACE (0,1 U/mL). Absorbansi pada 340 nm diukur, dan setelah diinkubasi pada 37°C selama 30 menit, absorbansi pada 340 nm diukur lagi. Aktivitas penghambatan ACE dihitung menggunakan rumus berikut berdasarkan perubahan absorbansi pada 340 nm:
![]()
di mana A a dan A b adalah absorbansi kelompok eksperimen sebelum dan sesudah reaksi, dan B a dan B b adalah absorbansi kelompok kosong sebelum dan sesudah reaksi.
2.6 Analisis data
Semua percobaan dilakukan dalam rangkap tiga, dan data disajikan sebagai rata-rata ± simpangan baku. Semua gambar dalam naskah digambar menggunakan perangkat lunak GraphPad Prism 8.0 dan Origin 2018.
3 HASIL DAN PEMBAHASAN
3.1 Analisis hasil docking
3.1.1 Analisis asam amino situs pengikat ACE
Dalam penelitian ini, konformasi 160.000 tetrapeptida dihasilkan dan disambungkan dengan reseptor ACE untuk memperoleh struktur kompleks peptida–ACE. ACE memiliki tiga kantong situs aktif utama: S1, S1′, dan S2. Gambar 1 memberikan informasi terperinci tentang kantong aktif ini. Kantong S1 mencakup tiga residu: Ala354, Glu384, dan Tyr523, sedangkan kantong S2 berisi lima residu: Gln281, His353, Tyr520, His513, dan Lys511. Selain itu, kantong S1′ terdiri dari satu residu, yaitu Glu162. 35
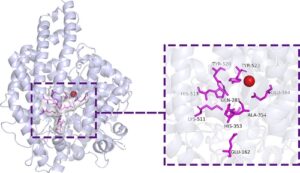
Kami menganalisis interaksi antara sembilan residu situs aktif ini dan peptida, dan menemukan bahwa ikatan hidrogen merupakan interaksi yang dominan (Gambar 2a ). Pembentukan ikatan hidrogen meningkatkan interaksi antara peptida dan ACE, 36 memainkan peran yang sangat penting dalam menstabilkan struktur kompleks dan aktivitas ACE. 37
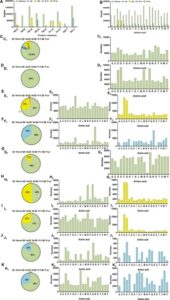
Selain ikatan hidrogen, beberapa residu situs aktif juga membentuk interaksi hidrofobik, jembatan garam, dan interaksi pi-stacking (Gambar 2a ). Analisis interaksi peptida–asam amino pada sembilan situs pengikatan ini mengungkapkan bahwa 20 asam amino berbeda dalam peptida dapat membentuk ikatan hidrogen dengan residu aktif. Asp (D) dan Glu (Q) terutama terlibat dalam jembatan garam. Kecuali Cys (C), Gly (G), dan Ser (S), semua asam amino lainnya dapat membentuk interaksi hidrofobik (Gambar 2b ).
Seperti yang ditunjukkan pada Gambar 2 , semua residu aktif dapat berpartisipasi dalam pembentukan ikatan hidrogen. Kecuali residu Lys511, yang membentuk jembatan garam dan ikatan hidrogen dalam proporsi yang sama, residu yang tersisa sebagian besar terlibat dalam ikatan hidrogen. Residu yang bertanggung jawab untuk interaksi hidrofobik terutama adalah Glu162, Ala354, Tyr520, dan Tyr523, dengan Ala354 dan Tyr523 menjadi yang paling melimpah. Lima residu asam amino terlibat dalam jembatan garam: Glu162, His353, Glu384, Lys511, dan His513, dengan His353, Lys511, dan His513 menjadi yang paling terlibat. Empat residu asam amino di situs aktif ACE—Tyr523, His353, His513, dan Lys511—bertanggung jawab untuk pi-cation, dan Tyr523, His353, dan His513 terlibat dalam pengepakan. Meskipun hanya sedikit interaksi penumpukan pi-kation dan pi–pi yang diamati, interaksi ini juga berkontribusi untuk menstabilkan konfigurasi kompleks. Kombinasi beberapa interaksi ini melumpuhkan polipeptida di situs aktif ACE, sehingga memungkinkan pengikatan afinitas tinggi antara peptida dan ACE (Gambar 2c–k ).
3.1.2 Analisis karakteristik urutan tetrapeptida untuk pengikatan ACE
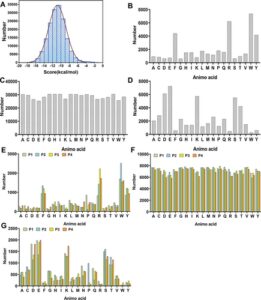
Analisis hasil skor docking mengungkapkan bahwa skor docking tetrapeptida berkisar antara -20 hingga -1,53 kkal/mol (Gambar 3a ), dengan nilai absolut yang lebih besar menunjukkan interaksi yang lebih kuat dan struktur kompleks yang lebih stabil. Berdasarkan skor docking, 160.000 peptida dikategorikan ke dalam tiga interval: tinggi (-20 hingga -14), sedang (-14 hingga -8), dan rendah (-8 hingga -1), dan karakteristik urutan asam amino peptida di setiap interval dianalisis.
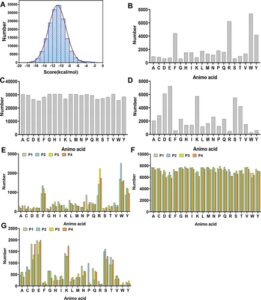
Dalam interval (−20, −14), asam amino Tyr (W), Arg (R), Phe (F), dan Tyr (Y) ditemukan muncul dengan frekuensi yang lebih tinggi (Gambar 3b ). Analisis lebih lanjut dari posisi asam amino mengungkapkan bahwa W, Y, F, R, dan Pro (P) sering muncul pada posisi pertama tetrapeptida, sedangkan W, Y, F, dan R lebih sering muncul pada posisi kedua, ketiga, dan keempat (Gambar 3e ). Hal ini menunjukkan bahwa asam amino hidrofobik dengan struktur siklik, serta arginin bermuatan positif dengan potensi untuk membentuk jembatan garam atau ikatan hidrogen, lebih disukai untuk inhibitor ACE. Penelitian sebelumnya telah menunjukkan bahwa rantai samping asam amino siklik meningkatkan aktivitas penghambatan ACE dari peptida, 38 dan asam amino bermuatan positif dan asam amino aromatik meningkatkan penghambatan ACE, yang konsisten dengan temuan kami. 39
Dalam interval (−14, −8), tidak ada preferensi asam amino yang jelas yang diamati pada posisi peptida mana pun (Gambar 3c,f ). Dalam interval (−8, −1), Asp (D), Glu (E), Lys (K), Ser (S), dan Thr (T) menunjukkan frekuensi tinggi pada setiap posisi peptida (Gambar 3d ), sedangkan W, Y, F, dan R hadir dalam proporsi yang sangat rendah pada posisi N-terminal, C-terminal, dan internal, yang menunjukkan preferensi asam amino yang sama sekali berbeda dibandingkan dengan interval (−20, −14) (Gambar 3g ) . Temuan ini menunjukkan bahwa kantong pengikat ACE lebih menyukai asam amino aromatik dengan cincin fenil dan arginin dengan struktur guanidin, sedangkan asam amino dengan muatan negatif atau yang netral mungkin memiliki afinitas pengikatan yang lebih lemah.
3.1.3 Karakteristik interaksi tetrapeptida dengan ACE
Protein ACE dapat berinteraksi dengan peptida dalam berbagai cara, termasuk ikatan hidrogen dan interaksi hidrofobik, yang dapat menempati lebih banyak ruang dan mencegah substrat memasuki situs aktif. Untuk mengeksplorasi hubungan antara jenis ikatan dan preferensi asam amino peptida, kami menganalisis interaksi dan preferensi asam amino dalam tiga interval (−20, −14), (−14, −8), dan (−8, −1). Seperti yang ditunjukkan pada Gambar 4 , dalam interval (−20, −14), asam amino utama yang terlibat dalam ikatan hidrogen, hidrofobisitas, dan pembentukan jembatan garam adalah W, Y, R, dan F. Gambar 3 juga mengungkapkan bahwa interval skor tinggi diperkaya dalam asam amino W, Y, R, dan F. Kami menyimpulkan bahwa ikatan hidrogen, hidrofobisitas, dan interaksi jembatan garam meningkatkan interaksi antara polipeptida dan ACE, menghasilkan skor docking yang lebih rendah. Hal ini selanjutnya menegaskan pentingnya sifat hidrofobisitas, muatan positif, dan asam amino bervolume besar dalam meningkatkan aktivitas penghambatan ACE. 36 , 41 Oleh karena itu, peptida yang kaya akan asam amino W, Y, R, dan F dapat disintesis sebagai penghambat ACE potensial untuk penggunaan di masa mendatang. Dalam interval (−14, −8), 20 asam amino terlibat dalam ikatan hidrogen dan pembentukan jembatan garam. Selain C, H, dan S, semua asam amino lainnya berkontribusi pada interaksi hidrofobik. Dalam interval (−8, −1), asam amino utama yang terlibat dalam ikatan hidrogen, sifat hidrofobisitas, dan jembatan garam adalah D, E, K, dan T, yang menunjukkan preferensi asam amino yang berbeda dibandingkan dengan interval (−20, −14).
3.2 Skrining peptida penghambat ACE
Sebanyak 9951 tetrapeptida diperoleh dari interval skor tinggi. Untuk memvalidasi hasil penyaringan, peptida disintesis berdasarkan preferensi asam amino pada setiap posisi dan situs aktif. Karena W dan R muncul secara signifikan lebih sering pada posisi kedua dan ketiga dalam peptida, kedua asam amino ini difiksasi pada posisi ini. Asam amino dengan frekuensi lebih tinggi pada posisi pertama adalah W, F, R, Y, dan P, sedangkan asam amino frekuensi lebih tinggi pada posisi keempat adalah W, F, R, dan Y. Karena W, F, R, dan Y dapat berinteraksi dengan semua residu dalam kantong aktif, keempat asam amino ini dipilih untuk disusun secara acak pada posisi pertama dan keempat, menghasilkan 16 peptida yang berbeda.
Peptida dengan karakteristik pemrosesan yang baik juga harus menunjukkan kelarutan yang baik. Oleh karena itu, alat daring Innovagen digunakan untuk memprediksi kelarutan 16 peptida berdasarkan titik isoelektriknya, jumlah residu bermuatan, dan panjang peptida. Hasil penelitian menunjukkan bahwa tujuh peptida menunjukkan kelarutan yang baik (Tabel 1 ). Selain itu, agar peptida bioaktif dapat mengerahkan aktivitas fungsionalnya, mereka harus diserap melalui saluran pencernaan dan mencapai tempat targetnya melalui aliran darah. 17 Sifat ADMET dari peptida ini diprediksi menggunakan program admetSAR. Ketujuh peptida ini memenuhi semua kriteria ADMET, termasuk penetrasi sawar darah-otak (BBB+), penyerapan usus manusia yang baik (HIA+), permeabilitas Caco-2 yang tinggi, nonsubstrat atau noninhibitor dalam metabolisme, dan nilai LD 50 antara 500 dan 5000 mg/kg. Indikator-indikator ini mencerminkan masuknya peptida ke dalam otak, perjalanan melalui usus, dan permeabilitas tinggi pada tingkat sel. Oleh karena itu, peptida ini dipilih untuk penyelidikan lebih lanjut.
| Peptida | Berat molekul (Da) | ToksiPed | Kelarutan dalam air | Titik iso-listrik (PI) | Penghalang darah-otak | Penyerapan usus manusia | Permeabilitas Caco-2 |
|---|---|---|---|---|---|---|---|
| WWRR | 702.81 | Tidak beracun | Bagus | 12.1 | 0.6105 | 0.8475 | 0.8157 |
| FWRR | 663.77 | Tidak beracun | Bagus | 12.1 | 0.6394 | 0.8587 | 0.8063 |
| YWRR | 679.77 | Tidak beracun | Bagus | 11.0 | 0.7044 | 0.8973 | 0.8533 |
| RWRR | 672.78 | Tidak beracun | Bagus | 12.4 | 0.6624 | 0.8355 | 0,7996 tahun |
| RWRW | 702.81 | Tidak beracun | Bagus | 12.1 | 0.6105 | 0.8475 | 0.8157 |
| RWRF | 663.77 | Tidak beracun | Bagus | 12.1 | 0.6394 | 0.8587 | 0.8063 |
| RWRY | 679.77 | Tidak beracun | Bagus | 11.0 | 0.7044 | 0.8973 | 0.8533 |
3.3 Aktivitas penghambatan ACE peptida secara in vitro
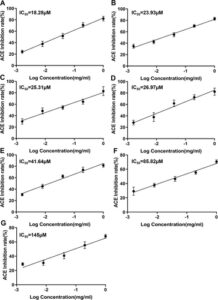
Tujuh peptida terpilih disintesis melalui sintesis peptida fase padat dan diuji untuk aktivitas penghambatan ACE in vitro (IC 50 ). Hasil penelitian kami menunjukkan bahwa nilai IC 50 dari tujuh peptida yang disintesis berkisar antara 18,28 hingga 145,00 μM (Gambar 5 ). Penelitian telah menunjukkan bahwa peptida dengan nilai IC 50 berkisar antara 0,32 hingga 1000,00 μM berpotensi menurunkan tekanan darah. 42 , 43 IC 50 dari obat positif Captopril yang saat ini dipasarkan adalah 0,025 μM. Meskipun nilai IC 50 dari sebagian besar peptida yang berasal dari produk alami lebih tinggi daripada Captopril, mereka menawarkan keuntungan dari efek samping yang lebih sedikit dan efek penurunan tekanan darah yang berpotensi lebih baik. 44 Penelitian sebelumnya melaporkan IC 50 dari peptida penghambat ACE baru HLHT, yang dimurnikan dari hidrolisat tiram mutiara, sebesar 458,06 ± 3,24 μM. 45 Demikian pula, dua peptida baru dari hidrolisat protein dedak padi, FDGSPVGY dan VFDGVLRPGQ, memiliki nilai IC 50 masing-masing sebesar 94,05 dan 85,59 μM. 18 Nilai IC 50 dari peptida penghambat ACE EPNGLLLPQY dari protein penyimpan biji kenari dilaporkan sebesar 233,18 μM. 46 Dibandingkan dengan peptida yang dilaporkan sebelumnya, peptida yang diidentifikasi dalam penelitian kami menunjukkan aktivitas penghambat ACE yang lebih kuat. Hal ini dapat dikaitkan dengan peran penting yang dimainkan oleh komposisi dan sifat asam amino dalam penghambatan ACE. Seperti yang ditunjukkan oleh J. Wu et al. 47 , asam amino aromatik dan hidrofobik sangat penting untuk meningkatkan efek penghambatan ACE. Peptida yang kami identifikasi memiliki karakteristik utama ini, yang kemungkinan berkontribusi pada aktivitas penghambatannya yang unggul.
3.4 Pola pengikatan ACE dan tetrapeptida
Untuk lebih menjelaskan mekanisme di balik aktivitas penghambatan tinggi dari tetrapeptida yang disintesis, kami menggunakan PLIP (protein–ligand interaction profiler) untuk menganalisis interaksi antara peptida dan ACE, dan gambar 2D dan 3D dari kompleks ACE–peptida digambar oleh Discovery Studio Visualizer dan LigPlot. Pendekatan ini memungkinkan pemahaman yang lebih baik tentang mekanisme penghambatan. Docking molekuler digunakan untuk mensimulasikan pengikatan peptida ke ACE, dan hasilnya menunjukkan bahwa semua peptida dapat membentuk ikatan hidrogen (Gambar 6 ), yang memainkan peran penting dalam menstabilkan kompleks peptida–ACE. 48
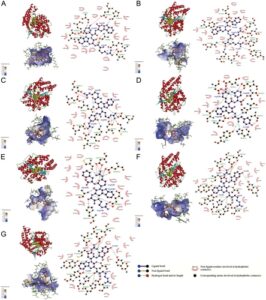
Tabel 2 menunjukkan bahwa semua peptida ini dapat mengikat residu asam amino kunci dan berinteraksi dengan situs katalitik aktivitas ACE. Di antara mereka, RWRW menghasilkan 8 ikatan hidrogen, YWRR dan WWRR masing-masing menghasilkan 10 ikatan hidrogen, RWRR menghasilkan 9 ikatan hidrogen, RWRF dan FWRR menghasilkan 6 ikatan hidrogen, dan RWRY menghasilkan 11 ikatan hidrogen. Perlu dicatat bahwa Ala354 dan Lys511 adalah residu signifikan dalam situs aktif ACE, yang diketahui berinteraksi dengan obat antihipertensi seperti enalapril. 19 , 31 Penelitian sebelumnya telah mengidentifikasi peptida dengan aktivitas penghambatan ACE tinggi yang berinteraksi dengan Ala354 atau Lys511, seperti LPESVHLDK (IC50 = 22,88 μM) dan YLVR (IC50 = 15,42 μM). 19 , 49 Dalam penelitian ini, semua peptida yang disintesis berinteraksi dengan Ala354 atau Lys511, yang sebagian menjelaskan aktivitas penghambatan ACE yang kuat. Karena W, F, dan Y adalah asam amino pahit, penelitian di masa mendatang perlu mencari cara untuk mengurangi potensi rasa pahit dari peptida tersebut. 50
| Jenis ikatan | RWRW | WWRR | RWRR | YWRR | RWRF | RWRY | FWRR |
|---|---|---|---|---|---|---|---|
| Interaksi hidrofobik | Arg522 | Asn277 | Ala354 | Ala354 | Ala356 | Ala356 | Cys352 |
| Asn406 | Cys352 | Asn277 | Asn277 | Asn277 | Cys352 | Gln281 | |
| Glu403 | Gly276 | Glu369 | Cys370 | Asn285 | Gln369 | Gln369 | |
| Gly404 | miliknya353 | miliknya353 | miliknya513 | Bahasa Inggris Asp415 | Glu376 | Glu384 | |
| miliknya353 | miliknya383 | miliknya383 | Leu161 | Cys352 | miliknya383 | miliknya353 | |
| miliknya387 | miliknya513 | miliknya513 | Phe457 | Glu376 | miliknya387 | miliknya383 | |
| Dia410 | Leu161 | Thr166 | Phe527 | Gly276 | Leu161 | miliknya513 | |
| miliknya513 | Met169 | Trp279 | Ser355 | miliknya353 | Lys511 | Phe457 | |
| Lys368 | bertemu278 | Bahasa Indonesia:Tyra520 | Trp279 | miliknya383 | Phe457 | Phe512 | |
| Phe391 | Phe457 | Bahasa Indonesia: Tyr523 | Bahasa Indonesia: Val380 | miliknya387 | Phe512 | Phe527 | |
| Phe512 | Phe512 | Val379 | bertemu278 | Phe527 | Ser355 | ||
| Ser355 | Ser147 | Bahasa Indonesia: Val380 | Phe527 | Ser355 | Thr282 | ||
| Trp357 | Ser355 | Ser355 | Trp279 | Bahasa Indonesia: Tyr523 | |||
| Bahasa Indonesia:Ty360 | Thr166 | Thr166 | Bahasa Indonesia: Val380 | Val379 | |||
| Bahasa Indonesia:Ty394 | Trp279 | Trp279 | Bahasa Indonesia: Val380 | ||||
| Bahasa Indonesia: Tyr523 | Bahasa Indonesia:Tyra520 | Bahasa Indonesia: Tyr523 | Bahasa Indonesia: Val518 | ||||
| Val351 | Bahasa Indonesia: Val380 | Val379 | |||||
| Bahasa Indonesia: Val518 | Bahasa Indonesia: Val380 | ||||||
| Ikatan hidrogen | Ala354 | ALA354 | Bahasa Inggris Asp453 | Ala356 | Ala354 | Ala354 | Ala354 |
| Ala356 | Bahasa Inggris Asp377 | Bahasa Inggris Asp377 | Bahasa Inggris Asp377 | Bahasa Inggris Asp377 | Bahasa Inggris Asp377 | Bahasa Inggris Asp377 | |
| Arg402 | GLU162 | Cys370 | Glu162 | Cys370 | Cys370 | Bahasa Inggris Asp453 | |
| Asn70 | GLN281 | Glu162 | Glu376 | Glu162 | Glu162 | Cys370 | |
| Bahasa Inggris Asp358 | Glu376 | Gln281 | Glu384 | Glu384 | Glu384 | Glu162 | |
| Glu384 | Glu384 | Glu376 | miliknya353 | miliknya513 | miliknya353 | Glu376 | |
| Glu411 | Glu411 | Glu384 | miliknya383 | miliknya513 | |||
| Pro407 | Lys511 | Glu411 | Thr166 | Thr372 | |||
| TYR146 | Lys511 | Thr372 | tyr146 dan tyr146 | ||||
| Bahasa Indonesia: Tyr523 | Bahasa Indonesia: Tyr523 | Bahasa Indonesia:Tyra520 | |||||
| Bahasa Indonesia: Tyr523 | |||||||
| Jembatan garam | Bahasa Indonesia: ASP358 | GLU376 | Bahasa Indonesia: ASP377 | Bahasa Indonesia: ASP377 | Bahasa Indonesia: ASP377 | Bahasa Indonesia: ASP377 | Bahasa Indonesia: ASP377 |
| GLU384 | Bahasa Indonesia: ASP377 | Bahasa Indonesia: ASP453 | GLU162 | GLU162 | GLU162 | Bahasa Indonesia: ASP453 | |
| GLU411 | GLU384 | GLU162 | GLU376 | GLU384 | GLU384 | GLU162 | |
| HIS387 | GLU411 | GLU376 | GLU376 | ||||
| HIS410 | LYS511 | GLU384 | HIS353 | ||||
| HIS513 | GLU411 | ||||||
| HIS513 | |||||||
| LYS511 | |||||||
| Interaksi Pi-kation | ARG522 | HIS387 | |||||
| HIS410 | |||||||
| Penumpukan pi–pi | HIS383 |
Selain ikatan hidrogen, interaksi hidrofobik juga menonjol, berkontribusi pada pengikatan antara peptida dan kantong aktif ACE. Interaksi ini menstabilkan kompleks enzim-peptida dan menciptakan halangan sterik, yang secara efektif mencegah interaksi ACE-substrat. 36 Selain interaksi dengan residu di dalam situs aktif, peptida juga membentuk beberapa interaksi dengan residu di luar kantong pengikat, yang meningkatkan stabilitas keseluruhan struktur. Ion seng (Zn 2+ ) di situs aktif ACE berkoordinasi dengan His383, His387, dan Glu411 untuk membentuk kompleks koordinasi tetrahedral. 51 Wilayah ini penting untuk aktivitas biologis ACE dan merupakan target untuk inhibitor ACE. 52 Sebagian besar tetrapeptida ditemukan berinteraksi dengan wilayah ini melalui jembatan garam, penumpukan pi-pi, dan interaksi pi-kation. Gaya-gaya ini, bersama dengan ikatan hidrogen dan interaksi hidrofobik, membantu menstabilkan kompleks dan meningkatkan aktivitas penghambatan peptida.
4 KESIMPULAN
Dalam beberapa tahun terakhir, peptida antihipertensi yang berasal dari makanan telah menarik perhatian luas sebagai alternatif potensial untuk obat antihipertensi tradisional karena bioaktivitasnya yang tinggi, toksisitasnya yang rendah, dan kemudahan penyerapannya dalam tubuh manusia. Mengembangkan metode penyaringan yang efisien dan akurat, serta memperoleh pemahaman yang lebih mendalam tentang hubungan struktur-aktivitas (SAR) dan mekanisme penghambatan peptida penghambat ACE, sangat penting untuk penemuan dan pengembangan penghambat ACE yang sangat efektif. Dalam penelitian ini, simulasi docking molekuler digunakan untuk menghasilkan konformasi kompleks ACE dengan semua tetrapeptida, dan fungsi penilaian digunakan untuk mengevaluasi secara awal efek penghambatan tetrapeptida pada ACE. Hasilnya menunjukkan bahwa asam amino aromatik dan asam amino bermuatan positif dikaitkan dengan aktivitas penghambatan ACE yang tinggi. Tujuh peptida yang disintesis menunjukkan nilai IC50 berkisar antara 18,28 hingga 145,00 μM, yang menunjukkan potensinya sebagai alternatif obat ACE. Karakteristik ACE inhibitor ini dapat memandu pemrosesan makanan fungsional antihipertensi. Selain itu, Ala354 dan Lys511 adalah dua residu penting yang terletak di dalam kantong pengikat ACE dan memainkan peran kunci dalam pengikatan ACE. Temuan ini memperluas penerapan simulasi molekuler dalam penelitian peptida aktif dan memberikan panduan teoritis dan bukti eksperimental untuk penyaringan dan pengembangan peptida antihipertensi. Namun, karena penyerapan, distribusi, metabolisme, dan sekresi peptida dalam tubuh manusia dapat mengakibatkan bioavailabilitas dan stabilitas peptida yang buruk secara in vivo, sering kali terdapat perbedaan antara hasil analisis in vitro peptida bioaktif dan aktivitas in vivo. Oleh karena itu, penting untuk melakukan eksperimen in vivo pada peptida. Penelitian selanjutnya juga akan melibatkan eksperimen hewan atau sel untuk mengevaluasi lebih lanjut kemanjuran peptida yang sebenarnya secara in vivo.

