
ABSTRAK
Penelitian ini menggunakan sequencing 16S rDNA berthroughput tinggi untuk menganalisis keragaman bakteri kolostrum sapi Jersey dan susu matang, dan mengevaluasi sifat probiotik Ligilactobacillus salivarius CR29 yang diisolasi dari sampel. Struktur komunitas bakteri dari sampel susu sapi Jersey dianalisis, dan bakteri asam laktat diisolasi menggunakan media MRS. Galur probiotik potensial dievaluasi untuk pertumbuhan, produksi asam, aktivitas hemolitik, aktivitas antibakteri, sensitivitas antibiotik, toleransi asam dan empedu, hidrofobisitas, kemampuan autoagregasi dan koagregasi, serta kelangsungan hidup mereka dalam lingkungan gastrointestinal yang disimulasikan. Hasil penelitian menunjukkan bahwa sembilan galur bakteri asam laktat yang diisolasi dari sampel susu menunjukkan potensi probiotik, di antaranya Ligilactobacillus salivarius CR29 tidak menunjukkan hemolisis dan memiliki aktivitas antibakteri yang kuat, secara signifikan menghambat beberapa patogen dibandingkan dengan galur lainnya. CR29 sensitif terhadap berbagai antibiotik (seperti tetrasiklin dan rifampisin), dan tingkat kelangsungan hidupnya dalam kondisi garam empedu 0,3% dan pH 2 masing-masing adalah 56,28% dan 77,59%. Tingkat kelangsungan hidupnya setelah simulasi saluran gastrointestinal adalah 47,86%. Singkatnya, Ligilactobacillus salivarius CR29 menunjukkan potensi probiotik yang sangat baik dan dapat diaplikasikan dalam makanan fungsional dan bidang terkait kesehatan di masa mendatang.
1 Pendahuluan
Bakteri asam laktat (BAL) memainkan peran penting dalam industri makanan dan bidang kesehatan, dan sifat probiotiknya telah dikenal luas. Mikroorganisme ini tidak hanya meningkatkan rasa dan kualitas makanan, tetapi juga berdampak positif pada kesehatan usus manusia dengan mengatur flora usus, menurunkan kolesterol, dan memberikan manfaat lainnya (Meng et al. 2024 ). Bakteri ini banyak digunakan dalam industri fermentasi, makanan kesehatan, dan sediaan mikroekologi. Akibatnya, eksplorasi BAL dan aplikasi potensialnya telah menjadi topik penelitian terkini.
Sapi Jersey terkenal karena toleransinya yang tinggi terhadap panas (Park et al. 2021 ) dan kinerja produksi yang unggul. Susu mereka, yang dicirikan oleh kandungan lemak dan protein yang tinggi, merupakan sumber daya yang berharga dalam industri susu (Børsting et al. 2023 ). Kolostrum sapi, susu pertama yang dikeluarkan setelah kelahiran anak sapi, kaya akan vitamin, mineral, komponen aktif biologis, dan antibodi spesifik patogen berkualitas tinggi (Chae et al. 2017 ). Kolostrum juga mengandung banyak mikroorganisme, di antaranya LAB memainkan peran penting dalam menjaga keseimbangan mikroba usus (Eshaghi et al. 2017 ). Setelah memasuki saluran pencernaan, mikroba ini dapat menempel pada sel epitel usus, menghambat perlekatan patogen (Minj et al. 2020 ), dan secara langsung menghancurkan patogen melalui produksi asam laktat, bakteriosin, dan spesies oksigen reaktif (Rastogi dan Singh 2022 ). Selain itu, LAB dapat mengubah komposisi mikroba usus dengan mengatur pH lumen, meningkatkan produksi lendir, dan mengeluarkan peptida antimikroba, sehingga meningkatkan perlindungan penghalang (Dempsey dan Corr 2022 ).
Agar LAB dapat memberikan efek probiotik, mereka harus tahan terhadap kondisi yang tidak menguntungkan, termasuk pH rendah dan asam empedu selama perjalanan gastrointestinal. Mereka juga harus menunjukkan kapasitas adhesi, autoagregasi, dan hidrofobisitas permukaan yang baik untuk menjajah sel epitel gastrointestinal. Lebih jauh, aktivitas antimikroba dan kemampuan untuk berkoagregasi dengan patogen sangat penting. Evaluasi keamanan, seperti pengujian kerentanan antibiotik dan penilaian aktivitas hemolitik, diperlukan sebelum memasukkan mikroorganisme ini ke dalam makanan.
Tujuan dari penelitian ini adalah untuk mengeksplorasi keragaman bakteri pada kolostrum Jersey dan susu matang melalui sekuensing 16S rDNA berthroughput tinggi, dan untuk mengisolasi dan mengidentifikasi galur LAB dengan sifat probiotik yang sangat baik. Kami menilai secara komprehensif karakteristik pertumbuhan, kapasitas produksi asam, aktivitas bakteriostatik, sensitivitas antibiotik, dan kelangsungan hidup mereka dalam lingkungan gastrointestinal yang disimulasikan untuk mengevaluasi potensi aplikasi mereka untuk perbaikan makanan dan gizi. Pekerjaan ini bertujuan untuk memberikan dasar ilmiah dan panduan praktis untuk pengembangan industri susu dan inovasi produk probiotik.
2 Bahan dan Metode
2.1 Reagen
de Mann Rogosa dan Sharpe (MRS) broth medium (M8540, Beijing Solarbio Science & Technology Co. Ltd., Beijing, Cina); LB broth medium (02–136, AOBOX, Beijing, Cina); Columbia blood agar (Dijing Microbial Technology Co. Ltd., Guangzhou, Cina); amoksisilin (A6180F), tetrasiklin (T9020), rifampisin (R6010F), eritromisin (E6100), klindamisin (C0040F), gentamisin (G6170F), dan kloramfenikol (C6050F) dibeli dari Beijing Boao Tuoda Technology Co. Ltd., Beijing, Cina; heptadesil garam (01–046, AOBOX, Beijing, Cina); etil asetat (AR, Tianli Chemical Reagent Co. Ltd., Tianjin, Cina); jus lambung buatan dan jus usus buatan dibeli dari Shanghai Yuanye Biotechnology Co. Ltd., Shanghai, Cina. Semua reagen lainnya memiliki kemurnian analitis.
2.2 Kondisi Strain dan Kultur
Bakteri indikator yang digunakan dalam penelitian ini adalah Escherichia coli (ATCC 25922), Staphylococcus aureus (ATCC 25923), Listeria monocytogenes (CMCC 54001), Salmonella typhimurium (SL.1344), Bacillus subtilis (ATCC 26633), dan Pseudomonas aeruginosa (ATCC 27853), yang semuanya diawetkan oleh Laboratorium Mikrobiologi Utama Universitas Heilongjiang. Strain tersebut ditumbuhkan dalam medium kaldu LB dan diinkubasi pada suhu 37°C dengan pengocokan pada kecepatan 120 rpm selama 24 jam.
2.3 Pengumpulan Sampel dan Pengurutan Berkapasitas Tinggi
Sampel susu disediakan oleh sebuah peternakan di Kota Harbin, Provinsi Heilongjiang. Sapi Jersey dalam kondisi baik (sapi dengan paritas 2–5) dipilih pada bulan Agustus 2023. Pakan diberikan dengan ransum campuran total, dan kolostrum dikumpulkan dalam waktu 2 jam. Kolostrum Jersey berlabel JS (JS1-JS6) dan susu matang Jersey CR berlabel (CR1–CR6) dikumpulkan oleh staf peternakan. Saat mengumpulkan susu, staf pertama-tama menyeka puting susu dengan air hangat untuk membuatnya bersih, kemudian mendisinfeksi dan menyekanya dengan alkohol 75%, dan terakhir, melakukan pemerahan buatan. Setiap kelompok sampel susu adalah 10 mL, ditempatkan dalam tabung pembeku, dan diangkut dalam rantai dingin pada suhu rendah untuk menghindari kerusakan yang disebabkan oleh suhu tinggi di musim panas. Total DNA genomik dari sampel susu diekstraksi, setelah itu kemurnian dan konsentrasi DNA dideteksi menggunakan elektroforesis gel agarosa 1%. Primer mengamplifikasi wilayah 16S V3–V4: 341F (5′-CCTACGGGRSGCAGCAG-3′) dan 806R (5′-GGACTACVVGGGTATCTAATC-3′), dan produk PCR yang lolos uji dimurnikan dan produk dipulihkan menggunakan kit pemulihan DNA untuk pita target. Konstruksi pustaka dilakukan menggunakan NEB Next➅Ultra II FS DNA PCR-free Library Prep Kit (E7645B, New England BioLabs Inc., Ipswich, MA, AS). Setelah pustaka memenuhi syarat, PE 250 diurutkan ulang menggunakan instrumen sekuensing (NovaSeq 6000; Illumina Inc., San Diego, CA, AS), dan proses sekuensing berthroughput tinggi diselesaikan oleh Beijing Novogene Co. Ltd.
2.4 Isolasi dan Karakterisasi LAB
Dalam kondisi steril, 1 mL sampel susu dipipet ke dalam 9 mL larutan garam 0,85% (b/v) dan diencerkan secara serial. Alikuot 100 μL dari pengenceran yang sesuai disebarkan ke media padat MRS dan diinkubasi dalam inkubator suhu konstan 37°C (DNP-9082; Shanghai Jinghong Experimental Equipment Co. Ltd., Shanghai, Tiongkok) selama 24–48 jam. Karakteristik morfologi koloni diamati. Koloni tunggal dengan morfologi putih atau halus seperti krim dipilih dan digoreskan pada media padat MRS menggunakan metode garis tiga zona, diinkubasi pada suhu 37°C selama 24 jam, dan diulang dua kali untuk mendapatkan koloni tunggal yang murni. Koloni-koloni ini diinokulasi dalam media cair MRS dan diinkubasi semalaman pada suhu 37°C dengan pengocokan pada 120 rpm. Suspensi bakteri digunakan untuk analisis morfologi (pewarnaan Gram) dan biokimia (uji katalase).
Strain bakteri yang hasil pengujiannya negatif untuk katalase dan positif untuk pewarnaan Gram dikirim ke Shanghai Paiseno Biotechnology Co. Ltd. untuk pengurutan bakteri tunggal. DNA genom bakteri diekstraksi dan dilakukan amplifikasi PCR dengan primer berikut: 27F (5′-AGAGTTTGATCCTGGCTCAG-3′) dan 1492R (5′-GGTTACCTTGTTACGACTT-3′). Produk PCR dari setiap bakteri dimurnikan dan diurutkan menggunakan instrumen pengurutan ABI3730-XL (ABI3730-XL; Applied Biosystems Inc., Carlsbad, CA, AS). Urutan yang dirakit dibandingkan dengan basis data 16S untuk identifikasi spesies.
2.5 Karakteristik Pertumbuhan dan Produksi Asam LAB
Galur yang tercantum dalam “Daftar Galur yang Dapat Digunakan dalam Makanan” dianalisis untuk mengetahui karakteristik pertumbuhan dan produksi asam. Galur tersebut dikulturkan dalam media cair MRS pada suhu 37°C selama 24–48 jam. Nilai OD 600 dan nilai pH dicatat setiap 2 jam menggunakan pembaca mikroplat gelombang penuh (SpectraMax 190; Molecular Devices LLC, Shanghai, Tiongkok) dan pH meter (FE20; Mettler Toledo Instruments Co. Ltd., Shanghai, Tiongkok), diikuti dengan pembuatan kurva pertumbuhan dan produksi asam.
2.6 Evaluasi Keamanan LAB
2.6.1 Hemolisis
Uji hemolitik dilakukan menurut metode Kuerman et al. ( 2021 ). Strain yang disubkultur selama dua generasi digoreskan pada pelat darah Columbia dan diinkubasi pada suhu 37°C selama 24 jam. Aktivitas hemolitik dianggap positif jika zona hemolitik yang jelas muncul di sekitar koloni.
2.6.2 Sensitivitas Antibiotik
Sensitivitas LAB terhadap tujuh antibiotik (ampisilin, tetrasiklin, rifampisin, eritromisin, klindamisin, gentamisin, dan kloramfenikol) dinilai menggunakan metode difusi agar. LAB yang teraktivasi dan tersalurkan disentrifugasi pada 8000 rpm selama 10 menit, pelet dicuci dengan garam fisiologis dua kali, dan disesuaikan dengan OD 600 sebesar 1,0. Menggunakan metode cawan Oxford, 100 μL suspensi bakteri disebarkan pada media padat MRS, dan 200 μL antibiotik ditambahkan ke sumur cawan Oxford. Plat diinkubasi semalaman pada suhu 37°C, dan hasilnya ditafsirkan menurut pedoman Clinical and Laboratory Standards Institute (CLSI 2023 ).
2.7 Aktivitas Antibakteri LAB
LAB disentrifugasi pada 8000 rpm selama 10 menit menggunakan centrifuge berkecepatan tinggi benchtop (H1850; Hunan Xiang Yi Laboratory Instrument Development Co. Ltd., Hunan, Tiongkok) untuk mengumpulkan supernatan bebas sel, yang dinetralkan menggunakan 1 mol/L NaOH untuk menghilangkan gangguan asam. Aktivitas antibakteri LAB ditentukan menggunakan metode difusi agar seperti yang dijelaskan oleh Mulaw et al. ( 2019 ). Media padat MRS yang disterilkan dituangkan ke dalam cawan Petri steril, dan setelah didinginkan hingga suhu kamar, berbagai bakteri indikator ( Escherichia coli , Staphylococcus aureus , Listeria monocytogenes , Bacillus subtilis , Salmonella Typhimurium , dan Pseudomonas aeruginosa ) disebarkan di atas pelat. Selanjutnya, tiga cawan Oxford steril dengan diameter 8 mm ditempatkan pada media menggunakan pinset steril. Setelah pemadatan, cawan diangkat, dan 200 μL supernatan bebas sel yang dinetralkan ditambahkan ke setiap sumur. Pelat kemudian diinkubasi pada suhu 37°C selama 24 jam, dan diameter zona penghambatan diukur.
2.8 Evaluasi Sifat Probiotik LAB
2.8.1 Resistensi Asam dan Garam Empedu
Ketahanan terhadap asam dan garam empedu dari LAB yang diisolasi dievaluasi berdasarkan metode Dbeibia et al. ( 2023 ). LAB yang diisolasi diinokulasi ke dalam media cair MRS dengan nilai pH yang berbeda (pH 2, 3, dan 4,5) dan konsentrasi garam empedu (0,1% dan 0,3%), MRS yang tidak disesuaikan digunakan sebagai kontrol, dan tingkat kelangsungan hidup dihitung dengan metode penghitungan lempeng setelah inkubasi pada suhu 37°C selama 3 jam.
![]()
2.8.2 Autoagregasi, Koagregasi, dan Hidrofobisitas
Kemampuan autoagregasi LAB ditentukan menurut Missaoui et al. ( 2019 ). Suspensi bakteri disesuaikan dengan OD 600 = 1,0 (A 0 ). Empat mililiter suspensi bakteri diaduk dengan pengocok vortex (Shanghai Hutong Experimental Co. Ltd., Shanghai, Tiongkok) selama 10 detik, absorbansi pada 600 nm diukur setelah diinkubasi pada suhu 37°C selama 5 jam, A t dicatat, dan autoagregasi dihitung menurut rumus:
![]()
Kemampuan koagregasi LAB dengan Escherichia coli dan Staphylococcus aureus ditentukan dengan cara yang sama. Suspensi bakteri dan bakteri patogen masing-masing disesuaikan dengan OD 600 = 1,0, yang dicatat sebagai A 0,2 mL suspensi bakteri dicampur dengan 2 mL masing-masing suspensi bakteri patogen, diaduk selama 10 detik, diinkubasi pada suhu 37°C selama 5 jam, kemudian absorbansi pada 600 nm (A x ) diukur dan koagregasi dihitung menurut rumus:
![]()
Hidrofobisitas LAB ditentukan menggunakan etil asetat menurut Dbeibia et al. ( 2023 ) dengan sedikit modifikasi. Suspensi bakteri disesuaikan dengan OD 600 = 1,0 (dicatat sebagai A 0 ); 1 mL pelarut organik dicampur dengan 3 mL suspensi bakteri, diaduk selama 2 menit, kemudian didiamkan selama 30 menit untuk mengukur absorbansi A x pada 600 nm dengan menyerap fase air dan hidrofobisitas dihitung menurut rumus:
![]()
2.8.3 Analisis Stabilitas Gastrointestinal
LAB dikenakan uji gastrointestinal simulasi menurut Qi et al. ( 2024 ) Setelah LAB diaktifkan dan dilewatkan dua kali, 1 mL suspensi bakteri ( OD 600 = 1,0) dan 5 mL jus lambung buatan dicampur dan diinkubasi pada 120 rpm dalam pengocok 37°C selama 2 jam. Selanjutnya, suspensi bakteri disentrifugasi pada 8000 rpm selama 15 menit, diikuti dengan pencucian dengan garam. LAB yang diobati dengan jus lambung buatan dikultur pada media padat MRS, dan jumlah bakteri yang hidup dihitung. Kemudian, lumpur bakteri yang diobati ditempatkan dalam 5 mL empedu buatan dan diinkubasi pada 120 rpm dalam pengocok pada 37°C selama 20 menit, dan jumlah bakteri yang hidup dihitung seperti dijelaskan di atas. Akhirnya, lumpur bakteri yang diolah dengan empedu ditambahkan ke 5 mL cairan usus buatan (medium), diinkubasi pada 120 rpm dalam pengocok pada suhu 37°C selama 2 jam, dan jumlah bakteri yang hidup dihitung seperti dijelaskan di atas.
2.9 Analisis Data
Semua percobaan dilakukan rangkap tiga, data dianalisis secara statistik dan dibuat grafik menggunakan perangkat lunak Origin 9.0 (Origin Lab Corporation, Northampton, MS, AS), hasil numerik dinyatakan sebagai
± SD simpangan baku, dan tingkat signifikansi p < 0,05.
3 Hasil dan Pembahasan
3.1 Hasil Pengurutan 16S rDNA Berthroughput Tinggi
Dalam penelitian ini, teknologi sequencing 16S rDNA high-throughput digunakan untuk membandingkan dan menganalisis komposisi dan keragaman mikroorganisme dalam kolostrum dan susu mature sapi Jersey. Dapat dilihat dari Gambar 1a,b bahwa kurva pengenceran semua sampel susu mencapai periode platform, yang menunjukkan bahwa kedalaman sequencing memenuhi persyaratan analisis selanjutnya. Sebanyak 2529 OTU diproduksi dalam kelompok CR, sementara 749 OTU diproduksi dalam kelompok JS, yang mana 177 OTU diproduksi di kedua kelompok (Gambar 1c ). Dapat dilihat bahwa jumlah OTU dalam kelompok susu mature jauh lebih tinggi daripada yang ada di kelompok kolostrum, yang menunjukkan bahwa keragaman bakteri dalam kelompok susu mature lebih tinggi daripada yang ada di kelompok kolostrum.

Pada tingkat filum, flora inti dalam kolostrum dan susu matang terdiri dari Proteobacteria , Firmicutes , Bacteroidetes , dan Actinobacteriota (Gambar 2a ), konsisten dengan temuan sebelumnya (Breitenwieser et al. 2020 ). Bacteroidetes jauh lebih melimpah dalam susu JS (22,7%) dibandingkan dalam susu CR (3,7%). Sebaliknya, Actinobacteriota menunjukkan proporsi yang lebih tinggi dalam susu CR (7,1%) dibandingkan dengan susu JS (1,5%) (Gambar 2a ).

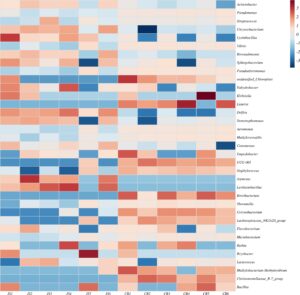
Pada tingkat genus, perbedaan komposisi yang signifikan diamati antara kolostrum dan susu matang (Gambar 2b ). Mikrobiota kolostrum didominasi oleh Acinetobacter dan Chryseobacterium , yang juga dapat diamati dari analisis Heatmap (Gambar 3 ), yang keduanya mengungkapkan kemampuan anti-infeksi (Xie et al. 2021a ); sedangkan flora dominan dalam kelompok susu matang adalah Pseudomonas , Pseudoalteromonas , dan Vibrio . Proporsi Acinetobacter dalam kelompok kolostrum jauh lebih tinggi daripada yang ada dalam kelompok susu matang, dan proporsi Vibrio dalam setiap sampel susu matang lebih tinggi. Perlu dicatat bahwa proporsi Pseudomonas dalam setiap sampel kelompok susu matang lebih dari 20% (Gambar 2b ). Bahasa Indonesia: Sebagai genus yang memanfaatkan laktosa, Acinetobacter ditemukan dalam proporsi yang jauh lebih tinggi dalam kolostrum dibandingkan dengan susu matang, dan prevalensinya menurun seiring dengan menurunnya kandungan laktosa dalam sampel susu matang (Chen et al. 2018 ). Acinetobacter sensitif terhadap berbagai antibiotik, yang juga membantu dalam menjaga kesehatan sapi perah (Zhu et al. 2023 ). Kelimpahan komunitas mikroba dalam susu sapi juga dipengaruhi oleh faktor musiman dan lingkungan (Oikonomou et al. 2020 ). Sampel untuk penelitian ini dikumpulkan selama musim panas, yang mungkin menyebabkan kelimpahan Acinetobacter dan Chryseobacterium yang jauh lebih tinggi dalam susu sapi, karena suhu yang lebih tinggi di musim panas juga akan meningkatkan risiko kontaminasi bakteri selama pengumpulan susu (Xie et al. 2021b ). Hasil ini juga sesuai dengan penelitian lain (Gathinji et al. 2023 ). Temuan ini menawarkan wawasan baru tentang langkah-langkah kebersihan untuk mengelola peternakan sapi Jersey. Kelimpahan Pseudoalteromonas pada kelompok susu matang meningkat secara signifikan dibandingkan dengan kelompok kolostrum (Gambar 2b ), yang sesuai dengan penelitian sebelumnya (Quigley et al. 2013 ) dan Li et al. ( 2018 ). Karakteristik susu Jersey yang tinggi lemak dan tinggi protein menyebabkan kelimpahan Pseudomonas yang relatif lebih tinggi , yang konsisten dengan hasil penelitian lain (Nguyen et al. 2020 ).
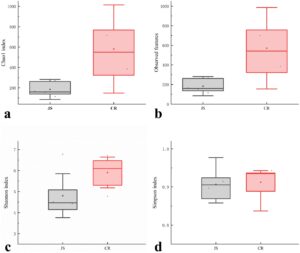
Untuk mencerminkan keragaman dan kemerataan distribusi spesies, beberapa indeks keragaman α yang berbeda digunakan (Gambar 4 ), dan ada perbedaan signifikan dalam fitur yang diamati (Gambar 4a ) dan indeks Chao1 (Gambar 4b ) antara kolostrum dan sampel susu matang ( p < 0,05), yang menunjukkan bahwa kekayaan mikroba sampel susu matang jauh lebih tinggi daripada sampel kolostrum. Namun, tidak ditemukan perbedaan signifikan dalam indeks Shannon dan Simpson antara kelompok JS dan CR (Gambar 4c,d ). Indeks Shannon (yang mencerminkan kekayaan dan kemerataan spesies) dan indeks Simpson (menekankan dominasi spesies yang melimpah) secara konsisten menunjukkan bahwa kelompok JS dan CR menunjukkan tingkat keragaman mikroba keseluruhan yang serupa. Meskipun terdapat variasi kelimpahan pada genus tertentu (misalnya, Acinetobacter atau Pseudomonas , seperti terlihat pada Gambar 2a ), kerangka keanekaragaman komunitas secara keseluruhan kemungkinan tetap seimbang secara dinamis karena gabungan regulasi oleh fisiologi inang (misalnya, jenis sapi dan tahap laktasi) dan faktor lingkungan.
PCoA mengungkapkan pola pengelompokan yang jelas antara kolostrum dan mikrobiota susu matang (Gambar 5a ). Dua koordinat utama pertama masing-masing mencakup 60,37% (PCoA1) dan 14,76% (PCoA2) dari total variasi. Sementara tumpang tindih kecil antara kelompok menunjukkan kesamaan struktural parsial, sampel susu matang menunjukkan homogenitas komposisi yang tinggi, sedangkan sampel kolostrum menunjukkan variabilitas yang lebih besar. Pengelompokan UPGMA lebih lanjut mendukung tren ini (Gambar 5b ). Sampel (misalnya, CR3 dan CR4) mengelompok dengan rapat, yang menunjukkan kesamaan yang tinggi. Heterogenitas yang lebih besar diamati, dengan JS4, JS6, dan JS2 membentuk satu subklaster, sementara JS1 dan JS3 dikelompokkan secara terpisah. Temuan ini konsisten dengan Lima et al. ( 2017 ), yang menyoroti dinamika mikroba yang bergantung pada tahap. Analisis LEfSe mengidentifikasi 19 taksa yang berlimpah secara berbeda dalam kolostrum dan 14 dalam susu matang (Gambar 5c ). Khususnya, Moraxellaceae secara signifikan memengaruhi struktur mikrobiota kolostrum, sejalan dengan Yasir et al. ( 2024 ).

Selain itu, susu Jersey menunjukkan kelimpahan relatif yang lebih tinggi dalam tiga kategori fungsional utama: metabolisme, pemrosesan informasi genetik, dan pemrosesan informasi lingkungan (Gambar 6a ). Prediksi fungsional KEGG selanjutnya mengungkapkan 10 jalur fungsional terkait metabolisme teratas dengan kelimpahan tertinggi (Gambar 6b ), yang diperingkat berdasarkan kelimpahan: transpor membran, metabolisme karbohidrat, metabolisme asam amino, translasi, replikasi dan perbaikan, metabolisme energi, transduksi sinyal, metabolisme nukleotida, metabolisme kofaktor dan vitamin, dan metabolisme lipid. Temuan ini sejalan dengan penelitian sebelumnya oleh Liu et al. ( 2021 ).

3.2 Isolasi dan Identifikasi LAB
3.2.1 Hasil Isolasi Strain
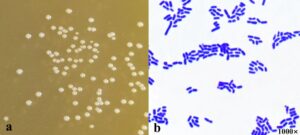
Pemeriksaan pendahuluan mengidentifikasi 62 galur yang bersifat katalase-negatif dan Gram-positif (data tidak ditampilkan). Dengan menggunakan Ligilactobacillus salivarius CR29 (PQ285082.1) sebagai contoh (selanjutnya disebut sebagai CR29), karakteristik morfologi koloni tunggal yang diperiksa pada media padat MRS (Gambar 7a ) dan hasil pewarnaan Gram (Gambar 7b ) menunjukkan bahwa sel bakteri memiliki permukaan yang halus dan bulat serta berwarna putih atau krem.
3.2.2 Hasil Identifikasi Strain
Strain yang diisolasi dikenakan sequencing 16S rDNA, dan hasil identifikasi diperoleh melalui NCBI BLAST sequence alignment (Tabel 1 ). Lactococcus garvieae diisolasi dari kolostrum Jersey dan susu mature Jersey, Lacticaseibacillus paracasei terutama diisolasi dari sampel kolostrum Jersey, dan Ligilactobacillus salivarius terutama diisolasi dari susu mature Jersey. Strain terisolasi lainnya ditemukan di berbagai sampel. Berdasarkan “Daftar Strain yang Dapat Digunakan dalam Makanan,” total sembilan LAB dipilih untuk studi lebih lanjut tentang sifat probiotiknya: enam strain Limosilactobacillus fermentum , dua strain Lacticaseibacillus paracasei , dan satu strain Ligilactobacillus salivarius .
| Nomor | Hasil identifikasi | Nomor | Hasil identifikasi |
|---|---|---|---|
| JS02 | Bakteri Enterococcus faecalis | JS19 | Limosilactobacillus fermentum |
| JS03 | Bakteri Enterococcus faecalis | JS42 | Limosilactobacillus fermentum |
| JS04 | Bakteri Enterococcus faecalis | JS43 | Limosilactobacillus fermentum |
| Bahasa Inggris JS2 | Bakteri Enterococcus faecalis | JS44 | Limosilactobacillus fermentum |
| JS17 | Bakteri Enterococcus faecalis | JS75 | Limosilactobacillus fermentum |
| JS25 | Bakteri Enterococcus faecalis | JS58 | Bunga Weissella cibaria |
| JS59 | Bakteri Enterococcus faecalis | JS68 | Bunga Weissella cibaria |
| JS60 | Bakteri Enterococcus faecalis | Bahasa Inggris JS64 | Kurthia gibsonii |
| JS61 | Bakteri Enterococcus faecalis | JS67 | Bakteri Enterococcus faecium |
| JS63 | Bakteri Enterococcus faecalis | JS70 | Bakteri Enterococcus faecium |
| JS65 | Bakteri Enterococcus faecalis | CR33 | Bakteri Tropis |
| JS66 | Bakteri Enterococcus faecalis | CR35 | Bakteri Enterococcus faecalis |
| JS69 | Bakteri Enterococcus faecalis | CR28 | Bakteri Lactococcus garviaceae |
| JS71 | Bakteri Enterococcus faecalis | CR30 | Bakteri Lactococcus garviaceae |
| JS72 | Bakteri Enterococcus faecalis | CR32 | Bakteri Lactococcus garviaceae |
| JS73 | Bakteri Enterococcus faecalis | CR39 | Limosilactobacillus fermentum |
| JS05 | Bakteri Lactococcus garviaceae | CR26 | Stafilokokus simulan |
| JS1 | Bakteri Lactococcus garviaceae | CR27 | Stafilokokus simulan |
| JS21 | Bakteri Laktataseibacillus paracasei | CR38 | Stafilokokus simulan |
| JS24 | Bakteri Laktataseibacillus paracasei | CR29 | Bakteri Ligilactobacillus salivarius |
3.3 Karakteristik Pertumbuhan dan Penghasil Asam
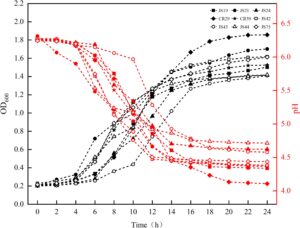
Kurva pertumbuhan dan pH dari sembilan LAB ditunjukkan pada Gambar 8. Sebagian besar strain tumbuh cepat dalam waktu 6–16 jam, yang ditetapkan sebagai periode pertumbuhan logaritmiknya, dan kemudian memasuki fase stasioner. pH kaldu MRS menurun cepat antara 8 dan 16 jam dan stabil sekitar 4,38 setelah periode pertumbuhan logaritmik. OD 600 dan pH CR29 mencapai 1,86 ± 0,03 dan 4,11 ± 0,012 pada 24 jam, masing-masing, menunjukkan kinerja pertumbuhan dan produksi asam yang baik, yang sama dengan Piwat et al. ( 2011 ). Ligilactobacillus salivarius adalah bakteri asam laktat yang berkarakterisasi baik, sering diisolasi dari saluran pencernaan manusia, babi, dan unggas, susu manusia, dan sumber lainnya. Strain ini dapat memodulasi mikrobiota usus, merangsang respons imun protektif, dan menghambat aktivitas enzim tinja, sehingga memungkinkan pengasaman usus yang tepat (Messaoudi et al. 2013 ).
3.4 Evaluasi Keamanan LAB
3.4.1 Hemolisis
Keamanan merupakan prasyarat penting untuk penggunaan probiotik dalam industri pangan. Aktivitas hemolitik digunakan untuk mengevaluasi keamanan probiotik (Jose et al. 2015 ). Gambar 9 menampilkan gambar representatif CR29 (a) dan Staphylococcus aureus (b), dengan yang terakhir menunjukkan β-hemolisis sebagai kontrol positif. Tak satu pun dari sembilan galur LAB, termasuk CR29, menunjukkan hemolisis, yang menunjukkan bahwa mereka adalah galur yang aman.

3.4.2 Sensitivitas Antibiotik
Jika suatu strain membawa gen resistensi yang dapat ditransfer, maka strain tersebut dapat menimbulkan risiko bagi kesehatan inangnya. Oleh karena itu, menilai resistensi antibiotik dari strain probiotik merupakan langkah penting dalam pemilihan probiotik potensial (Abdou dan Awad 2024 ). Tabel 2 menunjukkan hasil metode difusi agar yang digunakan untuk menentukan sensitivitas sembilan strain LAB terhadap tujuh antibiotik yang berbeda. Resistensi antibiotik dari sembilan strain ini menunjukkan kesamaan antarspesies, dengan semua strain menunjukkan resistensi terhadap antibiotik aminoglikosida. Namun, sensitivitas mereka terhadap kelas antibiotik lain bervariasi. CR29 sensitif terhadap tetrasiklin, ampisilin, kloramfenikol, rifampisin, dan klindamisin, yang serupa dengan temuan Langa et al. ( 2012 ), di mana Lactobacillus salivarius CECT5713, yang diisolasi dari ASI, juga menunjukkan sensitivitas terhadap sebagian besar antibiotik yang diuji. Ada pula kesamaan intraspesies dalam sensitivitas antibiotik, karena Lacticaseibacillus paracasei JS21 (PQ285080.1) dan JS24 (PQ285081.1) (selanjutnya disebut JS21 dan JS24) keduanya sensitif terhadap rifampisin dan menunjukkan resistensi sedang terhadap tetrasiklin. Namun, perbedaan intraspesies juga diamati: Limosilactobacillus fermentum CR39 (PQ285083.1), JS42 (PQ285084.1), dan JS75 (PQ285087.1) (selanjutnya disebut sebagai CR39, JS42, dan JS75) sensitif terhadap klindamisin, sementara Limosilactobacillus fermentum JS19 (PQ285079.1), JS43 (PQ285085.1), dan JS44 (PQ285086.1) (selanjutnya disebut sebagai JS19, JS43, dan JS44) menunjukkan resistensi sedang.
| Kategori antibiotik | Nama antibiotik | JS19 | JS21 | JS24 | CR29 | CR39 | JS42 | JS43 | JS44 | JS75 |
|---|---|---|---|---|---|---|---|---|---|---|
| β-Laktam | Ampisilin | S | S | S | S | S | S | S | S | S |
| Kelas tetrasiklin | Tetrasiklin | S | SAYA | SAYA | S | S | S | SAYA | S | S |
| Makrolida | Eritromisin | SAYA | SAYA | SAYA | SAYA | SAYA | SAYA | SAYA | SAYA | SAYA |
| Kuinolon | Rifampisin | SAYA | S | S | S | SAYA | SAYA | SAYA | SAYA | SAYA |
| Aminoglikosida | Gentamisin | R | R | R | R | R | R | R | R | R |
| Lainnya | Kloramfenikol | S | S | S | S | S | S | S | S | S |
| Klindamisin | SAYA | S | S | S | S | S | SAYA | SAYA | S |
Singkatan: I: menengah; R: resistan; S: sensitif.
3.5 Aktivitas Antibakteri
LAB dapat memberikan efek antagonis dengan bersaing dengan patogen untuk mendapatkan ruang pertumbuhan, sehingga menghambat pertumbuhannya (Sirikhwan et al. 2011 ). Dalam penelitian ini, supernatan bebas sel (CFS) yang diperoleh setelah pelepasan asam digunakan untuk menilai aktivitas antibakteri dari strain tersebut. Diameter zona penghambatan ditunjukkan pada Tabel 3. CR29 menunjukkan aktivitas penghambatan yang secara signifikan lebih tinggi terhadap Escherichia coli , Staphylococcus aureus , Listeria monocytogenes , Pseudomonas aeruginosa , dan Salmonella typhimurium dibandingkan dengan strain lainnya ( p < 0,05). Hasil serupa diamati untuk Ligilactobacillus salivarius XP132 dan Ligilactobacillus salivarius CNU1334 (He et al. 2024 ; Kang et al. 2017 ). Selain itu, dalam penelitian ini, Limosilactobacillus fermentum CR39 menunjukkan efek penghambatan yang signifikan terhadap lima strain patogen. Menurut peneliti sebelumnya, LAB dapat menghasilkan efek antibakteri dengan memproduksi asam organik, peptida antimikroba, atau bakteriosin (Rodríguez-Sojo et al. 2021 ). Dalam penelitian saat ini, kami belum menentukan produk mana yang memengaruhi kemampuan antibakteri strain eksperimental, yang memerlukan eksperimen lebih lanjut untuk membuktikannya.
| Ketegangan | Bakteri Escherichia coli | Stafilokokus aureus | Bakteri Listeria monocytogenes | Bakteri Pseudomonas aeruginosa | Salmonella typhimurium | Bakteri subtilis |
|---|---|---|---|---|---|---|
| JS19 | 13,8 ± 0,340 miliar | 21,0 ± 0,852 per menit | 20,2 ± 0,287 miliar | 12,2 ± 0,377 hari | 14,9 ± 0,170 miliar | 16,2 ± 0,216 satu |
| JS21 | 12,4 ± 0,125 detik | 12,8 ± 0,141 miliar | 13,4 ± 0,125 hari | 13,3 ± 0,163 detik | 10,7 ± 0,125 hari | 11,3 ± 0,125 hari |
| JS24 | 13,2 ± 0,205 SM | 13,7 ± 0,245 miliar | 14,7 ± 0,330c | 14,9 ± 0,205 miliar | 12,6 ± 0,094 detik | 10,9 ± 0,216 hari |
| CR29 | 15,5 ± 0,205 satu | 22,0 ± 0,850 per menit | 21,5 ± 0,589 satu | 19,8 ± 0,249 per menit | 17,4 ± 0,216 satu | 13,1 ± 0,094 miliar |
| CR39 | 15,8 ± 0,189 satuan | 21,7 ± 0,368 jam | 19,5 ± 0,205 miliar | 19,3 ± 0,492 satuan | 17,6 ± 0,236 satuan | 15,3 ± 0,125 satu |
| JS42 | 12,7 ± 0,356 detik | 13,9 ± 0,287 miliar | 14,4 ± 0,294 kkal | 14,5 ± 0,125 miliar | 10,8 ± 0,287 hari | 11,9 ± 0,170 kDa |
| JS43 | 12,6 ± 0,141 detik | 13,4 ± 0,236 miliar | 15,0 ± 0,216c | 11,7 ± 0,386 detik | 9,6 ± 0,170 e | 9,5 ± 0,309 e |
| JS44 | 12,8 ± 0,294 SM | 14,1 ± 0,535 miliar | 15,6 ± 0,094 detik | 10,9 ± 0,216 e | 12,9 ± 0,170 detik | 12,8 ± 0,377 SM |
| JS75 | 12,4 ± 0,094c | 13,9 ± 0,262 miliar | 11,2 ± 0,082 e | 11,9 ± 0,170 hari | 8,8 ± 0,047 e | 11,2 ± 0,245 hari |
Catatan: Huruf yang berbeda pada data kolom yang sama menunjukkan perbedaan yang signifikan ( p < 0,05), dan label huruf yang sama menunjukkan bahwa perbedaannya tidak signifikan ( p > 0,05).
3.6 Evaluasi Sifat Probiotik LAB
3.6.1 Resistensi Asam dan Garam Empedu
Sebagai mikroorganisme yang bermanfaat di dalam usus, probiotik dapat memberikan efek probiotik setelah kolonisasi (Ma et al. 2023 ), tetapi berbagai lingkungan di dalam saluran gastrointestinal, seperti sari lambung yang sangat asam, garam empedu, dan berbagai enzim pencernaan, dapat mematikan bagi mereka (Zhou et al. 2024 ), sehingga probiotik harus memiliki kemampuan untuk menahan pH rendah dan konsentrasi garam empedu yang tinggi. Toleransi asam dari sembilan galur LAB dianalisis dengan mengukur tingkat kelangsungan hidup mereka setelah 3 jam pertumbuhan dalam lingkungan pH rendah (Gambar 10a ). Semua galur menunjukkan tingkat kelangsungan hidup yang relatif tinggi pada pH 4,5 dan 3, dengan CR29 menunjukkan tingkat kelangsungan hidup masing-masing sebesar 91,61% ± 0,50% dan 88,33% ± 0,70%, secara signifikan lebih tinggi daripada galur lainnya ( p < 0,05). Pada pH 2, tingkat kelangsungan hidup bervariasi di antara strain, berkisar antara 41,40% ± 0,20% hingga 77,59% ± 0,70%, dengan CR29 menunjukkan toleransi asam terkuat ( p < 0,05).

Toleransi garam empedu dari sembilan strain LAB ditunjukkan pada Gambar 10b . Setelah 3 jam pembudidayaan dalam lingkungan dengan 0,1% garam empedu, semua strain menunjukkan tingkat kelangsungan hidup yang relatif tinggi. Namun, dalam lingkungan garam empedu 0,3%, pertumbuhan mereka terhambat, dengan tingkat kelangsungan hidup di bawah 60%. Tingkat kelangsungan hidup tertinggi diamati pada JS75 dan CR29, masing-masing sebesar 56,31% ± 0,80% dan 56,28% ± 0,40%. Dalam percobaan ini, CR29 memiliki tingkat kelangsungan hidup yang tinggi setelah terpapar pH 2 dan konsentrasi garam empedu 0,3%, yang sama dengan hasil Messaoudi et al. ( 2012 ), yang menemukan bahwa Ligilactobacillus salivarius SMXD51 memiliki toleransi asam dan garam empedu yang baik. ( 2024 ) mengisolasi beberapa strain LAB dari usus kelinci percobaan dan menemukan bahwa Ligilactobacillus salivarius memiliki toleransi yang baik.
3.6.2 Autoagregasi, Koagregasi, dan Hidrofobisitas
Strain dengan sifat hidrofobisitas tinggi biasanya menunjukkan sifat adhesi yang kuat, yang juga menentukan kemampuan probiotik untuk mengikat reseptor pada permukaan mukosa usus (Cho et al. 2016 ). Seperti yang ditunjukkan pada Gambar 11a , strain CR29 menunjukkan sifat hidrofobisitas tertinggi pada 25,88% ± 0,40%. Kemampuan autoagregasi dan koagregasi suatu strain juga penting untuk efek probiotiknya. Autoagregasi memengaruhi adhesi probiotik ke sel epitel usus, sementara koagregasi dengan patogen dapat mencegah bakteri berbahaya ini menjajah usus (Gómez et al. 2017 ). Gambar 11b menyajikan kemampuan autoagregasi dari sembilan strain LAB; kemampuan autoagregasi CR29 adalah 16,72% ± 0,40%. Kemampuan koagregasi dari sembilan strain LAB dengan Escherichia coli dan Staphylococcus aureus ditunjukkan pada Gambar 11c,d . JS75 dan CR29 menunjukkan koagregasi tertinggi dengan Escherichia coli , dengan nilai masing-masing 22,20% ± 0,40% dan 16,69% ± 0,50%. Demikian pula, JS75 dan CR29 juga menunjukkan kemampuan koagregasi tertinggi dengan Staphylococcus aureus , dengan nilai koagregasi masing-masing 17,99% ± 0,60% dan 15,43% ± 0,30%.
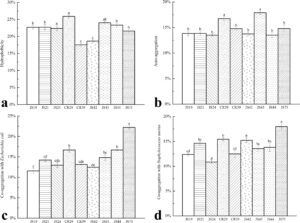
Dalam penelitian ini, CR29 menunjukkan kemampuan hidrofobisitas, autoagregasi, dan koagregasi yang relatif tinggi. Demikian pula, Ait Seddik dkk. menemukan bahwa Ligilactobacillus salivarius p85lb1 dan Ligilactobacillus salivarius p104lb1, di antara 67 galur LAB yang mereka isolasi, menunjukkan sifat yang serupa (Ait Seddik dkk. 2017 ). Kumar dkk. juga mengamati bahwa Ligilactobacillus salivarius yang diisolasi dari feses anak sapi menunjukkan kemampuan autoagregasi dan koagregasi yang tinggi (Kumar dkk. 2022 ), konsisten dengan hasil percobaan ini.
3.6.3 Tingkat Kelangsungan Hidup dalam Lingkungan Gastrointestinal yang Disimulasikan
Tingkat kelangsungan hidup dari sembilan strain LAB setelah perawatan dalam lingkungan gastrointestinal buatan yang disimulasikan ditunjukkan pada Tabel 4. Jumlah sel yang hidup awal berkisar dari 10,84 ± 0,05 hingga 12,92 ± 0,07 lg CFU/mL. CR29 menunjukkan toleransi keseluruhan tertinggi. Setelah paparan cairan lambung, jumlah selnya menurun minimal (dari 12,92 ± 0,07 menjadi 8,87 ± 0,09 lg CFU/mL), dengan tingkat kelangsungan hidup setinggi 68,61% ± 0,40%, yang menunjukkan toleransi cairan lambung yang jauh lebih tinggi dibandingkan dengan strain lainnya ( p < 0,05). Sebaliknya, CR39 adalah yang paling tidak toleran. Setelah uji cairan empedu yang disimulasikan, kelangsungan hidup CR29 adalah 51,97% ± 0,60%. Cairan usus memiliki dampak yang lebih kecil pada jumlah sel yang hidup dibandingkan dengan cairan lambung dan empedu, dengan pengurangan rata-rata sekitar 1 unit log.
| Ketegangan | Awal (lg CFU/mL) | SGJ (lg CFU/ml) | Tingkat kelangsungan hidup (%) | SBJ (lg CFU/ml) | Tingkat kelangsungan hidup (%) | SIJ (lg CFU/ml) | Tingkat kelangsungan hidup (%) |
|---|---|---|---|---|---|---|---|
| JS19 | 12.292 ± 0,034 miliar | 7.174 ± 0.042 hari | 58,36 ± 0,002 kDa | 5.040 ± 0.085 detik | 51,79 ± 0,006 hari | 4,999 ± 0,081 hari | 40,67 ± 0,008 e |
| JS21 | 12.765 ± 0,069 satu | 7,568 ± 0,057 detik | 59,29 ± 0,008 detik | 5.960 ± 0,056 miliar | 46,69 ± 0,004 detik | 5,806 ± 0,041 miliar | 45,49 ± 0,001 detik |
| JS24 | 11.901 ± 0,041 hari | 6,772 ± 0,056 e | 56,90 ± 0,005 detik | 6,007 ± 0,065 miliar | 50,47 ± 0,006 miliar | 5,604 ± 0,036 SM | 47,09 ± 0,004 SM |
| CR29 | 12.922 ± 0,070 satu | 8.866 ± 0.092 satu | 68,61 ± 0,004 satu | 6,716 ± 0,050 satu | 51,97 ± 0,006 miliar | 6,184 ± 0,028 satu | 47,86 ± 0,004 miliar |
| CR39 | 11.012 ± 0,018 e | 6,061 ± 0,045 derajat Fahrenheit | 55,04 ± 0,005 e | 4,594 ± 0,058 hari | 41,72 ± 0,005 hari | 3.990 ± 0,047 e | 36,23 ± 0,004 ppm |
| JS42 | 10.844 ± 0.046 e | 7.092 ± 0.047 hari | 65,40 ± 0,007 miliar | 6,037 ± 0,054 miliar | 55,67 ± 0,007 satu | 5,706 ± 0,062 SM | 52,61 ± 0,004 satu |
| JS43 | 12.132 ± 0,049 SM | 8.183 ± 0.032 miliar | 67,46 ± 0,005 pon | 6.160 ± 0,031 miliar | 50,78 ± 0,005 miliar | 5,572 ± 0,057 detik | 45,93 ± 0,004 detik |
| JS44 | 11.936 ± 0,053 kDa | 7.212 ± 0,035 hari | 60,42 ± 0,002 detik | 6,025 ± 0,072 miliar | 50,47 ± 0,005 miliar | 5.083 ± 0.042 hari | 42,58 ± 0,003 hari |
| JS75 | 12.195 ± 0,043 miliar | 8.053 ± 0.059 miliar | 66,03 ± 0,003 miliar | 6.091 ± 0,046 miliar | 49,95 ± 0,003 miliar | 4,975 ± 0,0318 hari | 40,80 ± 0,004 detik |
Catatan: Sembilan strain bakteri asam laktat masing-masing mensimulasikan proses gastrointestinal ( n = 3). Awalnya, sembilan strain bakteri asam laktat sebelum disimulasikan pengobatan gastrointestinal. Huruf yang berbeda pada kolom data yang sama menunjukkan perbedaan yang signifikan ( p < 0,05), dan label huruf yang sama menunjukkan bahwa perbedaannya tidak signifikan ( p > 0,05). Singkatan: SBJ, simulasi jus empedu; SGJ, simulasi jus lambung; SIJ, simulasi jus usus.
Resistensi terhadap kondisi saluran gastrointestinal yang keras merupakan prasyarat penting untuk kolonisasi probiotik yang efektif (Dicks dan Botes 2010 ), dan CR29 masih memiliki tingkat kelangsungan hidup yang relatif tinggi setelah simulasi saluran gastrointestinal, yang sama dengan hasil penelitian sebelumnya (Ait Seddik et al. 2017 ). Ligilactobacillus salivarius CPN60, yang diisolasi oleh Gupta et al. dari feses anak sapi, menunjukkan tingkat kelangsungan hidup yang tinggi setelah melewati lingkungan gastrointestinal (Gupta et al. 2021 ), yang konsisten dengan hasil penelitian ini. Hasil ini menyoroti potensi CR29 sebagai kandidat probiotik.
4 Kesimpulan
Dalam penelitian ini, sequencing 16S rDNA dengan throughput tinggi digunakan untuk membandingkan dan menganalisis mikrobiota antara kolostrum Jersey dan susu matang. Hasil penelitian menunjukkan bahwa mikrobiota susu matang memiliki keragaman yang lebih besar, dan terdapat perbedaan yang signifikan dalam distribusi mikrobiota inti pada tingkat genus. Selain itu, sembilan galur LAB dengan potensi probiotik diisolasi dari susu Jersey. Hasil eksperimen menunjukkan bahwa Ligilactobacillus salivarius CR29 menunjukkan efek penghambatan yang signifikan terhadap berbagai bakteri patogen, sensitif terhadap berbagai antibiotik, dan memiliki tingkat kelangsungan hidup yang tinggi dalam lingkungan dengan pH rendah dan konsentrasi garam empedu tinggi, yang menunjukkan sifat probiotik yang sangat baik. Hal ini menjadi dasar untuk penelitian lebih lanjut tentang probiotik dalam susu Jersey.

