
ABSTRAK
Sorgum merupakan tanaman serealia yang penting secara global dan dapat menjadi sumber potensial protein nabati yang inovatif. Kafirin merupakan protein simpanan utama dalam biji sorgum. Penelitian ini bertujuan untuk melakukan analisis komparatif terhadap sifat fisikokimia dan fungsional protein yang diperkaya kafirin yang diekstraksi menggunakan metode asam asetat glasial dari berbagai jenis sorgum, serta biji penyulingnya (DG), dan untuk memahami pengaruh jenis sorgum dan proses fermentasi terhadap sifat protein. Kandungan protein dari protein yang diperkaya kafirin yang diekstraksi berkisar antara 75% hingga 85%. Struktur α-heliks dominan pada protein yang diekstraksi. Hasil SDS-PAGE menunjukkan bahwa protein dari berbagai bahan baku sorgum memiliki profil pita yang serupa, kecuali bahwa pita baru dalam kisaran 15–20 kDa dan 25–37 kDa diamati untuk sampel protein dari tepung tetapi bukan DG. Hidrofobisitas permukaan protein bervariasi antara 51,37 dan 59,02 μg SDS/mg protein, dan proses fermentasi selanjutnya mengubah hidrofobisitas permukaan protein yang diekstraksi sampai batas tertentu. Protein yang diperkaya kafirin dari DG sorgum hitam memiliki daya cerna protein in vitro yang sedikit lebih rendah (sekitar 74,80%) dibandingkan dengan DG lainnya (75,34%–79,33%), yang mungkin disebabkan oleh kandungan tanin yang tinggi dalam sorgum hitam. Sifat fungsional protein bervariasi sampai batas tertentu. Studi ini memberikan pengetahuan mendasar tentang sifat protein yang terkait dengan berbagai jenis sorgum dan DG-nya, yang akan membantu produksi di masa mendatang dan aplikasi protein turunan sorgum yang lebih luas.
1 Pendahuluan
Dalam sistem pangan kontemporer, menangani tantangan seperti menipisnya sumber air tawar, lahan layak huni, area subur, dan emisi gas rumah kaca adalah yang terpenting (Pöri et al. 2023 ). Lebih jauh lagi, meningkatnya kesadaran untuk memperoleh protein berkualitas tinggi dalam makanan telah memacu para peneliti untuk mengeksplorasi sumber protein yang lebih ramah lingkungan dan berkelanjutan (Kumar et al. 2021 ). Protein yang berasal dari tumbuhan telah muncul sebagai alternatif yang layak untuk protein hewani dalam makanan manusia, karena berbagai manfaatnya, termasuk sumber yang berkelanjutan, penyediaan fitokimia dan serat esensial, dan pengurangan asupan lemak jenuh dan kolesterol (Akharume et al. 2021 ). Namun, sementara isolat protein konvensional seperti gluten gandum dan protein kedelai memainkan peran penting dalam makanan, konsumsinya dibatasi oleh pembatasan diet di antara individu dengan kondisi seperti penyakit celiac dan alergi kedelai (Dias de Carvalho et al. 2024 ). Situasi ini telah memicu peningkatan yang nyata dalam minat konsumen terhadap sumber daya bebas gluten.
Sorgum ( Sorghum bicolor L.), serealia bebas gluten, menempati peringkat kelima sebagai tanaman serealia yang paling banyak diproduksi secara global, setelah jagung, gandum, beras, dan barley (Perraulta Lavanya et al. 2021 ). Tanaman ini serbaguna dan tahan kekeringan, terutama ditanam di wilayah semi-kering di Afrika, Asia, Australia, serta Amerika Utara dan Selatan (Hassan 2023 ). Sorgum berfungsi sebagai makanan pokok di negara-negara Asia dan Afrika, yang dikonsumsi dalam berbagai bentuk seperti roti, bubur, dan kerupuk. Sebaliknya, di negara-negara Barat seperti Amerika Serikat, Australia, dan Brasil, sorgum terutama dibudidayakan untuk pakan ternak atau produksi bioetanol (Abah et al. 2020 ; Hassan 2023 ).
Produksi komersial bioetanol dari biji-bijian seperti sorgum untuk biofuel menghasilkan generasi signifikan biji-bijian penyulingan (DG), produk sampingan yang kaya akan protein (Lau et al. 2015 ; Zhao et al. 2021 ). Saat ini, DG sebagian besar digunakan sebagai suplemen dalam pakan ternak. Namun, bagian residu sering dibuang sebagai limbah, menimbulkan risiko lingkungan (Böttger dan Südekum 2018 ). Oleh karena itu, penting untuk mengeksplorasi teknologi untuk membuka nilai DG yang kurang dimanfaatkan ini, sehingga mengurangi beban lingkungan yang terkait dengan pembuangannya. DG sorgum, sebagai produk sampingan utama dari fermentasi bioetanol, menyajikan bahan baku yang berharga, melimpah, dan mudah didapat dengan kandungan protein berkisar antara 30% hingga 40% (Wang et al. 2009 ).
Protein sorgum merupakan sumber makronutrien penting dalam biji sorgum, dengan kandungan protein rata-rata sekitar 10%. Protein-protein ini dapat dikategorikan menjadi albumin, globulin, prolamin, dan glutelin berdasarkan karakteristik kelarutannya. Di antara protein-protein ini, kafirin, suatu prolamin, merupakan mayoritas dari total kandungan protein, dengan kombinasi kafirin dan glutelin yang mencapai 70%–80% dalam biji sorgum (Lasztity 2017 ). Kafirin selanjutnya diklasifikasikan menjadi empat subunit, meliputi α-kafirin (23–25 kDa), β-kafirin (16–20 kDa), γ-kafirin (28–50 kDa), dan δ-kafirin (13 kDa), dengan α-kafirin biasanya terletak di bagian inti dan dikelilingi oleh β- dan γ-kafirin (Belton et al. 2006 ). Subunit β- dan γ-kafirin di daerah luar sering kali saling berikatan karena kandungan sisteinnya yang tinggi, sehingga kafirin tidak larut dan bersifat hidrofobik (Semwal dan Ms 2022 ). Namun, mengisolasi kafirin dari biji sorgum menimbulkan tantangan karena distribusinya di dalam endosperma, di mana ia membentuk aglomerasi dengan matriks glutelin di sekitar butiran pati (Castro-Jácome et al. 2020 ).
Ada kebutuhan mendesak untuk memperluas aplikasi DG di luar penggunaan tradisional mereka sebagai pakan ternak atau bahan limbah. DG mengandung sejumlah besar protein; ketika diekstraksi menggunakan teknik yang tepat, itu dapat diterapkan di berbagai sektor, termasuk makanan, pakan, atau produk industri. Berbagai metode ekstraksi protein dapat diterapkan pada bahan ini. Metode yang umum digunakan untuk ekstraksi protein sorgum meliputi presipitasi pada titik isoelektrik, solubilisasi dalam pelarut alkohol, penggilingan basah, sonikasi, dan hidrolisis enzimatik. Metode presipitasi memanfaatkan ketidaklarutan protein pada titik isoelektriknya, biasanya melibatkan teknik ekstraksi basa atau asam (Dias de Carvalho et al. 2024 ; Wang et al. 2009 ), seperti yang digunakan dalam penelitian kami. Ekstraksi berbasis alkohol, menggunakan pelarut nonpolar seperti etanol dan agen pereduksi, adalah pendekatan umum lainnya karena kelarutan prolamin sorgum yang tinggi dalam pelarut nonpolar (Espinosa-Ramírez dan Serna-Saldívar 2016 ; Ioerger et al. 2020 ). Penggilingan basah, berdasarkan prinsip pemisahan fisik, sering dikombinasikan dengan reagen kimia dan enzim untuk meningkatkan ekstraksi protein sorgum (Amoura et al. 2020 ; Espinosa-Ramírez et al. 2017 ). Selain itu, metode sonikasi dan enzimatik menggunakan peralatan fisik atau enzim untuk menambah ekstraksi protein (Semwal dan Ms 2022 ; Wulandari et al. 2023 ).
Di antara teknologi ekstraksi di atas, penggunaan asam asetat glasial menawarkan keuntungan signifikan karena konstanta dielektriknya yang rendah, yang memfasilitasi pembubaran protein hidrofobik pada suhu sekitar (Taylor et al. 2005 ). Penyesuaian pH berikutnya ke titik isoelektrik protein sorgum meningkatkan presipitasi dan isolasinya. Sebaliknya, metode yang menggunakan etanol berair sering menggunakan suhu ekstraksi tinggi, yang dapat mengganggu struktur protein. Dalam pengujian awal kami, kami juga menemukan bahwa menggabungkan asam asetat glasial dengan metode presipitasi alkali menghasilkan kemurnian protein tertinggi.
Meskipun terdapat keragaman genotipe sorgum yang tersedia di pasaran, pengaruh genotipe dan fermentasi terhadap sifat protein menggunakan metode ekstraksi ini sebagian besar masih belum dieksplorasi. Oleh karena itu, penelitian kami bertujuan untuk menyelidiki pengaruh varietas sorgum dan proses fermentasi yang berbeda terhadap sifat-sifat ini. Untuk mencapai hal ini, kami menggunakan asam asetat glasial sebagai pelarut utama untuk mengekstrak protein yang diperkaya kafirin dari berbagai tepung sorgum dan DG yang sesuai. Tujuannya adalah untuk mengkarakterisasi protein yang diekstraksi dan mengevaluasi bagaimana genotipe dan fermentasi memengaruhi karakteristik fisikokimia dan fungsinya.
2 Bahan dan Metode
2.1 Bahan
Sorgum merah-normal (Red-NLM-20 dan Red-NLM-SB), merah-lilin (Red-Waxy), putih-normal (White-4525, White-32020, dan White-F1000), dan hitam-normal (Black-NLM-16) diperoleh dari pemasok komersial (perusahaan Nulife Market, Scott City, KS, AS). DG merupakan produk sampingan yang diperoleh dari fermentasi baijiu Tiongkok seperti yang dijelaskan dalam penelitian kami sebelumnya (Liu et al. 2023 ). Isolat protein kedelai komersial (SPI) dibeli dari perusahaan Bulk Supplements (Henderson, NV, AS), dan isolat protein kacang polong komersial (PPI) dan gluten gandum diperoleh dari perusahaan Anthony (Glendale, CA, AS). Tripsin dari pankreas babi (13.000–20.000 unit BAEE/mg protein), ɑ-kimotripsin dari pankreas sapi (≥ 40 unit/mg protein), dan protease dari Streptomyces griseus (≥ 3,5 unit/mg protein) dibeli dari Sigma–Aldrich (St. Louis, MO, AS). Natrium metabisulfit, asam asetat glasial, natrium hidroksida (NaOH), dan heksana juga dibeli dari Sigma–Aldrich.
2.2 Persiapan Protein yang Diperkaya Kafirin
Metode asam asetat dirujuk ke Wang et al. ( 2009 ) dengan beberapa modifikasi. Baik biji-bijian asli maupun DG digiling menjadi tepung halus menggunakan penggiling kopi, memastikan bahwa 70% sampel lolos dari saringan 0,355 μm (ayakan No. 45). Selanjutnya, 100 g tepung sorgum atau 50 g DG direndam terlebih dahulu dalam 4 kali volume natrium metabisulfit 0,5% (b/b) dan diaduk selama 24 jam. Bagian padat dikumpulkan melalui sentrifugasi (sentrifus kecepatan tinggi Avanti JE, Beckman Coulter Inc., Brea, CA, AS) selama 20 menit (pada 8000 × g ), diikuti dengan penambahan 5 volume asam asetat dan pengadukan selama 2 jam pada suhu ruangan (RT). Campuran tersebut disentrifugasi lagi untuk memperoleh supernatan pada 8000 × g selama 15 menit. pH supernatan secara perlahan disesuaikan dari 2,4 hingga 5,0 menggunakan 50% (b/v) NaOH, dengan penangas es digunakan selama proses ini. Suspensi kemudian disimpan pada suhu 4°C semalaman, diikuti oleh sentrifugasi (8000 × g , 15 menit) untuk mengumpulkan sedimen. Sedimen dicuci dengan air suling tiga kali, diikuti oleh sentrifugasi (8000 × g , 10 menit) dan selanjutnya dikeringkan beku (Freezone 4.5, Labconco Corporation, Kansas City, MO, AS). Sampel protein kering dihilangkan lemaknya menggunakan heksana tiga kali, kemudian disentrifugasi pada 8000 × g selama 15 menit untuk menghilangkan supernatan. Sampel yang dihasilkan ditempatkan dalam lemari asam semalaman untuk menguapkan residu heksana, dan bubuk protein akhir dikumpulkan. Semua sampel protein disimpan dalam lemari es pada suhu 4°C untuk penggunaan selanjutnya. Kandungan protein dari protein yang diperkaya kafirin ditentukan menggunakan penganalisis nitrogen FP928 LECO (LECO Corporation, Saint Joseph, MI, AS) menurut metode AOAC 990.03 dengan faktor konversi 6,25. Persamaan di bawah ini menggambarkan perhitungan hasil dan pemulihan protein (Espinosa-Ramírez dan Serna-Saldívar 2016 ):

2.3 Analisis Warna
Warna protein yang diperkaya kafirin yang diekstrak dari tepung dan DG serta protein kacang polong dan kedelai komersial diukur menggunakan kolorimeter Minolta Chroma Meter CR-300 (Minolta Camera Co., Osaka, Jepang). Nilai L* (kecerahan), a* (kemerahan ke hijauan), dan b* (kekuningan ke biruan) dikumpulkan dan dirata-ratakan dari sampel duplikat.
2.4 Spektroskopi FTIR
Spektrum inframerah transformasi Fourier (FTIR) diperoleh menggunakan Spektrometer FT-IR/FTNIR PerkinElmer Spectrum 400 (PerkinElmer Inc., Waltham, MA, AS) yang dilengkapi dengan sel reflektansi total (ATR) yang dilemahkan. Setiap sampel protein menjalani 64 pemindaian dalam rentang 400–4000 cm −1 pada resolusi 4 cm −1 (Chen et al. 2019 ). Analisis struktur sekunder protein difokuskan pada wilayah amida I (1600–1700 cm −1 ). Perangkat lunak yang digunakan untuk koreksi garis dasar dan pengumpulan spektrum FTIR adalah Spectrum 2010 (PerkinElmer, Shelton, CT, AS). Area relatif wilayah amida I diukur menggunakan perangkat lunak OriginPro 2016 (OriginLab Inc., Northampton, MA, AS).
2.5 Elektroforesis Gel Poliakrilamid Natrium Dodecyl Sulfate (SDS-PAGE)
Profil protein ditentukan melalui SDS-PAGE, mengikuti protokol oleh Hong et al. ( 2022 ) dengan penyesuaian kecil. 150 mg protein dicampur dengan 10 mL buffer PBS (pH = 6,8) yang mengandung 2% (b/v) SDS untuk membentuk suspensi yang stabil (dikocok selama 2 jam pada 250 rpm). Setelah sentrifugasi (8000 g , 5 menit), supernatan dikumpulkan sebagai larutan sampel. Sampel protein diolah dalam kondisi non-reduksi. Secara singkat, larutan sampel dikombinasikan dengan 3 volume buffer Laemmli 4× (Bio-Rad Laboratories Inc., Hercules, CA, AS) dan dididihkan selama 5 menit. Setelah pendinginan, 10 μL campuran dimuat ke dalam sumur gel Mini-Protean TGX 4%–20% (Bio-Rad Laboratories Inc., Hercules, CA, AS). Precision Plus Protein Dual Color Standards (Bio-Rad Laboratories Inc., Hercules, CA, AS) dimuat secara paralel sebagai penanda berat molekul (BM). Elektroforesis dilakukan pada 200 V dalam buffer berjalan 1× Tris/Glycine/SDS (Bio-Rad Laboratories Inc., Hercules, CA, AS) selama sekitar 38 menit. Gel diwarnai dengan larutan Brilliant Blue R Concentrate yang diencerkan (Sigma, St. Louis, MO, AS) selama 8 menit, dibilas dengan air suling semalaman, dan dicuci dengan larutan penghilang noda (10% v/v asam asetat dan 30% v/v metanol) hingga latar belakangnya bersih. Gambar gel diambil menggunakan kamera.
2.6 Hidrofobisitas Permukaan
Hidrofobisitas permukaan (H 0 ) ditentukan menggunakan metode pengikatan natrium dodecyl sulfate (SDS), mengikuti protokol yang diuraikan oleh Tang et al. ( 2021 ). Suspensi disiapkan dengan mencampur 10 mg setiap protein dengan 40 mL buffer SDS 0,1 mmol/L, diikuti dengan pengocokan selama 1 jam untuk memastikan penyebaran menyeluruh. Suspensi kemudian dipindahkan ke dalam tabung dialisis SnakeSkin (ID kering 35 mm) dengan batas MW 3,5 kDa (Thermo scientific, Rockford, IL, AS) dan didialisis selama 48 jam dalam air suling, dengan volume larutan yang dihasilkan dicatat. Setelah itu, sebagian kecil larutan dialisis (10 mL) dicampur dengan 25 mL kloroform dan 5 mL metilen biru 24 mg/L. Campuran dikocok selama 5 menit sebelum disentrifugasi pada 2500 g selama 15 menit, dan larutan lapisan kloroform bawah dianalisis menggunakan spektrometer sinar ganda (VWR UV-6300PC, Radnor, PA, AS) pada 655 nm. Larutan SDS dengan berbagai konsentrasi disiapkan untuk membuat kurva standar. Hidrofobisitas permukaan ditentukan berdasarkan jumlah SDS yang terikat pada protein.
2.7 Kecernaan Protein In Vitro
Daya cerna protein dinilai mengikuti Hsu et al. ( 1977 ) dengan beberapa modifikasi. Larutan 30 mL dengan konsentrasi protein 6,25 mg/mL disiapkan dalam air suling, dan pH disesuaikan menjadi 8,00 (±0,02) menggunakan 1 N HCl dan/atau 1 M NaOH. Larutan multienzim disiapkan dengan 1,6 mg/mL tripsin, 3,1 mg/mL α-kimotripsin, dan 1,3 mg/mL protease dalam air suling, dengan mempertahankan pH pada 8,00 (±0,02). Saat mencampur 3 mL larutan enzim dengan larutan sampel pada suhu 37°C selama 10 menit, perubahan pH dipantau menggunakan pH meter. Daya cerna dihitung menggunakan Persamaan ( 3 ) dari Tinus et al. ( 2012 ):
![]()
di mana ΔpH 10-menit adalah perubahan pH dalam 10 menit dari pH awal 8,0.
2.8 Kandungan Tanin Total (TTC)
Kandungan tanin total ditentukan dengan mengikuti pendekatan gabungan berdasarkan metode oleh Price et al. ( 1978 ) dan Subbiah et al. ( 2020 ) dengan beberapa modifikasi. Untuk mengekstrak senyawa fenolik, sampel protein 100 mg dicampur dengan 800 μL metanol, diikuti dengan agitasi dalam kegelapan selama 20 menit pada 250 rpm. Supernatan dikumpulkan setelah sentrifugasi pada 3000 g selama 15 menit. Setelah itu, 25 μL ekstrak fenolik, 25 μL asam sulfat 32% v/v (dilarutkan dalam metanol), dan 150 μL larutan vanilin 4% b/v (dilarutkan dalam metanol) ditambahkan ke mikroplat 96 sumur secara berurutan dan diinkubasi selama 30 menit dalam kegelapan. Absorbansi diukur pada 500 nm menggunakan spektrofotometer mikroplat (BioTek, Synergy H1 Hybrid, Highland Park, Winooski, VT). Total kandungan tanin diukur menggunakan kurva kalibrasi katekin dengan konsentrasi berkisar dari 0 hingga 1 mg/mL dan dinyatakan dalam mg ekuivalen katekin per gram berat protein. Analisis korelasi daya cerna protein in vitro dan total kandungan tanin dilakukan berdasarkan metode Pearson menggunakan perangkat lunak IBM SPSS Statistics (versi 27.0.1., Armonk, NY, AS).
2.9 Properti Fungsional
2.9.1 Kapasitas Penahan Air/Minyak dan Kelarutan Protein
Kapasitas menahan air dan minyak dinilai mengikuti metode yang dijelaskan oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ) dengan beberapa modifikasi. Untuk kapasitas menahan air, 0,25 g protein ( W0 ) dicampur dengan 7,5 mL air suling dalam tabung sentrifus 15 mL ( W2 ) dan diaduk pada 300 rpm selama 30 menit. Setelah sentrifugasi pada 4500 g selama 15 menit, tabung dibalik selama 5 menit untuk menghilangkan kelebihan air, dan berat akhir ( W1 ) dicatat. Kapasitas menahan air ( WHC ) dihitung menggunakan rumus (Persamaan 4 ):
![]()
Endapan setelah uji WHC dikumpulkan dan dikeringkan beku; kelarutan dihitung dengan perbedaan berat antara sampel protein asli dan endapan dibagi dengan berat sampel protein asli, seperti yang ditunjukkan pada Persamaan ( 5 ):
![]()
Untuk kapasitas menahan minyak, 0,25 g protein ( O 0 ) dicampur dengan 7,5 mL minyak kedelai dalam tabung sentrifus 15 mL ( O 2 ). Setelah dikocok, disentrifugasi, dan kelebihan minyak dibuang, berat akhir endapan dicatat ( O 1 ). Perhitungan kapasitas menahan minyak (OHC) mengikuti Persamaan ( 6 ):
![]()
2.9.2 Sifat Pengemulsi
Kedua kapasitas pengemulsi (Indeks Aktivitas Emulsifikasi (EAI) dan Indeks Stabilitas Emulsi (ESI)) ditentukan mengikuti metode turbidimetri yang dijelaskan oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ) dengan modifikasi. Prosedur ini melibatkan penggabungan 0,25 g protein dengan 25 mL buffer fosfat 100 mM (pH = 7) dan pengadukan hingga terbentuk larutan yang seragam. Selanjutnya, 8,33 mL minyak kedelai didispersikan ke dalam larutan dan dihomogenkan menggunakan homogenizer Polytron PT 2500 E (Kinematica AG, Swiss) pada 14.000 rpm selama 1 menit pada suhu RT. Setelah homogenisasi, 50 μL emulsi dicampur dengan 2,95 mL buffer SDS 0,1% (b/v) dan dipusarkan. Absorbansi emulsi yang diencerkan diukur pada 500 nm ( A 0 ) dan sekali lagi setelah 10 menit ( A 10 ). Indeks Aktivitas Emulsifikasi (EAI) dan Indeks Stabilitas Emulsi (ESI) kemudian dihitung menggunakan rumus berikut:
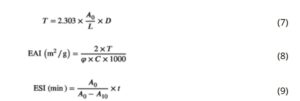
di mana T adalah kekeruhan emulsi, A adalah absorbansi pada 500 nm, D adalah faktor pengenceran, L adalah panjang lintasan cahaya (m), φ adalah fraksi volume minyak, C adalah konsentrasi protein dalam dispersi (mg/mL), dan t adalah 10 menit.
2.10 Analisis Statistik
Percobaan dilakukan sedikitnya dalam dua kali percobaan, dan hasilnya dinyatakan sebagai nilai rata-rata ± simpangan baku (SD). Analisis statistik dilakukan menggunakan perangkat lunak IBM SPSS Statistics (versi 27.0.1., Armonk, NY, AS). Analisis varians satu arah (ANOVA) dilakukan, diikuti oleh uji Tukey untuk beberapa perbandingan guna menilai perbedaan rata-rata. Signifikansi statistik ditetapkan pada p < 0,05.
3 Hasil dan Pembahasan
3.1 Ekstraksi dan Pemulihan Protein
Hasil pada Tabel 1 menunjukkan variasi signifikan dalam kandungan protein, rendemen, dan pemulihan protein di antara berbagai jenis sorgum dari DG dan sampel tepung. Protein yang diperkaya kafirin yang diekstraksi dari DG dan tepung menunjukkan kandungan protein berkisar antara 68,9% hingga 88,5%, yang lebih tinggi daripada 49,8% hingga 88,5% yang dilaporkan oleh Musigakun dan Thongngam ( 2007 ), Wang et al. ( 2009 ), dan Pontieri et al. ( 2019 ). Pilihan metode ekstraksi memiliki dampak signifikan pada kemurnian protein yang diekstraksi. Secara umum, metode asam asetat dan NaOH-etanol menghasilkan protein dengan kemurnian tinggi (Wang et al. 2009 ). Terlepas dari sumbernya (DG atau tepung), kandungan protein yang diperkaya kafirin dari jenis sorgum merah dan hitam cenderung lebih tinggi daripada jenis sorgum putih, yang konsisten dengan temuan Espinosa-Ramírez dan Serna-Saldívar ( 2016 ). Namun, kandungan protein dari biji sorgum mentah atau DG hampir sama, yang menunjukkan bahwa kemurnian protein lebih bergantung pada genotipe daripada pada konsentrasi protein awal. Di antara berbagai jenis, kandungan protein ekstrak dari DG secara signifikan lebih tinggi daripada yang dari tepung ( p <0,05), kecuali untuk Red-NLM-20, yang protein dari DG dan tepung memiliki kandungan protein yang sama (masing-masing 87,9% dan 88,5%). Fenomena ini dapat dikaitkan dengan proses fermentasi selama produksi DG, yang menghidrolisis butiran pati, melepaskan badan protein dari kompleks pati-protein dalam sel endosperma. Proses ini memfasilitasi ekstraksi protein, sehingga menghasilkan kemurnian lebih tinggi pada protein yang diekstrak dari DG sorgum.
| Sampel | Kandungan protein (%, db) | Menghasilkan (%) | Pemulihan protein (%) |
|---|---|---|---|
| Merah-NLM-20 (DG) | 87,91 ± 1,90 per menit | 15,02 ± 0,14 kDa | 36,98 ± 1,15 detik |
| Lilin Merah (DG) | 84,19 ± 4,95 inci | 17,53 ± 1,46 miliar | 41,87 ± 1,02 miliar |
| Putih-32020 (DG) | 82,69 ± 0,71 abjad | 13,20 ± 0,45 e | 35,65 ± 1,53 detik |
| Putih-F1000 (DG) | 79,94 ± 0,71 bcd | 13,77 ± 0,49 detik | 36,10 ± 0,98 detik |
| Hitam-NLM-16 (DG) | 83,91 ± 1,72 inci | 15,82 ± 0,17 kDa | 43,13 ± 1,35 miliar |
| Merah-NLM-SB (DG) | 83,78 ± 0,13 pon | 8,30 ± 0,13 per menit | 24,90 ± 4,97 hari |
| Putih-4525 (DG) | 75,69 ± 4,33 hari | 14,06 ± 1,02 detik | 36,33 ± 0,55 detik |
| Red-NLM-20 (Tepung) | 88,47 ± 3,05 detik | 4,63 ± 0,17 jam | 37,03 ± 2,63 detik |
| Lilin Merah (Tepung) | 76,91 ± 4,02 kkal | 3,97 ± 0,34 jam | 26,98 ± 0,90 hari |
| Black-NLM-16 (Tepung) | 76,69 ± 0,43 kDa | 8,14 ± 0,26 derajat Fahrenheit | 57,16 ± 0,68 jam |
| Putih-4525 (Tepung) | 68,88 ± 0,59 | 6,04 ± 0,34 gram | 28,87 ± 0,73 hari |
Catatan: Hasil dinyatakan sebagai mean ± SD ( n = 2). Huruf yang berbeda menunjukkan perbedaan yang signifikan pada kolom yang sama ( p < 0,05). Kandungan protein sampel didasarkan pada apa adanya. (DGs) berarti protein diekstraksi dari DGs dan (Flour) berarti protein diekstraksi dari tepung.
Dalam hal hasil, sampel Red-Waxy (DGs) menampilkan hasil tertinggi pada 17,53%, sedangkan Red-Waxy (Tepung) menunjukkan hasil terendah pada 3,97%. Khususnya, hasil protein yang diperkaya kafirin yang diekstraksi dari DGs (rata-rata 13,96%) juga secara signifikan lebih tinggi daripada yang dari tepung (rata-rata 5,70%) ( p < 0,05), yang selanjutnya mendukung hipotesis yang disebutkan di atas. Lebih jauh lagi, hasil protein yang diekstraksi serupa di berbagai jenis sorgum (jenis merah, hitam, dan putih), yang sesuai dengan penelitian sebelumnya (Espinosa-Ramírez dan Serna-Saldívar 2016 ). Pemulihan protein berkisar antara 24,90% (Red-NLM-SB (DGs)) hingga 57,16% (Black-NLM-16 (tepung)). Protein yang diekstrak dari DG dan tepung sorgum hitam menunjukkan pemulihan protein tertinggi. Hal ini mungkin disebabkan oleh jenis atau cara pengikatan tanin tertentu dalam varietas sorgum hitam ini, yang dapat membentuk kompleks longgar dengan protein, sehingga memudahkan pelepasannya dalam kondisi ekstraksi yang tepat. Namun, validasi eksperimental lebih lanjut diperlukan untuk mengonfirmasi hipotesis ini. Temuan ini menunjukkan bahwa varietas sorgum dan proses fermentasi dapat memengaruhi proses ekstraksi protein.
3.2 Properti Warna
Analisis warna memberikan informasi penting mengenai tampilan visual sampel, yang memengaruhi penerimaan konsumen dan penilaian kualitas produk. Nilai L* menunjukkan tingkat kecerahan, dengan nilai yang lebih tinggi menunjukkan warna yang lebih terang dan nilai yang lebih rendah menunjukkan warna yang lebih gelap. Nilai a* menandakan sumbu merah ke hijau, sedangkan nilai b* menunjukkan sumbu kuning ke biru. Parameter warna dirangkum dalam Tabel 2 .
| Sampel | Warna | ||
|---|---|---|---|
| L* | A* | B* | |
| Merah-NLM-20 (DG) | 79,93 ± 0,19 g/m2 | 4,50 ± 0,08 hari | 12,84 ± 0,18 hari |
| Lilin Merah (DG) | 78,61 ± 0,09 jam | 4,89 ± 0,02 detik | 11,69 ± 0,04 jam |
| Putih-32020 (DG) | 83,94 ± 0,33 miliar | 1,81 ± 0,01 joule | 11,93 ± 0,08 gram |
| Putih-F1000 (DG) | 85,73 ± 0,16 satu | 1,57 ± 0,03 liter | 12,81 ± 0,14 hari |
| Hitam-NLM-16 (DG) | 75,46 ± 0,17 joule | 6,27 ± 0,03 satuan | 10,59 ± 0,02 joule |
| Merah-NLM-SB (DG) | 79,98 ± 0,05 gram | 3,96 ± 0,02 e | 12,15 ± 0,07 derajat Fahrenheit |
| Putih-4525 (DG) | 85,56 ± 0,04 satu | 1,67 ± 0,05 kkal | 12,64 ± 0,09 e |
| Red-NLM-20 (Tepung) | 80,55 ± 0,06 e | 3,71 ± 0,04 derajat Fahrenheit | 11,53 ± 0,07 saya |
| Lilin Merah (Tepung) | 79,73 ± 0,05 gram | 3,55 ± 0,02 gram | 9,84 ± 0,06 kkal |
| Black-NLM-16 (Tepung) | 71,74 ± 0,07 kkal | 5,88 ± 0,02 miliar | 9,75 ± 0,04 kkal |
| Putih-4525 (Tepung) | 85,77 ± 0,12 satu | 1,29 ± 0,02 m2 | 11,58 ± 0,02 tinggi |
| PPI | 77,65 ± 0,02 saya | 4,91 ± 0,01 detik | 20,89 ± 0,05 satu |
| SPI | 82,85 ± 0,03 detik | 1,97 ± 0,01 saya | 17,59 ± 0,11 miliar |
| Perekat | 81,87 ± 0,06 hari | 2,20 ± 0,02 jam | 16,27 ± 0,02 detik |
Catatan: Hasil dinyatakan sebagai mean ± SD ( n = 2). Huruf yang berbeda menunjukkan perbedaan yang signifikan pada kolom yang sama ( p < 0,05). (DGs) berarti protein diekstraksi dari DGs dan (Flour) berarti protein diekstraksi dari tepung. SPI berarti isolat protein kedelai dan PPI berarti isolat protein kacang polong.
Berdasarkan nilai L*, protein yang diekstraksi dari DG dan tepung sorgum putih menunjukkan tingkat kecerahan tertinggi, yaitu sekitar 83,94–85,77, sedangkan yang diekstraksi dari jenis sorgum hitam (DG atau tepung) memiliki tingkat kecerahan terendah, yaitu sekitar 71,74–75,46. Temuan ini sejalan dengan hasil yang dilaporkan oleh Espinosa-Ramírez et al. ( 2017 ), di mana protein yang diperkaya kafirin dari sorgum putih menunjukkan nilai tingkat kecerahan yang lebih tinggi berkisar antara 86,62 hingga 89,40. Selain itu, tidak ada perbedaan signifikan dalam nilai L* protein di antara sampel DG dan tepung. Untuk protein nabati komersial, isolat protein kedelai (SPI) menunjukkan tingkat kecerahan yang relatif lebih tinggi dibandingkan dengan gluten gandum dan isolat protein kacang polong (PPI), namun masih lebih rendah daripada protein yang berasal dari jenis sorgum putih.
Protein yang diekstraksi dari DG atau tepung sorgum hitam menunjukkan nilai a* tertinggi (masing-masing 6,27 dan 5,88) dibandingkan dengan protein dari jenis sorgum merah dan putih, yang menunjukkan warna yang lebih kemerahan. Selain itu, nilai a* protein yang diekstraksi dari DG lebih tinggi daripada protein dari tepung dalam jenis sorgum yang sama. PPI menunjukkan nilai a* tertinggi di antara protein nabati komersial, yaitu 4,91. Sebaliknya, protein yang diekstraksi dari jenis sorgum hitam menunjukkan nilai b* terendah, dengan 10,59 untuk DG dan 9,75 untuk tepung. PPI menunjukkan nilai b* tertinggi, yang menunjukkan warna kekuningan, dan semua protein nabati komersial menunjukkan nilai b* yang lebih tinggi dibandingkan dengan protein sorgum. Dalam penelitian oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ), ekstrak kafirin menunjukkan nilai a* yang lebih rendah tetapi nilai b* yang relatif lebih tinggi dibandingkan dengan penelitian kami. Perbedaan dalam atribut warna ini dapat dikaitkan dengan variasi senyawa pigmen dan susunan genetik berbagai jenis sorgum, yang memengaruhi warna biji sorgum. Berbagai varietas sorgum memiliki gen dan kandungan tanin yang berbeda, yang menyebabkan variasi warna kulit biji atau pembentukan kulit biji berpigmen (Rashwan et al. 2021 ).
3.3 Struktur Sekunder Protein
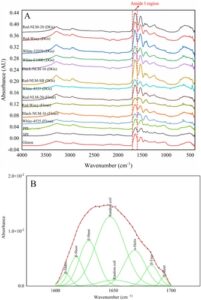
Analisis spektroskopi inframerah transformasi Fourier (FTIR) memberikan wawasan mengenai karakteristik struktural protein dalam sampel, yang sangat penting untuk memahami sifat fungsionalnya. Spektrum FTIR dari semua sampel protein ditunjukkan pada Gambar 1A . Elemen struktural sekunder, termasuk struktur α-helix, β-sheet, β-turn, dan random coil, diperoleh dari spektrum FTIR dan disajikan pada Gambar 1B dan Tabel 3 .
| Sampel | Rasio struktur sekunder protein (%) | |||
|---|---|---|---|---|
| heliks alfa | lembar β | putaran β | kumparan acak | |
| Merah-NLM-20 (DG) | 68,02 ± 9,05 abjad | 27,48 ± 8,77 SM | 4,49 ± 0,27 hari | tidak ada |
| Lilin Merah (DG) | 71,55 ± 2,08 inci | 20,31 ± 3,55 bcd | 8,13 ± 1,47 kDa | tidak ada |
| Putih-32020 (DG) | 73,08 ± 0,37 jam | 19,88 ± 4,60 bcd | 7,04 ± 4,97 kkal | tidak ada |
| Putih-F1000 (DG) | 60,31 ± 6,82 SM | 14,83 ± 2,43 detik | 24,86 ± 4,40 miliar | tidak ada |
| Hitam-NLM-16 (DG) | 75,93 ± 4,00 per jam | 18,91 ± 1,42 SM | 5,16 ± 2,58 hari | tidak ada |
| Merah-NLM-SB (DG) | 74,94 ± 0,57 satu | 20,14 ± 0,29 bcd | 4,92 ± 0,28 hari | tidak ada |
| Putih-4525 (DG) | 73,47 ± 5,16 jam | 22,95 ± 5,78 bcd | 3,57 ± 0,62 hari | tidak ada |
| Red-NLM-20 (Tepung) | 39,85 ± 0,16 hari | 51,68 ± 2,77 menit | 8,47 ± 2,61 kDa | tidak ada |
| Lilin Merah (Tepung) | 72,25 ± 5,38 inci | 14,93 ± 1,15 detik | 12,81 ± 4,23 detik | tidak ada |
| Black-NLM-16 (Tepung) | 66,20 ± 3,02 abjad | 12,97 ± 0,65 detik | 20,83 ± 2,37 miliar | tidak ada |
| Putih-4525 (Tepung) | 58,77 ± 0,16 detik | 9,38 ± 0,41 hari | 31,84 ± 0,57 satuan | tidak ada |
| PPI | 16,24 ± 7,93 hari | 51,75 ± 7,75 per tahun | 4,92 ± 1,09 hari | 27,09 ± 0,91 miliar |
| SPI | 24,64 ± 2,94 tahun | 17,92 ± 4,19 kde | 7,70 ± 4,04 kkal | 49,73 ± 5,29 jam |
| Perekat | 14,63 ± 5,72 hari | 28,73 ± 3,41 miliar | 5,03 ± 0,17 hari | 51,61 ± 2,13 jam |
Catatan: Hasil dinyatakan sebagai mean ± SD ( n = 2). Huruf yang berbeda menunjukkan perbedaan yang signifikan dalam kolom yang sama ( p < 0,05). nc berarti kandungan yang dapat diabaikan (< 1%) dari analisis kami. (DGs) berarti protein diekstraksi dari DGs dan (Flour) berarti protein diekstraksi dari tepung. SPI berarti isolat protein kedelai dan PPI berarti isolat protein kacang polong.
Kandungan α-helix menggambarkan struktur sekunder protein berbentuk spiral, dengan persentase yang lebih tinggi menunjukkan stabilitas struktural yang lebih besar (Swanson dan Sivaramakrishnan 2014 ). Protein yang diperkaya kafirin yang diekstraksi dari berbagai jenis menunjukkan kandungan α-helix yang sama, sekitar 71,40% pada protein yang diekstraksi DG dan 59,27% pada protein yang diekstraksi tepung, yang menunjukkan pengaruh minimal jenis sorgum pada struktur protein. Red-NLM-20 (Tepung) menunjukkan kandungan α-helix yang secara signifikan lebih rendah dibandingkan dengan protein yang diekstraksi tepung lainnya ( p < 0,05), sementara protein dari DG secara umum menunjukkan kandungan α-helix yang lebih tinggi dibandingkan dengan protein yang diekstraksi tepung. Fenomena ini dapat dikaitkan dengan perubahan struktural yang disebabkan oleh proses fermentasi, yang melibatkan perlakuan panas untuk hidrolisis pati dan distilasi etanol. Peningkatan kandungan α-helix yang diamati setelah perlakuan termal juga dilaporkan dalam penelitian oleh Semwal dan Ms ( 2022 ). Hebatnya, semua protein yang diperkaya kafirin menunjukkan kandungan α-helix yang jauh lebih tinggi (66,76%) dibandingkan dengan protein nabati komersial (18,50%).
Kandungan beta-sheet mencerminkan keberadaan struktur seperti lembaran yang memanjang dalam protein. Meskipun proporsi struktur β-sheet tidak berbeda secara signifikan di antara jenis sorgum dengan warna yang berbeda ( p < 0,05), protein yang diperkaya kafirin yang diekstraksi dari DG umumnya menunjukkan kandungan β-sheet yang lebih tinggi dibandingkan dengan yang berasal dari tepung sorgum, kecuali untuk Red-NLM-20 (Tepung) yang menunjukkan kandungan β-sheet yang lebih tinggi dibandingkan dengan DG (51,68% versus 27,48%). PPI menunjukkan kandungan β-sheet tertinggi (51,75%) di antara semua sampel, sebuah fenomena yang juga telah diamati dalam penelitian PPI lainnya (Shevkani et al. 2019 ). Proporsi struktur β yang tinggi berkontribusi pada stabilitas termal sampel protein, yang memungkinkannya menahan denaturasi pada suhu yang lebih tinggi (Shevkani et al. 2019 ).
Kandungan β-turn menunjukkan belokan atau tekukan yang rapat dalam struktur protein. Protein dari White-4525 (Tepung) menunjukkan persentase β-turn tertinggi di antara semua sampel protein, yang menunjukkan peningkatan fleksibilitas atau tekukan dalam struktur proteinnya. Untuk DG, protein yang diekstraksi dari jenis sorgum putih (11,82%) memiliki kandungan β-turn yang lebih tinggi dibandingkan dengan jenis sorgum merah dan hitam (masing-masing 5,85% dan 5,16%), sedangkan pada tepung sorgum, protein yang diekstraksi dari jenis sorgum hitam memiliki kandungan β-turn tertinggi. Menariknya, protein yang diekstraksi dari DG memiliki kandungan β-turn yang lebih rendah dibandingkan dengan yang berasal dari tepung yang sesuai, yang menunjukkan dampak proses fermentasi pada struktur protein. Akibatnya, proses fermentasi menyebabkan peningkatan jumlah struktur α-helix dan β-sheet sementara struktur β-turn pada protein yang diperkaya kafirin yang diekstraksi menurun. Sebaliknya, penelitian oleh Shah et al. ( 2021 ) mengamati perubahan struktural yang sebagian berlawanan dalam ekstrak kafirin, di mana struktur β-sheet meningkat saat struktur α-helix dan random coil dalam kafirin yang diekstrak dari DG menurun. Hal ini mungkin disebabkan oleh perbedaan metode ekstraksi yang digunakan. Metode ekstraksi etanol-NaOH yang diterapkan di atas melibatkan suhu yang lebih tinggi dibandingkan dengan metode kami, yang kemungkinan mengarah pada koagulasi protein yang lebih besar dan peningkatan struktur β-sheet dengan mengorbankan beberapa struktur α-helix (Wang et al. 2009 ). Selain itu, kandungan β-turn protein tanaman komersial (5,88%) secara umum lebih rendah daripada protein yang diekstrak dari tepung sorgum (18,49%).
Kandungan kumparan acak menunjukkan tidak adanya elemen struktural yang jelas dalam protein. Khususnya, semua sampel sorgum menunjukkan persentase kandungan kumparan acak yang dapat diabaikan, yang menunjukkan elemen struktural yang jelas dalam protein yang dianalisis. Sebaliknya, protein tanaman komersial menunjukkan proporsi struktur kumparan acak yang lebih besar, dengan rata-rata 42,81%.
3.4 SDS-PAGE
Profil SDS-PAGE dari protein yang diperkaya kafirin dalam kondisi non-reduksi ditunjukkan pada Gambar 2. Kafirin ditemukan dalam berbagai bentuk, termasuk bentuk monomerik, bentuk oligomerik, atau kompleks polimerik (Belton et al. 2006 ). Profil pita serupa diamati untuk protein yang diperkaya kafirin yang diekstraksi dari berbagai DG dan tepung, dengan intensitas pita yang sebanding, yang konsisten dengan temuan oleh Shah et al. ( 2021 ). Kehadiran residu di atas 250 kDa, yang diidentifikasi sebagai protein dengan berat molekul tinggi, menunjukkan pembentukan agregat protein yang mungkin disebabkan oleh kondisi ekstraksi yang ekstrem, seperti pH yang sangat rendah, seperti yang dilaporkan oleh Dias de Carvalho et al. ( 2024 ). Media alkali secara berbahaya mengubah struktur protein, yang menyebabkan ikatan silang antara protein dan agregasi (Rawel et al. 2001 ).
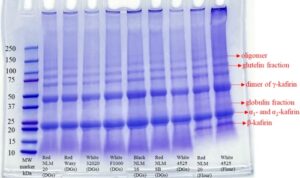
Pita samar di atas 100 kDa dapat mengindikasikan trimer atau oligomer, seperti yang diamati dalam penelitian sebelumnya (Castro-Jácome et al. 2020 ). Pita di sekitar 75 kDa dapat berhubungan dengan fraksi residu glutelin (Ioerger et al. 2020 ). Pita gelap dan lebar yang jelas di sekitar 50 kDa, diidentifikasi sebagai dimer γ-kafirin (Belton et al. 2006 ), diamati dalam ekstrak DG dan tepung, yang konsisten dengan temuan oleh Shah et al. ( 2021 ). Pita samar pada sekitar 36 kDa, yang hanya diamati pada protein yang diekstraksi dari tepung, dapat dikaitkan dengan fraksi protein non-penyimpanan. Ketidakhadirannya dalam protein yang diekstraksi dari DG dapat dikaitkan dengan fermentasi dan pasca-pemrosesan, yang kemungkinan menghilangkan protein non-penyimpanan dari DG. Pita lain pada sekitar 28 kDa, yang secara eksklusif hadir dalam protein yang diperkaya kafirin dari tepung sorgum, kemungkinan besar merupakan representasi dari migrasi bersama antara α-polipeptida dan γ-polipeptida (Shah et al. 2021 ). Khususnya, pita dalam rentang 20–25 kDa tampak lebih gelap dan lebih luas dalam protein yang diekstraksi dari DG dibandingkan dengan yang berasal dari tepung, yang menunjukkan kelimpahan α 1 – dan α 2 -kafirin yang lebih tinggi dalam protein yang diekstraksi dari DG.
Selain itu, pita 16 kDa, yang diamati secara eksklusif pada protein yang diekstraksi dari tepung, kemungkinan adalah β-kafirin (Belton et al. 2006 ). Proses fermentasi ragi yang diterapkan pada DG mungkin telah menyebabkan hidrolisis protein parsial, yang mengarah pada pembentukan peptida yang lebih kecil. Hal ini dibuktikan dengan adanya pita dalam kisaran 10–15 kDa, yang diamati hanya pada protein yang diekstraksi dari DG. Dias de Carvalho et al. ( 2024 ) juga melaporkan pita pada 14 kDa untuk protein sorgum yang diekstraksi pada pH 12, sementara itu tidak ada dalam sampel yang diekstraksi pada pH 8 atau 10. Kondisi basa yang ekstrem dapat memfasilitasi hidrolisis protein selama ekstraksi dalam menghasilkan peptida.
3.5 Hidrofobisitas Permukaan (H 0 )
Nilai hidrofobisitas permukaan (H 0 ) merupakan faktor kritis yang dapat memengaruhi sifat fungsional protein. Parameter ini juga memberikan informasi tentang pelipatan dan stabilitas protein dan dapat berhubungan dengan konsentrasi residu asam amino hidrofobik yang terekspos pada protein (Zhi et al. 2022 ). Hasil H 0 disajikan pada Tabel 4 .
| Sampel | Hidrofobisitas permukaan (μg SDS/mg protein) | Kecernaan protein in vitro (%) | Kandungan tanin total (mg katekin setara/g protein) |
|---|---|---|---|
| Merah-NLM-20 (DG) | 51,37 ± 0,31 ribu | 77,24 ± 0,51 detik | 0,45 ± 0,02 |
| Lilin Merah (DG) | 59,02 ± 0,64 detik | 79,05 ± 0,51 detik | 0,49 ± 0,01 e |
| Putih-32020 (DG) | 56,52 ± 0,55 dpl | 79,33 ± 0,13 detik | 0,02 ± 0,01 jam |
| Putih-F1000 (DG) | 55,32 ± 0,39 gram | 77,97 ± 0,51 hari | 0,08 ± 0,02 gram |
| Hitam-NLM-16 (DG) | 55,63 ± 0,06 fg. | 74,80 ± 0,13 jam | 2,44 ± 0,05 miliar |
| Merah-NLM-SB (DG) | 57,53 ± 0,22 hari | 75,34 ± 0,13 gram | 1,05 ± 0,33 detik |
| Putih-4525 (DG) | 53,22 ± 0,70 tinggi | 75,80 ± 0,03 gram | 0,00 ± 0,00 jam |
| Red-NLM-20 (Tepung) | 52,02 ± 0,11 jk | 79,24 ± 0,06 detik | 0,46 ± 0,03 e |
| Lilin Merah (Tepung) | 56,99 ± 0,33 detik | 79,33 ± 0,38 detik | 0,69 ± 0,04 hari |
| Black-NLM-16 (Tepung) | 52,89 ± 0,11 J | 76,25 ± 0,38 derajat Fahrenheit | 5,70 ± 0,04 satuan |
| Putih-4525 (Tepung) | 56,91 ± 0,22 detik | 77,06 ± 0,77 hari | 0,01 ± 0,01 jam |
| PPI | 64,87 ± 0,36 miliar | 85,75 ± 0,06 satu | 0,15 ± 0,01 pF |
| SPI | 68,00 ± 0,53 per menit | 86,20 ± 0,38 per menit | 0,00 ± 0,00 jam |
| Perekat | 53,89 ± 0,61 jam | 83,31 ± 0,13 miliar | 0,74 ± 0,03 hari |
Catatan: Hasil dinyatakan sebagai mean ± SD ( n = 2). Huruf yang berbeda menunjukkan perbedaan yang signifikan pada kolom yang sama ( p < 0,05). (DGs) berarti protein diekstraksi dari DGs dan (Flour) berarti protein diekstraksi dari tepung. SPI berarti isolat protein kedelai dan PPI berarti isolat protein kacang polong.
Untuk protein yang diekstraksi DG, H 0 berkisar antara 51,37 hingga 59,02 μg SDS/mg protein, dengan Red-Waxy (DG) menunjukkan hidrofobisitas permukaan tertinggi. Khususnya, nilai-nilai ini tetap serupa di antara jenis sorgum merah, hitam, atau putih, yang menunjukkan bahwa jenis sorgum memiliki pengaruh minimal pada hidrofobisitas permukaan protein yang diekstraksi DG. Sebaliknya, pada protein yang diekstraksi dari tepung, nilai H 0 tertinggi (rata-rata) diamati pada jenis sorgum putih (56,91 μg SDS/mg protein), diikuti oleh jenis sorgum merah dan hitam, dengan Red-NLM-20 (Tepung) menunjukkan hidrofobisitas permukaan terendah (52,02 μg SDS/mg protein). Menariknya, perbandingan antara protein yang diekstraksi dari DG dan tepung menunjukkan fluktuasi nilai H 0 , dengan peningkatan yang diamati untuk Red-Waxy (Tepung) dan Black-NLM-16 (Tepung) setelah fermentasi, sementara Red-NLM-20 (Tepung) dan White-4525 (Tepung) mengalami penurunan. Variasi nilai H 0 ini dapat dikaitkan dengan perubahan struktural yang disebabkan oleh perlakuan panas dan proses fermentasi, yang dapat menghambat atau mengekspos residu hidrofobik tergantung pada jenis sampel tertentu. Dalam penelitian oleh Semwal dan Ms ( 2022 ), perlakuan termal menyebabkan penurunan nilai H 0 protein kafirin, yang dikaitkan dengan terungkapnya protein, sehingga menghasilkan lebih sedikit situs hidrofobik yang terekspos. Di antara sampel, SPI menunjukkan hidrofobisitas permukaan tertinggi (68,00 μg SDS/mg protein), diikuti oleh PPI (64,87 μg SDS/mg protein). Namun, perlu dicatat bahwa penelitian sebelumnya telah melaporkan sifat hidrofobisitas permukaan yang relatif lebih rendah untuk PPI dan SPI karena kandungan asam amino hidrofiliknya yang tinggi. Penelitian lebih lanjut harus dilakukan dengan menggunakan metode yang berbeda untuk mengevaluasi sifat hidrofobisitas permukaan.
3.6 Daya Cerna Protein In Vitro dan Kandungan Tanin Total (TTC)
Kecernaan protein in vitro menunjukkan persentase protein yang dicerna dalam kondisi fisiologis yang disimulasikan. Hasilnya disajikan dalam Tabel 4. Untuk protein yang diekstraksi DG, kecernaan protein berkisar antara 74,80% hingga 79,33%, dengan White-32020 (DGs) menunjukkan nilai tertinggi (79,33%) dan Black-NLM-16 (DGs) menunjukkan yang terendah (74,80%). Variabilitas dalam kecernaan protein di antara jenis sorgum dapat dipengaruhi oleh beberapa faktor, termasuk variasi genotipe, struktur tubuh protein dan biji-bijian, ikatan silang protein, dan keberadaan senyawa fenolik (Khoddami et al. 2023 ). Sebaliknya, protein yang diekstraksi dari tepung sorgum umumnya menunjukkan kecernaan yang lebih tinggi (76,25% hingga 79,33%) daripada yang diekstraksi dari DG (74,80% hingga 79,33%). Kecernaan yang relatif lebih rendah yang diamati pada protein yang diekstraksi-DG dapat dikaitkan dengan proses fermentasi, di mana panas meningkatkan pembentukan ikatan silang disulfida, yang menghasilkan struktur protein seperti jaring. Struktur ini akan menghalangi akses ke tempat aksi enzim, membuat protein yang diperkaya kafirin yang diekstraksi-DG lebih tahan terhadap enzim pencernaan, sehingga mengurangi kecernaannya (Day dan Morawicki 2018 ). Meskipun tepung menghasilkan kecernaan yang lebih tinggi secara keseluruhan, Black-NLM-16 (Tepung) masih menunjukkan kecernaan terendah di antara protein yang diekstraksi-tepung. Untuk lebih menjelaskan fenomena ini, kami menyelidiki kandungan tanin total dalam sampel protein.
Seperti yang ditunjukkan pada Tabel 4 , protein yang diekstraksi dari jenis sorgum hitam (baik DG maupun tepung) memiliki kandungan tanin total tertinggi. Protein yang diekstraksi dari DG menunjukkan kandungan tanin total sebesar 2,44 mg ekuivalen katekin/g protein, sedangkan protein yang diekstraksi dari tepung memiliki kandungan yang lebih tinggi yaitu 5,70 mg ekuivalen katekin/g protein, yang konsisten dengan temuan dari penelitian oleh De Morais Cardoso et al. ( 2017 ). Temuan ini menunjukkan korelasi negatif antara kecernaan protein in vitro dan kandungan tanin total. Analisis korelasi selanjutnya mengonfirmasi hal ini, mengungkapkan koefisien korelasi sebesar -0,42. Tanin memiliki kemampuan untuk mengikat protein dan protease dan membentuk kompleks, yang dapat membuatnya resisten terhadap hidrolisis enzim. Selain itu, interaksi tanin-protein dapat mengubah sifat enzim, yang menyebabkan penghambatan enzim pencernaan (Girard dan Awika 2019 ). Selain itu, penting untuk dicatat bahwa beberapa protein dengan kandungan tanin total yang relatif rendah masih menunjukkan daya cerna yang rendah, mungkin karena faktor-faktor seperti kelarutan yang rendah. Di antara protein nabati komersial yang dianalisis, SPI menunjukkan daya cerna protein in vitro tertinggi (86,20%), diikuti oleh PPI (85,75%) dan gluten gandum (83,31%), yang sebanding dengan hasil dari Qin et al. ( 2022 ). Daya cerna SPI, PPI, dan gluten gandum yang lebih tinggi dapat dikaitkan dengan profil proteinnya, kelarutan yang tinggi, dan kandungan tanin yang rendah atau tidak ada dibandingkan dengan protein yang diperkaya kafirin.
3.7 Kapasitas Penahan Air dan Kapasitas Penahan Minyak
Kapasitas menahan air (WHC) dan kapasitas menahan minyak (OHC) merupakan parameter penting yang memengaruhi kemampuan protein untuk menahan air dan mengikat minyak, masing-masing, yang berdampak besar pada tekstur dan rasa makanan selama aplikasi. Tabel 5 menyajikan nilai WHC dan OHC yang diperoleh dalam penelitian kami. Untuk protein yang diekstraksi dari DG, WHC berkisar antara 2,12 hingga 3,42 g air/g protein, dengan nilai tertinggi diamati pada jenis sorgum merah dan terendah pada jenis sorgum hitam. Sebaliknya, protein yang diekstraksi dari tepung menunjukkan nilai WHC berkisar antara 2,08 hingga 2,61 g air/g protein, dengan tren serupa berupa nilai yang lebih tinggi pada jenis sorgum merah dan terendah pada jenis sorgum putih. Perbedaan ini mungkin timbul dari variasi kandungan dan komposisi protein di antara berbagai jenis warna sorgum. Khususnya, kecuali untuk Black-NLM-16, protein yang diekstraksi dari DG secara umum menunjukkan nilai WHC yang lebih tinggi daripada yang diekstraksi dari tepung, yang mungkin disebabkan oleh kontribusi dari komponen karbohidrat residu dalam DG. Hasil yang sebanding diperoleh dari penelitian oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ), dengan nilai WHC berkisar antara 1,99 hingga 2,96 g air/g protein, dan kafirin yang diekstrak dari tepung sorgum merah juga memiliki nilai WHC yang lebih tinggi. Namun, dalam penelitian oleh Amoura et al. ( 2020 ), WHC kafirin yang diekstrak dari metode penggilingan kering atau penggilingan basah masing-masing adalah 1,82 g air/g protein dan 2,20 g air/g protein, yang relatif lebih rendah daripada nilai WHC dalam penelitian ini. Perbedaan ini dapat dikaitkan dengan metode ekstraksi yang digunakan dan praperlakuan.
| Sampel | Kapasitas menahan air (g air/g protein) | Kapasitas menahan minyak (g minyak/g protein) | Kelarutan (%) | Indeks aktivitas pengemulsi (m2 / g) | Indeks stabilitas pengemulsi (min) |
|---|---|---|---|---|---|
| Merah-NLM-20 (DG) | 2,85 ± 0,02 hari | 2,97 ± 0,09 ab | 8,99 ± 0,05 saya | 5,45 ± 0,05 gram | 58,06 ± 1,84 detik |
| Lilin Merah (DG) | 2,84 ± 0,08 hari | 2,81 ± 0,22 SM | 11,64 ± 0,40 jam | 5,34 ± 0,05 gram | 85,56 ± 1,91 jam |
| Putih-32020 (DG) | 2,41 ± 0,02 gram | 2,58 ± 0,24 kDa | 12.30 ± 0,54 jam | 7,15 ± 0,04 e | 41,55 ± 1,55 derajat Fahrenheit |
| Putih-F1000 (DG) | 2,71 ± 0,06 detik | 2,74 ± 0,31 SM | 15,34 ± 0,26 derajat Fahrenheit | 5,20 ± 0,04 gram | 79,87 ± 1,96 miliar |
| Hitam-NLM-16 (DG) | 2,12 ± 0,03 saya | 2,57 ± 0,02 cd | 13,05 ± 0,08 gram | 8,95 ± 0,30 miliar | 55,10 ± 0,86 hari |
| Merah-NLM-SB (DG) | 3,42 ± 0,04 detik | 3,24 ± 0,03 satuan | 7,29 ± 0,20 joule | 7,58 ± 0,04 hari | 48,59 ± 0,66 hari |
| Putih-4525 (DG) | 2,41 ± 0,04 gram | 2,16 ± 0,01 gram | 19,78 ± 0,09 detik | 7,81 ± 0,07 hari | 28,75 ± 0,12 gram |
| Red-NLM-20 (Tepung) | 2,61 ± 0,02 dtk | 2,04 ± 0,06 gram | 8,65 ± 0,31 saya | 6,11 ± 0,02 derajat Fahrenheit | 24,60 ± 0,65 tinggi |
| Lilin Merah (Tepung) | 2,56 ± 0,01 pF | 2,28 ± 0,02 dB | 15,99 ± 0,40 derajat Fahrenheit | 7,89 ± 0,13 hari | 26,14 ± 0,53 jam |
| Black-NLM-16 (Tepung) | 2,25 ± 0,01 jam | 1,97 ± 0,05 gram | 17,49 ± 0,36 hari | 7,94 ± 0,26 hari | 21,04 ± 0,05 joule |
| Putih-4525 (Tepung) | 2,08 ± 0,01 saya | 2,41 ± 0,09 detik | 28,32 ± 0,47 satu | 8,58 ± 0,18 detik | 23,42 ± 0,06 Jt |
| PPI | 6,04 ± 0,08 miliar | 1,19 ± 0,02 jam | 18,57 ± 0,46 hari | 10,65 ± 0,07 satu | 21,53 ± 0,36 joule |
| SPI | 10,01 ± 0,19 per menit | 1,46 ± 0,01 jam | 24,71 ± 0,10 miliar | 9,00 ± 0,04 miliar | 21,07 ± 0,53 joule |
| Perekat | 1,47 ± 0,03 joule | 1,17 ± 0,01 jam | 5,78 ± 0,02 kkal | 5,13 ± 0,43 gram | 18,32 ± 1,03 ribu |
Catatan: Hasil dinyatakan sebagai mean ± SD ( n = 2). Huruf yang berbeda menunjukkan perbedaan yang signifikan pada kolom yang sama ( p < 0,05). (DGs) berarti protein diekstraksi dari DGs dan (Flour) berarti protein diekstraksi dari tepung. SPI berarti isolat protein kedelai dan PPI berarti isolat protein kacang polong.
Di antara sampel protein yang dianalisis, SPI menunjukkan WHC tertinggi (10,01 g air/g protein), diikuti oleh PPI (6,04 g air/g protein) dan protein yang diperkaya kafirin. Sebaliknya, gluten gandum menunjukkan WHC terendah (1,47 g air/g protein) di antara sampel protein, yang mencerminkan perbedaan dalam struktur dan komposisi proteinnya. Lam dkk. ( 2018 ) melaporkan nilai WHC sebesar 4,0 g air/g protein dan 4,6 g air/g protein untuk PPI dan SPI komersial, masing-masing, yang lebih rendah daripada nilai di sini, yang menunjukkan perbedaan potensial dalam metode ekstraksi atau pengeringan dan sumber protein. Selain itu, variasi dalam metode pengujian juga dapat menyebabkan nilai WHC yang berbeda.
Mengenai OHC, protein yang diekstraksi dari DG menunjukkan nilai berkisar antara 2,16 hingga 3,24 g minyak/g protein, dengan nilai tertinggi diamati pada jenis sorgum merah (rata-rata 3 g minyak/g protein) dan terendah pada jenis sorgum putih (rata-rata 2,49 g minyak/g protein), meskipun tidak berbeda secara signifikan ( p < 0,05). Sebaliknya, protein yang diekstraksi dari tepung sorgum menunjukkan nilai OHC berkisar antara 1,97 hingga 2,41 g minyak/g protein, dengan nilai lebih tinggi pada jenis sorgum putih (rata-rata 2,41 g minyak/g protein) dan terendah pada jenis sorgum hitam (1,97 g minyak/g protein). Sebuah studi oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ) juga menunjukkan kisaran OHC yang sama dari 2,04 hingga 2,76 g minyak/g protein, dan kafirin yang diekstraksi dari tepung sorgum putih memiliki OHC yang lebih tinggi, yang konsisten dengan hasil dalam studi ini. Khususnya, protein yang diekstraksi-DG menunjukkan OHC yang jauh lebih tinggi daripada protein yang diekstraksi-tepung ( p < 0,05), yang menunjukkan bahwa proses fermentasi menyebabkan peningkatan paparan daerah hidrofobik yang dapat memerangkap lebih banyak minyak. Selain itu, protein yang diekstraksi-DG mengandung lebih sedikit komponen karbohidrat, yang dihidrolisis untuk menghasilkan etanol, yang memungkinkan protein untuk lebih berinteraksi dengan fraksi minyak. OHC protein tanaman komersial secara umum berada di bawah protein yang diperkaya kafirin, karena lipid dan protein berinteraksi melalui pengikatan rantai alifatik lipid ke rantai samping nonpolar asam amino, dan protein yang lebih hidrofobik cenderung memiliki kecenderungan lebih besar untuk menahan minyak (Lam et al. 2018 ).
3.8 Kelarutan
Kelarutan menunjukkan proporsi protein yang larut dalam pelarut tertentu, biasanya air. Nilai kelarutan yang lebih tinggi menunjukkan dispersibilitas protein yang lebih besar dalam air, yang dapat menguntungkan dalam berbagai aplikasi seperti pengolahan dan formulasi makanan.
Pada Tabel 5 , di antara protein yang diekstraksi DG, jenis sorgum putih menunjukkan kelarutan tertinggi, dengan nilai rata-rata 15,80%, diikuti oleh jenis sorgum hitam pada 13,05% dan jenis merah pada 9,31%. Sebaliknya, kelarutan protein yang diekstraksi dari tepung berkisar antara 8,65% hingga 28,32%, dengan jenis sorgum putih juga menunjukkan kelarutan tertinggi. Tren kelarutan yang diamati dalam penelitian kami sejalan dengan temuan yang dilaporkan oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ), meskipun nilai keseluruhan secara dramatis lebih rendah dibandingkan dengan penelitian kami karena metode pengujian yang berbeda. Namun demikian, tren yang konsisten menunjukkan bahwa protein yang diekstraksi dari varietas sorgum putih cenderung lebih larut.
Secara keseluruhan, protein yang diekstraksi-DG menunjukkan kelarutan yang jauh lebih rendah dibandingkan dengan yang diekstraksi-tepung, yang menunjukkan bahwa protein sorgum dapat mengalami modifikasi struktural selama perlakuan panas dan fermentasi, yang mengakibatkan penurunan tolakan elektrostatik intermolekul dan stabilitas koloid terhadap sedimentasi gravitasi, sehingga mengurangi kelarutan (Ryan et al. 2013 ). Pengamatan ini kontras dengan penelitian Semwal dan Ms ( 2022 ), yang melaporkan peningkatan kelarutan kafirin setelah induksi panas dibandingkan dengan kontrol, yang menunjukkan dampak perlakuan termal pada protein sorgum. Perbedaan tersebut dapat dikaitkan dengan variasi kondisi yang digunakan untuk perlakuan termal relatif terhadap proses fermentasi. Selanjutnya, di antara sampel protein nabati komersial, SPI menunjukkan kelarutan tertinggi sebesar 24,71%.
3.9 Sifat Pengemulsi
Indeks aktivitas pengemulsi (EAI) menunjukkan kemampuan protein untuk membentuk emulsi, dengan nilai yang lebih tinggi menunjukkan sifat pengemulsi yang lebih baik, dan indeks stabilitas pengemulsi (ESI) menunjukkan kemampuan emulsi untuk menahan pemisahan fase dari waktu ke waktu, dengan nilai yang lebih tinggi menunjukkan stabilitas yang lebih baik. Sifat pengemulsi disajikan dalam Tabel 5 .
Untuk protein yang diekstraksi DG, EAI berkisar dari 5,20 hingga 8,95 m 2 /g. EAI tertinggi diamati pada jenis sorgum hitam (8,95 m 2 /g), diikuti oleh jenis sorgum putih (nilai rata-rata 6,72 m 2 /g) dan jenis sorgum merah (rata-rata hingga 6,12 m 2 /g). Sebaliknya, di antara protein yang diekstraksi dari tepung, jenis sorgum putih menunjukkan EAI tertinggi (8,58 m 2 /g). Kafirin memiliki EAI yang jelas lebih rendah berkisar dari 1,08 hingga 1,73 m 2 /g yang dilaporkan oleh Espinosa-Ramírez dan Serna-Saldívar ( 2016 ), di mana kafirin yang diekstraksi dari varietas sorgum putih memiliki EAI yang lebih tinggi dibandingkan dengan yang dari varietas merah yang sejalan dengan tren dalam penelitian ini. Sebaliknya, Dias de Carvalho et al. ( 2024 ) melaporkan nilai EAI yang jauh lebih tinggi berkisar antara 102,49 hingga 125,16 m 2 /g, yang menunjukkan kemungkinan perbedaan dalam bahan baku atau metode ekstraksi. Menariknya, fermentasi menyebabkan penurunan EAI untuk protein yang diekstraksi dari DG dibandingkan dengan yang berasal dari tepung sorgum, kecuali Black-NLM-16, yang menunjukkan peningkatan. Selain itu, SPI dan PPI menunjukkan EAI yang lebih tinggi dibandingkan dengan protein yang diperkaya kafirin yang diekstraksi, sementara gluten gandum menunjukkan EAI terendah di antara sampel protein (5,13 m 2 /g).
Mengenai nilai ESI, protein yang diperkaya kafirin yang diekstrak dari DG menunjukkan nilai yang sangat tinggi berkisar antara 28,75 hingga 85,56 menit. Jenis sorgum merah menunjukkan ESI tertinggi (64,07 menit) dibandingkan dengan jenis sorgum hitam dan putih. Sebaliknya, nilai ESI untuk protein yang diekstrak dari tepung sorgum secara signifikan lebih rendah, berkisar antara 21,04 hingga 26,14 menit, dengan jenis sorgum merah masih menunjukkan ESI tertinggi (25,37 menit) di antara protein yang diekstrak dari tepung. Perbedaan nilai ESI ini dapat mencerminkan variasi dalam karakteristik fisikokimia protein, distribusi ukuran tetesan, dan gaya tolak antar tetesan. Hasil yang dilaporkan oleh Dias de Carvalho et al. ( 2024 ) menunjukkan bahwa isolat protein sorgum yang diekstraksi dalam kondisi basa dan diendapkan melalui penyesuaian pH menggunakan asam memiliki ESI yang lebih rendah berkisar antara 14,76 hingga 20,81 menit dibandingkan dengan penelitian kami, yang juga menunjukkan perbedaan potensial dalam kondisi eksperimen atau sumber protein. SPI dan PPI memiliki nilai ESI yang sebanding dengan protein yang diperkaya kafirin yang diekstraksi dari tepung sorgum, sementara gluten gandum memiliki nilai ESI terendah di antara semua sampel protein (18,32 menit).
4 Kesimpulan
Protein yang diperkaya kafirin yang diekstraksi menggunakan metode asam asetat glasial secara konsisten menunjukkan kandungan protein berkisar antara 68,88% hingga 88,47%. Variasi yang diamati pada warna protein mencerminkan perbedaan warna pada bahan aslinya. Struktur α-helix mendominasi protein, berkisar antara 39,85% hingga 75,93%. Profil SDS-PAGE menunjukkan kesamaan di antara berbagai protein yang diperkaya kafirin, meskipun tiga pita tidak ada dalam rentang 25–37 kDa dan 15–20 kDa pada protein yang diekstraksi DG. Protein yang diekstraksi dari jenis sorgum hitam menunjukkan daya cerna terendah, yang sesuai dengan kadar kandungan tanin total tertinggi. Temuan ini menunjukkan korelasi negatif antara daya cerna protein in vitro dan kandungan tanin total, dengan koefisien korelasi -0,42. Fungsionalitas protein yang diekstraksi dari DG atau tepung menunjukkan beberapa variasi.
Dengan membandingkan protein yang diekstraksi dari tepung dan protein yang diekstraksi dari DG, kita dapat menemukan bahwa protein yang diekstraksi dari DG secara umum menunjukkan kandungan protein, hidrofobisitas permukaan, dan kapasitas menahan air dan minyak yang lebih tinggi, tetapi daya cerna dan kelarutannya lebih rendah dibandingkan dengan protein yang diekstraksi dari tepung sorgum. Perbedaan ini dapat dikaitkan dengan perubahan struktural yang disebabkan oleh proses fermentasi dan menggarisbawahi peran penting metode pemrosesan dalam membentuk sifat fungsional protein. Perbandingan dengan protein nabati komersial menyoroti atribut fungsional yang berbeda dari protein sorgum, dengan isolat protein kedelai dan protein kacang polong menunjukkan kapasitas menahan air, kelarutan, dan aktivitas pengemulsi yang lebih tinggi, sedangkan protein yang diperkaya kafirin unggul dalam kapasitas menahan minyak.
Jenis sorgum memiliki dampak minimal pada sifat protein, kecuali pada sorgum hitam, yang memiliki kadar tanin tinggi dan daya cerna rendah. Hal ini menunjukkan bahwa sebagian besar varietas sorgum dapat digunakan secara bergantian untuk produksi protein. Mengingat sifat fungsionalnya, protein sorgum memiliki potensi aplikasi dalam sistem pangan, seperti analog daging, produk roti, lapisan film yang dapat dimakan, dan bahan dinding untuk membungkus nutrisi dan senyawa bioaktif. Modifikasi yang ditargetkan dapat lebih meningkatkan fungsionalitasnya untuk penggunaan khusus. Singkatnya, temuan ini memberikan wawasan berharga tentang dampak jenis sorgum dan proses fermentasi pada karakteristik dan sifat fungsional protein yang diperkaya kafirin, sehingga meningkatkan pemahaman mendasar tentang protein sorgum. Hasil ini berpotensi untuk lebih memajukan pemanfaatan protein sorgum dalam aplikasi makanan dan industri.

