
ABSTRAK
Faktor intrinsik dan ekstrinsik (penuaan alami, penyakit, infeksi, bahan kimia, radiasi, logam berat, dll.) menciptakan stres oksidatif, yang menyebabkan cacat reproduksi pada pria dan wanita. Demikian pula, stres oksidatif menyebabkan kelainan pada sperma dan oosit, dan dengan demikian mengurangi keberhasilan fertilisasi in vitro. Metabolit yang berasal dari jamur dan/atau alga (polisakarida, karotenoid, ergothioneine, fikobiliprotein, florotanin, dan kordisepin) meringankan kerusakan pada ovarium dan testis dan memperbaiki fungsi reproduksi yang terganggu (spermatogenesis, ovulasi, pembuahan, dan implantasi) pada model in vivo dengan meningkatkan aktivitas enzim antioksidan (superoksida dismutase, katalase, glutathione peroksidase, dll.), memperbaiki parameter mitokondria (potensial membran, distribusi, dinamika, dan aktivitas mitokondria), mengurangi stres oksidatif (pengurangan ROS intraseluler dan kadar malondialdehida), inflamasi (pengurangan kadar COX-2, IL-6, IL-1β, dan TNF-α) dan apoptosis (pengurangan kadar Caspase-3 dan Bax ) serta menyeimbangkan kadar hormon darah (hormon perangsang folikel, hormon luteinisasi, testosteron). Demikian pula, dalam model in vitro, mereka meningkatkan aktivitas enzim antioksidan, mengurangi stres oksidatif dan apoptosis, dan membuat fungsi mitokondria lebih baik, dengan demikian memulihkan cacat pada parameter sperma dan oosit dan meningkatkan pembentukan blastokista. Secara keseluruhan, studi tinjauan ini mengungkapkan bahwa antioksidan dari jamur dan alga berkontribusi pada peningkatan hasil reproduksi manusia dan hewan dan teknologi reproduksi berbantuan dengan mencegah atau mengurangi stres oksidatif. Namun, lebih banyak studi in vitro, in vivo, atau klinis diperlukan untuk membuktikan profil keamanan dan kemanjuran antioksidan berbasis jamur dan alga. Ini adalah studi tinjauan pertama yang berfokus pada efek perlindungan antioksidan berbasis jamur dan alga terhadap cacat reproduksi yang disebabkan oleh stres oksidatif.
Singkatan
KUCING
katalase
COX-2
siklooksigenase 2
GPx
glutation peroksidase
GSH
glutation
H2O2 ( air )
hidrogen peroksida
IL-1β
interleukin-1 beta
Pesawat IL-6
interleukin-6
IVM
media pematangan in vitro
MDA
malondialdehida
TIDAK •
radikal oksida nitrat
O2 • –
radikal superoksida
OH •
radikal hidroksil
ROS
spesies oksigen reaktif
SIRT1
sirtuin1
MERUMPUT
superoksida dismutase
TNF-α
faktor nekrosis tumor alfa
1 Pendahuluan
Dalam sistem kehidupan termasuk manusia, spesies oksigen reaktif (ROS) pada tingkat yang memadai sangat diperlukan untuk fungsi yang tepat dari berbagai proses seluler, sedangkan akumulasi ROS yang berlebihan merusak molekul seluler, membran, dan organel, sehingga menyebabkan masalah kesehatan yang tidak diinginkan, seperti infertilitas, penyakit neurodegeneratif, gangguan kardiometabolik, penyakit radang usus, kanker, diabetes, dan penuaan fisiologis alami (Arslan et al. 2022 , 2023 ; Arslan, Taskin, dan Keles 2024 ; Arslan, Orak, et al. 2024 ; Esim et al. 2024 ). Misalnya, ROS pada tingkat yang memadai sangat penting untuk fungsi yang tepat dari organ dan sel sistem reproduksi pada manusia, sedangkan ROS yang berlebihan, yaitu stres oksidatif, adalah salah satu alasan utama infertilitas manusia. Stres oksidatif yang disebabkan oleh ROS menyebabkan kerusakan DNA dan membran pada sperma, mengurangi motilitas dan viabilitas sperma, reaksi akrosom sperma, dan interaksi sperma-oosit, sehingga berdampak negatif pada infertilitas pria (Lopes et al. 2021 ; Arslan et al. 2022 ; Takeshima et al. 2021 ; Mannucci et al. 2022 ). Demikian pula, stres oksidatif menyebabkan kerusakan ovarium pada wanita, sehingga mengurangi kualitas dan pematangan oosit, pembentukan blastokista, dan implantasi (Agarwal et al. 2005 ; Wang et al. 2021 ; Yan et al. 2022 ; Arslan, Taskin, dan Keles 2024 ).
Dalam literatur, telah didokumentasikan bahwa stres oksidatif yang diciptakan oleh faktor intrinsik atau ekstrinsik dapat menyebabkan gangguan fungsi dan kerusakan pada organ (testis, ovarium, rahim, dll.) dan sel (sperma, oosit, dll.) sistem reproduksi pada wanita dan pria. Terutama penuaan fisiologis alami dianggap sebagai faktor utama yang bertanggung jawab atas berkurangnya fungsi ovarium dan kesuburan pada wanita (Alchalabi et al. 2016 ; Gao et al. 2017 ; Harlev et al. 2017 ; Ramgir dan Abilash 2019 ; Abudawood et al. 2021 ; Santacruz-Márquez et al. 2021 ; Arslan et al. 2022 ; Madhu et al. 2022 ; Zhang et al. 2023 ; Arslan, Taskin, dan Keles 2024 ).
Hingga saat ini, penelitian in vivo telah mengungkapkan bahwa antioksidan eksogen alami atau sintetis dapat melindungi organ dan sel sistem reproduksi terhadap faktor stres oksidatif intrinsik dan ekstrinsik. Demikian pula, antioksidan eksogen juga dapat melindungi sperma, oosit, atau embrio terhadap faktor stres oksidatif dalam model in vitro (Nabenishi et al. 2012 ; Walczak-Jedrzejowska et al. 2013 ; Ahmad et al. 2017 ; Yu et al. 2019 ; Shahat et al. 2020 ; Ghorbani et al. 2021 ; Vašková et al. 2023 ; Arslan, Taskin, dan Keles 2024 ). Misalnya, potensi metabolit antioksidan yang berasal dari tumbuhan (fenolik, alkaloid, antosianin, polisakarida, dll.) atau ekstraknya untuk meringankan cacat reproduksi yang disebabkan oleh stres oksidatif telah diungkapkan oleh banyak artikel penelitian (Li et al. 2015 ; Shi et al. 2018 ; Bahramrezaie et al. 2019 ; Soleimanzadeh et al. 2020 ; Jalili et al. 2021 ; Dong et al. 2024 ). Misalnya, Bahramrezaie et al. ( 2019 ) menemukan bahwa resveratrol, fenolik yang berasal dari tumbuhan, meningkatkan kualitas oosit dan blastokista ketika dioleskan secara oral kepada manusia. Shi et al. ( 2018 ) menemukan bahwa polisakarida yang dimurnikan dari tumbuhan Lycium barbarum meringankan disfungsi testis diabetes dengan menghambat autofagi abnormal yang disebabkan oleh stres oksidatif pada tikus jantan. Sebuah penelitian terbaru yang dilakukan oleh Dong et al. ( 2024 ) menjelaskan bahwa antosianin dari tanaman L. ruthenicum murray dapat mengaktifkan jalur pensinyalan keap1/nrf2 dan dengan demikian melemahkan stres oksidatif dan toksisitas testis yang disebabkan oleh kadmium. Lebih jauh, potensi perlindungan metabolit yang berasal dari tanaman atau ekstraknya terhadap cacat reproduksi telah dibahas dalam beberapa artikel tinjauan (Sorelle et al. 2019 ; Akbaribazm et al. 2021 ; Yang et al. 2021 ; Vašková et al. 2023 ). Sebaliknya, potensi metabolit (polisakarida, karotenoid, ergothioneine, fikobiliprotein, florotanin, dan kordisepin) dari jamur dan/atau alga belum disebutkan dalam artikel tinjauan mana pun. Oleh karena itu, kajian ini berfokus pada peningkatan pengetahuan literatur terkini tentang pengaruh perlindungan in vitro dan/atau in vivo dari metabolit antioksidan ini pada organ dan sel sistem reproduksi manusia dan hewan. Kajian ini disiapkan dengan mempertimbangkan sebagian besar publikasi dari 5 tahun terakhir (2020–2024).
2 Antioksidan Melawan Penyakit Akibat Stres Oksidatif
Spesies oksigen reaktif (ROS) adalah sekumpulan molekul tidak stabil yang dihasilkan oleh semua jenis sel. ROS yang paling terkenal adalah hidrogen peroksida (H 2 O 2 ), radikal hidroksil (OH • ), oksigen singlet ( 1 O 2 ) dan superoksida (O 2 •– ) (Su et al. 2019 ). Sumber endogen ROS adalah mitokondria, retikulum endoplasma, peroksisom, nuklei, sitosol, membran plasma, dan ruang ekstraseluler. Sumber utama ROS mitokondria adalah rantai transpor elektron yang terletak di membran mitokondria bagian dalam. Oleh karena itu, ROS diterima sebagai produk sampingan metabolisme energi aerobik dalam sel (Bedard dan Krause 2007 ). Mayoritas ROS intraseluler dihasilkan oleh mitokondria; Namun, retikulum endoplasma (ER), yang menghasilkan sekitar 25% dari total ROS, dianggap sebagai penyumbang ROS penting lainnya (Tu dan Weissman 2004 ). Selain itu, ada beberapa faktor eksogen yang menyebabkan produksi ROS dalam sel, seperti polutan udara, asap tembakau, radiasi pengion dan nonpengion, obat-obatan, xenobiotik, logam berat, dan pestisida (Bhattacharyya et al. 2014 ).
Pada organisme hidup, ROS pada tingkat yang memadai (tingkat rendah atau sedang) berfungsi sebagai transduser sinyal, dengan demikian memediasi berbagai proses seluler (proliferasi sel, migrasi, diferensiasi, apoptosis, dll.). Selain itu, tingkat ROS yang memadai dapat mencegah patogen. Oleh karena itu, tingkat ROS yang memadai disebut sebagai “stres baik”. Sementara akumulasi ROS yang berlebihan dalam sel menciptakan stres oksidatif (stres buruk) dan pengaruh yang merugikan dalam sel dengan mengoksidasi molekul seluler (asam nukleat, protein, dan lipid) (Liguori et al. 2018 ; Lee dan Song 2021 ; Nakamura dan Takada 2021 ; Jomova et al. 2023 ; Esim et al. 2024 ). Misalnya, tingkat ROS yang tinggi menyebabkan gangguan produksi energi di mitokondria, menghambat enzim sistem pernapasan. Demikian pula, kadar ROS yang tinggi menyebabkan terganggunya dinamika mitokondria dengan memengaruhi protein fisi dan fusi mitokondria (Damas et al. 2014 ; Lakshmanan et al. 2018 ). Paparan lipid terhadap ROS mengakibatkan peroksidasi lipid. Peristiwa ini membahayakan fosfolipid secara langsung dan juga dapat berperilaku sebagai sinyal sel yang menginduksi kematian sel terprogram. Lebih jauh lagi, fosfolipid yang teroksidasi dapat memediasi perubahan proinflamasi (Que et al. 2018 ). Misalnya, membran sel atau organel secara khusus lebih rentan terhadap pengaruh merugikan ROS karena memiliki kandungan asam lemak tak jenuh ganda yang lebih tinggi (Arslan et al. 2023 ; Esim et al. 2024 ).
Stres oksidatif yang diinduksi ROS, yaitu stres buruk, terlibat dalam kondisi patologis, seperti infertilitas, kanker, penyakit radang usus, diabetes, artritis reumatoid, penyakit vaskular kardiovaskular (hipertensi, aterosklerosis, gagal jantung, dan fibrilasi atrium), penyakit retina (degenerasi makula, glaukoma, retinopati diabetik, dan oklusi vena retina), penyakit neurodegeneratif (penyakit Alzheimer, penyakit Parkinson, Penyakit Huntington, dan Penyakit Wilson), disfungsi ginjal, penyakit ginjal kronis, obesitas, penuaan alami, dan penuaan kulit (Popolo et al. 2013 ; Damas et al. 2014 ; Bhatti et al. 2017 ; Mao et al. 2017 ; Masuda et al. 2017 ; Lakshmanan et al. 2018 ; Nebbioso et al. 2022 ; Arslan et al. 2022 ; Arslan, Taskin, dan Keles 2024 ). Dengan demikian, menjaga ROS pada tingkat yang memadai, yaitu tingkat rendah atau sedang, sangat diperlukan untuk menjalankan fungsi seluler dan mencegah stres oksidatif. Pada manusia, keseimbangan ini dipertahankan oleh molekul endogen dan eksogen dengan aktivitas antioksidan.
Sistem antioksidan endogen secara umum terdiri dari dua kelompok antioksidan: enzim antioksidan dan antioksidan non-enzimatik. Kelompok pertama mengandung superoksida dismutase (SOD), katalase (CAT) dan glutathione peroksidase (GPx), dan tioredoksin (Trx), sedangkan kelompok kedua meliputi koenzim Q10, melatonin, bilirubin, glutathione, protein pengikat logam, dll. (Mirończuk-Chodakowska et al. 2018 ; Arslan et al. 2023 ).
Antioksidan eksogen sebagian besar dikonsumsi melalui makanan atau sebagai suplemen dari tumbuhan; namun, antioksidan dapat diperoleh dari sumber alami lainnya, termasuk alga, lumut kerak, bakteri, dan jamur. Antioksidan yang berasal dari sumber alami ini menunjukkan peran protektif terhadap penyakit yang disebabkan oleh stres oksidatif (Mirończuk-Chodakowska et al. 2018 ; Ak Sonat et al. 2018 ; Liang et al. 2019 ; Jędrejko et al. 2021 ; Khavari et al. 2021 ; Ampofo and Abbey 2022 ; Arslan et al. 2023 ; Chen et al. 2023 ; Vignaud et al. 2023 ; Naik and Gupte 2023 ; Rahim et al. 2024 ).
3 Antioksidan Melawan Kelainan Reproduksi Akibat Stres Oksidatif
Infertilitas didefinisikan sebagai ketidakmampuan untuk mencapai kehamilan spontan meskipun telah melakukan hubungan seksual tanpa pengaman secara teratur selama 12 bulan atau lebih. Penyakit ini memengaruhi sekitar 15% pasangan (Mannucci et al. 2022 ). Stres oksidatif merupakan salah satu faktor utama infertilitas pria dan wanita (Agarwal et al. 2005 ; Arslan et al. 2022 ).
Tingkat fisiologis ROS, biasanya digambarkan sebagai tingkat ROS rendah atau sedang, sangat penting untuk pematangan dan motilitas sperma serta kemotaksis, kapasitasi, hiperaktivasi, reaksi akrosom, dan sifat interaksi oosit (Mannucci et al. 2022 ). Sebaliknya, ROS yang berlebihan merusak organ dan sel reproduksi pada pria dan wanita. Misalnya, stres oksidatif yang diinduksi ROS menyebabkan kelainan histomorfologi pada tunika albuginea, sel germinal, tubulus seminiferus, dan jaringan interstisial testis (Dutta et al. 2021 ; Arafa et al. 2024 ). Lebih jauh lagi, ROS yang berlebihan mengubah fluiditas dan integritas membran sperma dengan menyebabkan peroksidasi lipid dalam membran, sehingga mengubah morfologi sperma dan menurunkan motilitas dan viabilitas. Akhirnya, kelainan fungsional dan morfologi mencegah sperma membuahi sel telur, sehingga menyebabkan infertilitas (Chandra et al. 2012 ; Chianese dan Pierantoni 2021 ; Momeni dan Eskandari 2020; Hussain et al. 2023 ). Lebih jauh lagi, stres oksidatif yang dipicu oleh ROS secara signifikan meningkatkan kadar malondialdehid (MDA) dalam plasma mani dengan menyebabkan peroksidasi lipid (Dorostghoal et al. 2017 ).
Pada wanita, ovarium memiliki dua fungsi utama. Yang pertama adalah untuk menghasilkan hormon yang mengaktifkan sistem reproduksi wanita, dan yang kedua adalah untuk mengendalikan perkembangan, seleksi, dan pelepasan oosit melalui proses yang dikenal sebagai folikulogenesis (Barnett et al. 2006 ). Kadar ROS yang adekuat sangat penting untuk steroidogenesis, folikulogenesis, ovulasi, fungsi tuba, implantasi, dan perkembangan embrio (Kaltsas et al. 2023 ). Sebaliknya, stres oksidatif yang diinduksi ROS menyebabkan kelainan histomorfologi pada oosit, ovarium, dan uterus, dan juga berdampak negatif pada kadar hormon plasma (Sharma et al. 2015 ; Alchalabi et al. 2016 ; Arslan, Taskin, dan Keles 2024 ). Selain itu, stres oksidatif mempercepat penuaan ovarium dan meningkatkan apoptosis, peradangan, kerusakan mitokondria, pemendekan telomer, dan kerusakan makromolekul, sehingga menyebabkan hilangnya atau penurunan fungsi ovarium (folikulogenesis, ovulasi, implantasi, dll.; Agarwal et al. 2005 ; Wang et al. 2021 ; Yan et al. 2022 ; Arslan, Taskin, dan Keles 2024 ).
Penuaan fisiologis alami merupakan salah satu kontributor utama infertilitas wanita. Meskipun penuaan fisiologis memengaruhi semua organ tubuh, proses penuaan di ovarium terjadi lebih cepat dibandingkan di organ lain, seperti rahim, kelenjar pituitari, atau pankreas (Amanvermez dan Tosun 2016 ; Arslan, Taskin, dan Keles 2024 ). Selama proses penuaan, stres oksidatif yang terjadi dengan akumulasi ROS mengurangi kualitas oosit di ovarium, memicu apoptosis sel granulosa, mempercepat degenerasi korpus luteum, mengurangi komunikasi antara oosit dan sel granulosa, dan menghambat pematangan oosit (Sasaki et al. 2019 ; Cajas et al. 2020 ; Yang et al. 2021 ). Selain itu, jumlah embrio yang berkembang menurun karena penuaan ovarium mengurangi kualitas oosit. Selain itu, seiring dengan penurunan fungsi endokrin ovarium seiring bertambahnya usia, terjadi kelainan pada sistem pembuluh darah rahim, yang mengurangi keberhasilan implantasi (Gougeon et al. 1994 ; Szafarowska dan Jerzak 2013 ; Meldrum et al. 2016 ; Ansere et al. 2021 ). Selain penuaan alami, beberapa penyakit (endometriosis, sindrom ovarium polikistik, varikokel, infeksi, dll.) dan faktor eksogen lainnya (agen kemoterapi, radiasi, merokok, polutan organik, logam berat, penggunaan alkohol, dll.) dapat menyebabkan akumulasi ROS dan stres oksidatif pada pria dan wanita, dan akhirnya infertilitas hewan dan manusia (Gao et al. 2017 ; Harlev et al. 2017 ; Ramgir dan Abilash 2019 ; Abudawood et al. 2021 ; Santacruz-Márquez et al. 2021 ; Arslan et al. 2022 ; Madhu et al. 2022 ; Zhang et al. 2023 ; Arslan, Taskin, dan Keles 2024 ; Gambar 1 ).
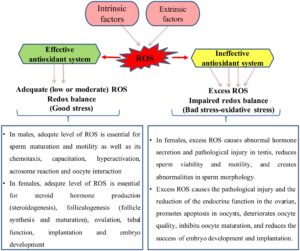
Secara keseluruhan, dapat dikatakan bahwa stres oksidatif berdampak negatif pada spermatogenesis, ovulasi, dan implantasi pada hewan dan manusia. Oleh karena itu, mencegah akumulasi ROS yang berlebihan dianggap sebagai pendekatan penting dalam melindungi organ dan sel sistem reproduksi wanita dan pria dari stres oksidatif. Dalam konteks ini, penggunaan antioksidan dari sumber alami (tumbuhan, jamur, makroalga, mikroalga, bakteri, dll.) dianggap sebagai solusi untuk pengurangan atau pencegahan kelainan reproduksi terkait stres oksidatif.
4 Pentingnya Bioteknologi Jamur dan Alga
Jamur merupakan organisme eukariotik yang tersebar di lingkungan darat dan perairan. Jamur dikategorikan menjadi tiga kelompok utama: khamir bersel tunggal, jamur mikro berfilamen (kapang), dan jamur berfilamen makroskopis (jamur). Hanya sebagian kecil jamur yang bersifat patogen, dan sebagian besar menguntungkan bagi manusia. Misalnya, khamir, jamur, dan jamur digunakan untuk menghasilkan zat bioaktif yang memiliki beragam aplikasi dalam industri makanan, kosmetik, nutraseutika, dan farmasi (Arslan et al. 2023 ; Arslan, Orak, et al. 2024 ).
Alga merupakan organisme fotosintetik tunggal atau multiseluler yang hidup di air atau lingkungan lembap dan menghasilkan makanannya sendiri. Alga secara umum dibagi menjadi mikroalga dan makroalga. Ukuran mikroalga bervariasi antara 1 mm hingga beberapa cm, dan hanya dapat dilihat melalui peralatan pembesar, sedangkan ukuran makroalga dapat mencapai panjang hingga 60 m, dan dapat dilihat dengan jelas oleh mata telanjang (Biris-Dorhoi et al. 2020 ; Pereira 2021 ). Berdasarkan pigmentasinya, makroalga dapat dikategorikan menjadi tiga kelompok besar: rumput laut coklat ( Phaeophyceae ), rumput laut merah ( Rhodophyceae ), dan rumput laut hijau ( Chlorophyceae ) (Deepika et al. 2022 ).
Makroalga, juga dikenal sebagai rumput laut, memiliki kandungan karbohidrat, protein, lipid, vitamin, dan serat yang tinggi. Mereka juga kaya akan asam amino esensial dan mineral. Karena komposisi nutrisinya yang kaya, beberapa makroalga dikonsumsi sebagai makanan atau bahan tambahan makanan untuk manusia atau hewan (Deepika et al. 2022 ; Guo et al. 2022 ). Selain itu, mereka menghasilkan berbagai polisakarida (agar, alginat, karagenan, dll.), yang banyak digunakan dalam industri makanan, kosmetik, dan farmasi (Chudasama et al. 2021 ; Deepika et al. 2022 ). Selain itu, makroalga dapat mensintesis metabolit sekunder yang menunjukkan beragam aktivitas biologis, dan oleh karena itu penting untuk aplikasi farmasi (Silva et al. 2020 ).
Mikroalga memiliki struktur sel eukariotik atau prokariotik. Mikroalga prokariotik dikelompokkan menjadi divisi Cyanophyta dan Prochlorophyta , sedangkan mikroalga eukariotik mencakup divisi berikut: Chlorophyta, Euglenophyta, Rhodophyta, Haptophyta (Prymnesiophyta), Heterokontophyta (Bacillariophyceae, Chrysophyceae, Xantophyceae , antara lain), Cryptophyta , dan Dinophyta (Silva et al. 2019 ). Mikroalga ada dalam bentuk uniseluler maupun multiseluler, dan memiliki potensi untuk hidup di lingkungan akuatik dan terestrial. Mereka banyak digunakan sebagai agen bioremediasi dalam sistem pengolahan air limbah untuk menghilangkan logam berat, pewarna, gas beracun, dan kontaminan berbasis minyak bumi (Esim et al. 2024 ). Mikroalga yang memiliki kandungan lipid tinggi digunakan sebagai bahan baku untuk produksi biodiesel (Maity et al. 2014 ). Beberapa mikroalga dikonsumsi sebagai makanan oleh manusia. Selain itu, mikroalga memiliki kepentingan bioteknologi dan medis karena mampu menghasilkan metabolit alami yang memiliki aktivitas biologis yang menjanjikan (Khavari et al. 2021 ; Ampofo dan Abbey 2022 ).
5 Antioksidan Berasal dari Jamur dan Alga untuk Melawan Cacat Reproduksi Akibat Stres Oksidatif
Penelitian yang dilakukan telah mengungkapkan bahwa metabolit turunan jamur dan alga (mikro dan makro alga) (polisakarida, karotenoid, ergothioneine, fikobiliprotein, florotanin, cordycepin, dll.) dapat mencegah atau melemahkan masalah reproduksi terkait stres oksidatif dalam model in vivo dan in vitro (Chen et al. 2010 , 2023 ; Sohn et al. 2012 ; Kopalli et al. 2019 ; Pyeon et al. 2021 ; Ghareeb et al. 2021 ; Wang, Tan, et al. 2022 ; Yang et al. 2022 ; Semaida et al. 2022 ; Farag et al. 2023 ; Jeong et al. 2023 ; Rahim et al. 2024 ) (Gambar 2 ).
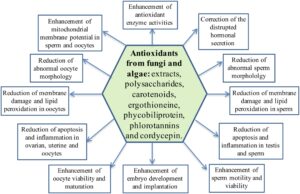
5.1 Polisakarida Melawan Cacat Reproduksi yang Disebabkan oleh Stres Oksidatif
Polisakarida adalah makromolekul yang terdiri dari unit-unit monosakarida yang dihubungkan oleh ikatan glikosidik. Makromolekul dengan berat molekul tinggi ini disintesis oleh semua organisme, termasuk tumbuhan, hewan, jamur, bakteri, makroalga, dan mikroalga. Berdasarkan unit monosakarida, polisakarida dikategorikan menjadi dua kelompok utama: homopolisakarida dan heteropolisakarida. Kelompok pertama mencakup polisakarida yang terdiri dari unit-unit berulang dari hanya satu jenis monosakarida, sedangkan yang terdiri dari unit-unit berulang dari dua atau lebih jenis monosakarida terdapat pada kelompok kedua (Arslan et al. 2023 ; Arslan, Orak, et al. 2024 ).
Berdasarkan distribusi dan lokalisasinya, polisakarida yang berasal dari jamur dikategorikan menjadi dua kelompok utama: polisakarida intraseluler (IPS) dan ekstraseluler (EPS), dan yang berasal dari mikroalga dikategorikan menjadi tiga kelompok utama: polisakarida struktural (dinding sel), polisakarida cadangan (α- dan β-glukan) dan EPS (Laroche 2022 ; Wang, Tan, et al. 2022 ; Synytsya et al. 2023 ). Polisakarida yang berasal dari jamur dan/atau mikroalga menunjukkan berbagai sifat bioaktif, termasuk antioksidan, imunomodulator, antikanker, hepatoprotektif, antiinflamasi, antipenuaan, hipolipidemik, antikoagulan, antilipidemik, antivirus, antibakteri, antijamur, dan aktivitas radioprotektif (Severo et al. 2022 ; Arslan et al. 2023 ).
Upaya yang dilakukan telah menunjukkan bahwa polisakarida antioksidan yang berasal dari jamur atau mikroalga mampu melindungi organ sistem reproduksi (testis dan ovarium) dan sel-sel (sperma dan oosit) terhadap stres oksidatif yang disebabkan oleh penuaan alami dan bahan kimia, sehingga mengurangi masalah pembuahan (Tabel 1 ). Misalnya, Ak Sonat et al. ( 2018 ) mengungkapkan bahwa ketika diterapkan secara intragastrik pada tikus jantan dengan pembatasan diet selama 14 hari, β-glukan yang berasal dari Euglena gracilis meningkatkan motilitas dan vitalitas spermatozoa, berat organ reproduksi (testis, vesicula seminalis dan epididimis) dan diameter tubulus seminiferus. Dalam karya yang berbeda, Wang, Li, et al. ( 2022 ) bermaksud untuk memeriksa efek perlindungan polisakarida miselium (MMP) dari jamur Macrolepiota procera pada gangguan reproduksi yang disebabkan oleh nonilfenol (NP) pada tikus jantan. Hasilnya mengungkapkan bahwa pengobatan NP menyebabkan stres oksidatif pada jaringan testis, penurunan jumlah sperma dan indeks testis, peningkatan deformasi sperma, sekresi hormon abnormal, dan cedera patologis. Sebaliknya, pemberian MMP mengurangi stres oksidatif dan membalikkan perubahan yang tidak diinginkan dalam parameter reproduksi pada tikus yang diobati dengan NP. Lebih jauh lagi, pemberian MMP ditentukan untuk meningkatkan respons autofagi dan inflamasi secara nyata dan untuk menekan jalur pensinyalan Akt/mTOR pada jaringan testis. Dalam karya lain, Zhou et al. ( 2023 ) bertujuan untuk memeriksa efek polisakarida (PCP) dari jamur yang dapat dimakan Poria cocos pada kualitas dan metilasi DNA spermatozoa kriopreservasi babi putih Shanghai. Dibandingkan dengan kelompok kontrol (bebas PCP), pengobatan PCP meningkatkan viabilitas spermatozoa dan meningkatkan motilitas, integritas membran plasma, integritas akrosom, dan aktivitas mitokondria pada spermatozoa beku-cair. Hasilnya juga menunjukkan bahwa jika dibandingkan dengan kontrol, pengobatan PCP menurunkan kadar ROS dan MDA serta meningkatkan aktivitas SOD, katalase, dan GSH-Px pada spermatozoa. Lebih jauh, hasilnya mengungkapkan bahwa jika dibandingkan dengan kontrol, PCP menyebabkan penurunan kadar 5-methylcytosine, indikator metilasi DNA spermatozoa. Secara keseluruhan, penulis menyimpulkan bahwa strategi pengobatan berbasis PCP dapat digunakan untuk kriopreservasi semen babi. Dalam penelitian sebelumnya, Ding et al. ( 2020 ) bertujuan untuk mengevaluasi efek polisakarida (IOP) jamur yang dapat dimakan Inonotus obliquus terhadap cacat fungsi reproduksi Toxoplasma gondii.-tikus jantan yang terinfeksi. Temuan penelitian mereka mengungkapkan bahwa TIO melemahkan kerusakan patologis testis dan meningkatkan kapasitas spermatogenik, testosteron serum (T), hormon luteinisasi (LH) dan kadar hormon perangsang folikel (FSH) ketika diberikan secara oral kepada tikus jantan yang terinfeksi T. gondii . TIO juga mengurangi kadar MDA dan oksida nitrat (NO) tetapi meningkatkan aktivitas SOD dan kadar glutathione (GSH). Selain itu, TIO dipastikan menekan apoptosis pada sel testis dengan mengurangi ekspresi protein × terkait Bcl-2 (Bax) dan caspase-3 yang terbelah. Secara keseluruhan, penelitian ini mengungkapkan bahwa TIO menunjukkan stres anti-oksidatif dan aktivitas anti-apoptosis, sehingga secara signifikan membalikkan cacat pada fungsi reproduksi tikus jantan yang terinfeksi T. gondii .
| Faktor toksisitas | Senyawa bioaktif | Aktivitas in vitro/in vivo | Referensi |
|---|---|---|---|
| Pembatasan makanan | β-glukan dari mikroalga Euglena gracilis | Pembatasan diet mengurangi motilitas dan vitalitas spermatozoa, berat organ reproduksi (testis, vesicula seminalis dan epididimis) dan diameter tubulus seminiferus, sementara β-glukan memperbaiki cacat ini pada parameter sperma dan organ reproduksi (In vivo) | Ak Sonat dkk. ( 2018 ) |
| Nonilfenol | Polisakarida dari jamur Macrolepiota procera | Nonilfenol mengurangi jumlah sperma dan indeks testis, dan juga menyebabkan deformasi sperma, sekresi hormon abnormal dan cedera patologis secara in vivo. Penambahan polisakarida melemahkan efek toksik nonilfenol ini (In vivo) | Wang, Li, dkk. ( 2022 ) |
| Pemaparan semen terhadap kriopreservasi | Polisakarida dari jamur Poria cocos yang dapat dimakan | Kriopreservasi menurunkan viabilitas, motilitas, integritas membran plasma, integritas akrosom, dan aktivitas mitokondria sperma babi (in vitro), sementara polisakarida melemahkan efek toksik ini. Polisakarida juga menurunkan kadar ROS, MDA, dan metilasi DNA serta meningkatkan aktivitas SOD, katalase, dan GSH-Px pada spermatozoa (in vitro) | Zhou dan kawan-kawan ( 2023 ) |
| Infeksi Toksoplasma gondii | Polisakarida dari jamur yang dapat dimakan Inonotus obliquus | Infeksi tersebut mengurangi kapasitas spermatogenik, menyebabkan kerusakan patologis pada testis, mengganggu sekresi hormon, sementara polisakarida menunjukkan sifat protektif terhadap efek toksik tersebut. Lebih jauh, polisakarida menurunkan kadar MDA dan NO • serta meningkatkan aktivitas SOD dan kandungan GSH (In vivo) | Ding dan kawan-kawan ( 2020 ) |
Singkatan: CAT, katalase; GPx, glutation peroksidase; GSH, glutation; MDA, malondialdehid ; NO • , radikal oksida nitrat; ROS, spesies oksigen reaktif; SOD, superoksida dismutase.
5.2 Ergothioneine Melawan Kelainan Reproduksi yang Disebabkan Stres Oksidatif
Ergothioneine (EGT) adalah asam amino tio-histidin betaine yang larut dalam air yang berasal dari histidin (Borodina et al. 2020 ). Meskipun EGT disintesis oleh jamur (jamur, khamir, dan kapang) dan bakteri, produsen utamanya adalah jamur (Arslan et al. 2023 ). Misalnya, beberapa jamur ( Lentinus edodes, Pleurotus ostreatus, P. eryngii , Grifola frondosa dll.) serta beberapa bakteri ( Mycobacterium smegmatis dan Lactobacillus reuteri ) dan ragi ( Rhodotorula mucilaginosa DL-X01 dan Aureobasidium pullulans ) dapat menghasilkan EGT secara alami (Dubost et al. 2006 ; Sao Emani dkk . 2013 ; Fujitani dkk . 2018 ; Selain itu, EGT dilaporkan diproduksi oleh beberapa bakteri yang direkayasa secara genetik ( Esherichia coli dan Methylobacterium Aquaticum strain 22A, Mycolicibacterium neoaurum , Corynebacterium glutamicum dan Burkholderia pseudomallei ), ragi ( Saccharomyces cerevisiae , Schizosaccharomyces pombe , dan Yarrowia lipolytica ), dan jamur berserabut Aspergillus oryzae (Gamage et al. 2018 ; Sejauh ini, belum ada eukariota tingkat tinggi, termasuk manusia dan tumbuhan, yang tercatat dapat melakukan biosintesis EGT (Borodina dkk. 2020 ; van der Hoek dkk. 2022 ).
Hewan mengambil EGT dengan makanan dari makanan (seperti jamur, biji-bijian, organ dalam) dan kemudian mengangkutnya ke dalam sel dan jaringan melalui transporter ergothioneine spesifik (carnitine/organic cation transporter OCTN1) pada membran sel (Fu dan Shen 2022 ). Telah didokumentasikan dalam literatur bahwa ketika EGT diberikan kepada manusia atau hewan, ia terakumulasi di beberapa jaringan dan organ. Bahkan, ia hadir dalam cairan dan sekresi ekstraseluler manusia, dan cairan mani hewan (Halliwell et al. 2018 ). Dalam tubuh manusia, kadar EGT tertinggi di hati dan eritrosit; namun, akumulasi masifnya juga tinggi di usus, air mani, testis, sumsum tulang, ginjal, limpa, paru-paru, mata, dan otak. Terutama di jaringan dan organ di mana stres oksidatif dan peradangan berlebihan, kadar EGT lebih tinggi (Fu dan Shen 2022 ).
EGT dianggap sebagai salah satu antioksidan paling kuat. Ia memiliki potensi untuk membersihkan OH − , 1 O 2 , asam hipoklorit (HOCl), dan peroksinitrit (ONOO − ) (Cheah dan Halliwell 2012 ; Fu dan Shen 2022 ). Misalnya, EGT dilaporkan memiliki potensi pembersihan radikal bebas yang lebih tinggi jika dibandingkan dengan antioksidan terkenal lainnya, termasuk GSH, Trolox (analog vitamin E) dan asam urat (Franzoni et al. 2006 ). Selain itu, EGT menunjukkan aktivitas biologis lainnya, yaitu aktivitas anti-inflamasi, anti-apoptosis, dan anti-penuaan (Apparoo et al. 2022 ). Karena kapasitas antioksidannya, ia menunjukkan sifat sitoprotektif yang kuat pada beberapa sel dan jaringan penting. Misalnya, EGT melindungi eritrosit terhadap kerusakan HClO (Cheah dan Halliwell 2012 ). Demikian pula, ia melindungi neuron terhadap toksisitas yang disebabkan oleh bahan kimia atau obat-obatan (Paul 2022 ). Selain itu, karena potensi antioksidan dan anti-inflamasi, ia memberikan perlindungan terhadap penyakit yang disebabkan oleh stres oksidatif, seperti diabetes, penyakit kardiovaskular, penyakit hati, penyakit neurodegeneratif, penyakit Crohn, artritis reumatoid, dan penyakit radang usus (Fu dan Shen 2022 ). Selain itu, penelitian telah menjelaskan bahwa molekul tersebut berkontribusi pada pengurangan cacat reproduksi yang disebabkan oleh stres oksidatif atau peradangan (Tabel 2 ). Misalnya, Dare et al. ( 2019 ) menunjukkan bahwa ketika cisplatin diterapkan pada tikus wistar jantan, itu mengurangi jumlah sperma, konsentrasi testosteron serum, dan kadar enzim antioksidan (SOD, GPx, CAT), meningkatkan morfologi sperma abnormal, jumlah sel sperma mati, kadar MDA, dan juga menyebabkan kerusakan histopatologis pada testis, sedangkan EGT yang diterapkan secara oral secara signifikan mencegah efek buruk cisplatin ini. Dalam karya yang berbeda, Chen et al. ( 2023 ) berfokus pada evaluasi potensi terapeutik EGT pada kerusakan testis yang disebabkan oleh varikokel (VC) secara in vivo, in vitro, dan in silico. Hasil dari percobaan in vivo mengungkapkan bahwa EGT meningkatkan kualitas sperma pada tikus model VC ketika diberikan secara intragastrik. Percobaan in vitro menunjukkan bahwa stres oksidatif yang diinduksi H 2 O 2 mengurangi proliferasi dan meningkatkan apoptosis pada sel GC1 dan GC2, tetapi penambahan EGT mengoreksi kelainan ini. Analisis molecular docking, western blot, imunohistokimia, dan RT-qPCR mengungkapkan bahwa EGT melemahkan cedera testis dengan meningkatkan ekspresi gen penting, HSP90AA1. Dalam penelitian terbaru, Jeong et al. ( 2023) meneliti pengaruh penambahan EGT pada pematangan oosit babi dalam periode pematangan in vitro (IVM) dan kompetensi perkembangan embrio setelah fertilisasi in vitro (IVF). Analisis mengungkapkan bahwa kelompok EGT memiliki kadar GSH intraseluler yang lebih tinggi dan kadar ROS intraseluler yang lebih rendah setelah IVM dibandingkan dengan kontrol. Lebih jauh, EGT ditentukan untuk meningkatkan tingkat ekspresi gen terkait jalur antioksidan dalam sel kumulus dan oosit setelah IVM. Setelah IVF, tingkat pembelahan dan pembentukan perkembangan blastokista ditemukan jauh lebih tinggi pada kelompok EGT 10 μM dibandingkan dengan kelompok kontrol. Dalam studi yang berbeda (Usuga et al. 2021 ), para peneliti bermaksud untuk menilai kapasitas krioprotektif EGT pada kualitas semen anjing yang dicairkan. Percobaan menunjukkan bahwa jika dibandingkan dengan kontrol, EGT (100 μM) meningkatkan motilitas total dan progresif, kecepatan garis lurus, sperma cepat, dan integritas akrosomal serta menurunkan morfologi abnormal dan produksi ROS. Secara keseluruhan, para peneliti menyimpulkan bahwa ergothioneine melemahkan cacat sperma dan stres oksidatif dalam semen anjing yang dicairkan.
| Faktor toksisitas | Senyawa bioaktif | Aktivitas in vitro/in vivo | Referensi |
|---|---|---|---|
| Cisplatin (agen kemoterapi) | Ergotionein | Cisplatin menurunkan jumlah sperma, konsentrasi testosteron serum dan aktivitas enzim antioksidan (SOD, GPx, CAT) dan meningkatkan morfologi sperma abnormal, tingkat MDA dan juga menyebabkan kerusakan histopatologi pada testis tikus, sementara ergothioneine yang dioleskan secara oral mencegah efek buruk ini. | Dare dan kawan-kawan ( 2019 ) |
| Varikokel | Ergotionein | Varikokel mengurangi kualitas sperma dan menyebabkan cedera testis pada tikus, sementara ergothioneine melemahkan efek buruk ini (in vivo) | Chen dan kawan-kawan ( 2023 ) |
| Pemaparan semen terhadap kriopreservasi | Ergotionein | Proses kriopreservasi mengurangi motilitas, kecepatan garis lurus, dan integritas akrosomal serta meningkatkan morfologi abnormal dan produksi ROS dalam semen anjing, namun ergothioneine melemahkan efek buruk ini. | Usuga dan kawan-kawan ( 2021 ) |
Singkatan: CAT, katalase; GPx, glutathione peroksidase; MDA, malondialdehyde ; ROS, spesies oksigen reaktif; SOD, superoksida dismutase.
5.3 Cordycepin Melawan Cacat Reproduksi yang Disebabkan Stres Oksidatif
Cordyceps militaris adalah spesies jamur yang penting secara medis yang banyak digunakan di negara-negara Asia Timur untuk mengobati berbagai penyakit dan masalah kesehatan. Jamur ini juga digunakan untuk menyembuhkan masalah kesehatan yang berkaitan dengan penuaan dan penuaan dini, seperti kelemahan pada pinggang dan lutut, impotensi dan emisi mani, hiposeksualitas, kelelahan, dan keringat malam (Ji et al. 2009 ; Ramesh et al. 2012 ). Cordycepin (3′-deoxyadenosine), analog adenosine, adalah senyawa organik yang tidak larut dalam air yang disintesis oleh spesies jamur ini. Ia menunjukkan berbagai sifat bioaktif, seperti antioksidan, antiradang, antipenuaan, antibakteri, antijamur, antimalaria, antihiperurisemia, antivirus, antidiabetik, antikanker, imunostimulasi, hipolipidemik, antiosteoporosis, antiartritis, dan aktivitas hipoglikemik (Ng dan Wang 2005 ; Ramesh et al. 2012 ; Jędrejko et al. 2021 ). Berkat aktivitas antioksidannya, ia menurunkan stres oksidatif terkait usia dan gangguan neurodegeneratif (Ramesh et al. 2012 ; Soraksa et al. 2023 ). Lebih jauh lagi, beberapa studi terkini telah membuktikan bahwa cordycepin melindungi organ dan/atau sel sistem reproduksi dari stres oksidatif dan inflamasi yang disebabkan oleh penuaan atau bahan kimia, dengan demikian melemahkan cacat pada fungsi reproduksi pada hewan dan manusia (Sohn et al. 2012 ; Kopalli et al. 2019 , 2022 ; Huang et al. 2022 ; Li, Zhu, et al. 2023 ; Li, Han, et al. 2023 ; Li, Wang, et al. 2023 ) (Tabel 3 ). Misalnya, Sohn et al. ( 2012 ) berfokus pada pengujian pengaruh bermanfaat dari cordycepin yang dioleskan secara oral pada fungsi testis yang berkurang yang disebabkan oleh penuaan. Percobaan tersebut mengungkapkan bahwa ada penurunan yang nyata pada berat epididimis, motilitas sperma, dan spermatogenesis pada tikus setengah baya (kelompok kontrol) dibandingkan dengan kelompok muda. Sebaliknya, aplikasi cordycepin terbukti dapat mencegah hilangnya berat epididimis pada tikus setengah baya dan meningkatkan kadar kalsium serta menurunkan kadar urea, nitrogen, asam urat, dan kreatinin dalam darah tikus setengah baya. Lebih jauh lagi, senyawa ini terbukti dapat meningkatkan motilitas sperma dan progresivitas pergerakan sperma. Pengamatan histopatologi mengungkapkan bahwa aplikasi cordycepin menghasilkan spermatogonia yang tersusun dengan baik dan bahan seluler yang padat serta meningkatkan jumlah spermatozoa matang dalam lumen seminiferus. Dalam penelitian serupa, Kopalli et al. ( 2019)) berfokus pada penyelidikan efek perlindungan cordycepin terhadap cacat reproduksi yang disebabkan oleh penuaan pada tikus jantan. Percobaan tersebut mengungkapkan bahwa kelompok kontrol-tua (berusia 12 bulan; AC) memiliki kualitas sperma yang menurun dan histomorfologi testis yang berubah dibandingkan dengan kontrol muda (berusia 2 bulan; YC). Sebaliknya, dibandingkan dengan kelompok AC, kelompok tua yang diobati dengan cordycepin (COR) menunjukkan perbaikan yang signifikan dalam parameter sperma. Kelompok COR-20 mg/kg ditentukan untuk memulihkan kadar protein terkait spermatogenesis, histone deacetylating SIRT1 dan mTORC1 terkait autophagy dibandingkan dengan kelompok AC. Selain itu, kadar ekspresi enzim antioksidan utama lebih tinggi pada kelompok COR-20 mg/kg dibandingkan dengan kelompok AC. Secara keseluruhan, para peneliti menginformasikan bahwa cordycepin dapat memperbaiki disfungsi testis yang dimediasi oleh penuaan pada tikus. Dalam studi lain, tim peneliti yang sama (Kopalli et al. 2022 ) menguji pengaruh menguntungkan yang potensial dari cordycepin (COR) pada peradangan testis terkait penuaan dan perubahan biokimia serum pada tikus yang menua secara alami. Percobaan tersebut mengungkapkan bahwa ada perubahan yang nyata dalam jumlah sel darah total, metabolisme lipid, dan parameter fungsi hati pada kelompok tua dibandingkan dengan kelompok muda. Lebih jauh lagi, ada peningkatan yang nyata dalam ekspresi mediator inflamasi pada testis tikus tua dibandingkan dengan tikus muda. Namun, pengobatan cordycepin ditentukan untuk memperbaiki perubahan dalam parameter biokimia dan melemahkan peningkatan ekspresi mediator inflamasi. Kelompok penelitian lain (Huang et al. 2022 ) bermaksud untuk menilai kemungkinan efek perlindungan dari pemberian cordycepin terhadap cedera testis yang disebabkan oleh diabetes tipe 2 pada tikus jantan. Hasil penelitian menunjukkan bahwa cordycepin melemahkan kerusakan testis, memperbaiki gangguan pada sawar darah-testis, dan meningkatkan fungsi spermatogenik melalui kapasitas antiapoptotik dan antioksidan. Dalam hal mekanisme, senyawa ini ditentukan untuk meningkatkan ekspresi SIRT1, memicu aktivitas Foxo3a, dan meningkatkan ekspresi enzim antioksidan. Dalam penelitian yang baru diterbitkan, Li, Zhu, dkk. (a); Li, Han, dkk. ( 2023 ); Li, Wang, dkk. ( 2023 ) menunjukkan bahwa cordycepin menurunkan fragmentasi oosit, mengoreksi morfologi spindel/kromosom dan fungsi mitokondria dalam oosit selama penuaan pascaovulasi in vitro, dan meningkatkan potensi perkembangan embrio oosit.
| Faktor toksisitas | Senyawa bioaktif | Aktivitas in vitro/in vivo | Referensi |
|---|---|---|---|
| Penuaan | Cordycepin | Proses penuaan mengurangi berat epididimis, motilitas sperma, dan spermatogenesis pada tikus jantan, sedangkan cordycepin yang diberikan secara oral dapat mengurangi cacat tersebut (In vivo) | Sohn dan kawan-kawan ( 2012 ) |
| Penuaan | Cordycepin | Proses penuaan mengurangi motilitas dan progresivitas sperma serta tingkat ekspresi SIRT1, enzim antioksidan (GPx4, GSTm5, dan PRx4) dan protein terkait spermatogenesis (CREB-1, nectin-2, dan inhibin-α) pada tikus jantan. Proses ini juga meningkatkan tingkat protein terkait autofagi (mTORC1). Sebaliknya, cordycepin dapat memperbaiki atau membalikkan kelainan ini (In vivo) | Kopalli dkk. ( 2019 ) |
| Penuaan | kordispin | Proses penuaan meningkatkan kadar mediator inflamasi (COX-2, IL-6, IL-1β, dan TNF-α) pada testis tikus dan menyebabkan perubahan signifikan pada jumlah sel darah total, metabolisme lipid, dan parameter fungsional hati pada tikus, sementara pengobatan cordycepin mencegah atau melemahkan kelainan ini (In vivo). | Kopalli dkk. ( 2022 ) |
| Toksisitas akibat diabetes | Cordycepin | Toksisitas yang disebabkan oleh diabetes meningkatkan apoptosis dan mengurangi kapasitas antioksidan (Mn-SOD dan CAT) serta ekspresi SIRT1 pada model tikus jantan, sehingga menyebabkan kerusakan testis dan mengurangi fungsi spermatogenik, sedangkan cordycepin mencegah atau membalikkan kelainan ini (In vivo) | Huang dan kawan-kawan ( 2022 ) |
| Penuaan pascaovulasi in vitro | B. amyloliquefaciens SJ100001 | Penuaan pascaovulasi meningkatkan fragmentasi oosit dan morfologi spindel/kromosom abnormal serta mengurangi fungsi mitokondria, sementara cordycepin memperbaiki kelainan ini (In vitro) | Li, Zhu, dkk. ( 2023 ); Li, Han, dkk. ( 2023 ); Li, Wang, dkk. ( 2023 ) |
Singkatan: CAT, katalase; COX-2, siklooksigenase 2; CREB1, protein pengikat elemen responsif cAMP 1; GPx, glutation peroksidase; GPx4g, glutation peroksidase; GSTm5, glutation S-transferase mu 5; IL-1β, interleukin-1 beta; IL-6, interleukin 6; Mn-SOD, mangan superoksida dismutase; mTORC1, target mamalia dari kompleks rapamycin 1; PRx4, peroksiredoksin; SIRT1, sirtuin 1; TNF-α, faktor nekrosis jaringan-alfa.
5.4 Fikobiliprotein Terhadap Cacat Reproduksi Akibat Stres Oksidatif
Fikobiliprotein (PBP) adalah protein yang larut dalam air yang terdapat dalam berbagai kelompok alga (sianobteri, mikroalga eukariotik, dan makroalga eukariotik) dan mencakup sekitar 40%–60% dari semua protein yang larut dalam sel-selnya. Pada organisme ini, PBP berfungsi sebagai blok penyusun utama kompleks pemanen cahaya. Menurut karakteristik penyerapan cahaya, protein ini diklasifikasikan menjadi empat kelompok: fikoeritrin (ungu-merah muda), fikoeritrosianin (oranye), fikosianin (biru), dan alofikosianin (Pan-utai dan Iamtham 2019 ; Chen et al. 2022 ; Dagnino-Leone et al. 2022 ; Esim et al. 2024 ). Karena beberapa sifat bioaktif, mereka juga memiliki potensi tinggi untuk digunakan dalam industri kosmetik, farmasi, dan nutraceutical (Li et al. 2016 ; Yang et al. 2022 ; Dagnino-Leone et al. 2022 ). Misalnya, penelitian in vitro dan in vivo telah mengklarifikasi bahwa PBP dapat efektif untuk mengurangi cacat reproduksi yang disebabkan oleh stres oksidatif (Tabel 4 ). Penelitian sebelumnya (Montaño-González et al. 2022 ) menilai kapasitas perlindungan Spirulina (Sp) yang dioleskan secara oral dan ekstrak PBP-nya terhadap efek toksik Cd pada jaringan testis dan spermatozoa pada tikus jantan. Percobaan menunjukkan bahwa PBP dan Sp mengurangi toksisitas Cd pada motilitas dan viabilitas sperma. Lebih jauh lagi, PBP dipastikan dapat mengurangi produksi MDA yang disebabkan oleh toksisitas Cd pada spermatozoa. Di dalam tubulus seminiferus, Cd menyebabkan nekrosis dan area terkait apoptosis, tetapi PBP dan Sp memperbaikinya. Secara keseluruhan, tim peneliti menginformasikan bahwa PBP memiliki kapasitas untuk melindungi testis dan sperma terhadap toksisitas yang disebabkan Cd. Sebuah studi in vivo yang berbeda (Boukari et al. 2024 ) dilakukan untuk memeriksa kemampuan C-phycocyanin yang berasal dari Spirulina platensis untuk memperbaiki toksisitas etanol pada parameter reproduksi pada tikus jantan. Temuan tersebut mengungkapkan bahwa paparan etanol menurunkan produksi dan viabilitas sperma, mengubah berat dan morfologi testis, dan meningkatkan peroksidasi lipid ketika diterapkan pada tikus jantan, sedangkan C-phycocyanin yang diberikan secara oral menghambat efek merugikan ini dan mempertahankan produksi dan viabilitas sperma normal. Dalam sebuah studi yang baru diterbitkan, Rahim et al. ( 2024 ) mengungkapkan bahwa C-phycocyanin dari S. platensis meningkatkan parameter kualitas semen domba jantan (motilitas total, viabilitas, dll.) pada domba jantan Boujaâd selama penyimpanan dingin pada suhu 5°C. Data tersebut juga menunjukkan bahwa C-phycocyanin meningkatkan potensi fertilisasi in vivo dari semen domba jantan. Yang et al. ( 2022) mengungkapkan bahwa pengobatan TNF α + Smac mimetic + zVAD-fmk (TSZ) mengurangi viabilitas sel dan meningkatkan kematian sel dalam model in vitro sel spg GC-1, sedangkan C-phycocyanin dari Spirulina platensis dapat melemahkan cacat ini. Demikian pula, percobaan in vivo dari penelitian ini menjelaskan bahwa C-phycocyanin yang dioleskan secara oral melindungi sistem reproduksi tikus jantan terhadap toksisitas yang diinduksi siklofosfamid, meningkatkan aktivitas spermatogenik, kualitas sperma, dan keberhasilan pembuahan, meningkatkan produksi testosteron, dan menstabilkan mekanisme pengaturan umpan balik. Pekerjaan in vivo sebelumnya (Li et al. 2016 ) dilakukan untuk memeriksa potensi C-phycocyanin dari Spirulina platensis untuk membalikkan efek negatif dari proses penuaan yang diinduksi D-galaktosa pada kemampuan reproduksi tikus B6D2F/1 betina dewasa. Hasil penelitian menunjukkan bahwa C-phycocyanin dapat membatasi fragmentasi oosit dan aneuploidi yang diinduksi oleh penuaan. Lebih jauh lagi, C-phycocyanin dipastikan menghambat produksi ROS, meningkatkan aktivitas antioksidan, dan menormalkan distribusi mitokondria. Secara keseluruhan, para peneliti menunjukkan bahwa C-phycocyanin dapat mengurangi akumulasi ROS dan mencegah sebagian efek negatif dari proses penuaan yang diinduksi D-galaktosa pada kemampuan reproduksi wanita. Kelompok penelitian lain (Wen et al. 2020 ) bermaksud untuk menilai kemampuan C-phycocyanin dari Spirulina platensis dalam membalikkan efek merugikan obesitas pada fertilisasi. Mereka menemukan bahwa pemberian C-phycocyanin pada tikus obesitas mampu meningkatkan jumlah anak dan tingkat kelangsungan hidup keturunan, memperbaiki tingkat enzim antioksidan ovarium, mengurangi atresia folikel, dan memperbaiki morfologi abnormal kompleks kromosom-spindel dan pola distribusi mitokondria abnormal dalam oosit. Lebih jauh lagi, pengobatan C-phycocyanin ditemukan dapat mengurangi akumulasi ROS terkait obesitas dan apoptosis dini pada oosit. Dalam sebuah studi yang baru diterbitkan, Wang, Liu, et al. ( 2024 ) melaporkan bahwa C-phycocyanin mempertahankan ciri morfologi oosit manusia yang dikriopreservasi secara teratur dan meningkatkan pematangannya dengan mengurangi produksi ROS intraseluler dan laju apoptosis dini serta meningkatkan potensi membran mitokondria. Lebih jauh, mereka melaporkan bahwa C-phycocyanin meningkatkan pembelahan dan pembentukan blastokista oosit yang mengalami vitrifikasi setelah pematangan in vitro dan aktivasi partenogenetik. Tim peneliti lain (Wang, Gao, et al. 2024)) berfokus pada penyelidikan pengaruh C-phycocyanin pada pematangan oosit kambing secara in vitro atau kompetensi perkembangan setelah vitrifikasi. Mereka menemukan bahwa penambahan C-phycocyanin ke dalam media pematangan oosit memfasilitasi ekstrusi badan polar pertama, indeks ekspansi kumulus, pembentukan blastokista partenogenetik, migrasi granula kortikal, distribusi mitokondria, dan potensial membran mitokondria tetapi menghambat akumulasi spesies oksigen reaktif dan apoptosis sel.
| Faktor toksisitas | Senyawa bioaktif | Aktivitas in vitro/in vivo | Referensi |
|---|---|---|---|
| Logam berat (Cd) | Fikobiliprotein | Toksisitas yang disebabkan oleh Cd menyebabkan nekrosis dan apoptosis pada tubulus seminiferus dan juga mengurangi motilitas dan viabilitas sperma serta meningkatkan kandungan MDA, sedangkan ekstrak fikobiliprotein melemahkan efek buruk ini (in vivo) | Montaño-González dkk. ( 2022 ) |
| Penyimpanan pendinginan | C-fikosianin | Penyimpanan dingin mengurangi parameter kualitas semen domba jantan (motilitas, motilitas progresif, kecepatan lengkung, kecepatan garis lurus, kecepatan lintasan rata-rata dan viabilitas) pada domba jantan Boujaâd, sementara C-phycocyanin melemahkan efek buruk yang disebabkan oleh penyimpanan dingin (in vitro) | Rahim dan kawan-kawan ( 2024 ) |
| Siklofosfamid | C-fikosianin | Siklofosfamid mengurangi spermatogenesis, kualitas sperma, kesuburan, dan tingkat testosteron pada tikus, namun C-phycocyanin yang diberikan secara oral dapat mengurangi efek negatif tersebut (In vivo) | Yang dkk. ( 2022 ) |
| Etanol | C-fikosianin | Etanol menurunkan produksi dan viabilitas sperma, menyebabkan kerusakan testis, dan meningkatkan peroksidasi lipid pada tikus jantan, namun suplementasi oral C-phycocyanin memperbaiki kerusakan ini (In vivo) | Boukari dkk. ( 2024 ) |
| Penuaan | C-fikosianin | Proses penuaan yang diinduksi D-galaktosa menyebabkan fragmentasi oosit, aneuploidi, akumulasi ROS, distribusi mitokondria abnormal, dan mekanisme antioksidan yang berkurang pada tikus betina, sementara C-phycocyanin membalikkan cacat ini (In vivo) | Li dan kawan-kawan ( 2016 ) |
| Kegemukan | C-fikosianin | Obesitas mengurangi tingkat kelangsungan hidup keturunan dan aktivitas enzim antioksidan ovarium, serta meningkatkan atresia folikel, akumulasi ROS, apoptosis dini, dan distribusi mitokondria abnormal dalam oosit. Sementara itu, C-phycocyanin melemahkan atau membalikkan kelainan ini (In vivo) | Wen dkk. ( 2020 ) |
| Kriopreservasi | C-fikosianin | Proses kriopreservasi meningkatkan ROS intraseluler dan tingkat apoptosis dini, serta mengurangi potensi membran mitokondria pada oosit manusia, sedangkan C-phycocyanin membalikkan kerusakan tersebut dan juga pembentukan blastokista pada oosit vitrifikasi setelah pematangan in vitro. | Wang, Liu, dkk. ( 2024 ) |
| Dieckol (suatu phlorotannin) | Stres oksidatif meningkatkan sel apoptosis dan menurunkan pembentukan blastokista dalam media IVM , sementara Dieckol dapat meningkatkan tingkat glutathione dan ekspresi gen antioksidan ( NFE2L, SOD1 , dan SOD2 ) dan mengurangi ROS, sehingga mencegah efek buruk stres oksidatif ini (In vitro) | Pyeon dkk. ( 2021 ) |
Singkatan: IVM, media pematangan in vitro; MDA, malondialdehyde ; NFE2L , faktor nuklir eritroid 2-faktor terkait 2; ROS, spesies oksigen reaktif; SOD1 dan SOD2, superoksida dismutase 1 dan 2.
5.5 Phlorotannins Melawan Cacat Reproduksi yang Disebabkan oleh Stres Oksidatif
Florotanin merupakan senyawa fenolik dengan aktivitas antioksidan, yang diekstraksi dari makroalga laut, terutama dari makroalga coklat. Berdasarkan tingkat polimerisasi dan keragaman struktur, senyawa ini dapat diklasifikasikan ke dalam enam kelompok berbeda: floroetol, fuhalol, fukofloroetol, fukol, eckol, dan karmalol. Fungsinya adalah untuk melindungi alga dari kondisi perairan yang menantang (Priyanka et al. 2022 ; Kumar et al. 2022 ; Esim et al. 2024 ). Selain itu, florotenol yang berasal dari alga bermanfaat bagi manusia karena sifatnya yang meningkatkan kesehatan, seperti antioksidan, antibakteri, antivirus, antikanker, antihipertensi, hipoglikemik, antialergi, dan antiinflamasi (Zheng et al. 2022 ). Terutama karena sifat antioksidannya, phlorotannin telah didokumentasikan memiliki aplikasi dalam masalah kesehatan yang dimediasi oleh stres oksidatif, seperti penyakit neurodegeneratif, penyakit hati, diabetes, dan penyakit retina (Phang et al. 2023 ). Selain itu, dalam sebuah penelitian (Pyeon et al. 2021 ), para peneliti menjelaskan efek menguntungkan dari dieckol, suatu phlorotannin dari makroalga coklat yang dapat dimakan Ecklonia cava , pada pematangan dan kompetensi perkembangan oosit babi yang terpapar stres oksidatif secara in vitro. Percobaan menunjukkan bahwa 0,5 μM dieckol mengurangi rasio sel apoptosis dan menambah pembentukan blastokista dalam medium pematangan in vitro (IVM) yang dilengkapi dengan 0,5 μM dieckol. Selain itu, 0,5 μM dieckol ditemukan dapat menurunkan ROS, meningkatkan kapasitas antioksidan, dan mencegah organisasi spindel abnormal dan ketidaksejajaran kromosom serta meningkatkan ekspresi penanda maternal ( CCNB1 dan MOS ) dan aktivitas mitogen-activated protein kinase p44/42 (Tabel 4 ).
5.6 Karotenoid Melawan Kelainan Reproduksi Akibat Stres Oksidatif
Karotenoid adalah pigmen lipofilik yang diproduksi oleh tumbuhan, alga, archaea, khamir, jamur, dan beberapa hewan (serangga, tungau, ikan, burung, dll.). Dua jenis utama karotenoid adalah karoten dan xantofil. Jenis karoten yang paling dikenal adalah α-, β-, dan γ-karoten, torulena, dan likopen. Contoh xantofil meliputi zeaxanthin, astaxanthin, lutein, β -cryptoxanthin, fucoxanthin, dan peridinin. Karotenoid, yaitu karoten dan xantofil, digunakan sebagai pewarna alami dalam industri makanan. Lebih jauh lagi, karena aktivitas biologis yang berbeda, mereka menemukan banyak praktik dalam industri farmasi, nutraceutical, dan kosmetik (Dewanjee et al. 2021 ; Arslan et al. 2023 ; Gebregziabher et al. 2023 ; Esim et al. 2024 ). Misalnya, mereka menunjukkan peran protektif terhadap berbagai gangguan kesehatan, seperti infertilitas, penyakit neurodegeneratif, degenerasi makula terkait usia dan katarak, penyakit hati berlemak non-alkohol, dan penyakit kardiovaskular (Kong et al. 2019 ; Jia et al. 2020 ; Kabir et al. 2022 ; Gebregziabher et al. 2023 ).
Meskipun astaxanthin dapat disintesis oleh berbagai organisme, seperti jamur, mikroalga, hewan, produksi komersialnya dilakukan dengan menggunakan khamir Phaffia rhodozyma dan Xanthophyllomyces dendrorhous , dan mikroalga Haematococcus pluvialis (Patel et al. 2022 ; Ritu et al. 2023 ; Arslan et al. 2023 ). Fucoxanthin adalah karotenoid jenis xantofil lain yang ditemukan dalam alga laut, seperti makroalga coklat dan mikroalga. Pigmen ini bertindak sebagai kompleks pengumpul cahaya untuk fotosintesis dan fotoproteksi (Peng et al. 2011 ; Din et al. 2022 ). Bahasa Indonesia: Selain peran mereka dalam organisme tempat mereka ditemukan, astaxanthin dan fucoxanthin juga menunjukkan banyak khasiat yang bermanfaat bagi kesehatan manusia (Peng et al. 2011 ; Fakhri et al. 2018 ). Karena aktivitas antioksidan dan antiinflamasinya, astaxanthin dan fucoxanthin dapat melindungi organ dan sel sistem reproduksi terhadap kerusakan oksidatif (Tabel 5 ). Misalnya, Jang et al. ( 2010 ) menunjukkan bahwa astaxanthin dalam cara yang bergantung dosis meringankan stres oksidatif yang diinduksi oksida nitrat (peroksidasi lipid), meningkatkan gen antioksidan dan menurunkan gen apoptosis, sehingga mengurangi efek negatif stres oksidatif pada viabilitas sel epitel saluran telur sapi (BOEC) dan potensi perkembangan embrio IVM/IVF sapi. Sebuah studi berbeda (Kuroki et al. 2013 ) menjelaskan bahwa suplementasi astaxanthin ke dalam medium dapat mengurangi cacat perkembangan embrio sapi yang dikultur secara in vitro di bawah tekanan panas, memulihkan potensial membran mitokondria embrio dan memberikan pemulihan yang nyata dalam perkembangan blastokista. Jia et al. ( 2020 ) mengungkapkan bahwa astaxanthin meringankan stres oksidatif pada oosit tua secara in vitro dengan mengurangi ROS dan meningkatkan ekspresi gen glutathione dan antioksidan. Mereka juga melaporkan bahwa astaxanthin menghambat apoptosis dan autofagi pada oosit tua, mempertahankan organisasi spindel dan ekspresi aktin, menyelamatkan status fungsional organel, dan memulihkan kualitas dan kompetensi perkembangan oosit babi tua. Secara keseluruhan, mereka menyarankan bahwa astaxanthin dapat bermanfaat untuk teknologi reproduksi berbantuan karena potensi perlindungannya terhadap penuaan oosit. Dalam sebuah karya yang dilakukan oleh Gao et al. ( 2021 ), pengaruh astaxanthin makanan (dari Haematococcus pluvialis) pada kualitas semen (viabilitas sperma, motilitas, dan konsentrasi) dan potensi antioksidan pada ayam jantan tua diuji. Percobaan mengungkapkan bahwa astaxanthin dalam makanan meningkatkan kadar enzim antioksidan dan menunjukkan kapasitas penangkal radikal yang lebih besar melalui peningkatan jalur MAPK/Nrf2, sehingga meningkatkan kualitas semen. Kelompok penelitian lain (Guo et al. 2021 ) berupaya untuk mengungkap apakah astaxanthin dari H. pluvialis mengawetkan sperma babi hutan terhadap stres oksidatif yang diinduksi ROS selama proses kriopreservasi. Mereka menemukan bahwa suplementasi astaxanthin pada pengencer beku, khususnya pada konsentrasi 2 μM, meningkatkan motilitas sperma, integritas membran, dan integritas akrosom, mencegah peroksidasi lipid, dan mengoreksi komposisi asam lemak pada membran sperma. Kong et al. ( 2019 ) melaporkan bahwa ketika fucoxanthin dari alga coklat Laminaria japonica diberikan secara oral ke dalam model tikus diabetes yang diinduksi streptozotocin, ia memperbaiki resistensi insulin, menunjukkan sifat antioksidan dan anti-inflamasi, meningkatkan motilitas sperma, mengurangi jumlah sperma abnormal, mencegah peroksidasi lipid, dan memulihkan kadar hormon luteinisasi dan testosteron, dan akhirnya memperbaiki fungsi reproduksi. Wang dkk. ( 2020 ) menunjukkan bahwa pemberian obat kemoterapi cisplatin ke dalam hamster menyebabkan kelainan sperma dan mengganggu morfologi tubulus seminiferus dan kadar testosteron, sedangkan pemberian ekstrak fucoxanthin oral dari alga coklat yang dapat dimakan Sargassum glaucescens mencegah atau membalikkan cacat ini.
| Faktor toksisitas | Senyawa bioaktif | Aktivitas in vitro/in vivo | Referensi |
|---|---|---|---|
| oksida nitrat | Astaxantin | Nitric oxide menyebabkan peroksidasi lipid, menurunkan ekspresi gen antioksidan ( CuZnSOD, MnSOD dan Catalase ) dan meningkatkan ekspresi gen apoptosis (gen Caspase-3 dan Bax ) pada sel epitel saluran telur sapi, namun pengobatan astaxanthin membalikkan atau melemahkan kelainan ini (In vitro) | Jang dan kawan-kawan ( 2010 ) |
| Stres panas | Astaxantin | Stres panas mengurangi potensi membran mitokondria dan menyebabkan cacat perkembangan pada embrio sapi yang dikultur secara in vitro, sedangkan suplementasi astaxanthin memperbaiki cacat ini dan meningkatkan perkembangan blastokista (In vitro) | Kuroki dan kawan-kawan ( 2013 ) |
| Penuaan in vitro | Astaxantin | Penuaan in vitro meningkatkan ROS, apoptosis dan autophagy dan menyebabkan organisasi spindle abnormal dan ekspresi Actin dalam oosit, sementara pengobatan astaxanthin mengurangi ROS dan melemahkan kelainan ini (In vitro) | Jia dan kawan-kawan ( 2020 ) |
| Penuaan | Astaxantin | Proses penuaan mengurangi peningkatan peroksidasi lipid yang berhubungan dengan stres oksidatif sehingga menurunkan viabilitas sperma dan konsentrasi sperma pada ayam jantan, sementara astaxanthin meningkatkan jalur MAPK/Nrf2, meningkatkan aktivitas enzim antioksidan (SOD, CAT, GSH-Px dan T-AOC) dan memperbaiki cacat semen (In vivo) | Gao dan kawan-kawan ( 2021 ) |
| Kriopreservasi | Astaxantin | Proses kriopreservasi meningkatkan peroksidasi lipid dan mengurangi motilitas sperma, integritas membran, dan integritas akrosom pada sperma babi hutan, sedangkan penambahan astaxanthin pada pengencer beku meningkatkan parameter sperma dan menghambat peroksidasi lipid (In vitro) | Guo dan kawan-kawan ( 2021 ) |
| Toksisitas akibat diabetes | Fukosantin | Toksisitas yang disebabkan oleh diabetes mengurangi motilitas sperma, meningkatkan jumlah sperma abnormal dan peroksidasi lipid, dan menyebabkan perubahan kadar hormon luteinisasi dan testosteron, sedangkan ekstrak fucoxanthin menunjukkan sifat antioksidan dan anti-inflamasi dan melemahkan kelainan ini (In vitro) | Kong dkk. ( 2019 ) |
Singkatan: CAT, katalase; GSH-Px, glutation peroksidase; MAPK, mitogen-activated protein kinase; Mn-SOD, mangan superoksida dismutase; Nrf2, faktor nuklir eritroid 2-faktor terkait 2; SIRT1, sirtuin 1; T-AOC, kapasitas antioksidan total.
6 Keterbatasan Penggunaan Antioksidan dalam Studi Klinis
Sampai saat ini, banyak penelitian telah menyelidiki peran protektif molekul alami atau sintetis dengan aktivitas antioksidan terhadap patologi, seperti infertilitas, sistem kardiovaskular, penuaan, dan diabetes.
Dalam beberapa penelitian ini, dilaporkan bahwa molekul antioksidan memiliki efektivitas terapeutik terhadap patologi yang dimaksud, dan dalam beberapa penelitian lain, sebaliknya, molekul antioksidan tidak memberikan manfaat yang signifikan. Misalnya, beberapa percobaan praklinis telah menunjukkan bahwa antioksidan, seperti diapocynin, carnosine, dan carvacrol mungkin efektif dalam mengobati atau mencegah penyakit yang berhubungan dengan stres oksidatif (Boldyrev et al. 2008 ; Dranka et al. 2013 ; Dost et al. 2024 ). Demikian pula, beberapa penelitian telah melaporkan bahwa antioksidan, seperti melatonin, CoQ10, prekursor NAD + (nikotinamida mononukleotida dan nikotinamida ribosida) dan resveratrol mengurangi cacat reproduksi yang menyebabkan infertilitas baik secara in vivo (model hewan atau manusia) dan in vitro (teknologi reproduksi berbantuan) (Xu et al. 2018 ; Galano dan Reiter 2018 ; Bahramrezaie et al. 2019 ; Arslan, Taskin, dan Keles 2024 ). Misalnya, pemberian CoQ10 subkutan kepada tikus dilaporkan melindungi cadangan ovarium terhadap penuaan, meningkatkan fungsi mitokondria di ovarium, dan meningkatkan laju perkembangan blastokista (Boots et al. 2016 ; Delkhosh et al. 2019 ). Sebuah studi acak yang dilakukan pada manusia (Xu et al. 2018 ) menunjukkan bahwa pemberian CoQ10 oral kepada wanita meningkatkan kualitas embrio dan tingkat fertilisasi, tetapi tidak menyebabkan kemajuan yang menonjol dalam kehamilan klinis dan tingkat kelahiran hidup per transfer embrio. Dalam studi klinis lain (Bahramrezaie et al. 2019 ), resveratrol yang diberikan secara oral kepada manusia terbukti meningkatkan kualitas oosit dan blastokista tetapi tidak mempengaruhi keberhasilan fertilisasi. Dalam studi terbaru, Arslan, Taskin, dan Keles ( 2024 ) melaporkan bahwa nikotinamida ribosida dan nikotinamida mononukleotida menyeimbangkan kembali dinamika mitokondria dan mengaktifkan SIRT1, sehingga membalikkan penuaan ovarium pada tikus setengah baya, mengurangi stres mitokondria, dan mengoreksi kelainan folikulogenesis yang disebabkan oleh penuaan. Beberapa penelitian in vitro menunjukkan bahwa penambahan prekursor CoQ10 atau NAD+ ke dalam media kultur meningkatkan pengurangan stres oksidatif, peningkatan pematangan oosit, dan perkembangan blastokista (Al-Zubaidi et al. 2021 ; Wang et al. 2023 ; Khan et al. 2023 ; Li, Zhu, et al. 2023 ; Li, Han, et al. 2023 ).
Sebaliknya, beberapa penelitian telah melaporkan bahwa molekul antioksidan (glutathione, N-acetylcysteine, β-karoten, vitamin E, vitamin C, likopen, lutein, quercetin, rutin, katekin, selenium, retinol, seng, riboflavin, CoQ10, molibdenum, dll.) tidak memiliki peran perlindungan yang signifikan terhadap patologi yang disebabkan oleh stres oksidatif, seperti infertilitas, kanker, diabetes, dan penyakit neurodegeneratif (Iannitti dan Palmieri 2009 ; Goodman et al. 2011 ; Bjelakovic et al. 2012 ; Bentov et al. 2014 ; Murphy 2014 ; Caballero et al. 2016 ; Forman dan Zhang 2021 ; Banerjee et al. 2022 ; Pappolla et al. 2024 ). Misalnya, telah dinyatakan bahwa CoQ10 secara statistik tidak memengaruhi jumlah oosit, tingkat implantasi, atau tingkat kehamilan klinis pada manusia (Bentov et al. 2014 ; Caballero et al. 2016 ). Meski demikian, sebuah penelitian sebelumnya melaporkan bahwa resveratrol yang diberikan secara oral mengurangi tingkat kehamilan klinis dan meningkatkan risiko keguguran (Ochiai et al. 2019 ).
Keterbatasan utama penggunaan antioksidan dalam pengobatan patologi adalah kesulitan dalam menyalurkan antioksidan yang cukup ke lokasi intraseluler yang ditargetkan, misalnya, lebih disukai di dalam mitokondria (Murphy 2014 ; Banerjee et al. 2022 ). Untuk mengatasi masalah ini, konjugat yang mengangkut antioksidan ke organ target telah disiapkan. Misalnya, untuk pengobatan penyakit Parkinson, antioksidan telah dikombinasikan dengan trifenilfosfonium (TPP+), yang memiliki kapasitas untuk melewati sawar darah-otak dan menargetkan mitokondria, dan konjugat yang disiapkan telah diuji pada model hewan baik secara oral maupun intraperitoneal. Hasil praklinis yang diperoleh mengungkapkan bahwa antioksidan yang ditargetkan pada mitokondria yang dikonjugasikan dengan TPP+ memberikan perlindungan yang lebih baik terhadap penyakit Parkinson dibandingkan dengan yang tidak ditargetkan (Yang, Calingasan, et al. 2009 ; Yang, Zhao, et al. 2009 ; Ghosh et al. 2010 , 2012 ; Jin et al. 2014 ; Ramis et al. 2015 ). Demikian pula, dalam studi praklinis, MitoQ10, antioksidan yang ditargetkan pada mitokondria, telah terbukti memiliki peran protektif terhadap penyakit autoimun dan kardiovaskular (Graham et al. 2009 ; Mao et al. 2013 ; McLachlan et al. 2014 ). Selain itu, efektivitas antioksidan yang ditargetkan terhadap faktor infertilitas telah diuji. Misalnya, dalam sebuah penelitian yang dilakukan (Ding et al. 2019 ), efektivitas terapi antioksidan yang ditargetkan pada mitokondria MitoQ10 terhadap sindrom ovarium polikistik (PCOS) diuji pada tikus Sprague–Dawley betina. Hasil penelitian tersebut mengungkapkan bahwa MitoQ10 secara signifikan meningkatkan resistensi insulin, mengurangi apoptosis, dan juga memulihkan fungsi endokrin, kondisi reproduksi, dan aktivitas mitokondria.
Singkatnya, temuan yang meyakinkan tentang efektivitas antioksidan yang berasal dari tumbuhan atau molekul antioksidan sintetis belum diperoleh. Lebih jauh lagi, overdosis beberapa antioksidan, seperti β-karoten, dan vitamin C dan E telah dilaporkan menyebabkan stres reduktif, dengan demikian berkontribusi pada perkembangan beberapa patologi (Pérez-Torres et al. 2017 ; Al-Madhagi dan Masoud 2024 ). Karena alasan-alasan ini, penggunaan antioksidan secara klinis masih kontroversial. Meski begitu, studi-studi baru sedang dilakukan untuk mengungkap potensi terapeutik dari molekul antioksidan yang diketahui saat ini atau yang baru ditemukan. Misalnya, ada banyak studi tentang efek perlindungan antioksidan jamur atau alga terhadap cacat reproduksi in vivo dan in vitro yang disebabkan oleh penuaan alami dan faktor lingkungan (Tabel 1 ). Namun, perlu dicatat bahwa efektivitasnya hanya diuji pada model hewan dan tidak pada manusia. Oleh karena itu, keberhasilan yang sama mungkin tidak tercapai pada model manusia. Selain itu, analisis toksisitas antioksidan alga dan jamur belum dilakukan secara rinci dalam studi hewan yang dirangkum dalam Tabel 1. Dengan demikian, studi lebih lanjut pada hewan dan manusia harus dilakukan untuk menjelaskan potensi toksisitas senyawa antioksidan jamur atau alga. Untuk meningkatkan efektivitas antioksidan jamur atau alga dan meminimalkan efek sampingnya, antioksidan ini dapat dimodifikasi untuk menargetkan organ atau organel tertentu. Misalnya, antioksidan ini dapat dikonjugasikan dengan TPP + untuk menargetkan mitokondria. Lebih jauh, meskipun ada formulasi komersial produk alami yang diperoleh dari jamur dan alga yang dijual sebagai suplemen (Niego et al. 2021 ; Matos et al. 2022 ), efektivitasnya belum diuji terhadap cacat reproduksi atau pada keberhasilan pembuahan dalam model in vivo atau in vitro. Oleh karena itu, formulasi komersial senyawa yang berasal dari jamur atau alga juga harus diuji dalam hal pengaruhnya yang berguna atau merugikan pada pembuahan manusia.
7 Kesimpulan dan Prospek Masa Depan
Akumulasi ROS dan terjadinya kerusakan oksidatif pada organ dan sel sistem reproduksi mengganggu spermatogenesis, ovulasi, fertilisasi, dan implantasi pada manusia dan hewan dan akhirnya menyebabkan infertilitas. Tinjauan ini mengungkapkan bahwa jamur dan/atau alga, terutama yang dapat dimakan, merupakan sumber antioksidan eksogen penting yang menunjukkan peran protektif terhadap infertilitas. Dalam model in vivo, antioksidan yang berasal dari jamur dan/atau alga memperbaiki cacat pada fungsi reproduksi dengan melindungi organ dan sel sistem reproduksi dari stres oksidatif yang disebabkan oleh berbagai faktor, seperti penuaan alami, penyakit, dan bahan kimia. Dalam model in vitro, mereka juga dapat melindungi spermatozoa dan oosit terhadap stres oksidatif yang disebabkan oleh bahan kimia beracun atau kriopreservasi. Namun, survei literatur mengungkapkan bahwa, berbeda dengan antioksidan yang berasal dari tanaman, ada penelitian terbatas tentang peran protektif antioksidan yang berasal dari jamur dan alga, terutama florotanin, terhadap infertilisasi yang disebabkan oleh stres oksidatif. Oleh karena itu, kami menyarankan agar antioksidan yang berasal dari jamur dan alga, khususnya florotanin, diteliti lebih lanjut dalam penelitian mendatang. Secara keseluruhan, tinjauan ini menunjukkan bahwa bentuk dan ekstrak murni antioksidan jamur dan alga berpotensi digunakan sebagai agen pelindung terhadap cacat reproduksi yang disebabkan oleh stres oksidatif, khususnya penuaan alami. Lebih jauh, tinjauan ini menunjukkan bahwa antioksidan dari jamur dan alga dapat meningkatkan keberhasilan teknologi reproduksi berbantuan. Meskipun demikian, diperlukan lebih banyak penelitian in vivo, in vitro, atau klinis untuk membuktikan profil keamanan dan kemanjurannya.

