
ABSTRAK
Diabetes melitus adalah penyakit metabolik kronis dan persisten yang ditandai dengan kadar glukosa darah tinggi. Tujuan dari penelitian ini adalah untuk mengevaluasi efek stres antihiperglikemik dan antioksidan dari fraksi bubuk kulit batang Erythrophyllum africanum pada tikus yang diinduksi diabetes. 30 tikus jantan dibagi menjadi 6 kelompok yang masing-masing terdiri dari lima tikus menerima diet hiperkalori yang dimaniskan dengan sukrosa (4 g/kg bb) setiap hari, kecuali untuk kontrol normal, yang menerima diet normal. Kontrol normal dan diabetes kemudian menerima air suling (10 mL/kg bb per os ), kontrol positif menerima metformin (20 mg/kg bb per os ) dan tikus uji menerima fraksi bubuk (≤ 50 μm ≤ 50–120 μm) atau bubuk E. africanum yang tidak diayak (300 mg/kg bb per os ) selama 7 minggu. Deksametason (0,2 mg/kg) diberikan secara intraperitoneal seminggu sekali sejak minggu ketiga, kecuali untuk kontrol normal, yang menerima salin. Glukosa darah puasa, profil lipid, dan parameter biokimia stres oksidatif dinilai selama dan di akhir pengobatan. Kadar glukosa darah hewan pada minggu ke-7 adalah 0,92 ± 0,03, 1,52 ± 0,08, 0,78 ± 0,04, 0,77 ± 0,03, 1,13 ± 0,03, dan 0,40 ± 0,01 g/L pada kontrol normal, kontrol diabetes, hewan yang diobati dengan metformin, fraksi ≤ 50 μm, fraksi 50–120 μm, dan bubuk yang tidak diayak, masing-masing. Fraksi serbuk ≤ 50 μm secara signifikan memperbaiki ( p < 0,01) profil lipid (penurunan kadar trigliserida dan kolesterol LDL, peningkatan kadar kolesterol HDL) dengan mengurangi indeks aterogenik. E. africanum memiliki efek antihiperglikemik dan stres antioksidan dan akan kurang beracun bagi hati dan ginjal. Serbuk halus (≤ 50 μm) E. africanum dapat digunakan sebagai bahan tambahan makanan untuk mencegah terjadinya diabetes pada pasien yang rentan.
1 Pendahuluan
Diabetes melitus adalah penyakit metabolik persisten dan progresif yang ditandai dengan kadar glukosa darah tinggi akibat cacat produksi insulin atau cacat kerja insulin, atau keduanya (Almaghrabi et al. 2021 ). Klasifikasi diabetes menggambarkan dua tipe utama (ADA 2010 ) termasuk diabetes tipe 1 (T1D) dan tipe 2 (T2D) yang merupakan bentuk yang paling umum (90% kasus). T2D ditandai dengan resistensi insulin (Tenenbaum et al. 2018 ). Beberapa obat seperti glukokortikoid mungkin terlibat dalam patofisiologi diabetes tipe 2. Deksametason merupakan salah satu glukokortikoid yang menginduksi hiperglikemia dengan cara meningkatkan glukoneogenesis di hati melalui peningkatan ekspresi dan aktivitas fosfoenolpiruvat karboksilase dan glukosa-6-fosfatase serta menurunkan sensitivitas sekresi insulin (Clore dan Thurby-Hay 2009 ; Sari et al. 2021 ; Zhang dan Karam 2021 ). Diabetes melitus merupakan salah satu kedaruratan kesehatan global utama pada abad ke-21, dengan peningkatan kasus yang signifikan dan angka kematian yang semakin tinggi di seluruh dunia (Liu et al. 2021 ). Menurut laporan International Diabetes Federation (IDF) ke-10, diabetes melitus menyebabkan 6,7 juta kematian di seluruh dunia pada tahun 2021, dengan estimasi prevalensi sebesar 643 juta jiwa pada tahun 2030 dan 783 juta jiwa pada tahun 2045, apabila tidak dilakukan tindakan penatalaksanaan yang efektif (IDF 2021 ). Menurut Laporan Diabetes Global WHO 2016, 24 juta orang Afrika didiagnosis menderita diabetes, dan jumlah ini diperkirakan akan meningkat sebesar 129% menjadi 55 juta pada tahun 2045 (OMS 2016 ). Jika tidak diobati, hiperglikemia permanen dapat menjadi penyebab pemasangan stres oksidatif dengan aktivasi jalur metabolisme pembentukan spesies oksigen reaktif (Delattre et al. 2001 ; Omar et al. 2023 ). Banyak obat (sulfonamida hipoglikemik dan biguanida) tersedia untuk pengobatan diabetes tipe 2, tetapi hampir semuanya memiliki efek samping yang merugikan (Chen et al. 2003 ). Pencegahan diabetes melitus dapat dilakukan dengan menjaga kebersihan dan aturan diet (Foussier dan Zergane 2020 ) dan pengobatan dalam pengobatan konvensional didasarkan pada penggunaan agen hipoglikemik seperti insulin (Bello et al. 2011 ) dan antidiabetik oral (biguanida, sulfonamid, glinida, tiazolidinedion, dll.) (Haq et al. 2021 ). Metformin merupakan salah satu pengobatan lini pertama untuk diabetes tipe 2 karena efek hipoglikemiknya, profil keamanan yang mapan, dan biaya yang relatif rendah. Metformin menghambat glukoneogenesis hati secara selektif terhadap substrat dan mengubah keseimbangan redoks seluler (Lamoia dan Shulman 2021)). Namun, manajemen obat ini, meskipun menawarkan efek terapeutik yang diharapkan, tetap memiliki banyak efek samping seperti diare, muntah, gagal jantung, dan risiko hipoglikemia berat (Kancherla et al. 2017 ; Seaquist et al. 2013 ). Konsumsi metformin yang berkepanjangan dapat menyebabkan anoreksia, muntah, efek gastrointestinal, dan malabsorpsi vitamin B12 (Dhananjay et al. 2014 ). Oleh karena itu, ada kebutuhan mendesak untuk mengidentifikasi sumber daya alam dan mempelajari potensi sifat farmakologisnya untuk mengembangkan pengobatan antidiabetik baru yang kurang beracun. Banyak sediaan herbal telah menjadi subjek dari beberapa uji coba eksperimental dan praklinis dalam pengobatan diabetes tipe 2 (Kamgang et al. 2008 ; Mvongo et al. 2016 ; Ngakou Mukam et al. 2025 ). Erythrophleum africanum adalah pohon berukuran sedang dari famili Fabaceae yang ditemukan di sebagian besar Afrika tropis, dari Senegal timur hingga Sudan, dan selatan hingga Afrika Tengah, Kenya, Tanzania, dan Afrika Selatan (Maroyi 2019 ). Erythrophleum africanum adalah spesies pirofit yang hanya tumbuh di lingkungan terbuka, sering kali setelah kebakaran hebat. E. africanum memiliki rachis, tangkai daun, dan tangkai daun yang puber. Anak daunnya tidak terakumulasi dan berukuran sekitar 6,5 × 3,5 cm. Helaian daunnya sering kali puber di kedua sisi dengan urat sekunder yang terlihat jelas. Bunganya sekitar 4 mm, berwarna putih kekuningan hingga kemerahan dengan sepal bebas. Polongnya berukuran 2,2–4,5 × 7–19 cm, memiliki implantasi stipe di median, dan mengandung 3–5 biji dengan endosperma tipis (Gorel et al. 2015 ). E. africanum secara tradisional digunakan dalam pengobatan beberapa patologi seperti penyakit kardiovaskular, penyakit menular seksual, berbagai radang, diabetes, kusta, gondok, disentri, diare, dan sebagai astringen (Son 2019 ). Oleh karena itu, tujuan dari penelitian ini adalah untuk mengevaluasi efek stres antihiperglikemik dan antioksidan dari fraksi bubuk kulit batang Erythrophleum africanum pada diabetes tipe 2 yang diinduksi oleh diet tinggi kalori pada tikus. Metabolit sekunder umumnya lebih terkonsentrasi pada fraksi tanaman yang lebih halus, dan oleh karena itu fraksi ini akan memiliki lebih banyak aktivitas (Jones dan Kinghorn 2006 ).
2 Bahan dan Metode
2.1 Hewan Percobaan
Hewan percobaan terdiri dari tikus Wistar albino jantan berumur delapan sampai 10 minggu dan beratnya antara 140 dan 190 g. Hewan-hewan ini berasal dari rumah hewan Fakultas Sains Universitas Ngaoundere (Kamerun) dan dibesarkan dalam kondisi suhu ruangan (25°C), kelembapan (50%–60%), ventilasi yang cukup, dan siklus terang/gelap 12 jam/24 jam dengan akses bebas ke makanan normal dan air keran. Hewan-hewan ini ditangani sesuai dengan arahan Uni Eropa untuk perlindungan hewan (EEC Council 86/609) (Smith et al. 2007 ).
2.2 Bahan Tanaman dan Ekstraksi
Bahan tanaman yang digunakan dalam penelitian kami terdiri dari kulit batang Erythrophleum africanum . Sampel kulit dipanen pada bulan Februari 2024 di daerah Pitoa, Departemen Benue (Wilayah Utara, Kamerun). Identifikasi sampel tanaman dilakukan oleh Dokter FAWA Guidawa, Ahli Botani dari Departemen Ilmu Biologi Fakultas Sains Universitas Ngaoundere. Kulit yang dikumpulkan dipotong kecil-kecil, kemudian dikeringkan di tempat teduh pada suhu ruangan selama enam (06) minggu. Proses yang diikuti untuk mendapatkan fraksi bubuk adalah penyaringan diferensial terkendali (Deli et al. 2019 ). Sampel kulit kayu kering ditumbuk menggunakan mortar untuk mengurangi ukurannya dan memudahkan perjalanannya ke penggiling listrik. Bubuk yang diperoleh dibagi menjadi dua bagian yang sama, satu disimpan dan yang lainnya digunakan untuk pemisahan ukuran partikel. Jadi, 200 g bubuk dituangkan perlahan ke dalam saringan atas saringan tipe “BIOBASE” dan penyaringan dilakukan dalam mode getar permanen selama 10 menit. Fraksi bubuk yang tertahan pada setiap saringan dikumpulkan dan kemudian ditimbang untuk menentukan fraksi massa setiap kelas ukuran partikel. Jadi, dari proses penyaringan ini, kami memperoleh lima (05) fraksi ukuran partikel bubuk (> 500 μm; 500–300 μm; 300–120 μm; 120–50 μm dan ≤ 50 μm). Fraksi ukuran partikel dan bubuk yang tidak diayak akhirnya dikemas dalam kantong polietilen dan disimpan pada suhu 10°C hingga percobaan.
2.3 Induksi dan Pengobatan Diabetes Tipe 2
Induksi dilakukan dengan menggunakan diet gula berkalori tinggi (HSD) (Tabel 1 ), menurut model MACAPOS 1 (Jagung, Singkong, Minyak Sawit dan Sukrosa) (Kamgang et al. 2005 ) yang dimodifikasi dengan pemberian tambahan deksametason intraperitoneal (NDC 57319–519-05, Phoenix) sebesar 0,2 mg/kg bb (Niu et al. 2018 ), seminggu sekali dari minggu ketiga hingga akhir. Perlakuan itu sendiri didasarkan pada pemberian metformin, fraksi ukuran partikel (≤ 50 μm, 120–50 μm) dan bubuk kulit batang Erythrophleum africanum yang tidak diayak.
| Bahan-bahan | Diet Normal (g/kg) | Berat jenis hidrokarbon (g/kg) |
|---|---|---|
| Jagung | 250 | 330 |
| Gandum | 400 | 260 |
| Kedelai | 150 | 100 |
| Bubuk ikan | 100 | 30 |
| Sukrosa | — | 200 |
| Minyak kelapa sawit | — | 60 |
| Bubuk tulang | 10 | 10 |
| Bungkil inti sawit | 50 | — |
| Singkong | — | 100 |
| Garam | tanggal 05 | tanggal 05 |
| Campuran vitamin | tanggal 05 | tanggal 05 |
| Energi kkal/kg | 3400 | 4340 |
Singkatan: HSD, Diet Tinggi Kalori Sukrosa.
Tiga puluh (30) tikus jantan dibagi menjadi enam (06) kelompok yang masing-masing terdiri dari lima (05) tikus dan diberi perlakuan setiap hari selama 7 minggu sebagai berikut:
- Kelompok 1: tikus kontrol normal (NC) menerima diet normal dan air suling (10 mL/kg/hari);
- Kelompok 2: tikus kontrol diabetes (DC) menerima diet berkalori tinggi, 10 mL/kg/hari air suling dan sukrosa (4 g/kg bb);
- Kelompok 3: Tikus yang diberi pengobatan metformin (MET) menerima diet berkalori tinggi, Metformin Hidroklorida (NDC 0378–6001-91, Mylan Pharmaceuticals Inc.) (20 mg/kg bb) dan sukrosa (4 g/kg bb);
- Kelompok 4: tikus yang diberi perlakuan fraksi (EAPF≤ 50 μm) menerima diet berkalori tinggi, 300 mg/kg fraksi (≤ 50 μm) kulit batang E. africanum per os dan sukrosa (4 g/kg bw) per os ;
- Kelompok 5: tikus yang diberi perlakuan fraksi (EAPF120–50 μm) menerima diet berkalori tinggi, 300 mg/kg fraksi (120–50 μm) kulit batang E. africanum per os dan sukrosa (4 g/kg bw);
- Kelompok 6: Tikus yang diberi bubuk tanpa saringan menerima diet sukrosa berkalori tinggi, 300 mg/kg bubuk kulit batang E. africanum tanpa saringan per os , dan sukrosa 4 g/kg (Kamgang et al. 2008 ).
Deksametason (0,2 mg/kg bb) diberikan secara intraperitoneal mulai minggu ketiga hingga akhir minggu ketujuh pengobatan kepada semua hewan, kecuali kelompok kontrol normal, yang juga menerima garam fisiologis (5 mL/kg) secara intraperitoneal.
Uji hiperglikemia yang diinduksi secara oral dilakukan pada akhir minggu ketujuh. Uji ini terdiri dari pengambilan kadar glukosa darah puasa dan kemudian pemberian larutan D-glukosa (4 mg/kg bb per hari). Kadar glukosa darah diukur 30 menit, 60 menit, 90 menit, dan 120 menit setelah pemberian D-glukosa pada kelima tikus di setiap kelompok (Ngakou Mukam et al. 2023 ). Pada akhir pengobatan, tikus sebelumnya dipuasakan selama 15 jam dan kemudian dibius dengan injeksi intraperitoneal campuran diazepam (10 mg/kg)/ketamin (50 mg/kg) (Fokam Tagne et al. 2025 ). Setelah anestesi, hewan dikorbankan dengan sayatan vena jugularis leher, dan darah dikumpulkan dalam tabung kering untuk pengukuran parameter seperti lipid darah, transaminase, dan parameter stres oksidatif. Organ-organ seperti jantung, hati, pankreas, dan ginjal dari setiap hewan dikumpulkan segera setelah pengambilan darah, kemudian dibilas dalam larutan ringer laktat (RL), dikeringkan, dan ditimbang untuk mengevaluasi massa relatifnya dibandingkan dengan bangkai hewan sesuai dengan rumus berikut:
![]()
Buffer digunakan untuk homogenat hati (20%). Setiap homogenat disentrifugasi pada 3000 g selama 15 menit, dan supernatan yang terkumpul disimpan pada suhu -20°C untuk evaluasi parameter stres oksidatif.
2.4 Analisis Biokimia
Untuk profil lipid, konsentrasi trigliserida (TG), kolesterol total (TC), dan kolesterol HDL ditentukan menggunakan kit Fortress Diagnostics (BXC0317A, Inggris) mengikuti protokol pabrik pembuatnya. Konsentrasi kolesterol LDL dihitung dari nilai kolesterol total (TC), trigliserida (TG), dan kolesterol HDL mengikuti rumus (Friedewald et al. 1972 ):

Aktivitas Alanine Aminotransferase (ALT) dan Aspartate Aminotransferase (AST) ditentukan menggunakan Fortress Diagnostics Kit (masing-masing BXC0212A dan BXC0202A) mengikuti protokol pabrikan.
Kreatinin serum ditentukan menggunakan metode kinetik (Bartels dan Cikes 1969 ). 100 μL kreatinin standar, 100 μL air suling, dan 100 μL sampel ditambahkan ke tabung standar, tabung blanko, dan tabung reaksi, yang masing-masing berisi 500 μL media reaksi. Campuran dihomogenkan, dan absorbansi tabung standar dan tabung reaksi dibaca pada 500 nm terhadap blanko pada 30 dan 90 detik. Konsentrasi kreatinin dihitung sebagai berikut:
![]()
di mana [Crea], konsentrasi kreatinin (mg/dL); A.Sample, absorbansi sampel; A.Std, absorbansi standar; Conc.Std, konsentrasi standar (200 mg/dL).
Untuk Uji Malondialdehid (MDA), 125 μL asam trikloroasetat (TCA, 20%) dan 250 μL asam tiobarbiturat (TBA, 0,67%) ditambahkan ke tabung reaksi yang berisi 250 μL buffer Tris–HCl (50 mM, pH 7,4) atau homogenat. Tabung ditutup dengan manik-manik kaca, dipanaskan hingga 90°C dalam penangas air selama 10 menit, kemudian didinginkan dalam air keran dan disentrifugasi pada 3000 g pada suhu ruangan selama 15 menit. Supernatan dipipet dan absorbansi dibaca pada 530 nm terhadap blanko (Fokam Tagne et al. 2021 ). Konsentrasi MDA dalam setiap sampel ditentukan menggunakan rumus berikut:
![]()
di mana [MDA], konsentrasi MDA (mol/g organ); ΔDO, kerapatan optik pengujian—kepadatan optik blanko; L, panjang lintasan optik (1 cm); ɛ, koefisien kepunahan molar (13.600 mol −1 . cm −1 ); m, massa organ (g).
Untuk penentuan oksida nitrat (NO), 400 μL air suling dan 500 μL reagen Griess ditambahkan ke tabung yang berisi 100 μL sampel atau blanko. Campuran dihomogenkan dan diinkubasi dalam gelap selama 10 menit pada suhu kamar. Absorbansi dibaca menggunakan spektrofotometer pada 560 nm (Fermor et al. 2001 ). Konsentrasi nitrit dalam setiap sampel ditentukan menggunakan rumus berikut:
![]()
di mana [Nitrit], konsentrasi nitrit (μmol/g organ); ΔDO, uji OD—OD kosong; a, kemiringan kurva kalibrasi; m, massa organ.
Untuk Uji Superoksida Dismutase (SOD), 1666 μL penyangga karbonat (0,05 M, pH 10,2) dan 200 μL adrenalin (0,3 mM) ditambahkan ke tabung reaksi yang berisi 134 μL sampel. Dalam tabung kosong, 1800 μL penyangga karbonat (0,05 M, pH 10,2) ditambahkan ke 200 μL adrenalin (0,3 mM). Setelah homogenisasi tabung yang berbeda, absorbansi tabung reaksi dibaca terhadap blanko pada 480 nm pada 20 dan 80 detik (Fokam Tagne et al. 2021 ). Aktivitas SOD ditentukan sebagai berikut:
![]()
di mana A20s, Penyerapan diukur pada 20 detik; A80s, Penyerapan diukur pada 80 detik.
Untuk Uji Katalase (CAT), 187,5 μL buffer fosfat (0,1 mM; pH 7,5) ditambahkan ke 12,5 μL homogenat untuk tabung reaksi dan ke 12,5 μL air suling untuk tabung kosong. 50 μL hidrogen peroksida (50 mM) ditambahkan ke setiap tabung dan diinkubasi selama 1 menit pada suhu ruangan. 500 μL kalium dikromat/asam asetat glasial (5%) kemudian ditambahkan ke semua tabung dan campuran dipanaskan pada suhu 100°C selama 10 menit. Setelah mendinginkan masing-masing tabung, absorbansi dibaca pada 570 nm terhadap blanko (Fokam Tagne et al. 2021 ). Aktivitas spesifik katalase ditentukan menggunakan rumus berikut:
![]()
di mana ActCAT, aktivitas katalase (mM H 2 O 2 /menit/g organ); A.test, absorbansi tabung reaksi; A.blank, absorbansi tabung blanko; a, kemiringan kurva kalibrasi; t, waktu reaksi (1 menit); m, massa organ (g).
Untuk Uji Glutathione Tereduksi, 1500 μL reagen Ellman ditambahkan ke 100 μL homogenat untuk tabung reaksi atau ke 100 μL buffer Tris–HCl (50 mM; pH = 7,4) untuk tabung kosong. Campuran dihomogenkan dan diinkubasi pada suhu ruangan selama 60 menit. Absorbansi dibaca terhadap blanko pada 412 nm (Fokam Tagne et al. 2021 ). Konsentrasi GSH ditentukan menurut rumus berikut:
![]()
di mana [GSH], konsentrasi GSH (mol/g organ); A.test, absorbansi tabung reaksi; A.blank, absorbansi tabung blanko; L, panjang lintasan optik (1 cm); ε, koefisien kepunahan molar (15.600 mol −1 . cm −1 ); m, massa organ (g).
2.5 Analisis Statistik
Hasil yang diperoleh dinyatakan dalam bentuk mean ± standard error of mean (SEM). Pengolahan data dilakukan menggunakan perangkat lunak Microsoft Excel 2021 dan eksplorasi data dilakukan menggunakan perangkat lunak IBM SPSS Statistics 27. Analisis uji varians “Two-way ANOVA” yang dilanjutkan dengan uji multiple comparison Turki dilakukan menggunakan perangkat lunak GraphPad prism 10.1.0.
3 Hasil
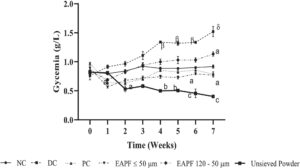
3.1 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Glikemia Puasa pada Tikus Diabetes
Glikemia puasa pada kelompok hewan pada awal percobaan (waktu T0) tidak menunjukkan perbedaan signifikan (dengan nilai rata-rata sekitar 0,85 ± 0,03 g/L (Gambar 1 )). Glikemia pada tikus diabetes meningkat secara signifikan ( p < 0,001) selama perawatan dibandingkan dengan kelompok kontrol normal. Kadar glukosa darah pada kelompok kontrol diabetes meningkat dari 0,91 ± 0,03 g/L pada akhir minggu ke-1 menjadi 1,52 ± 0,08 g/L pada akhir minggu ke-7. Fraksi ≤ 50 μm, bubuk E. africanum yang tidak diayak dan metformin (20 mg/kg) mencegah peningkatan glukosa darah dibandingkan dengan tikus kontrol diabetes. Nilai glukosa darah menurun dari 0,56 ± 0,01 g/L, 0,81 ± 0,02 g/L dan 0,63 ± 0,02 g/L pada minggu ke-1 menjadi 0,77 ± 0,03 g/L, 0,30 ± 0,10 g/L dan 0,59 ± 0,19 g/L pada minggu ke-7 untuk kelompok yang menerima fraksi ≤ 50 μm, bubuk E. africanum yang tidak diayak dan metformin (20 mg/kg), masing-masing. Selain itu, fraksi ≤ 50 μm (300 mg/kg) menghasilkan kontrol glikemik jangka panjang terbaik dibandingkan dengan bubuk yang tidak diayak (300 mg/kg) dan metformin (20 mg/kg).
3.2 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Toleransi Glukosa Oral
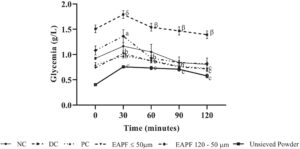
30 menit setelah pemberian glukosa (4 g/kg), nilai glukosa darah adalah sebagai berikut: 1,16 ± 0,2; 1,79 ± 0,07; 0,97 ± 0,04; 1,02 ± 0,05; 1,36 ± 0,12; 0,75 ± 0,02 g/L, berturut-turut pada kelompok kontrol normal, kontrol diabetes, kontrol positif, dan kelompok uji yang menerima fraksi bubuk Erythrophleum africanum ≤ 50 μm, 50–120 μm, dan bubuk yang tidak diayak (300 mg/kg bb). Nilai-nilai ini menurun secara signifikan ( p < 0,001) pada hewan yang diobati dengan fraksi bubuk E. africanum ≤ 50 μm, 50–120 μm, bubuk yang tidak diayak, atau metformin dan masing-masing adalah 0,71 ± 0,02; 0,81 ± 0,03; 0,57 ± 0,03; 0,72 ± 0,06 g/L (Gambar 2 ).
3.3 Pengaruh Pemberian Serbuk Kulit Batang Erythrophleum africanum terhadap Asupan Makanan
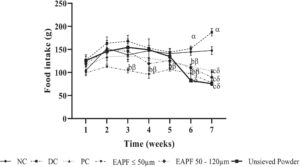
Selama 4 minggu pertama pengobatan, konsumsi makanan hewan yang menerima diet normal (Kontrol Normal) tidak menunjukkan perbedaan signifikan dibandingkan dengan hewan yang menerima diet berkalori tinggi (Kontrol Diabetes). Pada akhir minggu ke-7, konsumsi makanan hewan yang menerima diet berkalori tinggi dan diobati dengan air suling (Kontrol Diabetes) (187,25 ± 8,08 g) meningkat secara signifikan ( p < 0,05) dibandingkan dengan hewan yang menerima diet normal dan air suling (Kontrol Normal) (147,50 ± 8,52 g) (Gambar 3 ). Namun, pada hewan yang menerima diet berkalori tinggi dan diobati dengan fraksi (≤ 50 μm, 50–120 μm), bubuk yang tidak diayak, atau metformin (20 mg/kg), asupan makanan berkurang secara signifikan ( p < 0,001) dibandingkan dengan kontrol diabetes. Nilai-nilai tersebut pada minggu ketujuh adalah 77,75 ± 4,25 g, 89,75 ± 10,91 g, 75,66 ± 4,05 g, dan 103 ± 3,21 g pada hewan yang diobati dengan fraksi bubuk ≤ 50 μm, 50–120 μm, bubuk yang tidak diayak, dan metformin, masing-masing.
3.4 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Berat Badan
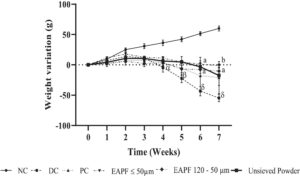
Berat hewan pada kontrol diabetes, kontrol positif, dan hewan yang menerima fraksi ≤ 50 μm, 120–50 μm, bubuk yang tidak diayak menurun secara signifikan ( p < 0,001) dibandingkan dengan kontrol normal (Gambar 4 ).
3.5 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Massa Relatif Organ
Pengaruh pemberian makanan berkalori tinggi yang mengandung gula dan fraksi bubuk kulit batang Erythrophleum africanum secara bersamaan terhadap massa relatif organ, yaitu jantung, hati, pankreas, dan ginjal, dicatat dalam Tabel 2 di bawah ini. Jelas dari tabel ini bahwa tidak ada variasi signifikan yang disebabkan pada kelompok hewan yang berbeda.
| Kelompok | Massa relatif (%) | |||
|---|---|---|---|---|
| Jantung | Hati | Pankreas | Ginjal | |
| NC | 0,38 ± 0,03 | 3,38 ± 0,14 | 0,38 ± 0,14 | 0,75 ± 0,03 |
| DC | 0,47 ± 0,05 | 4,61 ± 0,10 β | 0,50 ± 0,10 | 0,81 ± 0,00α |
| MC | 0,44 ± 0,01 | 4,49 ± 0,35 β | 0,36 ± 0,06 | 0,78 ± 0,06 |
| EAPF ≤ 50 μm | 0,37 ± 0,04** | 4,02 ± 0,07* | 0,37 ± 0,05 | 0,71 ± 0,02** |
| EAPF 120–50 μm | 0,36 ± 0,03** | 4,35 ± 0,25 β | 0,41 ± 0,04 | 0,69 ± 0,02 α ** |
| Bubuk yang tidak diayak | 0,35 ± 0,02** | 4,11 ± 0,14 β | 0,41 ± 0,09 | 0,64 ± 0,03 β ** |
Catatan: Nilai dinyatakan sebagai mean ± SEM, ( n = 5). Perbedaan signifikan ( αp < 0,05; βp < 0,01 ) dibandingkan dengan kontrol normal (NC) dan (* p < 0,05; ** p < 0,01) dibandingkan dengan kontrol diabetes (DC). Singkatan: EAPF, Fraksi bubuk Erythrophleum africanum; PC, Kontrol positif.
3.6 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Profil Lipid Tikus Diabetes
Pada akhir perawatan, trigliserida, kolesterol total, kolesterol LDL, kolesterol HDL, dan indeks aterogenik masing-masing adalah 52,36 ± 7,00, 141,4 ± 9,72, 38,22 ± 11,18, 92,7 ± 2,38, dan 1,53 ± 0,14 pada kontrol normal. Pada hewan yang diberi diet berkalori tinggi dan diobati dengan air suling, nilai-nilai ini adalah 125,66 ± 3,60, 260,42 ± 16,71, 171,60 ± 16,84, 62,91 ± 1,16, dan 4,15 ± 0,34, masing-masing, untuk trigliserida, kolesterol total, kolesterol LDL, kolesterol HDL, dan indeks aterogenik. Nilai-nilai ini menurun secara signifikan ( p < 0,001) pada hewan yang diobati dengan fraksi bubuk E. africanum dan metformin dibandingkan dengan kontrol diabetes (Tabel 3 ).
| Kelompok | Tg | TC | HDL | LDL | Kecerdasan buatan |
|---|---|---|---|---|---|
| NC | 52,36 ± 7,00 | 141,4 ± 9,72 | 92,7 ± 2,38 | 38,22 ± 11,18 | 1,53 ± 0,14 |
| DC | 125,66 ± 3,60 β | 260,42 ± 16,71 β | 62,91 ± 1,16 | 171,60 ± 16,84 β | 4,15 ± 0,34 β |
| MC | 74,8 ± 10,77** | 157,2 ± 6,77** | 108,46 ± 4,69** | 33,77 ± 10,15** | 1,45 ± 0,11** |
| EAPF ≤ 50 μm | 57,83 ± 10,54** | 149,76 ± 19,61** | 120,63 ± 1,69** | 7,86 ± 1,34** | 1,24 ± 0,17** |
| EAPF 50–120 μm | 74 ± 6,72** | 149,93 ± 8,45** | 109,23 ± 2,74** | 25,9 ± 10,59** | 1,37 ± 0,10** |
| Bubuk yang tidak diayak | 55,43 ± 12,86** | 155,46 ± 16,33** | 119,7 ± 3,36** | 24,68 ± 15,57** | 1,30 ± 0,13** |
Catatan: Nilai dinyatakan sebagai mean ± SEM, ( n = 5). Perbedaan signifikan ( αp < 0,05; βp < 0,01 ) dibandingkan dengan kontrol normal (NC) dan (** p < 0,01) dibandingkan dengan kontrol diabetes (DC). Singkatan: EAPF, fraksi bubuk Erythrophleum africanum; MC, kontrol metformin.
3.7 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Parameter Hepatik dan Ginjal pada Tikus Diabetes
Peningkatan signifikan ( p < 0,05) aktivitas serum ALAT dan ASAT serta kreatininemia diamati pada tikus dalam kelompok kontrol diabetes dibandingkan dengan kontrol normal (Tabel 4 ). Namun, pemberian fraksi ≤ 50 μm, 50–120 μm, bubuk yang tidak diayak, dan metformin (20 mg/kg) mengakibatkan penurunan signifikan ( p < 0,05) pada parameter ini pada tikus dalam kelompok masing-masing dibandingkan dengan tikus dalam kelompok kontrol diabetes.
| Kelompok | ALAT (U/L) | ASAT (U/L) | Kreatinin (mg/dL) |
|---|---|---|---|
| NC | 37,55 ± 2,48 | 68,11 ± 1,70 | 0,66 ± 0,04 |
| DC | 55,46 ± 3,69 | 90,05 ± 8,83 | 1,15 ± 0,11 β |
| MC | 42,90 ± 4,09* | 72,83 ± 6,52* | 0,76 ± 0,07* |
| EAPF ≤ 50 μm | 38,38 ± 7,09** | 70,91 ± 1,82* | 0,73 ± 0,09* |
| EAPF 120–50 μm | 45,63 ± 1,15* | 78,93 ± 3,35* | 0,87 ± 0,06* |
| Bubuk yang tidak diayak | 45,21 ± 2,28* | 86,7 ± 5,33 | 1,03 ± 0,25 |
Catatan: Nilai dinyatakan sebagai mean ± SEM, ( n = 5). Perbedaan signifikan ( αp < 0,05; βp < 0,01 ) dibandingkan dengan kontrol normal (NC) dan (* p < 0,05; ** p < 0,01) dibandingkan dengan kontrol diabetes (DC). Singkatan: DC, Pengendalian Diabetes; EAPF, fraksi bubuk Erythrophleum africanum.
3.8 Pengaruh Fraksi Serbuk Kulit Batang Erythrophleum africanum terhadap Parameter Stres Oksidatif
Kadar malondialdehid (MDA) serum masing-masing adalah 46,68 ± 0,26, 113,86 ± 2,28, 37,47 ± 0,38, 16,85 ± 0,53, 18,37 ± 0,42, dan 59,22 ± 1,55 μmol/L pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak. Di dalam hati, nilai-nilai tersebut berturut-turut adalah 144,02 ± 9,17, 201,52 ± 5,34, 130,62 ± 7,86, 113,04 ± 8,18, 131,95 ± 12,38, dan 132,94 ± 13,76 μmol/g hati pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau dengan bubuk yang tidak diayak (Tabel 5 ).
| MDA (μmol/L) | TIDAK (nmol/L) | CAT (mM/menit/L) | SOD (Satuan/L) | Kadar GSH (μmol/L) | |
|---|---|---|---|---|---|
| Serum | |||||
| Kontrol normal | 46,68 ± 0,26 | 215,87 ± 14,68 | 107,88 ± 12,37 | 363,16 ± 6,07 | 59,58 ± 2,12 |
| Kontrol diabetes | 113,86 ± 2,28 β | 58,77 ± 8,30 β | 52,64 ± 2,85 β | 122,81 ± 14,03 β | 11,95 ± 0,40 |
| Kontrol Positif | 37,47 ± 0,38* | 201,68 ± 16,72** | 90,74 ± 11,53 β * | 374,15 ± 3,03** | 54,48 ± 2,00* |
| EAPF ≤ 50 μm | 16,85 ± 0,53 β ** | 204,52 ± 14,64** | 131,21 ± 15,84 β | 484,21 ± 10,95** | 72,20 ± 4,38** |
| EAPF 50–120 μm | 18,37 ± 0,42 β * | 134,48 ± 4,95** | 95,74 ± 12,26* | 409,65 ± 3,50** | 55,34 ± 1,82* |
| Bubuk yang tidak diayak | 59,22 ± 1,55 α ** | 137,32 ± 6,13** | 79,55 ± 10,13* | 357,89 ± 6,07** | 62,64 ± 2,39** |
| MDA (μmol/gram) | TIDAK (nmol/g) | CAT (mM/menit/g) | SOD (U/g) | Kadar GSH (μmol/g) | |
|---|---|---|---|---|---|
| Hati | |||||
| Kontrol Normal | 144,02 ± 9,17 | 599,08 ± 19,59 | 203,69 ± 10,71 | 701,75 ± 35,08 | 127,44 ± 8,08 |
| Kontrol Diabetes | 201,52 ± 5,34 β | 265,47 ± 7,26 β | 97,74 ± 8,59 β | 508,77 ± 36,47 β | 67,76 ± 9,09 β |
| Kontrol Positif | 130,62 ± 7,86** | 383,77 ± 18,46 β * | 171,55 ± 7,13** | 763,16 ± 28,94** | 116,17 ± 7,96** |
| EAPF ≤ 50 μm | 113,04 ± 8,18** | 613,57 ± 14,00** | 197,74 ± 14,41** | 859,65 ± 23,20** | 128,05 ± 11,49** |
| EAPF 50–120 μm | 131,95 ± 12,38** | 397,97 ± 14,48 β * | 187,02 ± 10,49** | 824,56 ± 21,20** | 136,14 ± 4,25** |
| Bubuk yang tidak diayak | 132,94 ± 13,76** | 286,76 ± 6,78 β | 135,83 ± 12,75* | 850,88 ± 17,54** | 93,74 ± 8,22* |
Catatan: Nilai dinyatakan sebagai mean ± SEM, ( n = 5). Perbedaan signifikan ( αp < 0,05; βp < 0,01 ) dibandingkan dengan kontrol normal dan (* p < 0,05; ** p < 0,01) dibandingkan dengan kontrol diabetes. Singkatan: CAT, katalase; EAPF, fraksi bubuk Erythrophleum africanum; GSH, glutathione tereduksi; MDA, malondialdehid; NO, oksida nitrat; SOD, superoksida dismutase.
Aktivitas katalase serum adalah 107,88 ± 12,37, 52,64 ± 2,85, 90,74 ± 11,53, 131,21 ± 15,84, 95,74 ± 12,26, dan 79,55 ± 10,13 μmol/L pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak, masing-masing. Di dalam hati, nilai-nilai tersebut berturut-turut adalah 203,69 ± 10,71, 97,74 ± 8,59, 171,55 ± 7,13, 197,74 ± 14,41, 187,02 ± 10,49, dan 135,83 ± 12,75 μmol/g hati pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau dengan bubuk yang tidak diayak (Tabel 5 ).
Aktivitas SOD serum adalah 363,16 ± 6,07, 122,81 ± 14,03, 374,15 ± 3,03, 484,21 ± 10,95, 409,65 ± 3,50, dan 357,89 ± 6,07 μmol/L pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak, masing-masing. Di hati, aktivitas SOD masing-masing adalah 701,75 ± 35,08, 508,77 ± 36,94, 763,16 ± 28,94, 859,65 ± 23,20, 824,56 ± 21,20, dan 850,88 ± 17,54 μmol/g hati pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak (Tabel 5 ).
Kadar glutathione tereduksi dalam hati masing-masing adalah 127,44 ± 8,08, 67,76 ± 9,09, 116,17 ± 7,96, 128,05 ± 11,49, 136,14 ± 4,25, dan 93,74 ± 8,22 μmol/g hati pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak. Dalam serum, nilai GSH adalah 59,58 ± 2,12, 11,95 ± 0,40, 54,48 ± 2,00, 72,20 ± 4,38, 55,34 ± 1,82, dan 62,64 ± 2,39 μmol/L pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak, masing-masing (Tabel 5 ).
Kadar oksida nitrat serum masing-masing adalah 215,87 ± 14,68, 58,77 ± 8,30, 201,68 ± 16,72, 204,52 ± 14,64, 134,48 ± 4,95, dan 137,32 ± 6,13 μmol/L pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak. Di dalam hati, nilai NO adalah 599,08 ± 19,59, 265,47 ± 7,26, 383,77 ± 18,46, 613,57 ± 14,00, 397,97 ± 14,48, dan 286,76 ± 6,78 μmol/g hati pada kontrol normal, kontrol diabetes, kontrol positif, dan hewan yang diobati dengan fraksi bubuk E. africanum atau bubuk yang tidak diayak, masing-masing (Tabel 5 ).
4 Diskusi
Karena aspek epidemiologi, etiologi, dan faktor risiko diabetes tipe 2 pada manusia, penting untuk memilih model hewan yang tepat untuk mereproduksi keadaan fisiologis manusia untuk menguji fitomedisinfektan antidiabetik (Vialettes 2021 ). Salah satu fitur model ini adalah kemungkinan munculnya resistensi insulin. Beberapa penelitian telah menunjukkan bahwa ketika tikus diberi diet tinggi kalori yang mengandung gula, mereka mudah mengembangkan resistensi insulin (Kamgang et al. 2005 ). Yang paling umum, deksametason (glukokortikoid eksogen) dikombinasikan dengan diet ini karena kemampuannya untuk meningkatkan perkembangan resistensi insulin dengan mengurangi jumlah dan aktivitas transporter glukosa (Bastin dan Andreelli 2020 ; Ngounou et al. 2021 ). Dengan demikian, model hewan diabetes tipe 2 yang diinduksi oleh diet sukrosa hiperkalori yang dikombinasikan dengan pemberian deksametason (0,2 mg/kg) adalah model yang akan mereproduksi karakteristik metabolik diabetes tipe 2 pada manusia. Erythrophleum africanum adalah tanaman obat yang digunakan dalam pengobatan beberapa patologi, termasuk diabetes. Penelitian saat ini bertujuan untuk mengevaluasi potensi efek antidiabetik dan antioksidan dari fraksi bubuk kulit batang Erythrophleum africanum pada diabetes tipe 2 yang diinduksi oleh diet dan deksametason pada tikus.
Kadar glukosa darah puasa hewan setelah pemberian bersamaan diet tinggi kalori yang mengandung gula dan fraksi bubuk Erythrophleum africanum menurun dari minggu ketiga hingga minggu ketujuh. Zat-zat yang terkandung dalam E. africanum diduga bertanggung jawab atas aktivitas farmakologis ini. Memang, beberapa senyawa seperti saponin, flavonoid, polifenol, tanin, dan glikosida jantung telah disorot oleh analisis fitokimia ekstrak air dari kulit batang tanaman ini (Tukur et al. 2022 ). Penelitian sebelumnya telah menunjukkan adanya kemungkinan hubungan antara sifat fitokimia senyawa yang ada dalam tanaman dan kadar glukosa darah (Bi et al. 2008 ). Zat-zat seperti polifenol dan flavonoid secara umum dikenal mampu mengatur kadar glukosa darah dengan meningkatkan ekspresi GLUT-2 pada sel-β pankreas dan juga meningkatkan ekspresi GLUT-4 serta mendorong penghambatan α-glukosidase (Ansarullah et al. 2011 ; Hanhineva et al. 2010 ; Soares et al. 2017 ). Saponin dikenal karena perannya dalam mengurangi gula darah dengan menghambat penyerapan glukosa di usus, mencegah penyimpanan glukosa, yang kemudian akan menyebabkan sekresi insulin (Kambouche et al. 2009 ). Khasiat tanaman kami lebih nyata daripada khasiat metformin dan menunjukkan bahwa selain jalur kerja metformin, tanaman tersebut mungkin memiliki jalur kerja lain. Memang, metformin bekerja pada hati dengan mengurangi produksi glukosa hati melalui penghambatan glukoneogenesis (Cladera et al. 2024 ; Vezza et al. 2023 ). Obat ini juga berkontribusi untuk meningkatkan sensitivitas reseptor insulin (Foretz et al. 2021 ; Koffert et al. 2017 ).
Hilangnya berat badan yang diamati selama percobaan pada hewan dalam kelompok kontrol negatif dapat dijelaskan oleh hidrolisis cadangan protein dan lipid pada tingkat jaringan karena ketidakmampuan sel untuk menggunakan glukosa darah (Sidibeh 2018 ). Fraksi bubuk kulit batang Erythrophleum africanum juga menyebabkan penurunan berat badan. Efek ini terkait dengan penurunan asupan makanan, yang dapat dijelaskan oleh pengaruh ekstrak pada nafsu makan tikus (Jouad et al. 2003 ; Kamgang et al. 2008 ). Ada kemungkinan bahwa fraksi-fraksi ini mengandung polisakarida yang, begitu berada di dalam tubuh, dapat terlibat dalam mengurangi konsumsi makanan dengan menggantikan glukosa, sehingga mengurangi kebutuhan glukosa seluler.
Sebagian besar zat yang diberikan ke tubuh secara oral ( per os ) didistribusikan ke hati untuk menjalani biotransformasi (metabolisme presistemik) sebelum memasuki sirkulasi sistemik dan kemudian dihilangkan (Naud et al. 2015 ). Jantung, sebagai organ sentral dari sistem peredaran darah organisme hewan tingkat tinggi, juga dapat mengalami efek toksik zat. Analisis massa relatif organ yang dipelajari dalam penelitian ini menunjukkan bahwa semuanya identik. Hasil ini menunjukkan bahwa kondisi organ (jantung, hati, pankreas, dan ginjal) tidak dimodifikasi secara signifikan oleh perawatan yang diberikan selama seluruh percobaan.
Pada kontrol diabetes, kami mengamati dislipidemia yang ditandai dengan kadar trigliserida, kolesterol total, dan kolesterol LDL yang tinggi dan kadar kolesterol HDL yang rendah dibandingkan dengan kontrol normal, yang akan dikaitkan dengan resistensi insulin. Serbuk fraksi kulit batang Erythrophleum africanum memperbaiki profil lipid ini dengan menginduksi peningkatan kadar kolesterol HDL dan penurunan kadar trigliserida dan kolesterol LDL. Penghambatan aktivitas lipoprotein lipase mencegah hidrolisis trigliserida menjadi gliserol dan asam lemak (Charrière 2021 ). Tindakan pencegahan E. africanum pada profil lipid akan dihasilkan dari kapasitasnya untuk menghambat aktivitas lipoprotein lipase. Fraksi serbuk kulit batang pohon E. africanum dapat bertindak dengan mengurangi biosintesis kolesterol dengan menghambat aktivitas 3-hidroksi-3-metil-glutaril koenzim A reduktase (HMG-CoA reduktase) (Pierrot dan Octave 2014 ). Rasio kolesterol total/kolesterol HDL adalah indeks aterogenik yang dianggap sebagai cara yang sangat berguna untuk memprediksi disfungsi kardiovaskular (Castelli et al. 1983 ). Indeks kurang dari atau sama dengan 3 identik dengan tidak adanya risiko aterogenik, sementara indeks lebih besar dari 4 pada subjek merupakan risiko utama kerusakan kardiovaskular (Liu et al. 2024 ). Fraksi serbuk kulit batang pohon Erythrophleum africanum menunjukkan indeks jauh di bawah 3, yang menunjukkan tindakan perlindungan ekstrak ini pada jantung dan vaskularisasinya.
Karena alanine aminotransferase (ALAT) dan aspartate aminotransferase (ASAT) adalah enzim asal sitoplasma, setiap nekrosis sel, peningkatan permeabilitas membran hepatosit, atau kerusakan parenkim hati dapat menyebabkan peningkatan kadar serum mereka (Alkalah 2017 ; Jodynis-Liebert et al. 2010 ). Kreatinin tetap menjadi parameter semiologi umum untuk menetapkan diagnosis fungsi ginjal (Dussol 2011 ). Dengan demikian, zat apa pun yang dapat memodifikasi fungsi ginjal yang berbeda akan menyebabkan modifikasi konsentrasi plasma kreatinin (Filler et al. 2014 ; Gowda et al. 2010 ). Hasil penelitian menunjukkan bahwa pemberian diet tinggi kalori yang mengandung gula ditambah dengan deksametason menyebabkan peningkatan yang signifikan pada kadar ALAT, ASAT, dan kreatinin pada hewan dalam kelompok kontrol diabetes. Fraksi bubuk Erythrophleum africanum tidak menyebabkan peningkatan kadar enzim ini dalam serum, yang menunjukkan bahwa pengobatan tersebut tidak beracun. Senyawa bioaktif seperti flavonoid dan saponin dapat menjadi asal mula efek hepatoprotektif dan nefroprotektif ini, seperti yang ditunjukkan oleh El Khasmi dan Farh ( 2022 ); Kouadio dkk. ( 2022 ).
Diabetes melitus ditandai dengan produksi berlebih spesies oksigen reaktif yang diduga muncul dari autoksidasi glukosa, sehingga menyebabkan tingkat stres oksidatif yang signifikan (Boyer et al. 2014 ; Delattre et al. 2001 ). Malondialdehid (MDA) dianggap sebagai salah satu perantara oksidasi subtraktif yang paling banyak dipelajari untuk menilai ruang lingkup oksidasi seluler (Favier 2003 ; Lee et al. 2012 ). Dengan demikian, peningkatan signifikan dalam konsentrasi MDA dalam kontrol diabetes akan menunjukkan timbulnya stres oksidatif karena produksi radikal bebas yang tinggi yang disebabkan oleh pemberian deksametason. Deksametason menyebabkan resistensi insulin dan hiperlipidemia yang menyebabkan lipotoksisitas seluler dan glukotoksisitas yang bertanggung jawab atas produksi radikal bebas yang berlebihan dan oleh karena itu melemahnya enzim antioksidan (CAT, SOD, GSH) dalam jaringan (Ellah et al. 2017 ; Keeney et al. 1993 ). Konsentrasi NO yang rendah pada hewan-hewan dari kelompok kontrol diabetes akan dihasilkan dari satu sisi efek deksametason yang, dengan menyebabkan resistensi insulin, akan menghambat aktivasi NOS (enzim sintesis NO), di sisi lain dari penggunaan NO yang nyata sebagai antioksidan (Fofié et al. 2018 ). Peningkatan aktivitas CAT, SOD, GSH, kadar NO dan penurunan kadar MDA yang diamati dalam serum dan homogenat hati tikus yang diobati dengan fraksi bubuk Erythrophleum africanum menunjukkan bahwa yang terakhir akan memiliki aktivitas anti-radikal dan bahwa mereka akan meningkatkan sensitivitas insulin, atau aktivitas NOS (dengan merangsang sintesisnya atau menonaktifkan inhibitornya), atau dengan memastikan ketersediaan L-arginin (prekursor NO) (Fofié et al. 2018 ; Tchamadeu et al. 2022 ). Beberapa penelitian menghubungkan aktivitas antioksidan dengan komposisi fitokimia spesies tanaman (Rivera-Yañez et al. 2018 ; Yadav et al. 2015 ). Faktanya, senyawa bioaktif seperti flavonoid, polifenol, saponin, dan tanin yang terkandung dalam E. africanum bekerja dengan cara menangkap radikal bebas dan merangsang biosintesis antioksidan, sehingga memiliki kekuatan antiradikal (Olalekan 2015 ; Tukur et al. 2022 ).
5 Kesimpulan
Tujuan dari penelitian ini adalah untuk mengevaluasi efek antidiabetik dan antioksidan dari fraksi serbuk kulit batang Erythrophleum africanum terhadap diabetes tipe 2 yang disebabkan oleh diet tinggi kalori dan deksametason pada tikus. Tanaman ini menunjukkan sifat antihiperglikemik pada tikus hiperglikemik, aktivitas hipolipidemik, dan aktivitas antioksidan. Penelitian ini membuktikan bahwa E. africanum memiliki sifat terhadap diabetes melitus tipe 2 dan memberikan argumen yang mendukung penggunaannya dalam pengobatan tradisional untuk diabetes. Untuk lebih menjelaskan mekanisme kerja fraksi serbuk kulit batang E. africanum dalam pengobatan diabetes melitus, di masa mendatang kita harus menilai aksi berbagai senyawa dari fraksi serbuk kita terhadap sel β pulau Langerhans pankreas, neoglukogenesis hati, dan enterosit, serta potensi efek toksik dari tanaman ini. Setelah mekanisme ini dijelaskan, serbuk E. africanum dapat digunakan sebagai suplemen makanan pada pasien diabetes.

