
ABSTRAK
Studi ini menyelidiki efek yang bergantung pada fotoperiode dari delapan ekstrak buah yang diperkaya fenolik pada kadar triasilgliserida (TAG) darah pasca makan dan kadar sitokin dan CRP serum pada tikus F344 setelah uji toleransi lipid oral (OLTT) dan tantangan inflamasi yang diinduksi lipopolisakarida (LPS). Hewan dipaparkan pada fotoperiode pendek (cahaya 6 jam, L6) atau panjang (cahaya 18 jam, L18) dan diberi suplemen ekstrak buah (100 mg/kg) secara oral selama 2 minggu. Ekstrak diperoleh dari buah musiman (ceri, plum, aprikot, stroberi, kesemek, anggur, jeruk, dan delima). Gangguan homeostasis temporal diinduksi oleh tantangan OLTT dan LPS. Tidak ada perbedaan kadar TAG pasca makan darah yang diamati pada kelompok kontrol L6 dan L12. Namun, dalam kelompok eksperimen, respons TAG postprandial bergantung pada periode cahaya dan konsumsi ekstrak buah, terutama ekstrak ceri dan plum di L6 ( p < 0,05). Selain itu, tikus kontrol yang terpapar L6 menunjukkan kadar IL-6 dan TNF-α darah yang lebih tinggi setelah menginduksi respons inflamasi LPS. Khususnya, ekstrak buah musim dingin dan stroberi adalah yang paling efisien dalam menurunkan sitokin proinflamasi. Temuan ini menunjukkan efektivitas ekstrak buah tertentu dalam memodulasi kadar TAG postprandial dan respons inflamasi akut, karena efeknya bergantung pada periode cahaya, membuka pintu bagi desain bahan fungsional yang spesifik untuk setiap musim.
Singkatan
AUC
area di bawah kurva
Bahasa Indonesia: CRP
Protein C-reaktif
Tikus F344
Fisher 344 tikus
PPS
ekstrak biji anggur yang kaya akan proantosianidin
HDL-C
kolesterol lipoprotein densitas tinggi
Inggris
interleukin
LDL-C
kolesterol lipoprotein densitas rendah
LPS
lipopolisakarida
Bahasa Indonesia: OLTT
Tes toleransi lipid oral
MENANDAI
triasilgliserida
TNF-α
faktor nekrosis tumor alfa
1 Pendahuluan
Penyakit tidak menular merupakan masalah kesehatan masyarakat yang signifikan yang menyebabkan 74 juta kematian setiap tahunnya, yang setara dengan 74% dari kematian global [ 1 ]. Insidensinya meningkat oleh berbagai faktor metabolik, seperti obesitas, tekanan darah tinggi, dan kadar glukosa dan lipid darah tinggi, serta faktor perilaku, termasuk gaya hidup yang tidak banyak bergerak, konsumsi alkohol dan tembakau, dan pola makan yang tidak sehat [ 2 , 3 ]. Fitur yang terkait dengan obesitas, seperti lingkar pinggang yang tinggi, dislipidemia, resistensi insulin, dan hipertensi, adalah beberapa kriteria yang digunakan untuk mendiagnosis sindrom metabolik (MetS). Selain itu, sitokin inflamasi yang bersirkulasi dikaitkan dengan perluasan jaringan adiposa pada individu yang mengalami obesitas dan dianggap sebagai biomarker yang berguna untuk memprediksi penyakit tidak menular [ 4 ].
Perubahan gaya hidup dan pola makan melalui perolehan pilihan yang lebih sehat dapat mencegah penambahan berat badan dan meringankan penyakit penyerta yang tidak menular [ 5 ]. Konsumsi rendah makanan nabati telah dikaitkan dengan risiko lebih tinggi terkena penyakit, termasuk obesitas, diabetes, dan penyakit kardiovaskular [ 6 ]. Sebaliknya, konsumsi sayur dan buah berbanding terbalik dengan tekanan darah diastolik dan risiko MetS [ 7 – 9 ]. Makanan nabati ini mengandung beragam senyawa bioaktif, seperti senyawa fenolik. Konsumsi mereka telah dikaitkan dengan efek anti-inflamasi, perbaikan dalam kontrol glukosa dan tekanan darah, pengurangan oksidasi kolesterol lipoprotein densitas rendah (LDL-C) dan kadar triasilgliserida (TAG), indeks massa tubuh, dan lingkar pinggang [ 10 – 12 ]. Namun, efeknya terhadap kesehatan dapat bervariasi tergantung pada jenis (poli)fenol yang dikonsumsi, dosis, atau profil (poli)fenol saat dikonsumsi dalam ekstrak atau produk turunan tanaman. Lebih jauh lagi, profil fenolik ini dapat bervariasi tergantung pada beberapa faktor seperti spesies atau faktor lingkungan, antara lain [ 13 ]. Menariknya, penelitian terbaru telah menunjukkan bahwa efek menguntungkan dari senyawa fenolik, yang diberikan sebagai ekstrak fenolik atau buah-buahan kaya fenolik, dapat bervariasi tergantung pada fotoperiode saat mereka dikonsumsi [ 14 , 15 ]. Teori xenohormesis mengusulkan bahwa senyawa berbasis tanaman tertentu, seperti senyawa fenolik, dapat bertindak sebagai molekul sinyal, yang memberikan informasi tentang kondisi lingkungan eksternal kepada konsumen. Sinyal-sinyal ini akan membantu memodulasi proses metabolisme, fisiologis, dan perilaku, membantu adaptasi konsumen terhadap perubahan lingkungan [ 16 – 18 ]. Dalam hal ini, dalam penelitian sebelumnya, kelompok kami memperoleh delapan ekstrak buah yang diperkaya fenolik dari buah-buahan musiman, yang memodulasi penanda biokimia darah, termasuk TAG, kolesterol, dan kadar glukosa puasa pada tikus Fisher 344 (F344) setelah 2 minggu konsumsi [ 19 ]. Menariknya, khasiatnya tidak hanya bergantung pada komposisi fenolik ekstrak tetapi juga pada periode cahaya konsumsi [ 19 ]. Secara khusus, ekstrak ceri dan aprikot menurunkan kadar TAG darah secara eksklusif ketika dikonsumsi dalam periode cahaya pendek. Sementara itu, ekstrak buah delima, anggur, dan jeruk menurunkan kadar kolesterol dan glukosa puasa pada hewan yang terpapar periode cahaya pendek [ 19]. Namun, tidak diketahui apakah ekstrak ini dapat memberikan efek menguntungkan pada kadar TAG pasca makan dan respons inflamasi pada hewan yang mengalami kondisi stres metabolik yang berbeda. Peningkatan TAG pasca makan dan inflamasi, jika berlangsung lama, dapat meningkatkan risiko penyakit kardiovaskular [ 20 , 21 ]. Mungkin bermanfaat untuk mengevaluasi potensi ekstrak ini sebagai bahan fungsional untuk pencegahan penyakit terkait MetS.
Selain itu, efeknya mungkin berbeda jika mempertimbangkan hasil penelitian kami sebelumnya dan bahwa penanda biokimia darah, seperti TAG atau glukosa, dapat dipengaruhi oleh fotoperiode pada tikus F344. Selain itu, penelitian lain menunjukkan bahwa manusia dapat memiliki status inflamasi yang berbeda tergantung pada musim, dan konsumsi buah dapat mengurangi kadar protein C-reaktif (CRP) tergantung pada musim konsumsi [ 22 ].
Berbagai uji tantangan metabolik telah dirancang untuk mengevaluasi efek senyawa bioaktif pada perubahan metabolik utama. Sebagai respons terhadap stresor metabolik, suatu organisme bertujuan untuk memulihkan keseimbangan dan menimbulkan respons yang kuat dan cepat [ 23 ]. Akibatnya, pengukuran reaksi respons stres akan membantu dalam menentukan kemanjuran pemberian senyawa bioaktif. Ini dianggap sebagai metode yang sensitif untuk menilai perubahan status kesehatan sebagai respons terhadap intervensi. Uji tantangan yang umum digunakan adalah uji toleransi lipid oral (OLTT), yang memungkinkan pemantauan metabolisme lipid [ 24 ]. Selain itu, tantangan inflamasi yang diinduksi lipopolisakarida (LPS) telah banyak digunakan untuk mempelajari potensi antiinflamasi obat-obatan dan senyawa alami [ 25 ]. LPS mengaktifkan makrofag/monosit dan menginduksi pelepasan dan produksi sitokin inflamasi seperti tumor necrosis factor-alpha (TNF-α), interleukin (IL)-1, dan IL-6, serta CRP [ 26 ]. Sitokin proinflamasi ini adalah molekul protein yang biasanya disekresikan oleh berbagai jenis sel (terutama makrofag) sebagai bagian dari respons inflamasi, sedangkan CRP adalah protein fase akut dengan kadar yang sangat tinggi dalam kondisi inflamasi, yang sering diukur secara klinis untuk menilai tingkat keparahan inflamasi [ 27 , 28 ].
Oleh karena itu, tujuan dari penelitian ini adalah untuk mengevaluasi efek dari delapan ekstrak buah pada metabolisme lipid pasca makan dan respons inflamasi pada tikus F344 yang menjalani berbagai uji tantangan metabolik untuk sementara waktu menyebabkan gangguan homeostasis. Selain itu, hewan juga akan terpapar periode cahaya pendek (cahaya 6 jam, L6) dan panjang (cahaya 18 jam, L18) untuk mengevaluasi potensi perubahan dalam efektivitas ekstrak ini tergantung pada periode cahaya konsumsi.
2 Bahan dan Metode
2.1 Ekstrak Buah Musiman
Ekstrak buah diperoleh seperti yang dijelaskan dalam Manocchio et al. [ 19 ]. Buah musim panas yang matang (ceri ( Prunus avium L.), aprikot ( Prunus armeniaca ), stroberi ( Fragaria vesca L.), plum ( Prunus domestica ) dan buah musim dingin (anggur ( Vitis vinifera ), jeruk ( Citrus sinensis L.), kesemek ( Diospyros kaki ), dan delima ( Punica granatum ) masing-masing diperoleh selama musim panas dan musim dingin dari produsen lokal. Tangkai buah dibuang secara manual, dan buah utuh, termasuk kulit, biji, dan daging buah, digiling secara mekanis dan dicampur untuk mendapatkan homogenat stroberi dan anggur. Untuk ceri, aprikot, plum, dan kesemek, biji dibuang sebelum digiling, dan untuk jeruk dan delima, kulit dibuang sebelum digiling. Homogenat disimpan pada suhu -20°C hingga proses ekstraksi.
Komposisi proksimat (protein, abu, serat, dan kandungan lemak) dari buah dan ekstrak asli tercantum dalam Manocchio et al. [ 19 ]. Komposisi fenolik dari ekstrak buah yang ditentukan menggunakan HPLC-Diode Array Detection-Electrospray Ionization-Tandem mass spectrometry juga tercantum dalam Manocchio et al. [ 19 ]. Secara singkat, keluarga fenolik utama yang ditemukan dalam ekstrak anggur dan ceri adalah antosianin, dengan cyanidin-3-rutinoside dan malvidin-3- O -monoglucoside, masing-masing, menjadi senyawa fenolik yang paling melimpah. Ekstrak stroberi dan delima terutama mengandung asam fenolik, dengan senyawa utama adalah asam ellagic rhamnoside dan asam ellagic dalam ekstrak stroberi, dan punicalagin dan pedunculagin dalam ekstrak delima. Dalam kasus ekstrak aprikot dan jeruk, famili yang paling melimpah adalah flavonol dan flavanon, masing-masing, dengan rutinosida dan didimin sebagai komponen utama, sedangkan ekstrak plum menonjol karena kandungan flavanolnya, terutama kandungannya dalam dimer prosianidin. Senyawa fenolik tidak teridentifikasi dalam ekstrak kesemek kaki karena konsentrasinya yang rendah [ 19 ].
2.2 Desain Eksperimen
Setelah 1 minggu adaptasi, tikus F344/IcoCrl berumur 8 minggu (Charles River Laboratories, L’Arblese, Cedex, Prancis) diberi paparan L6 dan L18 ( n = 72 per kelompok) untuk mensimulasikan musim dingin dan musim panas. Substrain tikus F344 ini terbukti responsif terhadap fotoperiode [ 14 , 29 , 30 ]. Selama percobaan, semua hewan diberi makanan biasa (AO4; Panlab, Barcelona, Spanyol) dan diberi akses ke air ledeng sesuai permintaan.
Percobaan 1 : Setelah 4 minggu adaptasi fotoperiode, tikus diberi suplemen ekstrak buah atau air keran setiap hari (kontrol, kelompok C) selama 2 minggu ( n = 8 per kelompok). Setelah 12 jam berpuasa, hewan-hewan tersebut menjalani OLTT. Untuk itu, mereka diberi ekstrak (100 mg/kg BB) atau air keran, dan 3 jam kemudian, mereka diberi minyak lemak babi secara oral melalui gavage (2,5 mL/kg BB). Kadar TAG dalam darah dari vena ekor dianalisis menggunakan instrumen Accutrend Plus (Roche Diagnostics, Barcelona, Spanyol) pada menit ke-0, 30, 60, 120, dan 240.
Mengikuti prinsip 3 R, hanya pengambilan sampel darah mikro yang dilakukan, dan hewan-hewan tersebut digunakan lagi dalam percobaan berikutnya setelah 4 hari pencucian, di mana mereka tidak diberi suplemen ekstrak.
Percobaan 2 : Tikus diberi ekstrak buah atau air ledeng (C) setiap hari selama 2 minggu ( n = 8 per kelompok). Hari terakhir percobaan melibatkan pemberian LPS dengan dosis 0,5 mg/kg BB pada hewan 3 jam setelah perawatan. Empat jam kemudian, tikus dibunuh dengan pemenggalan kepala. Serum diperoleh dengan mensentrifugasi darah yang tidak diheparinisasi pada 3000 × g selama 15 menit pada suhu kamar dan disimpan pada suhu -80°C hingga dibutuhkan untuk penelitian. Penanda inflamasi serum seperti kadar TNF-α, IL-6, CRP, dan penanda antiinflamasi IL-10 ditentukan menggunakan kit ELISA Finetest mengikuti petunjuk pabrik (Labclinics, Barcelona, Spanyol). Semua analisis dilakukan dalam rangkap dua. Diagram desain eksperimen ditampilkan pada Gambar 1 .
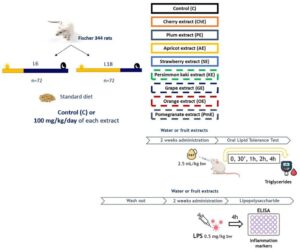
Komite Etika Hewan dari Universitas Rovira i Virgili (Tarragona, Spanyol) dan Generalitat de Catalunya (nomor izin 11 610) menyetujui prosedur hewan yang digunakan dalam penelitian ini.
2.3 Informasi Pemberian dan Dosis Ekstrak
Konsumsi ekstrak buah oleh hewan dilakukan secara sukarela, dengan menghubungkan mereka ke jarum suntik. Ekstrak buah diberikan antara pukul 8:00 pagi dan 9:00 pagi, secara konsisten pada waktu yang sama setiap hari dan bertepatan dengan siklus cahaya hewan, yang dimulai pada pukul 7:00 pagi (lampu menyala). Kelompok kontrol diberikan air keran dengan volume yang sama, mengikuti prosedur yang sama.
Hewan menerima ekstrak buah yang sesuai dengan dosis 100 mg/kg berat badan (BB). Dosis ini dipilih berdasarkan penelitian sebelumnya, yang menunjukkan bahwa jumlah ekstrak ini mampu memodulasi berbagai biomarker darah pada tikus F344 yang sehat [ 19 ]. Mempertimbangkan penerjemahan dosis hewan ke manusia dan memperkirakan asupan harian untuk manusia seberat 70 kg [ 31 ], dosis ekstrak 100 mg/kg/hari sesuai dengan asupan sekitar 1120 mg ekstrak yang diperkaya fenolik per hari [ 31 ]. Asupan harian senyawa fenolik dalam makanan manusia dapat sangat bervariasi tergantung pada kebiasaan makan, dan diperkirakan antara 200 dan 1000 mg per hari [ 32 ], dengan dosis yang dipelajari di atas perkiraan rata-rata ini.
2.4 Analisis Statistik
Nilai dinyatakan sebagai rata-rata ± simpangan baku (SD). Nilai-nilai outlier diidentifikasi dan dihilangkan sebelum analisis statistik. Analisis varians dua arah dan satu arah (ANOVA) digunakan untuk menentukan perbedaan antar kelompok menggunakan uji Post Hoc Tukey. ANOVA dua arah diindikasikan sebagai P: efek fotoperiode, E: efek ekstrak, P × E: interaksi antara fotoperiode dan ekstrak ketika p ≤ 0,05. Uji t Student digunakan untuk mengidentifikasi perbedaan signifikan ( p < 0,05) yang dihasilkan oleh fotoperiode untuk setiap perlakuan. Semua analisis statistik dilakukan menggunakan perangkat lunak Statistical Product and Service Solutions (SPSS) (SPSS Inc., Chicago, IL, AS).
3 Hasil dan Pembahasan
Beberapa strategi telah diusulkan untuk pencegahan MetS, termasuk pendekatan nutrisi untuk konsumsi makanan yang kaya akan senyawa bioaktif seperti buah-buahan dan sayuran [ 7 ]. Buah-buahan kaya akan senyawa fenolik, yang memainkan peran penting dalam mencegah gangguan metabolisme [ 33 ]. Dalam hal ini, mengonsumsi buah utuh dan beberapa ekstrak yang diperkaya fenolik, seperti ekstrak kaya proantosianidin biji anggur (GSPE), dapat meningkatkan hasil terkait obesitas. Misalnya, suplementasi GSPE mengurangi ukuran adiposit dan meningkatkan jumlah adiposit dalam model tikus obesitas [ 34 ]. Namun, penelitian pada tikus F344 telah menunjukkan bahwa efek ini dapat bervariasi tergantung pada fotoperiode konsumsi [ 17 ].
Dengan demikian, modulasi penanda darah yang berbeda pada tikus sehat oleh delapan ekstrak buah musiman baru baru-baru ini terbukti bergantung tidak hanya pada komposisi fenolik ekstrak, tetapi juga pada periode cahaya konsumsi [ 19 ]. Namun, efek ekstrak buah ini pada perubahan metabolik masih belum jelas. Oleh karena itu, penelitian saat ini difokuskan pada penyelidikan efek delapan ekstrak buah musiman yang diberikan kepada tikus F344 yang terpapar periode cahaya yang berbeda selama 2 minggu, ketika perubahan metabolik dilakukan melalui tantangan inflamasi yang diinduksi OLTT dan LPS.
3.1 Ekstrak Buah Meningkatkan Respon Lipid Pasca Makan Tergantung pada Fotoperiode
OLTT adalah metode yang efisien untuk mengevaluasi metabolisme lipid dalam tubuh setelah hipertrigliseridemia yang diinduksi lipid [ 35 ]. Kemampuan untuk mengurangi kadar TAG setelah konsumsi lipid memberikan informasi tentang penyerapan, transportasi, dan metabolisme lipid usus [ 36 ]. Peningkatan kadar TAG postprandial dikaitkan dengan perkembangan penyakit kardiovaskular [ 37 ]. Dengan demikian, uji tantangan ini adalah metode yang efisien untuk mengevaluasi potensi anti-hipertrigliseridemia dari senyawa bioaktif. Dalam penelitian ini, analisis statistik dari area di bawah kurva (AUC) yang diperoleh dari representasi kadar TAG darah hewan yang mengalami OLTT menunjukkan efek fotoperiode yang signifikan dan kecenderungan dalam interaksi antara ekstrak buah dan fotoperiode (ANOVA dua arah, p ≤ 0,05, dan p = 0,06, masing-masing, Gambar 2A,B ). Tidak ada perbedaan signifikan yang diamati dalam AUC antara kedua kelompok kontrol (Gambar 2A,B ). Namun, dalam penelitian kami sebelumnya, kami mengamati bahwa tikus F344 yang sehat menunjukkan peningkatan kadar TAG darah pada fotoperiode L6 (213 mg/dL) dibandingkan dengan fotoperiode L18 (155 mg/dL) [ 38 ]. Perbedaan fotoperiode ini tampaknya berkurang setelah tantangan OLTT. Fluktuasi musiman dalam kadar LDL-C, glukosa, dan tekanan darah yang bersirkulasi telah diamati pada pasien diabetes, dengan kadar yang lebih tinggi terjadi pada musim dingin dibandingkan dengan musim panas [ 39 ]. Selain itu, perubahan yang bergantung pada musim dan jenis kelamin dalam kadar lipid total yang bersirkulasi, tetapi tidak pada kadar TAG atau kolesterol, diamati pada Tropidurus catalanensis betina [ 40 ]. Selain itu, gen spesifik yang terkait dengan metabolisme glukosa dan lipid mengubah ekspresinya karena perbedaan fotoperiode dan musim, seperti Sirtuin 1 ( Sirt1 ), dengan ekspresi gen yang lebih tinggi pada fotoperiode L6 [ 41 ].
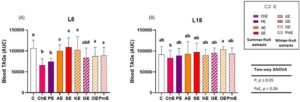
Mengenai efek ekstrak pada kadar TAG darah setelah OLTT, ekstrak yang diperoleh dari dua buah musim panas, ceri dan plum, secara signifikan menurunkan kadar TAG serum pada tikus yang terpapar L6 (masing-masing 65,6 dan 74,4 mg/dL × s) dibandingkan dengan kelompok L6-C (106,6 mg/dL × s) (Gambar 2A ). Namun, tidak ada ekstrak buah yang mengubah respons lipid postprandial pada hewan yang terpapar L18 setelah OLTT dibandingkan dengan kelompok L18-C (Gambar 2B ). Sejalan dengan hasil ini, penelitian sebelumnya menggunakan ekstrak ceri yang sama menemukan pengurangan kadar TAG darah pada tikus F344 yang sehat hanya ketika diberikan selama fotoperiode L6 yang menunjukkan penurunan 27% dari 223 menjadi 163 mg/dL [ 19 ]. Menariknya, efek menguntungkan dari ceri utuh, seperti ceri asam dan asam, pada kadar TAG pasca makan telah dilaporkan dalam studi klinis, meskipun tanpa mempertimbangkan waktu konsumsi dalam setahun [ 42 ]. Namun, pemberian ceri manis (100 mg/kg BB setiap hari selama 7 minggu) kepada tikus F344 tidak memengaruhi kadar TAG darah [ 43 ]. Kurangnya efek ceri utuh pada kadar TAG ini dapat disebabkan oleh perbedaan (poli)fenol yang diberikan kepada hewan [ 19 ]. Jadi, meskipun tikus F344 dalam kedua studi mengonsumsi produk dalam jumlah yang sama, dosis ekstrak mengandung lebih banyak senyawa fenolik daripada dosis buah. Selain itu, ekstrak ceri diperkaya dengan antosianin [ 19 ], yang dapat terlibat dalam efek ekstrak ceri pada kadar TAG, karena penelitian sebelumnya telah menunjukkan bahwa asupan antosianin memperbaiki dislipidemia pada populasi sehat [ 44 ]. Selain itu, cyanidin-3-rutinoside muncul sebagai senyawa fenolik utama yang terdapat dalam ekstrak ceri [ 19 ]. Senyawa ini menghambat aktivitas lipase pankreas dan kolesterol esterase in vitro dan mengurangi asupan kolesterol dalam sel Caco-2 yang diobati dengan senyawa ini [ 45 ].
Mengenai efek ekstrak plum, plum dikenal karena kandungan proantosianidin dan asam klorogenatnya yang tinggi [ 46 ]. Demikian pula, dimer proantosianidin merupakan senyawa utama dalam ekstrak plum yang diperoleh dalam penelitian ini [ 19 ]. Penelitian sebelumnya telah menunjukkan bahwa ekstrak biji anggur yang kaya akan proantosianidin dapat melemahkan perkembangan faktor risiko kardiometabolik (tekanan darah tinggi, berat badan, lingkar pinggang, penanda metabolisme lipid) pada tikus Wistar [ 47 ]. Selain itu, beberapa penelitian klinis menunjukkan bahwa suplementasi plum secara signifikan mengurangi kadar LDL-C; namun, tidak ada efek yang diamati pada penurunan kadar TAG di antara pasien sehat dan kelebihan berat badan yang diberi suplemen dengan dosis yang berbeda [ 48 ]. Hasil ini bertentangan dengan penelitian kami, di mana ekstrak plum mengurangi kadar TAG. Ekstrak plum diperkaya dengan senyawa fenolik dibandingkan dengan buah plum utuh [ 19 ] oleh karena itu, selain model in vivo dan durasi pengobatan, peningkatan kandungan senyawa fenolik yang diberikan kepada hewan (ekstrak plum vs. buah utuh) dapat menjelaskan efek berbeda yang diamati antara buah utuh dan ekstrak.
Sedikit yang diketahui saat ini tentang mekanisme aksi potensial yang terlibat dalam efek yang bergantung pada fotoperiode dari ekstrak kaya (poli)fenol pada kadar TAG. Namun, telah diamati dalam model tikus knockout (tikus reseptor Farnesoid X (FXR) −/− ) bahwa pengurangan kadar TAG yang diamati karena konsumsi ekstrak yang kaya (poli)fenol biji anggur bergantung pada FXR [ 49 ]. FXR memainkan peran penting dalam homeostasis lipid hati, dan transkripsinya menunjukkan ritme sirkadian [ 50 ]. Selain itu, reseptor nuklir ini diatur oleh sirtuin [ 51 ], yang aktivitasnya dimodulasi oleh senyawa fenolik [ 52 ] dan mengikuti osilasi harian [ 53 ]. Ritme sirkadian adalah osilasi endogen yang terjadi secara otonom, meskipun mereka diatur ulang oleh berbagai isyarat eksternal—di antaranya siang hari, yang mendefinisikan fotoperiode, adalah yang paling menonjol [ 54 ]. Penjelasan potensial lain untuk efek yang bervariasi dari senyawa fenolik tergantung pada fotoperiode konsumsi bisa jadi adalah interaksi mereka dengan mikrobiota usus. Selain itu, spesies Bakteri, seperti Escherichia coli , Bifidobacterium sp., Lactobacillus sp., Bacteroides sp., dan Eubacterium sp. dapat memetabolisme senyawa fenolik, menghasilkan metabolit turunan fenolik yang berbeda [ 55 ]. Metabolit fenolik ini dapat diserap dan memberikan manfaat kesehatan [ 55 ]. Selain itu, senyawa ini dapat mengatur kadar FXR ileum [ 56 ]. Khususnya, penelitian terbaru telah melaporkan perbedaan dalam komposisi mikrobiota usus tikus F344 yang terpapar fotoperiode berbeda, yang dapat menyebabkan produksi metabolit yang berbeda [ 57 ]. Lebih jauh lagi, penelitian terbaru menunjukkan bahwa mikrobiota usus memediasi efek bioavailabilitas proantosianidin yang bergantung pada fotoperiode pada tikus F344 yang mengalami obesitas [ 58 ]. Hal ini juga dapat berkontribusi pada efek diferensial dari ekstrak buah yang diteliti. Meskipun demikian, penelitian lebih lanjut diperlukan untuk menjelaskan mekanisme yang mendasari efek ekstrak buah kaya fenolik.
Perlu disebutkan bahwa ekstrak ceri dan plum mengurangi kadar TAG hanya jika diberikan selama periode foto L6. Oleh karena itu, temuan ini menunjukkan bahwa musim konsumsi harus dipertimbangkan untuk mengoptimalkan khasiat ekstrak buah yang diperkaya fenolik ini. Selain itu, fakta bahwa efek tersebut diamati dalam periode foto pendek juga dianggap relevan karena hasil terkait metabolik lebih sering terjadi selama bulan-bulan musim dingin pada manusia [ 59 ]. Oleh karena itu, hasil saat ini menunjukkan bahwa ekstrak ceri dan plum mungkin menjadi kandidat yang baik untuk digunakan sebagai suplemen atau bahan makanan fungsional untuk menurunkan kadar TAG pasca makan dalam darah selama musim dingin.
3.2 Modulasi Fotoperiodik Sitokin Inflamasi yang Beredar oleh Ekstrak Buah
Peradangan usus merupakan hasil yang relevan untuk obesitas dan gangguan metabolik, terutama karena fungsi penghalang yang rusak yang mendorong masuknya endotoksin, yang menyebabkan keadaan peradangan kronis dan sistemik [ 60 ]. Memang, permeabilitas usus sangat dipengaruhi oleh komposisi mikrobiota, yang pada gilirannya dipengaruhi oleh diet [ 61 ]. Misalnya, asupan makanan berlemak tinggi sangat berkorelasi dengan perluasan jaringan adiposa dan peningkatan beberapa sitokin inflamasi, seperti IL-6, IL-1, TNF-α, dan protein fase akut, seperti CRP [ 62 ].
Dalam studi ini, tantangan inflamasi yang diinduksi LPS dilakukan untuk mensimulasikan inflamasi sistemik. Tujuan dari studi ini adalah untuk mempelajari potensi efek anti-inflamasi dari ekstrak buah musiman dengan cara yang bergantung pada fotoperiode. Studi sebelumnya telah menyebutkan bahwa inflamasi dapat terjadi selama musim dingin pada manusia. Dopico et al. [ 63 ] menemukan pola ekspresi gen musiman dalam sel imun dan jaringan adiposa di berbagai populasi, mencatat profil ekspresi terbalik antara kelompok Eropa dan Oseania. Khususnya, orang Eropa menunjukkan peningkatan tingkat ekspresi gen IL-6 dan CRP selama musim dingin [ 63 ]. Selain itu, ada status proinflamasi selama fotoperiode pendek di pars tuberalis domba betina pada spesies yang responsif terhadap fotoperiode, juga terkait dengan ekspresi gen proinflamasi yang secara signifikan lebih tinggi seperti IL6 , TNF , IL6ST , TNFRSF1A , dan TNFRSF1B [ 64 ].
TNF-α, sitokin proinflamasi yang menstimulasi respons makrofag dalam kehadiran LPS [ 65 ], adalah salah satu biomarker kunci yang dievaluasi. Interaksi signifikan antara fotoperiode dan efek konsumsi ekstrak diamati (ANOVA dua arah, P, E, P × E, p ≤ 0,05). Kadar serum TNF-α lebih dari dua kali lebih tinggi pada tikus di bawah jadwal terang/gelap musim dingin (kelompok L6-C) daripada yang di bawah L18 (kelompok L18-C), masing-masing 2.197,3 dan 853,4 pg/mL (Gambar 3A,B ). Fakta ini menunjukkan bahwa keadaan inflamasi lebih disukai di bawah jadwal terang/gelap musim dingin. Variasi musiman dalam kadar TNF-α yang bersirkulasi juga ditemukan pada tupai palem utara; namun, kadarnya lebih tinggi di musim panas daripada di musim dingin [ 66 ]. Mengenai efek ekstrak pada penanda inflamasi ini, kadar serum TNF-α berkisar antara 427,5 dan 2197,3 pg/mL pada hewan yang terpajan L6 yang diberi suplemen, dan antara 714,0 dan 1453,2 pg/mL pada tikus yang terpajan L18 yang diberi suplemen (Gambar 3A,B , berturut-turut). Ekstrak buah musim dingin (kesemek kaki, anggur, jeruk, dan delima) dan satu ekstrak buah musim panas (stroberi) secara signifikan menurunkan kadar TNF-α ketika diberikan kepada tikus yang terpajan L6 dibandingkan dengan kelompok L6-C (Gambar 3A ). Namun, sebagian besar ekstrak tidak memengaruhi kadar TNF-α pada hewan yang terpajan L18, kecuali ekstrak kesemek kaki, aprikot, dan stroberi, yang meningkatkan kadar TNF-α sehubungan dengan kelompok L18-C, yang cenderung melawan efek fotoperiode (Gambar 3A,B ). Khususnya, efek diferensial yang bergantung pada fotoperiode diamati setelah konsumsi ekstrak stroberi ( p ≤ 0,05, uji -t Student ), karena kadar TNF-α berkurang pada fotoperiode L6, sedangkan efek sebaliknya terjadi pada fotoperiode L18 (Gambar 3A,B ). Penelitian sebelumnya yang dilakukan dalam model praklinis telah mengamati bahwa suplementasi dengan kombinasi buah dan sayuran mengurangi konsentrasi TNF-α serum dalam jadwal terang/gelap 12:12 [ 67 ]. Asupan buah, seperti stroberi, dikaitkan dengan peningkatan penanda antioksidan dan fungsi endotel; dengan mengurangi penanda inflamasi pada manusia [ 68 ]. Di antara delapan ekstrak buah, ekstrak stroberi, anggur, dan delima menunjukkan aktivitas antioksidan in vitro terkuat (delima > anggur > stroberi) [ 19 ], yang berpotensi berkontribusi pada efek anti-inflamasinya selama L6. Selain itu, beberapa penelitian yang dilakukan pada buah-buahan telah mengamati adanya efek yang bergantung pada fotoperiode pada beberapa biomarker metabolik yang terlibat dalam metabolisme glukosa dan lipid [ 38 , 69 , 70]. Namun, ini adalah pertama kalinya efek antiperadangan dari ekstrak yang mengandung senyawa fenolik terbukti bergantung pada fotoperiode saat senyawa tersebut dikonsumsi.
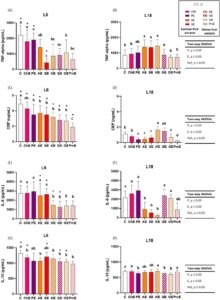
Sebagai respons nonspesifik terhadap obesitas, hati memproduksi CRP, yang levelnya dimodulasi oleh pola diet yang berbeda [ 71 ]. Asupan kolesterol yang tinggi dikaitkan dengan peningkatan level CRP [ 72 ], sedangkan diet Mediterania, yang kaya akan senyawa bioaktif, dikaitkan dengan penurunan level CRP [ 73 ]. Lebih jauh lagi, korelasi terbalik antara konsumsi beberapa buah dan level CRP darah telah diamati pada pasien yang menderita MetS [ 74 ]. Dalam penelitian ini, efek fotoperiode dan konsumsi ekstrak serta interaksi antara kedua faktor diamati (ANOVA dua arah, P, E, P × E, p ≤ 0,05). Secara khusus, level CRP serum lebih tinggi pada kelompok L6-C dibandingkan pada kelompok L18-C (Student’s t -test, p ≤ 0,05) (Gambar 3C,D ). Level CRP yang tinggi pada manusia telah dikaitkan dengan musim dingin, yang menunjukkan bahwa jam cahaya dapat memainkan peran dalam kondisi inflamasi [ 75 ]. Selain itu, semua ekstrak buah, kecuali ceri, menurunkan kadar CRP serum ketika dikonsumsi selama fotoperiode L6, dengan ekstrak buah delima menjadi yang paling efektif dalam menurunkan penanda inflamasi ini (0,24 ng/mL) (Gambar 3C ). Namun, konsumsi jus buah delima tidak menunjukkan perbaikan kadar CRP darah pada relawan [ 76 ]. Perbedaan antara penelitian mungkin disebabkan oleh perbedaan model eksperimen, waktu konsumsi, atau profil fenolik yang berbeda dari seluruh buah dan ekstrak, dengan mempertimbangkan bahwa ekstrak buah delima diperkaya dengan senyawa fenolik [ 19 ]. Korelasi terbalik antara konsumsi makanan dengan aktivitas antioksidan in vitro dan kadar CRP serum diamati pada wanita muda Jepang [ 77 ]. Penelitian kami sebelumnya menunjukkan bahwa ekstrak ini memiliki kapasitas antioksidan in vitro tertinggi di antara ekstrak buah yang diuji [ 19 ]. Penelitian lain juga telah menunjukkan aktivitas anti-inflamasi dari berbagai ekstrak kaya (poli)fenol dalam beberapa model sel dan hewan [ 78 ]. Selain itu, korelasi negatif juga ditemukan antara aktivitas antioksidan dan produksi oksida nitrat pada sel RAW 264.7 yang diinduksi LPS yang diobati dengan ekstrak biji raspberry hitam, yang mengandung ellagitanin [ 79 ]. Turunan ellagitanin merupakan senyawa fenolik utama dalam ekstrak buah delima. Oleh karena itu, kapasitas antioksidan ekstrak ini mungkin terlibat dalam efek anti-inflamasinya.
Mengenai fotoperiode L18, semua ekstrak menghasilkan perubahan dalam kadar CRP serum dibandingkan dengan kelompok kontrol, kecuali ekstrak ceri dan anggur. Dalam hal ini, ekstrak plum, aprikot, stroberi, delima, dan jeruk menurunkan kadar CRP dibandingkan dengan kelompok L18-C, sedangkan ekstrak kesemek kaki meningkatkannya (Gambar 3D ). Dengan demikian, ekstrak delima secara signifikan menurunkan kadar CRP di kedua fotoperiode. Di antara buah-buahan yang digunakan dalam penelitian ini, stroberi adalah salah satu buah dengan kandungan (poli)fenol dan kapasitas antioksidan tertinggi [ 80 ]. Konsumsi mereka telah dikaitkan dengan beberapa efek menguntungkan, seperti efek antimikroba, antioksidan, dan antihipertensi [ 81 ], dan berkorelasi terbalik dengan kadar CRP pada manusia [ 82 ], yang sesuai dengan hasil penelitian ini. Secara keseluruhan, sebagian besar ekstrak buah menurunkan kadar CRP, meskipun efek ini bergantung pada ekstrak buah dan fotoperiode konsumsi. Perbedaan antar ekstrak dapat disebabkan oleh perbedaan profil fenolik yang ditunjukkan oleh delapan ekstrak [ 19 ], karena profil fenolik dari buah, sayuran, atau ekstrak telah terbukti menjadi kunci kemampuannya untuk memberikan sifat biologis [ 83 ].
Selain itu, kadar IL-6 ditentukan dalam penelitian ini. Sitokin inflamasi yang bersirkulasi ini, yang berhubungan dengan obesitas dan insiden penyakit kardiovaskular [ 84 ], dapat dikurangi dengan konsumsi makanan yang kaya akan senyawa fenolik [ 85 ]. Dalam penelitian ini, kadar IL-6 dipengaruhi oleh fotoperiode dan konsumsi ekstrak, dan interaksi antara kedua faktor tersebut juga terdeteksi (ANOVA dua arah, P, E, P × E, p ≤ 0,05) (Gambar 3E,F ). Variasi musiman pada kadar IL-6 darah manusia diamati, lebih tinggi di musim dingin dan musim panas dibandingkan di musim lain [ 86 ]. Sebaliknya, pola sebaliknya ditemukan pada tupai palem utara, di mana kadar IL-6 yang bersirkulasi lebih tinggi di musim panas dibandingkan di musim dingin [ 66 ]. Semua ekstrak buah musim dingin (ekstrak kesemek kaki, jeruk, anggur, dan delima) menurunkan kadar IL-6 serum pada tikus yang terpajan L6 dibandingkan dengan kelompok L6-C, yang menunjukkan hubungan antara konsumsi ekstrak buah musim dingin dan sifat anti-inflamasinya hanya di bawah jadwal terang/gelap musim dingin. Selain itu, ekstrak aprikot, stroberi, dan kesemek kaki menurunkan kadar IL-6 di bawah L18 (Gambar 3F ). Sesuai dengan hasil kami, penelitian lain telah melaporkan efek konsumsi beberapa buah atau (poli)fenol yang berasal dari buah pada interleukin dalam beberapa model percobaan [ 87 , 88 ]. Misalnya, dalam model MetS pada ikan zebra, kesemek kaki menurunkan ekspresi gen Il6 [ 89 ]. Selain itu, sebuah studi klinis menunjukkan bahwa setelah konsumsi makanan berlemak tinggi, kadar sitokin proinflamasi meningkat dalam darah, dan suplementasi buah jeruk sebagian menangkal inflamasi dengan menurunkan sekresi sitokin proinflamasi, seperti IL-17, tetapi tidak IL-6 [ 90 ]. Efek kontroversial pada IL-6 setelah konsumsi produk turunan buah delima telah dilaporkan. Dalam hal ini, kadar IL-6 berkurang setelah mengobati sel Caco-2 yang meradang dengan ekstrak yang diperoleh dari kulit buah delima (mengandung punicalagin, senyawa turunan ellagitanin) atau punicalagin murni [ 87 ]. Senyawa fenolik yang paling relevan dalam ekstrak buah delima adalah turunan asam ellagitanin, terutama pedunculagin dan punicalagin [ 19 ]. Pada manusia, penurunan IL-6 darah diamati pada pasien hemodialisis (55–81 tahun) dan pasien diabetes tipe-2 setelah asupan jus buah delima (masing-masing 100 mL/hari/12 bulan dan 50 g/hari/4 minggu); Namun, tidak ada efek pada sitokin ini yang diamati pada pasien hipertensi setelah mengonsumsi jus buah delima (100 mL/hari/1 hari) atau pada pasien hemodialisis (47–75 tahun) setelah mengonsumsi jus buah delima (100 mL/hari/4 minggu) atau ekstrak buah delima (POMx, 1050 mg/hari/4 minggu) [ 91 ].
Selain itu, penelitian kami mengungkap efek yang bergantung pada fotoperiode pada kadar IL-6 di sebagian besar ekstrak buah. Dalam hal ini, efek antiinflamasi dari ekstrak aprikot, stroberi, dan anggur bergantung pada fotoperiode konsumsi; namun, efek antiinflamasi dari ekstrak kesemek kaki tidak bergantung pada fotoperiode konsumsi (Gambar 3E,F ). Hasil ini menyoroti hubungan antara ritme musiman dan ekstrak buah yang diperkaya dengan (poli)fenol.
Akhirnya, kadar IL-10, sebuah sitokin anti-inflamasi [ 92 ], juga dievaluasi dalam penelitian ini. Kadar IL-10 hampir dua kali lebih tinggi di sebagian besar kelompok L6 yang diteliti dibandingkan di kelompok L18 (kecuali untuk ekstrak plum dan aprikot; p ≤ 0,05, uji- t Student ). Selain itu, tidak satu pun ekstrak buah meningkatkan kadar IL-10 dalam fotoperiode apa pun. Meskipun demikian, semua ekstrak buah musim dingin, bersama dengan ekstrak ceri dan aprikot, mengurangi kadar IL-10 serum dalam fotoperiode L6, sedangkan ekstrak jeruk, plum, dan anggur menguranginya dalam fotoperiode L18 (Gambar 3G,H ). Hasil ini dapat dikaitkan dengan jumlah jam setelah injeksi LPS; memang, setelah 4 jam peradangan yang diinduksi, respons sitokin anti-inflamasi tidak mencapai konsentrasi puncaknya [ 93 ].
Informasi mengenai mekanisme yang terlibat dalam efek polifenol yang bergantung pada fotoperiode terhadap inflamasi masih terbatas. Beberapa penelitian telah mengamati bahwa ekstrak yang kaya fenolik dapat memberikan efek antiinflamasi dengan memodulasi jalur NF-κB dan Nrf2 [ 94 ]. NF-κB, suatu faktor transkripsi nuklir, merupakan pengatur utama proses inflamasi [ 95 ], sementara Nrf2 mengendalikan ekspresi berbagai gen yang terlibat dalam pertahanan antioksidan, detoksifikasi, dan proses antiinflamasi [ 96 ]. Selain itu, senyawa fenolik telah terbukti mengatur berbagai protein kinase, termasuk kinase yang diatur oleh sinyal ekstraseluler (ERK1/2), kinase terminal-N c-Jun (JNK), dan kinase protein teraktivasi AMP (AMPK), yang memengaruhi aktivitas faktor transkripsi seperti Nrf2 dan NF-κB [ 97 ]. Melatonin, yang memainkan peran penting dalam pengaturan ritme musiman, juga menunjukkan efek antiinflamasi dengan memodulasi beberapa jalur pensinyalan ini, termasuk JNK, NF-κB, dan Nrf2 [ 98 , 99 ]. Selain itu, serupa dengan efek pada kadar TAG, mekanisme lain yang harus dipertimbangkan adalah interaksi antara mikrobiota usus, senyawa fenolik, dan fotoperiode. Selain itu, mikrobiota usus juga dapat menghasilkan metabolit dengan sifat antiinflamasi [ 100 ]. Namun, penelitian lebih lanjut diperlukan untuk memahami mekanisme yang terlibat dalam efek ekstrak buah yang kaya fenolik.
4 Kesimpulan
Ekstrak buah dapat menjadi kandidat yang menarik untuk mencegah atau mengobati gangguan metabolisme dengan memulihkan homeostasis yang terganggu. Penurunan kadar TAG darah pasca makan setelah hipertrigliseridemia yang diinduksi lipid dan modulasi sitokin inflamasi dalam situasi peradangan yang diinduksi tidak hanya bergantung pada ekstrak buah tetapi juga pada periode foto konsumsi. Secara khusus, ekstrak ceri dan plum menonjol untuk pengendalian hipertrigliseridemia saat dikonsumsi selama L6, dan ekstrak buah musim dingin dan ekstrak stroberi untuk pencegahan peradangan. Selain itu, penelitian ini menyoroti pentingnya mempertimbangkan efek musiman konsumsi pada efektivitas ekstrak fenolik, tidak hanya saat menyelidiki efek biologisnya, tetapi juga dalam intervensi nutrisi, suatu aspek yang belum diperhitungkan dalam intervensi nutrisi saat ini. Selain itu, hasil ini membuka pintu untuk desain bahan fungsional baru yang disesuaikan dengan setiap musim, dengan fokus khusus pada penyakit metabolik. Dengan merancang suplemen makanan yang selaras dengan musim yang berbeda, mungkin saja untuk menyediakan kebutuhan nutrisi khusus tergantung pada waktu dalam setahun dan pendekatan nutrisi baru untuk mengatasi gangguan terkait metabolisme. Penelitian lebih lanjut diperlukan untuk memvalidasi potensi yang menjanjikan dari ekstrak kaya fenolik ini, termasuk tidak hanya uji klinis yang menilai fraksi bioaktif dalam berbagai periode cahaya tetapi juga analisis penerimaan sensorik dan konsumen. Meskipun demikian, penelitian signifikan masih harus dilakukan untuk memahami mekanisme di balik perubahan yang disebabkan oleh periode cahaya, serta penelitian pada manusia untuk memvalidasi efek yang diamati pada model hewan.

