ABSTRAK
Tujuan dari penelitian ini adalah untuk membandingkan aktivitas antiinflamasi in vitro dari tiga varietas kentang komersial yang dibudidayakan di dataran tinggi, Kennebec, Desirée, dan Bleuet, yang ekstraknya, berdasarkan analisis kimia, dianggap kaya akan asam klorogenat (CGA), karotenoid, dan antosianin, masing-masing. Untuk tujuan ini, makrofag turunan THP-1 diberi perlakuan awal dengan ekstrak dan kemudian ditantang dengan LPS. Sementara pada dosis suprafisiologis (50 µM), ketiga ekstrak tersebut secara signifikan menangkal TNF-α, IL-1β, dan IL-6 yang diinduksi LPS, pada dosis yang lebih relevan secara fisiologis (1–5 µM), hanya Desirée dan Bleuet yang menunjukkan aktivitas antiinflamasi. Kami berhipotesis bahwa kandungan CGA yang tinggi dalam ekstrak Bleuet dapat mengganggu antosianin. Mendukung hal ini, penambahan CGA ke pelargonidin 3-glukosa murni dan peonidin 3-glukosa mengurangi aktivitas antiinflamasinya. Demikian pula, fraksi antosianin yang diisolasi dari Bleuet (fraksi ACN) menunjukkan efek antiinflamasi yang lebih kuat daripada seluruh ekstrak Bleuet, dan penambahan CGA ke fraksi ACN secara signifikan mengurangi efek antiinflamasinya. Simulasi docking molekuler menunjukkan bahwa transporter glukosa GLUT-1, GLUT-3, dan SGLT-1 dapat terlibat dalam interaksi seperti antagonis ini. Sebagai kesimpulan, ekstrak dari varietas berpigmen Desirée dan Bleuet menangkal inflamasi yang diinduksi LPS pada makrofag THP-1 pada dosis yang relevan dengan plasma. Lebih jauh, CGA dapat bersaing dengan antosianin untuk transporter glukosa, membatasi penyerapan selulernya dan, akibatnya, aktivitas antiinflamasinya.
Singkatan
Sebuah Mal
A-maltosa
ACN
antosianin
β-NG
nonil-β-D-glukopiranosida
Bahasa Inggris CGA
asam klorogenat
GAPDH
gliseraldehida-3-fosfat dehidrogenase
KEKENYANGAN
pengangkut glukosa
PTM
penyakit tidak menular
Hal.3G
pelargonidin 3-glukosa
Pn3G
peonidin 3-glukosa
Bahasa Inggris SGLT
kotransporter natrium/glukosa
TNF
faktor nekrosis tumor
1 Pendahuluan
Sementara peradangan memiliki peran yang bermanfaat dan protektif dalam kondisi fisiologis, dengan menghilangkan patogen atau rangsangan endogen yang berbahaya dan menyelesaikan kerusakan, peradangan kronis adalah kondisi peradangan sistemik yang berkepanjangan, yang dikenal sebagai faktor risiko utama dalam timbulnya dan/atau perkembangan berbagai penyakit tidak menular (PTM) [ 1 ]. Ini termasuk gangguan kardiovaskular, neurodegeneratif, dan pernapasan serta diabetes dan kanker, yang secara kolektif mewakili penyebab utama mortalitas dan morbiditas secara global [ 2 , 3 ]. Di antara faktor lingkungan dan gaya hidup yang mendorong peradangan kronis, pola makan yang tidak sehat adalah salah satu kontributor utama serta yang paling dapat dicegah [ 4 , 5 ]. Akibatnya, strategi diet untuk mencegah perkembangan peradangan menjadi keadaan kronis menarik minat yang besar, karena konsumsi makanan seimbang, kaya buah-buahan dan sayuran, telah berkorelasi terbalik dengan kejadian banyak penyakit kronis terkait peradangan [ 5 , 6 ].
Namun demikian, perubahan iklim, yang baru-baru ini ditetapkan sebagai “ancaman kesehatan global terbesar di abad ke- 21 ,” secara signifikan memengaruhi produksi, pasokan, dan keamanan pangan, serta secara langsung atau tidak langsung kesehatan manusia, karena dampaknya pada ketersediaan, biaya, dan komposisi nutrisi tanaman pangan [ 7 – 9 ]. Diperkirakan bahwa pada tahun 2050, mayoritas kematian global yang terkait dengan perubahan iklim terutama akan disebabkan oleh perubahan konsumsi buah dan sayur [ 10 ]. Dengan demikian, tantangan utamanya adalah mengidentifikasi tanaman pangan yang tangguh, berkelanjutan, dan hemat biaya yang mampu tumbuh dengan sumber daya yang lebih sedikit dan menyediakan zat gizi makro dan mikro serta senyawa bioaktif yang meningkatkan kesehatan.
Kentang ( Solanum tuberosum L.) adalah tanaman pangan pokok ketiga terpenting setelah sereal [ 11 ] dan merupakan kandidat yang berharga, karena tersedia dalam beberapa lusin varietas yang dibudidayakan di berbagai iklim dan sistem pertanian dan berkat nilai gizinya yang tinggi, menyediakan energi, karbohidrat, vitamin B, C, dan beberapa mineral. Varietas kentang yang paling umum dibudidayakan adalah yang berdaging putih, yang kaya akan asam fenolik, khususnya asam 5-O-caffeoylquinic, yang umumnya dikenal sebagai asam klorogenat (CGA), yang dilaporkan memiliki beberapa efek menguntungkan, termasuk antioksidan, antidiabetik, anti-obesitas, antikanker, anti-inflamasi, dan sifat anti-mikroba [ 12 , 13 ]. Di sisi lain, varietas berpigmen juga diperkaya dengan senyawa bioaktif, seperti karotenoid dan antosianin [ 14 , 15 ]. Karotenoid adalah prekursor vitamin A dan antioksidan kuat, yang konsumsinya berkorelasi terbalik dengan kejadian banyak penyakit kronis, termasuk obesitas, diabetes, dan kanker [ 16 ], sementara antosianin telah menunjukkan efek pencegahan terhadap penyakit kardiovaskular dan neurodegeneratif, obesitas, diabetes, stres inflamasi dan oksidatif, dan kanker [ 17 ].
Penelitian yang bertujuan untuk menentukan aktivitas biologis varietas kentang berpigmen sebagian besar terbatas pada penelitian praklinis dan terutama difokuskan pada varietas ungu/merah [ 18 ]. Yaitu, kentang berdaging ungu mencegah peradangan gastrointestinal, disfungsi mikrobiota, dan kerusakan penghalang usus pada babi yang diberi diet tinggi lemak [ 19 ] dan kolitis yang diinduksi dekstran natrium sulfat (DSS) pada tikus [ 20 , 21 ], sambil mengurangi obesitas, hiperglikemia, dan stres oksidatif pada tikus diabetes atau hiperkolesterolemia [ 22 – 27 ]. Selain itu, kentang ungu dan merah mengurangi kanker perut dan payudara yang diinduksi secara kimia pada tikus [ 28 , 29 ].
Beberapa studi klinis telah menunjukkan bahwa konsumsi kentang berpigmen, baik yang berdaging kuning maupun ungu, mengurangi peradangan dan kerusakan DNA dibandingkan dengan kentang berwarna putih [ 30 ], sedangkan kentang ungu dikaitkan dengan penurunan tekanan darah yang signifikan [ 31 ], glikemia pasca makan dan insulinemia [ 32 – 34 ], dan kekakuan arteri [ 35 ].
Namun, belum ada penelitian yang dilakukan untuk menilai efek sinergis atau antagonis dari berbagai kelas senyawa bioaktif atau kombinasi berbagai polifenol dalam kentang. Lebih jauh lagi, sebagian besar penelitian in vitro tentang aktivitas antiinflamasi, antioksidan, atau antikanker dari ekstrak kentang berpigmen menggunakan konsentrasi suprafisiologis (misalnya, 10–100 µM atau lebih tinggi untuk antosianin) [ 36 , 37 ]. Sebaliknya, konsentrasi yang relevan dengan plasma (misalnya, 0,1–10 µM untuk antosianin) harus digunakan untuk menentukan mekanisme aksi dan efek peningkatan kesehatan dalam kondisi eksperimen yang lebih terkait secara fisiologis [ 38 , 39 ].
Penelitian ini bertujuan untuk mengevaluasi dan membandingkan aktivitas antiinflamasi ekstrak yang diperoleh dari umbi tiga varietas kentang komersial bernama Kennebec (kulit kuning dan daging putih), Desirée (kulit merah dan daging kuning), dan Bleuet (kulit dan daging ungu) dari budidaya dataran tinggi pada makrofag manusia turunan THP-1 yang dihina dengan LPS. Karakterisasi ekstrak memungkinkan kami untuk mempertimbangkan varietas Kennebec, Desirée, dan Bleuet sebagai varietas yang diperkaya secara berbeda dalam CGA, karotenoid, dan antosianin. Aktivitas yang bergantung pada dosis dari konsentrasi plasma yang relevan dari ketiga ekstrak, fraksi antosianin dari Bleuet, atau kombinasi senyawa murni terhadap gen dan protein sitokin proinflamasi yang diinduksi LPS (TNF-α, IL-1β, IL-6).
2 Bagian Eksperimen
2.1 Bahan
CGA, pelargonidin 3-glukosa (Pg3G), dan peonidin 3-glukosa (Pn3G) yang digunakan untuk perawatan sel dibeli di Extrasynthese (Genay, Prancis). Monosit THP-1 turunan leukemia manusia (ATCC-TIB-202) dibeli dari LGC Standards SrL (Milan, Italia).
2.2 Umbi Kentang
Tiga varietas kentang komersial dipilih: cv. Kennebec berkulit kuning dan berdaging putih (Gambar 1A ), cv. Desirée berkulit merah dan berdaging kuning (Gambar 1B ), dan Bleuet berkulit dan berdaging ungu tua (Gambar 1C ). Semua varietas kentang dibudidayakan di bawah praktik agronomi lokal di lahan percobaan yang terletak di Starleggia (Campodolcino, Provinsi Sondrio, Lembah Spluga, Wilayah Lombardy, Italia) pada ketinggian 1560 mdpl. Umbi dipanen selama minggu pertama Oktober 2019 pada tahap pertumbuhan senesens BBCH 97 907 [ 40 ], yaitu daun dan batang mati, batang memutih dan kering. Untuk setiap genotipe, setidaknya sejumlah 100 umbi US No. 1 (diameter 5 cm atau berat minimal 112 g) dipilih dari plot acak (5 umbi per 5 tanaman tunggal per 4 ulangan per varietas tunggal) dan dikeringkan secara beku untuk prosedur ekstraksi berikutnya.

2.3 Ekstraksi dan Fraksinasi
Ekstrak yang digunakan untuk percobaan sel in vitro diperoleh dari umbi kentang utuh yang dibekukan (kulit dan daging) dari varietas Kennebec, Desirée, dan Bleuet (Gambar 1A–C ), seperti yang dijelaskan dalam Metode Tambahan. Fraksi antosianin (fraksi ACN) diisolasi dari ekstrak Bleuet melalui ekstraksi cair-cair menggunakan corong pemisah, seperti yang dijelaskan dalam Metode Tambahan.
2.4 Analisis Spektrofotometri dan HPLC-DAD Ekstrak dan Fraksi ACN
Ekstrak kentang dan fraksi ACN dianalisis dan dikarakterisasi menggunakan spektrofotometri dan HPLC-DAD untuk menentukan kandungan CGA, karotenoid, dan antosianin, seperti yang dijelaskan dalam Metode Tambahan.
2.5 Kultur Sel, Uji Sitotoksisitas, dan Perawatan
Monosit THP-1 turunan leukemia manusia dikultur dalam medium kultur RPMI 1640 (EuroClone, Pero, MI, Italia) yang dilengkapi dengan 10% serum sapi fetal (FBS, Sigma-Aldrich, St. Louis, MO, AS), 2 mM L-glutamin (Sigma-Aldrich), 100 unit/mL penisilin, dan 100 µg/mL streptomisin (Gibco/BRL, Carlsbad, CA, AS) pada suhu 37°C dalam atmosfer humidifikasi yang mengandung 5% CO 2 . Untuk membedakan monosit THP-1 menjadi makrofag yang melekat, 2 × 10 6 sel/sumur disemai dalam pelat 12-sumur dengan 25 ng/mL Phorbol 12-Myristate 13-Acetate (PMA, Sigma-Aldrich) selama 24 jam. Non-sitotoksisitas diverifikasi dengan mengobati makrofag THP-1 selama 48 jam dengan berbagai konsentrasi ekstrak Kennebec, Desirée, dan Bleuet (0, 5, 25, 50, 75 µM). Konsentrasi ditentukan berdasarkan kandungan ekuivalen Pg3G dari ekstrak Bleuet atau fraksi ACN, dan ekstrak lainnya diencerkan dalam media kultur menggunakan volume yang sama. Viabilitas sel ditentukan menggunakan uji 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida (MTT, Sigma-Aldrich) seperti yang dijelaskan sebelumnya [ 41 ] dan uji aktivitas laktat dehidrogenase (LDH) (Sigma-Aldrich) mengikuti petunjuk pabrik pembuatnya.
Untuk meniru pengobatan pencegahan, makrofag THP-1 kemudian diobati terlebih dahulu dengan atau tanpa ekstrak kentang (1–50 µM), fraksi ACN (1–5 µM), atau senyawa murni (1–10 µM) selama 16 jam sebelum stimulus inflamasi. Untuk menginduksi respons pro-inflamasi, sel diobati bersamaan dengan atau tanpa 1 µg/mL LPS (Sigma-Aldrich) selama 6 jam untuk analisis RT-PCR waktu nyata atau 24 jam untuk uji ELISA, dengan atau tanpa ekstrak kentang, fraksi ACN, atau senyawa murni. Titik waktu dipilih berdasarkan eksperimen pengaturan sebelumnya, karena 6 jam pengobatan LPS menunjukkan kadar transkrip tertinggi dari gen sitokin pro-inflamasi, sedangkan kami mengamati kadar sekresi sitokin tertinggi setelah 24 jam pengobatan LPS (data tidak ditampilkan).
2.6 Ekstraksi RNA dan Analisis RT-PCR Real Time
Total RNA diisolasi dari sel, ditranskripsi balik menjadi cDNA, dan digunakan untuk menentukan tingkat transkrip menggunakan primer spesifik gen (Tabel S1 ) seperti yang dijelaskan dalam Metode Tambahan .
2.7 Uji Imunosorben Terkait Enzim (ELISA)
Konsentrasi sitokin dalam supernatan sel dideteksi menggunakan Human TNF-α, Human IL-1β, dan Human IL-6 DuoSet ELISA Kit (R&D Systems, Minneapolis, MN, AS), seperti yang dijelaskan dalam Metode Tambahan.
2.8 Docking Molekuler
Pipa docking dilakukan menggunakan Schrödinger Maestro rilis 2023-3 build 125 (Maestro, Schrödinger, LLC, New York, NY, 2023). Struktur kristalografi transporter glukosa tipe 1 manusia (GLUT-1), tipe 3 (GLUT-3), dan kotransporter natrium/glukosa 1 (SGLT-1) diambil dari Protein Data Bank [ 42 ]. Secara khusus, konformasi terbuka ke dalam GLUT-1 yang terikat pada nonil-β-D-glukopiranosida (β-NG; PDB ID: 4PYP), konformasi terbuka ke luar GLUT-3 yang terikat pada A-maltosa (A-Mal; PDB ID: 4ZWC), dan konformasi apo terbuka ke dalam parsial SGLT-1 (PDB ID: 7SLA) dipilih (Gambar S4 ). Ligand dan molekul air yang terletak lebih dari 5 Å dari ligand dihilangkan. Penyempurnaan struktural dilakukan seperti yang dijelaskan dalam Metode Tambahan. Ligand dugaan Pg3G, Pn3G, dan CGA direkonstruksi dari untaian SMILES yang dikaitkan dengan CID PubChem (masing-masing 443648, 443654, dan 1794427). Geometri ligand dioptimalkan menggunakan alat LigPrep [ 43 ], dan keadaan protonasi pada pH 7 dihasilkan menggunakan Epik [ 44 ].
Kisi-kisi dok dirancang untuk setiap transporter agar mencakup seluruh saluran translokasi substrat, seperti dijelaskan dalam Metode Tambahan.
Tiga pose docking terbaik untuk setiap ligan dianalisis untuk interaksinya dengan protein target. Proses docking dan diagram interaksi protein-ligan bidimensi dilakukan seperti yang dijelaskan dalam metode Tambahan.
Protein target dan pose docking terbaik tersedia di Zenodo [ 45 ] ( https://doi.org/10.5281/zenodo.14681251 ).
2.9 Analisis Statistik
Data dianalisis melalui ANOVA satu arah diikuti oleh uji post hoc Tukey untuk beberapa perbandingan menggunakan perangkat lunak GraphPad Prism 8. Perbedaan dengan p < 0,05 dianggap signifikan.
3 Hasil
3.1 Komposisi Fitonutrien Ekstrak Kentang Dataran Tinggi
Komposisi ekstrak dari tiga varietas kentang terpilih, Kennebec, Desirée, dan Bleuet (Gambar 1A–C ), total CGA, karotenoid, dan antosianin dianalisis dengan spektrofotometri dan HPLC-DAD. Gambar 1D menunjukkan bahwa antosianin hanya hadir dalam ekstrak Bleuet (3867 ± 320 ppm), karotenoid hadir pada tingkat yang sebanding dalam Bleuet dan Desirée (masing-masing 1,9 ± 0,6 dan 2,1 ± 0,7 ppm), dan pada tingkat 3 kali lipat lebih rendah dalam Kennebec (0,6 ± 0,4 ppm), sedangkan CGA hadir pada tingkat yang sebanding dalam Desirée dan Kennebec (masing-masing 1067 ± 25 dan 1667 ± 73 ppm), tetapi pada tingkat yang jauh lebih tinggi dalam Bleuet (5200 ± 842 ppm). Berdasarkan data ini, ekstrak Kennebec, Desirée, dan Bleuet dianggap kaya CGA, kaya karotenoid, dan kaya antosianin berdasarkan fitonutrien khasnya masing-masing (Gambar 1D ).
3.2 Ekstrak Desirée dan Bleuet Lebih Efektif pada Dosis yang Relevan dengan Plasma Dibandingkan dengan Kennebec
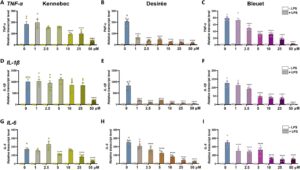
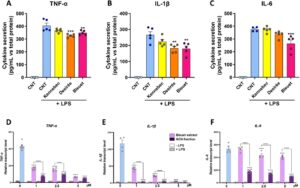
Untuk membandingkan efikasi anti-inflamasi dari ekstrak kentang yang berbeda, tingkat transkrip gen pro-inflamasi ( TNF-α , IL-1β , IL-6 ) dianalisis dengan qRT-PCR (Gambar 2 ). Makrofag THP-1 diobati dengan peningkatan konsentrasi ekstrak hingga 50 µM, yang terbukti non-sitotoksik hingga 48 jam (Gambar S3 ). Pengobatan dengan ekstrak kaya CGA dari Kennebec mengurangi tingkat transkrip yang diinduksi LPS dari gen sitokin pro-inflamasi hanya pada konsentrasi suprafisiologis (10-50 µM untuk TNF-α dan IL-6 ; hanya 50 µM untuk IL-1β ) (Gambar 2A,D,G ). Sebaliknya, pengobatan dengan ekstrak Desirée yang kaya karotenoid dan ekstrak Bleuet yang kaya antosianin secara signifikan mengurangi ekspresi mereka dalam cara yang bergantung dosis mulai dari 1–2,5 µM, dengan pengurangan TNF-α dan IL-1β yang lebih kuat diamati untuk Desirée (Gambar 2B,E ) dibandingkan dengan Bleuet (Gambar 2C,F ), sedangkan mereka menentukan pengurangan yang sebanding dalam tingkat transkrip IL-6 (Gambar 2H–I ) sehubungan dengan pengobatan LPS saja (0 μΜ + LPS). Data ini didukung oleh analisis ELISA dari sitokin pro-inflamasi yang disekresikan dalam medium sel setelah pengobatan dengan ekstrak kentang 5 μΜ (Gambar 3A–C ). Ekstrak Kennebec tidak menunjukkan efek antiinflamasi yang signifikan, karena tidak mengurangi sekresi TNF-α, IL-1β, maupun IL-6 jika dibandingkan dengan pengobatan LPS saja (CNT + LPS), sementara ekstrak Desirée dan Bleuet menangkal sekresi TNF-α dan IL-1β (Gambar 3A–B ) yang diinduksi LPS dengan cara yang sebanding (masing-masing -15%–18% dan -31%–33%), tetapi hanya ekstrak kaya antosianin dari Bleuet yang secara signifikan mengurangi sekresi IL-6 yang diinduksi LPS (-27%, Gambar 3C ).
3.3 Efek Ekstrak Bleuet Dibandingkan dengan Fraksi ACN Terisolasi pada Tingkat Transkrip Sitokin Pro-Inflamasi
Mengingat bahwa antosianin terkenal karena aktivitas anti-inflamasi langsungnya, sedangkan karotenoid lebih umum dikaitkan dengan sifat antioksidan [ 16 ], kami berhipotesis bahwa beberapa senyawa lain dalam ekstrak Bleuet dapat mengganggu antosianin dalam melawan peradangan yang disebabkan oleh LPS. Untuk mengeksplorasi hipotesis ini, efek fraksi antosianin terisolasi dari ekstrak Bleuet (fraksi ACN) versus ekstrak Bleuet pada tingkat transkrip sitokin pro-inflamasi dianalisis hingga pengobatan 5 µM (Gambar 3D–F ). Meskipun pengobatan dengan ekstrak Bleuet mampu mengurangi transkrip TNF-α , IL-1β , dan IL-6 , pengobatan dengan fraksi ACN terisolasi selalu lebih efektif dalam menurunkannya. Perbedaan ini khususnya terbukti untuk IL-6 , yang sangat berkurang oleh fraksi ACN sehubungan dengan ekstrak Bleuet pada semua konsentrasi yang diuji ( p < 0,0001, Gambar 3F ). Untuk TNF-α dan IL-1β (Gambar 3D–E ), efek antiinflamasi dari fraksi ACN yang diisolasi secara signifikan lebih kuat daripada ekstrak Bleuet hingga pengobatan 2,5 µM, sedangkan pada 5 µM pengurangannya lebih kuat, tetapi tidak berbeda secara signifikan dibandingkan dengan ekstrak Bleuet.
3.4 Aktivitas Anti-Inflamasi Fraksi ACN Terisolasi Dari Bleuet Dapat Dihambat oleh CGA
Mengingat bahwa ekstrak kaya CGA dari Kennebec (Gambar 2A,D,G ) dan CGA dengan kemurnian serupa (Gambar 4 ) tidak menunjukkan efek anti-inflamasi pada dosis relevan plasma, dan bahwa ekstrak Bleuet khususnya diperkaya dengan CGA (Gambar 1D ), kami menyelidiki kemungkinan keterlibatan senyawa ini dalam mengganggu aktivitas anti-inflamasi antosianin.

Pertama, efek campuran 5 µM 1:1,5 dari Pn3G dan Pg3G murni, yang mewakili rasio antosianin utama dalam ekstrak Bleuet, pada tingkat transkrip gen sitokin pro-inflamasi diverifikasi (Gambar 5A–C ). Semua gen yang diinduksi LPS yang diuji berkurang secara signifikan oleh campuran ini saja, tetapi ketika 10 µM CGA ditambahkan, efek anti-inflamasi ini berkurang untuk TNF-α dan IL-1β (Gambar 5A–B ) atau hilang sepenuhnya untuk IL-6 (Gambar 5C ). Konsentrasi CGA telah dipilih untuk mempertahankan rasio antara antosianin:CGA yang mirip dengan yang ada dalam ekstrak Bleuet.
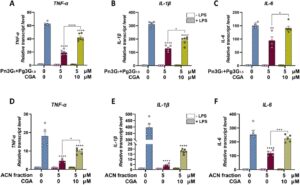
Demikian pula, untuk meniru komposisi ekstrak Bleuet dengan lebih baik, makrofag THP-1 diobati dengan fraksi ACN 5 µM saja atau dalam kombinasi dengan CGA murni 10 µM (Gambar 5D–F ). Hasil penelitian menunjukkan bahwa, juga dalam kasus ini, sementara fraksi ACN secara signifikan menurunkan ekspresi gen pro-inflamasi yang diinduksi LPS ( p < 0,0001), CGA mengurangi aktivitas anti-inflamasinya. Secara khusus, penambahan CGA ke fraksi ACN menghasilkan penurunan regulasi yang kurang parah pada gen TNF-α dan IL-1β dibandingkan dengan fraksi ACN saja, tetapi masih signifikan dibandingkan dengan pengobatan LPS saja ( p < 0,0001, Gambar 5D–E ), dan hilangnya efektivitas sepenuhnya dalam menurunkan IL-6 (Gambar 5F ). Meskipun perbedaan kadar transkrip IL-1β antara fraksi ACN saja dan dalam kombinasi dengan CGA tidak signifikan secara statistik, tren peningkatan diamati (Gambar 5E ).
3.5 Dugaan Keterlibatan Transporter Glukosa melalui Docking Molekuler
Antosianin dilaporkan diserap oleh berbagai jenis sel juga melalui transporter glukosa, berkat bagian gulanya, yang mengikat protein ini dan memfasilitasi pengangkutannya [ 46 , 47 ]. Di sisi lain, CGA diketahui mengatur metabolisme glukosa [ 12 ], dan yang menarik, molekul asam quinic dalam struktur kimianya menyerupai glukosa. Oleh karena itu, kami berhipotesis bahwa CGA mungkin bersaing dengan antosianin untuk transporter glukosa, membatasi penyerapannya. Untuk mengeksplorasi hipotesis ini, kami menggunakan docking molekuler.
Simulasi docking untuk GLUT-1 menunjukkan tumpang tindih dalam residu yang berinteraksi dengan Pg3G, Pn3G, dan CGA (Gambar 6A ). Asam amino utama yang dimiliki bersama di antara ligan tersebut meliputi Asn 288, Asn 317, Trp 388, Asn 411, dan Asn 415, yang diamati berinteraksi dengan ketiga ligan dalam setidaknya satu pose (Gambar S11A ). CGA menunjukkan skor docking sebesar -11,791 (pose 1), -11,726 (pose 2), dan -10,952 (pose 3), yang meskipun kurang negatif, masih sebanding dengan skor docking Pg3G (-13,017, -12,810, -12,750) dan Pn3G (-14,210, -13,768, -13,391) (Gambar S11A, S5, S6 ). Khususnya, CGA, serta antosianin yang diuji, berinteraksi dengan residu Asn 288 dan Asn 317, yang juga diikat oleh ligan β-NG dalam struktur terpecahkan sinar-X (Gambar 6D , S5, S11A ). β-NG diperkenalkan kembali dalam GLUT-1 dengan skor docking -10,795 (Gambar 6D ).

Untuk GLUT-3, simulasi docking mengidentifikasi tumpang tindih residu yang signifikan di antara Pg3G, Pn3G, dan CGA (Gambar 6B ). Residu bersama, yang diamati di ketiga ligan dalam setidaknya satu pose, meliputi Asn 32, Gln 281, Asn 315, dan Asn 413. Skor docking CGA (−10,371, −9,794, −9,476) mendekati skor Pg3G (−9,738, −9,305, −9,089) dan Pn3G (−11,594, −11,082, −9,736) (Gambar S11B,S7,S8 ). Ketiga ligan tersebut melibatkan residu yang tumpang tindih dengan molekul A-Mal dalam struktur kristal, seperti Gln 281 dan Asn 315 (Gambar 6D ). Lebih jauh, semua pose CGA menunjukkan interaksi dengan Gln 159, yang sama dengan A-Mal tetapi tidak dengan antosianin lain yang diuji. A-Mal diperkenalkan kembali dalam GLUT-3 dengan skor docking sebesar -13,108 (Gambar S11B,S7 ).
Dalam SGLT-1, tumpang tindih residu yang signifikan antara Pg3G, Pn3G, dan CGA juga diidentifikasi oleh simulasi docking (Gambar 6C ). CGA menunjukkan afinitas pengikatan terkuat dengan skor docking (−12.719, −10.476, −10.329) dibandingkan dengan Pg3G (−8.979, −8.816, −8.571) dan Pn3G (−9.427, −9.240, −7.423) (Gambar S11C, S9, S10 ). Interaksi dengan Lys 157 terbentuk di semua pose CGA tetapi tidak dengan ligan lainnya (Gambar S11C ). Asp 161 dan Gln 457 umum di semua ligan (Gambar 6D ).
Secara umum, sebagian besar interaksi yang dibentuk oleh ligan dengan residu transporter adalah ikatan hidrogen, terutama melibatkan residu asparagin dan glutamin, yang banyak terdapat di saluran translokasi substrat GLUT-1, GLUT-3, dan SGLT-1. Selain itu, beberapa interaksi penumpukan π-π diamati, yang melibatkan residu triptofan dan fenilalanin dari transporter (Gambar S6, S8, S10 ).
4 Diskusi
Penelitian kami bertujuan untuk membandingkan potensi anti-inflamasi dari tiga varietas kentang komersial dari budidaya dataran tinggi yang diperkaya secara berbeda dalam senyawa yang bermanfaat bagi kesehatan, seperti CGA [ 12 ], karotenoid [ 16 ], dan antosianin [ 17 ], pada makrofag manusia turunan THP-1 yang dihina dengan LPS. Berdasarkan analisis kimia, ekstrak dari umbi utuh dianggap sebagian besar kaya CGA (cv. Kennebec), kaya karotenoid (cv. Desirée), dan kaya antosianin (cv. Bleuet).
Dalam studi ini, semua ekstrak kentang secara signifikan mengurangi tingkat transkrip gen sitokin pro-inflamasi yang diinduksi LPS pada dosis suprafisiologis di atas 25–50 µM, tetapi pada dosis yang lebih dekat dengan yang dapat dicapai secara in vivo setelah konsumsi kentang berpigmen [ 48 ], hanya ekstrak dari Desirée dan Bleuet (1–5 µM) yang memberikan efek anti-inflamasi. Hasil ini dikonfirmasi oleh analisis sekresi sitokin setelah pengobatan dengan ekstrak kentang 5 μΜ. Meskipun hasil kami pada ekstrak kaya CGA dari Kennebec tampaknya bertentangan dengan studi yang melaporkan CGA sebagai agen anti-inflamasi [ 49 – 51 ], penting untuk dicatat bahwa sebagian besar dari mereka menggunakan dosis suprafisiologis, melebihi 5 µM. Hasil kami juga menunjukkan bahwa 50 µM CGA secara signifikan mengurangi peradangan, sesuai dengan sebuah studi yang melaporkan bahwa 50 µM CGA menangkal peradangan yang diinduksi LPS pada makrofag tikus RAW264.7, mengurangi TNF-α, IL-6, dan oksida nitrat [ 49 ]. Demikian pula, CGA mengerahkan sifat anti-inflamasi dan anti-apoptosis dengan menghambat NF-κB pada sel-sel mirip oligodendrosit manusia M13-03 dan keratinosit manusia HaCaT ketika diberikan pada dosis sekitar 100 µM [ 50 , 51 ]. Meskipun demikian, konsentrasi CGA ini sulit dicapai dalam plasma manusia, mengingat bioavailabilitas CGA yang rendah, sekitar 33% [ 12 , 52 ]. Menyelidiki bioaktivitas nutrisi pada konsentrasi yang relevan dengan plasma sangat penting untuk memahami mekanisme kerjanya. Sebuah studi pada sel HUVEC melaporkan bahwa dosis sianidin 3-glukosa yang relevan dalam plasma mengurangi kadar IL-6 yang diinduksi oleh CD40L tetapi tidak oleh LDL teroksidasi, yang, bagaimanapun, diatur oleh metabolitnya, yang menunjukkan bahwa pada dosis ini aktivitas anti-inflamasi diatur oleh jalur yang berbeda [ 39 ]. Sesuai dengan penelitian kami, 5 µM CGA sendiri tidak menunjukkan efek terhadap peradangan yang diinduksi LPS pada makrofag THP-1 [ 53 ]. Selain itu, CGA baru-baru ini dideskripsikan sebagai senyawa anti-kanker ampuh yang mampu meningkatkan polarisasi makrofag menuju fenotipe pro-inflamasi M1 dalam konteks lingkungan tumor [ 54 , 55 ].
Aktivitas antiinflamasi yang lebih kuat dari ekstrak kaya karotenoid dari Desirée dibandingkan dengan Bleuet tidak terduga, terutama karena karotenoid terutama dikenal karena sifat antioksidannya [ 16 ]. Selain itu, karotenoid utama dalam ekstrak Desirée, violaxanthin dan antheraxanthin [ 56 ], kurang dipelajari untuk sifat antiinflamasinya dibandingkan dengan turunan de-epoksinya, lutein dan zeaxanthin. Sejauh pengetahuan kami, hanya satu penelitian yang menyelidiki potensi antiinflamasi violaxanthin, melaporkan bahwa penghambatan signifikan aktivasi jalur NF-κB yang diinduksi LPS pada makrofag tikus RAW264.7 memerlukan konsentrasi di atas 30–60 µM [ 57 ]. Di sisi lain, xantofil lain dalam varietas Desirèe, seperti lutein dan zeaxanthin [ 56 ], telah menunjukkan aktivitas antiinflamasi in vivo pada pasien dengan angina stabil dan ex vivo dalam sel mononuklear darah perifer (PBMC) dari pasien penyakit arteri koroner [ 58 ]. Dengan demikian, efek kuat ekstrak kaya karotenoid dari Desirèe dalam penelitian kami berpotensi dikaitkan dengan karotenoid ini. Namun, konsentrasinya sangat rendah, terutama jika dibandingkan dengan kandungan antosianin dalam ekstrak Bleuet yang digunakan sebagai referensi (antosianin 5 µM setara dengan sekitar karotenoid 1,9 nM).
Efek antiinflamasi yang lebih ringan dari ekstrak kaya antosianin dari Bleuet dapat disebabkan oleh dominasi antosianin berbasis pelargonidin dan peonidin. Faktanya, sebuah penelitian pada makrofag murine RAW264.7 menunjukkan bahwa struktur antosianidin memengaruhi aktivitas antiinflamasinya, dengan hanya delphinidin dan cyanidin yang menghambat produksi siklooksigenase-2 (COX-2) yang diinduksi LPS, sementara pelargonidin, peonidin, dan malvidin tidak menunjukkan efek apa pun [ 59 ]. Selain itu, kami berspekulasi bahwa senyawa selain antosianin dalam ekstrak Bleuet dapat mengganggu aktivitas antiinflamasinya yang telah dilaporkan dengan baik. Membandingkan ekstrak Bleuet dengan fraksi ACN yang diisolasi, kami menemukan bahwa fraksi ACN menunjukkan aktivitas antiinflamasi yang lebih kuat pada dosis yang relevan dengan plasma (1–5 µM). Karena ekstrak Bleuet secara khusus diperkaya dengan CGA, yang tidak menunjukkan aktivitas antiinflamasi pada dosis yang relevan dengan plasma, kemungkinan keterlibatan CGA dalam mengganggu aktivitas antiinflamasi antosianin diselidiki terlebih dahulu dalam kombinasi dengan antosianin murni (Pg3G dan Pn3G) dan kemudian dengan fraksi ACN yang diisolasi dari Bleuet. Sesuai dengan hipotesis kami, dalam kedua kasus, 10 µM CGA menghambat efek antiinflamasi dari 5 µM antosianin. Secara khusus, sementara aktivitasnya pada TNF-α dan IL-1β diturunkan dalam kombinasi dengan CGA, efek antosianin pada IL-6 yang diinduksi LPS hilang sepenuhnya, mempertahankan transkrip IL-6 pada tingkat yang sama dengan pengobatan LPS saja.
Mengenai mekanisme yang digunakan CGA untuk mengganggu aktivitas anti-inflamasi antosianin, diperlukan investigasi lebih lanjut untuk memperdalam wawasan tentang interaksi fitonutrien. Namun, kami berhipotesis tentang keterlibatan transporter glukosa, karena antosianin juga dapat diserap melalui transporter ini, berkat bagian gulanya [ 46 , 47 ]. Selain itu, CGA dapat memodulasi metabolisme glukosa, yang berkontribusi terhadap efek menguntungkannya terhadap diabetes dan hiperglikemia [ 60 – 62 ]. CGA dapat memodulasi ekspresi transporter glukosa, seperti SGLT-1 dan GLUT-2, sehingga mengatur penyerapan glukosa usus dan homeostasis pada tikus dengan diet tinggi lemak [ 61 ]. Namun, meskipun ada kesamaan struktural antara bagian asam quinic dan glukosa, tidak ada penelitian yang melaporkan interaksi langsung CGA dengan transporter glukosa. Dengan demikian, kami menyelidiki melalui docking molekuler kemungkinan interaksi CGA dengan GLUT-1, GLUT-3, dan SGLT-1 yang diketahui terlibat dalam penyerapan antosianin [ 46 , 47 ] dan diekspresikan oleh makrofag [ 63 ]. Untuk mengeksplorasi secara komprehensif perilaku pengikatan Pg3G, Pn3G, dan CGA, berbagai kondisi transporter dipertimbangkan dalam jalur docking. Pendekatan ini memungkinkan penilaian pengikatan ligan di berbagai keadaan saluran translokasi substrat, memberikan wawasan tentang kemampuan ligan untuk berinteraksi dengan dan berpotensi melewati saluran dalam kondisi protein yang berbeda. Analisis docking kami menunjukkan bahwa CGA dapat bersaing dengan antosianin, khususnya Pg3G dan Pn3G, untuk mengikat transporter glukosa GLUT-1, GLUT-3, dan SGLT-1. Persaingan potensial ini muncul dari kemampuan CGA untuk membentuk interaksi dengan residu yang juga ditargetkan oleh antosianin. Kesamaan struktural dalam mode pengikatan antara Pg3G, Pn3G, dan CGA meluas melampaui residu bersama ke kemampuan mereka untuk menempati daerah yang tumpang tindih dalam saluran translokasi substrat, meniru satu sama lain. Kesamaan spasial ini memungkinkan CGA untuk berinteraksi dengan residu kunci dengan cara yang sebanding dengan antosianin. Perilaku ini diamati di ketiga transporter, seperti yang diilustrasikan oleh pose docking dan jaringan interaksi. Oleh karena itu, karena transporter glukosa adalah transporter jenuh, kadar tinggi CGA dalam ekstrak Bleuet dapat bersaing dengan antosianin untuk transporter ini, membatasi penyerapan seluler mereka dan, akibatnya, aktivitas anti-inflamasi mereka. Sementara polifenol teh lainnya telah dilaporkan mengikat SGLT-1 sebagai molekul seperti antagonis tanpa diangkut melalui transporter ini [ 64 ], penelitian serupa belum dilakukan pada CGA.
Meskipun terdapat beberapa keterbatasan terkait efek pemasakan dan pencernaan, hasil penelitian kami sesuai dengan studi manusia yang menunjukkan bahwa, tidak seperti kentang berdaging putih, mengonsumsi kentang berdaging kuning atau ungu, yang kaya akan karotenoid dan antosianin, dapat mengurangi kadar IL-6 serum dan protein C-reaktif (CRP) [ 30 ].
Singkatnya, penelitian kami menunjukkan bahwa kentang berpigmen dari budidaya dataran tinggi, seperti Desirèe dan Bleuet, dapat menjadi sumber daya ekonomi bagi petani lokal, mengingat senyawa bioaktifnya yang meningkatkan kesehatan dan kemampuannya untuk melawan penyakit terkait peradangan. Selain itu, data kami memberikan, untuk pertama kalinya, hipotesis bahwa CGA dapat mengikat transporter glukosa secara kompetitif, membatasi penyerapan glukosa dan substrat lain seperti antosianin, yang membuka jalan bagi rasionalisasi molekuler dari efek yang diamati.

