
ABSTRAK
Cornus officinalis Sieb. et Zucc. ( Cornus officinalis ), buah tanaman alami yang dapat dimakan, memiliki efek menguntungkan pada banyak penyakit metabolik, tetapi mekanisme untuk meningkatkan steatosis hati masih sulit dipahami. Dalam penelitian ini, efek kuratif ekstrak Cornus officinalis (COE) dievaluasi dalam model tikus NAFLD yang diinduksi fruktosa menggunakan pemantauan indikator biokimia, pewarnaan histologis, analisis sekuensing 16S rRNA, dan transplantasi mikrobiota feses. Hasil kami menunjukkan bahwa COE melemahkan steatosis hati pada tikus yang diberi makan fruktosa. Secara mekanistis, COE memperbaiki kerusakan penghalang usus dan disbiosis flora usus untuk menekan transportasi metabolit yang berasal dari mikroba proinflamasi ke hati, sehingga menghambat peradangan hati dan disfungsi metabolisme lipid. Khususnya, transplantasi mikrobiota feses yang diisolasi dari tikus yang diberi makan fruktosa dapat membalikkan efek menguntungkan COE dalam melemahkan NAFLD. Oleh karena itu, penelitian kami menunjukkan bahwa COE menunda perkembangan NAFLD yang dipicu oleh fruktosa dengan menekan disfungsi metabolisme lipid dan peradangan hati yang dimediasi mikrobiota usus, menyoroti potensi C. officinalis sebagai sumber pengobatan obat NAFLD.
Singkatan
AKSES
asetil CoA karboksilase
ALT
alanin aminotransferase
Bahasa Inggris
aspartat aminotransferase
Jagung manis
Cornus officinalis Sieb. dan Zucc.
KELOMPOK KERJA
Ekstrak Cornus officinalis
CPT1α
karnitin palmitiltransferase 1α
Bahasa Inggris FASN
sintase asam lemak
HDL-c
kolesterol lipoprotein densitas tinggi
IL-1β
interleukin-1β
Pesawat IL-18
interleukin-18
Pesawat IL-6
interleukin-6
LDL-c
kolesterol lipoprotein densitas rendah
LPS
lipopolisakarida
MDA
malondialdehida
NAFLD
penyakit hati berlemak non-alkohol
ROS
spesies oksigen reaktif
SREBP-1
protein pengikat elemen pengatur sterol-1
TC
kolesterol total
Tg
trigliserida
TNF-α
faktor nekrosis tumor-α
T-SOD
total superoksida dismutase
ZO-1
zonula okludens-1
1 Pendahuluan
Penyakit hati berlemak non-alkohol (NAFLD), yang baru-baru ini berganti nama menjadi penyakit hati berlemak terkait disfungsi metabolik, memengaruhi hampir seperempat populasi global dengan insidensi yang terus meningkat dan lebih muda (Goldner dan Lavine 2020 ; Teng et al. 2023 ). Sebagian besar pasien dengan NAFLD berisiko mengalami perkembangan menjadi steatohepatitis, fibrosis, sirosis, dan akhirnya karsinoma hepatoseluler. Dengan demikian, NAFLD telah menjadi penyebab utama morbiditas dan mortalitas terkait hati, yang menimbulkan beban yang signifikan pada kesehatan masyarakat global (Lee et al. 2023 ). Namun, belum ada obat yang secara definitif efektif telah diidentifikasi untuk pengobatan klinisnya hingga saat ini, yang menyoroti perlunya penelitian lebih lanjut untuk mengembangkan strategi praktis untuk pencegahan dan terapi NAFLD.
Meskipun penumpukan lipid berlebihan dalam adiposit secara luas dianggap sebagai kelainan utama yang memicu NAFLD, banyak faktor, termasuk interaksi antara metabolisme sistemik dan pola makan yang tidak sehat, terlibat dalam perkembangannya (Yang et al. 2024 ). Dengan perubahan sekuler dalam kebiasaan makan modern, fruktosa semakin banyak dikonsumsi sebagai sukrosa atau sirup jagung fruktosa tinggi dalam buah-buahan, minuman ringan, dan makanan manis lainnya, menjadi beban manis bagi kesehatan manusia, terutama dalam etiologi penyakit metabolik seperti NAFLD (Alwahsh dan Gebhardt 2017 ; Jensen et al. 2018 ). Fruktosa makanan awalnya dianggap dimetabolisme secara eksklusif di hati, tempat ia mengubah asetil koenzim A menjadi asam lemak dengan meningkatkan sintesis asam lemak de novo . Saat ini, metabolisme fruktosa juga dikenali di usus halus, tempat mikroba usus berkontribusi pada penyerapannya, menyediakan substrat untuk sintesis asam lemak hati berikutnya (Taylor et al. 2021 ; Zhao et al. 2020 ). Ini menyoroti peran penting hubungan silang usus-hati dalam metabolisme fruktosa makanan. Bukti substansial telah menunjukkan bahwa disfungsi aksis usus-hati memainkan peran penting dalam NAFLD yang didorong oleh fruktosa, termasuk mikrobiota usus yang tidak seimbang dan fungsi penghalang usus yang terganggu (Vasques-Monteiro et al. 2021 ). Selain itu, konsumsi berlebihan dan penyalahgunaan fruktosa di usus halus memicu kerusakan penghalang usus, yang menyebabkan translokasi bakteri dan endotoxemia (Cho et al. 2021 ). Gangguan integritas epitel usus meningkatkan permeabilitas usus, yang memaparkan hati terhadap sirkulasi sistemik racun dan penyebaran bakteri. Akibatnya, gangguan metabolisme hati dan proses penyakit berakselerasi melalui aksis usus-hati (Leung et al. 2016 ; Todoric et al. 2020 ). Bukti yang muncul menunjukkan bahwa memulihkan integritas penghalang usus dan menyeimbangkan mikrobiota usus dapat meringankan NAFLD (Brandt et al. 2019 ; He et al. 2022 ; Li et al. 2023 ). Oleh karena itu, ketidakseimbangan mikroba usus, metabolisme fruktosa hati, dan dialog usus-hati mereka adalah pusat NAFLD yang didorong oleh fruktosa. Dengan demikian, mempertahankan homeostasis fungsional usus-hati dapat berfungsi sebagai strategi prospektif untuk menunda perkembangan NAFLD.
Dalam beberapa tahun terakhir, dengan munculnya konsep “makanan sebagai obat” (Mafra et al. 2021 ), terutama karena konsep ini terkait erat dengan penyakit metabolik, ada peningkatan minat untuk mengeksplorasi molekul alami yang aktif secara farmakologis yang berasal dari makanan sebagai agen terapeutik yang potensial untuk menghentikan perkembangan NAFLD. Cornus officinalis Sieb. et Zucc. ( Cornus officinalis ), buah tanaman alami yang dapat dimakan, memiliki efek menguntungkan pada banyak penyakit metabolik di klinik pengobatan Tiongkok (Gao et al. 2021 ; Huang et al. 2018 ), yang dapat berfungsi sebagai bahan baku untuk pengembangan makanan kesehatan hijau, seperti minuman, selai, dan manisan (Czerwinska et al. 2021 ). Studi farmakologis modern telah menunjukkan bahwa C. officinalis dan berbagai bentuk medisnya memiliki efek menguntungkan pada banyak penyakit metabolik (Cao et al. 2022 ; Han et al. 2014 ; Park et al. 2021 ). Sementara itu, ada beberapa laporan yang menunjukkan efeknya dalam mengoreksi dislipidemia dan mengurangi deposisi lipid hati (Cao et al. 2022 ; Park et al. 2021 ). Studi-studi di atas menunjukkan bahwa C. officinalis mungkin bermanfaat dalam pengobatan NAFLD. Namun, efek C. officinalis dalam meningkatkan NAFLD dengan mempertahankan homeostasis fungsi usus-hati belum dilaporkan. Di sini, model tikus yang diberi fruktosa dibuat untuk menyelidiki kemanjuran dan mekanisme ekstrak C. officinalis (COE) dalam menunda NAFLD dengan menargetkan aksis usus-hati. Studi kami menunjukkan bahwa COE memperbaiki NAFLD yang diinduksi fruktosa dengan memulihkan homeostasis flora usus dan gangguan metabolisme lipid. Temuan ini mengungkap strategi potensial baru bahwa suplementasi makanan dengan C. officinalis mungkin merupakan strategi yang menjanjikan untuk pengobatan NAFLD, terutama bagi pasien dengan pola makan konsumsi fruktosa berlebihan.
2 Bahan dan Metode
2.1 Bahan
Fruktosa (kemurnian ≥ 99%) dibeli dari Aladdin Biochemical Technology Co. Ltd (Shanghai, Tiongkok). Kit komersial untuk deteksi biokimia, seperti trigliserida (TG), kolesterol total (TC), kolesterol lipoprotein densitas rendah (LDL-c), kolesterol lipoprotein densitas tinggi (HDL-c), alanine aminotransferase (ALT), aspartate aminotransferase (AST), spesies oksigen reaktif (ROS), malondialdehid (MDA), dan total superoksida dismutase (T-SOD) diperoleh dari Jiancheng Bioengineering Institute (Nanjing, Tiongkok). Kit ELISA untuk mendeteksi lipopolisakarida (LPS), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), IL-1β, dan IL-18 dibeli dari Ruixin Biotechnology Co. Ltd (Quanzhou, Tiongkok). Semua reagen lain yang digunakan bermutu analitis.
2.2 Penyusunan COE
Cornus officinalis yang dikumpulkan di provinsi Anhui (Tiongkok) dibeli dari Beijing Shizhentang (Yichang) Pharmaceutical Co., LTD (Yichang, Tiongkok) dan diautentikasi oleh Prof. Guohua Zheng (Sekolah Farmasi, Universitas Kedokteran Tiongkok Hubei, Tiongkok). COE disiapkan seperti yang dijelaskan sebelumnya (Quah et al. 2020 ). Secara singkat, C. officinalis (500 g) digiling menjadi mikropartikel halus menggunakan mesin bubuk, lalu disaring melalui saringan 100 mesh. Bubuk (100 g) dilarutkan dalam etanol 75% dengan rasio volume 1:10 dalam kondisi ultrasonik selama 60 menit dan terus diaduk selama proses ekstraksi, diikuti dengan pemekatan hingga sekitar 200 mL pada rotary evaporator, lalu dikeringkan beku-kering dengan pengering beku untuk mendapatkan bubuk COE kering dan diawetkan dalam kondisi kering pada suhu ruangan.
2.3 Analisis Kandungan Fitokimia pada COE
2.3.1 Analisis Kromatografi Cair Kinerja Tinggi (HPLC)
Sistem HPLC Agilent 1260 (Agilent Technologies, Palo Alto, AS) digunakan untuk menganalisis fitokimia utama dalam COE. Asam fosfat 0,3% (A) dan asetonitril (B) digunakan sebagai fase gerak pada laju alir 1,0 mL/menit. Prosedur elusi dioptimalkan sebagai berikut: 0–5 menit, 10% B; 6–20 menit, 10% ~ 60% B; 21–30 menit, 60% ~ 80% B. Sampel sebanyak 10 μL disuntikkan ke dalam kolom fase balik Symmetry C18 (4,6 mm × 250 mm, 5 μm) pada suhu 30°C, dan panjang gelombang deteksi UV–vis adalah 240 nm.
2.3.2 Analisis Spektrometri Massa Waktu Terbang Kromatografi Cair Kinerja Ultra Quadrupole (UPLC-Q-TOF-MS)
Sistem UHPLC-Q-TOF-MS dengan stasiun kerja MassHunter MS dan basis data METILIN digunakan untuk menganalisis konstituen fitokimia dalam COE seperti yang dijelaskan sebelumnya (Chen, Liu, et al. 2022 ). Asam fosfat 0,3% (A) dan asetonitril (B) digunakan sebagai fase mobil pada laju alir 0,3 mL/menit. Prosedur elusi dioptimalkan sebagai berikut: 0–5 menit, 5%–10% B; 6–20 menit, 10%–60% B; 21–30 menit, 60%–80% B. Larutan metanol COE disuntikkan pada laju alir 0,3 mL/menit ke dalam kolom ikatan tunggal C18 InfinityLab Poroshell 120 EC (3,0 × 150 mm, 2,7 μm) pada suhu 30°C. Akuisisi data massal dilakukan dengan Agilent 6530 Q-TOF (Agilent Technologies, Palo Alto, AS). Konstituen fitokimia dalam COE diidentifikasi menggunakan pustaka METLIN ( https://metlin.scripps.edu ).
2.4 Pemantauan Hewan
Tikus jantan C57BL/6 (berat 20 ± 2 g) diperoleh dari Pusat Hewan Percobaan Provinsi Hubei (Wuhan, Tiongkok). Semua tikus dibagi secara acak ke dalam lima kelompok ( n = 8 per kelompok) dan diberi makanan tikus standar. Kelompok kontrol dibiarkan mengakses air putih secara bebas, dan kelompok diet fruktosa serta kelompok pemberian diberi larutan fruktosa 30%. Sementara itu, kelompok pemberian diberi COE (100 atau 200 mg/kg) melalui gavage setiap hari selama 8 minggu terus menerus (Park et al. 2020 ). Fenofibrate berfungsi sebagai obat kontrol positif dalam penelitian ini melalui pemberian lambung dengan dosis 100 mg/kg pada tikus yang diberi fruktosa (Shin et al. 2021 ). Pada akhir percobaan hewan, semua tikus dikorbankan dengan isoflurana 3% untuk mengumpulkan serum, spesimen hati, dan isi usus untuk penyelidikan berikut. Prosedur penggunaan hewan dalam penelitian ini dilakukan sesuai dengan Pedoman Manajemen dan Penggunaan Hewan Laboratorium (edisi asli 8, Dewan Nasional untuk Penelitian Akademik, 2012) dan disetujui oleh Komite Perawatan dan Penggunaan Hewan Institusional Universitas Kedokteran Cina Hubei (HUCMS202106003).
2.5 Pewarnaan Hematoxylin–Eosin, Oil Red O, dan Periodic Acid-Schiff
Jaringan hati segar dan sampel usus difiksasi dengan 10% paraformaldehida, didehidrasi, ditanamkan dengan parafin, dan kemudian dipotong menjadi irisan 5 μm. Irisan hati dan usus parafin diproses untuk dewaxing xylene dan rehidrasi etanol gradien dan kemudian diwarnai dengan pewarna hematoxylin–eosin (H&E). Sistem penilaian steatosis hati terdiri dari penilaian semi-kuantitatif dari tiga fitur histologis: steatosis (0–3), peradangan lobular (0–3), dan balon hepatoseluler (0–2) (Kleiner et al. 2005 ). Irisan usus juga dikenakan pewarnaan asam periodik-Schiff (PAS) menggunakan pewarna PAS. Untuk pewarnaan minyak Red O (ORO), irisan hati beku diwarnai dengan larutan ORO, dibilas dengan isopropanol 60%, dan kemudian inti diwarnai ulang dengan hematoxylin. Semua segmen ini dipasang di bawah penutup kaca untuk visualisasi mikroskopis lebih lanjut.
2.6 Western Blotting, Imunohistokimia, dan Imunofluoresensi
Protein sitosolik diekstraksi dari jaringan hati dan usus menggunakan buffer lisat M-PER yang dicampur dengan inhibitor protease dan inhibitor fosfatase. Konsentrasi protein yang diekstraksi ditentukan menggunakan kit BCA, dan sampel protein kemudian disiapkan setelah menambahkan buffer pemuatan dan dipanaskan pada suhu 95°C selama 5 menit untuk memungkinkan denaturasi protein. Protein yang terdenaturasi dipisahkan dengan SDS-PAGE dan dipindahkan semi-kering ke membran PVDF. Setelah pemblokiran selama setidaknya 1 jam dalam buffer pemblokiran, membran diinkubasi dengan antibodi primer spesifik semalaman, diikuti oleh inkubasi dengan antibodi sekunder yang sesuai. Pita protein kemudian dinilai oleh substrat chemiluminescent dan dikuantifikasi menggunakan perangkat lunak Image J 1.51.
Uji imunohistokimia dilakukan menggunakan Kit HRP SP Rabbit & Mouse sesuai dengan petunjuk. Singkatnya, setelah penghilangan lilin dan rehidrasi, pengambilan antigen dilakukan pada irisan hati dalam buffer natrium sitrat yang mendidih, kemudian didinginkan hingga suhu ruangan. Irisan diinkubasi dengan antibodi primer semalaman pada suhu 4°C, kemudian imunoreaktivitas diamati menggunakan pewarnaan DAB dan diambil di bawah mikroskop.
Untuk pewarnaan imunofluoresens, irisan usus yang diambil antigennya diinkubasi dengan antibodi primer semalaman dan antibodi sekunder yang dikonjugasikan dengan FITC. Daerah intensitas fluoresensi diperiksa dan dicitrakan menggunakan mikroskop fluoresensi Olympus IX 73 DP80 (Tokyo, Jepang). Inti sel diwarnai dengan warna biru (DAPI). Semua antibodi yang terlibat tercantum dalam Tabel S1 .
2.7 Reaksi Rantai Polimerase Kuantitatif Real-Time
Total RNA diekstraksi dari homogenat hati dan usus dengan Reagen TRIzol. Setelah itu, DNA komplementer (cDNA) diperoleh melalui transkripsi balik menggunakan transkriptase balik M-MLV dan primer oligo-dT18. Uji reaksi berantai polimerase kuantitatif waktu nyata (RT-qPCR) kemudian diproses melalui FastStart Universal SYBR Green Master Mix pada Sistem PCR ABI StepOne PlusTM (Applied Biosystems, Foster City, CA). Kadar mRNA relatif dinormalisasi menurut referensi GAPDH. Semua urutan primer tercantum dalam Tabel S2 .
2.8 Uji Spesies Oksigen Reaktif
Pembentukan Spesies Oksigen Reaktif (ROS) ditentukan menggunakan flow cytometry. Secara rinci, hepatosit primer diisolasi dari suspensi hati segar, kemudian diwarnai dengan 2′-7′-diklorofluorescin diasetat (DCFH-DA) pada suhu 37°C selama 30 menit dan dicuci dengan PBS. Setelah disentrifugasi, supernatan dibuang untuk mengumpulkan sel, dan sel disuspensikan kembali dalam larutan PBS 0,5 mL, diikuti dengan analisis dengan flow cytometer.
2.9 Analisis Urutan 16S rRNA
Sampel feses dikumpulkan dari tikus kontrol atau tikus yang diberi fruktosa dengan pemberian intragastrik baik pembawa maupun COE (200 mg/kg) selama 8 minggu. Total DNA diekstraksi dari sampel feses menggunakan Stool Genomic DNA Extraction Kits (Solarbio, Beijing, Tiongkok). Primer (forward: 5′-ACTCCTACGGGAGGCAGCA-3′ dan reversed: 5′-GGACTACHVGGGTWTCTAAT-3′) digunakan untuk mengamplifikasi gen 16S rRNA di wilayah V3-V4. Selanjutnya, produk PCR dimurnikan dan diukur untuk membuat pustaka sekuensing, dan pustaka yang memenuhi syarat diurutkan menggunakan platform Illumina Miseq (Illumina NovaSeq 6000, Illumina, San Diego, CA, AS) sesuai dengan petunjuk pabrik pembuatnya. Akhirnya, perubahan komunitas mikroba antara kelompok yang berbeda dievaluasi melalui berbagai analisis (termasuk analisis OTU, analisis keragaman α/β, analisis struktur dan kelimpahan, dll.) seperti yang dijelaskan sebelumnya (Chen, Wang, et al. 2022 ).
2.10 Transplantasi Mikrobiota Feses
Transplantasi mikrobiota feses dilakukan seperti yang dijelaskan sebelumnya (Peng et al. 2023 ). Secara singkat, tikus jantan C57BL/6 dibagi secara acak menjadi empat kelompok ( n = 6 per kelompok). Tikus dalam kelompok kontrol dibiarkan bebas mengakses air, dan kelompok diet fruktosa diberi makan larutan fruktosa 30% selama 8 minggu. Sementara itu, pemberian intragastrik COE (200 mg/kg) dilakukan setiap hari pada kelompok perlakuan. Setelah 4 minggu, feses dari tikus diet fruktosa dikumpulkan setiap hari dalam tabung steril dengan garam normal (200 mg/mL) untuk homogenisasi dan kemudian disentrifugasi pada 2000 g/menit selama 1 menit untuk mengumpulkan supernatan untuk mendapatkan larutan mikrobiota feses. Tikus dalam kelompok transplantasi mikrobiota feses diberikan secara intragastrik dengan larutan mikrobiota feses (0,2 mL/hari) sebagai tambahan COE setiap hari. Akhirnya, evaluasi peran flora usus dalam efek perbaikan COE pada tikus yang diberi fruktosa diproses dengan mengamati perubahan dalam histologi hati dan fungsi metabolisme lipid.
2.11 Analisis Statistik
Prism 8.0 (GraphPad Software Inc., San Diego, CA, AS) digunakan untuk analisis statistik. Semua data direpresentasikan sebagai nilai Mean ± SD. Uji t tak berpasangan dua sisi dan ANOVA dilakukan antara dua kelompok dan di antara tiga kelompok atau lebih. p < 0,05 berarti signifikansi statistik.
3 Hasil
3.1 Analisis Kualitatif Konstituen Fitokimia dalam COE
Metode UPLC-QTOF-MS digunakan untuk mengidentifikasi konstituen fitokimia utama dalam COE. Sebanyak 31 komponen diidentifikasi dalam mode positif dan negatif menggunakan pustaka METLIN ( https://metlin.scripps.edu ) (Tabel S3 ). Di antara mereka, 5 senyawa representatif COE masing-masing dikarakterisasi sebagai morroniside, loganin, cornuside I, asam galat, dan magnolin dengan analisis HPLC (Gambar S1 ). Dapat disimpulkan bahwa COE diperkaya dengan glikosida iridoid, yang konsisten dengan penelitian sebelumnya (Huang et al. 2018 ).
3.2 COE Meredakan Steatosis Hepatik yang Diinduksi Fruktose
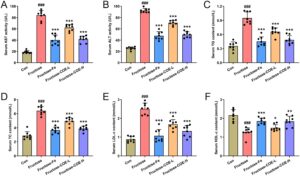
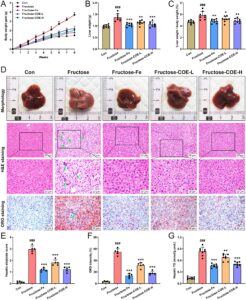
Sejak penggunaannya yang luas dalam makanan sehari-hari saat ini, fruktosa menjadi faktor risiko independen penting dari NAFLD yang layak mendapat perhatian lebih (Febbraio dan Karin 2021 ). Dalam penelitian ini, model tikus steatosis hati yang didorong oleh fruktosa dibangun dengan memberi makan larutan fruktosa selama 8 minggu terus menerus, dan pemberian COE secara simultan melalui gavage (100 atau 200 mg/kg) dilakukan untuk menyelidiki efek COE pada NAFLD yang diinduksi fruktosa. Hasil kami menunjukkan bahwa aktivitas enzim fungsi hati (AST dan ALT) meningkat pada tikus yang diberi fruktosa sementara menurun setelah pengobatan COE (Gambar 1A,B ). Kandungan serum TG, TC, dan LDL-c juga meningkat tetapi HDL-c berkurang pada tikus yang diberi fruktosa, yang dibalikkan oleh COE (Gambar 1C–F ). Selain itu, berat badan, berat hati, dan indeks hati meningkat pada tikus yang diberi fruktosa (Gambar 2A–C ), sementara mereka menurun dengan pemberian COE. Secara morfologis, hati tikus yang diberi fruktosa berwarna kuning pucat tetapi cenderung normal pada tikus yang diobati dengan COE (Gambar 2D ). Pewarnaan histologis menunjukkan steatosis vesikular, akumulasi lipid, dan infiltrasi inflamasi (panah hijau) di hati tikus yang diberi fruktosa bersama dengan skor steatosis hati yang meningkat, intensitas ORO dan kandungan TG hati, yang ditingkatkan dengan pemberian COE (Gambar 2D–G ). Dibandingkan dengan efek positif fenofibrate (Fe), obat hipolipidemik, terlihat bahwa COE menunjukkan efek yang sebanding dalam memperbaiki disfungsi hati, dislipidemia, dan steatosis. Semua ini mengungkapkan bahwa COE efektif dalam menekan perkembangan NAFLD pada tikus yang diberi fruktosa.
3.3 COE Mempertahankan Homeostasis Metabolisme Lipid Hepatik pada Tikus yang Diberi Makan Fruktosa
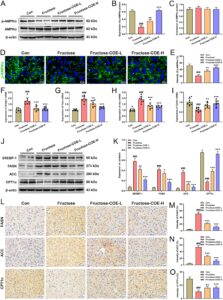
Homeostasis metabolisme lipid diketahui penting dalam perkembangan NAFLD. Di sini, diet fruktosa ditemukan mengganggu keseimbangan metabolisme lipid hati, yang dengannya sintesis lipid ditingkatkan tetapi oksidasi berkurang. Secara rinci, hasil menunjukkan bahwa pemberian fruktosa menekan fosforilasi AMPK, faktor kunci dari gangguan metabolisme lipid hati yang diinduksi fruktosa (Woods et al. 2017 ), sementara pengobatan COE meningkatkan aktivasinya (Gambar 3A–C ). Hasil serupa ditemukan dalam analisis imunofluoresensi (Gambar 3D,E ). Selain itu, baik tingkat mRNA dan protein dari faktor lipogenik utama (SREBP-1, FASN, dan ACC) meningkat dan molekul penting oksidasi asam lemak (CPT1α) menurun di hati tikus yang diberi fruktosa, sementara dibalikkan oleh pemberian COE (Gambar 3F–K ). Hasil serupa diamati dalam analisis imunohistokimia (Gambar 3L–O ). Secara keseluruhan, hal ini menunjukkan bahwa COE dapat menghambat lipogenesis yang diinduksi fruktosa dan meningkatkan β-oksidasi untuk menjaga homeostasis metabolisme lipid pada tikus.
3.4 COE Menekan Stres Oksidatif dan Respon Peradangan di Hati Tikus yang Diberi Makan Fruktosa
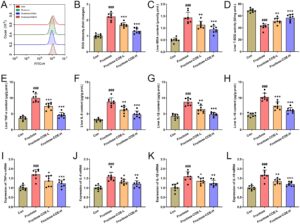
Mengingat akumulasi lipid dalam hepatosit dan fungsi hati yang rusak seperti yang ditemukan di atas, hal itu mungkin mengakibatkan oksidasi hati dan respons inflamasi. Secara koheren, ditemukan bahwa kadar ROS hati meningkat pada tikus yang diberi fruktosa sementara dikurangi dengan pengobatan COE (Gambar 4A, B ) disertai dengan penurunan kadar MDA dan peningkatan aktivitas T-SOD (Gambar 4C, D ). Selain itu, peningkatan kandungan dan kadar mRNA sitokin pro-inflamasi (TNF-α, IL-6, IL-1β, dan IL-18) di hati tikus yang diberi fruktosa juga berkurang setelah pengobatan COE (Gambar 4E–L ). Hasil ini menunjukkan bahwa COE mampu menghambat stres oksidatif hati dan respons inflamasi pada tikus yang diberi fruktosa.
3,5 COE Meningkatkan Kerusakan Penghalang Usus pada Tikus yang Diberi Makan Fruktosa
Bukti menunjukkan bahwa aksis usus-hati terlibat dalam etiologi NAFLD (Albillos et al. 2020 ). Dalam penelitian ini, pewarnaan histologis usus menunjukkan bahwa dibandingkan dengan kelompok kontrol, vili kolon sangat rusak dan tersusun tidak teratur pada tikus yang diberi fruktosa bersama dengan infiltrasi inflamasi yang jelas (panah hitam) dan berkurangnya sel goblet kolon yang tidak terdistribusi secara merata, sedangkan vili kolon tikus yang diobati dengan COE tersusun rapi dan rapat dan tidak terlihat infiltrasi inflamasi disertai dengan peningkatan jumlah sel goblet kolon (Gambar 5A ). Sementara itu, panjang vili kolon, kedalaman kripta, dan rasio panjang vili/kedalaman kripta menurun pada tikus yang diberi fruktosa, sedangkan meningkat dengan pengobatan COE (Gambar 5B–D ). Selain itu, hasil kami menunjukkan bahwa tingkat mRNA dan ekspresi protein gen penting yang terkait dengan tight junction (ZO-1) menurun di kolon tikus yang diberi fruktosa, tetapi meningkat setelah pemberian COE (Gambar 5E–G ). Gambar imunofluoresensi menunjukkan hasil yang konsisten (Gambar 5H,I ). Secara keseluruhan, ini menunjukkan bahwa COE dapat melindungi integritas penghalang usus pada tikus yang diberi fruktosa.
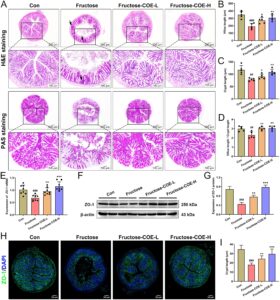
3.6 COE Melemahkan Disbiosis Mikrobiota Usus yang Diinduksi Fruktosa pada Tikus
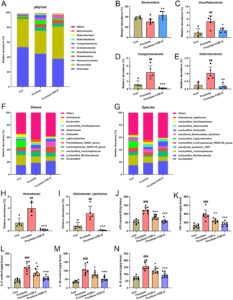
Berikutnya, kami menyelidiki lebih lanjut efek COE pada perubahan komposisi mikrobiota intestinal pada tikus yang diberi fruktosa. Analisis sekuens gen 16S rRNA menunjukkan bahwa terdapat 1634 unit taksonomi operasional (OTU) pada kelompok kontrol, 1533 pada kelompok diet fruktosa, dan 1477 pada kelompok yang diobati dengan COE, di antaranya 305 OTU dibagikan (Gambar 6A ). Indeks keanekaragaman Chao1, Shannon, dan Simpson digunakan untuk memperkirakan keanekaragaman alfa flora usus, dan indeks keanekaragaman ini meningkat pada flora usus tikus yang diberi fruktosa sementara menurun oleh pengobatan COE (Gambar 6B–D ). Selain itu, analisis komponen utama (PCA), analisis koordinat utama (PCoA), dan penskalaan multidimensi nonmetrik (NMDS), analisis β-diversity, menunjukkan bahwa kelompok yang diberi fruktosa terpisah secara jelas dari kelompok lain, yang menunjukkan bahwa kelompok yang diberi fruktosa menyebabkan disbiosis komposisi mikrobiota usus yang jelas. Namun, kelompok yang diberi COE menunjukkan tren yang lebih dekat ke arah kelompok kontrol, yang menunjukkan efek positif COE dalam regulasi mikrobiota usus (Gambar 6E–G ). Selain itu, dengan menggunakan Metode Kelompok Berpasangan Tidak Tertimbang dengan Rata-rata Aritmatika (UPGMA) untuk menganalisis kesamaan komunitas mikroba di antara sampel, hasilnya juga menunjukkan bahwa sampel dalam setiap kelompok dapat dibedakan dengan jelas (Gambar 6H ). Hasil ini menunjukkan bahwa COE dapat meningkatkan komposisi mikrobiota usus yang berubah akibat fruktosa pada tikus.

Kami selanjutnya menganalisis perubahan dalam komposisi mikrobiota setiap kelompok pada tingkat filum. Hasilnya menunjukkan bahwa dibandingkan dengan kelompok kontrol, kelimpahan relatif Bacteroidota menurun secara signifikan, dan kelimpahan relatif Desulfobacterota , Campylobacterota , dan Deferribacterota meningkat dalam usus tikus yang diberi fruktosa tetapi dapat dibalikkan dengan pengobatan COE (Gambar 7A–E ). Pada tingkat genus dan spesies, ditemukan bahwa kelimpahan relatif Helicobacter spesies dan Helicobacter_typhlonius meningkat dalam kelompok fruktosa, sementara mereka menurun dalam kelompok yang diobati COE (Gambar 7F–I ). Histogram cabang evolusi dan distribusi nilai LDA menunjukkan bahwa flora usus terutama terdiri dari Lactobacillales dan Prevotellaceae pada kelompok kontrol, dan Typhlonius , Desulfovibrio , dan Deferribacteraceae di bawah genus Helicobacter pada kelompok diet fruktosa, sedangkan flora utama pada kelompok yang diobati COE adalah Coprostanoligenes dari genus Eubacterium (Gambar S2 ). Lebih jauh lagi, kandungan sitokin pro-inflamasi (LPS, TNF-α, IL-6, IL-1β, dan IL-18) dalam feses tikus yang diberi fruktosa juga berkurang setelah pengobatan COE (Gambar 7J–N ). Ini menunjukkan bahwa COE mampu mengurangi peradangan usus yang diinduksi flora pro-inflamasi dan kerusakan penghalang usus dengan meningkatkan homeostasis flora usus.
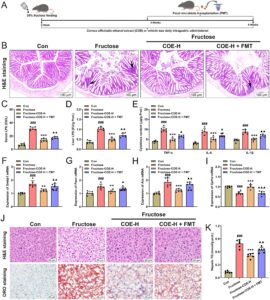
3.7 Transplantasi Mikrobiota Usus Tikus yang Diberi Makan Fruktosa Menghilangkan Efek Perbaikan COE pada NAFLD yang Diinduksi Fruktosa
Untuk memvalidasi peran penting mikrobiota intestinal dalam efek menguntungkan COE pada NAFLD pada tikus yang diberi fruktosa, kami mentransplantasikan mikrobiota feses tikus yang diberi fruktosa ke tikus yang diobati dengan COE (Gambar 8A ). COE ditemukan efektif dalam mengurangi kerusakan histologis intestinal dan infiltrat inflamasi yang diinduksi fruktosa (panah hitam), sedangkan transplantasi flora membalikkan efek positif COE (Gambar 8B ). Sementara itu, kandungan LPS serum dan hati tidak diatur pada tikus yang ditransplantasikan flora bersama dengan peningkatan kandungan faktor proinflamasi TNF-α, IL-6, dan IL-1β (Gambar 8C–E ). Selain itu, kadar mRNA faktor metabolik lipid penting (SREBP-1, FASN, dan ACC) meningkat bersama dengan penurunan CPT1α pada tikus yang ditransplantasikan flora (Gambar 8F–I ). Perlu dicatat, efek perbaikan COE pada steatosis hati yang diinduksi fruktosa dinetralisir oleh transplantasi flora, dan kandungan TG hati juga meningkat (Gambar 8J,K ). Semua data mengungkapkan bahwa transplantasi flora usus dapat membalikkan sebagian efek penghambatan COE pada NAFLD yang dipicu fruktosa pada tikus.
4 Diskusi
NAFLD merupakan manifestasi utama dari sindrom metabolik hepatik yang sangat mungkin berkembang menjadi steatohepatitis, sirosis, dan bahkan karsinoma hepatoseluler dengan pengobatan terbatas karena etiologinya yang kompleks (Samuel dan Shulman 2018 ). Cornus officinalis merupakan bubur buah matang yang dapat dimakan yang telah terungkap memiliki aktivitas biologis yang baik dalam perlindungan hati (Cao et al. 2022 ; Han et al. 2014 ; Park et al. 2020 , 2021 ). Penelitian sebelumnya telah menunjukkan manfaat C. officinalis dan produk olahannya dalam anti-obesitas dan mengurangi deposisi lipid hati (Cao et al. 2022 ; Park et al. 2021 ). Akan tetapi, laporan yang tersedia ini hanya mengeksplorasi efek perbaikan C. officinalis berdasarkan model tikus obesitas, dan mekanisme yang menjelaskan efeknya dalam mengurangi akumulasi lipid seluler masih belum dijelaskan dengan baik, terutama interaksi yang melibatkan homeostasis mikrobiota usus dan steatosis hepatoseluler. Di sini, penelitian ini menyelidiki kemanjuran perbaikan COE dalam model tikus yang diberi fruktosa dan mengungkap bahwa COE secara efektif meringankan NAFLD yang diinduksi fruktosa dengan memulihkan homeostasis mikrobiota usus untuk memperbaiki disfungsi metabolisme lipid.
Fruktosa, karbohidrat yang utamanya diperoleh dari gula rafinasi dan sirup jagung fruktosa tinggi dalam pola makan modern, khususnya di dunia Barat (Stricker et al. 2021 ), semakin dianggap sebagai pendorong utama meningkatnya morbiditas dalam berbagai penyakit gaya hidup, seperti NAFLD (Ouyang et al. 2008 ). Pandangan akademis tradisional menunjukkan bahwa NAFLD yang diinduksi fruktosa terutama terjadi karena fruktosa dimetabolisme dengan cepat dalam hepatosit oleh ketoheksokinase menjadi fruktosa 1-fosfat, yang akhirnya menghasilkan sitrat. Sitrat kemudian diubah menjadi asetil-KoA oleh enzim ATP sitrat liase (ACLY), kemudian diubah menjadi malonil KoA, yang berfungsi sebagai substrat untuk lipogenesis (Herman dan Samuel 2016 ; Softic et al. 2016 ). Lebih jauh lagi, metabolisme fruktosa hati mengganggu homeostasis metabolik lipid dengan meningkatkan lipogenesis de novo dan mengurangi β-oksidasi asam lemak melalui perubahan ekspresi molekul-molekul relevan, yang pada akhirnya mengakibatkan akumulasi lipid hati (Softic et al. 2019 ; Zhao et al. 2020 ). AMP-activated protein kinase (AMPK) memainkan peran penting dalam mengintegrasikan jalur-jalur metabolisme sebagai respons terhadap tuntutan energi dan memberikan efek perlindungan terhadap steatosis hati yang diinduksi fruktosa (Woods et al. 2017 ). Sejalan dengan ini, data kami menunjukkan bahwa diet tinggi fruktosa jangka panjang menginduksi steatosis hati, yang ditandai dengan akumulasi TG dan menekan aktivasi AMPK pada tikus. Selain itu, peningkatan pensinyalan lipogenik SREBP-1/FASN/ACC pada tingkat transkripsi dan translasi, bersama dengan gangguan oksidasi asam lemak, semakin membesar-besarkan steatosis hati. Konsep penting lain yang diajukan dalam sejumlah penelitian adalah bahwa patologi hati yang diinduksi fruktosa melibatkan interaksi antara usus dan hati (Albillos et al. 2020 ; Febbraio dan Karin 2021 ). Sebuah penelitian utama yang diterbitkan dalam Nature (2020) menunjukkan bahwa fruktosa makanan yang dimetabolisme di usus halus dapat diubah menjadi asetat oleh mikrobiota usus, yang memicu sintesis lipid secara independen dari ACLY (Zhao et al. 2020 ). Temuan ini menunjukkan bahwa interaksi antara fungsi usus dan hati pada NAFLD yang didorong oleh fruktosa layak mendapat perhatian lebih lanjut. Penghalang mukosa usus berfungsi sebagai antarmuka penting untuk interaksi usus-hati dengan membatasi penyebaran sistemik mikroba dan racun yang mencapai hati. Sayangnya, konsumsi fruktosa yang berlebihan merusak penghalang epitel usus dengan meningkatkan permeabilitas usus, yang didorong oleh peradangan usus dan stres retikulum endoplasma (Cho et al. 2021 ; Kawabata et al. 2019). Akibatnya, hal ini memfasilitasi masuknya portal sistemik LPS yang berasal dari usus dan metabolit mikroba ke dalam hati (Cho et al. 2021 ; Todoric et al. 2020 ). LPS selanjutnya memulai kaskade inflamasi melalui pensinyalan makrofag TLR4, yang mendorong perkembangan NAFLD (Krishnan et al. 2018 ; Lambertz et al. 2017 ). Temuan kami menunjukkan bahwa diet fruktosa kronis merusak mukosa epitel usus dan mengurangi protein tight junction ZO-1, pemain kunci dalam integritas penghalang mukosa usus. Selain itu, kandungan LPS yang berasal dari usus meningkat pada tikus yang diberi makan fruktosa dan mengalir ke hati melalui vena porta, yang menyebabkan aktivasi respons inflamasi yang dirangsang LPS, sementara ini ditingkatkan dengan pengobatan COE. Selain memotivasi peradangan, generasi sitokin proinflamasi seperti TNF-α juga berfungsi sebagai pengatur metabolisme lipid yang kuat, mempercepat pengendapan lipid hepatosit dan steatosis (Chen et al. 2009 ; De Taeye et al. 2007 ; Endo et al. 2007 ). Secara konsisten, akumulasi lipid yang berlebihan selanjutnya dapat meningkatkan pensinyalan TLR4/NF-κB untuk memicu kebocoran sitokin proinflamasi (TNF-α, IL-6, IL-1β, dan IL-18), sehingga memperburuk lingkaran setan respons inflamasi di hati untuk memperburuk perkembangan hati berlemak (Fei et al. 2020 ). Secara konsisten, penelitian ini menemukan bahwa COE menghambat aktivasi pensinyalan inflamasi hati pada tikus yang diberi makan fruktosa, yang mungkin terkait dengan fakta bahwa COE meningkatkan fungsi usus untuk menghambat respons inflamasi yang diinduksi LPS.
Khususnya, disbiosis mikroba dianggap sebagai penyebab utama kerusakan usus, dan menjaga homeostasis mikroba sangat penting untuk menjaga kesehatan hati (Aron-Wisnewsky et al. 2020 ). Oleh karena itu, menentukan komposisi mikrobiota usus sangat penting untuk menyelidiki hubungan kausal dan potensi hubungan patogenik antara disbiosis dan NAFLD. Mengingat efek peningkatan COE pada permeabilitas usus, peradangan, dan metabolisme hati, kami selanjutnya menganalisis komposisi mikrobiota usus dalam kelompok yang berbeda untuk mengidentifikasi kemungkinan keterlibatan COE dalam mengatur komposisi bakteri usus. Hasil kami menunjukkan kelimpahan relatif yang lebih tinggi dari bakteri pro-inflamasi ( Helicobacter_typhlonius ) pada tikus yang diberi makan fruktosa bersama dengan pembentukan sejumlah besar sitokin proinflamasi dan kerusakan penghalang usus, sedangkan pengobatan COE mengurangi kelimpahan relatif Helicobacter_typhlonius dan melemahkan peradangan usus. Helicobacter_typhlonius dikenal sebagai spesies Helicobacter pylori yang memicu disbiosis usus dan peradangan usus dan memainkan peran penting dalam perkembangan penyakit radang usus sebagai pemicu model penyakit enterocolitis (Bostick et al. 2019 ; Franklin et al. 2001 ). Penelitian telah mengungkapkan bahwa infeksi Helicobacter_typhlonius dapat membangkitkan produksi TNF-α yang berlebihan, pemicu penyakit utama yang mendorong perkembangan kolitis (Chai et al. 2017 ; Hale et al. 2007 ; Powell et al. 2012 ). Disarankan bahwa COE dapat melindungi penghalang dan fungsi usus dengan mengurangi kolonisasi Helicobacter_typhlonius usus untuk melemahkan respons peradangan usus pada tikus yang diberi diet fruktosa. Selain itu, transplantasi mikrobiota usus yang diisolasi dari tikus yang diberi fruktosa ke tikus yang diobati dengan COE menyebabkan pembalikan sebagian dari perbaikannya dalam cedera usus, peradangan hati, dan gangguan metabolisme lipid, yang selanjutnya menunjukkan peran utama mikrobiota usus dalam menunda perkembangan NAFLD melalui pengobatan COE. Studi fitokimia telah melaporkan bahwa C. officinalis mengandung berbagai jenis konstituen kimia termasuk loganin, morroniside, cornuside, sweroside, asam galat, dan asam ursolat, dll. (He et al. 2016 ; Huang et al. 2018 ). Secara khusus, loganin dan morroniside, yang merupakan komponen indikator C. officinalis , telah terbukti memperbaiki gangguan metabolisme pada tikus obesitas (Jang et al. 2023 ; Park et al. 2009 ; Xu et al. 2022; Yamabe et al. 2010 ). Oleh karena itu, COE dapat memperbaiki NAFLD dengan membatasi homeostasis metabolisme lipid dan mengurangi disbiosis bakteri usus melalui berbagai komponen aktifnya.
Singkatnya, penelitian ini mengungkap bahwa COE efektif dalam memperbaiki NAFLD yang diinduksi fruktosa dengan membatasi homeostasis metabolisme lipid dan mengurangi respons inflamasi yang dimodulasi oleh disbiosis bakteri usus, terutama menekankan peran penting homeostasis mikrobiota dalam terapi ini. Penelitian terkini memberikan dasar teori praklinis untuk suplementasi makanan obat Cornus officinalis sebagai strategi efektif untuk pengobatan NAFLD.

