
ABSTRAK
Selama beberapa dekade terakhir, penelitian ekstensif telah menunjukkan dan mengonfirmasi potensi antioksidan polifenol, yang karena sifat-sifat ini, kini dikenal luas karena kemampuannya untuk meningkatkan viabilitas sel. Studi ini menyelidiki kapasitas antioksidan dari tujuh sayuran berdaun hijau pada garis sel fibroblas tikus (L929) dan manusia (BJ) in vitro, yang bertujuan untuk menentukan apakah polifenol dapat membantu regenerasi jaringan ikat, yang akan sangat bermanfaat dalam penyembuhan luka dan perbaikan jaringan, suatu proses di mana pertumbuhan fibroblas sangat penting. Kapasitas antioksidan ekstrak diselidiki menggunakan uji 2,2-difenil-1-pikrilhidrazil (DPPH), spektroskopi UV-Vis, dan amperometri, dengan quercetin sebagai standar. Nilai EC 50 untuk ekstrak setara dengan sekitar 5 μM quercetin, yang berasal dari kisaran konsentrasi 20 hingga 100 mg daun segar per mL. Investigasi in vitro mengungkapkan bahwa semua ekstrak, kecuali lovage, meningkatkan viabilitas tinggi (lebih dari 80%) pada kedua kultur sel, seperti yang ditunjukkan oleh hasil uji MTS dan mikroskopi fluoresensi. Selain itu, Tumor Necrosis Factor (TNF)-α dan Lipopolisakarida (LPS) digunakan sebagai antagonis spesies oksigen reaktif (ROS), dan uji Dichloro-dihydro-fluorescein diacetate (DCFH-DA) digunakan untuk menunjukkan aktivitas pembersihan ekstrak pada fibroblas in vitro. Untuk beberapa ekstrak, pengurangan stres oksidatif dibandingkan dengan kondisi metabolisme basal sel diamati.
1 Pendahuluan
Sayuran berdaun hijau merupakan sumber vitamin, mineral, antioksidan polifenol, dan banyak lagi elemen yang meningkatkan kesehatan. Polifenol telah terbukti meningkatkan viabilitas dan proliferasi sel dalam kultur fibroblas, dan dengan mendorong pertumbuhan dan kelangsungan hidup sel, polifenol mendukung pemeliharaan dan regenerasi jaringan ikat, yang dapat sangat bermanfaat untuk pemulihan cedera dan proses regenerasi jaringan di mana proliferasi fibroblas sangat penting (Tyszka-Czochara et al. 2014 ).
Dari sudut pandang nutrisi, Tabel 1 , sayuran berdaun hijau mengandung sedikit lipid dan protein dan dicirikan oleh indeks glikemik rendah, terkait dengan rendahnya glukosa dan rendahnya jumlah total kandungan karbohidrat, yang merekomendasikannya untuk diet sehat berdasarkan konsumsi kalori rendah. Sebaliknya, nilai gizi sayuran ini ditonjolkan oleh tingginya kandungan unsur mikro, serat makanan, dan antioksidan (Randhawa et al. 2015 ). Perbedaan yang jelas harus dibuat antara bergizi dan bergizi; sementara bergizi berarti “menggunakan makanan untuk mendukung kehidupan”, arti bergizi adalah “makan sehat dan memanfaatkan semua zat gizi” (Nordquist 2020 ; Brinkman et al. 2010 ).
| Nama binomial | Nilai gizi per 100 g | |||||
|---|---|---|---|---|---|---|
| Kalori (kkal) | Protein (gram) | Lipid (g) | Karbohidrat (g) | Serat makanan (g) | ||
| Selada | Lactuca sativa | 15 | 1.4 | 0.2 | 1.6 | 1.3 |
| Ramson | Bawang putih | 19 | 0.9 | 0.3 | 2.9 | 2.2 |
| Orakel | Atriplex hortensis | 26 | 3.0 | 3.0 | 0.0 | 2.6 |
| Peterseli | Petroselinum crispum | 36 | 3.0 | 0.8 | 2.7 | 3.3 |
| Cinta | Levisticum officinale | 42 | 3.5 | 0.8 | 2.0 | 3.0 |
| Dil | Anethum graveolens | 43 | 3.5 | 1.1 | 4.9 | 2.1 |
| Kemangi | Bunga Ocimum basilicum | 22 | 3.2 | 0.6 | 1.1 | 1.6 |
Berdasarkan sifat antioksidannya, molekul bioaktif dari sayuran berdaun hijau diketahui dapat menetralkan radikal bebas yang dihasilkan oleh latihan fisik yang intens atau oleh hidrokarbon aromatik polisiklik (PAH) yang dihasilkan dari pencernaan daging yang digoreng, diasapi, atau dipanggang. Selama memasak daging, terutama saat menggunakan metode seperti memanggang, menggoreng, atau mengasapi, hidrokarbon aromatik polisiklik (PAH) dapat terbentuk (Flores et al. 2019 ; Bulanda dan Janoszka 2022 ). PAH ini dapat menyebabkan produksi ROS saat dimetabolisme oleh tubuh, yang menyebabkan kerusakan oksidatif pada sel dan jaringan (Zahed et al. 2023 ). Kerusakan ini telah dikaitkan dengan masalah kesehatan seperti peradangan, degradasi DNA, dan peningkatan risiko kanker dan penyakit kardiovaskular. Selain itu, latihan fisik, terutama latihan yang berat atau berkepanjangan, juga dapat memicu produksi ROS dalam tubuh. Hal ini terjadi karena peningkatan aktivitas metabolisme dan konsumsi oksigen otot yang lebih tinggi. Faktor-faktor seperti peningkatan asupan oksigen, peningkatan denyut jantung, dan kontraksi otot secara kolektif berkontribusi terhadap produksi ROS selama aktivitas fisik (Mrakic-Sposta et al. 2015 ). Sementara beberapa tingkat ROS yang dihasilkan selama latihan fisik dapat memiliki efek pelatihan yang menguntungkan, ROS berlebihan yang diakibatkan oleh latihan olahraga atau dari mengonsumsi daging panggang, goreng, atau asap dapat melampaui pertahanan alami tubuh, yang menyebabkan stres seluler oksidatif. Untuk mengelola produksi ROS selama latihan keras dan konsumsi daging, moderasi dalam kedua kasus umumnya direkomendasikan. Selain itu, menggabungkan lauk yang kaya polifenol dapat membantu mengurangi stres oksidatif (Gomes et al. 2012 ; Duedahl-Olesen dan Ionas 2022 ; Wang et al. 2019 ).
Menurut IUPAC, aktivitas antioksidan berkaitan dengan kinetika reaksi antara antioksidan dan pro-oksidan atau radikal yang direduksi atau dibersihkannya, sedangkan kapasitas antioksidan mengukur efisiensi konversi termodinamika dari probe oksidan setelah bereaksi dengan antioksidan. Pengukuran tingkat aktivitas/kapasitas antioksidan makanan dilakukan untuk perbandingan yang bermakna dari kandungan antioksidan bahan makanan (Apak et al. 2013 ).
Sifat aktivitas/kapasitas antioksidan dari dedaunan yang dapat dimakan berasal dari vitamin dan turunan vitamin, atau dari komponen polifenolnya. Sementara kapasitas antioksidan vitamin terbatas pada vitamin C dan E atau turunannya, senyawa polifenol diwakili oleh sejumlah besar molekul (Chiorcea-Paquim et al. 2020 ). Senyawa polifenol utama yang dapat ditemukan dalam sayuran hijau termasuk dalam famili flavonoid dan asam fenolik (DuPont et al. 2000 ; Justesen dan Knuthsen 2001a ) dan sifat antioksidannya diberikan oleh gugus resorsinol dan/atau katekol (Zatloukalová et al. 2013 ), misalnya, quercetin dan asam kafeat.
Karakteristik utama dari molekul antioksidan diberikan oleh kemampuannya untuk menetralkan radikal bebas melalui transfer elektron (Brand-Williams et al. 1995 ); suatu proses yang menggunakan oksidasi molekul antioksidan dan reduksi/netralisasi radikal bebas (Gil dan Couto 2013 ). Faktanya, reaksi transfer elektron adalah fitur karakteristik dari berbagai proses biologis fundamental (Oliveira-Brett 2017 ), termasuk biosintesis metabolisme—suatu proses yang menghasilkan sejumlah besar radikal bebas (Fang et al. 2002 ). Sementara kompleksitas mekanistik reaksi transfer elektron biologis sangat bervariasi dari kasus ke kasus, prinsip dasarnya sama. Karena distribusi elektronnya, bagian katekol dari flavonoid—yang memiliki kemampuan untuk mentransfer dua elektron—akan menjadi yang pertama terlibat dalam netralisasi radikal bebas. Namun, setelah bagian resorsinol dioksidasi oleh spesies reaktif, produk oksidasinya akan mampu menetralkan lebih banyak molekul daripada satu bagian katekol (Enache dan Oliveira-Brett 2011 ).
Biasanya, analisis kandungan antioksidan tanaman atau buah diawali dengan ekstraksi fraksi antioksidan dan diikuti dengan evaluasi kapasitas antioksidan (Koźmiński dan Oliveira-Brett 2008 ; Issaad et al. 2017 , 2019 ). Berbagai metode ekstraksi telah dicoba dan ditingkatkan dari waktu ke waktu, dan terbukti bahwa metode yang dibantu ultrasonik metanol yang diasamkan adalah yang paling efisien (Koźmiński dan Oliveira-Brett 2008 ) sementara metode evaluasi umum yang digunakan untuk kapasitas antioksidan adalah spektrofotometri dan elektrokimia (Chiorcea-Paquim et al. 2020 ; Mishra et al. 2012 ; Chen et al. 2013 ).
Dalam penelitian ini, kapasitas antioksidan dari tiga tanaman berdaun hijau (selada, daun bawang, dan orache) dan empat tanaman aromatik (peterseli, lovage, dill, dan basil), Tabel 1 , dievaluasi menggunakan uji DPPH spektrometri, dan perisai terhadap ROS diuji secara in vitro menggunakan garis sel fibroblast BJ dan L929.
2 Eksperimental
2.1 Bahan
Dedaunan (selada, daun bawang, orache, peterseli, lovage, dill dan basil) dibeli dari pasar lokal (Bucharest, Rumania) pada akhir April, dan ekstraknya disiapkan dalam waktu 24 jam.
Metanol (Nomor Kategori 34.860), etanol (Nomor Kategori 51.976) dan asam klorida (Nomor Kategori 320.331) untuk ekstraksi, DPPH (Nomor Kategori D9132) untuk evaluasi kapasitas antioksidan, dan quercetin (Nomor Kategori Q4951) sebagai standar dibeli dari Merck (Jerman) dan digunakan tanpa pemurnian lebih lanjut. Metanol tingkat CHROMASOLV HPLC (Nomor Kategori 603–001-00-X) dibeli dari Honeywell. H 2 O untuk HPLC dimurnikan menggunakan sistem pemurnian air Merck Millipore Direct-Q 3 UV dan dihilangkan gasnya dengan sonikasi. Asam trifluoroasetat (Nomor Kategori A12198) dibeli dari Alfa Aesar.
Bahasa Indonesia: Garis sel fibroblas L929 (Kat No. CCL-1) dan BJ (Kat No. CRL-2522) dari ATCC (AS), Dulbecco’s Modified Eagle Medium (DMEM) (Kat No. 302002) dari ATCC (AS), Tripsin (Kat No. 15090046) dari ThermoFisher Scientific (AS) dan larutan penyangga fosfat salin (PBS) (Kat No. 70011044) dari ThermoFisher Scientific, dan Fluorescein Phalloidin (Kat No. F432) dari ThermoFisher Scientific (AS) digunakan untuk evaluasi in vitro kapasitas antioksidan ekstrak tumbuhan. Bahasa Indonesia: Serum sapi janin (Nomor Cat. F7524) dari Sigma-Aldrich, Penicillin–Streptomycin (Nomor Cat. 15140122), formaldehida (Nomor Cat. 252549) dan glutaraldehida (Nomor Cat. 340855) dari Sigma-Aldrich, MTS-CellTiter 96 AQueous One Solution Cell Proliferation Assay (Nomor Cat. G3582) dari Promega, Tumor Necrosis Factor (TNF-alpha) (Nomor Cat. 172400000) dari ThermoFisher Scientific (AS), dan Lipopolisakarida (LPS) (Nomor Cat. 00–4976-93) digunakan untuk menilai viabilitas sel dan aktivitas penangkal radikal.
Semua larutan yang diperlukan disiapkan dengan reagen tingkat analitis dan air murni dari sistem Millipore Milli-Q (konduktivitas ≤ 0,1 μS/cm).
2.2 Instrumentasi
2.2.1 Spektrofotometri
DPPH, H 2 DCFDA, dan MTS dilakukan menggunakan pembaca mikroplat multi-mode FLUOstar Omega (BMG LABTECH, Jerman).
2.2.2 Mikroskopi Fluoresensi
Gambar mikroskop fluoresensi diperoleh menggunakan mikroskop fluoresensi tegak Leica DM6B (Leica Microsystems CMS GmbH) yang dilengkapi dengan LED Leica CTR6 (kotak elektronik yang berisi catu daya untuk elektronik dan lampu) dan sumber cahaya eksternal Leica EL6000 untuk eksitasi fluoresensi. Sampel diambil gambarnya menggunakan lensa objektif 40x (0,65 NA, 0,36 mm WD, dan cincin koreksi) dari Leica, kubus filter yang sesuai (filter eksitasi 480/50 nm, cermin dikroik 505–510 nm, dan filter emisi 527/30 nm), dan kamera fluoresensi monokrom Leica DFC9000 sCMOS 4,2 MP.
2.2.3 Pengukuran Elektrokimia
Pengukuran elektrokimia dicatat pada Detektor Elektrokimia RS dari Thermo Fisher Scientific Dionex UltiMate 3000 UPHLC + , yang digunakan untuk injeksi sampel secara otomatis. Sampel dianalisis pada suhu 25°C menggunakan fase gerak isokratik (5% MeOH dengan 0,1% TFA, 95% H 2 O dengan 0,1% TFA) dan laju alir 0,5 mL/menit menggunakan kolom tiruan untuk menangkap semua spesies antioksidan pada waktu retensi yang sama dengan bagian depan pelarut. Sampel dianalisis masing-masing pada 300, 700, dan 900 mV.
2.3 Metode
2.3.1 Ekstrak Tumbuhan
Untuk setiap tanaman, 25 g daun dicuci dengan etanol dan air, lalu dihancurkan. Ekstraksi senyawa polifenol dilakukan dalam tiga tahap, menggunakan campuran metanol, etanol, dan asam klorida, 8:1,9:0,1(v:v:v), sebagai pelarut ekstraksi. Pertama, daun yang dihancurkan dicampur dengan 10 mL pelarut ekstraksi, dimasukkan ke dalam oven gelombang mikro pada 450 W selama 30 detik, dilindungi dari cahaya dengan aluminium foil, direndam dalam bak ultrasonik, dan dikenai perlakuan ultrasonik pada suhu 25°C dan frekuensi konstan 35 kHz selama 15 menit. Setelah 1 jam inkubasi dalam gelap pada suhu kamar (22°C hingga 24°C), sampel disentrifugasi pada 3500 rpm dalam rotor TX-150 (model SL 8R centrifuge Thermo Fisher Scientific, Jerman) selama 20 menit, dan supernatan dikumpulkan dalam labu laboratorium dan disimpan pada +4°C. Pada langkah kedua, padatan yang tersisa dari setiap tanaman dicampur dengan 10 mL pelarut ekstraksi, dikenakan perlakuan ultrasonik selama 30 menit, disentrifugasi, dan ekstrak dikumpulkan dan dicampur dengan yang diperoleh pada langkah pertama. Langkah ini diulang sekali lagi. Untuk setiap tanaman, ekstrak yang diperoleh dalam ketiga langkah dicampur dan disaring menggunakan filter steril tutup botol 45 μm dan pompa vakum.
2.3.2 Evaluasi Kapasitas Antioksidan secara Spektrofotometri dengan Uji DPPH
Spektrum serapan setiap ekstrak tanaman direkam menggunakan pembaca mikroplat multimode FLUOstar Omega dan plat 96 sumur. Kondisi percobaan adalah: volume total 130 μL/sumur (sesuai dengan panjang lintasan 1 cm), kecepatan pindai 400 nm/menit, dan interval pengambilan sampel 1 nm. Larutan stok DPPH disiapkan sebelum setiap percobaan, dan konsentrasi 100 μM digunakan. Untuk mengoptimalkan linearitas respons dan menetapkan kapasitas antioksidan dalam rentang linear yang memadai, 12 konsentrasi berbeda telah diuji untuk setiap ekstrak tanaman. Perlu disebutkan bahwa, antara persiapan sampel dan pengukuran, terdapat Δt sebesar 300 detik.
Aktivitas penangkal radikal DPPH (RSA), %RSA = (1 sampel A /A DPPH ) x 100, dihitung menggunakan absorbansi maksimum DPPH yang diukur pada 516 nm. Kapasitas antioksidan dinyatakan sebagai nilai EC 50 , yang didefinisikan sebagai jumlah antioksidan yang diperlukan untuk menurunkan absorbansi DPPH, yang diukur pada 516 nm, sebesar 50% dari absorbansi awal. Semua percobaan dilakukan dalam rangkap tiga ( n = 3) pada suhu ruangan.
2.3.3 Indeks Elektrokimia
Total polifenol, seperti Indeks Elektrokimia (EI) dan daya antioksidan fenolik yang tinggi diperoleh menggunakan analisis elektrokimia dan protokol penyaringan yang dimodifikasi yang awalnya diusulkan oleh Blasco (Blasco et al. 2005 ). Secara singkat, ekstrak disuntikkan ke dalam sel aliran elektrokimia, menggunakan otomatisasi sistem HPLC, dan arus oksidasi diukur pada 300 mV untuk evaluasi daya antioksidan fenol yang tinggi dan pada +900 mV untuk indeks elektrokimia.
2.3.4 Budidaya Sel
Lini sel fibroblas murine L929 dan manusia BJ ditumbuhkan dalam medium kultur Dulbecco’s Modified Eagle Medium (DMEM) yang dilengkapi dengan 4,5 g/L glukosa, 2 mM l-glutamin, 10% serum sapi fetal, dan penisilin (100 U/mL), streptomisin (100 μg/mL), dalam kondisi terkendali (95% kelembapan, 5% CO 2 , 37°C). Sub-kultivasi dilakukan dalam labu kultur sel (T 25) dan ketika sel mencapai pra-konfluensi ~80%, sel-sel dilepaskan menggunakan larutan tripsin dengan konsentrasi 0,25%. Kecuali dinyatakan lain, sel-sel L929 dihitung dan disemai dalam pelat 96 sumur dengan kepadatan 10.000 sel/sumur, dan sel-sel BJ disemai dengan kepadatan 4000 sel/sumur.
2.3.5 Uji Viabilitas Sel dan ROS Intraseluler
Kit viabilitas sel MTS merupakan pengujian lengkap dan optimal yang menghasilkan deteksi kolorimetrik yang konsisten terhadap sel mamalia yang viabilitas. Efek ekstrak tanaman, pada berbagai kondisi eksperimen (lihat Bagian 2.3.4 ), terhadap viabilitas sel ditentukan setelah inkubasi 24 jam dengan mengukur absorbansi pada 490 nm menggunakan pembaca mikroplat. Semua sampel dijalankan dalam rangkap tiga dalam pengujian yang sama.
Total ROS yang dihasilkan oleh sel setelah inkubasi 24 jam dengan agonis stres oksidatif dievaluasi menggunakan uji H 2 DCFDA. Uji ini didasarkan pada konversi 2′,7′-diklorofluorescin diacetate (DCFH-DA) yang tidak berfluoresensi menjadi 2′,7′-diklorofluorescein (DCF) yang sangat berfluoresensi dengan adanya ROS. 2′,7′-diklorodihidrofluorescein diacetate memasuki sel, tempat ROS intraseluler hadir, dan membelah gugus asetat, melepaskan molekul berfluoresensi 2′,7′-diklorofluorescein. Fluoresensi diukur pada 520 nm, dan semua sampel dijalankan sebanyak tiga kali. Untuk evaluasi ROS total, penyemaian dilakukan dalam pelat 96 sumur pada kepadatan 7000 sel/sumur untuk sel murine dan pada kepadatan 4000 sel/sumur untuk sel manusia dan diinkubasi selama 24 jam dalam kondisi tertentu (kelembapan 95%, CO 2 5% , 37°C). Selanjutnya, kultur sel dikenai ekstrak tanaman selama 24 jam dan diobati dengan agonis stres oksidatif, TNF-alfa (50 ng/mL) dan LPS (50 ng/mL) selama 24 jam. Perlakuan serupa dilakukan pada lini sel manusia untuk evaluasi ROS, sel BJ ditanam dalam pelat 96 sumur pada kepadatan 4000 sel/sumur dan diinkubasi selama 24 jam dalam kondisi tertentu, dikenai ekstrak tanaman selama 24 jam lagi, dan akhirnya diperlakukan dengan agonis stres, TNF-alfa (50 ng/mL) dan LPS (50 ng/mL) selama 40 menit. Untuk uji MTS, setelah inkubasi 24 jam, quercetin dan ekstrak tanaman pada konsentrasi EC 50 ditambahkan ke pelat sel dan diinkubasi selama 24 jam lagi. Analisis statistik dilakukan menggunakan ANOVA satu arah, diikuti oleh uji post hoc Tukey, dengan p < 0,05 dianggap signifikan secara statistik.
3 Hasil
Kapasitas antioksidan, berdasarkan radikal DPPH dan uji Indeks Elektrokimia (EI), serta efek in vitro pada kultur sel, dari beberapa ekstrak dedaunan yang dapat dimakan diselidiki menggunakan UV–Vis, spektroskopi fluoresensi, mikroskopi, dan amperometri.
3.1 Evaluasi Kapasitas Antioksidan dengan Uji DPPH
Uji DPPH merupakan metode yang banyak digunakan untuk mengevaluasi kapasitas antioksidan senyawa, khususnya ekstrak tanaman dan produk alami. DPPH merupakan senyawa radikal bebas yang stabil dengan warna ungu tua dalam bentuk radikalnya. Ketika zat antioksidan ditambahkan ke larutan DPPH, zat tersebut bereaksi dengan radikal DPPH dengan menyumbangkan atom hidrogen atau elektron. Reaksi ini menghasilkan reduksi radikal DPPH, yang menyebabkan perubahan warna dari ungu menjadi kuning, yang dapat diukur secara spektrofotometri.
Evaluasi spektrofotometri kapasitas antioksidan dilakukan dengan mengukur penyerapan DPPH pada 520 nm dan mengkorelasikan penurunan absorbansi maksimum dengan adanya ekstrak dengan kapasitas antioksidan. Setengah konsentrasi efektif maksimum (EC 50 ) dari setiap ekstrak dan quercetin sebagai standar dihitung sebagai nilai konsentrasi yang menginduksi penurunan absorbansi maksimum radikal DPPH sebesar 50%, yaitu netralisasi setengah jumlah radikal. Metode spektrofotometri ini memungkinkan tidak hanya perbandingan kapasitas antioksidan dalam ekstrak yang berbeda tetapi juga menyatakan kapasitas sebagai ekuivalen standar.
Untuk semua percobaan, waktu interaksi adalah 5 menit dan diamati bahwa dengan meningkatnya konsentrasi quercetin, dari 3 hingga 83 μM, terjadi penurunan dan hilangnya absorbansi maksimum DPPH, Gambar 1A . Penurunan absorbansi maksimum radikal DPPH dapat dinyatakan sebagai aktivitas pembersihan radikal, Gambar 1A -insert, dan dari ketergantungan linier aktivitas pembersihan dengan konsentrasi quercetin, EC50 = 5,48 μM untuk quercetin dihitung, mendekati nilai teoritis dan nilai eksperimental yang dilaporkan (Chen et al. 2013 ).
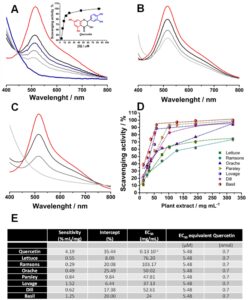
Mirip dengan quercetin, ekstrak tanaman menunjukkan perilaku yang sama, yaitu penurunan absorbansi maksimum DPPH seiring dengan peningkatan konsentrasi. Namun, penurunan tersebut bervariasi dari satu ekstrak ke ekstrak lainnya, Gambar 1B ,C , dan dengan memetakan aktivitas pemulung vs. konsentrasi ekstrak, Gambar 1D , nilai EC50 dihitung, Gambar 1E .
Nilai EC 50 terendah , yaitu kapasitas antioksidan tertinggi, diperoleh pada tanaman aromatik kemangi dan lovage, sedangkan nilai tertinggi diperoleh pada ramson. Meskipun demikian, nilai EC 50 berada di antara 20 dan 100 mg/mL, yang berarti bahwa kurang dari 100 mg daun segar memiliki daya antioksidan yang sama dengan 5,48 μM quercetin, Gambar 1E .
3.2 Indeks Elektrokimia
Metode elektrokimia merupakan teknik yang sangat sesuai, kompatibel dengan evaluasi dan kuantifikasi daya antioksidan berbagai sistem, dan seiring waktu beberapa metode dikembangkan, yang paling umum adalah Indeks Elektrokimia (EI) (Blasco et al. 2005 ). Prinsip metode ini didasarkan pada kuantifikasi arus oksidasi elektrokimia gugus fenolik, yaitu katekol, fenol, dan resorsinol, pada potensial tinggi; potensial kerja harus di atas potensial oksidasi resorsinol. Pada potensial oksidasi fenol, daya antioksidan fenolik antara diperoleh, sedangkan pada potensial oksidasi rendah, tempat berlangsungnya oksidasi gugus katekol, daya antioksidan fenolik yang tinggi dapat diperkirakan.
Sementara beberapa turunan metode ini menggunakan jumlah rasio arus dan potensial oksidasi (Lino et al. 2014 ), dalam sampel yang mengandung lebih banyak spesies redoks atau ketika spesies kimia menunjukkan beberapa puncak, area terintegrasi di bawah puncak oksidasi dianggap sebagai estimasi yang lebih komprehensif dari jumlah total elektron yang dipertukarkan (Chevion et al. 2000 ; Schilder et al. 2020 ; Haque et al. 2021 ).
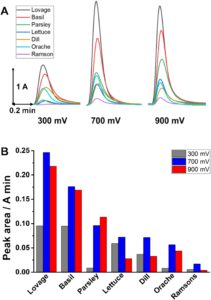
Dengan menggunakan detektor elektrokimia yang dibantu oleh sistem injeksi peralatan HPLC, puncak oksidasi semua ekstrak diperoleh pada 300, 700, dan 900 mV, dan EI diperkirakan. Dengan demikian, daya antioksidan ekstrak dapat diklasifikasikan ke dalam tiga kategori di mana lovage dan basil adalah yang paling kuat, diikuti oleh peterseli, selada, dill, dan orache, sedangkan nilai terendah diperoleh untuk ramson, Gambar 2. Perlu disebutkan bahwa untuk semua ekstrak, muatan terukur pada 700 dan 900 mV menunjukkan nilai yang sama, fenomena umum yang terjadi dalam matriks kompleks.
3.3 Evaluasi In Vitro
Karena EC 50 memungkinkan perbandingan kapasitas antioksidan dalam ekstrak berbeda yang terkait dengan padanan standar, yaitu quercetin, uji viabilitas sel MTS dilakukan untuk mengevaluasi biokompatibilitas ekstrak tanaman fenolik terhadap fibroblas BJ dan L929 pada konsentrasi EC 50 , Gambar 3A .
Viabilitas sel mengacu pada jumlah sel sehat dan fungsional fisiologis yang terkurung dalam sampel kerja biologis, dan mengukur integritas dan fungsionalitas sel yang tepat dalam populasi sel. Viabilitas yang tinggi menunjukkan bahwa mayoritas sel dari sampel hidup dan berfungsi dengan baik dan sebaliknya, viabilitas yang rendah menunjukkan bahwa persentase sel mati dan disfungsional yang tinggi terdapat dalam populasi yang diteliti. Uji garam tetrazolium seperti MTS (3-(4,5-dimetiltiazol-2-il)-5-(3-karboksimetoksifenil)-2-(4-sulfofenil)-2H-tetrazolium) digunakan secara luas untuk menilai viabilitas sel. Uji MTS mengukur aktivitas metabolisme sel, yang merupakan indikator viabilitas sel. Dalam uji MTS, MTS direduksi oleh dehidrogenase mitokondria (aktif dalam sel yang hidup), yang menghasilkan pembentukan produk formazan berwarna. Intensitas produk formazan sebanding dengan jumlah sel yang hidup dan aktif secara metabolik dari kultur yang dievaluasi.
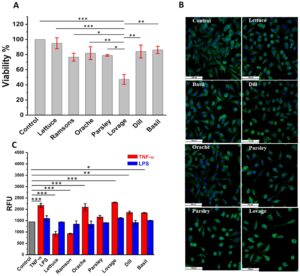
Uji MTS digunakan untuk menganalisis viabilitas lini sel fibroblastik (L929) dan (BJ) setelah interaksinya dengan ekstrak tumbuhan fenolik selada, daun salam, orache, peterseli, lovage, dill, dan basil, pada konsentrasi EC 50 yang ditentukan oleh uji DPPH. Hasil signifikan diperoleh untuk lovage, selada, basil, dan dill, sedangkan ekstrak lovage menunjukkan tingkat toksisitas tertentu, mengurangi viabilitas kultur sel hingga 50% jika dibandingkan dengan kontrol. Viabilitas sel L929 yang diobati dengan selada, basil, dan dill menunjukkan viabilitas lebih dari 90% dibandingkan dengan kontrol, dan daun salam, orache, dan peterseli menunjukkan viabilitas lebih dari 80%. Enam ekstrak yang dianalisis, kecuali lovage, menunjukkan viabilitas lebih dari 90% terhadap kontrol dalam kasus garis sel BJ, yang semuanya menunjukkan tingkat non-toksisitas yang tinggi untuk sebagian besar ekstrak, Gambar 3A dan 4A
.Berdasarkan indeks elektrokimia dan hasil viabilitas sel, ekstrak tersebut dikenakan mikroskopi fluoresensi untuk menyelidiki interaksinya dengan sel fibroblas L929 secara komplementer. Interaksi ekstrak selada, kemangi, dill, orache, peterseli, dan ramson dengan sel L929 menunjukkan viabilitas dan morfologi yang mirip dengan kontrol, dan tidak ada efek berbahaya yang diamati. Interaksi antara ekstrak lovage dan sel menunjukkan toksisitas tinggi terhadap kultur sel, yang ditandai dengan penurunan jumlah sel dibandingkan dengan kontrol.
Selain aspek viabilitas yang jelas, beberapa catatan panjang dapat diberikan terkait karakteristik morfologi sel yang diobati. Sel fibroblastik dewasa memiliki morfologi berbentuk gelendong atau memanjang yang jelas dan badan sel relatif lebih besar daripada nukleus. Nukleus sel fibroblastik dewasa biasanya tunggal, terletak di tengah, dan relatif kecil dibandingkan dengan ukuran sel. Nukleus sering kali tampak memanjang dan dapat berbentuk halus dan membulat. Sebaliknya, fibroblas muda dapat memiliki morfologi yang lebih membulat atau kurang memanjang dibandingkan dengan sel fibroblastik dewasa. Fibroblas muda mungkin tampak lebih kecil dan kurang berbentuk gelendong. Nukleus pada fibroblas muda mungkin lebih besar dan kurang memanjang dibandingkan pada fibrosit dewasa, dan mungkin memiliki bentuk yang lebih tidak teratur. Karakteristik morfologi fibroblas dewasa memungkinkan mereka untuk menjalankan fungsi esensialnya dalam mempertahankan struktur jaringan, memperbaiki cedera, dan mensintesis matriks ekstraseluler, komponen yang diperlukan untuk integritas jaringan. Fibroblas muda, pada gilirannya, secara morfologis belum berkembang, memiliki aktivitas fisiologis yang sangat rendah (Chong et al. 2019 ; Cooper 2019 ). Dapat diamati pada Gambar 3B bahwa sebagian besar sel menunjukkan karakteristik morfologis fibroblas dewasa yang aktif, kecuali yang diinkubasi dengan ekstrak lovage yang menunjukkan sejumlah besar sel tidak aktif dalam hubungan dengan jumlah total selnya dan dibandingkan dengan kontrol.
Berdasarkan uji fluoresensi—H2DCFDA, tingkat ROS yang ada dalam sel diukur secara spektrofotometri dan dikaitkan dengan stres oksidatif yang diinduksi oleh sitokin TNF-α dan oleh molekul membran bakteri Gram-negatif terluar—agonis LPS yang memicu reaksi inflamasi kuat terhadap sel fibroblastik L929. Hasil pengujian ini mengungkapkan bahwa, TNF-α menginduksi stres oksidatif 30% dan LPS 10% lebih banyak pada sel L929 dibandingkan dengan metabolisme basal dan, secara luar biasa, ekstrak fenolik selada dan ramson menunjukkan kemampuan untuk mengurangi stres oksidatif lebih dari 50% sebagai respons terhadap TNF-α, menurunkan ROS hingga 25% dalam metabolisme basal, Gambar 3C . Peterseli, adas, dan kemangi memiliki efektivitas 20% dalam menetralkan radikal bebas yang diinduksi oleh TNF-α, sementara orache dan lovage, sebaliknya, tidak memiliki efek dalam mengurangi stres seluler yang diproduksi oleh TNF-α. Jumlah radikal bebas yang diinduksi oleh LPS diturunkan ke tingkat metabolisme basal oleh selada, ramson, orache, peterseli, dill, dan basil; hanya lovage yang 10% lebih tinggi dari metabolisme basal tingkat ROS sel, Gambar 3C .
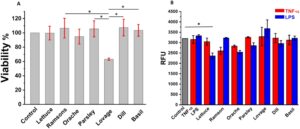
Dengan mempertimbangkan perbedaan metabolik antara sel murine dan sel manusia, uji viabilitas (MTS) dan fluoresensi (H2DCFDA) dilakukan pada lini sel fibroblas manusia BJ. Namun, mengingat bahwa pengobatan TNF-α dan LPS dapat menginduksi produksi ROS cukup cepat dalam 15–30 menit pasca-pengobatan (Hsu dan Wen 2002 ), waktu inkubasi dengan antagonis ROS dikurangi menjadi 40 menit. Mirip dengan fibroblas L929, uji viabilitas yang dilakukan pada lini sel BJ setelah 24 jam inkubasi dengan ekstrak tanaman pada konsentrasi EC 50 , yang ditentukan oleh uji DPPH, menunjukkan bahwa ekstrak lovage menurunkan viabilitas sel hingga 40%. Sebaliknya, beberapa ekstrak, seperti ramson, peterseli, dan dill, menghasilkan nilai viabilitas sedikit di atas kontrol, dan selada dan orache menunjukkan nilai yang mirip dengan kontrol, Gambar 4A .
Hasil ROS yang diinduksi secara kimia pada sel BJ mengungkapkan bahwa baik TNF-α maupun LPS tidak menginduksi stres oksidatif yang lebih tinggi secara signifikan dibandingkan dengan metabolisme basal. Ini menunjukkan bahwa sel BJ memiliki keseimbangan redoks yang relatif stabil dalam kondisi ini atau memiliki mekanisme antioksidan endogen yang efisien yang melawan produksi ROS. Namun, seperti yang ditunjukkan pada Gambar 4B , pasca-perawatan dengan ekstrak tanaman tertentu, sebelum antagonis ROS, menyebabkan penurunan kadar ROS yang diinduksi oleh TNF-α atau LPS, sehingga berada di bawah kadar kontrol. Ini menunjukkan bahwa senyawa bioaktif antioksidan dari ekstrak ini mampu memodulasi respons stres oksidatif pada sel BJ. Mirip dengan hasil yang diperoleh untuk fibroblas L929, perawatan dengan ekstrak lovage menghasilkan peningkatan yang nyata dalam produksi ROS total. Mempertimbangkan hasil uji viabilitas, efek ini dapat dijelaskan oleh interaksi kompleks antara aktivitas antioksidan lovage yang tinggi dan potensi perilaku pro-oksidannya dalam kondisi tertentu. Lovage diketahui mengandung flavonoid dan polifenol dalam jumlah yang signifikan, khususnya quercetin—molekul antioksidan dengan khasiat kemoterapi yang terdokumentasi dengan baik (Szparaga et al. 2023 ). Quercetin telah terbukti memberikan efek antioksidan dan pro-oksidan tergantung pada konsentrasinya, lingkungan seluler, dan interaksinya dengan biomolekul lain. Khususnya, quercetin hadir dalam jumlah besar dalam lovage, seperti yang dilaporkan dalam basis data Phenol-Explorer (Justesen dan Knuthsen 2001b ). Peningkatan produksi ROS yang diamati setelah perawatan lovage mungkin disebabkan oleh kemampuan quercetin untuk bertindak sebagai senyawa aktif redoks, yang secara paradoks dapat meningkatkan pembentukan ROS dalam kondisi tertentu, yang pada akhirnya memengaruhi viabilitas sel.
4 Diskusi
Lebih dari 15 tahun yang lalu, pada tahun 2006, Otoritas Keamanan Pangan Eropa (EFSA) menguraikan “Pendapat Ilmiah tentang pembuktian klaim kesehatan yang terkait dengan berbagai makanan/komponen makanan dan perlindungan sel dari penuaan dini, aktivitas antioksidan, kandungan antioksidan dan sifat antioksidan, perlindungan DNA dan perlindungan protein dan lipid dari kerusakan oksidatif” (Panel dan Nda 2023 ), dalam rangka mendukung “Peraturan (EC) No 1924/2006 parlemen Eropa dan dewan, tanggal 20 Desember 2006, tentang klaim nutrisi dan kesehatan yang dibuat pada makanan” yang secara khusus ditujukan pada pelabelan makanan (Zicari et al. 2007 ).
Pendapat Ilmiah ditujukan pada penggunaan istilah “aktivitas antioksidan” dan “sifat antioksidan”, dalam kaitannya dengan unsur-unsur makanan. Pendapat ini juga membahas kaitan istilah-istilah yang disebutkan dengan pencegahan penuaan dini sel, aktivitas antioksidan, kandungan antioksidan, dan perlindungan DNA, protein, dan lipid dari kerusakan oksidatif. Populasi sasaran diasumsikan sebagai populasi umum.
Panel menemukan tidak ada penelitian in vivo maupun klinis yang membuktikan fakta bahwa aktivitas/kandungan antioksidan dan/atau sifat antioksidan mempunyai dampak fisiologis yang menguntungkan dan berdasarkan data yang tersedia saat itu, menyimpulkan bahwa tidak ada hubungan sebab akibat yang dapat ditetapkan antara konsumsi bahan makanan yang dievaluasi dan dampak fisiologis positif apa pun yang terkait dengan aktivitas antioksidan, kandungan antioksidan, sifat antioksidan, atau perlindungan sel dari penuaan dini.
Mengenai dampak yang berkaitan dengan perlindungan sel dan biomolekul seperti lipid, protein, atau DNA dari kerusakan oksidatif, termasuk kerusakan yang disebabkan oleh radiasi UV pada populasi target yang dituju, Panel mempertimbangkan kemungkinan bahwa mungkin memang ada dampak fisiologis yang menguntungkan. Meski begitu, setelah evaluasi lebih lanjut berdasarkan data yang tersedia, diketahui bahwa bukti yang disajikan dari penelitian hewan dan in vitro tidak cukup untuk memprediksi apakah makanan/komponen makanan akan memiliki dampak pada perlindungan sel dan molekul tubuh, seperti DNA, protein, dan lipid, dari kerusakan oksidatif pada manusia.
Perlu disebutkan bahwa hasil yang dikembalikan oleh basis data Web of Science untuk tahun 1996–2006, untuk kata kunci “antioksidan”, “ekstrak tanaman”, “studi klinis”, dan “uji klinis” mengembalikan 20 artikel, sedangkan hasil dari tahun 2006 hingga Januari 2024, mengembalikan 1.047 hasil, yang mana artikel tinjauan mewakili jumlah yang cukup besar, Gambar 5 .
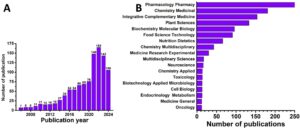
Meskipun, dalam 5 tahun terakhir, ada peningkatan upaya investigasi dan banyaknya bukti tentang manfaat antioksidan tanaman, rekomendasi EFSA tentang tindakan pencegahan pada pelabelan harus tetap berlaku. Banyak antioksidan tanaman memiliki efek terapeutik, tetapi penyalahgunaan dapat menyebabkan efek yang tidak diinginkan (Vafadar et al. 2020 ).
Dalam penelitian ini, ditunjukkan bahwa ekstrak lovage, dengan kapasitas antioksidan yang sama seperti selada, mengurangi viabilitas dalam lini sel fibroblas tikus dan manusia hingga 50%, fakta yang dapat dijelaskan melalui kandungan quercetin yang tinggi, biomolekul yang digunakan sebagai terapi kanker untuk menghancurkan sel-sel ganas. Secara keseluruhan, tanaman hijau yang diteliti dalam artikel ini menunjukkan aktivitas antioksidan yang tinggi, sitotoksisitas yang rendah, dan sifat-sifat yang bermanfaat bagi sel-sel yang mengalami stres oksidatif yang disebabkan oleh LPS bakteri atau oleh sitokin TNF-α.
Dengan mempertimbangkan nilai EC 50 untuk setiap ekstrak tumbuhan yang dihitung menggunakan uji DPPH, konsentrasi DPPH sebesar 100 μM, dan volume kerja sebesar 130 μL, campuran salad yang terdiri dari selada, ramson, orache, dan herba aromatik seperti peterseli, kemangi, dan dill memiliki kemampuan untuk menetralkan sejumlah total 150 μmol radikal bebas, Tabel 2 .
| A | B | C | D | Bahasa Inggris | F |
|---|---|---|---|---|---|
| EC50 (mg/ml) | dalam 130 μL | Campuran salad (g) | Potensial reaktif (μmol) | ||
| Tanaman (mg) | Nilai pemulung DPPH (nmol) | ||||
| Selada | 76.2 | 9.9 | 6.5 | 100 | 65.6 |
| Ramson | 103.17 | 13.4 | 6.5 | 30 | 14.5 |
| Orakel | 50.02 | 6.5 | 6.5 | 50 | 50 |
| Peterseli | 47.81 | 6.2 | 6.5 | 5 | 5.2 |
| Kemangi | 24 | 3.12 | 6.5 | 5 | 10.4 |
| Dil | 52.61 | 6.8 | 6.5 | 5 | 4.7 |
| Total | 150.5 | ||||
Jumlah radikal bebas ini mungkin setara dengan 40 menit latihan ergometer lengan progresif, latihan pendahuluan yang dilakukan oleh perenang ahli sebelum sesi latihan renang. (Mrakic-Sposta et al. 2015 ). Faktanya, menurunkan tingkat ROS basal dengan mengurangi produksi ROS adalah yang pertama (a) dari ABC redoks (Li 2013 ) dan dapat dicapai baik melalui latihan teratur atau/dan dengan memiliki pola makan yang sehat dan seimbang. Lebih jauh lagi, salad lauk seperti yang diusulkan dalam Tabel 2 (kolom E) mungkin juga memiliki potensi untuk melawan produksi radikal bebas yang dihasilkan dari hidrokarbon aromatik polisiklik (PAH) setelah makan yang melibatkan metabolisme pencernaan daging panggang (Wang et al. 2019 ; Sampaio et al. 2021 ).
5 Kesimpulan
Dengan menggunakan metode metanol yang diasamkan dengan ultrasonik, kandungan polifenol dari beberapa sayuran hijau yang dapat dimakan diekstraksi dan aktivitas penangkal radikal, serta total kapasitas antioksidan, dievaluasi melalui spektroskopi UV–Vis dan elektrokimia.
Evaluasi spektrofotometri kapasitas antioksidan dilakukan dengan uji DPPH, mengukur penyerapan pada 520 nm, dan setengah konsentrasi efektif maksimum (EC 50 ) dari setiap ekstrak dihitung sebagai nilai konsentrasi yang menghasilkan penurunan 50% dari absorbansi maksimum radikal DPPH, yaitu, netralisasi setengah jumlah radikal. Selain itu, kapasitas antioksidan ekstrak dievaluasi menggunakan amperometri pada potensial tetap; 0,3 V (vs. Ag/AgCl) dipilih untuk evaluasi kandungan antioksidan tinggi dan 0,7 V untuk estimasi fraksi antioksidan total. Hasil amperometri sesuai dengan nilai EC 50 ; nilai EC 50 terendah diperoleh untuk puncak oksidasi arus tertinggi.
Berdasarkan hasil ini, ekstrak tanaman, pada konsentrasi nilai EC 50 , dinilai dalam kultur sel fibroblas L929 dan BJ, mengukur viabilitas dan efek perlindungan ekstrak tanaman terhadap stres oksidatif yang disebabkan oleh LPS dan TNF-α. Hasil signifikan telah dicapai dalam kasus selada dan ramson, yang dibandingkan dengan metabolisme basal seluler menurun dengan ~ 25% tingkat radikal bebas yang diproduksi oleh sel murine dan dengan 20% masing-masing 15%, tingkat radikal bebas yang diproduksi oleh sel manusia setelah mereka mengalami stres dengan LPS dan TNF-α. Akhirnya, salad ~ 200 g dengan kapasitas antioksidan ~ 150 μmol diusulkan menggunakan 6 tanaman yang dianalisis.

