
ABSTRAK
Dendrobium officinale dari Guangnan disaring tanpa target menggunakan UHPLC–Orbitrap-MS untuk tahun pertumbuhan yang berbeda. OPLS-DA secara efektif membedakan D. officinale berdasarkan tahun pertumbuhan, mengidentifikasi 70 senyawa yang berbeda. Delapan alkaloid indol diketopiperazine tidak berbeda secara signifikan di antara tahun pertumbuhan. Senyawa diferensial D. officinale dengan pertumbuhan 4 tahun lebih jelas dari tahun-tahun lainnya, dengan 10 senyawa menunjukkan variabilitas yang lebih besar. Jalur dalam kanker, jalur metabolisme kanker, jalur metabolisme, karsinogenesis kimia—aktivasi reseptor lebih diperkaya. Hal ini menunjukkan bahwa senyawa fungsional D. officinale memiliki aktivitas farmakologis di area ini dan dapat mengatur proses metabolisme lipid dan aterosklerosis.
1 Pendahuluan
Guangnan Dendrobium officinale , yang tumbuh di Kabupaten Guangnan, Provinsi Yunnan, Tiongkok, merupakan produk indikasi geografis nasional Tiongkok. Guangnan D. officinale memiliki aktivitas antitumor, antioksidan, dan aktivitas fungsional bio-kesehatan lainnya yang baik karena tumbuh di daerah dataran tinggi dan lintang rendah di Provinsi Yunnan, Tiongkok. Pada bulan November 2023, Guangnan D. officinale dimasukkan ke dalam daftar zat yang secara tradisional digunakan sebagai makanan dan obat-obatan Tiongkok di Tiongkok, yang berarti bahwa Guangnan D. officinale dapat digunakan sebagai bahan makanan untuk memanfaatkan sepenuhnya manfaat kesehatannya yang lebih baik.
Flavonoid merupakan salah satu bahan aktif utama dalam Dendrobium , dengan fungsi meliputi antitumor (Liu et al. 2023 ; Zhao et al. 2004, 2021 ), hipoglikemik (Lv et al. 2023 ; Peng et al. 2023 ), antiinflamasi (Wang 2021 ), antioksidan (Luo et al. 2023 ), dan sifat pengaturan imun (Liang et al. 2019 ). Flavonoid secara bertahap telah menjadi senyawa molekul kecil yang signifikan dalam penelitian Dendrobium , kedua setelah polisakarida. Guangnan D. officinale , spesies Dendrobium khas dari Provinsi Yunnan, Tiongkok, mengandung rutin, vicenin Ⅱ, vicenin Ⅰ, schaftoside, isoschaftoside, violanthin, dan isoviolanthin (Luo et al. 2023 ; Zhang et al. 2019 ; Zhou et al. 2018 ). Akan tetapi, akumulasi, metabolisme, dan pola perubahan komponen terkait lainnya, seperti metabolit sekunder seperti alkaloid dan senyawa khas lainnya, hampir tidak pernah dilaporkan.
Dendrobium , sebagai salah satu jenis obat tradisional Tiongkok, memiliki komponen khasiat yang berkaitan erat dengan wilayah dan lingkungan tempat tumbuhnya (Li et al. 2020 ; Liu et al. 2017 ; Pant et al. 2021 ). Spesies yang sama di berbagai daerah dapat memiliki jenis dan kandungan komponen khasiat yang berbeda-beda (LingShang et al. 2009 ; Zhou et al. 2021 ), dan bahkan daerah yang sama dapat menghasilkan komponen khasiat yang berbeda pada tahun yang berbeda (Hu et al. 2021 ; Li et al. 2023 ). Perubahan kandungan dan pola akumulasi senyawa aktif terkait dalam berbagai tahap pertumbuhan Guangnan D. officinale tidak jelas. Oleh karena itu, untuk menyelidiki secara mendalam senyawa-senyawa karakteristik dalam Guangnan D. officinale dan untuk mempelajari akumulasi dan pola perubahannya selama tahun-tahun pertumbuhan yang berbeda, penelitian ini dilakukan dengan menggunakan UHPLC–Orbitrap–MS dan stoikiometri (Cui et al. 2015 ; Ju et al. 2025 ; Zeng et al. 2017 ). Hasilnya menunjukkan bahwa senyawa-senyawa karakteristik dalam Guangnan D. officinale bervariasi sesuai dengan tahun pertumbuhan, sehingga memberikan referensi untuk pengendalian mutu dan budidaya ilmiah.
2 Bahan dan Metode
2.1 Pengumpulan dan Persiapan Sampel
Guangnan D. officinale yang ditanam selama 1, 2, 3, 4, dan 5 tahun dikumpulkan dari Kabupaten Guangnan, Kota Wenshan, Tiongkok, dan 20 sampel D. officinale dari setiap tahun pertumbuhan dikumpulkan. Sampel dikumpulkan pada bulan Desember 2023 dan semua sampel dikumpulkan di pasar grosir lokal, dengan lima batang representatif dengan panjang sekitar 15 cm dipilih untuk setiap sampel, dikeringkan pada suhu 60°C, dihaluskan, disaring melalui saringan sampel berukuran 0,28 μm, dan disimpan pada suhu 4°C, terhindar dari cahaya.
2.2 Bahan Kimia dan Reagen
Asetonitril dan metanol dengan kadar HPLC dibeli dari Merck (Darmstadt, Jerman). Amonium asetat dan asam format dengan kadar HPLC dibeli dari DiKMA Technologies (Beijing, Cina). Air ultramurni disiapkan dari sistem air Elga (Wycombe, Inggris).
2.3 Persiapan dan Analisis Sampel
2.3.1 Metode Persiapan Sampel
Contoh langkah praperlakuan: Secara singkat, 1,0 g bubuk D. officinale ditimbang dengan tepat. Selanjutnya, 5,0 mL larutan metanol 60% ditambahkan, diekstraksi menggunakan gelombang ultrasonik 80 kHz pada suhu 25°C (penangas es) selama 30 menit, dan dilewatkan melalui membran 0,22-μm (0,22 μm) untuk penentuan.
Proses penyiapan sampel untuk percobaan penyaringan nontarget: (a) Penyiapan sampel kosong: Secara singkat, 5 mL larutan metanol 60% diukur ke dalam tabung sentrifus 50 mL sesuai dengan protokol praperlakuan sampel. (b) Penyiapan sampel QC: Di sini, 0,25 g setiap sampel ditimbang dan dicampur dengan baik untuk mendapatkan bubuk sampel QC. Selanjutnya, 1,0 g bubuk sampel QC ditimbang dan disiapkan sesuai dengan protokol praperlakuan sampel (ulangi untuk membuat lima sampel QC). (c) Penyiapan sampel aktual: Secara singkat, 1,0 g bubuk sampel ditimbang dan diekstraksi sesuai dengan praperlakuan sampel.
2.3.2 Metode Analisis Instrumental
Sistem Kromatografi Cair Kinerja Ultra Tinggi–Q Exactive High Resolution Mass Spectrometry (Thermo Fisher Scientific, Rockford, IL, AS) (Framingham, MA, AS) yang dilengkapi dengan kromatografi cair kinerja ultra tinggi HPG-3400RS (Thermo Fisher Scientific) dan ACQUITY UPLC HSS T3 (100 × 2,1 mm, 1,8 μm; Waters, Milford, MA, AS) digunakan. Kromatografi cair dilakukan dalam mode elusi gradien, dengan fase mobil A sebagai 0,1% asam format dalam air dan fase mobil B sebagai asetonitril. Program elusi adalah sebagai berikut: 0–5,5 menit, 2%–8% A, 98%–92% B; 18–20 menit, 60%–90% A, 40%–10% B; dan 20,5–25 menit, 2% A, 98% B. Volume injeksi adalah 1 μL, laju alir adalah 0,2 mL/menit, dan suhu adalah 35°C. Data spektrometri massa diperoleh dalam mode ESI positif dan negatif (tegangan semprot: 3,5 kV, suhu kapiler: 325°C, suhu pemanas probe: 350°C, dan SLens: 50 V). Mode MS/dd-MS2 penuh digunakan. Dalam MS penuh, rentang pemindaian adalah m/z 80–1200; resolusi massa pada 35.000 FWHM; dan target AGC dan IT maksimum masing-masing pada 3,0 e6 dan 100 ms. Untuk dd-MS2, parameter relevan ditetapkan sebagai berikut: resolusi massa: 17.500 FWHM; Target AGC: 1 e5; IT maksimum: 50 ms; jumlah loop: 5; Jumlah MSX: 1; jendela isolasi: 4,0 m/z ; dan energi tumbukan yang dinormalisasi bertahap: 20%, 40%, dan 60%. Tegangan semprotan dalam mode positif dan negatif ditetapkan masing-masing sebesar 3,5 dan 3,0 kV. Laju aliran gas selubung dan gas bantu masing-masing sebesar 45 dan 10 (dalam satuan sembarang). TraceFinder 4.1 EFS dan Compound Discoverer 3.3 digunakan.
2.3.3 Pengolahan Data dan Identifikasi Struktur Senyawa
File data mentah diimpor ke perangkat lunak Compound Discoverer 3.3 untuk penyelarasan puncak, koreksi waktu retensi, dan ekstraksi area puncak. Data yang diekstraksi oleh CD3.3 pertama-tama dikenai identifikasi struktur metabolit dan praproses data, kemudian evaluasi kualitas data eksperimental, dan akhirnya analisis data.
Praproses data mencakup langkah-langkah berikut: (1) penyaringan awal struktur yang diidentifikasi (mempertahankan metabolit dengan deviasi standar relatif < 30% dari luas puncak sampel QC) dan (2) memperoleh metabolit yang dipertahankan dalam basis data dan mengurangi penekanannya, termasuk mode ionik positif dan negatif, dalam urutan prioritas: MzVault > MzCloud > MassLists > ChemSpider. Ketika kadar metabolit sama, yang memiliki skor lebih tinggi dipilih sebagai hasil identifikasi. Untuk proses deduplikasi antara ion positif dan negatif, hasil dengan prioritas lebih tinggi lebih disukai dipertahankan, dan jika hasilnya sama, hasil pola dengan ekspresi tertinggi dipilih.
Analisis data meliputi peta panas, peta gunung berapi, analisis diskriminasi kuadrat parsial ortogonal (OPLS-DA), dan penyaringan metabolit diferensial. Data dinormalisasi dan dikelompokkan untuk analisis peta panas setelah pengelompokan kolom dan pengelompokan baris. Plot gunung berapi dianalisis dengan menggunakan Perubahan Lipatan dan nilai p sebagai koordinat horizontal dan vertikal, masing-masing. Matriks variabel prediktor dan variabel respons dikonfirmasi, dan jumlah komponen utama atau variabel laten yang akan digunakan ditentukan dan setelah koreksi sinyal ortogonal, analisis OPLS-DA dilakukan. Variabel penting dalam proyeksi (VIP) yang diperoleh dari model OPLS-DA dapat digunakan untuk mengukur intensitas pengaruh pola ekspresi setiap metabolit pada klasifikasi setiap kelompok sampel dan untuk mengidentifikasi molekul metabolit diferensial yang signifikan secara biologis. Dalam penelitian saat ini, kriteria penyaringan untuk metabolit diferensial ditetapkan sebagai berikut: VIP > 1 dan p < 0,05 oleh model OPLS-DA.
2.3.4 Analisis Pengayaan Jalur
Target senyawa diprediksi menggunakan perangkat lunak SwissTargetPrediction, dan fungsi target dianalisis dengan analisis pengayaan fungsional Gene Ontology (GO) dan analisis pengayaan jalur pensinyalan Kyoto Encyclopedia of Genes and Genomes (KEGG) menggunakan clusterProfiler. Hasil yang diperoleh disaring dan dianalisis menggunakan p < 0,05 sebagai indikator.
2.3.5 Docking Molekuler
Format SDF dari target inti yang sesuai dengan bahan aktif yang diperoleh dari basis data PubChem diimpor ke ChemDraw 3D. Minimalisasi energi dilakukan menggunakan modul MM2 untuk memperoleh konformasi dominan dengan energi terendah, disimpan sebagai mol2. Konformasi ini kemudian dihidrogenasi oleh AutoDockTools 1.5.7, diisi, akar ligan dideteksi, ikatan yang dapat diputar dicari dan ditentukan, dan disimpan sebagai berkas pdbqt. Struktur 3D dari protein target inti diperoleh dari basis data PDB. Protein dikeringkan, dan molekul kecil dihilangkan menggunakan perangkat lunak PyMOL. Atom hidrogen kemudian ditambahkan, dan muatan Gasteiger dihitung oleh perangkat lunak AutoDockTools 1.5.7. Akhirnya, struktur 3D ditentukan sebagai reseptor dan disimpan sebagai berkas pdbqt. Ligan didok ke reseptor menggunakan perangkat lunak AutoDockTools 1.5.7, dan pola pengikatan dianalisis dan divisualisasikan menggunakan perangkat lunak PyMOL.
3 Hasil
3.1 Identifikasi D. officinale yang Tumbuh pada Tahun yang Berbeda
Dalam mode ion positif dan negatif, 2372 dan 1087 sinyal senyawa dideteksi, masing-masing, yang mana 2214 dan 933 senyawa dikenali sebagai terdeteksi secara valid setelah penyaringan awal dan de-emphasis oleh sampel QC, masing-masing. Untuk 2214 dan 933 senyawa yang dideteksi, OPLS-DA dan PCA dilakukan, dan hasilnya ditunjukkan pada Gambar 1. Ketika PCA digunakan, sampel dengan tahun pertumbuhan yang berbeda dapat dibedakan secara efektif dalam mode ion positif. Namun, untuk senyawa yang diperoleh dalam mode ion negatif, sampel 2, 3, dan 5 tahun menunjukkan fenomena yang lebih teragregasi, dan beberapa sampel pada tahun kelima menunjukkan fenomena offset yang serius. Karena PCA adalah metode reduksi dimensionalitas tanpa pengawasan dan tidak sensitif terhadap variabel dengan korelasi kecil, mungkin tidak secara efektif membedakan sampel dalam percobaan ini, karena semuanya berasal dari asal dan spesies yang sama, hanya berbeda dalam tahun pertumbuhan. Beberapa variabel tidak berbeda secara signifikan satu sama lain. Namun, OPLS-DA menggabungkan sinyal ortogonal dan PLS-DA untuk menyaring variabel yang berbeda, secara efektif mengatasi masalah korelasi kecil dan kesulitan dalam membedakan.
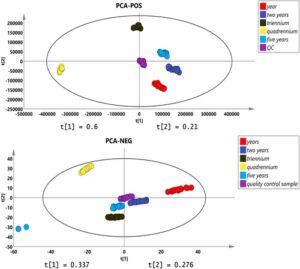
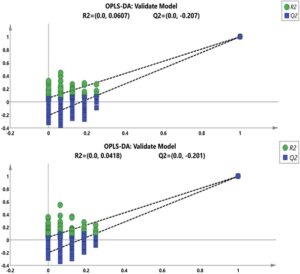
Dalam percobaan ini, penggunaan OPLS-DA dapat secara efektif membedakan D. officinale dengan tahun pertumbuhan yang berbeda, seperti yang ditunjukkan pada Gambar 2. Dalam mode ion positif dan negatif, sampel D. officinale dengan tahun pertumbuhan yang berbeda dapat dibedakan dengan lebih baik. D. officinale dengan pertumbuhan 4 tahun menunjukkan perbedaan yang lebih besar dibandingkan dengan tahun-tahun lainnya. Uji permutasi digunakan untuk memverifikasi keandalan model, menggunakan R2Y dan Q2Y sebagai dasar penilaian. Jika intersep R2Y < 0,3–0,4, intersep Q2Y < 0,05, dan semakin dekat Q2Y ke 1, maka semakin baik modelnya. Pada percobaan ini, hasil uji permutasi berdasarkan 200 uji acak OPLS-DA ini ditunjukkan pada Gambar 3 , di mana intersep R2Y < 0,3, intersep Q2Y < 0,05, dan Q2Y adalah 1, sehingga menunjukkan bahwa model tersebut tidak overfitted dan bahwa model tersebut sangat dapat diprediksi dan diandalkan.
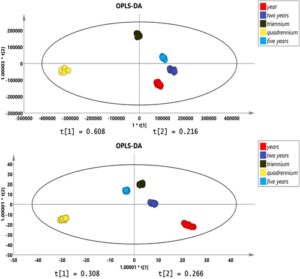
3.2 Penyaringan Senyawa Penanda yang Berbeda
Dalam studi terkini, setelah pencarian dan perbandingan basis data dan mengikuti persyaratan akurasi massa ≤ 5 ppm dalam SANTE/11312/2021 (Diallo et al. 2023 ; Maldonado-Reina et al. 2022 ), total 2040 senyawa diambil dalam mode ion positif dan 826 dalam mode ion negatif menggunakan penyaringan CD 3.3. Namun, informasi strukturalnya memerlukan pembuktian lebih lanjut. Model OPLS-DA mengidentifikasi senyawa dengan VIP > 1 dan p < 0,05, menyaring 29 senyawa penanda berbeda dalam mode ion positif dan 41 dalam mode ion negatif, seperti yang ditunjukkan pada Tabel 1 .
| Puncak | Waktu retensi/menit | Nama komponen | Rumus | pria/wanita | Catatan. DeltaMass [ppm] | Penambahan/pengisian | Referensi |
|---|---|---|---|---|---|---|---|
| 1 | 1.226 | Hidantosidin | C7H10N2O6 | 217.0475 | 4.23 | [M − H] − | Haruyama dkk. ( 1991 ) |
| 2 | 1.848 | Alopurinol | C5H4N4O | 137.0458 | 0.38 | [M + H] + | Peng dan kawan-kawan ( 2016 ) |
| 3 | 2.145 | Leptazolin D | C16H22N2O7 | 355.1496 | -0,99 | [M + H] + | Bhandari Neupane dkk. ( 2019 ) |
| 4 | 2.168 | Asetil -l -karnitin | C9H17NO4 | Nomor telepon 202.1077 | -3,96 | [M − H] − | Nie dan kawan-kawan ( 2021 ) |
| 5 | 3.105 | Leusil-4-hidroksiprolin | C11H20N2O4 | 245.1496 | angka 0 | [M + H] + | Hernandez dkk. ( 2004 ) |
| 6 | 3.117 | Vokissiamida B | C11H17NO4 | 245.1495 | -0,06 | [M + NH4 ] + | Dia dan kawan-kawan ( 2022 ) |
| 7 | 9.067 | 3-(Dimetilamino)-4-hidroksibutil dimetilkarbamat | C9H20N2O3 | 205.1546 | -0,19 | [M + H] + | — |
| 8 | 9.441 | Ac-Glu(OtBu)-OH | C 11 H 19 TIDAK 5 | 246.1336 | 0.19 | [M + H] + | Zhang dkk. ( 2017 ) |
| 9 | 9.516 | Asam 3-( tert -Butoksikarbonil)-2,2-dimetil-1,3-oksazolana-4-karboksilat | C 11 H 19 TIDAK 5 | 244.1188 | -0,87 | [M − H] − | Chattopadhyay dkk. ( 2006 ) |
| 10 | 9.734 | asam 2-[2-{2-( N-tert- butoksikarbonil)aminoetoksi}etoksi]etoksiasetat | C13H25NO7 | 308.1717 | 4.3 | [M + H] + | Adamczyk dan kawan-kawan ( 2002 ) |
| 11 | 9.883 | Isobutil-4-[4-(benziloks)fenil]-2-metil-5-okso-7-fenil-1,4,5,6,7,8-heksahidro-3-kuinolinkarboksilat | C34H35TIDAK4 | 520.2511 | 3.39 | [M − H] − | — |
| 12 | 10.049 | Etil N -[(1-asetamidosiklopentil)karbonil]serinat | C13H22N2O5 | 287.16 | -0,52 | [M + H] + | — |
| 13 | 10.091 | (4 R )-4-[3-oxo-3-(1-piperidinyl)propyl]- l -asam glutamat | C13H22N2O5 | 285.1457 | 0.18 | [M − H] − | Assaf dan kawan-kawan ( 2013 ) |
| 14 | 10.337 | N- (3-hidroksiheksanoil)-homoserin lakton | C10H17NO4 | 216.1229 | -0,49 | [M + H] + | Ortori dkk. ( 2011 ) |
| 15 | 10.884 | l -leucyl- l- prolinamide ( l-prolinamida) | C11H21N3O2 | 228.1705 | -0,56 | [M + H] + | Brunetti dkk. ( 2013 ) |
| 16 | 11.272 | Fomolida D | C12H20O5 | 243.1236 | -0,76 | [M − H] − | Li dan kawan-kawan ( 2010 ) |
| 17 | 11.653 | 1- O -sinapoyl-beta- d -glukosa | C17H22O10 | 385.1141 | 0.19 | [M − H] − | Offor dan kawan-kawan ( 2022 ) |
| 18 | 12.394 | 3,3-Dimetilheksahidroimidazo[1,5-a]irazin-1(5H)-satu | C8H15N3O | 170.1286 | -1,23 | [M + H] + | — |
| 19 | 12.422 | Kloriolida | C12H18O4 | 225.1128 | -2.11 | [M − H] − | Ostermeier dan Schobert ( 2014 ) |
| 20 | 12.734 | Quercetin 3-robinobiosida | C27H30O16 | 611.1602 | -0,81 | [M + H] + | Jaramillo dkk. ( 2011 ) |
| 21 | 12.812 | 2,2′-(Fenilimino)dietanol | C10H15NO2 | 182.1174 | -0,8 | [M + H] + | Bulan dkk. ( 1996 ) |
| 22 | 12.949 | Geralcin D | C15H22N2O6 | 327.1547 | -1,09 | [M + H] + | Le Goff dan kawan-kawan ( 2013 ) |
| 23 | 12.986 | Perennipin B | C21H26O9 | 421.1507 | 0.8 | [M − H] − | Kim dan kawan-kawan ( 2019 ) |
| 24 | 13.127 | Afalanin | C11H13TIDAK3 | Nomor telepon 206.0815 | -3,91 | [M − H] − | Tawfike dkk. ( 2018 ) |
| 25 | 13.275 | asam 2-{2-[(2-etilheksil)oksi]-2-okso etil}-2-hidroksi suksinat | C14H24O7 | 303.145 | 0,15 | [M − H] − | — |
| 26 | 13.595 | Rhoifolin | C27H30O14 | 579.1704 | -0,76 | [M + H] + | Refaat dkk. ( 2015 ) |
| 27 | 13.999 | Bahasa Lotaustralin | C 11 H 19 TIDAK 6 | 260.1138 | -0,62 | [M − H] − | Opala dkk. ( 2013 ) |
| 28 | 14.334 | 2-[( E )-(hidroksiimino)metil]-3-metil-1-(2-nitroetil)-1H-imidazol-3-ium | C7H11N4O3 | 198.0761 | 1.35 | [M − H] − | — |
| 29 | 14.339 | Swertisin 6‴- O- feruloyl 2″- O -glukosida | C29H32O15 | 619.1646 | -3,58 | [M − H] − | Becchi dan Fraisse ( 1989 ) |
| 30 | 14.833 | 1,7-Hidroksi-3-metilxanton | C14H10O3 | 227.07 | -1,25 | [M + H] + | Fujimoto dkk. ( 1998 ) |
| 31 | 14.921 | 3-Sikloheksilpropil 1-[metoksi(okso)asetil]-2-piperidin karboksilat | C 18 H 29 TIDAK 5 | 338.1974 | 0.18 | [M − H] − | — |
| 32 | 14.926 | Isomukronulatol 7 -O- glukosa | C23H28O10 | 463.161 | 0.13 | [M − H] − | Yoo dan kawan-kawan ( 2021 ) |
| 33 | 15.083 | Flutimida | C12H18N2O3 | 237.124 | -2.11 | [M − H] − | Hensens dan kawan-kawan ( 1995 ) |
| 34 | 15.601 | Endofenazin E | C19H18N2O6 | 369.1091 | -0,38 | [M − H] − | Wu dan kawan-kawan ( 2016 ) |
| 35 | 15.677 | Fomoksidiena C | C14H14O3 | 229.0864 | -2,75 | [M − H] − | Zhang dkk. ( 2021 ) |
| 36 | 15.925 | Variecolorin C | C24H29N3O3 | 408.2275 | -1,59 | [M + H] + | Wang dkk. ( 2007 ) |
| 37 | 16.069 | Nigirpeksin D | C15H20O6 | 295.1182 | -1,67 | [M − H] − | Zhou dan kawan-kawan ( 2018 ) |
| 38 | tanggal 16.09 | (2S,3R,5S)-(−)-2,3-dihidroksitetradekan-5-olida | C14H26O4 | 257.1756 | -0,8 | [M − H] − | Toshima dan kawan-kawan ( 1999 ) |
| 39 | 16.109 | 1-(2,4-Dihidroksifenil)-3-hidroksi-3-(4′-hidroksifenil)-1-propanon | C15H14O5 | 273.0768 | -0,08 | [M − H] − | Rafi dkk. ( 2002 ) |
| 40 | 16.111 | UCS1025B | C 20 H 25 TIDAK 6 | 374.1607 | -0,47 | [M − H] − | Agatsuma dkk. ( 2002 ) |
| 41 | 16.221 | ( E )-2-metoksi-1,4 naftokuinon-1-oksim | C11H9NO3 | Nomor telepon 202.0501 | -4,36 | [M − H] − | Zhang dkk. ( 2013 ) |
| 42 | 16.401 | YF-0200R-B | C12H20O5 | 244.1300 | -2,38 | [M − H] − | Wang dkk. ( 2016 ) |
| 43 | 16.407 | 1,2-Dihidro-5-hidroksi-2-(1-hidroksi-1-metiletil)-4-(isobutyryl)-6-fenilfurano [2,3-h] [1] benzopiran-8-on | C24H24O6 | 407.1498 | -0,43 | [M − H] − | Zhou dan kawan-kawan ( 2022 ) |
| 44 | 16.422 | Berbagai warna O | C19H21N3O3 | 340.1649 | -1,85 | [M + H] + | Chen dan kawan-kawan ( 2023 ) |
| 45 | 16.823 | Dikotosin | C23H28O9 | 447.1659 | -0,39 | [M − H] − | Ghosal dan kawan-kawan ( 1985 ) |
| 46 | 16.851 | Diorsinol H | C15H14O4 | 257.0817 | -1,03 | [M − H] − | Li dan kawan-kawan ( 2015 ) |
| 47 | 16.879 | LMA-P1 | C14H24O4 | 255.1599 | -1,02 | [M − H] − | Adelin dan kawan-kawan ( 2011 ) |
| 48 | 16.911 | Trimetil 1,2,8-oktanetikarboksilat | C14H24O6 | 287.1499 | -0,33 | [M − H] − | Ballini dan Bosica ( 1996 ) |
| 49 | 17.294 | Aspertetranon D | C22H28O9 | 435.1661 | 0,07 | [M − H] − | Wang dkk. ( 2015 ) |
| 50 | 17.315 | Dihidroneokinulin B | C19H21N3O2 | 324.17 | -1,99 | [M + H] + | Gao dan kawan-kawan ( 2013 ) |
| 51 | 17.315 | 2-(5-Nitro-2-piridinil)-1,2,3,4-tetrahidroisokuinolin | C14H13N3O2 | 256.1075 | -2,16 | [M + H] + | Andrew Hedley dan Stanforth ( 1992 ) |
| 52 | 17.315 | Neokinulin B | C19H19N3O2 | 322.1546 | -1,17 | [M + H] + | Wohlgemuth dan kawan-kawan ( 2017 ) |
| 53 | 17.573 | Okanin 3,4,3′-trimetil eter 4′-glukosa | C24H28O11 | 491.1559 | -0,06 | [M − H] − | Piispanen dan kawan-kawan ( 2023 ) |
| 54 | 17.659 | Asam 2-[Metil-(3-fenilpropionil)amino]-benzoat | C17H17NO3 | 282.1134 | -0,52 | [M − H] − | Farooq Biabani dkk. ( 1998 ) |
| 55 | 18.189 | 4-(2,5-Dimetoksifenil)-1-(4-etilfenil)-4,7-dihidrofuro[3,4-b]piridina-2,5(1H,3H)-dion | C 23 H 23 TIDAK 5 | 392.1503 | -0,07 | [M − H] − | — |
| 56 | 18.218 | UCS1025A | C 20 H 25 TIDAK 5 | 358.1659 | -0,26 | [M − H] − | Nakai dkk. ( 2000 ) |
| 57 | 18.408 | Citreoviripiron B | C14H16O3 | Nomor telepon 231.1021 | -2,4 | [M − H] − | Asai dkk. ( 2013 ) |
| 58 | 20.246 | Talathermophilin D | C24H29N3O3 | 408.2278 | -0,99 | [M + H] + | Guo dan kawan-kawan ( 2011 ) |
| 59 | 20.565 | 4-Hidroksifenetil 2-(4-hidroksifenil)asetat | C16H16O4 adalah | 271.0975 | -0,23 | [M − H] − | Wang dkk. ( 2009 ) |
| 60 | 20.693 | Sitreopiron D | C15H16O4 adalah | 259.0974 | -0,71 | [M − H] − | Kosemura dkk. ( 1997 ) |
| 61 | 21.075 | Asperglasida | C27H28N2O4 | 445.2118 | -0,89 | [M + H] + | Jaderson dan Park ( 2020 ) |
| 62 | 21.091 | Kladoniamida C | C22H17N3O5 | 404.1238 | -0,79 | [M + H] + | Williams dan kawan-kawan ( 2008 ) |
| 63 | 21.095 | Neokinulin D | C24H29N3O2 | 392.2328 | -1,1 | [M + H] + | Marchelli dan kawan-kawan ( 1977 ) |
| 64 | 21.702 | Dehidrovariecolorin L | C29H37N3O2 | 460.2956 | -0,67 | [M + H] + | Li dan kawan-kawan ( 2008 ) |
| 65 | 21.778 | (9 E , 11 Z )-13-oxo-9,11-oktadekadienoat asam | C18H30O3 | 293.2123 | 0.26 | [M − H] − | Cantrell dan kawan-kawan ( 2008 ) |
| 66 | 21.963 | 2-(2-Oxo-2H-kromen-3-il)-5H-kromeno[4,3-b]piridin-5-on | C 21 H 11 TIDAK 4 | 342.0767 | 1.73 | [M + H] + | Patel dan kawan-kawan ( 2013 ) |
| 67 | 22.16 | Arestritin A | C29H39N3O3 | 478.3061 | -0,71 | [M + H] + | Itabashi dkk. ( 2006 ) |
| 68 | 22.273 | Radianspene J | C 20 H 27 TIDAK 4 | 344.1865 | -0,58 | [M − H] − | Ou dan kawan-kawan ( 2012 ) |
| 69 | 22.281 | 4,4′-Dihidroksi-5,5′-diisopropil-7,7′-dimetil-3H,3′H-8,8′-binafto[1,8-bc]furan-3,3′-dion | C30H26O6 | 481.1655 | -0,28 | [M − H] − | Jaroszewski dan kawan-kawan ( 1992 ) |
| 70 | 22.484 | Dehidroekinulin | C29H37N3O2 | 460.2953 | -1,24 | [M + H] + | Li dan kawan-kawan ( 2008 ) |
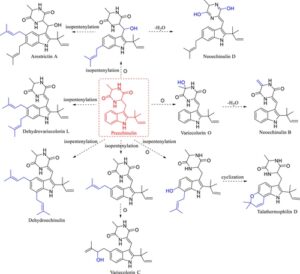
Untuk menyelidiki lebih lanjut variasi senyawa penanda perbedaan dalam D. officinale dengan tahun pertumbuhan yang berbeda, 20 senyawa teratas dengan VIP > 1 dan p < 0,05 dipilih untuk analisis skor VIP (Gambar 4 ), plot gunung berapi (Gambar 5 ), dan peta panas (Gambar 6 ). Plot gunung berapi menyajikan regulasi naik dan turun senyawa terkait antara tahun pertumbuhan yang berbeda. Arestrictin A, neoechinulin B, neoechinulin D, variecolorin O, variecolorin C, dehydrovariecolorin L, dehydroechinulin, talathermophilin D, dan delapan senyawa alkaloid indole diketopiperazine lainnya tidak menunjukkan perbedaan signifikan antara tahun pertumbuhan yang berbeda. Semua senyawa ini termasuk dalam metabolit sekunder D. officinale , yang terutama disintesis melalui jalur asam amino. Biasanya, setelah dibiosintesis, metabolit sekunder pada tanaman umumnya tidak berubah secara drastis dengan perubahan tahun pertumbuhan (Verma dan Shukla 2015 ). Sampel D. officinale yang dipilih dalam percobaan ini semuanya dari spesies dan lingkungan pertumbuhan yang sama, hanya berbeda dalam tahun pertumbuhan. Oleh karena itu, kandungan senyawa-senyawa ini dalam D. officinale tidak berbeda secara signifikan dengan perubahan tahun pertumbuhan. Interkonversi antara alkaloid indol diketopiperazine dipostulatkan, seperti yang ditunjukkan pada Gambar 7. Preechinulin adalah metabolit sekunder utama untuk biosintesis alkaloid indol diketopiperazine. Alkaloid ini kemudian disintesis melalui reaksi isopentenilasi, dehidrasi, oksigenasi, dan siklisasi dan dikatalisis oleh enzim EchPT2 dan EchP450, masing-masing, untuk menghasilkan serangkaian alkaloid indol diketopiperazine yang berbeda (Nies dan Li 2020 ).
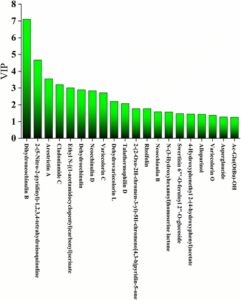


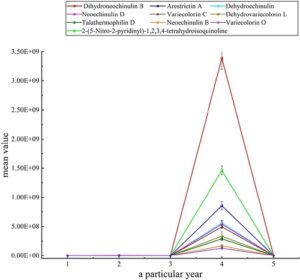
Dari peta panas, senyawa penanda perbedaan D. officinale dengan pertumbuhan 4 tahun lebih jelas dibandingkan dengan tahun-tahun lainnya. Ini konsisten dengan hasil analisis OPLS-DA, di mana 10 senyawa D. officinale dengan pertumbuhan 4 tahun, seperti neoechinulin D, variecolorin C, dan dehydrovariecolorin L, menunjukkan perbedaan yang lebih besar. Area puncak dari 10 senyawa ini di tahun-tahun yang berbeda ditunjukkan dalam grafik garis pada Gambar 8. Kandungan senyawa-senyawa ini meningkat seiring pertumbuhan, mencapai maksimum pada tahun keempat, kemudian menurun sesudahnya. Ini menunjukkan bahwa selama tahap pertumbuhan awal, D. officinale terutama mengakumulasi metabolit sekunder, memuncak pada tahun ke-4 (Jin et al. 2016 ; Yuan et al. 2022 ). Oleh karena itu, berdasarkan perbedaan senyawa dari tahun-tahun yang berbeda dalam peta panas, senyawa yang dicirikan secara berbeda dalam D. officinale dari tahun-tahun pertumbuhan lainnya dapat disimpulkan lebih lanjut. Pertumbuhan 1 tahun mencakup yang berikut: Ac-Glu(OtBu)-OH, etil N -[(1-asetamidosiklopentil)karbonil]serinat, N- (3-hidroksiheksanoil) homoserin lakton, dan alopurinol. Selain itu, pertumbuhan 2 tahun mencakup yang berikut: rhoifolin dan swertisin 6‴- O -feruloil 2″- O- glukosida. Pertumbuhan 3 tahun mencakup yang berikut: kladoniamida C , 4-hidroksifenetil 2-(4-hidroksifenil)asetat. Terakhir, pertumbuhan 5 tahun mencakup yang berikut: 2-(2-okso-2H-kromen-3-il)-5H-kromeno[4,3-b]piridin-5-on, asperglasida, tetapi kesimpulan ini masih perlu diverifikasi lebih lanjut dengan memperluas jumlah sampel lebih lanjut.
3.3 Penyaringan Target Potensial untuk Senyawa Penanda Perbedaan
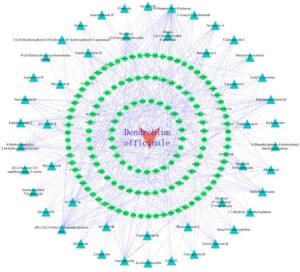
Dengan menggunakan database SwissTargetPrediction, STITCH, dan PharmMapper dengan parameter yang ditetapkan pada probabilitas ≥ 0,9, skor ≥ 0,7, dan skor kesesuaian norma ≥ 0,9, total 48 senyawa ampuh (Tabel 2 ) ditelusuri untuk memperoleh 6, 36, dan 96 target potensial, dan setelah membuang entri duplikat, 133 target tindakan potensial akhirnya diperoleh (Gambar 9 ).
| Nomor | Nama komponen | Rumus | pria/wanita | Jumlah target |
|---|---|---|---|---|
| 1 | Hidantosidin | C7H10N2O6 | 217.0475 | 2 |
| 2 | Alopurinol | C5H4N4O | 137.0458 | 10 |
| 3 | Leptazolin D | C16H22N2O7 | 355.1496 | 2 |
| 4 | Asetil -l -karnitin | C9H17NO4 | Nomor telepon 202.1077 | 10 |
| 5 | Leusil-4-hidroksiprolin | C11H20N2O4 | 245.1496 | 5 |
| 6 | Vokissiamida B | C11H17NO4 | 245.1495 | 1 |
| 7 | 3-(Dimetilamino)-4-hidroksibutil dimetilkarbamat | C9H20N2O3 | 205.1546 | 1 |
| 8 | Ac-Glu(OtBu)-OH | C 11 H 19 TIDAK 5 | 246.1336 | 3 |
| 9 | N- (3-hidroksiheksanoil)-homoserin lakton | C10H17NO4 | 216.1229 | 3 |
| 10 | l -Leucyl- l- prolinamide | C11H21N3O2 | 228.1705 | 7 |
| 11 | Fomolida D | C12H20O5 | 243.1236 | 1 |
| 12 | 1- O -sinapoyl-beta- d -glukosa | C17H22O10 | 385.1141 | 48 |
| 13 | Quercetin 3-robinobiosida | C27H30O16 | 611.1602 | 17 |
| 14 | Geralcin D | C15H22N2O6 | 327.1547 | 11 |
| 15 | Perennipin B | C21H26O9 | 421.1507 | 8 |
| 16 | Afalanin | C11H13TIDAK3 | Nomor telepon 206.0815 | 7 |
| 17 | Bahasa Lotaustralin | C 11 H 19 TIDAK 6 | 260.1138 | 2 |
| 18 | Swertisin 6‴- O- feruloyl 2″- O -glukosida | C29H32O15 | 619.1646 | 2 |
| 19 | 1,7-Hidroksi-3-metilxanton | C14H10O3 | 227.07 | 4 |
| 20 | Isomukronulatol 7- O -glukosa | C23H28O10 | 463.161 | 7 |
| 21 | Flutimida | C12H18N2O3 | 237.124 | 1 |
| 22 | Endofenazin E | C19H18N2O6 | 369.1091 | 16 |
| 23 | Fomoksidiena C | C14H14O3 | 229.0864 | 7 |
| 24 | 1-(2,4-Dihidroksifenil)-3-hidroksi-3-(4′-hidroksifenil)-1-propanon | C15H14O5 | 273.0768 | 9 |
| 25 | UCS1025B | C 20 H 25 TIDAK 6 | 374.1607 | 8 |
| 26 | ( E )-2-metoksi-1,4 naftokuinon-1-oksim | C11H9NO3 | Nomor telepon 202.0501 | 1 |
| 27 | YF-0200R-B | C12H20O5 | 244.13 | 2 |
| 28 | Berbagai warna O | C19H21N3O3 | 340.1649 | 16 |
| 29 | Dikotosin | C23H28O9 | 447.1659 | 8 |
| 30 | Diorsinol H | C15H14O4 | 257.0817 | 7 |
| 31 | LMA-P1 | C14H24O4 | 255.1599 | 4 |
| 32 | Trimetil 1,2,8-oktanetikarboksilat | C14H24O6 | 287.1499 | 16 |
| 33 | Aspertetranon D | C22H28O9 | 435.1661 | 4 |
| 34 | Dihidroneokinulin B | C19H21N3O2 | 324.17 | 22 |
| 35 | Okanin 3,4,3′-trimetil eter 4′-glukosa | C24H28O11 | 491.1559 | 1 |
| 36 | UCS1025A | C 20 H 25 TIDAK 5 | 358.1659 | 8 |
| 37 | Citreoviripiron B | C14H16O3 | Nomor telepon 231.1021 | 12 |
| 38 | Talathermophilin D | C24H29N3O3 | 408.2278 | 16 |
| 39 | 4-Hidroksifenetil 2-(4-hidroksifenil)asetat | C16H16O4 adalah | 271.0975 | 24 |
| 40 | Sitreopiron D | C15H16O4 adalah | 259.0974 | 6 |
| 41 | Asperglasida | C27H28N2O4 | 445.2118 | 22 |
| 42 | Kladoniamida C | C22H17N3O5 | 404.1238 | 9 |
| 43 | Neokinulin D | C24H29N3O2 | 392.2328 | 12 |
| 44 | Dehidrovariecolorin L | C29H37N3O2 | 460.2956 | 12 |
| 45 | (9 E , 11 Z )-13-oxo-9,11-oktadekadienoat asam | C18H30O3 | 293.2123 | 41 |
| 46 | Arestritin A | C29H39N3O3 | 478.3061 | 13 |
| 47 | Radianspene J | C 20 H 27 TIDAK 4 | 344.1865 | 9 |
| 48 | Dehidroekinulin | C29H37N3O2 | 460.2953 | 15 |
3.4 Analisis Pengayaan Fungsi GO dan Jalur Sinyal KEGG pada Target Aksi Utama Senyawa Fungsional D. officinale
Bahasa Indonesia: Menggunakan 24 target aksi kunci dari komponen fungsional D. officinale yang disaring di Bagian 3.3 , yang diperoleh dengan mencari basis data GeneCards untuk efikasi yang relevan (skor relevansi: > 10), 60 jalur fungsional GO diperkaya, seperti yang ditunjukkan pada Gambar 10 ( p < 0,05). Senyawa fungsional dalam D. officinale mungkin terutama mengerahkan aktivitas farmakologis dengan berpartisipasi dalam jalur ini. Di antara jalur ini, 40 adalah proses biologis (BP) termasuk transduksi sinyal, regulasi positif transkripsi DNA-pola, proses metabolisme glutathione, respons seluler terhadap ion kadmium, dan respons seluler terhadap stimulus estradiol. Ada 15 fungsi molekuler (MF), yang mencakup pengikatan protein identik, pengikatan enzim, aktivitas transfer elektron, pengikatan DNA, dan aktivitas glutathione transferase. Selain itu, lima komponen seluler (CC) disertakan: sitosol, nukleus, sitoplasma, eksosom ekstraseluler, eksosom mitokondria, dan respons seluler terhadap stimulus estradiol.
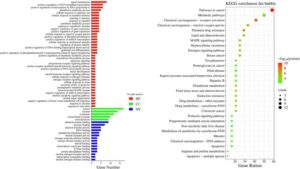
Sasaran utama aksi dari 24 senyawa fungsional D. officinale yang diperoleh diperkaya hingga total 67 jalur pensinyalan KEGG, seperti yang ditunjukkan pada Gambar 10. Di antara jalur-jalur ini, jalur kanker, jalur metabolik, karsinogenesis kimia—aktivasi reseptor, karsinogenesis kimia—spesies oksigen reaktif, resistensi obat platinum, dan jalur pensinyalan lipid dan aterosklerosis lebih diperkaya, yang menunjukkan bahwa senyawa fungsional diferensial D. officinale memiliki aktivitas farmakologis di area ini.
30 jalur pensinyalan KEGG pertama mencakup lipid dan aterosklerosis, tekanan geser cairan, dan aterosklerosis, yang menunjukkan bahwa D. officinale dapat mengatur proses metabolisme lipid dan aterosklerosis, yang konsisten dengan laporan literatur (Lin et al. 2023 ). Selain itu, temuan tersebut menunjukkan bahwa D. officinale mungkin memiliki fungsi aktif dalam mengatur sistem endokrin, seperti efek antivirus dan antiinflamasi.
4 Kesimpulan
Dalam penelitian ini, UHPLC–Orbitrap-MS digunakan untuk penyaringan nontarget D. officinale dari Guangnan yang tumbuh selama 1, 2, 3, 4, dan 5 tahun. Dalam mode ion positif dan negatif, masing-masing 2214 dan 933 senyawa berhasil dideteksi secara efektif. OPLS-DA mampu membedakan D. officinale secara efektif dari senyawa yang tumbuh pada tahun yang berbeda, dan senyawa dengan VIP > 1 dan p < 0,05 diperoleh dengan menggunakan model OPLS-DA, dengan total 29 senyawa berbeda yang disaring dalam mode ion positif dan 41 dalam mode ion negatif.
Peta gunung berapi menunjukkan bahwa arestrictin A, neoechinulin B, neoechinulin D, variecolorin O, variecolorin C, dehydrovariecolorin L, dehydroechinulin, talathermophilin D, dan delapan senyawa alkaloid indole diketopiperazine lainnya tidak menunjukkan perbedaan yang signifikan antara tahun pertumbuhan yang berbeda. Hubungan interkonversi antara alkaloid indole diketopiperazine dihipotesiskan, dengan preechinulin menjadi metabolit sekunder utama dalam biosintesisnya. Alkaloid indole diketopiperazine yang berbeda disintesis melalui isopentenilasi, dehidrasi, oksigenasi, siklisasi, dan katalisis oleh enzim EchPT2 dan EchP450, masing-masing.
Peta panas menunjukkan bahwa senyawa dalam D. officinale dengan pertumbuhan 4 tahun berbeda lebih signifikan dari senyawa pada tahun-tahun lainnya. Sepuluh senyawa, seperti neoechinulin D, variecolorin C, dan dehydrovariecolorin L, menunjukkan perbedaan yang lebih besar pada D. officinale berusia 4 tahun . Kandungan senyawa-senyawa ini meningkat seiring dengan tahun-tahun pertumbuhan, mencapai maksimum pada tahun keempat, dan kemudian menurun. Senyawa karakteristik diferensial dalam pertumbuhan 1 tahun adalah Ac-Glu(OtBu)-OH, etil N -[(1-acetamidocyclopentyl)carbonyl]serinate, N- (3-hydroxyhexanoyl) homoserine lactone, dan allopurinol. Untuk pertumbuhan 2 tahun, senyawa-senyawa tersebut adalah rhoifolin dan swertisin 6‴- O -feruloyl 2″- O- glucoside. Selain itu, untuk pertumbuhan 3 tahun, senyawa yang digunakan adalah kladoniamida C dan 4-hidroksifenetil 2-(4-hidroksifenil) asetat. Untuk pertumbuhan 5 tahun, senyawa yang digunakan adalah 2-(2-okso-2H-kromen-3-il)-5H-kromeno[4,3-b]piridin-5-on dan asperglasida.
Sebanyak 6, 36, dan 96 target potensial dari 48 senyawa efikasi diperoleh menggunakan basis data SwissTargetPrediction, STITCH, dan PharmMapper. Setelah menghilangkan duplikat, 133 target potensial diidentifikasi. Ke-24 target tindakan utama diperkaya untuk memperoleh 60 jalur fungsional GO, yang terdiri dari 40 BP, 15 MF, dan 5 CC. Selain itu, sebanyak 67 jalur pensinyalan KEGG diperkaya, dengan jalur kanker, jalur metabolik, karsinogenesis kimia—aktivasi reseptor, karsinogenesis kimia—spesies oksigen reaktif, resistensi obat platinum, dan jalur pensinyalan lipid dan aterosklerosis yang lebih diperkaya. Hal ini menunjukkan bahwa senyawa efikasi diferensial D. officinale aktif secara farmakologis di area ini. Lebih jauh lagi, temuan ini menunjukkan kemanjuran D. officinale dalam mengatur proses metabolisme lipid dan aterosklerosis, serta memiliki fungsi aktif dalam pengaturan sistem endokrin dan aktivitas antivirus dan anti-inflamasi.

