
ABSTRAK
Komposisi fenolik, kapasitas antioksidan, dan aktivitas penghambatan enzim ekstrak etanol daun Mangifera indica L. (MLs) dievaluasi secara komprehensif untuk mengeksplorasi aplikasi terapeutik dan industrinya. Profil kuantitatif 21 senyawa fenolik dilakukan menggunakan metode LC–MS/MS, dengan asam vanilat (1242,47 μg/L), asam galat (283,58 μg/L), dan quercetin (102,40 μg/L) diidentifikasi sebagai konstituen yang paling melimpah. Aktivitas antioksidan dinilai melalui uji DPPH, ABTS, FRAP, dan CUPRAC, yang menunjukkan kemampuan penyingkiran radikal sedang (DPPH: 26,87% ± 2,25%, ABTS: 14,65% ± 1,83%) dan kapasitas reduksi logam (FRAP: 0,118 ± 0,07, CUPRAC: 0,172 ± 0,03). Selain itu, ekstrak ML menunjukkan efek penghambatan yang bergantung pada dosis pada asetilkolinesterase (AChE, IC50 : 18,73 μg/mL), butirilkolinesterase (BChE, IC50 : 8,56 μg/mL), dan α-glukosidase (IC50 : 10,83 μg/mL), yang menyoroti potensinya dalam pengelolaan penyakit neurodegeneratif seperti Alzheimer dan gangguan metabolik termasuk diabetes. Temuan ini menekankan potensi bioaktif daun M. indica , yang memposisikannya sebagai sumber daya yang menjanjikan untuk valorisasi berkelanjutan. Dengan menunjukkan penerapan produk sampingan pertanian ini, penelitian ini memberikan dasar bagi inovasi di sektor pangan, nutraseutika, dan farmasi. Meskipun demikian, penyelidikan in vivo dan klinis lebih lanjut sangat penting untuk sepenuhnya memvalidasi keamanan dan kemanjuran terapeutiknya.
1 Pendahuluan
Mangifera indica L., anggota famili Anacardiaceae, dikenal sebagai salah satu tanaman tropis yang paling penting secara ekonomi dan nutrisi di seluruh dunia. Terkenal karena warnanya yang cerah, rasa yang manis, dan aroma yang kaya, mangga juga dihargai karena komposisi nutrisinya, yang mencakup vitamin, mineral, serat, dan senyawa bioaktif tingkat tinggi, menjadikannya buah pokok di banyak daerah (Reddy et al. 2021 ; Tharanathan et al. 2006 ). Selain buahnya, daun, kulit kayu, dan biji tanaman mangga juga memiliki potensi yang signifikan, terutama daun mangga (ML), yang kaya akan senyawa bioaktif seperti asam fenolik, flavonoid, turunan benzofenon, dan mangiferin. Senyawa-senyawa ini menunjukkan sifat antioksidan, antimikroba, dan antiinflamasi yang penting, menjadikan ML sebagai sumber daya yang menjanjikan untuk aplikasi kesehatan dan industri (Berardini et al. 2005 ; Yahia et al. 2023 ).
Studi terbaru telah mengeksplorasi komposisi fenolik dan sifat bioaktif ML, yang menyoroti manfaat kesehatannya. Senyawa utama seperti mangiferin (Imran et al. 2017 ), asam galat (Kahkeshani et al. 2019 ), dan asam klorogenat (Mphaphuli Chikhala et al. 2020 ) telah terbukti mengurangi stres oksidatif, mengatur metabolisme lipid, dan mengurangi gangguan terkait peradangan (Zivković et al. 2024 ). Selain itu, ekstrak ML telah menunjukkan potensi dalam mengelola penyakit metabolik melalui penghambatan α-glukosidase, membantu dalam pengobatan diabetes, dan penghambatan asetilkolinesterase (AChE), yang dapat bermanfaat bagi manajemen penyakit neurodegeneratif (Infante-Garcia et al. 2017 ; Saleem et al. 2019 ). Pendekatan metodologis serupa telah berhasil digunakan dalam mengkarakterisasi senyawa bioaktif dari berbagai sumber tanaman. (Boğa et al. 2016 ) menganalisis profil fitokimia spesies Centaurea menggunakan kromatografi cair-ionisasi elektrospray-spektrometri massa tandem (LC-ESI-MS/MS) dan mengevaluasi aktivitas antioksidan, antikolinesterase, dan antimikrobanya. Studi mereka menunjukkan aktivitas penangkal radikal yang signifikan dalam ekstrak metanol dan mengidentifikasi asam quinic sebagai senyawa utama, yang memberikan wawasan berharga tentang hubungan antara kandungan fitokimia dan bioaktivitas. İnci et al. (Inci et al. 2023 ) menyelidiki Apilarnil, produk lebah yang berasal dari larva drone, menggunakan teknik yang sebanding termasuk penangkal radikal DPPH, uji kemampuan reduksi logam, dan uji penghambatan enzim terhadap AChE dan butirilkolinesterase (BChE). Analisis kromatografi cair–spektrometri massa tandem (LC-MS/MS) mereka mengidentifikasi konsentrasi tinggi asam quinic, asam fumarat, dan flavonoid seperti kaempferol dan quercetin, senyawa yang juga relevan dalam penyelidikan kami terhadap ML. Dalam studi komprehensif, Ceylan et al. ( 2021 ) menganalisis 11 spesies Inula , mengevaluasi komposisi fitokimia mereka melalui LC-MS/MS, kapasitas antioksidan, dan efek penghambatan terhadap enzim utama yang terlibat dalam gangguan neurologis dan diabetes. Mereka menemukan asam quinic menjadi senyawa dominan di sebagian besar ekstrak, dengan kehadiran komponen bioaktif lainnya seperti rutin, asam klorogenat, dan flavonoid. Pendekatan multidimensi mereka yang menggabungkan profil kimia dengan penilaian bioaktivitas memberikan kerangka kerja yang sangat baik untuk memahami hubungan antara kandungan fitokimia dan potensi terapeutik tanaman obat. Güven et al. ( 2023 ) menggunakan analisis LC-MS/MS untuk mengidentifikasi senyawa bioaktif di Prunus mahalebkernel dan mengevaluasi efek penghambatannya pada enzim tirosinase dan melanogenesis, menunjukkan hubungan struktur-aktivitas di antara turunan asam sinamat. Studi mereka mengungkapkan bahwa senyawa yang mengandung fitur struktural spesifik menunjukkan penghambatan tirosinase non-kompetitif yang kuat, dengan aplikasi potensial pada gangguan hiperpigmentasi. Altay et al. ( 2022 ) menyelidiki ekstrak Hypericum scabrum menggunakan analisis LC-MS/MS dan mengidentifikasi 29 fitokimia, dengan asam quinic, quercitrin, dan isoquercitrin sebagai senyawa utama. Mereka mengevaluasi beberapa aktivitas biologis termasuk kapasitas antioksidan (DPPH dan FRAP), penghambatan enzim (α-glukosidase dan AChE), dan efek antikanker terhadap lini sel kanker payudara. Pekerjaan mereka termasuk studi docking molekuler yang memberikan wawasan berharga tentang mekanisme pengikatan senyawa kunci dengan enzim target, memperkuat pemahaman hubungan struktur-aktivitas pada tingkat molekuler.
Meskipun efek antidiabetik dan antineurodegeneratif ekstrak ML dalam kondisi in vivo telah dipelajari secara rinci dalam literatur, hubungan antara efek ini dan kandungan senyawa fenolik belum cukup dijelaskan. Dalam penelitian ini, analisis kuantitatif senyawa fenolik, yang menjadi dasar aktivitas biologis ML, dilakukan dengan metode LC-MS/MS, dan kontribusi senyawa ini terhadap efek antidiabetik dan antineurodegeneratif ML dalam kondisi in vitro dieksplorasi. Dalam konteks ini, penelitian ini bertujuan untuk lebih memahami potensi efek terapeutik ML dengan mengisi celah penting dalam literatur yang ada.
Meskipun daging buah mangga sudah terkenal akan nilai gizinya, penelitian semakin berfokus pada potensi produk sampingan mangga seperti daun, kulit, dan biji dalam aplikasi berkelanjutan. Dalam penelitian ini, ekstrak ML dievaluasi secara menyeluruh untuk komposisi fenoliknya, kapasitas antioksidan, dan potensi penghambatan enzim. Dengan menggunakan analisis LC-MS/MS tingkat lanjut, senyawa fenolik utama, termasuk asam galat, asam fumarat, asam vanilat, dan quercetin, diidentifikasi, dan aktivitas antioksidannya dinilai melalui uji DPPH, ABTS, FRAP, dan CUPRAC. Efek penghambatan ekstrak ML pada enzim AChE, BChE, dan α-glukosidase juga diselidiki, yang menunjukkan potensi terapeutik daun mangga dalam mengatasi penyakit neurodegeneratif dan metabolik.
2 Bahan dan Metode
2.1 Bahan Kimia
Reagen yang digunakan dalam penelitian ini meliputi 2,2-difenil-1-pikrilhidrazil (DPPH), asam galat, reagen Folin–Ciocalteu, quercetin, asam etilendiamintetraasetat (EDTA), tris(hidroksimetil)aminometana (Tris), natrium sitrat, dan 5,5′-dithio-bis (asam 2-nitrobenzoat) (DTNB). Bahan kimia ini diperoleh dari Sigma Aldrich, pemasok yang diakui secara global yang terkenal karena menyediakan reagen dengan kemurnian tinggi dan andal, yang memastikan validitas dan konsistensi hasil eksperimen. Semua bahan kimia bermutu analitis, dengan kemurnian melebihi 99%, meminimalkan potensi gangguan dan memastikan keakuratan pengujian.
2.2 Persiapan Ekstrak
ML dikumpulkan selama periode pematangan antara September dan Oktober 2021 pada ketinggian 650 m di atas permukaan laut di distrik Kozan, provinsi Adana, Turki. ML yang disediakan mengalami pengeringan udara pada suhu sekitar dalam pengaturan berventilasi baik, memastikan perlindungan dari sinar matahari langsung untuk mencegah degradasi senyawa bioaktif. Setelah proses pengeringan, daun dihaluskan menjadi bubuk halus menggunakan nitrogen cair untuk mempertahankan konstituen termolabil dan memastikan ukuran partikel yang seragam. Bahan tanaman bubuk mengalami ekstraksi dengan etanol dalam rasio 1:10 (b/v) untuk memaksimalkan hasil fitokimia yang larut dalam etanol. Proses ekstraksi dilakukan pada pengocok orbital pada suhu kamar (25°C) selama 24 jam untuk memastikan difusi senyawa aktif yang memadai ke dalam pelarut. Setelah ekstraksi, campuran disaring menggunakan kertas saring Whatman No. 1 untuk memisahkan residu padat. Filtrat kemudian dipekatkan di bawah tekanan rendah menggunakan rotary evaporator untuk menghilangkan pelarut etanol, menghasilkan ekstrak mentah. Ekstrak yang dihasilkan dikeringkan dan disimpan pada suhu 4°C dalam wadah kedap udara untuk menjaga kestabilannya dan mencegah kontaminasi (Işık et al. 2015 ). Ekstrak yang telah disiapkan ini selanjutnya digunakan untuk penelitian biokimia dan analitis lebih lanjut.
2.3 Profil Fenolik Ekstrak MLs Dengan Analisis LC–MS/MS
Profil fenolik ekstrak ML dikarakterisasi menggunakan kromatografi cair–spektrometri massa tandem (LC-MS/MS), yang digunakan untuk analisis kuantitatif 21 senyawa fenolik yang berbeda. Setelah mengoptimalkan kondisi analitis menggunakan senyawa fenolik standar dengan kemurnian tinggi, profil fenolik ekstrak tanaman dianalisis secara komprehensif. Identifikasi dan kuantifikasi senyawa fenolik dalam spesies tanaman dilakukan menggunakan metodologi tervalidasi yang sebelumnya dilaporkan dalam literatur. Secara khusus, penentuan senyawa fenolik dalam ekstrak ML dilakukan menurut metode yang dikembangkan oleh Yilmaz (Kavaz et al. 2021 ; Yilmaz 2020 ). Pemisahan kromatografi dicapai menggunakan kolom C18 Inertsil ODS-4 fase terbalik (dimensi: 3,0 mm × 100 mm, ukuran partikel: 2 μm). Suhu kolom dipertahankan pada 40°C, pengaturan yang dioptimalkan untuk meningkatkan resolusi analit dan memperbaiki kelarutan dalam fase gerak. Fase bergerak terdiri dari dua pelarut: air yang mengandung 0,1% asam format (Fase A) dan metanol yang mengandung 0,1% asam format (Fase B). Penambahan asam format memfasilitasi ionisasi analit dan mengurangi potensi korosi sumber ion. Program elusi gradien digunakan untuk mengoptimalkan pemisahan senyawa fenolik dengan menyesuaikan konsentrasi relatif fase bergerak. Volume injeksi untuk setiap sampel ditetapkan pada 4 μL, sedangkan laju alir dipertahankan secara konsisten pada 0,5 mL/menit untuk memastikan kondisi kromatografi yang stabil. Analisis kuantitatif dilakukan dalam rangkap tiga untuk setiap senyawa, dan nilai rata-rata dihitung untuk memastikan akurasi dan reproduktifitas.
2.4 Uji Aktivitas Antioksidan
2.4.1 Aktivitas Pembersihan Radikal DPPH
Potensi antioksidan ekstrak ML dievaluasi melalui aktivitas penangkal radikal DPPH menggunakan versi metode Blois yang sedikit dimodifikasi, suatu uji yang dikenal luas untuk mengukur netralisasi radikal bebas (Blois 1958 ). Larutan 0,26 mM 2,2-difenil-1-pikrilhidrazil (DPPH) dalam etanol disiapkan sebagai larutan kerja. Ekstrak diuji pada berbagai konsentrasi untuk menilai aktivitas yang bergantung pada dosis. Volume yang sama dari larutan DPPH dan ekstrak dicampur dan diinkubasi dalam gelap selama 30 menit pada suhu kamar untuk mencegah degradasi radikal yang disebabkan oleh cahaya. Aktivitas dipantau dengan mengukur absorbansi pada 517 nm menggunakan spektrofotometer UV–Vis. Persentase aktivitas penangkal radikal DPPH dihitung untuk setiap konsentrasi, dan nilai IC50 ditentukan dengan memplot persentase penghambatan terhadap konsentrasi ekstrak (Al-Khayri et al. 2022 ).
2.4.2 Aktivitas Pembersihan Radikal ABTS
Kation radikal ABTS (ABTS + ) dihasilkan melalui oksidasi ABTS (2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)) dengan kalium persulfate, metode yang banyak digunakan untuk mengevaluasi kapasitas antioksidan. Campuran reaksi dibiarkan diinkubasi dalam gelap selama 14 jam pada suhu ruangan untuk memastikan pembentukan radikal lengkap sambil menghindari dekomposisi yang disebabkan oleh cahaya (Re et al. 1999 ). Larutan ABTS .+ yang dihasilkan kemudian diencerkan dengan buffer fosfat atau air deionisasi untuk mencapai absorbansi awal 0,750 ± 0,025 pada 734 nm, langkah penting untuk menjaga konsistensi di seluruh pengukuran. Berbagai konsentrasi ekstrak tanaman dicampur dengan larutan ABTS + yang disiapkan , dan penurunan absorbansi dicatat pada 734 nm menggunakan spektrofotometer UV–Vis. Hasilnya dinyatakan dalam nilai IC50 , yang merupakan konsentrasi ekstrak yang diperlukan untuk mencapai aktivitas pemulungan 50% (Kavaz et al. 2022 ).
2.4.3 Uji Daya Reduksi Feri
Uji Daya Reduksi Feri digunakan untuk mengevaluasi kapasitas donor elektron dari ekstrak, indikator potensi antioksidan secara keseluruhan. Metode ini didasarkan pada reduksi kompleks Fe3 + /ferrisianida menjadi Fe2 + dengan adanya antioksidan, yang selanjutnya membentuk kompleks tripiridiltriazin fero berwarna biru yang dapat diukur pada 700 nm. Dalam uji ini, ekstrak awalnya dicampur dengan 0,2 M buffer fosfat (pH 6,6) dan 1% kalium ferrisianida [K3Fe ( CN) 6 ], diikuti dengan inkubasi pada suhu 50°C selama 20 menit untuk memfasilitasi reaksi reduksi. Setelah inkubasi, 10% asam trikloroasetat (TCA) ditambahkan untuk menghentikan reaksi, dan campuran disentrifugasi untuk memisahkan endapan. Supernatan yang dihasilkan digabungkan dengan larutan FeCl3 untuk membentuk kompleks fero-fero. Absorbansi larutan campuran diukur secara spektrofotometri pada 700 nm (Oyaizu 1986 ; Yüksel et al. 2021 ).
2.4.4 Kapasitas Antioksidan Pengurang Kupri (CUPRAC)
Uji kapasitas antioksidan pereduksi kupri (CUPRAC) digunakan untuk menilai aktivitas antioksidan ekstrak, berdasarkan kemampuannya untuk mereduksi ion Cu 2+ menjadi ion Cu + . Reduksi ini terjadi dengan adanya neokuproin, yang membentuk kompleks Cu + -neokuproin berwarna jingga stabil dengan absorbansi maksimum pada 450 nm. Dalam uji ini, campuran reaksi terdiri dari 1 mL larutan CuCl 2 10 mM , 1 mL larutan neokuproin 7,5 mM, dan 1 mL buffer amonium asetat (1 M, pH 7,0). Konsentrasi yang berbeda dari ekstrak ML ditambahkan ke campuran reaksi, dan volume total disesuaikan menjadi 4 mL dengan air suling (Apak et al. 2006 ; Ndhlala et al. 2024 ). Campuran diinkubasi selama 30 menit pada suhu kamar untuk memastikan reaksi lengkap dan diukur secara spektrofotometri pada 450 nm.
2.4.5 Uji Penghambatan Kolinesterase
Aktivitas penghambatan ekstrak terhadap enzim AChE dan BChE dinilai menggunakan metode Ellman, uji spektrofotometri yang diadopsi secara luas untuk studi penghambatan kolinesterase (Ellman et al. 1961 ). Campuran reaksi terdiri dari larutan enzim, buffer Tris–HCl (pH 8,0), DTNB, dan substrat (asetiltiokolin iodida untuk AChE atau butiriltiokolin iodida untuk BChE). Ekstrak ditambahkan pada berbagai konsentrasi untuk mengevaluasi efek penghambatan yang bergantung pada dosis. Campuran diinkubasi selama durasi tertentu pada suhu 25°C untuk memungkinkan terjadinya hidrolisis enzimatik. Pembacaan absorbansi pada 412 nm direkam menggunakan spektrofotometer UV–Vis untuk mengukur pembentukan produk berwarna kuning. Nilai IC50 , yang menunjukkan konsentrasi ekstrak yang diperlukan untuk menghambat 50% aktivitas enzim, dihitung dari kurva dosis-respons (NecİP dan Işık 2019 ; Türkeş et al. 2022 ). Pengujian dilakukan dalam rangkap tiga untuk setiap konsentrasi guna memastikan keakuratan dan reproduktifitas hasil.
2.4.6 Uji Penghambatan α-Glukosidase
Potensi penghambatan ekstrak terhadap aktivitas enzim α-glukosidase dievaluasi menggunakan p-nitrofenil-D-glukopiranosida (p-NPG) sebagai substrat, metode yang banyak digunakan untuk menilai penghambat α-glukosidase. Campuran reaksi meliputi larutan enzim, ekstrak pada berbagai konsentrasi, dan substrat yang dilarutkan dalam buffer yang sesuai (misalnya, buffer fosfat, pH 6,8). Absorbansi larutan yang dihasilkan dicatat pada 405 nm menggunakan spektrofotometer UV–Vis (Tao et al. 2013 ; Kaya et al. 2024 ). Aktivitas penghambatan ekstrak dihitung sebagai persentase penghambatan enzim relatif terhadap kontrol tanpa ekstrak. Nilai IC 50 , yang mewakili konsentrasi ekstrak yang diperlukan untuk menghambat 50% aktivitas α-glukosidase, ditentukan dari kurva penghambatan dosis–respons (Demir et al. 2017 ).
2.5 Analisis Statistik
Setiap percobaan dilakukan dalam rangkap tiga untuk memastikan keandalan dan reproduktifitas hasil. Semua percobaan dilakukan dalam rangkap tiga untuk memastikan keandalan dan reproduktifitas hasil. Data dinyatakan sebagai rata-rata ± simpangan baku (SD). Analisis statistik dilakukan menggunakan perangkat lunak GraphPad Prism versi 8, yang menyediakan alat yang kuat untuk visualisasi data dan pengujian hipotesis.
3 Hasil
3.1 Profil Fenolik Ekstrak MLs Dengan Analisis LC-MS/MS
Tabel 1 menyajikan secara komprehensif senyawa fenolik dalam ekstrak etanol ML sebagaimana ditentukan oleh analisis LC-MS/MS. Sebanyak 21 senyawa fenolik dianalisis, di antaranya asam vanilat (1242,47 μg/L), asam fumarat (378,29 μg/L), asam galat (283,58 μg/L), butein (283,32 μg/L), dan quercetin (102,40 μg/L) yang diidentifikasi sebagai yang paling melimpah. Senyawa lain yang terdeteksi pada konsentrasi yang lebih rendah meliputi katekin hidrat (5,08 μg/L), resveratrol (8,47 μg/L), dan phloridzin dihidrat (7,16 μg/L), sementara beberapa senyawa, seperti oleuropein, asam ellag, dan luteolin, tidak terdeteksi. Batas deteksi (LOD) dan kuantifikasi (LOQ) berkisar dari 0,05 μg/L hingga 207 μg/L, yang menunjukkan sensitivitas metode yang tinggi. Laju pemulihan mendekati 100% semakin menegaskan efisiensi proses ekstraksi dan keandalan analisis. Selain itu, koefisien determinasi ( nilai R2 ) untuk semua senyawa adalah ≥ 0,996, yang menunjukkan keakuratan kurva kalibrasi (Tabel 1 ). Parameter validasi senyawa fenolik yang ditentukan oleh LC- MS /MS disajikan dalam Tabel S1 dan Gambar S1 . Temuan ini menunjukkan bahwa ekstrak ML kaya akan senyawa fenolik, yang berkontribusi secara signifikan terhadap bioaktivitasnya.
| Senyawa standar | Kadar LOD dan LQ (μg/L) | Pemulihan (%) | RT | Konsentrasi (μg/L) |
|---|---|---|---|---|
| Kuersetin | 22,5/25,7 | 1.001 | 3886 | Nomor telepon 102.40 |
| Asam asetohidroksamat | 2.8/8.2 | 1.000 | 0396 | 62.71 |
| Katekin hidrat | 8.2/11.4 | 0,994 tahun | tahun 2712 | Tanggal 5.08 |
| Asam vanili | 125,5/142,2 | 1.001 | 3519 | 1242.47 |
| Obat Resveratrol | 9.0/13.6 | 0,998 | 3192 | 8.47 |
| Asam fumarat | 25,2/31,3 | 0,997 tahun | 0454 | 378.29 |
| Asam galat | 0,90/1,6 | 1.000 | 1.418 | 283.58 |
| Asam kafeat | 6.3/10.7 | 1.009 | 3114 | 3.65 |
| Phloridzin dihidrat | 61,0/207,0 | 1.000 | 3450 | 7.16 |
| Oleuropein | 0,05/1,0 | 0,997 tahun | 3.567 | ND |
| Asam ellagic | 0,101/0,333 | 1.002 | 3900 | ND |
| Mirisetin | 55,4/59,6 | 0,999 | 5.010 | 14.92 |
| Asam protocatechuic | 30,3/35,4 | 1.011 | 3.556 | ND |
| Butein | 22,7/28,6 | 0,096 tahun | 3923 | 283.32 |
| Naringenin | 5.4/6.4 | 0,998 | 4483 | ND |
| Lutein | 0,5/2,5 | 1.007 | 4124 | ND |
| Kaempferol | 206,6/214,3 | 0,999 | 4115 | ND |
| Alizarin | 65,2/77,5 | 0,966 tahun | 4.594 | ND |
| Asam 4-Hidroksibenzoat | 30,5/40,25 | 0,996 tahun | 4235 | ND |
Singkatan: LOD/LOQ (μg/L), batas deteksi/batas kuantisasi; ND, tidak terdeteksi; RT, waktu retensi.
3.2 Aktivitas Penangkapan Radikal dan Reduksi Logam Ekstrak Etanol ML
Tabel 2 menyajikan aktivitas penangkal radikal dan reduksi logam dari ekstrak etanol MLs, yang dievaluasi melalui uji DPPH, ABTS, FRAP, dan CUPRAC. Aktivitas penangkal radikal DPPH dari ekstrak diukur sebesar 26,866% ± 2,25%, sedangkan aktivitas penangkal radikal ABTS ditetapkan sebesar 14,653% ± 1,83%. Nilai-nilai ini secara signifikan lebih rendah dibandingkan dengan antioksidan standar BHA (DPPH: 73,36% ± 4,12%, ABTS: 83,35% ± 7,08%) dan BHT (DPPH: 49,62% ± 4,26%, ABTS: 46,19% ± 2,98%). Dalam uji FRAP, yang mengevaluasi kapasitas reduksi logam, ekstrak menunjukkan nilai absorbansi sebesar 0,118 ± 0,07, yang lebih rendah dibandingkan dengan standar BHA (0,39 ± 0,05) dan Trolox (0,25 ± 0,01). Demikian pula, dalam uji CUPRAC, ekstrak menunjukkan nilai absorbansi sebesar 0,172 ± 0,03, yang juga lebih rendah dibandingkan dengan BHA (0,58 ± 0,04) dan Trolox (0,54 ± 0,03).
| Antioksidan | DPPH a (0,2 μg mL −1 ) | ABTS (0,2 μg mL −1 ) | Uji FRAP b (0,2 μg mL −1 ) | Uji CUPRAC b (0,2 μg mL −1 ) |
|---|---|---|---|---|
| Mangifera indica L. | 26.866 ± 2,25 | 14.653 ± 1,83 | 0,118 ± 0,07 | 0,172 ± 0,03 |
| BHA | 73,36 ± 4,12 | 83,35 ± 7,08 | 0,39 ± 0,05 | 0,58 ± 0,04 |
| BHT | 49,62 ± 4,26 | 46,19 ± 2,98 | 0,67 ± 0,07 | 0,61 ± 0,04 |
| Troloks | 78,53 ± 6,97 | 82,18 ± 6,81 | 0,25 ± 0,01 | 0,54 ± 0,03 |
Catatan: Antioksidan standar (BHA, butylated hydroxyanisole; BHT, butylated hydroxytoluene, trolox). a Nilai dinyatakan sebagai persen aktivitas penangkal radikal. b Nilai dinyatakan sebagai absorbansi. Absorbansi tinggi menunjukkan kapasitas reduksi logam yang tinggi.
Hasil ini menunjukkan bahwa aktivitas penangkal radikal dan reduksi logam ekstrak ML terbatas dan jauh lebih rendah daripada antioksidan standar. Namun, ekstrak tersebut masih menunjukkan tingkat kapasitas antioksidan tertentu, yang menunjukkan adanya senyawa bioaktif yang berkontribusi terhadap sifat antioksidan alaminya.
3.3 Aktivitas Penghambatan Ekstrak MLs Terhadap AChE, BChE, dan α-Glukosidase
Gambar 1 mengilustrasikan efek penghambatan yang bergantung pada konsentrasi ekstrak etanol MLs pada enzim AChE, BChE, dan α-glukosidase. Grafik tersebut dengan jelas menunjukkan bahwa aktivitas enzim menurun seiring dengan peningkatan konsentrasi ekstrak. Untuk AChE, kurva penghambatan menunjukkan kesesuaian yang baik dengan persamaan y = 100e −0,037xy dan nilai R 2 sebesar 0,9216, dengan nilai IC 50 yang dihitung sebesar 16,116 μg/mL. Penghambatan BChE menunjukkan korelasi yang lebih kuat, yang dijelaskan oleh persamaan y = 100e −0,081xy dengan nilai R 2 sebesar 0,9848, dan nilai IC 50 sebesar 8,56 μg/mL, yang menunjukkan efek yang lebih kuat pada BChE dibandingkan dengan AChE. Demikian pula untuk α-glukosidase, kurva penghambatan dimodelkan oleh persamaan y = 100e −0,064xy dengan nilai R 2 sebesar 0,9646, dan nilai IC 50 dihitung sebesar 10,828 μg/mL (Tabel 3 dan Gambar 1 ).
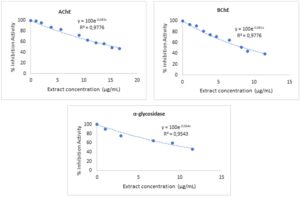
| Penghambat | IC AChE 50 (μg/ml) | R 2 | BChE IC 50 (μg/ml) | R 2 | α-Glukosidase IC 50 (μg/mL) | R 2 |
|---|---|---|---|---|---|---|
| Mangifera indica | 16.116 | 0.922 | 8.556 | 0,984 | 10.828 | 0,9649 tahun |
| Takrin | 3.19 | 0,989 | 2.54 | 0,987 | ||
| Akarbosa | 3.15 | 0,9961 tahun |
Temuan-temuan pada Gambar 1 dan Tabel 3 ini menyoroti efek selektif dan tergantung dosis dari ekstrak pada penghambatan enzim dengan nilai IC50 yang dilaporkan . Efek penghambatan yang lebih kuat pada BChE menunjukkan peran potensial dalam pengobatan penyakit neurodegeneratif, sementara penghambatan α-glukosidase mendukung aplikasi potensialnya dalam mengelola gangguan metabolik seperti diabetes. Nilai R2 yang tinggi di semua grafik memperkuat keakuratan dan keandalan data dan analisis.
4 Diskusi
Dalam penelitian ini, kandungan senyawa fenolik, kapasitas antioksidan, dan potensi penghambatan enzim dari ekstrak etanol ML dianalisis secara komprehensif. Temuan tersebut mengungkapkan bahwa ML kaya akan senyawa fenolik dan memiliki sifat-sifat yang meningkatkan kesehatan. Analisis LC–MS/MS menunjukkan bahwa ekstrak ML sangat kaya akan senyawa bioaktif seperti asam vanilat, asam fumarat, asam galat, butein, dan quercetin. Senyawa-senyawa ini menyoroti potensi ML sebagai sumber bioaktif dalam mengurangi stres oksidatif dan mengelola penyakit metabolik. Uji kapasitas antioksidan menunjukkan bahwa ekstrak ML menunjukkan aktivitas antioksidan tertentu. Meskipun uji FRAP dan CUPRAC mengungkapkan aktivitas logam yang relatif rendah dari ekstrak ML dibandingkan dengan antioksidan standar seperti BHA, BHT, dan Trolox, dapat dikatakan bahwa ekstrak ML memiliki kapasitas reduksi logam sedang sebagai agen antioksidan alami. Hal ini berbeda dengan uji DPPH dan ABTS, yang mengonfirmasi aktivitas penangkal radikal dari ekstrak tersebut. Hal ini menunjukkan bahwa aktivitas antioksidan ekstrak ML tidak hanya bergantung pada konsentrasi senyawa fenolik tetapi juga pada efek sinergis di antara senyawa-senyawa ini, struktur matriks ekstrak, dan bioavailabilitasnya (Rasoanaivo et al. 2011 ).
Hasilnya selaras dengan hasil penelitian Kumar et al. ( 2021 ), yang mengidentifikasi mangiferin, quercetin, dan isoquercitrin sebagai senyawa fenolik utama dengan kapasitas antioksidan tinggi pada daun mangga. Dalam penelitian Mohan et al. ( 2013 ), nilai IC50 ekstrak metanol untuk uji DPPH dilaporkan sebesar 13,37 μg/mL, sedangkan aktivitas penangkal radikal DPPH dari ekstrak dalam penelitian ini tercatat sebesar 26,87% pada 0,2 μg mL −1 . Selain itu, literatur menyoroti kapasitas antioksidan fraksi etil asetat yang unggul, dengan nilai DPPH mencapai 1226 mg ekuivalen Trolox/g (Kitbumrungsart et al. 2011 ). Sebaliknya, nilai FRAP dalam penelitian ini dibatasi hingga absorbansi 0,118, yang dapat dikaitkan dengan perbedaan metode ekstraksi dan pelarut (Kitbumrungsart et al. 2011 ). Di luar aktivitas antioksidan, potensi daun mangga tidak hanya berasal dari efek individual senyawa fenolik tetapi juga dari interaksi sinergis antar komponen. Sementara Gu et al. ( 2019 ) menekankan kontribusi antioksidan signifikan dari turunan mangiferin dan benzofenon, penelitian ini menyoroti peran asam vanilat dan quercetin dalam profil antioksidan daun mangga. Analisis penghambatan enzim mengungkapkan bahwa ekstrak ML menunjukkan efek penghambatan tergantung dosis pada enzim AChE, BChE, dan α-glukosidase. Khususnya, efek penghambatan pada AChE (IC 50 : 16,116 μg/mL) dan BChE (IC 50 : 8,556 μg/mL) menunjukkan potensi aplikasi terapeutik ML dalam pengobatan penyakit neurodegeneratif seperti Alzheimer. Selain itu, penghambatan α-glukosidase (IC 50 : 10,83 μg/mL) menunjukkan aplikasi yang menjanjikan untuk mengelola penyakit metabolik seperti diabetes. Temuan ini mendukung nilai ML sebagai produk alami dalam aplikasi terapeutik yang terkait dengan neuroproteksi dan gangguan metabolik.
Dibandingkan dengan literatur yang ada, hasil studi ini memberikan kontribusi baru. Misalnya, Pan et al. ( 2018 ) menyoroti aktivitas antioksidan dan antidiabetik dari turunan benzofenon yang diisolasi dari ML, sementara Sferrazzo et al. ( 2022 ) berfokus pada efek antibakteri dan antiinflamasi ML dan peran pelindung selulernya. Das et al. ( 2011 ) menekankan peran mangiferin sebagai antioksidan kuat dan agen efektif melawan penyakit terkait stres oksidatif. Dalam sebuah studi, efek penghambatan ekstrak air daun mangga yang dikumpulkan dari Mumbai, India, terhadap enzim α-amilase dan α-glukosidase sebagai antidiabetik disaring. Ekstrak air MLs menunjukkan efek penghambatan terhadap enzim-enzim ini dengan nilai IC 50 masing-masing sebesar 132,27 ± 4,23 μg/mL dan 345,79 ± 6,22 μg/mL (Kulkarni dan Rathod 2018 ). Dalam penelitian lain, ekstrak daun mangga (mangga Sisilia, yang dikumpulkan dari Lentini, Italia) ditemukan menunjukkan aktivitas penghambatan α-glukosidase dengan nilai IC 50 sebesar 187,48 μg/mL (Sferrazzo et al. 2022 ). Dalam penelitian ini, ekstrak etanol MLs yang dikumpulkan dari provinsi Adana di Turki memiliki efek penghambatan yang lebih tinggi terhadap enzim α-glukosidase dengan nilai IC 50 sebesar 10,828 μg/mL. Berdasarkan hasil penelitian, ekstrak tersebut diyakini memiliki kualitas antidiabetik dan antioksidan karena mengandung konsentrasi tinggi zat alami termasuk quercetin, asam fumarat, asam galat, butein, dan asam vanilat. Dalam hal ini, penelitian ini dapat berkontribusi pada penelitian penting dalam literatur dengan memberikan perspektif yang lebih luas tentang potensi terapeutik ML.
Studi ini juga menyoroti bahwa ML menawarkan profil senyawa bioaktif yang unik dibandingkan dengan ampas mangga. Sementara Palafox-Carlos et al. ( 2012 ) menyelidiki peran senyawa fenolik dalam metabolisme oksidatif ampas mangga, dan Maldonado-Celis et al. ( 2019 ) mengeksplorasi sifat nutrisi buah mangga, studi kami berfokus pada potensi terapeutik daun mangga dalam mengelola penyakit neurodegeneratif dan metabolik. Efek penghambatan pada AChE dan BChE selanjutnya memposisikan ML sebagai sumber alami untuk mengobati penyakit Alzheimer dan gangguan neurodegeneratif serupa.
Hasil-hasil ini menggarisbawahi potensi aplikasi ML yang luas dalam domain ilmu kesehatan dan pangan. Profil senyawa fenolik yang terperinci, ditambah dengan aktivitas biologis yang ditunjukkan, menyoroti nilai terapeutik dari sumber daya alam ini. Meskipun demikian, validasi lebih lanjut melalui studi in vivo dan klinis sangat penting untuk memperdalam pemahaman kita tentang aplikasi yang berhubungan dengan kesehatan dan peran mekanistik ML. Studi ini menyajikan evaluasi menyeluruh tentang sifat-sifat bioaktif dan komposisi fenolik ML, sehingga memberikan kontribusi substansial terhadap literatur ilmiah yang ada.
5 Kesimpulan
Studi ini mengevaluasi kandungan senyawa fenolik, kapasitas antioksidan, dan efek penghambatan enzim dari ML, yang menunjukkan potensi signifikannya untuk aplikasi kesehatan dan industri. Keberadaan senyawa fenolik seperti asam vanilat, asam galat, dan quercetin menggarisbawahi potensi daun ini sebagai sumber daya alam yang ampuh untuk memerangi stres oksidatif dan mengobati penyakit neurodegeneratif. Efek penghambatan yang diamati pada BChE dan α-glukosidase menunjukkan peran penting ML dalam aplikasi terapeutik yang terkait dengan neuroproteksi dan gangguan metabolisme. Temuan ini menyoroti penggunaan berkelanjutan dari sifat bioaktif ML, yang menyediakan landasan bagi pengembangan produk inovatif baik dalam industri makanan maupun farmasi. Studi ini berkontribusi pada semakin banyaknya bukti yang mendukung penggunaan sumber bioaktif alami dalam aplikasi terapeutik dan industri. Namun, penelitian lanjutan diperlukan untuk memvalidasi penerapan klinis dari hasil ini secara komprehensif. Meskipun hasilnya menjanjikan, keterbatasan tertentu harus diatasi. Sifat in vitro dari penelitian ini memerlukan uji klinis dan in vivo untuk memastikan kemanjuran dan keamanan ekstrak ML dalam aplikasi di dunia nyata. Selain itu, faktor-faktor seperti bioavailabilitas, optimalisasi dosis, dan potensi toksisitas perlu diperiksa secara ketat. Meskipun demikian, penelitian ini memberikan kontribusi yang signifikan terhadap literatur dengan menyoroti potensi daun ML sebagai sumber senyawa bioaktif yang alami dan berkelanjutan. Penelitian ini membuka jalan bagi eksplorasi lebih lanjut terhadap aplikasi terapeutik dan industrinya, yang menawarkan peluang baru untuk pengembangan produk yang inovatif.

