
ABSTRAK
Osteoporosis, yang ditandai dengan berkurangnya kepadatan mineral tulang (BMD) dan gangguan mikroarsitektur tulang, memberikan beban kesehatan dan ekonomi global yang signifikan, khususnya pada wanita pascamenopause. Studi ini menyelidiki kemanjuran suplemen baru yang menggabungkan ekstrak tanduk rusa pilose dan hidroksitirosol (kapsul Ruiling) dalam meningkatkan kesehatan tulang pada uji coba pada hewan dan manusia. Dalam model tikus osteoporosis, suplementasi Ruiling secara signifikan meningkatkan BMD dan kandungan kalsium tulang, khususnya pada dosis sedang, melampaui kontrol yang tidak diobati dan memulihkan nilai ke tingkat yang sebanding dengan tikus non-osteoporosis. Dalam uji klinis paralel acak, tersamar ganda, terkontrol plasebo, wanita pascamenopause yang menerima kapsul Ruiling selama 32 minggu menunjukkan peningkatan yang nyata pada BMD tulang belakang lumbar dan leher femoralis, penanda pergantian tulang, aktivitas enzim antioksidan, dan berkurangnya nyeri punggung bawah dibandingkan dengan kelompok plasebo. Tidak ada efek samping yang diamati, yang menunjukkan bahwa modulasi stres oksidatif dapat mendukung efek perlindungan tulang. Temuan ini menyoroti potensi menggabungkan ekstrak tanduk rusa pilose dan hidroksitirosol untuk mengatasi patogenesis osteoporosis multifaktorial. Kapsul Ruiling merupakan intervensi nonfarmakologis yang aman yang menawarkan manfaat struktural dan fungsional serta dapat berkontribusi pada pengelolaan osteoporosis jangka panjang pada populasi lanjut usia.
1 Pendahuluan
Osteoporosis ditandai dengan penurunan kepadatan mineral tulang (BMD) dan kerusakan mikroarsitektur tulang, yang mengakibatkan peningkatan risiko patah tulang karena kerapuhan sebagai konsekuensi klinis utama penyakit ini. (Kanis et al. 2019 , 1994 ; Lorentzon dan Cummings 2015 ). Studi epidemiologi telah melaporkan bahwa prevalensi osteoporosis global di antara pria dan wanita masing-masing adalah 11,7% dan 23,1% (Salari et al. 2021 ). Fraktur osteoporosis menimbulkan beban penyakit yang tinggi dan menyebabkan biaya perawatan kesehatan yang signifikan (Rashki Kemmak et al. 2020 ). Di Kanada, Eropa, dan AS saja, biaya tahunan langsung untuk mengobati patah tulang osteoporosis pada orang diperkirakan antara 5000 dan 6500 miliar USD (Rashki Kemmak et al. 2020 ). Karena risiko osteoporosis dan fraktur osteoporosis meningkat seiring bertambahnya usia (Kanis 2002 ), beban kesehatan dan ekonomi yang disebabkan oleh fraktur osteoporosis diperkirakan akan meningkat seiring bertambahnya usia populasi global (Rowland 2009 ). Di Tiongkok, jumlah fraktur osteoporosis tahunan diproyeksikan meningkat sebesar 135% dari 6,9 juta pada tahun 2020 menjadi 16,2 juta pada tahun 2024 karena populasi yang menua, dengan beban ekonomi yang meningkat drastis terkait dengan fraktur ini (Cui et al. 2021 ).
Wanita pascamenopause sangat rentan terhadap osteoporosis (Cosman et al. 2014 ; Lei et al. 2023 ), terutama karena penurunan tiba-tiba estrogen sistemik menghilangkan berbagai hambatan pada resorpsi tulang (Manolagas et al. 2013 ). Defisiensi estrogen meningkatkan regulasi RANKL, menurunkan regulasi reseptor umpannya osteoprotegerin (OPG), memperpanjang kelangsungan hidup osteoklas, dan melepaskan sitokin pro-resorptif seperti TNF-α, IL-1, IL-6, dan IFN-γ dari sel-sel garis keturunan osteoblas dan sel imun (Eastell et al. 2016 ). Ia juga mengubah sel-T memori yang diam menjadi sel efektor yang mensekresi IL-17 dan TNF-α (Cenci et al. 2000 ; Tyagi et al. 2012 ), yang selanjutnya memperkuat ekspresi RANKL dan osteoklastogenesis. Bersamaan dengan itu, penurunan estrogen melemahkan pertahanan antioksidan (superoksida dismutase, glutathione peroksidase), menciptakan stres oksidatif kronis di mana spesies oksigen reaktif (ROS) merangsang diferensiasi osteoklas (Manolagas 2010 ), memicu apoptosis osteosit dan osteoblas (Cruzoé-Souza et al. 2009 ) dan menekan pensinyalan Wnt/β-catenin pada progenitor osteoblas (Seibel et al. 2013 ). Penghinaan yang disebabkan oleh peradangan imun dan redoks ini, bersama dengan penuaan seluler terkait usia dan aktivitas SIRT1 yang berkurang pada sel pembentuk tulang, mengalihkan komitmen sel punca mesenkimal dari osteogenesis menuju adipogenesis (Sasaki et al. 2020 ). Hasil akhirnya adalah remodeling tulang yang tidak seimbang, dan kehilangan tulang bersih yang cepat terjadi setelah menopause, terutama pada tulang kanselus dalam 5 tahun pertama setelah menopause dan kemudian pada ruang tulang kortikal dan trabekular dengan kecepatan yang lebih lambat (Manolagas et al. 2013 ; Zhivodernikov et al. 2023 ).
Karena menopause tidak dapat dihindari, mengurangi kehilangan tulang pascamenopause dan mempertahankan BMD sangat penting untuk kesejahteraan jangka panjang wanita. Selain pendekatan pencegahan berbasis gaya hidup, termasuk asupan kalsium dan vitamin D yang cukup, peningkatan tingkat aktivitas fisik dan olahraga, berhenti merokok, dan mengurangi konsumsi alkohol (Cosman et al. 2014 ), farmakoterapi saat ini untuk osteoporosis terbagi dalam dua kategori utama: anti-resorptif (mengurangi pergantian tulang) dan anabolik (pembentukan tulang) (Langdahl 2021 ). Bifosfonat, termasuk alendronat, risedronat, ibandronat, dan zoledronat, adalah anti-resorptif lini pertama (Russell 2011 ). Denosumab, antibodi RANKL, digunakan sebagai alternatif bifosfonat dan telah terbukti mengurangi pergantian tulang dan meningkatkan BMD (Cummings et al. 2009 ). Raloxifene, modulator reseptor estrogen selektif, disetujui untuk pencegahan dan pengobatan osteoporosis pascamenopause (Chen et al. 2019 ). Terapi pembentukan tulang meliputi hormon paratiroid dan peptida terkait hormon paratiroid, yang bekerja melalui reseptor PTH1 (Hattersley et al. 2016 ), PTH 1–34 manusia rekombinan (teriparatide) (Neer et al. 2001 ), dan antibodi sklerostin humanisasi romosozumab (Padhi et al. 2011 ).
Studi epidemiologi telah menunjukkan bahwa diet Mediterania, yang menonjolkan konsumsi minyak zaitun yang tinggi, dikaitkan dengan insiden yang lebih rendah dari kondisi kronis yang berkaitan dengan usia, termasuk osteoporosis (Keys 1995 ; Keys et al. 1986 ). Hidroksitirosol adalah senyawa fenolik yang diekstrak dari pohon zaitun (Puel et al. 2008 ; Wichers et al. 2000 ) dengan kapasitas antioksidan yang besar (Martínez et al. 2018 ), dan dianggap aman sebagai bahan makanan baru oleh Otoritas Keamanan Pangan Eropa (EFSA) (Panel EFSA tentang Produk Diet, Nutrisi, dan Alergi, et al. 2017 ). Penelitian sebelumnya telah melaporkan bahwa konsumsi hidroksitirosol menyebabkan pencegahan kehilangan tulang yang disebabkan oleh peradangan pada tikus yang diovariektomi (OVX) (Puel et al. 2008 , 2004 ). Selain itu, hidroksiltirosol telah terbukti memberikan efek perlindungan tulang melalui peningkatan diferensiasi osteoblas dan penghambatan aktivitas osteoklas (Hagiwara et al. 2011 ). Secara keseluruhan, aktivitas peningkatan kesehatan tulang yang sudah terbukti dan keamanan hidroksiltirosol menjadikannya kandidat yang berpotensi menarik untuk intervensi diet yang bertujuan untuk menjaga atau meningkatkan kesehatan tulang, terutama pada populasi yang rentan seperti wanita pascamenopause.
Secara paralel, sistem pengobatan tradisional telah lama mengenali produk-produk turunan hewani tertentu karena khasiatnya dalam mendukung tulang (Apaza et al. 2003 ; Hao et al. 2023 ; Liu et al. 2024 ). Tanduk rusa pilose/tanduk rusa beludru, komponen pengobatan tradisional Tiongkok, dipercaya dapat meningkatkan sistem kekebalan tubuh, kekuatan fisik, dan fungsi seksual (Gilbey dan Perezgonzalez 2012 ; Kawtikwar et al. 2010 ; Sui et al. 2014 ; Xia et al. 2022 ). Mengandung komponen bioaktif termasuk faktor pertumbuhan (Lai et al. 2007 ), kolagen (Jeon et al. 2012 ), polipeptida (Chen et al. 2007 ) dan glikosaminoglikan (Takeda-Okuda et al. 2019 ) yang dapat meningkatkan proliferasi osteoblas, mineralisasi matriks, dan integritas rangka secara keseluruhan (Linkhart et al. 1996 ; Shi et al. 1996 ). Penelitian terkini telah menunjukkan bahwa suplementasi dengan ekstrak tanduk pilose meningkatkan kepadatan tulang dan kekuatan mekanis pada model hewan dengan meningkatkan ekspresi protein morfogenetik tulang-2 (BMP-2) dan kolagen I (COL-1) (Ren et al. 2019 ) dan dengan mengurangi ekspresi kinase 1 yang diatur sinyal ekstraseluler (ERK-1), kinase terminal N c-Jun (JNK), dan metaloproteinase matriks-9 (MMK-9) (Liu et al. 2023 ).
Meskipun manfaat individual dari hidroksitirosol dan ekstrak tanduk pilosa pada kesehatan tulang telah ditetapkan, efek kombinasinya belum diselidiki. Mengingat etiologi osteoporosis multifaktorial, termasuk ketidakseimbangan hormon yang menyeluruh, stres oksidatif, peradangan kronis, dan gangguan remodeling tulang, pendekatan gabungan yang menargetkan beberapa pendorong patologis dapat memberikan hasil bermanfaat yang lebih kuat (Manolagas dan Jilka 1995 ). Alasan untuk menggabungkan hidroksitirosol dan ekstrak tanduk pilosa terletak pada cara kerja komplementernya: efek antioksidan dan antiinflamasi hidroksitirosol yang kuat bersamaan dengan dukungan osteogenik dan remodeling tulang tanduk pilosa. Strategi aksi ganda ini dapat menghasilkan peningkatan kumulatif dalam BMD, mikroarsitektur tulang, dan integritas rangka secara keseluruhan.
Oleh karena itu, penelitian ini menyelidiki kemanjuran suplementasi gabungan dengan ekstrak tanduk rusa pilose dan hidroksitirosol (disebut kapsul Ruiling) dalam meningkatkan BMD dan parameter tulang terkait pada model hewan dan wanita pascamenopause. Dengan mengeksplorasi efek terpadunya, kami bertujuan untuk mengidentifikasi intervensi nonfarmakologis baru untuk pencegahan dan penanganan osteoporosis. Pada akhirnya, temuan ini dapat mendukung pengembangan formulasi diet fungsional yang membantu menjaga kesehatan tulang, meningkatkan kualitas hidup, dan mengurangi beban perawatan kesehatan jangka panjang yang terkait dengan osteoporosis.
2 Bahan dan Metode
2.1 Studi Hewan
2.1.1 Hewan Percobaan dan Kondisi Kandang
Enam puluh tikus Sprague–Dawley (SD) betina pada tingkat Bebas Patogen Spesifik (SPF) dipasok oleh Chengdu Dashuo Biotechnology Co. Ltd. (Nomor Lisensi: SCXK(Chuan)2013-24). Hewan-hewan tersebut ditempatkan dalam sistem kandang berventilasi individual (IVC) tingkat penghalang yang disetujui oleh Komite Manajemen Hewan Eksperimen Provinsi Sichuan (Nomor Lisensi: SYXK(Chuan)2013-011). Makanan standar dipasok oleh Chengdu Dashuo Biotechnology Co. Ltd. Selama percobaan, tikus-tikus tersebut memiliki akses bebas ke makanan dan air. Suhu kandang dipertahankan pada 20°C–23°C dengan kelembaban relatif 55%–66%.
2.1.2 Metode Eksperimen pada Studi Hewan
Setelah aklimatisasi pada diet basal, tikus-tikus tersebut secara acak dibagi menjadi lima kelompok berdasarkan berat badan: kelompok yang menjalani operasi semu, kelompok kontrol model, dan tiga kelompok yang menerima dosis Ruiling yang berbeda ( n = 12 per kelompok). Untuk kelompok yang menjalani operasi semu, anestesi diinduksi dengan injeksi intraperitoneal natrium pentobarbital 3%. Dalam kondisi aseptik yang ketat, sayatan dorsal bilateral dibuat di dekat vertebra lumbar untuk mengakses rongga perut, dan sebagian kecil mesenterium usus halus diangkat. Hemostasis dicapai dengan hati-hati sebelum menutup sayatan berlapis-lapis.
Untuk kelompok kontrol model (kontrol) dan tiga kelompok dosis Ruiling, prosedur estetika dan aseptik yang sama diikuti. Sayatan dorsal bilateral dibuat dengan cara yang sama untuk memasuki rongga perut secara medial, dan kedua ovarium diangkat seluruhnya. Sayatan ditutup berlapis-lapis setelah hemostasis dipastikan.
Pada hari ketiga pasca-operasi, kelompok yang menjalani operasi semu dan kelompok kontrol model diberikan air suling melalui gavage oral. Ketiga kelompok dosis Ruiling menerima larutan yang sesuai dengan 140 mg/kg berat badan (bb) (dosis rendah), 280 mg/kg bb (dosis sedang), dan 840 mg/kg bb (dosis tinggi). Untuk menyiapkan larutan, 1,4 g, 2,8 g, dan 8,4 g bahan kapsul Ruiling masing-masing dilarutkan dalam air suling dan dibuat hingga volume akhir 100 mL, menghasilkan konsentrasi yang dibutuhkan untuk masing-masing 140 mg/kg bb, 280 mg/kg bb, dan 840 mg/kg bb. Semua hewan menerima volume dosis 10 mL/kg bb melalui gavage oral sekali sehari selama 90 hari berturut-turut. Berat badan dicatat setiap minggu, dan volume gavage disesuaikan sebagaimana mestinya.
Pada akhir periode percobaan, hewan-hewan tersebut disuntik mati. Tulang paha kanan dipotong, dikeringkan dalam oven pada suhu 105°C hingga beratnya konstan, lalu ditimbang untuk menentukan massa tulang. Kepadatan mineral tulang (BMD) tulang paha kiri dinilai menggunakan sistem sinar-X hewan kecil (Bruker In Vivo DXS Pro). Kandungan kalsium pada tulang paha kanan diukur menggunakan spektrofotometri serapan atom.
2.1.3 Analisis Statistik dalam Studi Hewan
Perhitungan statistik dilakukan dengan menggunakan perangkat lunak statistik medis edisi PEMS3.1 yang dikembangkan oleh Bagian Pengajaran Statistik Rumah Sakit Huaxi. Perbedaan antara kelompok model dan kelompok yang menjalani operasi semu dinilai menggunakan uji-t. Untuk perbandingan berbagai indikator antara setiap kelompok dosis dan kelompok model, analisis varians (ANOVA) digunakan. Jika data tidak memenuhi asumsi untuk ANOVA, uji jumlah peringkat nonparametrik digunakan.
2.2 Studi Manusia
2.2.1 Desain Penelitian
Uji klinis paralel acak, tersamar ganda, terkontrol plasebo ini dilakukan di Rumah Sakit Ortopedi Bayi. Sebanyak 120 wanita pascamenopause dengan osteoporosis dibagi secara merata ke dalam dua kelompok: kelompok observasi (intervensi) dan kelompok kontrol, masing-masing menerima kapsul Ruiling plus kalsium karbonat (intervensi) atau plasebo plus kalsium karbonat (kontrol). Seluruh durasi penelitian adalah 32 minggu (8 bulan), dengan penilaian dilakukan pada awal dan di akhir periode pengobatan.
2.2.2 Peserta Studi
120 wanita pascamenopause yang memenuhi syarat dengan osteoporosis direkrut dan ditugaskan secara acak (rasio 1:1) ke kelompok observasi ( n = 60) atau kelompok kontrol ( n = 60).
Kriteria inklusi adalah: (1) T -skor ≤ −2,5 SD pada kerangka aksial atau sepertiga distal radius berdasarkan hasil dual-energy x-ray absorptiometry (DXA); (2) pascamenopause selama ≥ 2 tahun; (3) usia 46–65 tahun; (4) nyeri punggung bawah dasar dengan skor Visual Analog Scale (VAS) ≥ 4; dan (5) penyediaan persetujuan tertulis.
Kriteria eksklusi meliputi osteoporosis sekunder, penggunaan obat osteoporosis baru-baru ini, misalnya, terapi bifosfonat, suplemen kalsium atau vitamin D, keganasan, penyakit sistemik yang parah, gangguan kejiwaan, alergi yang diketahui terhadap produk yang diteliti, dan fungsi hati atau ginjal yang tidak normal.
Peserta yang menarik persetujuan, tidak ditindaklanjuti, menunjukkan kepatuhan yang buruk (asupan di luar 80%–120% dari dosis yang ditentukan), atau mengalami efek samping berat yang memerlukan pencabutan status buta dianggap mengundurkan diri. Kasus yang salah didiagnosis, yang memenuhi kriteria eksklusi setelah pendaftaran, dan peserta tanpa pengobatan atau data apa pun dikeluarkan dari analisis efikasi tetapi dipertahankan untuk penilaian keamanan jika berlaku.
2.2.3 Prosedur
Setelah pengacakan dan penilaian awal, kelompok observasi menerima kapsul Ruiling (2 kapsul per dosis) ditambah kalsium karbonat (1 kapsul per dosis), dua kali sehari. Kelompok kontrol menerima kapsul plasebo yang identik (2 kapsul per dosis) ditambah kalsium karbonat (1 kapsul per dosis), dua kali sehari. Kapsul Ruiling (Nomor Batch: 230110) dan plasebo yang cocok (Nomor Batch: 230115) diproduksi oleh Chengdu Yiping Pharmaceutical Technology Development Co. Ltd. Kalsium karbonat (Nomor Batch: 221004) diperoleh dari Liaoning Kangchen Pharmaceutical Co. Ltd.
Semua peserta melanjutkan rejimen pengobatan yang ditetapkan selama 8 bulan (32 minggu). Tidak ada pengobatan osteoporosis lain yang diizinkan, tetapi pengobatan yang diperlukan untuk kondisi komorbiditas dapat dilanjutkan dan dicatat. Kunjungan awal dan tindak lanjut 32 minggu mencakup penilaian nyeri (VAS), kepadatan mineral tulang (BMD), dan penanda metabolisme tulang. Evaluasi keamanan, termasuk pemeriksaan fisik umum, tes darah dan urine, EKG, dan pencitraan, dilakukan pada awal dan pada minggu ke-32.
Untuk mempertahankan penyamaran, plasebo disesuaikan dengan produk aktif dalam hal tampilan, bau, dan kemasan. Pihak ketiga yang tidak terlibat dalam penelitian ini memberikan nomor acak dan menyiapkan kotak penelitian berkode. Penyamaran darurat hanya diizinkan dalam kondisi klinis kritis, dan kasus seperti itu ditangani sebagai penarikan dalam analisis khasiat.
2.2.4 Biokimia
Penilaian biokimia dilakukan pada awal dan setelah 32 minggu pengobatan. Penanda metabolisme tulang meliputi β-crossLaps (β-CTx), prokolagen tipe I N-terminal propeptida (P1NP), dan 25-hidroksivitamin D (25(OH)D), yang diukur melalui uji elektrokhemiluminesensi. Penanda kadar oksidatif meliputi malondialdehid (MDA), superoksida dismutase (SOD) dan glutathione peroksidase (GSH-Px) diukur untuk menilai kemanjuran kapsul Ruiling dalam antioksidasi.
Parameter biokimia yang terkait dengan keselamatan meliputi hitung darah lengkap, urinalisis, glukosa darah puasa, enzim hati, tes fungsi ginjal, serta kadar hormon seks. Pemeriksaan ultrasonografi payudara dan rahim juga dilakukan.
2.2.5 Hasil
2.2.5.1 Hasil Khasiat Utama (Kesehatan Tulang)
- Nyeri Punggung Bawah (VAS): Skala VAS 0–10 cm digunakan, dengan skor yang lebih tinggi menunjukkan nyeri yang lebih parah. Pengukuran dilakukan pada awal dan setelah 32 minggu pengobatan.
- Kepadatan Mineral Tulang (BMD): BMD di tulang belakang lumbar (L2–L4) dan leher femur kanan diukur menggunakan DXA pada awal dan 32 minggu.
- Penanda Metabolisme Tulang: Kadar β-CTx, P1NP, dan 25(OH)D dinilai pada awal dan 32 minggu.
2.2.5.2 Hasil Khasiat Sekunder (Aktivitas Anti-Oksidan)
Aktivitas antioksidan kapsul Ruiling dinilai melalui pengukuran kadar serum MDA, SOD, dan GSH-Px.
2.2.5.3 Hasil Keselamatan
Pemeriksaan fisik umum, tes fungsi hati dan ginjal, analisis darah dan urine, dan studi pencitraan (misalnya, USG payudara dan rahim) dievaluasi pada awal dan pada minggu ke-32 untuk menilai tolerabilitas dan keamanan.
2.2.6 Kepatuhan Pengobatan dan Kejadian Buruk
Kepatuhan dievaluasi dengan menghitung kapsul yang dikembalikan pada setiap kunjungan tindak lanjut. Kepatuhan yang baik didefinisikan sebagai mengonsumsi 80%–120% dari dosis yang ditentukan. Peneliti menyimpan catatan terperinci tentang jumlah kapsul studi yang diberikan, dikonsumsi, dan dikembalikan, serta kejadian buruk (AE). Semua AE dicatat pada formulir laporan kasus, dan peserta dengan AE yang parah atau tidak dapat ditoleransi ditarik dari uji klinis.
2.2.7 Analisis Statistik
Setelah validasi data dan penguncian basis data, semua analisis dilakukan menggunakan SPSS 25.0 (IBM Corp., Armonk, NY). Variabel kontinu dinyatakan sebagai mean ± simpangan baku (SD). Perbedaan antar kelompok dievaluasi dengan ANOVA, diikuti oleh uji-q post hoc jika ANOVA menunjukkan signifikansi. Uji- t berpasangan menilai perubahan dalam kelompok dari awal hingga 32 minggu. Untuk data yang tidak terdistribusi normal atau varians heterogen, digunakan uji-t atau rank-sum. Data ordinal dianalisis menggunakan analisis Ridit. Nilai – p < 0,05 dianggap signifikan secara statistik.
3 Hasil
3.1 Uji Coba Hewan
3.1.1 Pengaruh Kapsul Ruiling terhadap Berat Badan dan Pengukuran Tulang pada Tikus OVX
Pengaruh kapsul Ruiling pada berat badan tikus ditunjukkan pada Gambar 1A , semua kelompok menunjukkan peningkatan berat badan selama uji coba 90 hari. Kelompok SHAM meningkat dari 253,5 ± 11,4 g pada awal menjadi 302,8 ± 19,9 g pada akhir uji coba. Sebaliknya, kelompok Kontrol menunjukkan peningkatan dari 251,3 ± 9,9 g menjadi 403,3 ± 18,9 g, secara signifikan lebih tinggi daripada SHAM ( p < 0,01), konsisten dengan publikasi sebelumnya bahwa tikus betina OVX makan lebih banyak dan bertambah lebih banyak berat badan daripada tikus utuh (Blaustein dan Wade 1976 ; Geary dan Asarian 1999 ; Tarttelin dan Gorski 1971 ). Kelompok yang menerima suplementasi kapsul Ruiling dosis rendah, sedang, dan tinggi menunjukkan berat badan akhir masing-masing 403,4 ± 50,2 g, 387,4 ± 33,4 g, dan 394,6 ± 26,7 g. Meskipun nilai-nilai ini menunjukkan pertambahan berat badan yang serupa dengan kelompok Kontrol, tidak ada signifikansi statistik yang ditunjukkan di antara kelompok perlakuan relatif terhadap Kontrol dalam hal perubahan berat badan.
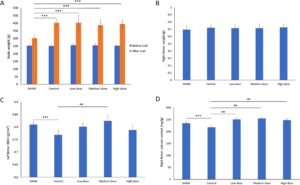
Berat femur kanan pada akhir percobaan sebanding di semua kelompok (Gambar 1B ). Kelompok SHAM memiliki berat femur rata-rata 0,693 ± 0,05 g, sedangkan kelompok Kontrol berukuran 0,72 ± 0,04 g. Kelompok dosis rendah, sedang, dan tinggi memiliki berat femur masing-masing 0,714 ± 0,052 g, 0,714 ± 0,055 g, dan 0,725 ± 0,044 g. Meskipun kelompok perlakuan cenderung menunjukkan berat femur yang sedikit lebih tinggi dibandingkan dengan SHAM, tidak ada perbedaan signifikan yang diamati.
Pengukuran BMD femur kiri menunjukkan perbedaan yang jelas di antara kelompok-kelompok (Gambar 1C ). Kelompok SHAM mempertahankan nilai BMD tertinggi pada 0,8101 ± 0,01 g/cm3 . Sebaliknya, kelompok Kontrol menunjukkan BMD yang berkurang sebesar 0,7688 ± 0,018 g/ cm3 , yang menunjukkan penurunan yang signifikan ( p < 0,01) relatif terhadap SHAM. Khususnya, suplementasi dosis sedang menghasilkan BMD sebesar 0,8244 ± 0,023 g/cm3 , yang menunjukkan peningkatan yang signifikan ( p < 0,01) dibandingkan dengan Kontrol dan bahkan melampaui baseline SHAM. Walaupun kelompok dosis rendah (0,8015 ± 0,015 g/cm 3 ) dan dosis tinggi (0,7883 ± 0,02 g/cm 3 ) menunjukkan peningkatan BMD relatif terhadap Kontrol, hanya dosis sedang yang mencapai tingkat signifikansi, seperti yang ditunjukkan pada Gambar 1C .
Kandungan kalsium femur kanan diukur pada akhir percobaan (Gambar 1D ). Kelompok SHAM memiliki kandungan kalsium sebesar 234,86 ± 6,32 mg/g, sedangkan nilai kelompok Kontrol turun signifikan menjadi 217,91 ± 7,82 mg/g ( p < 0,01). Semua kelompok yang diberi suplemen menunjukkan peningkatan yang nyata dalam kandungan kalsium femur: dosis rendah 250,82 ± 6,03 mg/g, dosis sedang 254,98 ± 4,25 mg/g, dan dosis tinggi 248,06 ± 6,13 mg/g. Semua kelompok dosis menunjukkan peningkatan yang signifikan ( p < 0,01) dibandingkan dengan Kontrol, yang menunjukkan bahwa pemberian kapsul Ruiling secara efektif memulihkan kadar mineralisasi tulang pada tikus OVX.
3.2 Uji Coba pada Manusia
3.2.1 Karakteristik Dasar
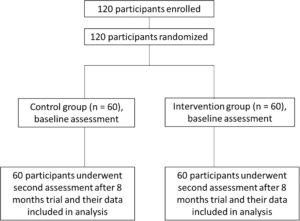
Sebanyak 120 pasien osteoporosis pascamenopause didaftarkan dan diacak ke dalam dua kelompok (Kelompok perlakuan: n = 60; Kelompok kontrol: n = 60) seperti yang ditunjukkan dalam diagram alir penelitian pada Gambar 2. Tidak ada perbedaan signifikan yang diamati antara kedua kelompok sehubungan dengan variabel demografi dasar (usia, tahun sejak menopause, tinggi badan, berat badan, dan BMI), tanda-tanda vital (denyut jantung, tekanan darah), atau ukuran efikasi dasar (skor nyeri punggung bawah, BMD tulang belakang lumbar dan leher femur, P1NP, β-CLx, dan kadar 25-hidroksivitamin D) ( p > 0,05). Temuan ini menunjukkan bahwa kedua kelompok tersebut sebanding pada awal penelitian (Tabel 1 ).
| Kelompok kontrol ( n = 60) | Kelompok intervensi ( n = 60) | |
|---|---|---|
| Usia | 56,73 ± 4,26 | 56,97 ± 3,89 |
| Tahun sejak menopause | 6,30 ± 3,66 | 7,03 ± 3,45 |
| Tinggi (cm) | 154,3 ± 4,14 | 155,87 ± 5,16 |
| Berat (kg) | 57,79 ± 4,12 | 56,66 ± 3,78 |
| BMI (kg/ m2 ) | 24.30 ± 2.21 | 23,39 ± 2,25 |
| Skor nyeri punggung (VAS) | 5,57 ± 1,41 | 5,63 ± 1,24 |
| Berat Badan Metabolik (BMD): L2–L4 (g/ cm2 ) | 0,65 ± 0,09 | 0,65 ± 0,09 |
| BMD: leher femur (g/ cm2 ) | 0,62 ± 0,08 | 0,61 ± 0,07 |
| P1NP (μg/L) | 49,83 ± 5,97 | 50,26 ± 6,03 |
| β-CTx (ng/L) | 540,16 ± 23,46 | 539,45 ± 24,83 |
| 25 (OH)D (ng/ml) | 26,41 ± 7,83 | 25,74 ± 7,39 |
Catatan: Data disajikan sebagai mean ± SD.
3.2.2 Skor Nyeri Punggung Bawah
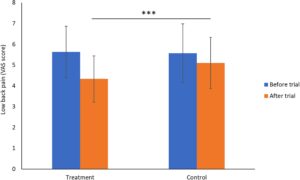
Khasiat kapsul Ruiling terhadap nyeri punggung bawah peserta dinilai dan hasilnya ditunjukkan pada Gambar 3. Sebelum perawatan, tidak ada perbedaan signifikan dalam skor nyeri punggung bawah (VAS) antara kedua kelompok ( p > 0,05). Setelah 32 minggu perawatan, kedua kelompok menunjukkan penurunan skor nyeri, tetapi penurunan lebih jelas pada kelompok perawatan setelah uji coba dibandingkan dengan kelompok kontrol setelah uji coba ( p < 0,01). Secara khusus, skor VAS kelompok perawatan menurun dari 5,63 ± 1,24 menjadi 4,33 ± 1,11, sedangkan skor kelompok kontrol berubah dari 5,57 ± 1,41 menjadi 5,10 ± 1,23.
3.2.3 Kepadatan Mineral Tulang (BMD)
Khasiat kapsul Ruiling dalam meningkatkan BMD peserta di L2–L4 (Gambar 4A ) dan leher femur (Gambar 4B ) dinilai dan hasilnya ditunjukkan pada Gambar 4 . BMD dasar di L2–L4 dan leher femur kanan tidak berbeda secara signifikan antara kedua kelompok ( p > 0,05). Setelah 32 minggu pengobatan, kelompok pengobatan menunjukkan nilai BMD yang secara signifikan lebih tinggi di kedua lokasi dibandingkan dengan kelompok kontrol ( p < 0,01). Misalnya, BMD leher femur rata-rata dalam kelompok intervensi meningkat dari 0,61 ± 0,07 g/cm 2 menjadi 0,70 ± 0,11 g/cm 2 , sedangkan BMD kelompok kontrol hanya meningkat dari 0,62 ± 0,08 g/cm 2 menjadi 0,64 ± 0,09 g/cm 2 . Pola serupa diamati di daerah L2–L4 (Gambar 4A ). Skor- T yang sesuai dihitung sebagaimana mestinya (Xue et al. 2021 ) dan ditunjukkan dalam Tabel 2. Peserta di kedua kelompok dianggap menderita osteoporosis karena skor- T mereka < −2,5. Setelah intervensi selama 32 minggu, peserta dalam kelompok intervensi yang menerima kapsul Ruiling plus kalsium karbonat menunjukkan peningkatan skor- T di lokasi L2–L4 (−2,91 hingga −2,33) dan leher femur (−2,9 hingga −2,0) dibandingkan dengan nilai dasar mereka. Sebaliknya, kelompok kontrol, yang menerima plasebo plus kalsium karbonat, menunjukkan lebih sedikit peningkatan. Hasil-hasil ini menunjukkan bahwa pengobatan yang diberikan kepada kelompok pengobatan secara efektif meningkatkan kepadatan tulang selama periode studi.

| Kelompok intervensi ( n = 60) | Kelompok kontrol ( n = 60) | |||
|---|---|---|---|---|
| Sebelum persidangan | Setelah persidangan | Sebelum persidangan | Setelah persidangan | |
| Bahasa Indonesia: L2–L4 | -2,91 ± 0,75 | -2,33 ± 1,00 | -3,08 ± 0,67 | -2,92 ± 0,83 |
| Leher femoralis | -2,90 ± 0,70 | -2,0 ± 1,10 | -2,8 ± 0,80 | -2,6 ± 0,90 |
Catatan: Data disajikan sebagai mean ± SD.
3.2.4 Penanda Metabolisme Tulang
Khasiat kapsul Ruiling dalam meningkatkan penanda biokimia terkait kesehatan tulang peserta dinilai (Gambar 5 ). Pada awal, tidak ada perbedaan signifikan antara kelompok dalam kadar β-CLx (Gambar 5A ), P1NP (Gambar 5B ), dan 25(OH)D (Gambar tambahan 1) ( p > 0,05). Setelah 32 minggu, kelompok perlakuan menunjukkan pengurangan substansial dalam β-CLx (dari 539,45 ± 24,83 ng/L menjadi 471,34 ± 22,87 ng/L) dan peningkatan nyata dalam P1NP (dari 50,26 ± 6,03 μg/L menjadi 69,18 ± 8,14 μg/L), kedua perubahan tersebut mencapai signifikansi statistik ( p < 0,01 dibandingkan dengan Kontrol). Sebaliknya, kelompok kontrol hanya menunjukkan perubahan sederhana pada penanda ini (β-CLx: 540,16 ± 23,46 ng/L menjadi 523,75 ± 25,83 ng/L; P1NP: 49,83 ± 5,97 μg/L menjadi 51,41 ± 9,86 μg/L) tanpa perbedaan yang signifikan. Tidak ada perbedaan signifikan yang diamati pada kadar 25-hidroksivitamin D setelah pengobatan antara kedua kelompok (Gambar 1 yang diperluas).

3.2.5 Khasiat Antioksidan
Khasiat antioksidan kapsul Ruiling dinilai dengan mengukur kadar MDA serum peserta (Gambar 2 yang diperluas), GSH-Px (Gambar 6A ) dan aktivitas SOD (Gambar 6B ). Seperti yang ditunjukkan pada Gambar 2 yang diperluas, tidak ada perbedaan signifikan dalam konsentrasi MDA sebelum dan sesudah intervensi dalam kelompok perlakuan (7,92 ± 0,21 nmol/mL vs. 7,89 ± 0,28 nmol/mL) atau kontrol (7,92 ± 0,19 nmol/mL vs. 7,85 ± 0,29 nmol/mL) ( p > 0,05). Selain itu, perbandingan kadar MDA pasca-perlakuan antara kelompok perlakuan dan kontrol tidak menunjukkan perbedaan yang signifikan secara statistik ( p > 0,05). Temuan ini menunjukkan bahwa intervensi tidak memiliki dampak yang berarti pada peroksidasi lipid sebagaimana tercermin oleh kadar MDA.

Gambar 6A menunjukkan bahwa, dalam kelompok perlakuan, aktivitas GSH-Px meningkat secara signifikan setelah intervensi (148,91 ± 7,11 U/mL) dibandingkan dengan nilai awal (137,85 ± 8,08 U/mL) ( p < 0,01), yang menunjukkan peningkatan dalam sistem antioksidan endogen. Namun, kelompok kontrol tidak menunjukkan perubahan signifikan dalam aktivitas GSH-Px dari sebelum hingga setelah intervensi ( p > 0,05).
Perbandingan antar kelompok tidak menunjukkan perbedaan signifikan dalam aktivitas GSH-Px pada awal (137,85 ± 8,08 U/mL vs. 142,69 ± 16,35 U/mL) ( p > 0,05). Namun, setelah intervensi, aktivitas GSH-Px kelompok perlakuan (148,91 ± 7,11 U/mL) secara signifikan lebih tinggi daripada kelompok kontrol (143,80 ± 16,30 U/mL) ( p < 0,05). Hasil ini menunjukkan bahwa intervensi yang diuji secara efektif meningkatkan kapasitas antioksidan yang dimediasi GSH-Px.
Gambar 6B menunjukkan bahwa kelompok percobaan mengalami peningkatan signifikan dalam aktivitas SOD (U/mL) setelah intervensi (70,21 ± 0,85 U/mL vs. 73,05 ± 2,14 U/mL) ( p < 0,01), sedangkan tidak ada perubahan signifikan yang diamati pada kelompok kontrol (71,10 ± 3,22 U/mL vs. 71,81 ± 3,92 U/mL) ( p > 0,05). Ketika membandingkan nilai pascaintervensi antara kedua kelompok, aktivitas SOD kelompok perlakuan jauh lebih tinggi daripada kelompok kontrol (73,05 ± 2,14 U/mL vs. 71,81 ± 3,92 U/mL) ( p < 0,01).
3.2.6 Kejadian Buruk dan Keamanan
Pemeriksaan darah rutin, tes fungsi hati dan ginjal tidak menunjukkan kelainan pada kedua kelompok sebelum atau sesudah intervensi (Tabel 3 ).
| Parameter | Kelompok intervensi ( n = 60) | Kelompok kontrol ( n = 60) | ||
|---|---|---|---|---|
| Sebelum persidangan | Setelah persidangan | Sebelum persidangan | Setelah persidangan | |
| Sel darah putih (109 / L) | 6,04 ± 1,77 | 5,85 ± 1,04 | 6,51 ± 1,69 | 6,30 ± 1,31 |
| Sel darah merah (10 12 /L) | 4,48 ± 0,61 | 4,57 ± 0,45 | 4,48 ± 0,52 | 4,54 ± 0,42 |
| Trombosit (109 / L) | 215,47 ± 48,04 | 216,05 ± 38,10 | 223,31 ± 55,15 | 228,81 ± 44,29 |
| Hemoglobin (gram/L) | 135,02 ± 12,87 | 132,64 ± 11,47 | 134,28 ± 16,33 | 132,63 ± 11,35 |
| Jumlah protein (gr/L) | 75,04 ± 3,55 | 74,18 ± 3,63 | 75,38 ± 3,18 | 75,54 ± 2,76 |
| Albumin (gr/L) | 48,08 ± 2,22 | 47,61 ± 2,12 | 46,62 ± 3,73 | 45,54 ± 2,55 |
| ALT (U/L) | 18,45 ± 7,90 | 18,40 ± 6,11 | 18,70 ± 6,56 | 19,56 ± 6,72 |
| AST (U/L) | 19,31 ± 4,29 | 19,80 ± 3,68 | 19,67 ± 4,78 | 19,69 ± 4,53 |
| Nitrogen urea (mmol/L) | 5,18 ± 1,15 | 5,31 ± 1,01 | 5,25 ± 1,16 | 5,45 ± 1,00 |
| Kreatinin (μmol/L) | 61,00 ± 11,10 | 62,35 ± 9,10 | 62,89 ± 12,52 | 61,52 ± 12,45 |
| Kolesterol total (mmol/L) | 5,14 ± 0,89 | 5,18 ± 0,69 | 5,72 ± 0,27 | 5,70 ± 0,24 |
| Trigliserida (mmol/L) | 1,13 ± 0,38 | 1,21 ± 0,32 | 1,83 ± 0,12 | 1,85 ± 0,13 |
| Glukosa (mmol/L) | 5,28 ± 0,73 | 5,07 ± 0,40 | 5,10 ± 0,49 | 5,19 ± 0,45 |
| Kadar HDL (mmol/L) | 1,52 ± 0,36 | 1,43 ± 0,20 | 1,31 ± 0,15 | 1,36 ± 0,19 |
| Asam urat (μmol/L) | 284,49 ± 61,00 | 279,40 ± 46,59 | 297,52 ± 62,64 | 296,13 ± 51,91 |
Catatan: Data disajikan sebagai mean ± SD, n = 60 pada kelompok intervensi dan kontrol.
Kejadian buruk yang dilaporkan sendiri (misalnya, mulut kering, konstipasi, gangguan pencernaan ringan, kelelahan) terjadi pada tingkat yang rendah dan tidak berbeda secara signifikan antara kedua kelompok ( p > 0,05). Tidak ada peningkatan yang signifikan secara statistik dalam reaksi buruk yang terkait dengan rejimen pengobatan pada kelompok Observasi dibandingkan dengan kelompok Kontrol (Tabel 4 ).
| N | Mulut kering | Sembelit | Gangguan pencernaan | Kelelahan | % | |
|---|---|---|---|---|---|---|
| Perlakuan | 60 | angka 0 | 3 | 2 | 5 | 11.1 |
| Kontrol | 60 | 3 | 4 | 2 | angka 0 | 10.0 |
Singkatnya, pasien yang menerima kapsul Ruiling sebagai tambahan kapsul kalsium karbonat (kelompok perawatan) menunjukkan perbaikan signifikan pada nyeri punggung bawah, BMD, pergantian tulang, dan profil penanda antioksidan tanpa peningkatan signifikan pada efek samping. Hal ini menunjukkan bahwa perawatan tersebut dapat memberikan pilihan yang aman dan efektif untuk mengelola osteoporosis pascamenopause.
4 Diskusi
Studi ini menyajikan bukti baru yang mendukung kemanjuran suplemen gabungan yang berasal dari ekstrak tanduk rusa pilose dan ekstrak zaitun yang kaya hidroksitirosol (kapsul Ruiling) meningkatkan kesehatan tulang baik pada model hewan osteoporosis maupun pada wanita pascamenopause. Hasilnya menunjukkan efek menguntungkan pada BMD, penanda pergantian tulang, pengurangan nyeri, dan aktivitas enzim antioksidan, yang menunjukkan efek gabungan antara ekstrak tanduk rusa pilose dan hidroksitirosol dapat menawarkan strategi nonfarmakologis yang menjanjikan untuk pencegahan dan penanganan osteoporosis.
Tanduk pilose telah digunakan selama berabad-abad dalam pengobatan tradisional Timur untuk mendukung kesehatan secara keseluruhan dan dianggap efektif dalam meringankan gejala klinis kondisi yang serupa dengan osteoporosis (Chen et al. 2015 ; Liu et al. 2023 ; Ren et al. 2019 ; Yun et al. 2020 ). Penelitian sebelumnya mengonfirmasi bahwa suplementasi makanan dengan tanduk pilose dapat secara langsung mengatur pertumbuhan dan remodeling tulang (Hemmings dan Song 2004 ), kemungkinan karena komposisinya yang kaya dan kompleks. Tanduk pilose mengandung asam amino esensial, kolagen, glikosaminoglikan, kondroitin sulfat, proteoglikan, berbagai mineral (Ca, P, Fe, Zn), faktor pertumbuhan (misalnya, BMP, FGF), dan berbagai lipid (Sui et al. 2014 ; Tsujibo et al. 1987 ). Bagian tanduk rusa pilose yang larut dalam air (tanduk rusa beludru) mengandung glikosaminoglikan yang menunjukkan efek pemacu pertumbuhan pada sel (Sunwoo 1998 ; Sunwoo et al. 1997 ). Dilaporkan oleh Liu et al., polisakarida dan ekstrak polipeptida tanduk rusa pilose menimbulkan efek penghambatan signifikan pada resorpsi tulang pada osteoporosis pergantian tinggi dengan memodulasi jalur MAPK dan MMP9, mengurangi ekspresi dan aktivitas ERK1 dan JNK (Liu et al. 2023 ). Dan peptida yang diekstrak dari tanduk rusa pilose dilaporkan meningkatkan osteoblastogenesis dengan menangkal penekanan diferensiasi osteoblas yang diinduksi TNFα (Liu et al. 2017 ). Selain itu, komponen tulang rawan dari tanduk rusa pilose mengandung proteoglikan kondroitin sulfat (yang mencakup sekitar 90% dari total proteoglikan dalam tanduk rusa beludru) dan komponen terdeproteinasi (Sunwoo et al. 1998 ). Secara umum dipercaya bahwa proteoglikan tulang rawan ini mengatur retensi air, serta diferensiasi dan proliferasi kondrosit dalam jaringan tulang rawan (Alcaide-Ruggiero et al. 2023 ). Selain itu, empat jenis kolagen (I, II, III, dan X) telah diidentifikasi dan dilokalisasi secara imunohistokimia dalam tanduk rusa pilose (Price et al. 1996 ). Feng et al. menemukan bahwa ekstrak tanduk rusa pilose mengandung berbagai keluarga faktor pertumbuhan, termasuk protein morfogenetik tulang (BMP) (Feng et al. 1995 , 1997 ) dan faktor pertumbuhan fibroblas (FGF) (Sunwoo et al. 1997 ). Faktor pertumbuhan ini memiliki efek anabolik yang kuat pada jaringan tulang. Secara khusus, BMP memberikan efek lokal yang kuat pada pembentukan tulang (Cheng et al. 2001 ; Fujimura et al. 1995 ) dan sistem pensinyalan FGF menstimulasi osteogenesis, memulihkan mikroarsitektur trabekular, dan meningkatkan perbaikan fraktur (Dunstan et al. 1999); Nakamura et al. 1995 ). Kim et al. selanjutnya menunjukkan bahwa suplementasi dengan ekstrak tanduk rusa pilose (Kim et al. 2003 ) pada tikus osteoporosis mempertahankan struktur trabekular yang terhubung dengan baik, sehingga secara efektif mencegah hilangnya tulang.
Hidroksitirosol, senyawa fenolik yang ditemukan dalam buah zaitun dan diakui aman oleh EFSA (Panel EFSA tentang Produk Diet, Nutrisi, dan Alergi, et al. 2017 ), juga memiliki sejarah panjang konsumsi manusia (Fernandez-Bolanos et al. 2008 ; Martínez et al. 2018 ). Hidroksitirosol telah terbukti menghambat diferensiasi osteoklas melalui regulasi fungsi mitokondria dan jalur pensinyalan ERK dan JNK (Incani et al. 2010 ; Zhang et al. 2020 ), sehingga mencegah kerusakan yang disebabkan oleh stres oksidatif (OS) pada pra-osteoblas. Selain itu, hidroksitirosol mengurangi kehilangan tulang alveolar, meningkatkan aktivitas pembentukan tulang, menghambat diferensiasi osteoklas, dan mengurangi kadar OS pada tikus dengan periodontitis (Zhang et al. 2021 ). Baik oleuropein (10–100 μM) maupun hidroksitirosol (50–100 μM) secara dosis-tergantung menghambat pembentukan osteoklas berinti banyak (Hagiwara et al. 2011 ). Lebih jauh, kedua senyawa ini mencegah hilangnya tulang trabekular pada tulang paha tikus OVX (Hagiwara et al. 2011 ; Puel et al. 2008 ), sementara hidroksitirosol mengurangi kadar H 2 O 2 pada sel MC3T3-E1 (Gao et al. 2015 ). Temuan ini menunjukkan bahwa polifenol zaitun, termasuk oleuropein dan hidroksitirosol, mungkin memainkan peran kunci dalam pembentukan dan pemeliharaan tulang, dan dapat digunakan sebagai agen yang efektif untuk mengobati gejala-gejala yang berhubungan dengan osteoporosis.
Temuan kami menyoroti bahwa suplementasi gabungan (kapsul Ruiling) dengan hydroxytorosol dan ekstrak tanduk rusa pilose memberikan manfaat kombinasi. Studi pada hewan menunjukkan bahwa Ruiling memulihkan BMD dan meningkatkan kandungan kalsium tulang melebihi tingkat yang terlihat pada kontrol osteoporosis yang tidak diobati. Dalam uji coba pada manusia, suplementasi Ruiling secara signifikan meningkatkan BMD, penanda pergantian tulang, dan hasil nyeri, yang menunjukkan bahwa efek ini menghasilkan perbaikan yang bermakna secara klinis. Manfaat antioksidan yang diamati—termasuk peningkatan aktivitas GSH-Px dan SOD—menunjukkan bahwa peningkatan kesehatan tulang mungkin sebagian dimediasi oleh mitigasi stres oksidatif, mengurangi efek buruk OS pada sel-sel tulang dan jalur perombakan.
Khususnya, tidak ada efek samping signifikan yang terdeteksi pada hewan maupun manusia dalam penelitian ini, yang menggarisbawahi keamanan dan tolerabilitas kapsul Ruiling. Hal ini penting mengingat bahwa pengobatan farmakologis jangka panjang untuk osteoporosis mungkin dibatasi oleh masalah keamanan dan kepatuhan (Cornelissen et al. 2020 ). Sebaliknya, intervensi diet fungsional seperti kapsul Ruiling dapat berfungsi sebagai pelengkap atau alternatif obat konvensional yang lebih aman dan lebih mudah diakses, yang berpotensi meningkatkan kepatuhan dan kualitas hidup pasien.
Meskipun hasil yang menggembirakan ini, keterbatasan tertentu tetap ada. Kesehatan tulang terkait erat dengan parameter komposisi tubuh, termasuk indeks massa lemak (FMI) dan indeks otot rangka (SMI) (Villa et al. 2024 ), yang dapat dimasukkan dalam uji coba di masa mendatang. Studi klinis jangka panjang diperlukan untuk memastikan ketahanan manfaat yang diamati. Studi mekanistik pada tingkat molekuler dan seluler akan menjelaskan bagaimana ekstrak tanduk rusa pilose dan hidroksitirosol berinteraksi untuk memengaruhi jalur pensinyalan spesifik, mediator inflamasi, dan populasi sel tulang. Kelompok yang lebih besar dan lebih beragam dapat memvalidasi generalisasi temuan kami dan menyempurnakan strategi pemberian dosis.
5 Kesimpulan
Kesimpulannya, dengan memanfaatkan profil bioaktif kompleks dari ekstrak tanduk rusa pilose—kaya akan asam amino, glikosaminoglikan, kolagen, faktor pertumbuhan—dan sifat antioksidan kuat dari hidroksitirosol dari ekstrak zaitun, kapsul Ruiling menunjukkan intervensi yang menjanjikan untuk meningkatkan kesehatan tulang pada wanita pascamenopause dengan osteoporosis. Ini adalah pertama kalinya manfaat gabungan antara ekstrak tanduk rusa pilose dan hidroksitirosol diteliti pada hewan dan manusia. Pendekatan integratif ini mencerminkan kearifan medis tradisional dan penelitian nutrisi dan biomedis modern.

