
ABSTRAK
Penelitian anti-penuaan merupakan bidang yang penting dan menantang dalam ilmu biomedis. Sementara rhodoxanthin, karotenoid yang terjadi secara alami, telah menunjukkan sifat antioksidan awal, mekanisme anti-penuaan yang tepat masih kurang dipahami. Studi ini secara sistematis menyelidiki efek anti-penuaan rhodoxanthin dalam model penuaan murine yang diinduksi D-galaktosa dengan fokus khusus pada penjelasan mekanisme molekuler yang mendasarinya. Temuan kami mengungkapkan bahwa pemberian rhodoxanthin secara signifikan melemahkan kerusakan oksidatif di jaringan otak dan hati, sebagaimana dibuktikan dengan berkurangnya peroksidasi lipid dan peningkatan aktivitas enzim antioksidan utama. Pada dosis optimal (80 mg/kg rhodoxanthin), aktivitas enzim antioksidan dipulihkan hingga 84,3% (CAT), 66,7% (SOD), dan 145% (GPX) dari tingkat kontrol model di hati dan 61,36% (CAT), 4,2% (SOD), dan 22,2% (GPX) di otak. Studi mekanistik menunjukkan bahwa efek antipenuaan rhodoxanthin dimediasi melalui modulasi faktor nuklir erythroid-related factor Nrf2 dan jalur pensinyalan PI3K/Akt. Analisis kuantitatif menunjukkan peningkatan signifikan ekspresi Nrf2, PI3K, dan Akt di jaringan hati dan otak tikus yang menua, dan penilaian perilaku mengonfirmasi bahwa rhodoxanthin tidak hanya berfungsi sebagai antioksidan alami yang ampuh tetapi juga meningkatkan retensi memori dan fungsi kognitif pada subjek yang menua. Hasil ini secara kolektif menetapkan rhodoxanthin sebagai komponen fungsional makanan, dengan efek perlindungan ganda terhadap kerusakan oksidatif dan penurunan kognitif. Rhodoxanthin dapat digunakan sebagai antioksidan alami dalam industri makanan.
Singkatan
Bertindak
Protein kinase B
KUCING
Katalase
GPX
Glutation peroksidase
GSH
Glutathione tereduksi
HO-1
Interleukin-10
HPLC
Kromatografi cair kinerja tinggi
LDH
Laktat dehidrogenase
MDA
Malonaldehid
MS
Spektrometri massa
PI3K
Fosfplnositida-3 kinase
ROS
Oksigen aktif
MERUMPUT
Superoksida dismutase
SOD1
Superoksida dismutase 1
SOD2
Superoksida dismutase 2
UV dan Visibilitas
Spektrofotometri tampak
1 Pendahuluan
Populasi global saat ini sedang mengalami penuaan yang belum pernah terjadi sebelumnya, tren demografi yang disertai dengan penurunan progresif fungsi seluler dan organ yang secara signifikan meningkatkan kerentanan terhadap patologi terkait usia, termasuk penyakit kardiovaskular dan penurunan kognitif (Shen et al. 2017 ). Penelitian kontemporer mengidentifikasi bahwa stres oksidatif, yang dicirikan oleh akumulasi spesies oksigen reaktif (ROS) yang berlebihan, adalah pendorong molekuler utama dari proses penuaan (Hu et al. 2022 ; Yu dan Xiao 2021 ). Selama metabolisme aerobik normal pada organisme yang menua, produksi ROS meningkat sementara mekanisme pertahanan antioksidan endogen menjadi semakin terganggu (Zhang et al. 2020 ). Ketidakseimbangan antara stres oksidatif dan kapasitas antioksidan ini menyebabkan kerusakan oksidatif kumulatif pada komponen seluler, yang pada akhirnya menyebabkan kerusakan jaringan yang tidak dapat dipulihkan, penuaan dini, dan perkembangan gangguan degeneratif (Luo et al. 2020 ).
Sistem pertahanan antioksidan endogen, yang terdiri dari komponen enzimatik dan non-enzimatik, memainkan peran penting dalam melindungi organisme terhadap kerusakan yang disebabkan oleh radikal bebas melalui eliminasi ROS berlebih (Hernandez et al. 2021 ). Bukti yang semakin meningkat menunjukkan korelasi yang kuat antara proses penuaan dan kapasitas antioksidan yang berkurang. Strategi terapi yang melibatkan suplementasi antioksidan telah muncul sebagai pendekatan yang menjanjikan untuk melawan kerusakan oksidatif terkait usia dengan menetralkan radikal bebas yang berlebihan. Studi terbaru telah menunjukkan bahwa rodoxanthin, senyawa bioaktif yang diisolasi dari Potamogeton crispus L. , menunjukkan efek sitoprotektif yang signifikan terhadap stres oksidatif. Khususnya, Fu et al. ( 2023 ) melaporkan bahwa pengobatan rodoxanthin meningkatkan aktivitas enzim antioksidan utama (SOD, CAT, dan GPX) sekaligus mengurangi penipisan glutathione (GSH) dalam model kerusakan seluler yang disebabkan oleh H 2 O 2 . Lebih jauh lagi, secara efektif menurunkan aktivitas laktat dehidrogenase (LDH) intraseluler, kandungan malondialdehid (MDA), dan kadar ROS. Sementara banyak senyawa sintetis telah menunjukkan sifat antipenuaan, aplikasi klinisnya sering dibatasi oleh efek samping yang terkait dengan penggunaan jangka panjang, termasuk imunosupresi dan hipertensi (Kong et al. 2018 ). Akibatnya, antioksidan alami yang berasal dari sumber tanaman telah menarik perhatian signifikan dalam penelitian gerontologi. Bukti saat ini mendukung bahwa suplementasi makanan dengan antioksidan berbasis tanaman dapat secara efektif memperbaiki stres oksidatif, sehingga melemahkan proses penuaan melalui berbagai mekanisme molekuler.
Karotenoid, kelas pigmen alami yang tersebar luas dalam sistem biologis, memainkan peran vital dalam berbagai proses fisiologis (Eroglu et al. 2023 ). Senyawa ini menunjukkan sifat antioksidan yang kuat, secara efektif membersihkan radikal bebas dan melindungi komponen seluler dari kerusakan oksidatif. Selain itu, karotenoid menunjukkan efek imunomodulatori melalui kemampuannya untuk mengatur berbagai fungsi sel imun, sehingga meningkatkan mekanisme pertahanan inang (Kurniawan et al. 2023 ). Potamogeton crispus L. , makrofita terendam menahun dengan distribusi global, merupakan sumber daya liar penting yang umum ditemukan di ekosistem lentik seperti danau dan waduk (Ren dan Zhang 2008 ). Analisis fitokimia baru-baru ini telah mengidentifikasi rodoxanthin sebagai karotenoid merah utama dalam tanaman akuatik ini (Fu et al. 2023 ; struktur ditunjukkan pada Gambar 1 ). Bukti yang terkumpul menunjukkan bahwa rodoxanthin memiliki beragam aktivitas biologis, terutama sifat antioksidan dan imunostimulasi yang penting. Studi eksperimental telah menunjukkan bahwa rodoxanthin secara efektif menghambat produksi malondialdehid dan membersihkan radikal hidroksil, sehingga mencegah peroksidasi lipid yang diinduksi radikal hidroksil dalam mitokondria hati tikus (Ren et al. 2006 ). Akumulasi patologis ROS intraseluler dapat membanjiri sistem pertahanan antioksidan endogen, yang mengakibatkan kerusakan oksidatif pada biomolekul penting termasuk protein dan karbohidrat. Kerusakan molekuler tersebut pada akhirnya menyebabkan disfungsi seluler dan apoptosis (Höhn et al. 2017 ). Ketika generasi ROS melebihi kapasitas pembersihan sistem antioksidan fisiologis, jaringan mengalami kerusakan peroksidatif yang signifikan. Khususnya, rodoxanthin menunjukkan sifat antikanker yang menjanjikan, sebagaimana dibuktikan oleh kemampuannya untuk menekan proliferasi dan menginduksi apoptosis pada sel kanker serviks manusia. Perubahan morfologi karakteristik termasuk fragmentasi nuklir, kondensasi kromatin, dan penyusutan sel telah diamati pada sel kanker yang diobati dengan rodoxanthin (Ren et al. 2006 ). Temuan-temuan ini secara kolektif menunjukkan bahwa rhodoxanthin dapat berfungsi sebagai agen terapeutik potensial melalui efek pro-apoptotiknya pada sel-sel ganas.
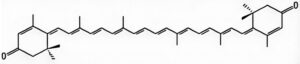
D-galaktosa telah terbukti mempercepat kerusakan oksidatif dengan mendorong pembentukan radikal bebas yang berasal dari oksigen, yang selanjutnya mendegradasi makromolekul seluler dan membahayakan integritas jaringan (Hu et al. 2022 ). Model tikus penuaan yang diinduksi D-galaktosa secara dekat merangkum karakteristik morfologi dan molekuler dari penuaan alami, menjadikannya sistem yang mapan untuk menyelidiki proses penuaan. Dalam penelitian ini, kami mengisolasi karotenoid merah bioaktif rhodoxanthin dari Potamogeton crispus L. dan menggunakan protokol injeksi D-galaktosa intraperitoneal untuk menetapkan model penuaan yang dimediasi oleh stres oksidatif pada tikus. Melalui penilaian komprehensif penanda stres oksidatif, indikator kerusakan hati dan otak, dan komponen utama jalur pensinyalan oksidatif, kami secara sistematis mengevaluasi kemanjuran antipenuaan rhodoxanthin dan menjelaskan mekanisme kerja yang mendasarinya.
2 Bahan dan Metode
2.1 Bahan Kimia dan Material
Tikus KM diperoleh dari Liaoning Changsheng Biotechnology Co. Ltd. Kit pengujian komersial untuk analisis biokimia serum, termasuk deteksi SOD, CAT, dan MDA, diperoleh dari Institut Bioteknologi Nanjing Jiancheng.
2.2 Analisis Struktural
Silika gel (200–300 mesh) digunakan untuk kromatografi kolom setelah aktivasi pada suhu 120°C selama 2 jam. Ekstrak kasar difraksinasi menggunakan elusi gradien dengan sistem pelarut dengan polaritas yang bervariasi. Pita pigmen yang berbeda dikumpulkan, dipekatkan di bawah tekanan rendah pada suhu 40°C, dan disimpan dalam aseton pada suhu -18°C. Untuk kromatografi lapis tipis (TLC), kami menggunakan sistem pelarut yang terdiri dari n-heksana: etil asetat:aseton:metanol (27:4:2:2, v/v/v/v) untuk memisahkan isomer rodoxantin (disebut r1, r2, dan r3). Analisis HPLC dilakukan menggunakan kolom ZORBAX SB-C18 (4,6 × 150 mm, 5 μm) dengan fase gerak asetonitril:metanol (70:30) pada laju alir 0,5 mL/menit. Panjang gelombang deteksi ditetapkan pada 480 nm dengan waktu operasi 15 menit. Konfirmasi struktural dicapai menggunakan spektrometer massa Agilent Q-TOF 6540.
2.3 Hewan dan Perawatannya
Tikus KM jantan dengan kadar SPF (18–22 g) diperoleh dari Liaoning Changsheng Biotechnology Co. Ltd. Hewan-hewan tersebut ditempatkan dalam kondisi lingkungan yang terkendali, dengan mempertahankan suhu konstan 25°C ± 1°C dengan ventilasi yang memadai dan siklus terang/gelap 12 jam. Sebelum prosedur percobaan, tikus diberi akses makanan dan air sepuasnya. Protokol percobaan dilakukan seperti yang diilustrasikan pada Gambar 2 .

2.4 Penilaian Penampilan Umum, Berat Badan, dan Berat Organ Relatif
Selama periode percobaan, penampilan umum hewan dipantau setiap minggu. Catatan harian asupan makanan dan air disimpan, dan berat badan diukur setiap 3 hari. Dosis yang diberikan untuk setiap hewan dihitung berdasarkan berat badannya dan disesuaikan secara berkala untuk memperhitungkan fluktuasi berat badan.
Setelah 40 hari pemberian intragastrik, tikus-tikus tersebut disuntik mati setelah menjalani puasa selama 12 jam. Sampel darah dikumpulkan melalui enukleasi bola mata. Selanjutnya, dilakukan nekropsi untuk mengangkat organ-organ penting, termasuk hati, ginjal, otak, dan jantung. Organ-organ yang diambil dibilas dengan larutan garam normal, ditimbang, dan digunakan untuk menghitung rasio berat organ terhadap tubuh (indeks organ).
![]()
2.5 Analisis Biokimia
Sebagian jaringan hati yang ditimbang dengan tepat diambil dari daerah tetap lobus hati kiri. Jaringan tersebut dibilas dengan larutan garam normal dingin untuk menghilangkan sisa darah dan kemudian dikeringkan menggunakan kertas saring. Sampel hati kemudian dihomogenkan dalam kondisi terkendali. Bagian hati tikus dibedah dan difiksasi dalam formalin untuk pemrosesan histologis lebih lanjut, sementara jaringan yang tersisa dibekukan dengan cepat dalam nitrogen cair dan disimpan pada suhu -80°C untuk analisis selanjutnya.
Untuk pemrosesan jaringan otak, hipokampus kanan diisolasi dan dihomogenkan dengan hati-hati dalam larutan garam normal 0,9% dingin sebanyak 10 kali lipat volumenya. Homogenat yang dihasilkan disentrifugasi pada 4000 × g selama 10 menit pada suhu 4°C untuk memperoleh supernatan, yang dialiquot dan disimpan pada suhu –80°C untuk pengujian biokimia.
Penanda stres oksidatif utama, termasuk kadar MDA, serta aktivitas enzimatik SOD, CAT, dan GPX, dianalisis secara kuantitatif dalam serum, hati, dan jaringan otak tikus percobaan.
2.6 Analisis Histopatologi
Jaringan hati dan otak diambil dari tikus, dan sisa darah dibuang dengan membilasnya menggunakan garam fisiologis. Jaringan kemudian difiksasi dengan cara direndam dalam formalin selama minimal 12 jam. Selanjutnya, jaringan dibersihkan dengan cara direndam dalam xilena untuk meningkatkan transparansi. Jaringan yang telah dikeringkan dan dibersihkan ditanamkan dalam lilin parafin. Setelah pemadatan lengkap, jaringan yang ditanamkan dalam parafin dipotong-potong menjadi blok-blok kecil dan diiris tipis menggunakan mikrotom. Potongan-potongan tersebut diapungkan dalam air untuk memastikan penyebaran yang tepat dan kemudian dipasang pada slide yang dilapisi protein-gliserin, memastikan tidak ada gelembung atau kotoran yang terperangkap di antara potongan jaringan dan slide. Slide dikeringkan dalam oven pada suhu 38°C sebelum diwarnai. Untuk pewarnaan, potongan jaringan dihilangkan lilinnya dalam xilena, dihidrasi ulang melalui seri etanol bertingkat, dan akhirnya diwarnai untuk pemeriksaan mikroskopis.
2.7 Analisis RT-PCR Real-Time Kuantitatif
Total RNA menggunakan kit ekstraksi RNA (Hunan Precision Biotechnology Co. Ltd.). Selanjutnya, RNA yang diekstraksi ditranskripsi balik menjadi DNA komplementer (cDNA) dengan kit transkripsi balik (China Precision Biotechnology (Hunan) Co. Ltd.). Kemurnian (rasio OD260/OD280 pada 1,8–2,0) dan integritas (munculnya pita 5S, pita 18S dan 28S yang jernih) dari sampel RNA diukur dengan menggunakan BioAnalyzer dan elektroforesis gel agarosa 1%. Primer spesifik gen untuk Nrf2, HO-1, SOD1, dan SOD2 dirancang (Tabel 1 ), dan tingkat ekspresi gen target dikuantifikasi menggunakan metode fluoresensi berbasis hijau SYBR. β- aktin digunakan sebagai gen referensi internal. Nilai siklus kuantifikasi ( Cq ) dari gen target dan referensi ditentukan dengan RT-PCR waktu nyata kuantitatif. Tingkat ekspresi relatif gen target, dinormalisasi ke β- aktin, dihitung dengan metode 2 −ΔΔCq , yang merupakan pendekatan yang digunakan secara luas dalam PCR kuantitatif untuk menghitung ekspresi gen relatif antara sampel.
| Gen | Konten urutan (5′ hingga 3′) |
|---|---|
| Nrf-2 | F: TCCGCTGCCATCAGTGAGTC |
| R: ATTGTGCCTTCAGCGTGTTC | |
| HO-1 | F: TGCAGGTGATGCTGACAGAGGG |
| R: ADAGACACACACACAGAACCAAA | |
| SOD1 | F: AGCATTGCCCCATCATTGGCCGTA |
| R: TAKTIKGCGCAATCCCAATCACTC | |
| SOD2 | F: TCCCAGACTGCCTTACGA |
| R: TCGGTGGCGTGAGATGG | |
| PI3K | F: ACTGTAGCCAACAGCATGAA |
| R: AAGGTCCCATCAGCAGTGTCTC | |
| Bertindak | F: CATCGTGTGGCAGGATGTGTA |
| R: TUTUPGGTGTCAGTCTCAGAGGGTG | |
| β -Aktin | F: CATCCGTAAAGACCTCTATGCCAAC |
| R: ATGGAGCCACCGATCCACA |
2.8 Analisis Ekspresi Protein
Tingkat ekspresi protein PI3K, Akt, dan Nrf2 dalam jaringan otak diukur dengan analisis Western blot. Jaringan otak tikus dibilas dua hingga tiga kali dengan buffer PBS yang didinginkan terlebih dahulu, dicincang menjadi fragmen kecil, dan dihomogenkan dalam buffer lisis dingin (volume jaringan 10x) menggunakan teknik homogenisasi rendaman es. Setelah 30 menit inkubasi rendaman es dengan pipet intermiten untuk memastikan lisis lengkap, sampel disentrifugasi pada 12.000 × g selama 5 menit pada suhu 4°C untuk mendapatkan supernatan jaringan yang mengandung ekstrak protein total.
Lisat protein dicampur dengan buffer pemuatan, diaduk secara menyeluruh, dan didenaturasi dengan pemanasan pada suhu 98°C selama 10 menit. Setelah sentrifugasi singkat, protein yang terdenaturasi dimuat ke gel SDS-PAGE. Gel terputus-putus disiapkan menurut berat molekul protein, yang terdiri dari gel pemisah 10% dan gel penumpukan 5%. Polimerisasi dimulai dengan penambahan TEMED, diikuti oleh pengecoran gel segera. Elektroforesis dilakukan pada tegangan konstan (80 V untuk gel penumpukan dan 130 V untuk gel pemisah) hingga bagian depan pewarna mencapai dasar gel.
Setelah elektroforesis, protein dipindahkan ke membran PVDF untuk imunoblotting. Membran diblokir dengan buffer yang sesuai, diikuti oleh inkubasi berurutan dengan antibodi primer dan sekunder dengan pengadukan lembut. Akhirnya, pita protein divisualisasikan menggunakan deteksi chemiluminescence yang ditingkatkan.
2.9 Analisis Statistik
Hasil dinyatakan sebagai rata-rata ± SD dari pengukuran rangkap tiga kecuali dinyatakan lain. Analisis signifikansi dilakukan dengan ANOVA satu arah, dengan p < 0,05 menunjukkan perbedaan signifikan dan p < 0,01 menunjukkan perbedaan sangat signifikan. Korelasi variabel dinilai menggunakan uji Pearson atau Spearman, dengan kenormalan data ditentukan oleh uji Shapiro–Wilk.
3 Hasil
3.1 Analisis Struktur Rhodoxanthin
Karotenoid merah yang diisolasi dari kolom gel silika mengalami pemisahan melalui KLT gel silika G, yang menghasilkan pembentukan tiga pita yang berbeda. Seperti yang diilustrasikan dalam Gambar 3 , pita-pita ini mencerminkan polaritas molekuler karotenoid merah, yang kemudian dibagi menjadi tiga komponen berdasarkan karakteristik pemisahan dan penyerapannya pada pelat lapisan tipis gel silika G. Komponen-komponen ini dikategorikan menurut polaritasnya sebagai r1, r2, dan r3.

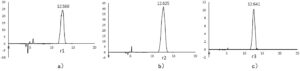
Analisis HPLC terhadap komponen rhodoxanthin r1, r2, dan r3 menunjukkan puncak kromatografi yang berbeda untuk setiap komponen (Gambar 4 ). Dalam kondisi elusi gradien, waktu retensi untuk r1, r2, dan r3 tercatat masing-masing 12,568, 12,625, dan 12,641 menit, yang menunjukkan pemisahan yang dekat namun berbeda. Temuan ini menunjukkan bahwa urutan polaritas komponen adalah r1>r2>r3, yang menguatkan hasil yang diperoleh dari KLT.
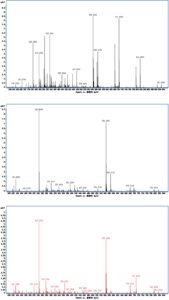
Gambar 5 menyajikan spektrum massa komponen karotenoid merah r1, r2, dan r3 dari Potamogeton crispus , dianalisis di bawah ionisasi elektrospray (ESI) dalam mode ionisasi positif. Untuk komponen r1, r2, dan r3, puncak molekul fragmen karakteristik karotenoid diamati (Tabel 2 ). Selain itu, spektrum massa mengungkapkan puncak ion eksimer yang menonjol pada m/z 563,2933 [M + H] + di r1, m/z 563,3897 [M + H] + bersama dengan puncak pada m/z 585,3719 [M + Na] + di r2 dan m/z 563,3844 [M + H] + di r3. Disimpulkan bahwa massa molekul relatif komponen r1, r2, dan r3 semuanya adalah 562. Temuan ini menunjukkan bahwa meskipun struktur kimia senyawa tersebut serupa, puncak fragmen dan intensitasnya berbeda. Dapat disimpulkan bahwa r1, r2, dan r3 merupakan isomer dari rhodoxanthin; hasilnya konsisten dengan Schex et al. ( 2020 ). Mengingat hasil ekstraksi dan persyaratan dosis eksperimen rhodoxanthin, campuran yang terdiri dari rhodoxanthin r1, r2, dan r3 selanjutnya digunakan dalam eksperimen in vivo.
| Rhodoksantin | pria/wanita | ||
|---|---|---|---|
| Ion molekul [M + H] + | Ion molekul [M + Na] + | Fragmen (karotenoid) | |
| r1 | 563.3933 | 149.0242, 242.2862, 332.3341 | |
| r2 | 563.3897 | 585.3719 | 242.2849, 338.3424, 453.3447 |
| r3 | 563.3884 | Nomor telepon 242.2844, 365.1057, 453.3439 | |
3.2 Efek Rhodoxanthin pada Berat Badan dan Koefisien Organ
Perubahan berat badan dan indeks organ tikus pada kelompok kosong, kelompok model, kelompok VE, kelompok RL, kelompok RM, dan kelompok RH ditunjukkan pada Tabel 3 .
| Kelompok | Berat | Indeks organ (%) | ||||
|---|---|---|---|---|---|---|
| Awal | Terakhir | Jantung | Hati | Otak | Ginjal | |
| NC | 27,97 ± 0,76 | 36,77 ± 2,72 ## | 0,70 ± 0,03 ## | 3,76 ± 0,12 ## | 1,13 ± 0,01 ## | 1,35 ± 0,05 ## |
| MC | 27,91 ± 0,43 | 34,03 ± 1,66** | 0,48 ± 0,01** | 3,05 ± 0,14** | 0,99 ± 0,02** | 1,23 ± 0,03** |
| KAMI | 28,27 ± 1,14 | 37,29 ± 1,90 ## | 0,56 ± 0,03 ## | 3,50 ± 0,03 ## | 1,17 ± 0,01 ## | 1,34 ± 0,04 ## |
| Bahasa Inggris | 27,64 ± 1,72 | 34,04 ± 1,46 | 0,52 ± 0,03 | 3,31 ± 0,03 ## | 1,10 ± 0,01 | 1,33 ± 0,03 ## |
| RM | 27,48 ± 0,71 | 34,52 ± 1,13 | 0,57 ± 0,02 ## | 3,48 ± 0,09 ## | 1,15 ± 0,03 ## | 1,35 ± 0,03## |
| RH | 27,81 ± 0,80 | 37,29 ± 1,12 ## | 0,64 ± 0,01 ## | 3,60 ± 0,05 ## | 1,16 ± 0,01 ## | 1,38 ± 0,04 ## |
Catatan: Dibandingkan dengan kelompok kosong, ** p < 0,01; dibandingkan dengan kelompok model, ## p < 0,01. Singkatan: MC, Kelompok kontrol model; NC, Kelompok kontrol kosong; RL, RM, dan RH, Kelompok dosis rendah, sedang, dan tinggi rhodoxanthin; VE, Kelompok kontrol positif. Tidak ada perbedaan signifikan dalam berat badan awal di antara semua kelompok ( p > 0,05). Setelah 40 hari injeksi dan pemberian gavage, berat badan MC secara signifikan lebih rendah daripada berat badan NC ( p < 0,01). Berat badan kelompok RH secara signifikan lebih tinggi daripada berat badan MC dan mendekati berat badan NC ( p < 0,01). Berat badan kelompok VE juga secara signifikan lebih tinggi daripada berat badan MC ( p < 0,01).
Indeks organ secara langsung mencerminkan tingkat penyakit dan status gizi organ hewan. Fungsi jaringan dan organ akan menurun seiring bertambahnya usia hewan, dan atrofi jantung, hati, otak, ginjal, dan jaringan serta organ lainnya dapat mencerminkan penuaan tubuh dengan baik. Indeks organ jantung, hati, otak, dan ginjal pada kelompok MC menurun secara signifikan ( p < 0,01), dan indeks organ kelompok MC meningkat ke berbagai tingkat setelah dosis rodoxanthin yang berbeda, terutama pada kelompok RH. Di antara mereka, kelompok VE juga secara signifikan meningkatkan atrofi organ tikus yang menua. Ini menunjukkan bahwa rodoxanthin memiliki efek perlindungan yang baik pada jantung, hati, otak, ginjal, dan jaringan serta organ lainnya pada tikus yang menua.
3.3 Efek Rhodoxanthin pada Aktivitas Antioksidan di Jaringan Otak dan Hati
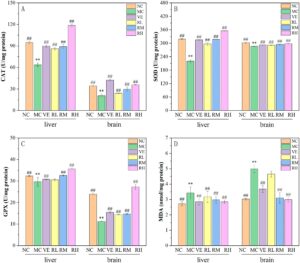
Gambar 6 menunjukkan efek regulasi rhodoxanthin pada biomarker antioksidan (CAT, SOD, dan GPX) dan penanda peroksidasi lipid (MDA) pada tikus yang mengalami penuaan akibat D-galaktosa (D-Gal) di hati dan otak. Dibandingkan dengan kelompok NC, kelompok MC menunjukkan penurunan signifikan pada aktivitas CAT, SOD, dan GPX di seluruh jaringan hati dan otak ( p < 0,01 ), disertai dengan peningkatan yang nyata pada kadar MDA ( p < 0,01 ), yang mengonfirmasi keberhasilan pembentukan penuaan yang dimediasi oleh stres oksidatif. Pemberian rhodoxanthin secara tergantung dosis memperbaiki perubahan yang disebabkan oleh D-Gal ini. Pada dosis optimal (80 mg/kg rhodoxanthin), aktivitas enzim antioksidan dipulihkan hingga 84,3% (CAT), 66,7% (SOD), dan 145% (GPX) dari level kontrol model di hati, dan 61,36% (CAT), 4,2% (SOD), dan 22,2% (GPX) di otak. Khususnya, suplementasi RH melampaui kontrol positif VE dalam meningkatkan aktivitas CAT dan SOD ( p < 0,05 ). Bersamaan dengan itu, kelompok RH secara signifikan melemahkan kerusakan oksidatif, mengurangi kandungan MDA hingga 40,0% di hati dan 16,6% di otak ( p < 0,01 ), mengungguli pengurangan kelompok VE sebesar 22,2%. Temuan ini menunjukkan bahwa 80 mg/kg rhodoxanthin efektif menangkal penuaan oksidatif yang disebabkan D-Gal melalui mekanisme ganda, potensiasi antioksidan enzimatik (meningkatkan aktivitas CAT/SOD/GPX melampaui kapasitas VE), dan penekanan peroksidasi lipid (mencapai kemanjuran pengurangan MDA yang unggul).
3.4 Analisis Hasil Pewarnaan HE pada Jaringan Hati dan Otak Tikus Tua
Hasil pewarnaan HE dari jaringan hati tikus ditunjukkan pada Gambar 7. Kelompok NC menunjukkan arsitektur hati utuh yang dicirikan oleh struktur lobulus yang jelas, tali hepatosit yang tersusun secara radial di sekitar vena sentral, dan nukleolus dengan morfologi bulat yang khas. Sebaliknya, kelompok MC menunjukkan perubahan histopatologis yang parah, hilangnya batas lobulus yang jelas dengan dilatasi sinusoidal, marginasi kromatin, vakuolisasi sitoplasma dalam hepatosit, dan akumulasi butiran lipofuscin. Dosis intervensi rhodoxanthin secara dependen melemahkan perubahan degeneratif ini. Khususnya, kelompok RH 80 mg/kg dan kelompok VE menunjukkan profil histologis yang hampir normal, termasuk struktur lobulus hati yang membaik sampai batas tertentu, susunan tali hati yang teratur, dan deposisi lipofuscin yang berkurang. Temuan ini menunjukkan bahwa RH secara efektif menangkal degenerasi hati yang diinduksi D-galaktosa, mencapai kemanjuran terapeutik yang setara dengan pengobatan VE standar emas.
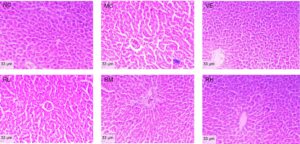
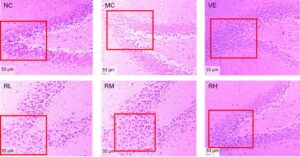
Evaluasi histopatologi morfologi hipokampus melalui pewarnaan HE disajikan dalam Gambar 8. Pada kelompok NC, neuron hipokampus tersusun rapat, berlimpah, utuh, dan tanpa nekrosis. Sebaliknya, neuron di hipokampus jarang, dan sel neuron hipokampus mengalami atrofi atau hilang pada kelompok MC. Pada kelompok RL dan RM, sel hipokampus tersusun longgar, dan sedikit nekrosis dan cedera diamati. Sel hipokampus pada kelompok RH dan VE tersusun dalam bentuk yang kompak dan lengkap. Temuan histomorfometri kuantitatif ini menunjukkan kemanjuran neuroprotektif rodoxanthin yang bergantung dosis terhadap degenerasi hipokampus yang diinduksi D-galaktosa, yang secara mekanistis disebabkan oleh peningkatan plastisitas neurit dan regulasi antiapoptotik.
3.5 Efek Rhodoxanthin pada Ekspresi mRNA Gen Terkait Penuaan
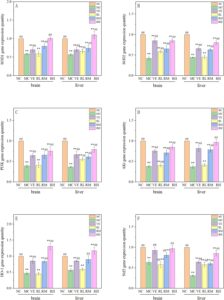
Untuk lebih memahami mekanisme antipenuaan rhodoxanthin, ekspresi mRNA gen terkait penuaan target (Nrf2, HO-1, SOD1, SOD2, PI3K, dan Akt) dideteksi dalam penelitian ini (Gambar 9 ).
3.5.1 Efek Rhodoxanthin pada Ekspresi mRNA Nrf2
Analisis kuantitatif regulasi transkripsi Nrf2 hati disajikan dalam Gambar 9 , dengan kelompok NC dinormalisasi ke 1,0. Tikus penuaan yang diinduksi D-galaktosa menunjukkan penurunan regulasi ekspresi Nrf2 yang signifikan di jaringan hati dan otak dibandingkan dengan kelompok NC ( p < 0,01 ). Ekspresi relatif gen Nrf2 di hati kelompok VE dan kelompok dosis rhodoxanthin meningkat ke derajat yang berbeda ( p < 0,01), dalam cara yang bergantung pada dosis. Kelompok RH memiliki perbaikan yang paling signifikan. Ini menunjukkan bahwa tingkat ekspresi relatif gen Nrf2 pada tikus usia oksidasi yang diobati dengan rhodoxanthin meningkat secara signifikan, tetapi tingkat ekspresi masih lebih rendah daripada yang ada pada kelompok kontrol normal, yang menunjukkan bahwa ekspresi gen Nrf2 pada tikus yang diobati dengan rhodoxanthin masih belum pulih sepenuhnya. Pada saat yang sama, efek perbaikan kelompok VE dan kelompok RH di otak hampir sama dengan kelompok kontrol kosong dan tidak memberikan efek signifikan, yang menunjukkan bahwa RH dapat meningkatkan tingkat ekspresi gen Nrf2 secara signifikan di otak tikus yang menua.
3.5.2 Efek Rhodoxanthin pada Ekspresi mRNA HO-1
Efek rhodoxanthin pada ekspresi relatif gen HO-1 ditunjukkan pada Gambar 9. Dibandingkan dengan kelompok NC, ekspresi relatif gen HO-1 di hati dan otak tikus dalam kelompok MC menurun secara signifikan ( p < 0,01). Ekspresi relatif gen HO-1 di hati tikus meningkat dengan peningkatan dosis rhodoxanthin, dan kelompok VE juga meningkat secara signifikan. Ekspresi relatif gen HO-1 dalam kelompok VE, RM, dan RH meningkat secara signifikan dibandingkan dengan kelompok model ( p < 0,01). Hasil penelitian menunjukkan bahwa ekspresi relatif gen HO-1 di hati dan otak tikus penuaan oksidatif yang diinduksi D-galaktosa ditingkatkan sampai batas tertentu.
3.5.3 Efek Rhodoxanthin pada Ekspresi mRNA SOD1
Efek rhodoxanthin pada ekspresi relatif gen SOD1 ditunjukkan pada Gambar 9. Dibandingkan dengan kelompok lain, ekspresi gen SOD1 pada kelompok MC menurun secara signifikan ( p < 0,01). Setelah pengobatan dengan dosis rhodoxanthin yang berbeda, tingkat ekspresi gen tikus di hati dan otak meningkat ke tingkat yang berbeda dibandingkan dengan kelompok MC dan menunjukkan efek tergantung dosis. Tingkat ekspresi relatif gen SOD1 pada kelompok RM di hati secara signifikan lebih tinggi daripada yang ada di kelompok NC ( p < 0,05). Ekspresi gen SOD1 pada kelompok VE secara signifikan lebih tinggi daripada yang ada di kelompok MC tetapi lebih rendah daripada yang ada di kelompok RH. Hasil ini menunjukkan bahwa rhodoxanthin dapat secara signifikan mengurangi ekspresi relatif gen SOD1 yang diinduksi oleh D-galaktosa.
3.5.4 Efek Rhodoxanthin pada Ekspresi mRNA SOD2
Efek rhodoxanthin pada ekspresi relatif gen SOD2 ditunjukkan pada Gambar 9. Dibandingkan dengan kelompok NC, tingkat ekspresi relatif gen SOD2 pada kelompok model menurun secara signifikan ( p < 0,01), dan tingkat ekspresi relatif gen SOD2 pada kelompok VE, RL, RM, dan RH meningkat secara signifikan ( p < 0,01). Di antara mereka, kelompok RH memiliki efek terbaik pada ekspresi relatif gen SOD2 pada tikus yang menua. Ini menunjukkan bahwa ekspresi relatif gen SOD2 di otak tikus yang menua yang diobati dengan rhodoxanthin meningkat secara signifikan; pada saat yang sama, peningkatan lebih jelas pada dosis rhodoxanthin yang lebih tinggi.
3.5.5 Efek Rhodoxanthin pada Ekspresi mRNA PI3K
Efek rhodoxanthin pada ekspresi relatif gen PI3K ditunjukkan pada Gambar 9. Tingkat ekspresi relatif gen PI3K pada kelompok MC menurun secara signifikan dibandingkan dengan kelompok NC ( p < 0,01). Dengan peningkatan dosis rhodoxanthin, ekspresi relatif gen PI3K lebih tinggi daripada kelompok MC ( p < 0,01). Aktivasi jalur PI3K/AKT/Nrf2 dapat memperbaiki disfungsi perilaku dan defisit neurologis. Studi ini menunjukkan bahwa pengobatan rhodoxanthin dapat mengaktifkan jalur pensinyalan PI3K/AKT, meningkatkan ekspresi relatif gen PI3K secara signifikan, dan memperbaiki stres oksidatif pada tikus yang menua.
3.5.6 Efek Rhodoxanthin pada Ekspresi mRNA Akt
Efek rhodoxanthin pada ekspresi relatif gen AKT di jaringan hati dan otak tikus yang menua ditunjukkan pada Gambar 9. Tingkat ekspresi relatif gen SOD2 pada kelompok MC menurun secara signifikan ( p < 0,01). Dibandingkan dengan kelompok MC, ekspresi gen AKT pada kelompok VE, RM, dan RH meningkat ke berbagai tingkat di hati dan otak ( p < 0,01). Peningkatan ekspresi gen AKT oleh rhodoxanthin berhubungan langsung dengan konsentrasinya.
3.6 Efek Rhodoxanthin pada Ekspresi Protein di Otak Tikus Penuaan yang Diinduksi D-Galaktosa
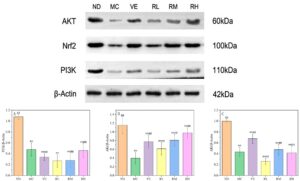
Untuk lebih memahami mekanisme antipenuaan dari rhodoxanthin, western blotting digunakan untuk menganalisis ekspresi protein molekuler target (PI3K, AKT, dan Nrf2). Seperti yang ditunjukkan dalam temuan eksperimental kami, pengobatan rhodoxanthin tergantung dosis meningkatkan ekspresi protein Nrf2 di otak tikus penuaan yang diinduksi stres oksidatif ( p < 0,01 ), menunjukkan potensinya untuk mengaktifkan sistem pertahanan antioksidan yang dimediasi Nrf2 dan mengurangi neuropatologi terkait usia. Analisis mekanistik lebih lanjut (Gambar 10 ) mengungkapkan regulasi diferensial komponen jalur PI3K/AKT. Kelompok RM, RH, dan VE secara signifikan meningkatkan kadar protein PI3K dan AKT dibandingkan dengan kelompok MC ( p < 0,01), dan tingkat ekspresi protein AKT secara signifikan meningkat dalam kelompok RL ( p < 0,01), tanpa mengubah kadar PI3K ( p > 0,05 ). Hasilnya menunjukkan bahwa rhodoxanthin dapat mengaktifkan jalur pensinyalan PI3K/AKT, yang pada gilirannya meningkatkan ekspresi Nrf2 dan mencegah stres oksidatif.
4 Diskusi
Stres oksidatif, yang diakibatkan oleh akumulasi ROS yang berlebihan melebihi kadar fisiologis, merupakan mekanisme utama yang mendasari proses penuaan. Berbagai faktor eksogen termasuk kurang tidur, konsumsi alkohol, dan radiasi ultraviolet telah terbukti meningkatkan pembentukan ROS (Fitsiou et al. 2021 ). ROS yang berlebihan akan mengoksidasi berbagai makromolekul biologis, sehingga mengganggu homeostasis dalam neuron dan akhirnya menyebabkan kematian sel terkait (Luo et al. 2020 ). Dalam konteks ini, antioksidan alami telah muncul sebagai kandidat terapeutik yang menjanjikan untuk mengurangi kerusakan oksidatif dan berpotensi memperlambat perkembangan penuaan.
Penelitian sebelumnya mengidentifikasi rodoxanthin, pigmen karotenoid merah, sebagai penangkap radikal bebas yang kuat yang mampu melemahkan kerusakan sel yang disebabkan oleh H 2 O 2 . Secara khusus, pengobatan rodoxanthin mengurangi penipisan GSH, aktivitas LDH, kandungan MDA, dan kadar ROS intraseluler dalam model stres oksidatif (Fu et al. 2023 ). Lebih jauh lagi, ia meningkatkan ekspresi gen yang berhubungan dengan antioksidan termasuk Nrf2, heme oxygenase-1 (HO-1), superoxide dismutase 1 (SOD1), dan SOD2 dalam sel RAW264.7 (Fu et al. 2023 ). Berdasarkan temuan ini, penelitian saat ini menunjukkan bahwa pemberian rodoxanthin kronis memperbaiki penuaan yang disebabkan oleh D-galaktosa pada tikus melalui modulasi kerusakan oksidatif, metabolisme lipid, dan sumbu pensinyalan PI3K/Akt/Nrf2, yang menunjukkan potensi efek neuroprotektif.
Model penuaan yang diinduksi D-galaktosa digunakan dalam penelitian ini karena reproduktifitasnya yang mapan, efektivitas biaya, dan tingkat kelangsungan hidup yang tinggi (Kong et al. 2018 ). Desain eksperimen kami melibatkan suntikan D-galaktosa bersamaan selama 40 hari dan perawatan rhodoxanthin. Pembentukan model yang berhasil dikonfirmasi oleh perubahan biokimia yang khas: peningkatan kadar MDA, penurunan aktivitas katalase (CAT), superoksida dismutase (SOD), dan glutathione peroksidase (GPX), bersama dengan ekspresi Nrf2, HO-1, SOD1, SOD2, PI3K, dan Akt yang berkurang. Hebatnya, pemberian rhodoxanthin, khususnya pada 80 mg/kg, secara efektif menormalkan gangguan ini (Gambar 6 – 9 ), yang menunjukkan kapasitasnya untuk melawan kerusakan sel yang dimediasi ROS.
Studi saat ini secara khusus meneliti modulasi rhodoxanthin pada jalur Nrf2 dan PI3K/Akt. Nrf2 berfungsi sebagai pengatur utama homeostasis redoks seluler, mengatur berbagai proses metabolisme termasuk keseimbangan redoks, metabolisme energi, homeostasis zat besi, dan metabolisme asam amino (Liu et al. 2023 ). Dalam kondisi fisiologis, Nrf2 tetap tersimpan dalam sitoplasma melalui pengikatan dengan protein 1 terkait ECH mirip Kelch (Keap1). Stres oksidatif menginduksi perubahan konformasi pada Keap1, memfasilitasi translokasi nuklir Nrf2 dan pengikatan berikutnya ke elemen respons antioksidan (ARE) untuk mengaktifkan ekspresi gen sitoprotektif (Su et al. 2023 ). Yang penting, hasil kami menunjukkan bahwa rhodoxanthin meningkatkan aktivitas Nrf2 melalui aktivasi jalur PI3K/Akt, dengan demikian melindungi terhadap stres oksidatif yang diinduksi D-galaktosa.
Interaksi mekanistik antara jalur-jalur ini melibatkan pembentukan fosfatidilinositol (3,4,5)-trisfosfat (PIP3) yang dimediasi PI3K, yang merekrut dan mengaktifkan Akt melalui fosforilasi (Savova et al. 2023 ). Karena Nrf2 merupakan target hilir Akt, aktivasi jalur PI3K/Akt mendorong translokasi nuklir Nrf2 sementara penghambatan ROS sebaliknya menekan aktivitas Akt (Paraiso et al. 2020 ). Regulasi timbal balik ini membentuk lingkaran umpan balik di mana rodoxantin dapat memberikan efek organoprotektif melalui aktivasi jalur PI3K/Akt/Nrf2 (Gambar 11 ).
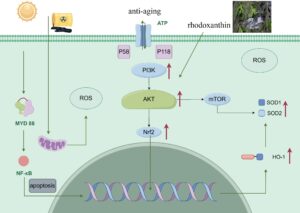
Studi ini memiliki beberapa keterbatasan yang perlu dipertimbangkan. Pertama, sementara interaksi yang diamati antara jalur Nrf2 dan PI3K/Akt memberikan wawasan mekanistik, validasi molekuler yang lebih dalam melalui eksperimen fungsional diperlukan untuk menetapkan hubungan kausal di luar analisis ekspresi gen/protein korelatif. Kedua, ketergantungan eksklusif pada model penuaan yang diinduksi D-galaktosa memerlukan validasi komplementer dalam paradigma penuaan alami dan model stres oksidatif alternatif untuk mengonfirmasi penerapan temuan secara luas. Akhirnya, translatabilitas klinis tetap dibatasi oleh tidak adanya model yang relevan dengan manusia dan hubungan farmakokinetik-farmakodinamik yang tidak terdefinisi di seluruh spesies, yang menyoroti perlunya pendekatan penskalaan alometrik untuk mengoptimalkan rejimen dosis yang setara dengan manusia. Secara kolektif, keterbatasan ini menggambarkan jalur penting untuk penyelidikan masa depan guna memperkuat potensi terapeutik rhodoxanthin dalam gangguan terkait usia.
Temuan kami menunjukkan bahwa rhodoxanthin mengurangi kerusakan oksidatif terkait penuaan melalui dua mekanisme yang saling melengkapi: (1) peningkatan regulasi gen antioksidan (Nrf2, HO-1, SOD1, dan SOD2) dan (2) aktivasi kaskade pensinyalan PI3K/Akt. Tindakan terkoordinasi ini secara signifikan memperbaiki fenotipe penuaan, yang menyoroti potensi rhodoxanthin sebagai agen terapeutik untuk gangguan terkait usia.
5 Kesimpulan
Studi ini menyelidiki potensi terapeutik rhodoxanthin terhadap kerusakan oksidatif menggunakan model tikus yang menua akibat D-galaktosa. Temuan kami menunjukkan bahwa pemberian rhodoxanthin secara signifikan meningkatkan indeks fungsi organ di jaringan jantung, hati, otak, dan ginjal pada tikus yang menua, sekaligus mengurangi manifestasi patologis. Senyawa tersebut secara efektif mempertahankan aktivitas enzim antioksidan di jaringan hati dan otak serta menekan akumulasi peroksida lipid.
Analisis molekuler mengungkapkan bahwa pengobatan rhodoxanthin secara nyata meningkatkan ekspresi gen-gen utama yang terkait dengan stres oksidatif, termasuk Nrf2, HO-1, SOD1, SOD2, PI3K, dan Akt, di jaringan hati dan otak. Khususnya, efek terapeutik yang paling menonjol diamati pada dosis 80 mg/kg rhodoxanthin.
Secara mekanistis, kami menetapkan bahwa rhodoxanthin memberikan efek neuroprotektifnya melalui aktivasi jalur pensinyalan PI3K/Akt, yang selanjutnya meningkatkan ekspresi Nrf2. Modulasi ganda dari jalur PI3K/Akt dan Nrf2 ini mendasari kemanjuran senyawa tersebut dalam mengurangi kerusakan oksidatif terkait usia, khususnya pada jaringan otak. Dosis dan bioavailabilitas pada manusia mungkin berbeda secara signifikan dari model murine. Diperlukan studi klinis lebih lanjut.

