
ABSTRAK
Teknologi pemrosesan makanan baru, seperti pemanasan ohmik, pemanasan ultrasonik, plasma dingin, pemrosesan bertekanan tinggi (HPP), medan listrik berdenyut (PEF), dan hidrolisis enzimatik, memiliki kemampuan untuk memperpanjang masa simpan, meningkatkan kualitas, mengatur kesegaran produk makanan, dan memiliki beragam efek pada komponen makanan, yaitu protein, lemak, dan karbohidrat. Memahami efek dan mekanisme keseluruhan metode ini pada protein makanan dari perspektif multidimensi merupakan landasan inti untuk mendorong inovasi dan kemajuan lebih lanjut terkait modifikasi protein makanan dan aplikasinya dalam industri makanan. Oleh karena itu, tinjauan ini bertujuan untuk mengeksplorasi teknologi pemrosesan makanan baru dan dampaknya pada ukuran partikel, struktur, kelarutan, stabilitas emulsi, sifat berbusa, dan bioaktivitas protein makanan, yang memengaruhi sifat nutrisi dan fungsional makanan. Studi terbaru telah menunjukkan bahwa semua teknologi ini memiliki efek signifikan pada struktur protein, kelarutan, fungsionalitas, dan bioaktivitas. Misalnya, HPP terutama memengaruhi ukuran partikel, struktur sekunder, dan sifat koagulasi. PEF telah terbukti meningkatkan kelarutan protein dan memodifikasi struktur protein. Hidrolisis enzimatik memecah protein, memperbaiki teksturnya, aktivitas proteolitiknya, tingkat hidrolisisnya, dan kelarutannya. Perubahan yang disebabkan oleh pemrosesan pada sifat protein secara signifikan meningkatkan kualitas keseluruhan produk makanan akhir. Meskipun metode pemrosesan makanan baru menunjukkan harapan untuk meningkatkan protein makanan, metode tersebut juga memiliki beberapa kekurangan. Untuk mengurangi efek negatif ini, menggabungkan berbagai teknik pemrosesan dapat menjadi solusi, dan alat berbasis komputer dapat membantu mensimulasikan, mengoptimalkan, mengendalikan, dan memvalidasi proses ini.
1 Pendahuluan
Protein, sebagai sumber asam amino esensial dan komponen dasar dari makanan manusia, memainkan peran penting dalam kesehatan manusia (Rezzi et al. 2024 ) dan diperoleh dari beberapa sumber, termasuk mikroorganisme, tumbuhan, hewan, dan jamur. Tumbuhan menyediakan sebagian besar protein dalam makanan di seluruh dunia, yang mencakup lebih dari 60% dari total pasokan protein. Makanan berbasis hewan seperti ikan, unggas, susu, dan daging memenuhi kebutuhan protein yang tersisa (FAO 2015 ). Selain manfaat gizi, bioaktif, dan fisiologisnya, protein makanan memiliki kualitas fungsional, termasuk kelarutan, retensi air, penyerapan lemak, emulsifikasi, pembusaan, dan gelasi. Karakteristik protein makanan menjadikannya komponen yang serbaguna dan berharga dalam berbagai pembuatan produk, formulasi, dan banyak aplikasi. Terlepas dari atributnya yang menarik, pemrosesan yang sesuai mungkin diperlukan untuk memodifikasi, meningkatkan, atau menyesuaikan sifat molekuler ini untuk penggunaan makanan tertentu. Karena sensitivitasnya terhadap perawatan yang diterapkan, struktur dan fungsionalitas protein dapat berubah selama pemrosesan makanan (Sagis dan Yang 2022 ).
Industri makanan berupaya keras untuk menyediakan produk makanan yang sehat, bebas bahan pengawet, berkualitas tinggi, dan aman bagi para pelanggannya. Beberapa teknologi baru telah dikembangkan dalam beberapa dekade terakhir untuk memastikan kualitas dan keamanan pangan. Pemanasan frekuensi radio, pemanasan ohmik, ultrasonikasi, iradiasi, pemrosesan Ozen dan CO 2 , pemrosesan tekanan tinggi, air yang diaktifkan plasma, fermentasi, dan hidrolisis enzimatik adalah beberapa di antara metode-metode ini (Ling et al. 2020 ). Dibandingkan dengan prosedur tradisional, proses inovatif ini lebih baik dalam menjaga sifat organoleptik dan nutrisi sambil memastikan keamanan pangan. Untuk proses pemrosesan pangan yang inovatif, seluruh waktu pemrosesan singkat, dan penggunaan energi minimal (Huang et al. 2024 ). Penelitian telah difokuskan pada pemahaman dampak teknologi ini pada struktur pangan, warna, rasa, komponen yang berhubungan dengan kesehatan, dan alergenisitas (Morales-de la Peña et al. 2019 ). Lebih jauh lagi, dampak pemrosesan pada struktur protein dan alergenisitas juga menarik dan telah diselidiki.
Setiap metode pemrosesan baru memiliki dampaknya sendiri pada sifat fungsional, reologi, struktural, mikrobiologi, dan sensori makanan. Perubahan sifat protein sebagai hasil pemrosesan sangat berkontribusi terhadap perubahan sifat fungsional dan reologi makanan (Wu et al. 2020 ). Oleh karena itu, protein tersusun dari rantai panjang asam amino, dan teknik pemrosesan makanan baru memiliki efek yang kompleks dan luas. Misalnya, perubahan struktural, yaitu struktur sekunder, tersier, dan kuartener, sebagai hasil dari berbagai perlakuan pemrosesan makanan, secara signifikan memengaruhi sifat fungsional seperti kelarutan, pengemulsi, dan kapasitas berbusa (Turker dan Isleroglu 2024 ), dan sifat gelasi (Sinthusamran et al. 2023 ) protein makanan.
Eksplorasi efek metode pemrosesan makanan baru pada protein makanan merupakan landasan untuk penerapannya dalam pemrosesan makanan dan modifikasi protein. Dari sudut pandang nutrisi, perubahan struktural pada protein yang disebabkan oleh perawatan dapat meningkatkan daya cerna protein makanan (Chian et al. 2019 ), menghasilkan peningkatan penyerapan asam amino (Cosson et al. 2022 ). Meskipun berdampak positif, perawatan yang berkepanjangan dan tidak optimal dapat menyebabkan denaturasi protein dan hilangnya asam amino esensial (Zou et al. 2024 ). Selain itu, modifikasi pada sifat fungsional protein secara signifikan memengaruhi tekstur, penampilan, rasa, dan sifat reologi produk makanan. Nemati dan Guimarães ( 2024 ) melaporkan peningkatan dalam penampilan, warna, dan rasa keju Mozzarella yang diolah dengan air teraktivasi plasma (PAW), yaitu, metode pemrosesan makanan baru yang menjanjikan, sebagai hasil dari peningkatan sifat gelasi proteinnya. Peningkatan kekencangan dan konsistensi produk seperti yoghurt telah dilaporkan sebagai hasil dari peningkatan sifat gelasi protein (Gantumur et al. 2024 ).
Selain itu, modifikasi sifat protein pangan melalui metode pemrosesan pangan baru memberikan peluang bagi inovasi produk dan peningkatan sifat produk yang ada, karena penelitian untuk meningkatkan sifat fungsional, fisikokimia, dan reologi protein pangan dari berbagai sumber (Baskıncı dan Gul 2023 ; Hu, Yu, dkk. 2023 ), serta pengembangan analog daging dari protein yang dimodifikasi (Jiang dkk. 2024 ), semakin diminati. Dengan demikian, penulis percaya bahwa mengeksplorasi dan mengorganisasikan penelitian terkini tentang efek berbagai metode pemrosesan pangan baru pada protein pangan dan menyoroti arah masa depan yang potensial akan membantu peneliti menemukan celah dan memajukan sektor ini.
Meskipun tinjauan sebelumnya menyajikan tinjauan yang berharga tentang dampak beberapa metode biologis dan konvensional pada struktur, fungsionalitas, dan bioaktivitas protein pangan (Wu et al. 2020 ), tinjauan ini merangkum metode pemrosesan pangan baru terkini dan dampaknya pada struktur, fungsionalitas, dan bioaktivitas protein yang berasal dari berbagai sumber berdasarkan studi dan temuan terkini. Tinjauan saat ini juga dirancang untuk menjawab setidaknya pertanyaan-pertanyaan berikut: (i) Apa saja mekanisme yang digunakan metode pemrosesan pangan baru untuk memodifikasi protein pangan? (ii) Bagaimana berbagai metode pemrosesan pangan baru dibandingkan dalam hal dampaknya pada protein pangan? (iii) Bagaimana metode pemrosesan pangan baru memengaruhi struktur protein pangan? (iv) Bagaimana dampak metode pemrosesan pangan baru pada protein pangan memengaruhi kualitas produk pangan akhir? (v) Dapatkah metode pemrosesan pangan baru dioptimalkan untuk mencapai hasil terkait protein tertentu dalam produk pangan? (vi) Apa saja potensi aplikasi protein pangan yang dimodifikasi yang dihasilkan dari metode pemrosesan baru dalam industri pangan? Lebih jauh, tinjauan ini memberikan perspektif masa depan tentang metode pemrosesan pangan baru dan kemungkinan dampaknya pada protein pangan.
Pemanasan 2 Ohmik
2.1 Deskripsi Umum dan Prinsip Kerja
Pemanasan ohmik merupakan pendekatan inovatif yang sering digunakan untuk pemrosesan termal. Produk makanan ditempatkan di antara dua elektroda, berfungsi sebagai resistor listrik, sementara arus listrik bolak-balik disalurkan melalui sirkuit. Panas dihasilkan di seluruh makanan sebagai akibat dari resistansi listrik, dan pembangkitannya terjadi di seluruh volume. Energi listrik diubah menjadi panas, yang mengakibatkan peningkatan suhu. Pada prinsipnya, makanan dijadikan bagian dari sirkuit listrik. Dibandingkan dengan pemanasan konvensional, pemanasan ohmik menyediakan pemanasan makanan yang cepat (Morya et al. 2022 ). Representasi skema pemanasan ohmik disajikan dalam Gambar 1 .
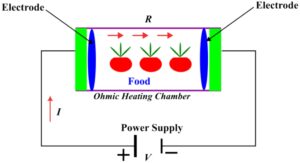
Meskipun terkenal dengan pemanasannya yang seragam, efisiensi energi yang sangat baik, dan pelestarian sifat nutrisi dan sensori, ia memiliki beberapa kelemahan (Aurina dan Sari 2022 ), termasuk endapan fouling, biaya awal yang tinggi, dan kesadaran terbatas tentang teknologi tersebut. Ia kurang efektif dengan makanan nonkonduktif, terutama yang tinggi lemak dan minyak. Biaya awal yang tinggi dan kurangnya penelitian yang luas membuat kontrol sistem menjadi sulit (Indiarto dan Rezaharsamto 2020 ). Beberapa faktor memengaruhi pemanasan ohmik makanan, terutama konduktivitas listrik dan kekuatan medan, yang dapat berubah selama pemanasan karena beberapa faktor, seperti transisi pati, pelelehan lemak, dan perubahan struktur sel. Komposisi makanan, terutama keberadaan garam dan partikel tersuspensi, berdampak pada efisiensi pemanasan ohmik (Jan et al. 2021 ).
2.2 Dampak Pemanasan Ohmik pada Protein Makanan
Safari et al. ( 2025 ) menyelidiki efek variabel pencairan ohmik dan metode pembekuan pada daging Turki dan menemukan pembekuan perendaman selama pemanasan ohmik menurunkan kualitas protein, dan denaturasi signifikan diperoleh selama penyimpanan selama 90 hari pada suhu −18°C. Pendekatan pembekuan cepat menghasilkan kelarutan protein terendah karena kerusakan struktural yang berkurang. Proses pembekuan cepat menghasilkan kristal es kecil, sehingga mengurangi degradasi protein dan meningkatkan retensi protein dalam produk. Kelarutan protein maksimum diperoleh dari prosedur pembekuan pada suhu −70°C dan −20°C, dengan gradien tegangan 15 V/cm. Pembekuan pada suhu −20°C menyebabkan produksi kristal es yang lebih besar, menyebabkan peningkatan degradasi protein dan konversi selanjutnya menjadi peptida yang lebih kecil. Peningkatan jumlah peptida meningkatkan kelarutan protein, menyebabkan peningkatan pelepasan protein setelah pencairan, dan menurunkan nilai gizi daging (Fattahi dan Zamindar 2021 ).
Pemanasan ohmik memengaruhi kandungan lemak dan struktur protein, dan interaksinya sangat memengaruhi viskositas susu dan sifat sensoris (Sun et al. 2024 ). Studi lain melaporkan peningkatan kapasitas menahan air dan minyak, sifat pengemulsi, dan karakteristik berbusa dari isolat protein wijen setelah perlakuan pemanasan ohmik (Saeedabad et al. 2024 ). Namun, ukuran partikel dan kekeruhan meningkat setelah pemanasan ohmik. Balthazar et al. ( 2024 ) melaporkan bahwa pemanasan ohmik meningkatkan bioaktivitas susu domba dengan memfasilitasi proteolisis, yang menghasilkan peptida dengan aktivitas biologis seperti sifat antimikroba, antioksidan, antihipertensi, antitrombotik, dan imunomodulator. Pemanasan ohmik dapat memicu pelepasan enzim yang bertanggung jawab untuk pembelahan protein, termasuk fraksi kasein dan protein whey, yang mengarah pada peningkatan zat bioaktif (Salari dan Jafari 2020 ).
Pemanasan ohmik meningkatkan kepadatan, ukuran rata-rata, dan persentase pori-pori roti karena perkembangan jaringan protein dan polimerisasi (Sutrisno et al. 2025 ). Temuan ini menunjukkan bahwa roti yang dibuat melalui pemanasan ohmik memiliki peningkatan kekerasan, kekenyalan, dan kekenyalan, yang berhubungan langsung dengan denaturasi dan hidrasi protein. Chen et al. ( 2023 ) melaporkan sedikit peningkatan kandungan keton dari isolat protein kacang tanah selama pemanasan ohmik, yang dapat dikaitkan dengan oksidasi rantai asam alkanoat dalam protein. Ferreira et al. ( 2021 ) menggunakan pemanasan ohmik untuk pemrosesan whey dan menemukan penurunan konsistensi karena produksi gel yang tidak seragam, serta peningkatan viskositas karena denaturasi protein. Ringkasan beberapa contoh efek pemanasan ohmik pada protein makanan disediakan dalam Tabel 1 .
| Sumber protein | Kondisi pemanasan ohmik | Pengamatan utama | Referensi |
|---|---|---|---|
| Susu rasa |
|
|
Rocha dan kawan-kawan ( 2022 ) |
| Belut Jepang |
|
|
Li, Deng dkk. ( 2024 ) |
| susu domba |
|
|
Balthazar dan kawan-kawan ( 2024 ) |
| Daging kalkun |
|
|
Safari dan kawan-kawan ( 2025 ) |
| Kacang |
|
|
Avelar dan kawan-kawan ( 2024 ) |
| Wijen |
|
|
Saeedabad dkk. ( 2024 ) |
3 Pemanasan Ultrasonik
3.1 Prinsip Kerja dan Rentang Frekuensi
Pemrosesan ultrasonik adalah metode pemrosesan nontermal yang dapat menonaktifkan mikroorganisme dan enzim melalui kavitasi pada gelombang suara frekuensi tinggi. Perlakuan ultrasonik pada dasarnya menghasilkan gelombang suara dengan frekuensi lebih besar dari 20 kHz (Gambar 2 ), yang dapat diklasifikasikan sebagai frekuensi rendah (20–100 kHz) atau frekuensi tinggi (100–1000 kHz) (Singla dan Sit 2021 ). Teknologi ultrasonik telah mengubah sektor pemrosesan makanan melalui penerapannya yang luas dalam beberapa proses, bertindak sebagai opsi yang berkelanjutan dan hemat biaya. Metode nondestruktif ini memberikan banyak manfaat, termasuk operasi yang dipercepat, peningkatan efisiensi, pengurangan langkah prosedural, kualitas produk yang unggul, pengawetan atribut produk (tekstur, kandungan nutrisi, fitur organoleptik), dan masa simpan yang diperpanjang (Bhargava et al. 2021 ).
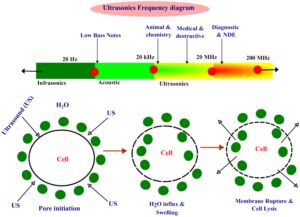
Teknologi ultrasonik dalam pengolahan makanan memberikan banyak manfaat, seperti pencampuran yang lebih baik, percepatan perpindahan energi dan massa, pengurangan durasi pengolahan, dan peningkatan kualitas produk. Fenomena kavitasi yang disebabkan oleh ultrasonik intensitas tinggi dapat mengakibatkan peningkatan suhu dan tekanan lokal, yang memengaruhi kualitas berbagai makanan (Jadhav et al. 2023 ). Meskipun efisien dalam menghilangkan bakteri patogen, teknologi ini memiliki beberapa kekurangan, termasuk biaya awal yang tinggi, kemungkinan produksi radikal bebas, hilangnya sifat sensoris dengan waktu pengolahan yang lebih lama, dan kemungkinan terjadinya perubahan fisik dan kimia dalam makanan (Rathnakumar et al. 2024 ).
3.2 Dampak Pemanasan Ultrasonik terhadap Protein Makanan
Dalam beberapa tahun terakhir, perlakuan ultrasonik telah diaplikasikan untuk pengolahan makanan untuk berbagai tujuan, yaitu emulsifikasi, dispersi, pengawetan, stabilisasi, pelarutan, dan kristalisasi. Perlakuan ultrasonik, sebuah teknik pengolahan yang menjanjikan, secara signifikan meningkatkan sifat fisikokimia, fungsional, dan reologi protein makanan. Laporan tentang efek perlakuan ultrasonik pada protein makanan dirangkum dalam Tabel 2. Perlakuan ultrasonik meningkatkan daya cerna protein dan mengurangi ukuran partikel protein murni daging (Luo et al. 2021 ). Ultrasonografi dapat mengakibatkan perubahan dalam struktur protein, yang mengarah pada paparan situs pembelahan enzim, yang memfasilitasi pemecahan protein dan meningkatkan daya cerna protein (Qian et al. 2023 ). Pacheco et al. ( 2023 ) menyelidiki efek perlakuan ultrasonik pada hidrolisis konsentrat protein biji labu dan melaporkan bahwa perlakuan ultrasonik mengakibatkan peningkatan laju proteolisis, kandungan peptida terlarut, dan aktivitas biologis protein. Produksi peptida yang lebih kecil dan paparan gugus polar dan terionisasi (gugus amino dan karboksil) meningkatkan sifat hidrofilisitas hidrolisat, sehingga meningkatkan kelarutan protein (Devaki dan Ghosh 2024 ). Lebih jauh, (Sinthusamran et al. 2023 ) melaporkan bahwa perawatan ultrasonik mengubah pola protein, meningkatkan kelarutan air, mengakibatkan agregasi protein dan perubahan struktural, meningkatkan sifat pembentuk gel, dan menyebabkan protein otot melepaskan mioglobin, sehingga mengakibatkan penurunan konsentrasi mioglobin pada protein ikan scad garis kuning. Penulis lain juga melaporkan efek perawatan ultrasonik terhadap fisikokimia, fungsional, dan bioaktivitas protein biji selada air (Turker dan Isleroglu 2024 ), protein susu (Zhao et al. 2024 ), protein telur (Zhang, Liu, et al. 2024 ), protein ikan (Rajasekaran et al. 2023 ), dan protein miofibrilar babi (Yu et al. 2024 ).
| Sumber protein | Variabel dan pengaruh pada protein makanan | Referensi |
|---|---|---|
| Bubur daging |
|
Luo dan kawan-kawan ( 2021 ) |
| Biji labu |
|
Pacheco dan kawan-kawan ( 2023 ) |
| Ikan layang bergaris kuning |
|
Sinthusamran dkk. ( 2023 ) |
| Biji selada air |
|
Turker dan Isleroglu ( 2024 ) |
| Biji labu |
|
Habib dkk. ( 2025 ) |
| Susu |
|
Zhao dan kawan-kawan ( 2024 ) |
| Ikan bass laut |
|
Bai dan kawan-kawan ( 2023 ) |
| Ikan |
|
Rajasekaran dkk. ( 2023 ) |
| Telur |
|
Zhang, Liu, dkk. ( 2024 ) |
4 Plasma Dingin dan Air Plasma Aktif (PAW)
4.1 Plasma Dingin
4.1.1 Deskripsi Umum
Metode pengolahan plasma dingin adalah pendekatan pengolahan nontermal baru yang menggunakan suhu operasi sedang tanpa reagen kimia. Dibandingkan dengan metode pengolahan konvensional, metode ini lebih murah dan dapat mempertahankan nilai gizi makanan serta meningkatkan sifat fungsionalnya (Kumar et al. 2022 ). Dalam beberapa tahun terakhir, pendekatan plasma dingin telah muncul sebagai metode yang efektif dalam industri makanan untuk menghilangkan organisme berbahaya dan bersporulasi dari produk makanan. Metode ini telah disetujui sebagai disinfektan untuk makanan dan permukaan yang bersentuhan dengannya. Teknik ini dikenal karena keragaman produksinya dan penggunaan prospektifnya, termasuk plasma langsung atau tidak langsung, efek nontermal, pelapis fungsional, dan air yang diolah dengan plasma, sambil mempertahankan atribut kualitas makanan tanpa dampak negatif (Sainz-García dan Alba-Elías 2023 ).
4.1.2 Efek Pengolahan Plasma Dingin pada Protein Makanan
Pemrosesan plasma dingin memengaruhi beberapa komponen makanan, seperti lipid, protein, karbohidrat, dan zat bioaktif. Protein merupakan komponen utama makanan, dan struktur, reaktivitas, sifat berbusa, sifat pengemulsi, dan sifat kelarutannya dapat memengaruhi rasa, tekstur, warna, dan reologi serta dipengaruhi oleh pemrosesan plasma dingin (Gambar 3 ). Tan et al. ( 2024 ) melaporkan bahwa plasma dingin meningkatkan hidrofobisitas permukaan isolat protein kedelai ketika meningkatkan waktu perlakuan. Hal ini dapat disebabkan oleh modifikasi oksidatif yang menyebabkan struktur protein terungkap, memperlihatkan gugus hidrofobik yang terkubur di antarmuka domain dan subdomain protein atau di antarmuka subunit sistem protein oligomerik, sehingga meningkatkan aksesibilitas asam natrium 8-anilino-1-naftalenasulfonat (ANS-N). Perlakuan plasma dingin meningkatkan kelarutan protein lebih dari 30%, yang dapat disebabkan oleh penurunan ukuran partikel, yang mengarah pada paparan luas permukaan yang lebih besar terhadap pelarut (Bu et al. 2022 ). Menurut laporan mereka, plasma dingin juga meningkatkan sifat fungsional (kapasitas menahan air dan minyak, aktivitas pengemulsi dan stabilitas emulsi) dari bahan tersebut. Ketika meningkatkan waktu perlakuan plasma dingin, peningkatan kapasitas menahan air dan lemak diamati. Namun, sedikit penurunan kapasitas menahan lemak diamati setelah perlakuan pada 14 kV selama 90 menit. Sifat pengemulsi, sifat fungsional penting dari protein yang memungkinkan protein digunakan untuk perbaikan tekstur, juga ditingkatkan setelah perlakuan plasma dingin. Lebih jauh lagi, viskositas nyata dari isolat protein tertinggi pada 14 kV setelah 90 menit perlakuan sebagai hasil dari penurunan ukuran tetesan dan peningkatan luas permukaan emulsi.
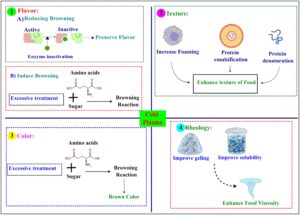
Perlakuan plasma dingin menyebabkan pengurangan ukuran partikel protein biji bunga matahari, yang terutama disebabkan oleh energi tinggi yang diberikan oleh plasma yang memengaruhi permukaan protein, sehingga meningkatkan jumlah situs aktif permukaan. Partikel yang lebih kecil menyajikan lebih banyak situs aktif pada permukaan misel, meningkatkan adsorpsi protein pada antarmuka minyak–air (Wang et al. 2024 ). Potensi zeta, ukuran stabilitas larutan protein, meningkat ketika meningkatkan waktu perlakuan. Temuan ini menunjukkan bahwa perlakuan plasma meningkatkan stabilitas protein bunga matahari karena partikel reaktif yang dihasilkan, seperti N 2+ , O 3 , dan H 2 O 2 , menginduksi depolymerisasi agregat larut, mengekspos lebih banyak gugus polar pada permukaan protein dan meningkatkan nilai absolut potensi zeta. Seperti yang dilaporkan, perlakuan plasma dingin menurunkan pH susu, mungkin karena oksidasi polipeptida (rantai panjang asam amino) yang disebabkan oleh kerusakan ozon dan pembentukan senyawa asidogenik (Sharma dan Singh 2022 ). Waktu perlakuan yang lama mengakibatkan perubahan warna susu menjadi cokelat karena perubahan struktur protein, yang berpotensi memicu reaksi Maillard, yang dicirikan oleh interaksi kovalen antara gugus ε-amino bebas dalam protein susu dan gugus karbonil laktosa (Chen, Wang, Guo, dkk. 2022 ). Lebih jauh lagi, penerapan plasma dingin menyebabkan perubahan dalam struktur sekunder, yang dicirikan oleh peningkatan konformasi β-sheet agregat bersamaan dengan pengurangan struktur kumparan acak protein, yang menunjukkan bahwa agregasi terjadi saat protein terbuka sebagai akibat dari paparan plasma dingin.
Spesies oksigen reaktif (ROS) dan spesies nitrogen reaktif (RNS) yang diproduksi dalam plasma dingin kemungkinan memainkan peran penting dalam oksidasi protein, mengubah rantai samping asam amino dan mengakibatkan terganggunya interaksi nonkovalen, yang pada akhirnya memengaruhi integritas struktural protein (Luo et al. 2020 ). Beberapa peneliti telah melaporkan bahwa ROS dan RNS dapat bereaksi dengan berbagai jenis asam amino, menyoroti kerentanan asam amino yang mengandung sulfur seperti sistein dan metionina terhadap oksidasi yang diinduksi ROS (Kehm et al. 2021 ; Wenske et al. 2021 ). Telah dilaporkan bahwa sistein dapat membentuk ikatan disulfida (-SS-) selama oksidasi, yang dapat mengikat silang rantai protein dan mengubah konformasi protein. Di sisi lain, metionina dapat dioksidasi menjadi metionina sulfoksida, yang sangat memengaruhi hidrofobisitas protein. Selain itu, spesies reaktif dapat menargetkan berbagai asam amino aromatik, termasuk triptofan, tirosin, dan fenilalanin. Secara khusus, radikal hidroksil () dapat dengan mudah mengoksidasi triptofan, yang menyebabkan terciptanya produk oksidasi yang mengubah struktur protein. Oksidasi rantai samping asam amino dapat mengubah struktur protein makanan secara signifikan (Andrés et al. 2022 ).
Ketika protein makanan mengalami perlakuan plasma dingin, oksidasi rantai asam amino, yang dilaporkan memiliki efek langsung pada struktur protein makanan, berlangsung secara berurutan. Awalnya, oksidasi yang disebabkan oleh spesies reaktif yang dihasilkan oleh plasma dingin menargetkan dan mendegradasi
-heliks dan
-lembar, yang merupakan elemen struktural fundamental dan krusial dari struktur sekunder protein. Saat proses oksidasi berlangsung, hal itu memicu pembentukan ikatan disulfida dan ikatan silang kovalen lainnya di antara rantai protein. Secara bersamaan, hal itu memodifikasi interaksi nonkovalen seperti kontak hidrofobik dan ikatan hidrogen. Kompleks protein yang lebih besar dikembangkan setelah agregasi, yang memengaruhi sifat kelarutan, pengemulsi, dan pembusaan protein makanan (Heinonen et al. 2021 ).
Sharma dan Singh ( 2022 ) meneliti dampak perlakuan plasma dingin terhadap sifat reologi susu dan menemukan perlakuan plasma dingin memperbaiki parameter gelasi seperti modulus penyimpanan (G′), waktu gelasi, dan tekstur gel, serta mengurangi waktu pembentukan gel rata-rata susu skim dari 21,0 menjadi 12,8 menit setelah 3 menit perlakuan. Ada kemungkinan sebagian protein whey telah terdenaturasi, yang dapat memengaruhi waktu pembentukan gel susu. Perlakuan plasma dingin (1–2 menit) mengurangi sineresis dalam susu skim. Namun, perlakuan yang berkepanjangan mengakibatkan sineresis karena terbentuknya agregat misel kasein yang lebih besar yang menggumpal bersama, menciptakan jaringan gel yang tidak jelas dan tingkat sineresis yang tinggi. Dharini dkk. ( 2023 ) menyelidiki dampak pemrosesan plasma dingin pada susu wijen, dan menemukan bahwa nilai b* terus meningkat seiring dengan peningkatan tingkat daya plasma, yang menunjukkan peningkatan pencoklatan yang disebabkan oleh reaksi Maillard antara protein dan gugus karbonil. Aktivitas lipoksigenase dalam susu mentah, yang diaktifkan oleh enzim lipoksigenase, menurun dari 100% menjadi 67% setelah 120 W perlakuan daya plasma, menunjukkan bahwa perubahan dalam struktur protein yang disebabkan oleh plasma dingin menghambat aktivitas enzim lipoksigenase (Manoharan et al. 2023 ). Perlakuan plasma dingin mengubah tatanan struktur protein dan pati dalam susu wijen mentah, menghasilkan perubahan dalam suhu puncak dan entalpi, yang menunjukkan stabilitas termal. Temuan serupa dari perlakuan plasma dingin berbagai makanan telah dilaporkan (Held et al. 2019 ; Hu, Chen, et al. 2023 ; Markoska et al. 2019 ). Contoh umum efek plasma dingin pada protein makanan dirangkum dalam Tabel 3 .
| Sumber protein | Kondisi plasma dingin | Pengamatan utama | Referensi |
|---|---|---|---|
| Susu skim |
|
|
Sharma dan kawan-kawan ( 2022 ) |
| fikosianin |
|
|
Gong dkk. ( 2025 ) |
| Ikan Kerapu Laut Asia |
|
|
Olatunde dan kawan-kawan ( 2021 ) |
| Udang |
|
|
Cheng dan kawan-kawan ( 2023 ) |
| susu domba |
|
|
Wang, Liu, dkk. ( 2022 ) |
| Biji bunga matahari |
|
|
Wang dan kawan-kawan. ( 2024 ) |
4.2 Air Aktif Plasma (PAW)
4.2.1 Deskripsi Umum
Air yang diaktivasi plasma (PAW) adalah air yang diolah dengan plasma dingin, dan mengandung spesies reaktif seperti radikal oksida nitrat, radikal hidroksil, radikal anion superoksida, oksigen atom, oksigen singlet, ion nitrogen, dan molekul nitrogen tereksitasi (Rahman et al. 2022 ). Seperti metode pemrosesan nontermal lainnya, PAW secara efektif menonaktifkan berbagai mikroorganisme (misalnya, bakteri, jamur, dan virus), memastikan keamanan mikrobiologis tanpa secara signifikan mempengaruhi kualitas asli atau kandungan nutrisi makanan. Karena prosesnya yang bebas residu, suhu pengoperasian yang rendah, kemudahan persiapan, dan efektivitas biaya, PAW telah mendapatkan popularitas untuk dekontaminasi makanan seperti buah-buahan, sayuran, dan ikan (Hosseini et al. 2020 ).
Plasma dingin atmosfer dengan pelepasan penghalang dielektrik sering digunakan untuk menghasilkan air yang diaktifkan plasma (PAW) (He, Xie, dkk. 2022 ). Air diaktifkan oleh plasma menggunakan daya masukan dari catu daya tegangan tinggi. PAW selanjutnya dipindahkan ke penyimpanan lain dan dapat digunakan untuk mengawetkan daging, ikan, udang, produk susu, buah-buahan, dan sayuran, di antara produk lainnya (Gambar 4 ). Selain sifat antimikrobanya, PAW memiliki berbagai dampak pada karakteristik fisikokimia dan reologi, termasuk hidrofobisitas permukaan, oksidasi lipid, degradasi gula, perubahan sifat termal, laju respirasi yang berkurang, dan modifikasi sifat reologi. Dengan demikian, sifat protein makanan berubah sebagai akibat dari perlakuan PAW.
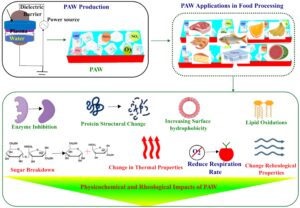
4.2.2 Efek Air Teraktivasi Plasma (PAW) terhadap Protein Makanan
Ringkasan studi terkini tentang dampak PAW pada protein pangan disajikan dalam Tabel 4. Perlakuan PAW berpotensi mengubah struktur dan fungsionalitas banyak protein pangan. Laporan tentang isolat protein whey (Perinban et al. 2023 ), protein miofibrilar Aristichthys nobilis (Li, Shi, et al. 2022 ), globulin bambara (Alabi et al. 2022 ), dan protein miofibrilar bebek (Rao et al. 2023 ) telah menunjukkan bahwa perlakuan PAW menginduksi oksidasi ringan, pelipatan, dan perubahan dalam struktur protein. Modifikasi yang disebutkan di atas biasanya mengarah pada perubahan dalam struktur sekunder, peningkatan hidrofobisitas, dan peningkatan kualitas fungsional protein, termasuk stabilitas busa dan kekuatan gel (Rao et al. 2023 ). Perlakuan PAW juga meningkatkan agregasi protein dan memperbaiki karakteristik gelasi (Jiang et al. 2023 ; Li, Rao, et al. 2024 ). Meskipun efeknya bervariasi tergantung pada sumber protein dan keadaan perawatan, (Alabi et al. 2022 ) melaporkan bahwa perawatan PAW mengurangi kemampuan pengemulsi sekaligus meningkatkan sifat berbusa.
| Sumber protein | Kondisi PAW | Temuan utama | Referensi |
|---|---|---|---|
| Tepung jagung |
|
|
Zou dan kawan-kawan ( 2024 ) |
| Keju Mozarella |
|
|
Nemati dan Guimarães ( 2024 ) |
| Biji kenari |
|
|
Xiao dan kawan-kawan ( 2023 ) |
| Aristichthys nobilis (ikan mas kepala besar) |
|
|
Li, Shi, dkk. ( 2022 ) |
| Globulin Bambara |
|
|
Alabi dkk. ( 2022 ) |
Li, Shi, dkk. ( 2022 ) menyelidiki efek PAW pada protein miofibrilar dan melaporkan bahwa PAW secara signifikan melemahkan ( p < 0,05) koneksi ionik sambil meningkatkan interaksi hidrofobik. Hal ini mendorong agregasi dan gelasi protein, yang mengarah pada pembentukan gel yang lebih kuat dan jaringan tiga dimensi yang lebih padat. Lebih lanjut, hasil tersebut menegaskan bahwa peningkatan waktu perawatan menyebabkan transformasi
-heliks dan kumparan acak menjadi lembaran-β dan putaran-β, serta peningkatan konstan dalam modul penyimpanan dan waktu degradasi protein yang lebih pendek. Dibandingkan dengan protein yang tidak diolah, pengolahan protein miofibrilar bebek dengan PAW selama 20 detik meningkatkan kekuatan gel dan kapasitas retensi air (Rao et al. 2023 ). Peningkatan ini dikaitkan dengan peningkatan interaksi hidrofobik antara molekul protein, yang menghasilkan mikrostruktur yang lebih seragam. Selain itu, tingkat pengolahan PAW yang lebih tinggi menyebabkan peningkatan konsentrasi gugus sulfhidril dan karbonil. Peningkatan sifat protein berdampak signifikan pada tekstur dan kualitas sensoris produk daging (Chen et al. 2020 ; Xia et al. 2019 ). Peningkatan ini terutama mengatasi keterbatasan yang menghambat pengembangan produk daging bebek, seperti sifat pengemulsi yang lebih rendah dan karakteristik pembentuk gel yang lemah, yang menghasilkan rasa kasar dan palatabilitas produk daging bebek yang buruk (Wang, Li, Qu, et al. 2022 ).
Sifat struktural, fisikokimia, fungsional, dan pencernaan tepung jagung yang dimodifikasi dengan air yang diaktivasi plasma dalam kombinasi dengan perlakuan hidrotermal telah dipelajari (Zou et al. 2024 ). Penelitian ini mengungkapkan bahwa, untuk beberapa sampel, denaturasi protein dan gelatinisasi pati mengakibatkan agregasi pati-protein dan pati-pati, yang menyebabkan peningkatan ukuran partikel sampai batas tertentu. Selain itu, PAW menyebabkan pelipatan, disosiasi, dan penataan ulang struktur heliks protein yang ada dalam tepung jagung. Proses ini dapat meningkatkan interaksi dan efisiensi pemecahan enzim pencernaan pada protein, yang pada akhirnya mengarah pada peningkatan kecernaan protein dan penyerapan asam amino yang lebih baik (Zhu et al. 2021) ).
Sebuah studi yang menyelidiki mekanisme dan efek PAW pada protein miofibrilar dari ikan mas perak ( Aristichthys nobilis ) juga melaporkan bahwa PAW mempercepat agregasi protein. Perlakuan dengan PAW selama 60 detik menggunakan pistol semprot plasma menghasilkan morfologi ikatan silang yang paling padat dan paling homogen. Dibandingkan dengan sampel yang tidak diobati, intensitas pita rantai berat miosin (MHC), aktin, dan tropomiosin secara signifikan lebih rendah dalam sampel yang diobati dengan PAW. Proporsi α-heliks menurun tajam ( p < 0,05), turun dari 52,14% dalam sampel PAW 0 menjadi 28,22% dalam PAW 240 . Sementara itu, kadar β-sheet dan β-turn meningkat, dengan β-sheet meningkat dari 18,68% menjadi 36,25% dan β-turn dari 6,39% menjadi 16,79% ( p < 0,05). Temuan ini menunjukkan bahwa PAW mendorong transformasi struktur sekunder protein otot dari α-heliks menjadi β-sheet dan β-turn. Sementara sebagian besar asam amino dalam sampel yang diberi perlakuan PAW sedikit menurun, dapat disimpulkan bahwa PAW efektif untuk memodifikasi protein pangan guna meningkatkan sifat fungsionalnya, khususnya kemampuan pembentukan gelnya, sehingga meningkatkan produk berbasis protein (Xiong et al. 2021 ).
5 Pemrosesan Tekanan Tinggi (HPP)
5.1 Deskripsi Umum
Di antara metode unik dan alternatif, teknologi pemrosesan tekanan tinggi (HPP) telah menjadi populer sebagai metode pengawetan dalam industri pemrosesan makanan. Pemrosesan tekanan tinggi adalah teknologi yang menjanjikan dan aman untuk modifikasi struktur protein. Pemrosesan tekanan dapat menyebabkan denaturasi, agregasi, atau gelasi protein berdasarkan sistem protein, suhu perlakuan, dan kondisi larutan (misalnya, pH dan kekuatan ionik) (Sahil et al. 2024 ). HPP efektif dalam mengawetkan makanan, termasuk cairan, semipadat, dan padat. Ini terkenal karena dampak antibakterinya yang kuat sambil mempertahankan kualitas gizi makanan (Houška et al. 2022 ). Kemanjuran HPP dipengaruhi oleh berbagai faktor, termasuk besarnya tekanan, periode penyimpanan, suhu, laju kompresi, dan kualitas intrinsik makanan. Ketidakefektifan untuk beberapa produk susu, hewan, dan barang rendah asam yang stabil di rak dianggap sebagai kelemahan utamanya (Woldemariam dan Emire 2019 ). Selain itu, sejumlah variabel dapat memengaruhi prosedur, dengan makanan yang berbeda membutuhkan jumlah tekanan yang berbeda untuk diawetkan (Nema et al. 2022 ). Di bagian ini, efek pemrosesan tekanan tinggi pada sifat reologi, fungsional, dan struktural protein dirangkum.
5.2 Efek HPP pada Protein Makanan
Ribeiro et al. ( 2018 ) mempelajari sifat fisik daging ikan yang mengalami HPP dan menemukan bahwa warna putih daging ikan meningkat seiring dengan peningkatan tekanan, yang sebagian besar terkait dengan tingkat denaturasi protein, khususnya denaturasi mioglobin. Tekanan 350–500 MPa pada 30°C menghasilkan perubahan signifikan pada kualitas tekstur daging ikan, yang menunjukkan peningkatan sifat pembentuk gel protein. Rajan et al. ( 2023 ) melaporkan bahwa HPP mengurangi fraksi α-helix dalam susu kedelai utuh dari 29,6% (kontrol) menjadi minimum 10,3% (600 MPa, 5 menit) dengan mengganggu ikatan hidrogen antara ikatan CO dan N H dari rantai peptida protein. Setelah denaturasi α-helix, fraksi β-sheet meningkat dari 32,0% (kontrol) menjadi 48,1% (600 MPa, 5 menit), yang menunjukkan bahwa HPP dapat mengubah struktur sekunder protein dengan mengubah rantai samping asam amino dan membentuk ikatan baru melalui pelipatan. Lebih jauh, HPP meningkatkan viskositas susu kedelai dari 4,13 menjadi 6,22 mPa.s pada 600 MPa selama 15 menit, yang menunjukkan bahwa HPP menginduksi agregasi dan perubahan struktur protein. Saat HPP meningkat, viskositas susu kedelai terus meningkat karena peningkatan kapasitas menahan air protein.
HPP meningkatkan penyerapan minyak dan emulsifikasi gel quinoa merah dengan memisahkan dan membuka lipatan polipeptida, memperlihatkan situs asam amino hidrofobik (Thakur et al. 2024 ), yang memungkinkan perlekatan hidrofobik rantai peptida ke tetesan lipid, meningkatkan volume dan luas permukaan protein yang tersedia untuk interaksi dan meningkatkan penyerapan minyak dan emulsifikasi. Kekuatan gel gel quinoa sedikit meningkat, mungkin karena denaturasi protein, yang mengakibatkan peningkatan agregasi. Peningkatan maksimum diameter partikel gel pada 600 MPa juga dilaporkan oleh (Muñoz et al. 2023 ), yang dapat disebabkan oleh gangguan pada struktur misel. Agregasi protein meningkat dengan tekanan, mencapai puncaknya pada 450 MPa dan mencapai tingkat tinggi pada 600 MPa. Cropotova et al. ( 2020 ) melaporkan bahwa perlakuan HPP pada 200 dan 300 MPa mengurangi kelarutan protein sarkoplasma dalam daging cincang ikan haddock masing-masing sebesar 0,4% dan 42,0%, dibandingkan dengan sampel kontrol. Selain itu, kelarutan protein miofibrilar menurun pada daging cincang ikan haddock dan ikan tenggiri. Dibandingkan dengan daging cincang ikan haddock yang diperlakukan pada 200 MPa, daging cincang ikan haddock yang diperlakukan pada 300 MPa memiliki kehilangan kelarutan protein yang lebih besar.
Pemberian tekanan pada cincangan ikan haddock dan makarel pada 200–300 MPa selama 5 menit mengurangi fungsi protein sarkoplasma dan miofibrilar, sehingga menurunkan kelarutan karena terbentuknya agregat yang tidak larut (Chen, Wang, Zhu, et al. 2022 ). Tekanan tinggi menyebabkan ikatan nonkovalen yang lemah putus, sehingga mengakibatkan denaturasi dan agregasi protein serta terbentuknya ikatan nonkovalen intra- dan/atau intermolekul baru (Castrica et al. 2021 ). Setelah 1 bulan penyimpanan beku, kandungan karbonil (indikator penting oksidasi protein) meningkat secara signifikan pada protein sarkoplasma dan miofibrilar dari cincangan ikan yang diberi tekanan dibandingkan dengan cincangan yang tidak diberi perlakuan. Dampak yang tidak diinginkan dari HPP pada oksidasi protein dalam cincangan ikan selama penyimpanan beku dapat dikaitkan dengan peningkatan kerusakan membran dibandingkan dengan yang terjadi pada kontrol (Puértolas dan Lavilla 2020 ). ( 2023 ) juga melaporkan bahwa perlakuan tekanan tinggi memecah membran sel adiposit, melepaskan produk oksidasi lipid yang berinteraksi dengan enzim dan menyebabkan oksidasi protein. Perlakuan HP menghasilkan nilai b* yang lebih tinggi pada cincangan ikan haddock dan mackerel dibandingkan dengan sampel kontrol, yang dapat dikaitkan dengan akumulasi produk oksidasi lipid sekunder, seperti yang terbentuk oleh interaksi gugus aldehida dengan gugus amino bebas dalam fosfolipid dan protein (Tatiyaborworntham et al. 2021 ). Dibandingkan dengan sampel kontrol, nilai L* dari sampel ikan haddock dan mackerel yang diolah dengan HP meningkat dengan meningkatnya tekanan hidrostatik, yang menunjukkan bahwa warna ikan menurun saat tekanan hidrostatik meningkat karena perubahan konformasi pada protein. Lebih jauh, fishcake yang dibuat dari cincangan ikan haddock dan mackerel yang diolah dengan HP memiliki kekerasan dan kohesivitas yang lebih rendah dibandingkan dengan cincangan yang tidak diolah. Hal ini dapat disebabkan oleh degradasi protein struktural seperti miosin dan aktin yang diinduksi tekanan, yang dapat dibantu oleh enzim proteolitik yang dilepaskan dari sel yang rusak akibat HP. HPP sedang (<400 MPa) dapat mengaktifkan enzim proteolitik seperti katepsin B dan D dalam jaringan ikan, yang menyebabkan degradasi protein. Kelembutan jaringan ikan selama perlakuan tekanan HP merupakan hasil dari tekanan tinggi dan aktivitas enzim proteolitik (Arnaud et al. 2018 ). Dibandingkan dengan kontrol, perlakuan HPP menghasilkan gel daging kepiting yang lebih ringan dan lebih merah tua. Pada 600 MPa, HPP menyebabkan denaturasi dan agregasi rantai berat miosin, menghasilkan agregat molekul besar. Dibandingkan dengan tingkat tekanan lainnya, struktur α-heliks bergeser ke lembaran β dan putaran β pada 100 MPa. Perlakuan tekanan sedang meningkatkan kapasitas pembentukan gel pada daging kepiting dan teksturnya dengan mengubah struktur protein (Martínez-Maldonado et al. 2020).
Mbye et al. ( 2021 ) menyelidiki efek gabungan pasteurisasi dan HPP pada kualitas keju unta dan sapi. Sifat antivirus dan antibakteri dari susu unta dikaitkan dengan keberadaan enzim protein pengenal peptidoglikan (PGRP), imunoglobulin (Igs), N-asetil-β-glukosaminidase (NAGase), laktoferin (LF), laktoperoksidase (LP), dan lisozim (LZ) (Karaman et al. 2021 ). Para penulis mengklaim bahwa pemrosesan tekanan tinggi (HPP) meningkatkan hasil keju dengan mendorong denaturasi protein whey, khususnya β-laktoglobulin. Denaturasi ini memfasilitasi interaksi dengan misel kasein, yang mengarah pada pembentukan penghalang yang menghambat pembentukan kembali agregat kasein selama pembentukan dadih. Hasilnya, keju menyajikan struktur terbuka dan peningkatan kadar air, yang pada akhirnya berkontribusi pada hasil yang lebih tinggi. Penulis juga mengonfirmasi bahwa peningkatan retensi air yang dihasilkan dari hidrasi jaringan protein menyebabkan pengurangan kekencangan keju. Air dalam matriks protein berfungsi sebagai plasticizer, mengurangi elastisitas dan meningkatkan kerentanan terhadap fraktur di bawah kompresi. Ahmad et al. ( 2024 ) melaporkan bahwa ikatan nonkovalen, yang dipengaruhi oleh pemrosesan tekanan tinggi (HPP) dalam hal kompresibilitas, tampaknya menjadi penyebab utama perubahan dalam spektrum UV ekstrak protein susu gandum, yang bertentangan dengan ikatan kovalen. Protein gandum mengandung residu asam amino hidrofobik dan aromatik, termasuk triptofan dan tirosin. Ringkasan beberapa contoh efek HPP pada protein makanan disajikan dalam Tabel 5 .
| Sumber protein | Variabel proses HPP | Temuan utama | Referensi |
|---|---|---|---|
| Ikan ham |
|
|
Sakamut dan kawan-kawan ( 2025 ) |
| susu domba |
|
|
Muñoz dan kawan-kawan ( 2023 ) |
| Daging kepiting |
|
|
Velazquez dan kawan-kawan ( 2021 ) |
| Alternatif susu berbahan dasar barley |
|
|
Strieder dan kawan-kawan ( 2022 ) |
| Susu sapi |
|
|
Dia, Yang, dkk. ( 2022 ) |
| quinoa merah |
|
|
Thakur dan kawan-kawan ( 2024 ) |
6. Medan Listrik Berdenyut (PEF)
6.1 Prinsip Kerja
Sistem pemrosesan medan listrik berdenyut sederhana terdiri dari catu daya tegangan tinggi, bank kapasitor penyimpanan energi, resistor pembatas arus pengisian, sakelar untuk melepaskan energi dari kapasitor melintasi makanan, dan ruang perawatan (Gambar 5 ). Bentuk gelombang pulsa dipantau melalui osiloskop. Generator DC tegangan tinggi mengubah tegangan dari saluran utilitas (110 V) menjadi arus bolak-balik (AC) tegangan tinggi, yang kemudian disearahkan menjadi arus searah (DC) tegangan tinggi. Energi dari catu daya disimpan dalam kapasitor dan dilepaskan melalui ruang perawatan, yang menciptakan medan listrik dalam produk makanan. Tegangan melintasi kapasitor dimaksudkan agar setara dengan tegangan melintasi generator. Untuk mengisi daya bank kapasitor, sumber daya arus searah digunakan, yang dihasilkan dengan memperkuat dan menyearahkan arus bolak-balik biasa. Energi dilepaskan dari bank penyimpanan kapasitor melintasi makanan di ruang perawatan melalui sakelar listrik (Raso et al. 2022 ).
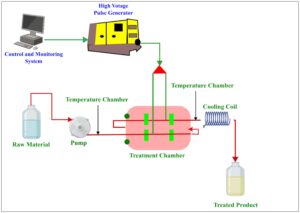
PEF dengan cepat mendapatkan popularitas sebagai teknologi pemrosesan makanan yang menjanjikan karena persyaratan suhu rendah, waktu pemrosesan yang singkat, dan ramah lingkungan. Berbeda dengan metode pemrosesan makanan konvensional, PEF berdampak minimal terhadap nutrisi makanan, secara efektif membasmi mikroba berbahaya, dan memperpanjang umur simpan produk makanan (Rahaman et al. 2020 ). Beberapa penelitian telah melaporkan penggunaan PEF dalam pemrosesan makanan, termasuk ekstraksi zat aktif, pasteurisasi, pengeringan, dan pencairan produk makanan, dan modifikasi sifat fisikokimia, reologi, dan fungsional makanan (Dong et al. 2020 ; Hu et al. 2024 ; Walkling-Ribeiro et al. 2024 ; Wang et al. 2023 ). PEF berpotensi untuk menginduksi perubahan struktural, meningkatkan asam amino bebas, memperbaiki sifat fungsional, dan meningkatkan pemulihan protein dalam makanan (Taha et al. 2022 ).
6.2 Efek Medan Listrik Berdenyut (PEF) pada Protein Makanan
Ringkasan efek PEF pada protein yang berasal dari berbagai makanan disajikan dalam Tabel 6. Sumber protein makanan, profil medan listrik, temuan utama, dan referensi terkait disediakan. Perlakuan PEF meningkatkan kelarutan kasein misel dari 84,9% (tidak diolah) menjadi 87,1% (diolah pada 10 kV/cm). Polarisasi molekuler dan konstanta dielektrik yang lebih baik yang terjadi dari perlakuan PEF merupakan penyebab utama peningkatan kelarutan kasein misel (Taha et al. 2023 ). Perlakuan PEF mengurangi kandungan α-helix dan meningkatkan kandungan β-sheet, yang menunjukkan perubahan dalam struktur protein sekunder dan ikatan hidrogen. Dibandingkan dengan pemrosesan suhu sangat tinggi (UHT) dan suhu rendah jangka panjang (LTLT), perlakuan PEF memiliki efek yang lebih lemah pada kandungan β-laktoglobulin dalam susu (Šalaševičius et al. 2021 ). Lebih jauh lagi, setelah perlakuan PEF, konsentrasi protein whey yang tidak terdenaturasi tetap tidak berubah dibandingkan dengan sampel susu mentah. Manzoor dkk. ( 2019 ) melaporkan penurunan viskositas nyata susu almond, yang sebagian besar disebabkan oleh pengolahan PEF, yang menyebabkan perubahan dalam koagulasi protein susu almond, ukuran gumpalan lemak, dan distribusi. Peningkatan intensitas PEF dari 7 menjadi 28 kVcm −1 menghasilkan viskositas nyata yang jauh lebih tinggi ( p < 0,05), yang menunjukkan interaksi antarmolekul antara molekul terdenaturasi yang berdekatan karena jaringan transien yang lemah. Perlakuan PEF pada 2,8 kV menghasilkan peningkatan suhu denaturasi ( puncak T ), yang menunjukkan peningkatan interaksi polipeptida dan kemampuan untuk membentuk gel yang kaku dan mandiri tanpa denaturasi protein lengkap (Tabel 6 ).
| Sumber protein | Parameter PEF | Temuan utama | Referensi |
|---|---|---|---|
| Putih telur |
|
|
Qian dan kawan-kawan ( 2019 ) |
| Biji kanola |
|
|
Zhu dan kawan-kawan ( 2024 ) |
| Susu whey |
|
|
Hu dan kawan-kawan ( 2024 ) |
| Daging sapi |
|
|
Chian dan kawan-kawan ( 2019 ) |
| Kedelai |
|
|
Wang dan kawan-kawan. ( 2023 ) |
| Daging sapi |
|
|
Bhat dkk. ( 2018 ) |
| Misel kasein |
|
|
Taha dan kawan-kawan ( 2023 ) |
Cropotova et al. ( 2021 ) mempelajari dampak praperlakuan medan listrik berdenyut pada parameter kualitas ikan kerapu dan melaporkan bahwa pH yang lebih rendah diperoleh dibandingkan dengan sampel yang tidak diolah, yang dapat disebabkan oleh pelepasan ion dari sel yang terganggu atau perubahan struktural pada protein yang memungkinkan pelepasan gugus asam. Tidak ada perbedaan signifikan dalam kapasitas menahan air dan aktivitas air antara sampel yang diolah dengan PEF dan yang tidak diolah yang dilaporkan. Lebih banyak penelitian telah menyelidiki efek perlakuan PEF pada protein makanan (Dong et al. 2020 ; Mungure et al. 2020 ; Šalaševičius et al. 2021 ; Shiekh et al. 2020 ; Taha et al. 2023 ).
Representasi umum mekanisme protein pangan yang mengalami perlakuan PEF, disorot oleh (Shams et al. 2024 ; Taha et al. 2022 ), digambarkan dalam Gambar 6 . Mekanisme modifikasi protein pangan di bawah perlakuan PEF meliputi, tetapi tidak terbatas pada, pelipatan, agregasi, interaksi kovalen, dan oksidasi. Awalnya, PEF mengganggu struktur tersier dan kuartener protein melalui gaya elektrostatik, yang menyebabkan pelipatan protein dan paparan area hidrofobik, sehingga meningkatkan kerentanannya terhadap interaksi berikutnya. Setelah pelipatan, area hidrofobik protein yang terekspos berinteraksi satu sama lain, menyebabkan agregasi dan pengembangan agregat protein yang dapat mengubah tekstur dan konsistensi makanan, yang berguna untuk modifikasi tekstur dalam produk makanan akhir (Wang, Li, Guo, et al. 2022 ). Lebih jauh lagi, PEF dapat mendorong perkembangan ikatan kovalen antara molekul protein, seperti ikatan disulfida, sehingga menstabilkan agregasi dan memodifikasi sifat fungsional protein, seperti kelarutannya, pembentukan gel, dan kapasitas pengemulsi, yang semuanya penting dalam pengolahan makanan. Lebih jauh lagi, medan listrik yang dihasilkan oleh PEF dapat mendorong reaksi oksidasi dengan menciptakan radikal bebas yang menargetkan rantai samping protein, yang mengakibatkan oksidasi. Oksidasi ini dapat memengaruhi stabilitas dan fungsionalitas protein, yang biasanya mengakibatkan perubahan pada rasa, warna, dan kualitas nutrisi makanan (Taha et al. 2022 ).
7. Hidrolisis Enzimatik
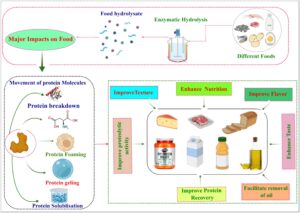
Hidrolisis enzimatik merupakan teknik pengolahan makanan baru yang memecah makromolekul makanan melalui penggunaan enzim dan air. Proses ini berpotensi mengubah struktur molekuler dari komponen makanan seperti protein, karbohidrat, dan lipid (Boukid et al. 2023 ). Hidrolisis enzimatik memiliki banyak efek pada protein makanan, termasuk peningkatan tekstur, aktivitas proteolitik, nutrisi, rasa (Vogelsang-O’Dwyer et al. 2022 ), dan pemulihan peptida (Chen et al. 2024 ), serta penghilangan minyak dari biji minyak dan sumber minyak lainnya (Zhao et al. 2023 ) (Gambar 7 ).
Kemajuan signifikan telah terungkap dalam hidrolisis enzimatik protein makanan dan sumbernya, termasuk makanan ringan, daging dan pengganti daging, saus dan sup, makanan panggang, makanan penutup dan es krim, dan minuman (Mohammadi et al. 2022 ; Zhao et al. 2021 ). Berbagai faktor memengaruhi hidrolisis enzimatik makanan. Faktor substrat seperti bentuk fisik, ukuran partikel, dan kandungan serat sangat memengaruhi laju hidrolisis (Tang et al. 2023 ). Difusi enzim, porositas substrat, adsorpsi enzim, dan kejadian katalitik semuanya berkontribusi terhadap keterbatasan hidrolisis. pH, kekuatan ionik, panas, dan geser mekanis memengaruhi hidrolisis protein.
Ringkasan efek hidrolisis enzimatik pada berbagai protein pangan disajikan dalam Tabel 7. Gu et al. ( 2021 ) memproses bubuk kuning telur melalui hidrolisis enzimatik dan ekstraksi fluida superkritis. Konsentrasi enzim alkalase sebesar 500 U/g, suhu ekstraksi 313,15 K, periode 120 menit, dan rasio padat-cair 1:9 (g/mL) digunakan. Derajat hidrolisis protein meningkat seiring dengan peningkatan konsentrasi enzim, mencapai maksimum (11,2%) pada 2000 U/g. Dibandingkan dengan sampel yang tidak diolah, sampel yang diolah dengan hidrolisis enzimatik menunjukkan distribusi ukuran partikel yang lebih teratur, yang menunjukkan ukuran yang lebih seragam. Hidrolisis enzimatik dilaporkan meningkatkan kelarutan protein dalam bubuk kuning telur dengan mengubah protein yang tidak larut, seperti lipoprotein densitas tinggi (HDL), menjadi peptida dengan berat molekul lebih rendah dan hidrofilisitas lebih besar. Pemutusan ikatan peptida akan mengekspos lebih banyak gugus polar dan meningkatkan jumlah ikatan hidrogen antara peptida dan molekul air, yang menyebabkan peningkatan kelarutan protein dalam air (WS). Hidrolisis akan mengubah konfigurasi heliks rangkap tiga gelatin dan mengurangi berat molekul protein, sehingga memengaruhi karakteristik fungsionalnya. Hidrolisis akan mengekspos gugus aktif seperti gugus karboksil dan gugus amino-terminal. Selain itu, peptida menjadi lebih hidrofilik dan berinteraksi dengan air melalui ikatan hidrogen (Sow et al. 2019 ).
| Sumber protein | Parameter hidrolisis enzimatik | Pengamatan utama | Referensi |
|---|---|---|---|
| Kepala udang |
|
|
Dzikri Hisyam dkk. ( 2024 ) |
| Klorella |
|
|
Gharehbeglou dkk. ( 2024 ) |
| Kedelai |
|
|
Zhang, Du, dkk. ( 2023 ) |
| Isi perut dan tulang ayam |
|
|
Lima dan kawan-kawan ( 2024 ) |
| Kuning telur |
|
|
Gao dan kawan-kawan ( 2019 ) |
| Ikan picu berbintang |
|
|
Sripokar dkk. ( 2019 ) |
Gao et al. ( 2019 ) melaporkan bahwa hidrolisis enzimatik kuning telur mengakibatkan peningkatan titik gel dari 78°C (tidak diolah) menjadi 90°C (terhidrolisis secara enzimatik), dengan peningkatan tajam dalam modul penyimpanan (G′) dan modul kehilangan (G″), yang menunjukkan peningkatan dalam stabilitas termal. Pada setiap konsentrasi protein, emulsi yang dibuat dari kuning telur yang dihidrolisis memiliki diameter partikel yang lebih kecil daripada emulsi asli, yang menunjukkan bahwa kuning telur yang dihidrolisis secara enzimatik memiliki stabilitas pengemulsi yang lebih baik. Hidrolisis enzimatik memodifikasi kuantitas dan keragaman asam amino yang ada dalam protein kuning telur, sehingga memengaruhi kerapatan muatan protein.
Proses hidrolisis dua tahap dikembangkan untuk aplikasi industri pada suhu 55°C, terdiri dari 12 jam hidrolisis dengan protease netral diikuti oleh 12 jam hidrolisis dengan aminopeptidase (Zhao et al. 2021 ). Metode ini secara efektif menghasilkan hidrolisat protein yang kaya akan peptida penambah rasa umami dan umami, seperti Asn-Pro dan Ala-His, dari preparat protein nonkecap, termasuk isolat protein kedelai, protein beras, protein gandum, protein kacang tanah, dan protein kacang polong. Peningkatan sifat termal tepung inti oat dicatat setelah hidrolisis enzimatik; khususnya, protein oat menunjukkan termostabilitas yang signifikan, dengan suhu denaturasi sekitar 110°C (Zhang, Huang, et al. 2024 ). Sifat termal protein penting dalam menentukan ketahanannya terhadap agregasi/denaturasi selama proses termal. Pada nilai pH di bawah 7,0, potensi zeta dari tepung inti oat dan sampel yang diolah dengan enzim ganda menurun drastis, yang disebabkan oleh presipitasi protein oat. Hidrolisis enzimatik karkas ayam menghilangkan lemak dan bahan yang tidak larut, sehingga menghasilkan peningkatan kandungan/pemulihan protein kasar sebesar 21,38% (Zhang, Li, dkk. 2023 ). Setelah hidrolisis enzimatik, asam amino esensial dalam karkas ayam meningkat drastis. Hasil ini menunjukkan bahwa kadar asam amino bebas dan oligopeptida yang lebih tinggi meningkatkan rasa, termasuk rasa kaldu, daging, dan gurih yang terkait dengan pengawetan dan hidrolisis (Begum dkk. 2020 ).
Hidrolisat protein dari otot ikan picu bintang ditemukan memiliki aktivitas penangkal radikal DPPH yang lebih besar pada konsentrasi 30–40 mg/mL (Sripokar et al. 2019 ). Hidrolisis enzimatik meningkatkan kelarutan protein secara signifikan, mencapai maksimum 94% pada pH 3. Perubahan kelarutan ini dapat dikaitkan dengan muatan bersih residu asam amino setelah hidrolisis, yang meningkat saat pH menjauh dari titik isoelektrik, yang mendorong agregasi interaksi hidrofobik (Dinakarkumar et al. 2022 ). Dalam sistem koloid, protein yang larut memberikan molekul dispersibilitas yang seragam dan meningkatkan karakteristik antarmuka. Hidrolisis enzimatik dapat memengaruhi ukuran, hidrofobisitas, polaritas, dan ionisasi hidrolisat protein. Faktor utama lain yang memengaruhi kelarutan protein adalah keseimbangan kepala peptida hidrofilik dan hidrofobik (Sinthusamran et al. 2020 ). Setelah perlakuan hidrolisis enzimatik, kelarutan protein meningkat secara eksponensial, yang berpotensi memengaruhi penampilan, sedimentasi, viskositas, dan rasa ikan selama penyimpanan serta rasa di mulut, daya cerna, dan respons metabolisme selama konsumsi (Cosson et al. 2022 ).
Hidrolisis enzimatik mengurangi ukuran partikel hidrolisat bungkil kedelai, yang menunjukkan bahwa peptida diproduksi sebagai hasil dari putusnya ikatan peptida (Zhang, Du, et al. 2023 ). Total kandungan asam amino meningkat dari 37,4 menjadi 39,2 dan kemudian menjadi 39,5 sebelum menurun menjadi 38,6 mg/g seiring dengan meningkatnya derajat hidrolisis (DH). Selama jam awal hidrolisis, konsentrasi asam amino meningkat, yang menunjukkan degradasi protein menjadi lebih banyak asam amino; namun, dengan hidrolisis yang berkepanjangan, residu asam amino kembali terkapsulasi di dalam struktur protein (Li, Yang, et al. 2022 ). Analisis SEM mengungkapkan degradasi protein yang disebabkan oleh hidrolisis enzimatik. Pergeseran pita amida I dari 1660 menjadi 1650 cm −1 menunjukkan perbedaan yang cukup besar dalam struktur sekunder, dengan lebih sedikit α-heliks dan lebih banyak β-belitan. Disintegrasi enzimatik meningkatkan kemampuan emulsifikasi dalam waktu singkat (1 jam). Paparan gugus hidrofobik dapat menyingkapkan lapisan dalam molekul, meningkatkan keseimbangan hidrofilik dan kemampuan emulsifikasi. Panelis sensoris menilai hidrolisat bungkil kedelai sebagai pahit dibandingkan dengan bungkil kedelai. Aktivitas antioksidan bungkil kedelai yang mengalami hidrolisis enzimatik meningkat secara signifikan ( p < 0,05), kemungkinan karena pembentukan peptida molekul kecil dan peningkatan ketersediaan asam amino aktif selama proses hidrolisis. Peningkatan kadar asam amino, termasuk Thr, Asp, Lys, Glu, Met, dan Gly, dapat secara efektif menghilangkan radikal bebas. Lebih banyak penelitian tentang efek hidrolisis enzimatik pada protein makanan telah dilaporkan (Bui et al. 2021 ; Gautam et al. 2024 ; Rios-Morales et al. 2023 ).
8 Menganalisis Variabilitas Hasil dan Faktor-Faktor yang Mempengaruhi Modifikasi Protein Makanan
Laporan yang berbeda yang dicakup dalam tinjauan ini mengungkapkan perbedaan penting dalam berbagai sifat protein pangan yang mengalami pemrosesan pangan baru dalam kondisi yang sama. Misalnya, HPP meningkatkan kelarutan protein dalam alternatif susu berbasis barley pada 300 MPa (Strrieder et al. 2022 ), tetapi tekanan (200–300 MPa) menurunkan kelarutan protein dari daging cincang Haddock. Perbedaan dalam perubahan kelarutan dapat dikaitkan dengan komposisi protein yang berbeda dan interaksi dalam dua sumber pangan ini. Daging cincang Haddock memiliki campuran protein otot, dan penggunaan tekanan tinggi dapat menyebabkan terbentuknya gumpalan dengan kelarutan rendah, terutama pada tekanan yang relatif lebih tinggi (Chen, Wang, Zhu, et al. 2022 ). Dalam alternatif susu berbasis barley, protein mungkin memiliki struktur yang lebih fleksibel yang memungkinkan dispersi yang lebih baik dan peningkatan kelarutan di bawah tekanan tinggi (Navare et al. 2023 ). Perlakuan HPP pada 500 MPa/10 menit/30°C menurunkan kapasitas menahan air dan memperbaiki kekerasan, kekenyalan, kekompakan, dan kekenyalan protein pada daging ham ikan (Sakamut et al. 2025 ). Pada protein daging kepiting, perlakuan tekanan sedang (300 MPa) meningkatkan kapasitas pembentukan gel dan tekstur. Namun, pada 500 MPa, miosin terdenaturasi sepenuhnya, dan transisi termal tidak menunjukkan puncak endotermik (Velazquez et al. 2021 ). Variasi yang diamati kemungkinan disebabkan oleh perbedaan jenis protein dan keadaan awalnya pada daging ham ikan dan daging kepiting. Daging ham ikan mungkin memiliki matriks protein yang lebih heterogen, dan tekanan tinggi dapat menyebabkan penataan ulang protein yang lebih kompleks, yang memengaruhi kapasitas menahan air dan tekstur (Cropotova et al. 2020 ). Protein daging kepiting, di sisi lain, menunjukkan respons yang berbeda di bawah berbagai rentang tekanan, dengan tekanan sedang mendorong modifikasi struktural yang menguntungkan untuk gelasi, sedangkan tekanan tinggi menghasilkan denaturasi total.
Seperti dibahas dalam bagian 4.2.2, perlakuan plasma dingin dapat memiliki efek yang berbeda pada kelarutan protein tergantung pada waktu perlakuan. Dilaporkan bahwa kelarutan protein biji bunga matahari yang diolah dengan plasma dingin selama 3 menit meningkat, sedangkan perlakuan selama 4 dan 5 menit menurunkan kelarutan (Wang et al. 2024 ). Namun, untuk isolat protein kedelai, perlakuan plasma dingin selama lebih dari 10 menit meningkatkan kelarutan lebih dari 30% (Bu et al. 2022 ). Perbedaan yang mencolok dalam hasil kelarutan dapat disebabkan oleh karakteristik unik dari setiap sumber protein. Protein biji bunga matahari dilaporkan sensitif terhadap paparan yang lama karena komposisi asam amino dan struktur proteinnya yang spesifik. Hal ini juga didukung oleh (Kehm et al. 2021 ), yang melaporkan protein kaya sulfur (misalnya, sistein dalam β-laktoglobulin susu) lebih rentan terhadap oksidasi oleh spesies reaktif plasma dingin, yang menyebabkan pembentukan dan agregasi ikatan disulfida, yang berpotensi mengurangi kelarutannya selama perlakuan yang lama. Hal ini jelas menunjukkan bahwa protein dari sumber yang berbeda menunjukkan variasi dalam urutan dan sifat asam aminonya, yang memengaruhi responsnya terhadap pemrosesan. Alasan lain yang mungkin adalah pH saat kelarutan protein diukur; yaitu, kelarutan yang diukur pada pH 7 dan 12 mungkin berbeda karena perubahan status muatan (Turker dan Isleroglu 2024 ).
Variasi dalam kelarutan dan derajat hidrolisis protein dari berbagai makanan yang diolah dengan hidrolisis enzimatik diamati. Untuk kepala udang, penambahan enzim papain 3% menghasilkan derajat hidrolisis protein tertinggi dan peningkatan kandungan protein terlarut dengan meningkatnya konsentrasi enzim papain (Dzikri Hisyam et al. 2024 ). Namun, dalam chlorella, meskipun semua hidrolisat menghasilkan lebih dari 50% kelarutan protein setelah hidrolisis enzimatik, hidrolisat tripsin dan pepsin masing-masing menunjukkan derajat hidrolisis tertinggi dan terendah di antara berbagai enzim yang diuji (Gharehbeglou et al. 2024 ). Variasi dalam derajat hidrolisis dan kelarutan disebabkan oleh selektivitas enzim untuk protein dari berbagai sumber. Papain mungkin memiliki afinitas yang lebih kuat untuk protein dalam kepala udang, sehingga menghasilkan hidrolisis yang lebih efisien. Berbagai enzim dalam chlorella memiliki spesifisitas pembelahan yang berbeda, sehingga menghasilkan derajat hidrolisis dan kelarutan yang bervariasi.
Hidrolisis enzimatik hidrolisat bungkil kedelai mengurangi ukuran partikel, meningkatkan total kandungan asam amino, dan memperbaiki kapasitas emulsifikasi untuk waktu yang singkat, tetapi hidrolisis yang berkepanjangan berdampak negatif pada semua karakteristik protein ini (Zhang, Du, et al. 2023 ). Di sisi lain, waktu perlakuan hidrolisis enzimatik sedang untuk kuning telur meningkatkan titik gel, memperbaiki stabilitas termal, dan meningkatkan stabilitas pengemulsi (Gao et al. 2019 ). Menurut penelitian mereka, hidrolisis enzimatik protein kuning telur meningkatkan kelarutan pada nilai pH yang jauh dari titik isoelektrik karena peningkatan tolakan elektrostatik, yang menunjukkan efek pH pada modifikasi protein. Struktur kompleks protein bungkil kedelai memerlukan pola hidrolisis khusus untuk meningkatkan emulsifikasi, dan gugus fungsi unik protein kuning telur, yang dianggap cocok untuk hidrolisis enzimatik, juga dapat menjelaskan variasi dalam sifat fungsional.
Metode modifikasi protein berbantuan termal seperti pemanasan ohmik dan pemanasan ultrasonik menunjukkan efek yang bergantung pada suhu pada protein makanan. Misalnya, pemanasan ohmik protein wijen pada 85°C meningkatkan kelarutan protein dengan membuka lipatan dan memaparkan gugus polar, tetapi perlakuan pada suhu tinggi mengurangi kelarutan karena ikatan silang (Saeedabad et al. 2024 ). Meskipun faktor lain mungkin memainkan peran penting dalam variasi respons protein makanan terhadap pemrosesan makanan baru, komposisi dan struktur asam amino, konformasi protein asli, intensitas dan durasi perlakuan, suhu dan pH selama pemrosesan, serta teknik pengukuran dan metode analisis merupakan faktor utama. Untuk mengatasi variabilitas semacam itu, penelitian masa depan di sektor ini harus berfokus pada pelaporan standar parameter pemrosesan (misalnya, gradien tegangan dalam pemanasan ohmik, bentuk gelombang pulsa dalam PEF, dan komposisi gas plasma dalam plasma dingin) untuk memungkinkan reproduktifitas, karakterisasi sumber protein, pendekatan analisis multi-metode, dan pemodelan statistik interaksi parameter.
9 Perspektif Masa Depan
9.1 Teknologi Gabungan
Meskipun metode pemrosesan makanan baru memiliki efek menarik pada berbagai sifat protein makanan, setiap metode pemrosesan makanan baru memiliki kekurangannya sendiri. Untuk mengurangi keterbatasan dan pengaruh yang tidak menguntungkan pada protein makanan dan untuk modifikasi protein yang lebih baik, metode pemrosesan termal dan nontermal dapat diterapkan. Misalnya, pemanasan ultrasonik dapat dikombinasikan dengan air yang diaktifkan plasma nontermal dengan menggunakan yang terakhir sebagai praperlakuan untuk protein makanan. Pendekatan ini dapat meningkatkan struktur protein, meningkatkan kerentanan terhadap pemanasan ultrasonik, yang membantu menghindari masalah umum denaturasi protein yang disebabkan oleh paparan ultrasound yang berkepanjangan. Lebih jauh, pemanasan ultrasonik menyediakan energi aktivasi yang dibutuhkan untuk spesies reaktif baik dalam plasma maupun protein. Hasilnya, metode ini dapat menghemat waktu dan energi selama proses modifikasi protein.
9.2 Perangkat Lunak Simulasi
Alat berbasis komputer (perangkat lunak simulasi) juga dapat digunakan untuk memprediksi interaksi antara metode pemrosesan makanan gabungan dan komponen makanan dengan jelas, sehingga mengatasi kompleksitas yang terkait dengan peningkatan skala, pengendalian proses, dan validasi metode pemrosesan makanan baru (Gambar 8 ). Misalnya, peneliti makanan dapat memanfaatkan COMSOL Multiphysics untuk lebih memahami interaksi antara spesies yang berbeda selama pemrosesan plasma, operasi kompleks yang sulit dipahami dalam aplikasi praktis.
Demikian pula, modifikasi hidrolisis enzimatik pada protein pangan menghadapi kendala seperti konsumsi energi tinggi untuk mempertahankan kondisi reaksi, enzim mahal dengan keterbatasan penggunaan ulang, biaya skalabilitas yang signifikan, dan persyaratan regulasi yang ketat. Perangkat lunak simulasi seperti COMSOL dapat memodelkan dan mengoptimalkan parameter reaksi, yaitu suhu, pH, dan rasio enzim-substrat untuk menghemat energi; memprediksi aktivitas enzim untuk pemanfaatan yang efektif dan penghematan biaya; dan mensimulasikan analisis peningkatan skala dan sensitivitas untuk mengidentifikasi pilihan peralatan, utilitas, dan metodologi yang hemat biaya. Lebih jauh lagi, teknologi enzim yang diimobilisasi (bidang penelitian yang dinamis di bidang bioteknologi dan rekayasa kimia) dapat meningkatkan penggunaan ulang enzim sekaligus menurunkan harga, dan penelitian terhadap metode produksi enzim yang lebih efisien juga dapat mengurangi biaya. Transparansi dan kolaborasi yang kuat dengan badan regulasi dari proyek rintisan sangat penting untuk memastikan kepatuhan terkait keamanan pangan dan penggunaan enzim. Perangkat lunak pemodelan dan simulasi lainnya, seperti ANSYS, juga dapat digunakan untuk memprediksi fenomena selama pemrosesan makanan baru dari protein makanan, memfasilitasi peningkatan skala dan pengendalian parameter proses yang tepat.
Selain metode pemrosesan makanan baru yang disebutkan di atas, modifikasi PEF pada protein makanan juga memiliki keterbatasan yang terkait dengan konsumsi energi tinggi dan efek perlakuan nontermal, yang dapat menyebabkan hasil yang tidak konsisten dan dapat dikurangi dengan mengoptimalkan desain sistem PEF, menyesuaikan kondisi larutan, dan meningkatkan ruang perlakuan. Meskipun hanya kendala umum dari beberapa metode pemrosesan makanan baru dalam modifikasi protein makanan yang disorot di sini, sebagian besar dari metode tersebut memiliki kendala yang sama kecuali untuk variasi operasi dan parameter proses spesifiknya; oleh karena itu, diyakini bahwa kedua perspektif yang diusulkan (teknologi gabungan dan perangkat lunak simulasi) dapat mengurangi kendala utamanya.
Lebih jauh, penelitian ekstensif harus dilakukan pada pengoptimalan parameter proses untuk metode pemrosesan gabungan, serta dampaknya pada ukuran partikel, kelarutan, struktur, stabilitas emulsi dan pembusaan, dan bioaktivitas protein makanan, karena perawatan gabungan dapat menghasilkan beberapa parameter yang memengaruhi proses modifikasi. Di masa mendatang, kombinasi pemrosesan makanan termal dan nontermal, serta simulasi dan pengoptimalan, diharapkan menghasilkan sifat sensorik yang lebih baik, kontrol proses yang efektif dan validasi operasi, peningkatan sifat nutrisi dan fungsional, masa simpan yang lebih lama, kemudahan komersialisasi, dan operasi yang hemat waktu dan biaya.
Akhirnya, untuk waktu yang lama, mengembangkan standar yang jelas untuk metode pemrosesan baru dan memastikan kepatuhan terhadap badan regulasi telah menjadi tren yang menantang. Namun, dengan perspektif perawatan gabungan dan perangkat komputer yang disebutkan di atas, mungkin saja untuk mencapai efek kombinasi yang optimal dan menetapkan standar yang jelas, sehingga memudahkan proses persetujuan dan sertifikasi.
10 Kesimpulan
Teknologi pemrosesan makanan baru, seperti pemanasan ohmik, pemanasan ultrasonik, plasma dingin, air yang diaktifkan plasma, pemrosesan bertekanan tinggi, medan listrik berdenyut, dan hidrolisis enzimatik, telah berkembang untuk memenuhi permintaan pelanggan yang terus meningkat akan makanan yang aman, bergizi, dan diproses secara minimal dengan masa simpan yang lebih lama. Dalam tinjauan ini, dampak dari teknik pemrosesan makanan baru tersebut pada struktur, ukuran partikel, kelarutan, stabilitas emulsi dan pembusaan, dan bioaktivitas protein makanan, serta dampak keseluruhannya pada sifat fungsional dan nutrisi makanan, dibahas. Menurut literatur, pemanasan ohmik memberikan pemanasan yang cepat dan seragam dan cenderung memengaruhi kualitas protein dalam berbagai makanan, yaitu daging, susu, dan roti. Pemanasan ultrasonik, proses nontermal, meningkatkan sifat fisikokimia dan fungsional protein makanan, seperti kapasitas menahan air dan pembusaannya. HPP dilaporkan terutama memengaruhi ukuran partikel, struktur sekunder, dan sifat koagulasi protein makanan. PEF, yang terkenal karena persyaratan suhu rendah dan waktu pemrosesan singkatnya, telah terbukti meningkatkan kelarutan protein dan memodifikasi struktur protein, sehingga meningkatkan viskositas nyata produk makanan. Hidrolisis enzimatik memecah makromolekul makanan, meningkatkan tekstur, aktivitas proteolitik, nutrisi, dan rasa. Ia juga meningkatkan derajat hidrolisis dan kelarutan protein, memodifikasi karakteristik fungsional protein.
Secara keseluruhan, metode pemrosesan makanan baru ini memiliki beragam efek pada protein makanan, yang mungkin positif atau negatif tergantung pada kondisi pemrosesan dan sumber protein. Memahami efek keseluruhan dari perspektif nutrisi, kualitas, dan rekayasa akan memfasilitasi pengoptimalan parameter proses, meningkatkan kualitas makanan, dan membantu pengembangan makanan inovatif dengan protein sebagai bahan utama. Oleh karena itu, untuk menjembatani kesenjangan pengetahuan yang ada dan mendorong kemajuan di sektor yang sedang naik daun ini, penelitian di masa mendatang harus berfokus pada pemahaman yang jelas tentang mekanisme efek ini, pengoptimalan parameter proses untuk efek protein terbaik, dan memperluas potensi aplikasi protein makanan yang dimodifikasi dalam industri makanan.

