
ABSTRAK
Pasien dengan kanker kolorektal (CRC) stadium II-III sering menerima kemoterapi berbasis fluoropirimidin, biasanya dikombinasikan dengan rejimen lain, yang mana ∼50% mengalami toksisitas berat akibat kemoterapi. Vitamin B folat telah dikaitkan dengan risiko toksisitas, mungkin melalui efek pada metilasi DNA. Di sini, kami meneliti peran potensial metilasi DNA terkait folat dalam konteks toksisitas akibat kemoterapi. Pencarian literatur sistematis dilakukan untuk mengidentifikasi penelitian yang menyelidiki profil metilasi DNA yang terkait dengan status/asupan folat atau dengan toksisitas. Situs CpG dan gen yang tumpang tindih di seluruh penelitian yang menyelidiki asosiasi untuk “metilasi folat-DNA” dan “toksisitas metilasi DNA” diidentifikasi. Probabilitas tumpang tindih diuji menggunakan uji hipergeometrik dan analisis jalur Gene Ontology dan KEGG dilakukan. Enam penelitian disertakan. Sejumlah besar CpG dan gen tumpang tindih dengan metilasi yang diubah sebagai respons terhadap folat dan sindrom tangan-kaki (HFS) atau trombositopenia. Selain itu, metilasi gen dalam jalur KEGG “adhesi fokal” terkait dengan status/asupan folat dan kejadian HFS, trombositopenia, dan neutropenia. Kami mengidentifikasi beberapa profil metilasi DNA yang tumpang tindih terkait dengan paparan folat dan toksisitas. Hal ini memberikan bukti awal yang menyiratkan bahwa metilasi DNA terkait folat dapat menentukan risiko toksisitas, dan oleh karena itu dapat dianggap sebagai faktor yang dapat dimodifikasi untuk meningkatkan hasil pasien.
Singkatan
5-FU
5-fluorourasil
CRC
kanker kolorektal
DMP
posisi metilasi berbeda
DMR
daerah metilasi berbeda
PERGI
ontologi gen
Bahasa Inggris HFS
sindrom tangan-kaki
KEGG
Ensiklopedia gen dan genom Kyoto
ROS
spesies oksigen reaktif
1 Pendahuluan
Kanker kolorektal (CRC) merupakan kanker ketiga yang paling sering didiagnosis [ 1 ]. Pasien dengan CRC stadium II dan stadium III berisiko tinggi sering menerima kemoterapi sebagai bagian dari pengobatan antikanker mereka [ 2 , 3 ]. Strategi kemoterapi yang umum untuk CRC terdiri dari regimen fluoropyrimidine, sering kali 5-fluorouracil (5-FU) atau capecitabine, dengan atau tanpa oxaliplatin [ 3 ]. Sejumlah besar pasien dengan CRC mengalami toksisitas yang diinduksi fluoropyrimidine, seperti diare (∼25%–50%) [ 4 – 6 ], sindrom tangan-kaki (∼25%–60%) [ 4 – 8 ], dan neutropenia (∼5%–20%) [ 4 , 5 ].
Regimen fluoropirimidin menargetkan metabolisme satu karbon di mana folat vitamin B memainkan peran penting [ 9 ]. Metabolisme satu karbon adalah serangkaian reaksi biokimia yang kompleks yang menyediakan nukleotida untuk sintesis dan perbaikan DNA dan gugus metil untuk reaksi metilasi [ 10 ]. Kadar folat yang beredar relatif tinggi dan kadar asam folat yang terdeteksi dalam darah telah dikaitkan dengan peningkatan risiko toksisitas yang diinduksi fluoropirimidin [ 11 – 13 ]. Metilasi DNA, mengacu pada penambahan gugus metil ke situs CpG [ 14 ], merupakan pengatur penting transkripsi gen [ 15 ] dan karenanya mungkin juga berperan dalam toksisitas yang diinduksi kemoterapi [ 16 ]. Studi asosiasi epigenom-lebar melaporkan bahwa asupan folat, baik dari makanan maupun suplemen dalam bentuk asam folat, dikaitkan dengan pola metilasi DNA [ 17 – 20 ].
Menguraikan peran metilasi DNA terkait folat dalam toksisitas yang disebabkan kemoterapi berpotensi meningkatkan pemahaman mekanisme di balik perbedaan toksisitas antar individu. Hal ini berpotensi memberikan dasar untuk menyempurnakan strategi pengobatan dan meminimalkan toksisitas pada pasien dengan CRC dan selanjutnya meningkatkan kualitas hidup dan hasil prognosis [ 21 , 22 ]. Di sini, kami bertujuan untuk memeriksa peran potensial metilasi DNA terkait folat dalam konteks toksisitas yang disebabkan kemoterapi.
2 Metode
Dua penelusuran terpisah dilakukan untuk memberikan tinjauan menyeluruh atas bukti terkini yang tersedia mengenai hubungan antara folat/asam folat dan metilasi DNA pada orang dewasa (Pencarian 1) dan metilasi DNA serta toksisitas yang diinduksi fluoropirimidin pada pasien dengan CRC (Pencarian 2). Data diekstraksi dari publikasi yang diidentifikasi dari setiap penelusuran untuk memeriksa tumpang tindih pada situs dan gen CpG termetilasi dalam kaitannya dengan toksisitas folat/asam folat dan yang diinduksi kemoterapi.
2.1 Identifikasi Penelitian
Kedua penelusuran pustaka dilakukan di PubMed pada tanggal 30 Mei 2024. Judul Subjek Medis dan kata teks bebas berdasarkan judul, abstrak, dan/atau kata kunci digunakan untuk menelusuri publikasi yang memenuhi syarat. Rangkaian penelusuran disajikan dalam Informasi Pendukung 1. Tinjauan ini difokuskan pada studi observasi dan intervensi manusia. Daftar referensi artikel yang disertakan ditelusuri untuk studi tambahan. Selain itu, tinjauan naratif atau sistematis digunakan untuk mengidentifikasi investigasi utama yang menarik.
Untuk penelitian yang memfokuskan paparan folat atau asam folat dalam kaitannya dengan profil metilasi DNA (Pencarian 1), populasi penelitian yang diminati adalah populasi umum (>18 tahun). Paparan yang diminati mencakup asupan makanan atau suplemen serta biomarker folat atau asam folat yang beredar. Penelitian yang tidak memeriksa folat atau asam folat sebagai variabel paparan dikecualikan. Selain itu, kadar homosistein yang beredar tidak dianggap sebagai paparan yang diminati, karena kadar homosistein tidak hanya mencerminkan status folat tetapi juga vitamin B lainnya [ 23 ]. Hasil yang diminati adalah metilasi DNA di seluruh genom yang diukur dalam darah oleh array Illumina Infinium HumanMethylation450k Bead Chip (450K) atau array Infinium MethylationEPIC BeadChip (EPIC).
Untuk penelitian yang berfokus pada profil metilasi DNA dalam kaitannya dengan toksisitas yang disebabkan oleh kemoterapi (Pencarian 2), populasi penelitian yang menjadi perhatian adalah orang dewasa dengan CRC yang menerima kemoterapi berbasis fluoropirimidin. Paparan yang menjadi perhatian adalah metilasi DNA di seluruh genom yang diukur dalam darah atau jaringan dengan array 450K atau array EPIC. Hasil yang menjadi perhatian adalah toksisitas atau ukuran toksisitas (misalnya, jumlah sel darah), yang mengacu pada kejadian buruk akut atau kronis dari kemoterapi. Toksisitas dapat dilaporkan oleh profesional perawatan kesehatan atau pasien dan diukur secara objektif atau subjektif.
Setelah duplikat dihapus, judul, abstrak, dan artikel teks lengkap dievaluasi oleh dua penulis (NRKZ dan SNHA atau JAM). Publikasi dikecualikan jika penelitian tersebut (1) diklasifikasikan sebagai eksperimen hewan atau penelitian in vitro; (2) tidak termasuk dalam populasi umum (>18 tahun) (Pencarian 1) atau tidak termasuk orang dewasa dengan CRC yang menerima kemoterapi berbasis fluoropirimidin (Pencarian 2); (3) tidak menyelidiki paparan atau hasil yang diinginkan seperti yang dijelaskan di atas secara terpisah per pencarian; (4) tidak berisi data asli (lengkap); (6) bukan dalam bahasa Inggris; dan (7) diterbitkan sebelum tahun 2008 (tahun peluncuran array 450K).
2.2 Integrasi Data
Bahasa Indonesia: Setelah penelusuran literatur, integrasi data dilakukan untuk mengeksplorasi profil metilasi DNA yang tumpang tindih terkait dengan pajanan folat dan toksisitas yang diinduksi kemoterapi. Untuk setiap studi yang disertakan, situs CpG dan daftar gen disusun. CpG ditentukan sebagai CpG yang terkait dengan pajanan folat atau toksisitas pada tingkat spesifik CpG, termasuk CpG di daerah metilasi berbeda (DMR) yang terkait dengan pajanan folat atau toksisitas. DMR dipetakan ke CpG terkait menggunakan GenomicRanges [ 24 ] dan paket IlluminaHumanMethylation450kanno.ilmn12.hg19 [ 25 ] di R-studio (versi 4.1.0), yang dapat menghasilkan CpG yang diekstraksi berlebihan dari DMR karena probe yang dikecualikan karena situs non-CpG, kualitas rendah, dan sebagainya, tidak diketahui untuk studi individual. Namun, jika dibandingkan dengan jumlah CpG yang disebutkan dalam publikasi, CpG yang diekstraksi secara berulang dari DMR jumlahnya sangat sedikit (<10%) (Informasi Pendukung 2 ). Daftar gen tersebut mencakup simbol gen yang sesuai dengan masing-masing CpG (posisi metilasi berbeda, DMP) atau DMR.
2.3 Perbandingan Profil Metilasi
Kami melakukan analisis komparatif dari daftar CpG dan gen, menggunakan ID CpG dan simbol gen sebagai pengenal umum. Probabilitas tumpang tindih yang diamati dalam profil metilasi DNA, baik pada tingkat CpG maupun gen, dievaluasi menggunakan uji hipergeometrik. Ukuran populasi untuk pengujian pada tingkat CpG ditentukan oleh jumlah situs CpG terendah yang diukur untuk status metilasi oleh larik yang digunakan dalam setiap penelitian (450K: 431.312; EPIC: 753.722). Untuk pengujian pada tingkat gen, ukuran populasi ditetapkan pada jumlah pengenal simbol gen RefSeq terendah pada larik yang digunakan dalam setiap penelitian (450K: 21.231; EPIC: 27.364). Nilai p di bawah 0,05 dianggap signifikan secara statistik.
2.4 Analisis Jalur GO dan KEGG
Database for Annotation, Visualization, and Integrated Discovery (DAVID) [ 26 ] digunakan untuk melakukan analisis jalur Gene Ontology (GO) dan Kyoto Encyclopedia of Genes and Genomes (KEGG) (Juni 2024). Analisis GO dan KEGG dilakukan secara individual untuk setiap studi yang disertakan. Proses GO dengan nilai p Benjamini-Hochberg < 0,05 dan jalur KEGG dengan nilai p standar < 0,05 dianggap signifikan secara statistik dan kemudian dibandingkan untuk mengungkap ontologi dan jalur yang tumpang tindih antara studi.
3 Hasil
Untuk penelitian yang berfokus pada paparan folat dalam kaitannya dengan metilasi DNA, strategi pencarian kami menghasilkan 368 publikasi (diagram alir dalam Informasi Pendukung 3 ). Berdasarkan kriteria pengecualian yang telah ditetapkan sebelumnya, 364 catatan dikecualikan. Empat laporan yang tersisa dievaluasi berdasarkan teks lengkap, setelah itu satu laporan dikecualikan. Tiga penelitian yang menyelidiki hubungan antara kadar folat serum atau asupan folat makanan dan metilasi DNA disertakan (F1 [ 17 ]; F2 [ 18 ]; F3 [ 19 ]).
Untuk studi yang berfokus pada metilasi DNA dalam kaitannya dengan toksisitas yang diinduksi kemoterapi, strategi pencarian menghasilkan total 29 studi (diagram alir dalam Informasi Pendukung 3 ). Sebanyak 26 catatan dikecualikan berdasarkan kriteria pengecualian yang telah ditentukan sebelumnya. Tiga laporan yang tersisa dievaluasi berdasarkan teks lengkapnya dan ketiga laporan disertakan (T1 [ 27 ]; T2 [ 28 ]; T3 [ 29 ]). Pada T1, toksisitas sindrom tangan-kaki (HFS), trombositopenia, anemia, supresi sumsum tulang, neutropenia, diare, mual, dan muntah dievaluasi, pada T2 hanya HFS dan pada T3 hanya trombositopenia yang dievaluasi. Studi T1-T3 berasal dari studi yang sama dengan populasi studi yang berpotensi tumpang tindih (ukuran sampel: T1, n = 21; T2, n = 56; T3, n = 56). Sebanyak enam publikasi disertakan dalam studi ini (Tabel 1 ). Persetujuan etika diberikan dalam setiap studi individual yang termasuk dalam studi ini.
| ID Studi | Penulis pertama + tahun | Negara | Jenis studi | Populasi studi | Jumlah peserta | Paparan | Hasil | Temuan utama |
|---|---|---|---|---|---|---|---|---|
| Paparan folat | ||||||||
| Bahasa Indonesia: F1 | Kok, 2015 [ 17 ] | Belanda | Analisis lintas seksi dalam uji coba acak terkontrol plasebo | Orang dewasa dengan kadar homosistein yang sedikit meningkat berusia 65–75 tahun | 87 | Tingkat folat serum dasar (diukur sebelum dimulainya intervensi) | Metilasi DNA di seluruh genom pada buffy coat
(array 450K) |
Tingkat folat serum dasar dikaitkan dengan metilasi DNA pada 0 DMP dan 173 DMR ( nilai p yang disesuaikan dengan BH < 0,05) |
| F2 | Mandaviya, 2019 [ 18 ] | Eropa dan Amerika Serikat | Meta-analisis dari 10 studi kohort yang berbeda | Orang dewasa | 5841 | Asupan folat dalam makanan dalam µg/hari (FFQ) | Metilasi DNA di seluruh genom dalam darah utuh atau buffy coat (array 450K) | Asupan folat dari makanan dikaitkan dengan metilasi DNA pada 6 DMP dan 74 DMR ( nilai p yang disesuaikan dengan BH < 0,05) |
| F3 | Perrier, 2019 [ 19 ] | Eropa b | Analisis lintas seksi dalam studi kasus-kontrol bersarang | Wanita pascamenopause tanpa kanker yang umum pada saat perekrutan (kecuali kanker kulit non-melanoma) | 450 | Asupan folat dalam makanan dalam µg/hari (metode FFQ atau wawancara) | Metilasi DNA di seluruh genom dalam buffy coat (array 450K) | Asupan folat dari makanan dikaitkan dengan metilasi DNA pada 0 DMP dan 24 DMR (q DMR < 0,05) |
| Toksisitas akibat kemoterapi | ||||||||
| T1 | Li, 2021 c [ 27 ] | Cina | Studi cross-sectional | Orang dewasa dengan kanker usus besar yang menjalani kemoterapi adjuvan berbasis kapesitabin | 21 | Metilasi DNA di seluruh genom pada jaringan kolorektal ganas (array EPIC) | Toksisitas akibat kemoterapi d (CTCAE_v4.03) | Banyak gen dan DMR yang berhubungan dengan berbagai toksisitas akibat kemoterapi ( nilai p ≤ 0,05 dan nilai Δß absolut rata-rata ≥0,1 ) |
| T2 | Li, 2021 c [ 28 ] | Cina | Studi cross-sectional | Orang dewasa dengan kanker usus besar yang menjalani kemoterapi adjuvan berbasis kapesitabin | 56 | Metilasi DNA di seluruh genom pada jaringan kolorektal ganas (array EPIC) | HFS (CTCAE_v4.0) | Beberapa CpG ( n = 13.756) terkait dengan HFS ( nilai p < 0,05 dan perubahan ±0,1 kali lipat) |
| T3 | Yao, 2022 c [ 29 ] | Cina | Studi cross-sectional | Orang dewasa dengan kanker usus besar yang menjalani kemoterapi adjuvan berbasis kapesitabin | 56 | Metilasi DNA di seluruh genom pada jaringan kolorektal ganas (array EPIC) | trombositopenia (CTCAE_v4.0) | Beberapa CpG ( n = 5090) terkait dengan trombositopenia (nilai perubahan log-lipat >0 atau <0, nilai p <0,05, dan nilai Δß absolut >0,01 ) |
Singkatan: BH, Benjamini Hochberg; CTCAE, Kriteria Terminologi Umum untuk Kejadian Buruk; DMP, posisi DNA yang termetilasi; DMR, daerah DNA yang termetilasi; EPIC, Infinium MethylationEPIC; FFQ, kuesioner frekuensi makanan; HFS, sindrom tangan-kaki; 450K, Illumina Infinium Human Methylation 450K BeadChip. a Belanda, Italia, Finlandia, dan Inggris. b Jerman, Yunani, Italia, Belanda, Spanyol, dan Inggris. c Dari penelitian yang sama, populasi penelitian berpotensi tumpang tindih. d Anemia, penekanan sumsum tulang, diare, sindrom tangan-kaki, mual, muntah, neutropenia, trombositopenia. e β = Intensitas [termetilasi]/Intensitas [termetilasi + tidak termetilasi].
3.1 Paparan Folat dan Metilasi DNA
Ada 1343 (F1), 442 (F2), dan 204 (F3) CpG yang diidentifikasi dengan metilasi terkait folat. Sebanyak 17 CpG unik, semuanya terletak di dalam HOXA4 , tumpang tindih antara dua dari tiga penelitian (F1 dan F3) (Gambar 1 ), yang tidak mungkin terjadi karena kebetulan ( p < 0,001). Ketika berfokus pada tingkat gen, ada 207 (F1), 112 (F2), dan 24 (F3) gen dengan pola metilasi DNA terkait folat yang diidentifikasi. Dari jumlah tersebut, hanya HOXA4 yang tumpang tindih di antara dua penelitian (F1 dan F3), yang kemungkinan terjadi karena kebetulan ( p = 0,21).
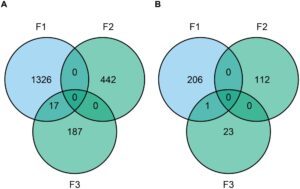
3.2 Metilasi DNA dan Toksisitas Akibat Kemoterapi
Secara total, 3680 (T1) dan 13 756 (T2) CpG dan 2339 (T1) dan 5386 (T2) gen dikaitkan dengan HFS. Ada 53 CpG ( p = 0,97) dan 949 gen ( p < 0,001) yang tumpang tindih antara kedua penelitian. Sebanyak 2876 (T1) dan 5090 (T3) CpG dan 1195 (T1) dan 2393 (T3) gen diamati dikaitkan dengan trombositopenia, yang mana 13 CpG ( p = 1,0) dan 272 gen ( p < 0,001) tumpang tindih. Selain itu, terdapat 205, 88, 7625, 75, 20, dan 18 CpG dan 40, 28, 162, 27, 11, dan 13 gen yang terkait dengan anemia, supresi sumsum tulang, neutropenia, diare, mual, dan muntah, masing-masing (T1). Karena hasil ini hanya dipertimbangkan dalam satu publikasi, tidak ada tumpang tindih yang dapat dihitung.
3.3 Paparan Folat, Toksisitas Akibat Kemoterapi, dan Metilasi DNA
Sebanyak 19 CpG tumpang tindih antara metilasi terkait folat dan HFS terkait metilasi di seluruh perbandingan studi (Tabel 2 dan Informasi Pendukung 4 ), yang semuanya kemungkinan merupakan temuan kebetulan. Satu situs CpG, cg16651126, yang terletak di dalam wilayah promotor HOXA4 , tumpang tindih antara tiga studi (F1, T1, dan T2). Berbeda dengan CpG, ada 118 tumpang tindih untuk 100 gen yang diamati antara metilasi terkait folat dan HFS terkait metilasi di seluruh perbandingan studi (Tabel 2 dan Informasi Pendukung 4 ). 24 tumpang tindih gen yang diamati antara F2 dan T1 tidak mungkin terjadi karena kebetulan ( p = 0,001) (Tabel 2 ); namun, semua tumpang tindih lainnya antara studi kemungkinan merupakan temuan kebetulan. Perlu dicatat, gen HOXA4 tumpang tindih di antara F1, F3, dan T2. Metilasi DNA HOXA4 meningkat dengan kadar folat serum yang lebih tinggi pada F1 (koefisien ß 0,08), sementara pada studi F3 metilasi HOXA4 menurun dengan asupan folat yang lebih tinggi (koefisien ß –0,016). Pada T2, individu dengan HFS dibandingkan dengan mereka yang tidak memiliki HFS, mengalami hipermetilasi HOXA4 . Selain itu, gen HOX lainnya, HOXA5 , tumpang tindih antara F3 dan T2, di mana asupan folat yang lebih tinggi dikaitkan dengan peningkatan metilasi DNA (koefisien ß 0,019) (F3) dan mereka yang memiliki HFS dibandingkan dengan mereka yang tidak memiliki HFS mengalami hipermetilasi HOXA5 (T2).
| Bahasa Indonesia: F1 | F2 | F3 | |||||
|---|---|---|---|---|---|---|---|
| Jumlah tumpang tindih | nilai p a | Jumlah tumpang tindih | nilai p a | Jumlah tumpang tindih | nilai p a | ||
| HFS (T1) | CpG (Komite Aksi Sosial) | 7 | 0,93 | 1 | 0,98 | angka 0 | — |
| Gen | 18 | 0,88 | 24 | 0,001 miliar | 3 | 0,50 | |
| HFS (T2) | CpG (Komite Aksi Sosial) | 5 | 1.00 | 2 | 1.00 | 5 | 0,78 |
| Gen | 33 | 1.00 | 31 | 0.32 | 9 | 0.13 | |
| Trombositopenia (T1) | CpG (Komite Aksi Sosial) | 1 | 1.00 | 8 | 0,011 detik | angka 0 | — |
| Gen | 10 | 0.73 | 8 | 0.30 | 1 | 0,75 | |
| Trombositopenia (T3) | CpG (Komite Aksi Sosial) | 2 | 1.00 | 2 | 0,97 | 1 | 0,91 |
| Gen | 17 | 0,94 | 15 | 0.28 | 4 | 0.28 | |
| Neutropenia (T1) | CpG (Komite Aksi Sosial) | 7 | 1.00 | 8 | 0.53 | angka 0 | — |
| Gen | 1 | 0,80 | 3 | 0,05 | angka 0 | ||
| Anemia (T1) | CpG (Komite Aksi Sosial) | angka 0 | — | angka 0 | — | angka 0 | — |
| Gen | angka 0 | — | angka 0 | — | angka 0 | — | |
| Penekanan sumsum tulang (T1) | CpG (Komite Aksi Sosial) | angka 0 | — | angka 0 | — | angka 0 | — |
| Gen | angka 0 | — | angka 0 | — | angka 0 | — | |
| Diare (T1) | CpG (Komite Aksi Sosial) | angka 0 | — | angka 0 | — | angka 0 | — |
| Gen | 1 | 0.27 | angka 0 | — | angka 0 | — | |
| Mual (T1) | CpG (Komite Aksi Sosial) | angka 0 | — | angka 0 | — | angka 0 | — |
| Gen | angka 0 | — | angka 0 | — | angka 0 | — | |
| Muntah (T1) | CpG (Komite Aksi Sosial) | angka 0 | — | angka 0 | — | angka 0 | — |
| Gen | angka 0 | — | angka 0 | — | angka 0 | — | |
nilai p dihitung menggunakan uji hipergeometrik, nilai p signifikan dicetak tebal( p < 0,05). b PPT2, PRRT1, NR3C1, SDCCAG8, AKT3, CUX1, PHF12, SEZ6, TMC6, SNCA, KIAA0408, MKL1, SH3PXD2A, EPG5, TMEM33, FBXO31, C10orf54, LSP1, NFIX, GFRA2, KDM2B, NFAM1, SEPT9 , dan SPIDR . c cg18082788, cg00073460, cg04275695, cg09678939, cg13136655, cg15132169, cg17501395, dan cg18951352.
Secara total, 14 tumpang tindih untuk 14 CpG diamati antara metilasi terkait folat dan trombositopenia terkait metilasi, yang mana delapan CpG, semuanya terletak dalam ZC3H12D , umum antara F2 dan T1 dan tidak mungkin terjadi karena peluang ( p = 0,011) (Tabel 2 , Informasi Pendukung 5 ). Selain itu, 55 tumpang tindih untuk 50 gen diamati untuk metilasi terkait folat dan trombositopenia terkait metilasi di seluruh perbandingan studi (Tabel 2 , Informasi Pendukung 5 ). Semua tumpang tindih antara studi kemungkinan merupakan temuan peluang.
Lima belas CpG dan empat gen dan umum dalam metilasi terkait folat dan neutropenia terkait metilasi (Tabel 2 , Informasi Pendukung 6 ), yang keduanya kemungkinan besar terjadi karena kebetulan. Sementara metilasi terkait folat dan diare terkait metilasi diamati dalam gen NUP35 , hal itu tidak ditemukan dalam CpG yang tumpang tindih secara spesifik dan juga kemungkinan besar terjadi karena kebetulan. Tidak ada CpG atau gen yang tumpang tindih yang diamati antara anemia terkait folat dan terkait metilasi, supresi sumsum tulang, muntah, dan mual (Tabel 2 ).
3.4 Analisis Jalur GO dan KEGG
Metilasi DNA sebagai respons terhadap folat dikaitkan dengan 20 proses GO dalam satu studi (F1), tetapi tidak ada dalam studi lainnya (F2 dan F3). Profil metilasi yang terkait dengan HFS, trombositopenia, dan neutropenia dikaitkan dengan 822 (T1) dan 989 (T2) (500 secara umum), 743 (T1) dan 445 (T3) (306 secara umum), dan 85 (T3) proses GO, masing-masing. Tidak ada proses yang tumpang tindih antara studi tentang folat dan toksisitas.
Analisis jalur KEGG menyoroti 2 (F1), 13 (F2), dan 0 (F3) jalur untuk metilasi DNA terkait folat (0 pada umumnya) (Tabel 3 dan 4 ). Meskipun berada di luar ambang batas signifikansi yang ditetapkan, “adhesi fokal” jalur KEGG diamati pada F2 ( p = 0,055). Sementara itu, 88 (T1) dan 115 (T2) jalur untuk HFS (57 pada umumnya), 105 (T1) dan 82 (T3) jalur untuk trombositopenia (59 pada umumnya), dan 17 jalur untuk neutropenia (T3) diamati. Tumpang tindih dalam jalur KEGG yang disorot antara HFS (T2), trombositopenia (T1), neutropenia (T1), dan F2 tidak mungkin terjadi karena kebetulan ( p < 0,001) (Tabel 3 ). Secara total, terdapat 37 tumpang tindih dari 13 jalur KEGG yang berbeda yang umum untuk folat dan toksisitas yang berbeda (Tabel 3 dan 4 ). “Adhesi fokal” jalur KEGG umum untuk folat, HFS, trombositopenia, dan neutropenia (Gambar 2 ).
| F1 [2] | F2 sebuah [13] | F3 [0] | ||
|---|---|---|---|---|
| Jumlah tumpang tindih | Jumlah tumpang tindih | nilai p b | Jumlah tumpang tindih | |
| HFS (T1) [88] | angka 0 | 1 | 0,98 | angka 0 |
| HFS (T2) [115] | angka 0 | 12 | <0,001 | angka 0 |
| Trombositopenia (T1) [105] | angka 0 | 12 | <0,001 | angka 0 |
| Trombositopenia (T3) [82] | angka 0 | 6 | 0,05 | angka 0 |
| Neutropenia (T1) [17] | angka 0 | 6 | <0,001 | angka 0 |
a Termasuk jalur KEGG “adhesi fokal.” Nilai p dihitung menggunakan uji hipergeometrik, nilai p signifikan dicetak tebal( p < 0,05).
| ID KEGG | jalur KEGG | nilai p | Gen yang terlibat | Jalur KEGG umum dengan T1-3 |
|---|---|---|---|---|
| Bahasa Indonesia: F1 | ||||
| hsa03010 | Ribosom | 0,008 | RPL4, RPL3, MRPL18, RPL34, MRPS21, RPS27A | — |
| hsa03040 | Spliceosom | 0,023 | SNRNP40, PRPF38A, RBM8A, PRPF3, HNRNPA1, RBM22 | — |
| F2 | ||||
| hsa04550 | Jalur sinyal yang mengatur pluripotensi sel induk | 0,003 | WNT6, WNT10A, ID2, AKT3, WNT9B | Trombositopenia (T1) |
| hsa05225 | Karsinoma hepatoseluler | 0,006 | WNT6, WNT10A, AKT3, WNT9B, ARID1B | HFS (T2), trombositopenia (T1), neutropenia (T1) |
| hsa04916 | Melanogenesis | 0,009 | POMC, WNT6, WNT10A, WNT9B | HFS (T2), trombositopenia (T1 dan T3) |
| hsa05205 | Proteoglikan dalam kanker | 0,011 | WNT6, WNT10A, AKT3, WNT9B, NUDT16L1 | HFS (T2), trombositopenia (T1), neutropenia (T1) |
| hsa05165 | Infeksi human papillomavirus | 0,013 | WNT6, WNT10A, AKT3, LAMA3, WNT9B, COL9A3 | HFS (T2), trombositopenia (T1 dan T3), neutropenia (T1) |
| hsa05010 | Penyakit Alzheimer | 0,023 | DKK4, WNT6, WNT10A, AKT3, WNT9B, SNCA | — |
| hsa05224 | Kanker payudara | 0,025 | WNT6, WNT10A, AKT3, WNT9B | HFS (T2), trombositopenia (T1) |
| hsa05226 | Kanker lambung | 0,025 | WNT6, WNT10A, AKT3, WNT9B | HFS (T2), trombositopenia (T1) |
| hsa04934 | Sindrom Cushing | 0,028 | POMC, WNT6, WNT10A, WNT9B | HFS (T2), trombositopenia (T1 dan T3) |
| hsa04150 | Jalur pensinyalan mTOR | 0,029 | WNT6, WNT10A, AKT3, WNT9B | HFS (T2), trombositopenia (T1), neutropenia (T1) |
| hsa04390 | Jalur sinyal Hippo | 0,029 | WNT6, WNT10A, ID2, WNT9B | HFS (T2), trombositopenia (T1 dan T3) |
| hsa05217 | Karsinoma sel basal | 0,030 | WNT6, WNT10A, WNT9B | HFS (T2) |
| hsa04310 | Jalur pensinyalan Wnt | 0,038 | DKK4, WNT6, WNT10A, WNT9B | HFS (T2), trombositopenia (T1 dan T3), neutropenia (T1) |
| hsa04510 | Adhesi fokal | 0,055 | AKT3, LAMA3, MYL10, COL9A3 | HFS (T1 dan T2), trombositopenia (T1 dan T3), neutropenia (T1) |
4 Diskusi
Dalam studi ini, kami bertujuan untuk mengeksplorasi peran potensial metilasi DNA yang dimediasi folat dalam konteks toksisitas yang diinduksi kemoterapi pada pasien dengan CRC yang menerima terapi berbasis fluoropirimidin menggunakan pendekatan meet-in-the-middle. Sebanyak enam studi disertakan dengan data tentang metilasi DNA terkait folat atau pola metilasi DNA yang terkait dengan toksisitas yang diinduksi kemoterapi. Kami mengamati sejumlah besar gen yang tumpang tindih dengan pola metilasi yang terkait dengan folat dan HFS, dan CpG dengan metilasi yang terkait dengan folat dan trombositopenia. Jalur KEGG “adhesi fokal” disorot sebagai berpotensi relevan, dengan status metilasi yang dikaitkan dengan folat, HFS, trombositopenia, dan neutropenia.
Sejauh pengetahuan kami, ini adalah studi pertama yang mengeksplorasi peran metilasi DNA yang dimediasi folat dalam toksisitas yang diinduksi fluoropirimidin. Namun, ada tumpang tindih yang sangat terbatas dari gen yang termetilasi dan CpG antara tiga studi yang menyelidiki hubungan antara paparan folat dan metilasi DNA. Hanya metilasi gen HOXA4 , dan khususnya situs CpG cg16651126 yang terletak dalam HOXA4 , yang diamati dalam dua dari tiga studi yang disertakan (F1, F3) [ 17 , 19 ]. Tumpang tindih yang terbatas mungkin dijelaskan oleh desain dan populasi studi yang berbeda. Hanya studi Kok et al. (F1) [ 17 ] yang mengukur folat sebagai folat serum; dua studi lainnya (F2, F3) [ 18 , 19 ] mengevaluasi asupan folat dari makanan. Asupan folat tidak selalu terkait kuat dengan status folat yang beredar [ 30 ]. Selain itu, populasi studi itu sendiri bervariasi, dengan Perrier et al. (F3) [ 19 ] hanya mencakup wanita pascamenopause dari Eropa, Kok et al. (F1) [ 17 ] mencakup orang dewasa lanjut usia dari Belanda, dan Mandaviya et al. (F2) [ 18 ] mencakup orang dewasa dari berbagai negara di Eropa dan Amerika Serikat. Metilasi DNA tidak hanya dikaitkan dengan usia [ 31 ], tetapi juga dikaitkan dengan berbagai faktor gaya hidup dan etnis [ 32 – 36 ], yang mungkin memengaruhi temuan, yang berpotensi menjelaskan variabilitas temuan antara penelitian. Oleh karena itu, perbedaan dalam desain penelitian dan populasi ini menyoroti kesenjangan dalam pemahaman kita tentang bagaimana paparan, khususnya asupan dan status folat, memengaruhi epigenom di seluruh populasi, dan menekankan perlunya investigasi lebih mendalam.
Namun demikian, kami mengamati gen dan CpG yang terkait dengan profil metilasi yang terkait dengan folat dan toksisitas tertentu yang diinduksi kemoterapi. Kami terutama mengamati hubungan potensial antara metilasi DNA yang dimediasi folat dan HFS dan trombositopenia. Tumpang tindih pola metilasi toksisitas dengan studi folat hanya diamati pada T1 dan bukan T2 atau T3, mungkin karena populasi studi yang berbeda. Namun, tumpang tindih yang diamati dalam pola metilasi DNA antara folat dan HFS dan trombositopenia, tetapi tidak toksisitas lainnya, mungkin juga menunjukkan bahwa untuk beberapa toksisitas, metilasi terkait folat mungkin berperan sementara untuk yang lain mungkin tidak. Perlu dicatat, dua gen HOX , HOXA4 dan HOXA5 , diidentifikasi dalam metilasi terkait folat dan HFS terkait metilasi. Gen HOX dan metilasi DNA dari gen-gen ini penting dalam proses perkembangan dan telah dikaitkan dengan kesehatan dan penyakit, termasuk cacat tabung saraf (NTD) [ 37 ] yang mana suplementasi asam folat selama awal kehamilan mengurangi risikonya [ 38 ]. Selain itu, ekspresi HOXA4 yang lebih tinggi dikaitkan dengan kelangsungan hidup bebas progresi yang lebih pendek pada 71 pasien dengan kanker ovarium yang menjalani kemoterapi berbasis platinum adjuvan (HR 1,20, 95% CI 1,07–1,34) [ 39 ]. Ekspresi berlebihan HOXA4 disarankan untuk meningkatkan resistensi terhadap beberapa senyawa platinum dan berpotensi mengurangi produksi spesies oksigen reaktif (ROS) dalam model sel kanker ovarium [ 39 ]. Kombinasi kapesitabin dan oksaliplatin, senyawa platinum, diberikan dalam penelitian yang termasuk dalam penelitian ini [ 27 – 29 ], dan oleh karena itu mungkin menjelaskan hubungan yang diamati antara metilasi HOXA4 dan HFS. Secara keseluruhan, peran metilasi dan ekspresi HOXA4 dalam toleransi pengobatan kapesitabin dan oksaliplatin merupakan area untuk penelitian lebih lanjut.
Analisis jalur menunjukkan gen yang terlibat dalam beberapa jalur terkait kanker, seperti “kanker lambung,” “jalur pensinyalan mTOR,” dan “kanker payudara,” memiliki profil metilasi yang terkait dengan folat dan toksisitas. Karena populasi studi dari studi toksisitas (T1-T3) terdiri dari individu yang didiagnosis dengan CRC, dan folat telah dikaitkan dengan kanker dan khususnya CRC sebelumnya [ 40 , 41 ], temuan ini mungkin lebih terkait dengan penyakit itu sendiri dan kurang terkait dengan toksisitas yang dialami. Namun demikian, metilasi gen dalam jalur “adhesi fokal” terkait dengan folat dan beberapa toksisitas, yaitu HFS, trombositopenia, dan neutropenia. Jalur KEGG “adhesi fokal” juga disorot sebelumnya dalam sebuah studi yang berusaha untuk menentukan gen terkait lingkungan mikro tumor yang terkait dengan resistensi 5-FU di antara pasien dengan CRC [ 42 ]. Studi praklinis mengamati bahwa pembungkaman gen focal adhesion kinase ( FAK ) dapat memperkuat sitotoksisitas 5-FU baik secara in vitro maupun in vivo [ 43 , 44 ], penulis menyarankan bahwa pengaruh ini mungkin terjadi melalui penekanan jalur pensinyalan AKT/NF-κB [ 43 , 44 ]. Secara keseluruhan, mengidentifikasi metilasi gen yang terkait dengan folat dalam jalur “focal adhesion” dapat membantu kita memahami mekanisme yang menghubungkan paparan folat dan toksisitas yang disebabkan oleh kemoterapi; namun, berdasarkan bukti saat ini, kita belum dapat memastikan hubungan ini.
Studi ini memiliki beberapa keterbatasan. Pertama, hanya enam studi yang memenuhi kriteria inklusi dan karena itu dapat dimasukkan dalam studi ini. Studi yang menyelidiki metilasi DNA terkait folat berasal dari Eropa dan Amerika Serikat (F1-F3) [ 17 – 19 ], sementara studi yang menyelidiki metilasi DNA dan toksisitas dilakukan di Cina (T1-T3) [ 27 – 29 ]. Hal ini dapat mengakibatkan beberapa gen dan CpG yang tumpang tindih diidentifikasi, karena profil epigenetik terbukti bergantung pada faktor gaya hidup dan etnis [ 32 – 34 ]. Selain itu, semua studi folat mengukur metilasi DNA dalam darah, sementara studi toksisitas mengukur metilasi DNA dalam jaringan ganas, yang mungkin telah memengaruhi pola metilasi [ 45 , 46 ]. Kedua, tidak semua studi memberikan data tentang arah metilasi (hiper- atau hipo-metilasi) per situs CpG dalam kaitannya dengan paparan folat atau dalam konteks toksisitas. Hiper- atau hipo-metilasi umumnya terkait dengan penghambatan atau aktivasi gen, masing-masing [ 15 ], dan dapat memengaruhi bagaimana kita berpikir folat dapat memengaruhi hasilnya. Ketiga, kita perlu menjelaskan hubungan folat-metilasi dan metilasi-toksisitas sebelum kita dapat memiliki wawasan yang lebih baik dalam peran potensial metilasi DNA yang dimediasi folat dalam toksisitas, karena kami mengamati tumpang tindih yang terbatas di seluruh studi yang menyelidiki paparan atau toksisitas folat. Kami terutama mengharapkan lebih banyak tumpang tindih antara studi toksisitas karena populasi studi ini serupa. Namun demikian, sejauh pengetahuan kami, ini adalah studi pertama yang mengeksplorasi peran potensial metilasi DNA yang dimediasi folat dalam konteks toksisitas yang diinduksi kemoterapi. Kami dapat mengamati gen dan CpG umum, seperti HOXA4 , dan jalur yang berpotensi penting, seperti “adhesi fokal,” yang terkait dengan metilasi terkait folat dan toksisitas terkait metilasi. Oleh karena itu, penelitian ini memberikan indikasi pertama bahwa metilasi DNA yang dimediasi folat mungkin berperan dalam toksisitas tertentu yang disebabkan oleh kemoterapi, seperti HFS dan trombositopenia.
Secara keseluruhan, penelitian ini bertujuan untuk mengeksplorasi peran potensial metilasi DNA yang dimediasi folat dalam toksisitas yang disebabkan oleh kemoterapi. Kami mengamati beberapa tumpang tindih antara profil metilasi DNA yang terkait dengan paparan folat dan toksisitas tertentu yang disebabkan oleh kemoterapi, terutama HFS dan trombositopenia, yang menunjukkan bahwa metilasi yang dimediasi folat mungkin penting dalam memahami peran folat dalam toksisitas. Penelitian selanjutnya diperlukan untuk menyelidiki metilasi yang dimediasi folat, untuk akhirnya memberikan bukti kuat tentang peran metilasi yang dimediasi folat dalam toksisitas.

