Abstrak
Secara global, 20%–30% orang menderita Penyakit Hati Berlemak Non-Alkohol (NAFLD). Saat ini, belum ada obat yang disetujui untuk mengobati NAFLD. Penyakit ini sebagian besar tidak bergejala dan ditandai dengan penumpukan lemak di hati tanpa konsumsi alkohol berlebihan. Capsaicin, nutraceutical dengan sifat anti-lipogenik dan anti-inflamasi, merupakan kandidat yang menjanjikan untuk penanganan NAFLD. Namun, bioavailabilitasnya yang buruk dan potensi iritasi gastrointestinal membatasi kegunaan klinisnya. Untuk mengatasi tantangan ini, capsaicin dienkapsulasi dalam sistem penghantaran ganda menggunakan poli(asam laktat-ko-glikolat) dan albumin serum sapi. Sistem ini dikembangkan menggunakan metode nanopresipitasi untuk meningkatkan stabilitas, penargetan hati, dan kemanjuran terapeutik capsaicin. Selain itu, penambahan albumin membantu mengatasi hipoalbuminemia, suatu kondisi yang umum diamati pada kasus NAFLD. Albumin berinteraksi dengan reseptor spesifik hati seperti reseptor asialoglikoprotein dan GP60, yang sebagian besar diekspresikan pada sel hati, meningkatkan spesifisitas nanopartikel berbasis albumin untuk penyerapan hati. Nanopartikel dioptimalkan untuk pemuatan kapsaisin dan diuji dalam model NAFLD yang diinduksi sel HepG2. Nanopartikel kapsaisin secara signifikan mengurangi trigliserida intraseluler, mencapai 89% untuk pengurangan lipid dengan cara yang bergantung pada dosis. Nanoformulasi ganda ini menunjukkan platform untuk pengiriman kapsaisin yang ditargetkan pada hati, mengatasi keterbatasan terapi konvensional dan menawarkan pendekatan terapeutik yang menjanjikan.
1. PENDAHULUAN
Penyakit hati kronis yang paling umum, penyakit hati berlemak non-alkohol (NAFLD), menyerang sekitar 20%–30% orang dewasa dengan angka yang lebih tinggi di negara-negara industri. 1 Penyakit ini merupakan manifestasi hepatik dari sindrom metabolik dan dikaitkan dengan obesitas, hipertensi, dan diabetes tipe 2, jika tidak disertai konsumsi alkohol yang berlebihan. 2 Sementara banyak individu tetap asimtomatik dengan steatosis sederhana, sebagian kecil berkembang menjadi steatohepatitis non-alkohol dan, akhirnya, sirosis, diikuti oleh gagal hati dan perlunya transplantasi hati. 3
Saat ini, hanya ada sedikit pengobatan farmakologis yang diterima untuk NAFLD, seperti pioglitazone dan vitamin E, tetapi pengobatan tersebut dibatasi oleh kemanjuran yang rendah, masalah keamanan, dan respons spesifik pasien. 4 Hal ini menggarisbawahi kebutuhan mendesak akan terapi baru yang menargetkan patogenesis multifaktorial penyakit tersebut. Pendekatan utama untuk penanganannya melibatkan modifikasi gaya hidup, seperti aktivitas fisik dan perubahan pola makan. 5 Terapi farmakologis—seperti obat antilipidemik, antioksidan, agen peningkat sensitivitas insulin, dan agen sitoprotektif—telah dieksplorasi, tetapi secara umum kurang spesifik dan efektif, sehingga menggarisbawahi perlunya strategi pengobatan inovatif dengan kemanjuran yang lebih baik. 6
Komponen makanan bioaktif telah muncul sebagai agen terapeutik potensial untuk berbagai penyakit, termasuk NAFLD. Capsaicin (CAP), senyawa fenolik yang ditemukan dalam cabai, telah menarik perhatian signifikan karena beragam aktivitas farmakologisnya, seperti efek antioksidan, antiinflamasi, antikanker, antidiabetes, dan antiobesitas. 7 Peran capsaicin dalam NAFLD sangat menjanjikan karena kemampuannya untuk memodulasi keseimbangan energi dengan menghambat jalur anabolik dan mengaktifkan jalur katabolik, sehingga mengurangi akumulasi lipid hati. Selain itu, interaksi capsaicin dengan reseptor TRPV1 menyebabkan efek analgesik melalui desensitisasi dan penipisan neuropeptida yang memediasi nyeri, sehingga berguna dalam pengobatan pereda nyeri. 8 Meskipun berpotensi, penerapan capsaicin dalam mengobati NAFLD menghadapi tantangan yang signifikan, terutama karena kelarutannya yang rendah dalam air, yang menyebabkan penyerapan oral yang buruk dan bioavailabilitas yang rendah. Nanocarrier, khususnya nanopartikel polimer seperti yang terbuat dari poli (D, L-lactic-co-glycolic acid) (PLGA), telah menunjukkan hasil yang menjanjikan dalam meningkatkan kelarutan, stabilitas, dan bioavailabilitas obat hidrofobik. 9 PLGA disetujui oleh Badan Pengawas Obat dan Makanan AS (FDA) untuk penggunaan klinis dalam beberapa obat antikanker karena biodegradabilitasnya, sifat pelepasan terkontrol, dan biokompatibilitasnya. Produk degradasinya, asam laktat dan glikolat adalah metabolit alami manusia yang menjadikannya pembawa obat yang aman dan efektif. 10 Albumin disetujui FDA dalam penanganan berbagai penyakit hati dan dapat berfungsi sebagai terapi target karena reseptor spesifik albumin di hati meningkatkan endositosis dan mengatasi hipoalbuminemia yang umum terlihat pada pasien NAFLD. 11 Ikatan reversibel albumin dengan ligan endogen dan eksogen, potensi untuk meningkatkan biodistribusi, bioavailabilitas, dan pengiriman yang ditargetkan membuatnya banyak digunakan untuk pengiriman obat. Formulasi yang dipasarkan seperti Abraxane® (paclitaxel), Levemir® (insulin yang dimodifikasi dengan asam miristat), dan Victoza® (agonis GLP-1 terkonjugasi asam palmitat) menyoroti kemampuan albumin untuk memperpanjang profil aksi obat, meningkatkan kelarutan, dan mengurangi toksisitas. 12 Untuk penargetan spesifik hati, nanopartikel berbasis albumin (NP) telah terbukti efektif dalam mengobati penyakit hati seperti hepatitis virus, karsinoma hepatoseluler (HCC), dan fibrosis hati. Contohnya termasuk turunan yang dimodifikasi galaktosa untuk DOX dan albumin serum sapi galaktosilasi (BSA) untuk oridonin, yang menunjukkan penargetan hati yang ditingkatkan, stabilitas, dan toksisitas sistemik yang berkurang. Fleksibilitas ini mendukung terapi tingkat lanjut, termasuk pelepasan obat yang terkontrol dan efek samping yang berkurang, untuk penyakit hati seperti NAFLD. 13Selain itu, polivinil alkohol (PVA) digunakan untuk meningkatkan kelarutan dan dispersibilitas nanopartikel.
Studi ini terutama berfokus pada pengembangan dan pengoptimalan penyiapan nanopartikel kapsaisin yang mengandung PLGA dan BSA untuk mengobati NAFLD. 14 Tujuannya adalah untuk meningkatkan stabilitas, kelarutan, dan bioaktivitas kapsaisin, yang menyediakan pendekatan baru untuk mengatasi kebutuhan mendesak akan terapi farmakologis yang efektif untuk NAFLD. NP dikarakterisasi dengan pengukuran ukuran partikel dan indeks polidispersitas (PDI), potensi zeta, dan selanjutnya dianalisis dengan menggunakan spektroskopi inframerah transformasi Fourier (FTIR) dan kalorimetri pemindaian diferensial (DSC). Evaluasi in vitro dilakukan untuk menentukan sitotoksisitas in vitro, penyerapan seluler, dan anti-akumulasi lemak pada steatosis yang diinduksi asam oleat (OA) pada sel karsinoma hepatoseluler (HepG2) manusia. 15
2 EKSPERIMENTAL
2.1 Bahan dan garis sel
PLGA dibeli dari MedChem Express Ltd.. 4′,6-diamidino-2-phenylindole (DAPI), Dimethylsulfoxide (DMSO), Triton-X-100, dan dichloromethane (DCM) dibeli dari Sisco Research Laboratory. Capsaicin dibeli dari Central Drug House Pvt Ltd. Acetonitrile (ACN) dibeli dari Thermo Fisher Scientific India Pvt Ltd. Dulbecco’s Modified Eagle’s Medium (DMEM), Fetal bovine serum (FBS), BSA, penicillin-streptomycin antibiotic solution, dan phosphate-buffered saline (PBS) diperoleh dari HiMedia Laboratories Pvt. Ltd. RIPA lysis buffer dibeli dari Thermo Fisher Scientific India Pvt Ltd. Sel karsinoma hepatoseluler (HepG2) diperoleh dari National Center for Cell Science. Sel-sel dikultur dalam DMEM yang ditambah dengan 10% FBS dan 1% larutan antibiotik dalam inkubator humidifikasi yang dijaga pada 5% CO2 dan 37°C.
2.2 Metode persiapan
2.2.1 Metode penguapan pelarut
Metode penguapan pelarut digunakan untuk persiapan nanopartikel polimer, yang melibatkan pembentukan emulsi minyak dalam air (O/W). Dalam metode penguapan pelarut, fase organik disiapkan dengan melarutkan PLGA (1% b/v) dalam 5 mL diklorometana dan aseton (3:2) diikuti oleh sonikasi selama 2 menit untuk meningkatkan kelarutan dan mencegah agregasi polimer. Ini perlahan-lahan ditambahkan ke dalam fase berair, yaitu larutan BSA (seperti yang disebutkan 1) dalam Tabel, langkah ini sangat penting untuk membentuk emulsi yang stabil dan memastikan dispersi yang tepat dan disonikasi selama 4 menit untuk memecah tetesan yang lebih besar dan membentuk emulsi minyak/air (O/W). Untuk mendispersikan emulsi O/W, 15 mL air deionisasi ditambahkan dan diaduk secara magnetis selama 240 menit untuk menghilangkan sisa pelarut. Kemudian disentrifugasi pada 15.000 rpm selama 30 menit untuk memisahkan nanopartikel yang terbentuk dari media di sekitarnya, diikuti dengan pembuangan supernatan. Nanopartikel dikumpulkan dan dicuci empat kali dengan air melalui sentrifugasi pada 10.000 rpm selama 15 menit untuk menghilangkan sisa kotoran, kelebihan BSA, atau residu pelarut dan dikumpulkan kembali untuk evaluasi lebih lanjut. 16
2.2.2 Metode Nanopresipitasi
Metode nanopresipitasi digunakan untuk persiapan nanopartikel polimer, yang melibatkan presipitasi polimer yang terkendali dalam lingkungan berair. PLGA (1% b/v dalam DMSO) untuk memastikan pelarutan polimer yang tepat. BSA (0,05 atau 1% b/v dalam air) bertindak sebagai fase berair. Larutan disiapkan dan disonikasi selama 2 menit untuk meningkatkan pelarutan dan memecah agregat polimer apa pun dalam metode nanopresipitasi. Larutan PVA (0,3 atau 1% b/v dalam air) diaduk selama 15 menit pada suhu 85°C pada 400 rpm untuk mencapai pelarutan lengkap. Larutan PLGA yang disiapkan ditambahkan tetes demi tetes ke larutan BSA sambil diaduk untuk mencegah agregasi dan memastikan keseragaman, diikuti oleh larutan PVA, dan pengadukan dipertahankan selama 4 atau 18 jam. Untuk nanopartikel yang mengandung capsaicin, larutan capsaicin (1, 2, atau 5 mg/mL) ditambahkan tetes demi tetes ke dalam larutan. Larutan akhir disentrifugasi pada 10.000 rpm selama 15 menit untuk memisahkan nanopartikel dari media di sekitarnya, diikuti dengan pencucian nanopartikel tiga kali dengan air deionisasi untuk menghilangkan sisa pelarut organik atau komponen yang tidak bereaksi. Akhirnya, nanopartikel dikeringkan dalam suhu beku dan disimpan pada suhu 4°C untuk karakterisasi dan evaluasi lebih lanjut. 16
Tabel 1 merangkum berbagai metode, pelarut dan konsentrasi polimer yang digunakan untuk persiapan nanopartikel.
| Tidak ada S. | Metode persiapan | Poli(laktat-ko-asam glikolat) (PLGA) (pelarut) | BSA (% b/v) | PVA (%b/v) | Polimer (%b/v) | Waktu pengadukan (jam) |
|---|---|---|---|---|---|---|
| 1 | Penguapan pelarut | Diklorometana (DCM) | 1 | – | 1:2 (PLGA:BSA) | 4 |
| 2 | 1:10 (PLGA:BSA) | |||||
| 3 | 1:1 (PLGA:BSA) | |||||
| 4 | Presipitasi nano | DCM: ASETON (3:2) | 1:1 (PLGA:BSA) | 18 | ||
| Dimetil sulfoksida (DMSO) | – | 1 | 1:1 (PLGA:PVA) | |||
| 5 | ||||||
| 6 | 0,05 | 0.3 | 1:0.5:10 (PLGA:BSA:PVA) | |||
| 7 | 1 | 1:1:0,3 (PLGA:BSA:PVA) |
Catatan : Larutan BSA (Bovine serum albumin) dan PVA (Polivinil alkohol) disiapkan dalam air.
2.2.3 Pelabelan fluoresensi nanopartikel
Nanopartikel diberi label menggunakan pewarna fluoresen, fluorescein isothiocyanate (FITC). Nanopartikel berlabel disiapkan menggunakan metode nanopresipitasi seperti yang dijelaskan di bagian sebelumnya. Larutan FITC (1 mg/mL dalam DMSO) ditambahkan ke nanopartikel ke dalam larutan polimer (untuk nanopartikel kosong) dan larutan polimer-kapsaisin (untuk nanopartikel bermuatan kapsaisin) sambil diaduk, dan diaduk selama 18 jam pada suhu kamar. Larutan akhir disentrifugasi pada 10.000 rpm, nanopartikel dikumpulkan, dan supernatan dibuang. Nanopartikel yang dikumpulkan dicuci tiga kali dengan air dengan cara disentrifugasi pada 10.000 rpm selama 15 menit. Akhirnya, nanopartikel disuspensikan kembali dengan air deionisasi, dikeringkan dalam suhu beku, dan disimpan pada suhu 4°C.
2.3 Karakterisasi nanopartikel
Potensi zeta diukur dengan Nano-ZS Zeta Sizer, Malvern Instruments. Partikel-partikel tersebut didispersikan dalam air deionisasi yang mengandung dispersan komersial dan ditempatkan dalam kuvet polistirena, kemudian dikenai paparan laser pada sudut 90°. 17 Teknik karakterisasi seperti spektroskopi inframerah transformasi Fourier (FTIR) dan DSC digunakan untuk menganalisis PLGA, BSA, PVA, Capsaicin, nanopartikel kosong, dan nanopartikel yang mengandung capsaicin. Spektrum FTIR diperoleh menggunakan spektrometer PerkinElmer Spectrum Two, sedangkan data DSC dikumpulkan dengan kalorimeter Waters Q20 TA. Morfologi permukaan nanopartikel diperiksa menggunakan mikroskop elektron pemindaian (SEM) dengan mikroskop Hitachi SU8010.
2.4 Efisiensi dan hasil enkapsulasi
Efisiensi enkapsulasi (EE) didefinisikan sebagai rasio berat kapsaisin yang dimuat ke dalam nanopartikel terhadap berat total kapsaisin yang ditambahkan ke campuran rakitan. 18 EE untuk nanopartikel diperkirakan dengan melarutkan nanopartikel yang dimuat kapsaisin dalam 2 mL air deionisasi dan sonikasi selama 15 menit untuk melarutkan kapsaisin yang dienkapsulasi. Sampel diaduk selama 3 menit dan kemudian disentrifugasi pada 10.000 rpm selama 10 menit. Konsentrasi kapsaisin diukur dengan spektrofotometer UV pada 230 nm menggunakan persamaan berikut

2.5 Penentuan kinetika pelepasan
Nanopartikel yang dimuat kapsaisin dimasukkan ke dalam kantong dialisis, yang direndam dalam 20 mL PBS dengan nilai pH 6,8 dan 1,8, yang masing-masing mensimulasikan lingkungan usus dan lambung. 19 Sistem dipertahankan pada suhu 37°C dan dikocok perlahan pada kecepatan 100 rpm. Pada interval waktu tertentu—30, 60, 120, 240, 360, 480, 840, 1440, 2880, dan 4320 menit—2 mL larutan PBS di sekitarnya ditarik dan diganti dengan volume media segar yang sama untuk mempertahankan kondisi penyerapan. Jumlah kapsaisin yang dilepaskan diukur dengan mengukur absorbansi UV–Vis pada 230 nm. Data konsentrasi-waktu yang dihasilkan dianalisis menggunakan perangkat lunak DD Solver untuk menilai kinetika pelepasan, dan analisis regresi linier dilakukan untuk mengidentifikasi model kinetik yang sesuai.
2.6 Pengukuran Hematotoksisitas
Untuk mengevaluasi potensi toksisitas nanopartikel terhadap sel darah merah (RBC), uji hemolisis standar dilakukan. Sebanyak 4 mL darah tikus utuh dikumpulkan dan diobati dengan asam etilendiamintetraasetat (EDTA) untuk menghambat pembekuan. RBC diisolasi dengan sentrifugasi pada 1500 rpm selama 8 menit pada suhu 4 °C, diikuti dengan pencucian berulang dengan PBS dingin hingga suspensi sel tampak bening. Untuk pengujian, 20 μL setiap sampel uji (nanopartikel kosong, nanopartikel bermuatan kapsaisin, dan kapsaisin bebas) pada konsentrasi yang berbeda dikombinasikan dengan 180 μL suspensi RBC dan diinkubasi pada suhu 37 °C selama 1 jam dengan pengocokan lembut. 20 Larutan garam normal (0,9% NaCl) berfungsi sebagai kontrol negatif, sedangkan 0,1% v/v Triton X-100 dalam larutan garam digunakan sebagai kontrol positif. Setelah inkubasi, sampel disentrifugasi pada kecepatan 1500 rpm selama 10 menit pada suhu 4°C, dan supernatan dikumpulkan. 20 Pelepasan hemoglobin diukur pada 540 nm menggunakan pembaca pelat ELISA BioRad, dan persentase hemolisis dihitung sebagai berikut:
![]()
2.7 Uji viabilitas sel
Uji MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida) digunakan untuk menilai viabilitas seluler dari formulasi. Sel HepG2 disemai dalam pelat kultur 96 sumur dalam media kultur 180 μL dan diinkubasi selama 24 jam pada suhu 37°C dalam inkubator yang dilembabkan dengan 5% CO2 . Setelah 24 jam, 20 μL berbagai konsentrasi nanopartikel kosong, kapsaisin bebas, dan nanopartikel bermuatan kapsaisin ditambahkan ke masing-masing sumur. Sumur kontrol hanya menerima media kultur tanpa perlakuan. Setelah periode inkubasi 24 jam berikutnya, supernatan di setiap sumur diganti dengan media baru yang mengandung 5 mg/mL reagen MTT. Pelat diinkubasi pada suhu 37°C selama 4 jam tambahan, setelah itu absorbansi setiap sumur direkam pada 595 nm. 20 Absorbansi sumur kosong dan kontrol diasumsikan masing-masing sebesar 0% dan 100% viabilitas, dan kurva kalibrasi digunakan untuk menentukan viabilitas sel di semua sumur.
![]()
2.8 Steatosis hati yang disebabkan oleh asam oleat
Kami menggunakan model in vitro steatosis hati yang diinduksi OA untuk menyelidiki kemanjuran capsaicin terhadap steatosis hati yang merupakan perlemakan hati non-alkohol. Akumulasi asam lemak bebas (FFA) dalam hepatosit menginduksi lipotoksisitas dan karenanya digunakan untuk menginduksi lipotoksisitas yang mengarah ke model klinis tiruan NAFLD. Steatosis hati diinduksi menggunakan berbagai konsentrasi asam oleat dalam HCC. Sel HepG2 disemai ke dalam pelat 12-sumur pada kepadatan sel 10 5 sel/sumur dan dibiarkan menempel semalaman. Sel kemudian diobati dengan berbagai konsentrasi asam Oleat (125 atau 250 μM) selama 24 jam. 21
2.9 Pewarnaan Minyak Merah O
Pewarnaan Oil Red O digunakan untuk mendeteksi akumulasi trigliserida dalam model steatosis hati yang disebabkan oleh asam oleat (OA). Oil Red O adalah pewarna yang larut dalam lemak yang mewarnai lipid netral, lipoprotein, dan ester kolesteril dengan warna oranye-merah yang khas. Sel-sel pertama-tama dibilas dengan PBS dan kemudian difiksasi menggunakan paraformaldehida 4% pada suhu kamar selama 15 menit. Setelah fiksasi, sel-sel dicuci tiga kali dengan PBS untuk menghilangkan sisa fiksatif, diikuti dengan pencucian dengan alkohol isopropil 60%. Kemudian diwarnai dengan larutan kerja Oil Red O yang baru disiapkan selama 30 menit pada suhu kamar. Pewarna berlebih dihilangkan dengan mencuci dua kali dengan isopropanol 60%, diikuti dengan tiga kali pencucian PBS. Pencitraan dilakukan pada perbesaran 20x menggunakan mikroskop terbalik Nikon.
2.10 Estimasi kuantitatif trigliserida
Efek kapsaisin dan nanopartikel bermuatan kapsaisin pada akumulasi lemak setelah induksi OA diukur dengan menggunakan kit uji trigliserida (TGA). Sel HepG2 diinokulasi dalam pelat kultur 24-sumur dan diinkubasi dengan OA (250 μM) selama 24 jam. Setelah induksi, sel diperlakukan dengan kapsaisin 10 μM dan nanopartikel bermuatan kapsaisin. Setelah 24 jam, media dibuang dan sel dicuci tiga kali dengan PBS yang didinginkan terlebih dahulu (pH7,4), dikikis perlahan dengan pengikis sel dan dipindahkan ke tabung Eppendorf dan disentrifugasi pada 2000 rpm selama 3 menit, supernatan dibuang dan pelet sel dilisiskan dengan buffer lisis RIPA, sampel disetrum di atas es selama 10 menit dan kemudian disentrifugasi pada 12.000 rpm selama 15 menit pada suhu 4°C. Supernatan dikumpulkan dan 10 μL masing-masing digunakan untuk kuantifikasi protein. Pengujian dilakukan sesuai dengan petunjuk pabrik. Secara singkat, reagen kerja dicampur dengan 10 μL supernatan air/standar/sampel untuk blanko/standar/sampel dan diinkubasi selama 10 menit pada suhu 37°C dan absorbansi diambil pada 505 nm menggunakan pembaca pelat ELISA. Konsentrasi protein dalam sel diukur dengan pengujian asam bicinchoninic (BCA) menggunakan kit pengujian BCA sesuai dengan petunjuk pabrik. Secara singkat, pengujian bergantung pada kapasitas protein untuk mengubah ion Cu 2+ menjadi ion Cu 1+ dalam media alkali, yang diikuti oleh ion Cu 1+ dan BCA yang membentuk kompleks berwarna ungu. Intensitas warna, yang dapat dideteksi pada 562 nm, berhubungan dengan konsentrasi protein. Reagen kerja BCA (WR) disiapkan dengan mencampur 50 bagian reagen BCA A dengan 1 bagian reagen BCA B (50:1, Reagen A:B), 0,1 mL sampel/standar dicampur dengan 2 mL reagen kerja dan diinkubasi selama 30 menit, diikuti dengan pengukuran absorbansi pada 562 nm. Kurva standar digunakan untuk menentukan konsentrasi protein dari setiap sampel yang tidak diketahui dan konsentrasi TGA ditentukan sebagai % kontrol dan µg per mg protein menggunakan persamaan berikut.
![]()
2.11 Penyerapan seluler
Penyerapan seluler oleh sel HepG2 diperkirakan menggunakan mikroskopi fluoresensi untuk nanopartikel kosong dan yang dimuat capsaicin. Sel-sel disemai pada penutup kaca dalam pelat 6-sumur dan dibiarkan menempel. Sel-sel tersebut kemudian diperlakukan dengan nanopartikel berlabel FITC dan diinkubasi selama 24 jam. Kemudian sel-sel tersebut dicuci dengan PBS dingin, difiksasi dengan paraformaldehida (4%) selama 30 menit. Kemudian, dicuci 3 kali dengan larutan PBS dan diinkubasi dengan DAPI (fluoresensi biru untuk pelabelan nuklir) selama 15 menit. Setelah pewarnaan dengan DAPI, sel-sel tersebut dicuci tiga kali dengan PBS dingin untuk menghilangkan pewarna berlebih dan difiksasi pada slide menggunakan gliserin. Sel-sel tersebut kemudian divisualisasikan menggunakan mikroskop fluoresensi Nikon Ci pada perbesaran 20x.
3 HASIL DAN PEMBAHASAN
3.1 Pemilihan metode dan rasio capsaicin: Polimer
Dua metode, yaitu metode penguapan pelarut dan nanopresipitasi digunakan untuk menyiapkan nanopartikel seperti yang ditunjukkan pada Tabel 2. Ukuran dan distribusi partikel diukur menggunakan Dynamic Light Scattering (DLS) dan berdasarkan ukuran partikel dan PDI, partikel terkecil dengan polidispersitas paling sedikit dipilih. Diameter rata-rata partikel diperkirakan 153,7 nm. Sedangkan, nanopartikel bermuatan capsaicin menggambarkan distribusi yang lebih luas dengan permukaan halus berbentuk bola bersama dengan beberapa partikel yang menggumpal dengan permukaan polihedral dan kasar (Gambar 3 ). Ukuran yang lebih kecil diperoleh dengan metode nanopresipitasi dan, oleh karena itu, metode nanopresipitasi dengan PLGA (1% b/v dalam DMSO), BSA (1% b/v dalam air), larutan PVA (0,3% b/v dalam air), dan waktu pengadukan 18 jam dipilih untuk studi dan evaluasi eksperimental lebih lanjut.
| S. Tidak | Metode persiapan | PLGA (pelarut) | BSA (% b/v) | PVA (%b/v) | Polimer (%b/v) | Waktu pengadukan (jam) | Ukuran partikel | PDI |
|---|---|---|---|---|---|---|---|---|
| 1 | Penguapan pelarut | Diklorometana (DCM) | 1 | – | 1:2 (PLGA:BSA) | 4 | Tahun 1230 ± 267,7 | 0.234 |
| 2 | 1:10 (PLGA:BSA) | 347 ± 60,88 | 0.450 | |||||
| 3 | 1:1 (PLGA:BSA) | 429,7 ± 253 | 0.358 | |||||
| 4 | Nano-presipitasi | Dimetilsulfoksida (DMSO) | 1:1 (PLGA:BSA) | 18 | 609 ± 38,92 | 0.731 | ||
| 5 | – | 0.3 | 1:1 (PLGA:PVA) | 377,8 ± 42,86 | 0.489 | |||
| 6 | 0,05 | 1:0.05:10 (PLGA:BSA:PVA) | 447 ± 66,59 | 0.444 | ||||
| 7 | DCM:Aseton (3:2) | 1 | 1:1:0,3 (PLGA:BSA:PVA) | 147 ± 33,44 | 0,077 tahun |
Catatan : Larutan BSA dan PVA disiapkan dalam air. Singkatan: BSA, bovine serum albumin; PLGA, poli(laktat-ko-asam glikolat); PVA, polivinil alkohol.
Berikutnya, kami menyimpulkan studi optimasi capsaicin. Rasio capsaicin-polimer mempengaruhi ukuran partikel enkapsulasi capsaicin, polidispersitas suatu formulasi. Peningkatan ukuran partikel karena peningkatan jumlah capsaicin diamati. Dalam studi ini, tiga konsentrasi capsaicin (1, 2, dan 5 mg/mL) dievaluasi (Tabel 3 ). Seperti yang diharapkan dengan peningkatan kandungan capsaicin, diamati bahwa dengan pemuatan capsaicin, jumlah capsaicin per mg nanopartikel meningkat tetapi EE menurun karena rasio polimer:capsaicin yang tinggi. Berdasarkan EE, nanopartikel yang dimuat capsaicin 1 dan 5 mg/mL digunakan untuk karakterisasi lebih lanjut.
| Tidak ada S. | Pemuatan kapsaisin (mg/mL) | Efisiensi enkapsulasi (%) | Capsaicin (μg) per mg berat nanopartikel | Ukuran partikel (nm) | PDI |
|---|---|---|---|---|---|
| 1 | 1 | 33.32 | 333.2 | 153 ± 17,57 | 0,147 tahun |
| 2 | 2 | 7.69 | 384.8 | 164,6 ± 13,40 | 0,125 |
| 3 | 5 | 11.9 | 595.1 | 176,4 ± 13,76 | 0,105 |
3.2 Karakterisasi nanopartikel
3.2.1 Sifat Fisik
Ukuran nanopartikel kosong dan nanopartikel bermuatan capsaicin, diukur menggunakan DLS, masing-masing adalah 153,7 dan 167,7 nm (Gambar 1 ). PDI yang sesuai adalah masing-masing 0,147 dan 0,107. Nilai PDI yang lebih rendah dari 0,147 dengan puncak tunggal menunjukkan distribusi ukuran yang seragam dengan polidispersitas rendah. Untuk pengiriman obat yang efisien, dispersi tunggal dengan PDI rendah sangat penting karena nilai PDI yang lebih tinggi atau mendekati 0,5 telah dilaporkan menyebabkan aglomerasi in vivo yang bersekongkol untuk meningkatkan ukuran partikel dan, dengan demikian berdampak negatif pada pembubaran obat dan dengan demikian penyerapannya. Persentase hasil adalah 61% dan 53% untuk nanopartikel kosong dan nanopartikel bermuatan obat, masing-masing. Kelarutan capsaicin dalam air yang buruk dapat menyebabkan difusinya ke dalam fase air selama nanopresipitasi, yang mengakibatkan hilangnya obat selama langkah pencucian. Selain itu, sifat hidrofilik BSA dan hidrofobisitas PLGA dapat mengakibatkan kompatibilitas terbatas, sehingga berpotensi mengorbankan stabilitas dan pemulihan nanopartikel.
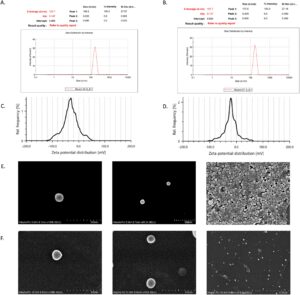
Potensial zeta untuk nanopartikel kosong dan nanopartikel bermuatan capsaicin tercatat masing-masing sebesar -33,6 dan -21,7 mV (Gambar 1 ). Pergeseran potensial pada muatan capsaicin disebabkan oleh netralisasi atau pelindungan gugus fungsi bermuatan negatif. Muatan negatif menunjukkan bahwa nanopartikel saling tolak karena muatan negatifnya, mencegah agregasi dan mempertahankan dispersi koloid yang stabil. Nilai absolut potensial zeta yang lebih besar, baik positif maupun negatif, menunjukkan peningkatan stabilitas formulasi. Nanopartikel bermuatan capsaicin yang menunjukkan potensi zeta di atas +20 mV atau di bawah -20 mV dianggap memiliki stabilitas koloid yang kuat, terutama karena gaya tolak elektrostatik.
Permukaan nanopartikel kosong dan nanopartikel bermuatan kapsaisin memiliki morfologi bulat dengan permukaan seragam seperti yang terlihat pada Gambar 1. Ukuran rata-rata partikel diamati sebesar 176,3 dan 153,3 nm untuk nanopartikel kosong dan bermuatan kapsaisin, yang sesuai dengan data DLS.
3.2.2 Analisis FTIR
Spektrum Spektroskopi FTIR dari nanopartikel bermuatan capsaicin, capsaicin, dan nanopartikel kosong bersama dengan PLGA, PVA, dan BSA, direkam untuk menentukan gugus fungsi yang ada dan mengonfirmasi pembentukan nanohibrida dengan membandingkan spektrumnya. Pada Gambar 2. Spektrum PLGA menunjukkan puncak yang kuat pada 1094 cm −1 untuk peregangan C–O–C, serta puncak pada 1758 cm −1 untuk peregangan C=O. Pada PVA, pita diamati pada 3780, 2917, 2858, 1690 dan 1425 cm −1 . Puncak-puncak ini ditetapkan untuk vibrasi peregangan O–H dari gugus hidroksi, vibrasi peregangan asimetris CH, peregangan karbonil C=O, vibrasi tekukan C–H dari CH 2 , vibrasi deformasi C–H, peregangan C–O dari gugus asetil dan vibrasi peregangan C–C. Dalam kasus BSA, puncak diamati pada 1400 untuk pita amida yang terkait dengan peregangan C–N dan getaran tekukan N–H. Selain itu, ia menunjukkan puncak pada 2850-2950 cm −1 , yang menunjukkan peregangan CH 2 dan CH 3 yang mewakili gugus alifatik CH 2 dan CH 3 dalam struktur protein dan peregangan O–H dan N–H pada (32,0–3500 cm −1 ) yang merupakan puncak lebar karena ikatan hidrogen dalam gugus hidroksil dan amina. Kapsaisin menunjukkan pita serapan menonjol pada 3435, 2932, 2351, 1637, 1538, 14.437, 1026, dan 812 cm −1 . Struktur kapsaisin memiliki cincin aromatik, gugus polar, dan gugus hidrofobik. Pita pada sekitar 3400 cm −1 kemungkinan disebabkan oleh gugus OH capsaicin atau oleh molekul air yang tersisa. Pita yang berpusat pada 27,0–3000 cm −1 menunjukkan gugus karbonil C=O dan gugus amida digambarkan antara 1600 dan 1750 cm −1 . Selain itu, keberadaan vibrasi regangan alifatik (C–H) dalam kisaran 29,6–2866 cm −1 dan dua vibrasi diamati karena keberadaan vibrasi regangan asimetris dalam (C–O–C) pada kisaran (12,8–1247 cm −1 ). Nanopartikel yang dimuat capsaicin menunjukkan puncak nanopartikel kosong dan capsaicin sehingga mengonfirmasi keberhasilan penjebakan capsaicin dalam nanopartikel.

3.2.3 DSC
Grafik DSC dari formulasi tersebut dibandingkan dengan nanopartikel kosong, capsaicin murni, dan campuran fisik seperti yang ditunjukkan pada Gambar 3. PLGA menunjukkan transisi endotermik sekitar 60°C, yang berhubungan dengan peristiwa relaksasi setelah transisi kaca, tanpa titik leleh yang jelas yang diamati, yang mengonfirmasi sifat amorfnya. Puncak eksotermik pada sekitar 370, 400, dan 500°C dikaitkan dengan degradasi termal polimer. Proses dekomposisi, yang ditandai dengan respons endotermik, dimulai sekitar 320°C. Analisis termal PLGA murni menunjukkan stabilitas hingga 250°C. Bahan tersebut mengalami dua tahap utama kehilangan berat karena kerusakan termal—96,60% pada 390°C dan 3,18% pada 470°C. PVA menunjukkan puncak eksotermik dari 224 hingga 298,22°C yang disebabkan oleh kristalisasi. Termogram BSA menunjukkan puncak endotermik pada 91°C, yang mewakili suhu denaturasi protein.
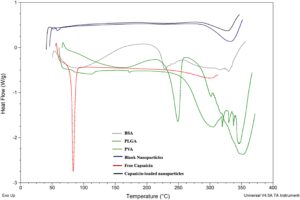
Capsaicin menunjukkan puncak leleh antara 63 dan 70°C, berpusat pada sekitar 67°C, seperti yang diamati pada Gambar 3. Capsaicin menunjukkan puncak endotermik yang tajam pada 63°C ± 0,05 dengan entalpi yang dibutuhkan sebesar 0,9 ± 1,2. Tidak adanya puncak karakteristik capsaicin dalam formulasi tersebut menegaskan enkapsulasi capsaicin dalam nanopartikel dan pembentukan lapisan polimer yang stabil.
3.2.4 Pelepasan obat secara in vitro
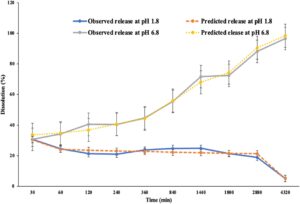
Dua kondisi pH dipilih. pH 6,8 sebagai pH intestinal untuk meniru pemberian oral dan pH 1,8 untuk meniru lingkungan gastrointestinal yang asam. Diamati (Gambar 4 ) bahwa pelepasan capsaicin secara bergantung waktu pada pH 6,8, pelepasan kumulatif mencapai 94% untuk 1 mg/mL nanopartikel bermuatan capsaicin dan 47% untuk 5 mg/mL nanopartikel bermuatan capsaicin. Sebaliknya, pada pH 1,8, pelepasannya lebih rendah, dengan 30% untuk 1 mg/mL nanopartikel bermuatan capsaicin dan 42% untuk 5 mg/mL nanopartikel bermuatan capsaicin. Pelepasan capsaicin yang lebih tinggi pada pH 6,8 dibandingkan dengan pH 1,8 sangat menguntungkan untuk terapi NAFLD, karena selaras dengan lingkungan fisiologis hati dan usus tempat penyerapan dan aksi obat diinginkan. Pada pH 6,8, hidrolisis polimer PLGA yang ditingkatkan memfasilitasi degradasi yang lebih cepat dan pelepasan obat yang berkelanjutan, sementara kelarutan capsaicin yang ditingkatkan dalam kondisi netral mendorong difusi yang efektif. Sebaliknya, pelepasan minimal pada pH asam (1,8) membantu mencegah pelepasan obat prematur di lambung, mengurangi potensi iritasi. Perilaku responsif pH ini memastikan pengiriman yang ditargetkan dan tindakan terapeutik capsaicin yang dioptimalkan di tempat perkembangan NAFLD. 22 Penurunan kecil dan tiba-tiba diikuti oleh peningkatan diamati pada 24 jam dalam nanopartikel bermuatan capsaicin 5 mg, yang dapat disebabkan oleh saturasi dalam larutan. Jumlah capsaicin yang dilepaskan sebanding dalam nanopartikel bermuatan 1 dan 5 mg yang ditunjukkan pada Gambar 4 .

3.2.5 Pemodelan kinetik
Berbagai model dievaluasi, dan model yang paling sesuai dipilih dengan R 2 (kuadrat koefisien regresi, R ) seperti yang ditunjukkan pada Tabel 4. Nilai kuadrat R menunjukkan pelepasan mengikuti Higuchi dengan Tlag pada pH 6,8 dan Weibull 4 pada pH 1,8, seperti yang ditunjukkan pada Gambar 5 .
| Tidak ada S. | Perintah rilis | Persamaan | pHnya 6,8 | pHnya 1,8 |
|---|---|---|---|---|
| 1. | Orde nol | F = K0 * t = t | -0,3130 | -23.5540 |
| 2. | Orde nol dengan Tlag | F = K0 * ( t − Tlag) | 0,9685 tahun | 0.1238 |
| 3. | Orde nol dengan F 0 | F = F0 + K0 * t | 0,9685 tahun | 0.1238 |
| 4. | Orde pertama | F = 100 * [1 − Eksp(− K 1 * t )] | 0.4821 | -23.352 |
| 5. | Pesanan pertama dengan Tlag | F = 100 * {1 − Exp[− K 1 * (1 − Tlag)]} | 0,0506 tahun | 0.1235 |
| 6. | Pesanan pertama dengan Fmax | F = F maks * [1 − Eksp(− K 1 * t )] | 0,5571 tahun | 0.0000 |
| Nomor telepon 7. | Pesanan pertama dengan Tlag dan Fmax | F = F maks * {1 − Eksp[− K 1 * (1 − Tlag)]} | 0,9896 tahun | 0.1234 |
| 8. | Higuchi | F = kH * t ^0,5 | 0.7148 | 14.6079 |
| Nomor 9. | Higuchi dengan Tlag | F = kH * ( t – Tlag)^0,5 | 0.9943 | 0.2445 |
| 10. | Higuchi dengan F 0 | F = F0 + kH * t ^0,5 | 0,9874 tahun | 0.2331 |
| 11. | Korsmeyer–Peppas | F = kKP * t ^ n | 0.9521 | 0.2534 |
| 12. | Korsmeyer–Peppas dengan Tlag | F = K k p * ( t − Tlag)^ n | 0.9924 | 0.4542 |
| 13. | Korsmeyer– Peppas dengan F 0 | F = F0 + Kkp * t ^ n | 0,9936 tahun | 0.4552 |
| 14. | Kuadrat | F = 100 x ( k1 * t ^2 + k2 * t ) | 0.2370 | -24.3884 |
| 15. | Kuadrat dengan Tlag | F = k 1( t − Tlag)^0,5 + k 2 * ( t − Tlag) | 0,9880 | 0.3305 |
| 16. | Weibull 1 | F = 100 * {1 − Exp[(( t − Ti)^ β )/ α ]} | 0.9692 | 0.6646 |
| 17. | Weibull 2 | F = 100 * {1 − Exp[−( t ^ β )/ α ]} | 0.8695 | 0.3958 |
| 18. | Weibull 3 | F = F maks * {1 − Exp[−( t ^ β )/ α ] | 0.9512 | 0.3978 |
| 19. | Weibull 4 | F = F maks * {1 − Exp[−(( t − Ti^ β )/ α )]} | 0.9830 | 0.6709 |

adalah versi modifikasi dari model Higuchi, yang menggambarkan kinetika pelepasan obat dari sistem matriks padat.
Model Higuchi membahas bagaimana jumlah obat yang dilepaskan dari waktu ke waktu mengikuti hubungan akar kuadrat waktu. Dalam persamaan ini, F menunjukkan fraksi obat yang terlarut pada waktu t , α adalah parameter skala yang menentukan skala waktu proses pelarutan, dan Ti menunjukkan waktu tunda sebelum pelarutan dimulai. Parameter β adalah faktor bentuk yang mencirikan bentuk kurva: bersifat eksponensial ketika β = 1, sigmoid (berbentuk S) dengan kurva ke atas diikuti oleh titik balik ketika β > 1, dan parabola ketika β < 1. Nilai β adalah −0,028, yang menunjukkan pelepasan parabola.
Model pada pH 6,8 ini menunjukkan pola pelepasan yang berkelanjutan dan dapat diprediksi di lingkungan usus, meningkatkan penyerapan dan memperpanjang tindakan terapeutik, sementara waktu jeda mencegah pelepasan dini. Model Weibull, yang dicirikan oleh parameter skala ( α ) dan bentuk ( β ), menunjukkan kurva pelepasan parabola pada pH 1,8, yang menunjukkan pelepasan terbatas dalam kondisi lambung yang asam. Hal ini membatasi pelepasan capsaicin di lambung, mengurangi risiko iritasi lambung dan meningkatkan pengiriman spesifik lokasi.
3.3 Studi berbasis sel
3.3.1 Uji hemolitik
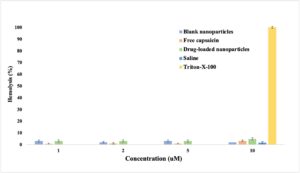
Senyawa dengan % hemolisis kurang dari 10 dianggap non-hemolitik, sedangkan senyawa dengan % hemolisis lebih dari 25 dianggap beracun. 20 Pada konsentrasi tertinggi (10 μM capsaicin dan konsentrasi setara nanopartikel kosong dan bermuatan capsaicin), % hemolisis masing-masing adalah 2% dan 4,88% untuk nanopartikel kosong dan bermuatan capsaicin (Gambar 6 ). 23 Saline (larutan natrium klorida 0,9%) digunakan sebagai kontrol negatif, yang menghasilkan hemolisis minimal, diukur sebesar 1,6%. Sebaliknya, kontrol positif terdiri dari 0,1% v/v Triton X-100 yang dilarutkan dalam saline, yang menyebabkan hemolisis lengkap, yang sesuai dengan 100%. Karena studi hemolisis tidak menunjukkan aktivitas hemolitik yang signifikan bahkan pada konsentrasi tinggi (10 μM) untuk semua sampel, dapat disimpulkan bahwa NP bersifat non-hemolitik. 24
3.3.2 Uji viabilitas sel
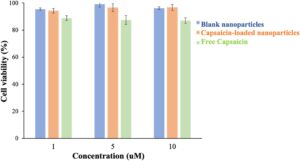
Viabilitas sel dievaluasi menggunakan uji MTT. Konsentrasi nanopartikel dan capsaicin yang berbeda dievaluasi untuk viabilitas selnya terhadap lini sel HepG2 (Gambar 7 ). Konsentrasi nanopartikel yang berbeda (capsaicin ekuivalen 1, 2, 5, 10 μM) digunakan untuk penelitian ini. Persentase viabilitas sel >80% dianggap tidak beracun. Bahkan pada konsentrasi tertinggi, viabilitas sel >80% untuk nanopartikel kosong, capsaicin, dan nanopartikel bermuatan capsaicin (Gambar 7 ), yang menunjukkan tidak ada sitotoksisitas yang signifikan terhadap sel HepG2.
3.3.3 Penyerapan seluler
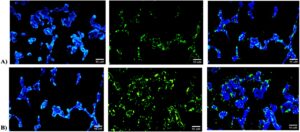
Studi penyerapan seluler dilakukan dengan menggunakan nanopartikel berlabel FITC dan gambar diambil menggunakan mikroskop fluoresensi. Untuk pencitraan, inti sel (biru) diwarnai dengan DAPI. Gambar fluoresensi (Gambar 8 ) mengonfirmasi internalisasi nanopartikel berlabel FITC dalam garis sel HepG2. Penyerapan dapat terjadi melalui ukuran nanopartikel yang kecil dan ekspresi reseptor spesifik albumin dalam sel HepG2, seperti glikoprotein 60 (gp60) dan Secreted Protein Acidic and Rich in Cysteine, yang memfasilitasi pengikatan dan penyerapan nanopartikel terkonjugasi BSA. 25 Gambar menunjukkan bahwa nanosistem kosong yang dikembangkan dapat digunakan sebagai kendaraan untuk pengiriman obat yang ditargetkan ke hati, terutama untuk senyawa yang sulit larut dalam air seperti capsaicin.
3.3.4 Model steatosis hati yang diinduksi asam oleat
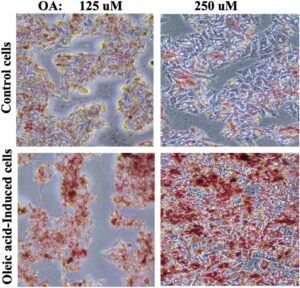
Kami menginkubasi sel Hepg2 dengan asam oleat (OA) (125 dan 250 μM) selama 24 jam untuk membangun model NAFLD in vitro, di mana hasil akumulasi lemak intraseluler diuji dengan pewarnaan Oil Red O. OA, asam lemak jenuh, adalah FFA utama dalam tubuh manusia dan telah banyak digunakan untuk menginduksi steatosis in vitro. Gambar 9 menunjukkan bahwa OA menyebabkan peningkatan akumulasi lipid yang bergantung pada konsentrasi sebagaimana tercermin dari keberadaan dan intensitas warna merah yang diwarnai dengan Oil Red O dengan pewarnaan merah yang lebih tinggi pada konsentrasi OA 26 sebesar 250 μM, sehingga digunakan untuk mengevaluasi aktivitas kapsaisin. 27
3.3.5 Efek capsaicin dan nanopartikel bermuatan capsaicin terhadap steatosis hati yang diinduksi asam oleat
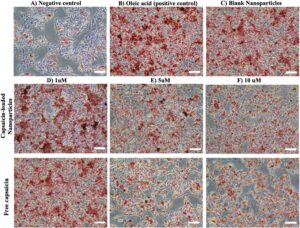
Steatosis pada sel HepG2 diinduksi dengan OA (250 μM) dan kemudian diobati dengan berbagai konsentrasi capsaicin (1, 5, dan 10 μM) dan konsentrasi ekivalen nanopartikel bermuatan capsaicin selama 24 jam. Nanopartikel kosong (pada konsentrasi ekivalen 10 μM) tidak menunjukkan efek yang terlihat pada kadar lipid, seperti yang digambarkan pada Gambar 10. Namun, dalam kasus capsaicin dan nanopartikel bermuatan capsaicin, terlihat penurunan kadar lipid intraseluler yang bergantung pada dosis dibandingkan dengan kelompok kontrol. Oleh karena itu, dapat dinyatakan bahwa capsaicin dapat berperan dalam pencegahan dan pengobatan awal NAFLD.
3.3.6 Estimasi kuantitatif trigliserida
Tingkat asam trigliserida (TGA) yang dihasilkan menunjukkan tingkat lipid intraseluler mengungkapkan bahwa capsaicin secara signifikan melemahkan akumulasi lipid yang diinduksi asam oleat seperti yang ditunjukkan pada Gambar 11. Peningkatan signifikan sebesar 113% ( p < 0,001) dalam kandungan TG pada sel yang diinduksi asam oleat dibandingkan dengan sel kontrol menunjukkan bahwa model akumulasi lipid HepG2 berhasil dibuat. Dibandingkan dengan sel kontrol, capsaicin bebas dan konsentrasi setara nanopartikel bermuatan capsaicin pada 10 μM secara efektif mengurangi kandungan TG masing-masing sebesar 90% dan 89% ( p < 0,01). Hasilnya serupa pada capsaicin dan nanopartikel bermuatan capsaicin yang menunjukkan kemanjuran formulasi yang dikembangkan dibandingkan dengan capsaicin bebas. Capsaicin bebas sangat mengiritasi bahkan pada dosis rendah 28 sementara enkapsulasi meminimalkan efek ini dan meningkatkan penargetan hati, membuat formulasi lebih aman dan lebih sesuai untuk terapi NAFLD. Enkapsulasi dalam nanopartikel PLGA-albumin meminimalkan paparan jaringan langsung, meningkatkan penargetan hati, dan meningkatkan keamanan terapeutik, membuatnya lebih sesuai untuk aplikasi klinis pada NAFLD. Ada empat fase NAFLD, dengan steatosis sederhana dianggap sebagai tahap awal. Ciri khas NAFLD adalah penumpukan lipid berlebih di hepatosit, yang tidak terkait dengan asupan alkohol. Dengan demikian, temuan tersebut dengan jelas menunjukkan bahwa capsaicin berpotensi menghentikan NAFLD pada tahap awal.

4 KESIMPULAN
Penelitian ini bertujuan untuk mengembangkan nanoformulasi yang mengandung capsaicin nutraceutical untuk meringankan NAFLD. Penggunaan terapeutik capsaicin terbatas karena bioavailabilitasnya yang rendah, penyerapan yang buruk, dan potensi menyebabkan iritasi kulit dan mata. Untuk mengatasi masalah ini, sistem nanopartikel PLGA (poli (asam laktat-ko-glikolat)) yang mengandung capsaicin dengan albumin dikembangkan untuk meningkatkan potensi terapeutik capsaicin sekaligus memberikan albumin untuk mengatasi hipoalbuminemia yang umum terjadi pada pasien NAFLD yang sebagian besar disebabkan oleh perubahan fungsi hati. PLGA, polimer yang dikenal dan disetujui FDA, digunakan untuk melapisi capsaicin guna mencegah degradasi metabolik, mengurangi interaksi dengan komponen darah, dan memberikan pelepasan yang lambat dan berkelanjutan dengan aktivitas yang ditingkatkan. Pengembangan nanoformulasi juga memfasilitasi pengiriman yang ditargetkan ke hati karena ukuran dan reseptor albumin yang sesuai di hati. Nanopartikel disintesis menggunakan berbagai metode, dengan sintesis yang berhasil dicapai melalui metode nanopresipitasi. Rasio polimer divariasikan dan dievaluasi untuk sifat fisikokimianya. Ukuran hidrodinamik nanopartikel kosong dan nanopartikel bermuatan capsaicin masing-masing adalah 153,7 dan 167,7 nm. SEM menunjukkan permukaan nanopartikel yang bulat dan seragam. Pengukuran potensi zeta menunjukkan stabilitas koloid yang baik, dengan nilai -33,6 mV untuk nanopartikel kosong dan -21,7 mV untuk nanopartikel bermuatan obat, yang menunjukkan pencegahan agregasi partikel yang efektif melalui tolakan elektrostatik. Analisis kualitatif menggunakan Spektroskopi FTIR dan DSC mengonfirmasi enkapsulasi capsaicin yang efektif dan pembentukan nano-hibrida. EE adalah 33% dengan pelepasan capsaicin mengikuti kinetika Higuchi pada pH 6,8 dan kinetika Weibull pada pH 1,8. Pelepasan yang lebih tinggi pada pH netral (94% dalam 72 jam) dibandingkan dengan pH asam (30% dalam 72 jam), diikuti oleh pelepasan berkelanjutan yang lambat diamati. Profil pelepasan yang responsif terhadap pH, dengan pelepasan capsaicin yang lebih tinggi pada pH 6,8 dan pelepasan yang lebih rendah pada pH 1,8, mendukung pengiriman yang ditargetkan ke hati. Hal ini meminimalkan iritasi lambung dan meningkatkan kemanjuran terapeutik untuk pengobatan NAFLD. Formulasi tersebut bersifat non-hemolitik dan tidak menunjukkan sitotoksisitas terhadap lini sel HepG2.
Dalam model NAFLD in vitro, sel HepG2 yang diobati dengan asam oleat menunjukkan peningkatan akumulasi lipid, khususnya dengan asam oleat. Pengobatan selanjutnya dengan kapsaisin dan nanopartikel yang mengandung kapsaisin menghasilkan pengurangan trigliserida intraseluler yang bergantung pada dosis. Kapsaisin secara signifikan menurunkan akumulasi lipid hingga 90% sebagai senyawa bebas dan 89% dalam bentuk nanopartikel, yang menunjukkan potensinya untuk menghentikan NAFLD tahap awal. Pencitraan fluoresensi menunjukkan bahwa nanopartikel berlabel FITC diinternalisasi oleh sel HepG2, yang menunjukkan potensi sistem nanopartikel kosong sebagai pembawa pengiriman obat yang efektif untuk obat yang sulit larut dalam air seperti kapsaisin. Secara keseluruhan, sistem pengiriman obat yang dikembangkan menunjukkan karakteristik yang sesuai dan, dengan evaluasi lebih lanjut dalam model NAFLD in vivo, dapat terbukti menjadi alat yang menjanjikan untuk mengobati NAFLD.

