
ABSTRAK
Ham Jinhua adalah produk kering tradisional yang lebih menyukai mikroflora asli, yang penting untuk karakteristik sensorik. Namun, fermentasi spontan dapat menghasilkan racun seperti amina biogenik. Studi ini mengevaluasi dampak kultur starter campuran yang mengandung Lactiplantibacillus plantarum, Lactilactobacillus sakei, dan Staphylococcus xylosus ( LLS ) pada keanekaragaman mikroba, akumulasi amina biogenik, rasa volatil, kualitas, dan atribut sensorik ham kering Jinhua. Profil mikroba mengungkapkan bahwa dalam kultur starter LLS , spesies Lactobacillaceae dan Staphylococcaceae mendominasi, dengan kelimpahan relatif berkisar antara 15,2% hingga 42,3% dan 3,5% hingga 35,6% selama proses fermentasi. Daging ham yang diperkaya LLS menunjukkan pengurangan yang nyata dalam amina biogenik seperti histamin, putresin, tiramin, dan kadaverin, disertai dengan penurunan pH, aktivitas air ( a w ), dan total nitrogen basa volatil ( p < 0,05) dibandingkan dengan kontrol. Dengan menggunakan mikroekstraksi fase padat yang digabungkan dengan kromatografi gas–spektrometri massa, 56 senyawa rasa volatil dideteksi dalam daging ham Jinhua. Daging ham yang diolah dengan LLS menunjukkan peningkatan 11 spesies volatil dibandingkan dengan kontrol, meningkatkan keberadaan volatil yang diinginkan termasuk 2,6-dimetilpirazina, 2-etil-1-heksanol, dan 1-okten-3-ol. Temuan ini menunjukkan bahwa kultur starter LLS dapat berfungsi sebagai agen yang efektif dalam produksi daging ham kering Jinhua untuk mengurangi pembentukan BA sambil meningkatkan sifat sensoris.
1 Pendahuluan
Ham Jinhua, makanan lezat tradisional yang diawetkan kering yang berasal dari wilayah Jinhua di provinsi Zhejiang, dibandingkan dengan ham kering lainnya, yang diproduksi dari kaki belakang jenis Liangtouwu, yang terkenal karena mikrobiota yang beragam dan rasa yang khas (Huan et al. 2005 ; Du dan Ahn 2001 ). Ham ini mengalami periode fermentasi alami yang panjang, yaitu 8–10 bulan (Miao et al. 2009 ), mirip dengan ham kering Eropa (Jiang et al. 2022 ). Sementara fermentasi oleh mikroflora asli meningkatkan rasa dan kandungan nutrisi, hal itu juga menyebabkan produksi zat-zat yang berpotensi berbahaya, seperti amina biogenik (BA) (Liu et al. 2018 ). BA, senyawa bioaktif yang mengandung nitrogen, berbobot molekul rendah, dan tidak mudah menguap, banyak terdapat dalam makanan yang difermentasi, terutama daging (Nie et al. 2014 ). Meskipun BA berperan dalam mengatur aktivitas saraf dan mendorong pertumbuhan dan metabolisme sel, asupan berlebihan di luar kapasitas degradasi tubuh—terutama histamin, putresin, tiramin, dan kadaverin—dapat merusak sistem saraf dan menyebabkan kram perut serta gangguan pernapasan. Strategi terkini untuk penghambatan BA pada ham kering meliputi modifikasi proses produksi, penyesuaian metode sterilisasi, dan penambahan agen antibakteri; namun, hal ini dapat merusak kualitas dan rasa ham (Mohammed 2016 ; Komprda et al. 2007 ). Oleh karena itu, pengembangan kultur starter yang aman, efektif, dan memiliki efek samping minimal merupakan bidang penelitian penting dalam produksi ham kering.
Ham Jinhua tradisional, biasanya difermentasi secara spontan dengan mikroflora asli, sering mengalami kontaminasi oleh mikroba yang tidak diinginkan, yang menyebabkan ketidakkonsistenan dengan standar keamanan dan kualitas produk. Di sebagian besar negara, bakteri asam laktat (BAL) dianggap sebagai kultur starter alami dan aman untuk produk daging yang difermentasi (Wang et al. 2015 ; Woraprayote et al. 2016 ); namun, sebagian besar penelitian difokuskan pada sosis, dan kultur starter ham yang diawetkan kering jarang, terutama untuk ham Jinhua. Telah dibuktikan bahwa strain yang diisolasi dari mikroorganisme asli dalam makanan yang difermentasi dapat mengurangi akumulasi BA. Lima puluh strain Staphylococcus xylosus ( S. xylosus ) dengan aktivitas amina oksidase dari sosis Italia, enam strain di antaranya mampu mengurangi kadar histamin hingga 90% (Martuscelli et al. 2010 ). Lacticaseibacillus casei , sebagai ko-fermenter kompetitif, secara signifikan mengendalikan BA selama pematangan keju (Herrero-Fresno et al. 2012 ). Selain itu, kultur starter daging fermentasi yang cocok dapat mengandung strain majemuk; selain strain BA yang dapat terurai secara hayati, sangat bagus untuk dieksplorasi guna memperpanjang stabilitas dan masa simpan (Komprda et al. 2007 ). Staphylococcus , digunakan sebagai kultur starter untuk makanan yang difermentasi dan diawetkan secara hayati dalam pembuatan makanan terutama meningkatkan rasa dan menjaga stabilitas. Lactiplantibacillus plantarum NJAU-01 telah terbukti secara signifikan meningkatkan warna dan tekstur pada ham (Ge et al. 2019 ). Inokulasi Lactiplantibacillus plantarum MSZ2 dan S. xylosus YCC3 menghambat bakteri berbahaya dalam sosis fermentasi dan meningkatkan periode penyimpanan (Wang, Aziz, et al. 2022 ; Wang, Hou, et al. 2022 ). Selain itu, kehadiran (Talon dan Zagorec 2017 ) Lactiplantibacillus plantarum R2 dan S. xylosus A2 diyakini meningkatkan kualitas sensoris produk daging fermentasi dengan memfasilitasi hidrolisis protein dan dekomposisi lemak (Xiao et al. 2020 ).
Galur kultur starter memainkan peran penting dalam pembentukan rasa ham kering. Kualitas dan rasa ham bergantung pada mikroorganisme dan enzim endogen. Flora mikroba selama fermentasi ham yang diubah oleh kondisi bahan baku dan lingkungan secara langsung memengaruhi rasa dan nilai gizi (Wang, Li, et al. 2021 ; Wang, Shen, et al. 2021 ). Penelitian kultur starter menunjukkan bahwa Lactiplantibacillus plantarum , Lactilactobacillus sakei , dan Weissella hellenica ( W. hellenica ) adalah galur dominan dalam daging fermentasi yang terkait dengan produksi ester, aldehida, dan keton (Hu et al. 2020 ). Telah terbukti bahwa kultur starter campuran Lactiplantibacillus plantarum YR07, Lactilactobacillus sakei L.48, S. xylosus S.14, dan Mammaliicoccus sciuri S.18 efisien dalam meningkatkan senyawa rasa khas seperti 3-hidroksi-2-butanon, heksanal, dan 1-okten-3-ol dalam sosis fermentasi (Zheng et al. 2024 ). Penelitian kami sebelumnya menunjukkan bahwa S. xylosus M06 yang disaring dari mikroorganisme asli ham Jinhua dapat secara efektif mengurangi BA; namun, strain ini difermentasi secara terpisah dalam ham Jiahua disertai dengan masa simpan yang pendek dan rasa yang tidak diinginkan. Lactiplantibacillus plantarum ZJ316 di lab kami telah diidentifikasi karena produksinya Plantaricin, yang menunjukkan efek antimikroba yang signifikan terhadap bakteri Gram positif dan Gram negatif, yang secara signifikan meningkatkan kualitas daging babi. Lactilactobacillus sakei Z18 yang dikulturkan dari sosis fermentasi dapat meningkatkan rasa dan tekstur daging (Chen et al. 2018 ; Suo et al. 2012 ). Berdasarkan penelitian sebelumnya, tujuan dari penelitian ini adalah untuk menyelidiki kultur starter campuran yang inovatif, mengeksplorasi efek sinergis dari strain, menilai penerapannya pada profil bakteri, BA, rasa volatil, dan kualitas ham, serta menyediakan starter komersial yang potensial untuk ham kering Jinhua.
2 Bahan dan Metode
2.1 Kultur Starter dan Bahan Kimia
Lactiplantibacillus plantarum ZJ316, yang berasal dari sampel tinja bayi baru lahir yang sehat, bersama dengan S. xylosus M06, yang diisolasi dari ham Jinhua, dan Lactilactobacillus sakei Z18 yang bersumber dari daging fermentasi Tiongkok—diperoleh dari Laboratorium Utama Teknologi Mikroba Pangan Provinsi Zhejiang, Tiongkok. Kultur starter LLS , yang terdiri dari ketiga galur ini dalam rasio yang sama (m/m) 1:1:1, dikultur hingga kepadatan 109 CFU /g dan disiapkan sebagai bubuk kering beku. Kultur starter komersial S015, yang terdiri dari Debaryomyces hansenii dan Staphylococcus xylosus yang digunakan untuk daging fermentasi, diperoleh dari Pusat Penelitian Teknologi Pemrosesan Daging dan Rekayasa Kualitas Provinsi Zhejiang, Tiongkok. Histamin, putresin, tiramin, kadaverin, dan senyawa internal dan standar untuk identifikasi volatil dibeli dari Sigma Aldrich (Sigma, AS).
2.2 Persiapan dan Pengambilan Sampel Ham Jinhua
Tiga kelompok ham Jinhua disiapkan: (1) kelompok kontrol tanpa kultur starter (kontrol); (2) ham yang diinokulasi dengan kultur starter LLS ( LLS ); (3) ham yang diinokulasi dengan kultur starter komersial S015 (S015). Ham diproduksi menggunakan teknik modern di Jinhua Ham Corporation, Zhejiang, Tiongkok. Kaki belakang segar seberat 6,0–7,0 kg dari Lanxi (provinsi Zhejiang), diperoleh dari persilangan Liangtouwu berusia 4 hingga 6 bulan seberat 80–90 kg, digunakan. Ham segar ditumpuk dan diasinkan pada kelembaban relatif 75%–85% dan 2°C–8°C selama 28 hari; natrium klorida ditambahkan dalam tiga tahap untuk mencapai total 5,5% berat. Setelah proses pengeringan, ham dicuci dalam air bersuhu 15°C selama 24 jam, kemudian diinokulasi dengan berbagai kultur starter dan dipindahkan ke ruang fermentasi selama 60 hari, dengan menjaga kondisi fermentasi pada suhu 20°C–25°C dan kelembapan 70%–75%. Setelah fermentasi, sampel dimatangkan selama 7 hari. Pengambilan sampel 100 g ham untuk analisis BA, sifat fisikokimia, LAB, dan jumlah bakteri dilakukan pada hari ke-0, 10, 20, 30, 40, 50, dan 60, sebanyak tiga kali. Analisis mikrobiologi dilakukan pada hari ke-10 dan 60.
2.3 Analisis Mikrobiologi
Komposisi mikroba ham Jinhua dikarakterisasi menggunakan teknik sekuensing berthroughput tinggi yang canggih. Total DNA dari sampel ham, baik kontrol maupun yang diberi perlakuan LLS , pada hari ke-10 dan ke-60, diekstraksi menggunakan EZNA Mag-Bind Soil DNA Kit (OMEGA, AS). Elektroforesis gel agarosa digunakan untuk menilai jumlah dan integritas DNA. Setelah wilayah V4 gen 16S rRNA bakteri diukur, primer berikut digunakan untuk mengamplifikasinya: 515F (5′-GTGCCAGCMGCCGCGGTAA-3′) dan 805R (5′-GGACTACHVGGGTWTCTAAT-3′). Pemurnian dengan Beckman DNA Clean Beads dan pengukuran dengan fluorimeter Qubit 2.0 (Invitrogen, Carlsbad, CA, AS) adalah langkah selanjutnya setelah produk PCR divalidasi pada gel agarosa 1% (Invitrogen, Carlsbad, CA, AS) (Qiu et al. 2018 ). Mengikuti metode konvensional, produk yang dimurnikan ini diurutkan pada sistem Illumina HiSeq 2500 (Illumina, San Diego, CA, AS). Unit taksonomi operasi (OTU) dibentuk dengan mengelompokkan urutan yang menampilkan tingkat kesamaan 97% atau lebih. Total OTU dinormalisasi dengan membandingkannya dengan sampel yang memiliki urutan paling sedikit. Analisis Koordinat Utama (PCoA) digunakan untuk mengevaluasi perbedaan dalam komunitas mikroba, dan indeks keragaman alfa QIIME (Versi 1.7.0) digunakan untuk mengukur keragaman dalam sampel. Perangkat lunak R (Versi 2.15.3) digunakan untuk memeriksa keragaman beta dan variasi antarkelompok (Bokulich dan Spiller 2016 ). Jumlah LAB dan total bakteri dinilai dengan metode hitungan lempeng standar.
2.4 Penentuan BA
Kuantifikasi BA diadaptasi dari Sun et al. ( 2016 ) dan dilakukan menggunakan kromatografi cair kinerja tinggi (HPLC). Larutan amina standar diproduksi dalam asam perklorat 0,4 M, dengan konsentrasi berkisar dari 0,0 hingga 20,0 mg/mL. Dua puluh mililiter asam perklorat 0,4 M digunakan untuk menghomogenkan sampel ham Jinhua seberat 10 g, yang kemudian disentrifugasi pada 8000× g selama 10 menit pada suhu 4°C. Setelah tiga siklus ekstraksi, supernatan gabungan disesuaikan hingga volume total 50 mL. 1 mL ekstrak ini, 100 μL natrium hidroksida 1,5 M, 2 mL dansil klorida 10 mg/mL (pelarut aseton), dan 250 μL natrium bikarbonat jenuh yang menyusun sampel analitis dibiarkan untuk diinkubasi pada suhu 50°C selama 20 menit tanpa cahaya. Setelah masa inkubasi, 100 μL amonium hidroksida (1,0 mol/L) dimasukkan, dan 5 mL asetonitril digunakan untuk meningkatkan volume. Selanjutnya, campuran disaring melalui membran 0,22 μm. Dengan suhu dipertahankan pada 40°C dan laju alir 1,0 mL/menit, analisis kromatografi dilakukan menggunakan kolom ZORBAX Extend-C18 (250 × 4,6 mm, 5 μm) pada 254 nm. Program elusi gradien dimulai dengan 60:40 (v/v) asetonitril: air pada laju alir 1,0 mL/menit, diikuti oleh peningkatan linier menjadi 85:15 (v/v) asetonitril: air (1,0 mL/menit) selama 3 menit berikutnya, dan kemudian peningkatan linier menjadi 100% asetonitril (1,0 mL/menit) selama 10 menit, dan rasio asetonitril: air diturunkan menjadi 60:40 (1,0 mL/menit) selama 10 menit terakhir.
2,5 pH, a w , dan Nilai Total Volatile Bases Nitrogen (TVB-N)
Tingkat pH dinilai menggunakan pH meter elektronik (Mettler Toledo FE28), sedangkan aktivitas air ( a w ) dievaluasi menggunakan meter AquaLab 4TE (AS). Konsentrasi TVB-N diukur dengan distilasi semi-mikro. Sampel ham seberat 10 g dihomogenkan dengan air steril selama 20 menit; campuran disaring untuk mengumpulkan ekstrak, yang ditambahkan 10 g/L magnesium oksida, lalu didistilasi dengan uap. Komponen alkali yang mudah menguap diserap oleh penerima borat dan diukur dengan titrasi.
2.6 Analisis Sifat Warna dan Tekstur
Sifat warna daging ham dianalisis menggunakan colorimeter Spectro-pen (HunterLab MiniScan 45/0 LAV, AS), yang mengukur CIE L * (kecerahan), a * (kemerahan), dan b * (kekuningan). Analisis Profil Tekstur (TPA) dilakukan menggunakan penganalisis tekstur (TMS-Pro, FTC, AS). Sampel daging ham dipotong menjadi kubus berukuran 1 cm3 dan dianalisis kekerasan dan kekenyalannya menggunakan probe silinder berdiameter 35 mm (p/50).
2.7 Penentuan Rasa Volatil
Dengan menggunakan kromatografi gas–spektrometri massa (SPME-GC–MS), kami dapat menganalisis ham Jinhua yang difermentasi untuk mengetahui komponen rasa yang mudah menguap. Standar internal 20 ng deuterobenzena ditambahkan ke dalam botol tertutup 20 mL yang berisi 3 g ham giling. Serat SPME DVB/CAR/PDMS 50/30 μm digunakan untuk mengekstrak zat yang mudah menguap. Setelah 50 menit dalam penangas air 65°C, serat diekspos ke dalam botol sampel selama 40 menit. Setelah itu, serat mengalami periode desorpsi selama 5 menit dalam injektor GC pada suhu 250°C. Kolom TG-624SilMS, berukuran 60 m × 250 μm × 1,4 μm, digunakan untuk pemisahan kromatografi. Helium digunakan sebagai gas pembawa, dan laju aliran ditetapkan pada 1,0 mL/menit. Jumlah bahan kimia yang mudah menguap ditentukan dengan membandingkan daerah puncaknya dengan standar internal (Atallah 2021 ).
2.8 Evaluasi Sensorik
Sampel ham dipotong menjadi irisan setebal 2 mm untuk analisis sensorik. Deskripsi sensorik, termasuk penampilan, rasa, kekerasan, tekstur, warna, bau, dan penampilan keseluruhan, dinilai menggunakan versi metode yang dimodifikasi dengan beberapa modifikasi (Cavalheiro et al. 2019 ). Sebelum analisis, sampel ham dari ham normal dan ham busuk diiris tipis dan ditempatkan pada suhu kamar tidak lebih dari 10 menit sebelum disajikan. Dua puluh penilai dilatih untuk memungkinkan peserta pelatihan memahami prosedur pengujian. Sampel ham diberi kode numerik dan disajikan kepada 20 penilai secara acak. Penerimaan dinilai pada skala enam poin dari 0 hingga 10 oleh penilai. Nilai 0 sesuai dengan yang terendah dan nilai 10 untuk yang tertinggi untuk enam faktor sensorik. Uji sensorik dilakukan di laboratorium sensorik yang dilengkapi dengan kompartemen terpisah.
2.9 Analisis Statistik
Analisis statistik dilakukan menggunakan GraphPad Prism versi 10.1. Perbedaan antar kelompok dievaluasi menggunakan ANOVA satu arah, dengan hasil disajikan sebagai rata-rata ± simpangan baku (SD), dan signifikansi ditentukan pada p < 0,05.
3 Hasil dan Pembahasan
3.1 Pengaruh Kultur Starter terhadap Keanekaragaman Bakteri
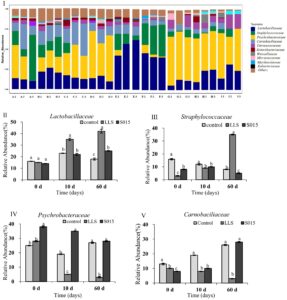
Kelimpahan relatif bakteri dalam empat sampel ham dianalisis menggunakan sequencing throughput tinggi. Sampel meliputi Hari 0, 10, dan 60 dalam kelompok kontrol, LLS, dan S015. Anotasi pada tingkat famili mengungkapkan total 10.825 sekuens gen dengan genera yang dapat diidentifikasi (Gambar 1 ). Pada kelompok kontrol, Psychrobacteraceae (31,8%) dan Carnobaciliaceae (24,6%) dominan, sedangkan Lactobacillaceae (43,5%) dan Staphylococcaceae (26,8%) mendominasi dalam kultur starter LLS dan S015. Ham yang diawetkan kering yang mengalami fermentasi spontan rentan terhadap bakteri patogen, yang dapat menyebabkan oksidasi lemak, perkembangan bau, dekomposisi, dan produksi BA. Perbedaan dalam keragaman mikroba diamati antara perlakuan. Psychrobacteraceae dan Carnobaciliaceae , yang dikenal sebagai bakteri pembusuk, menghasilkan metabolit yang mengubah warna dan viskositas daging. Lactobacillaceae , di sisi lain, dapat menghasilkan zat bakteriostatik selama fermentasi, membantu mengatur keseimbangan mikroba. Hasil ini menguatkan temuan oleh Wang, Li, et al. ( 2021 ) dan Wang, Shen, et al. ( 2021 ) bahwa Staphylococcus dan Lactobacillaceae mendominasi komunitas mikroba ham yang diawetkan kering, dengan Staphylococcus menunjukkan kelimpahan relatif yang jauh lebih tinggi pada ham Jinhua dibandingkan dengan ham Rugao dan Xuanwei. Dalam penelitian ini, S015 menunjukkan kelimpahan relatif Psychrobacteraceae yang tinggi selama fermentasi; untuk Carnobaciliaceae , kelimpahan relatif mencapai yang tertinggi pada tahap selanjutnya. Pada kelompok kontrol, kelimpahan relatif Staphylococcus menurun, sedangkan kelimpahan Carnobaciliaceae meningkat seiring waktu fermentasi. Namun, dalam kelompok kultur starter LLS , kelimpahan relatif Lactobacillus dan Staphylococcus berkisar antara 15,2% hingga 42,3% dan 3,5% hingga 35,6%. Hasil ini menunjukkan bahwa kultur starter LAB dapat meningkatkan keamanan dan memperbaiki kualitas sanitasi produk dalam industri. Lactiplantibacillus plantarum ZJ316 dalam kultur starter LLS telah diidentifikasi memiliki kemampuan memproduksi bakteriosin. Lactilactobacillus dan Staphylococcus dapat menghambat pertumbuhan patogen dan bakteri pembusuk melalui pengasaman atau produksi agen antibakteri (Chen et al. 2018 ).
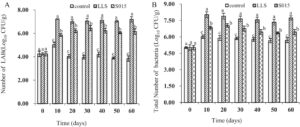
LAB dan jumlah total bakteri dalam kelompok ham yang berbeda ditunjukkan pada Gambar 2. Dengan perpanjangan waktu fermentasi, total koloni bakteri dari kelompok menunjukkan tren naik. Setelah 10 hari, jumlahnya mulai berkurang; jumlah total bakteri dalam LLS dan S015 secara signifikan lebih tinggi daripada dalam kelompok kontrol. Dalam proses fermentasi, LAB dalam kultur starter adalah kelompok bakteri dominan, menunjukkan jumlah yang secara signifikan lebih tinggi daripada kelompok kontrol. Kelompok LLS menunjukkan nilai tertinggi pada Hari ke-10 dan kelompok S015 pada Hari ke-30. Dibandingkan dengan kelompok S015, jumlah LAB kelompok LLS meningkat secara signifikan dalam waktu fermentasi ( p < 0,05).
3.2 Pengaruh Kultur Starter terhadap Pembentukan BA
Dampak dari berbagai kultur starter dan fermentasi spontan pada akumulasi BA digambarkan dalam Gambar 3. Triptamin, histamin, feniletilamin, tiramin, kadaverin, putresin, spermin, dan spermidina adalah beberapa BA umum yang ditemukan dalam makanan. Yang paling umum dalam daging adalah histamin, putresin, tiramin, dan kadaverin. Keempat BA ini terdeteksi selama proses fermentasi pada kelompok kontrol dan kultur starter. Kandungan kadaverin paling tinggi, diikuti oleh tiramin, putresin, dan histamin pada kelompok kontrol. Seiring bertambahnya waktu fermentasi, kandungan semua BA meningkat, kecuali histamin. Kadar histamin tertinggi pada kelompok kontrol mencapai 24,8 mg/kg pada hari ke-40, sedangkan kelompok kultur starter LLS mempertahankan kadar di bawah 5 mg/kg pada hari ke-60. Dalam penelitian ini, kadar amina biogenik—khususnya histamin, putresin, dan kadaverin—pada kelompok LLS dan S015 secara substansial lebih rendah daripada pada kelompok kontrol ( p < 0,05). Konsentrasi tiramin tidak menunjukkan perbedaan signifikan antara kelompok kontrol dan kelompok S015 ( p > 0,05). Pada tahap fermentasi selanjutnya, kandungan histamin pada kelompok kontrol menunjukkan tren penurunan, sedangkan pH meningkat signifikan (Gambar 4A ). Histamin merupakan produk dekarboksilasi di bawah aksi histidin dekarboksilase, yang dikaitkan dengan pH, mikroorganisme, dan asam amino bebas. Perubahan pH dapat mengatur mikrobiota dan memengaruhi kandungan histamin (Komprda et al. 2007 ). Hasil ini menunjukkan bahwa inokulasi dengan kultur starter secara signifikan mengurangi pembentukan sebagian besar BA dibandingkan dengan fermentasi alami. Kultur starter LLS menunjukkan penghambatan akumulasi BA yang lebih kuat daripada S015.
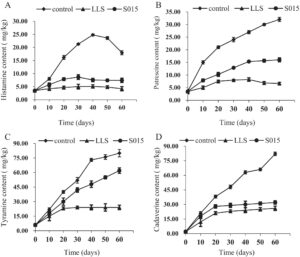
Selama fermentasi daging, protease yang disekresikan oleh mikroorganisme memecah protein menjadi asam amino, yang kemudian didekarboksilasi untuk membentuk BA. Laporan terbaru menunjukkan bahwa kultur starter campuran dapat secara efektif menghambat pertumbuhan bakteri penghasil amina cepat dalam produk fermentasi, sehingga mengurangi pembentukan BA. Lima puluh strain S. xylosus dengan aktivitas amina oksidase diisolasi dari sosis Italia, enam di antaranya dapat mengurangi kandungan histamin hingga 100% (Martuscelli et al. 2010 ). L. casei IFI-CA 52 secara signifikan mengurangi histamin dan humutin dalam anggur sambil menghambat produksi hidrogen sulfida dan mengurangi rasa pedas sulfur dioksida (García-Ruiz et al. 2011 ). Dalam penelitian ini, dinamika mikroba dalam kultur starter LLS meningkatkan kelimpahan relatif LAB dan mengurangi keberadaan organisme pembusuk, sehingga berpotensi mengurangi akumulasi BA selama fermentasi.
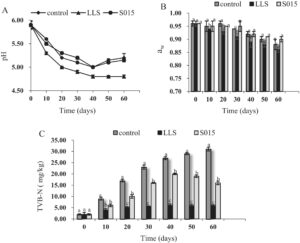
3.3 Pengaruh Kultur Starter terhadap pH, a w , dan TVB-N
Nilai pH, a w , dan TVB-N untuk kultur starter digambarkan dalam Gambar 4 . Awalnya, pH adalah 5,90 di seluruh sampel kontrol, LLS , dan S015. Selanjutnya, kadar pH di semua kelompok menunjukkan penurunan cepat, mencapai titik nadirnya pada Hari ke-40. Pada akhir periode fermentasi, kadar pH tercatat pada 5,20 untuk kontrol, 4,80 untuk LLS , dan 5,15 untuk S015. Tren penurunan dalam a w diamati di setiap kelompok, dengan LLS mencatat nilai terendah 0,86 pada akhir fermentasi.
Selama fermentasi daging, produksi asam oleh mikroorganisme mengurangi pH dan kapasitas menahan air dari protein. Lingkungan pengasaman (pH < 5,0) mencegah perkembangbiakan mikroorganisme pembusuk dan memperpanjang masa simpan produk daging. Nilai pH optimal dan aw rendah meningkatkan rasa dan warna serta memperpanjang masa simpan produk. Lactobacilli menjadi strain yang dominan, menghasilkan kemampuan asam yang lebih tinggi untuk nilai pH dan aw yang lebih rendah setelah inokulasi dengan LAB, yang dapat meningkatkan kualitas daging fermentasi.
Degradasi protein dan kesegaran dalam daging dinilai menggunakan nilai TVB-N. Nilai TVB-N dalam semua kelompok ham meningkat seiring dengan kemajuan fermentasi, dengan kelompok kontrol meningkat paling cepat, diikuti oleh kelompok S015 dan LLS . Temuan ini sejalan dengan penelitian sebelumnya yang menunjukkan bahwa kultur starter LAB membantu mengurangi TVB-N (Xiao et al. 2018 ).
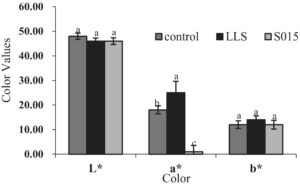
3.4 Pengaruh Kultur Starter terhadap Warna dan Tekstur
Kolorimetri ham ditentukan oleh tiga indikator: L *, a *, dan b *. Nilai L *, yang menunjukkan kecerahan, dikaitkan dengan kadar air sosis; nilai a *, yang menunjukkan kemerahan, mencerminkan rona kemerahan sampel; dan nilai b *, yang mewakili kekuningan, meningkat dengan oksidasi lemak dan denaturasi protein. Perbedaan nilai kolorimetri di antara ketiga kelompok diilustrasikan dalam Gambar 5. Nilai L * dalam kelompok kultur starter lebih rendah daripada yang ada pada kontrol, yang menunjukkan bahwa kultur starter kompleks mempercepat proses fermentasi, yang mengarah pada kehilangan air yang lebih cepat dan mengurangi kecerahan ham (Chen et al. 2022 ). Nilai a * dari kelompok LLS secara signifikan lebih tinggi ( p <0,05) daripada kelompok kontrol dan S015, yang menunjukkan bahwa LAB memfasilitasi konversi nitrat menjadi nitrit, yang bergabung dengan mioglobin untuk membentuk mioglobin oksida nitrat, meningkatkan warna merah ham. Tidak ditemukan perbedaan signifikan pada nilai b * antar kelompok ( p > 0,05).
Sifat tekstur produk ham pada akhir fermentasi disajikan dalam Tabel 1. Relatif terhadap kontrol, baik kelompok LLS maupun S015 menunjukkan kekerasan dan kekenyalan yang berkurang secara signifikan. Sebaliknya, kekenyalan pada kelompok LLS melampaui yang diamati pada kelompok kontrol dan S015. Hasil ini sejalan dengan yang dilaporkan oleh Ren et al. 2002. Protease yang diproduksi LAB mendenaturasi protein dalam daging, meningkatkan kekencangan. Saat fermentasi berlangsung, otot dalam ham terdegradasi, melonggarkan jaringan dan meningkatkan elastisitas otot (Wang, Aziz, et al. 2022 ; Wang, Hou, et al. 2022 ).
| Kekerasan (N/mm) | Tingkat kekenyalan (N/mm·s) | Kelenturan (N/mm) | |
|---|---|---|---|
| Kontrol | 12,23 ± 1,23 per menit | 50,54 ± 1,89 per menit | 5,67 ± 0,14 satuan |
| LLS | 9,65 ± 0,34 miliar | 45,98 ± 2,09 miliar | 7,86 ± 0,21 miliar |
| S015 | 9,87 ± 0,26 miliar | 45,02 ± 1,34 miliar | 6,34 ± 0,37 detik |
Catatan: Data menunjukkan mean ± SD ( n = 10); nilai mean dengan huruf yang berbeda menunjukkan perbedaan yang signifikan ( p < 0,05).
3.5 Pengaruh Kultur Starter terhadap Zat Volatil
Metode Relative Odor Activity Value (ROAV) digunakan untuk mengidentifikasi zat-zat utama yang memodifikasi keseluruhan rasa, dengan hasil yang disajikan dalam Tabel 2. Perbedaan dicatat dalam jenis senyawa rasa utama di antara kelompok-kelompok, dengan kelompok LLS menunjukkan keragaman tertinggi: 5 asam, 14 aldehida, 9 alkohol, 7 keton, 5 ester, 3 pirazina, 5 alkena, dan 5 lainnya. Ini diikuti oleh kelompok S015 dan kontrol. Dibandingkan dengan kontrol, kultur starter menunjukkan peningkatan 11 senyawa volatil. Degradasi protein, lemak, dan karbohidrat melalui aksi mikroorganisme memainkan peran penting dalam produksi asam lemak bebas dan asam amino yang berpartisipasi dalam senyawa volatil yang bertanggung jawab untuk rasa. Pengayaan profil rasa ham Jinhua ini terjadi dari keragaman mikroba yang tinggi yang ada dalam kultur starter LLS .
| TIDAK. | Senyawa mudah menguap | ROAV | ||
|---|---|---|---|---|
| Kontrol (μg/kg) | LLS (μg/kg) | S015 (μg/kg) | ||
| Asam | ||||
| 1 | Asam asetat | 1,21 ± 0,66 per menit | 2,87 ± 0,12 miliar | 4,48 ± 0,52 detik |
| 2 | Asam dodecenoat | 2,08 ± 0,02 satuan | 6,88 ± 0,07 miliar | 8,25 ± 0,02 detik |
| 3 | Asam undecylenic | 1,67 ± 0,56 per menit | 1,76 ± 0,32 per menit | 1,63 ± 0,39 per menit |
| 4 | Asam pelargonik | 0,42 ± 0,01 satu | 0,48 ± 0,56 per menit | 0,67 ± 0,56 miliar |
| 5 | Asam 2-Metilkaproat | 0,15 ± 0,12 satu | 0,14 ± 0,43 satuan | 0,10 ± 0,09 satu |
| Alkohol | ||||
| 6 | Etanol | 0,02 ± 0,17 satu | 0,10 ± 0,01 b | 0,21 ± 0,02 detik |
| 7 | 3-Metilbutanol | 0,45 ± 0,02 satuan | 2,19 ± 0,09 detik | 1,87 ± 0,02 miliar |
| 8 | 3-Metil-1-butanol | 0,05 ± 0,02 satu | 4,19 ± 0,13 detik | 2,76 ± 0,21 miliar |
| 9 | 1-Heksanol | 0,05 ± 0,02 satu | 0,03 ± 0,11 satu | 0,05 ± 0,23 satu |
| 10 | 1-Heptanol | 1,19 ± 0,12 per menit | 1,12 ± 0,23 satuan | 0,34 ± 0,09 miliar |
| 11 | 1-Okten-3-alkohol | 12,17 ± 0,62 satuan | 36,17 ± 1,22 miliar | 15,23 ± 1,23 detik |
| 12 | 2-Etil-1-heksanol | 0,96 ± 0,11 satu | 3,92 ± 0,17 miliar | 0,67 ± 0,03 satuan |
| 13 | 1-Oktanol | 0,07 ± 0,05 satu | 0,07 ± 0,65 satuan | 0,08 ± 0,17 satu |
| 14 | 2-Heksil-1-oktanol | 0,24 ± 0,11 satu | 0,26 ± 0,09 satuan | 0,25 ± 0,17 satu |
| Aldehida | ||||
| 15 | Bahasa Inggris Enanthalia | 0,76 ± 0,15 detik | 0,65 ± 0,35 b | 0,46 ± 0,06 satu |
| 16 | Nonil aldehida | 0,10 ± 0,15 per menit | 0,12 ± 0,13 satu | 0,09 ± 0,23 satuan |
| 17 | Kaprilaldehid | 0,06 ± 0,01 b | 0,06 ± 0,00 b | 0,04 ± 0,07 satu |
| 18 | Dapric aldehida | 0,07 ± 0,11 satu | 0,34 ± 0,11 miliar | 0,28 ± 0,06 detik |
| 19 | Kaproaldehida | 2,87 ± 0,12 miliar | 1,06 ± 0,09 satuan | 2,81 ± 0,34 miliar |
| 20 | 2-Metil-propanal | 0,34 ± 0,14 per menit | 1,67 ± 0,08 detik | 1,23 ± 0,09 miliar |
| 21 | 2-Metil-butiraldehida | 9,25 ± 0,56 satuan | 7,76 ± 0,47 miliar | 7,25 ± 1,28 miliar |
| 22 | 3-Metil-butiraldehida | 1,09 ± 0,12 per menit | 1,11 ± 0,13 per menit | 1,09 ± 0,45 per menit |
| 23 | Metil tiopropionaldehida | 0,13 ± 0,09 satuan | 1,67 ± 0,08 miliar | 1,62 ± 0,35 miliar |
| 24 | 2-Okten-2-aldehida | 0,20 ± 0,14 satuan | 0,15 ± 0,09 satu | 0,22 ± 0,06 satuan |
| 25 | Benzaldehida | 0,34 ± 1,04 per menit | 0,67 ± 2,02 miliar | 0,89 ± 0,08 per menit |
| 26 | Bahasa Indonesia: Nonanal | 0,26 ± 0,11 satu | 0,09 ± 0,07 satu | 0,12 ± 0,09 satuan |
| 27 | Lauraldehida | 1,22 ± 0,02 satuan | 4,98 ± 0,11 miliar | 4,25 ± 1,02 miliar |
| 28 | 13-Metiltetradekral | 1,65 ± 0,15 miliar | 1,34 ± 0,17 per menit | 1,26 ± 0,11 satuan |
| Keton | ||||
| 29 | 2, 3-Butanedion | 0,22 ± 0,02 detik | 3,78 ± 0,16 per menit | 1,09 ± 0,02 miliar |
| 30 | 3-Hidroksidibutanon | ND sebuah | ND sebuah | 5,76 ± 0,12 miliar |
| 31 | 1-Hidroksi-2-diaseton | 0,20 ± 0,08 satuan | 0,16 ± 0,01 satu | 0,12 ± 0,12 satu |
| 32 | 3-Heptanon | 1,25 ± 0,23 satuan | 1,15 ± 0,13 satuan | 1,26 ± 0,26 per menit |
| 33 | 2, 3-Oktanedion | 1,15 ± 0,11 satu | 1,08 ± 0,09 satuan | 1,12 ± 0,07 satu |
| 34 | L-karvon | 2,36 ± 0,21 miliar | ND sebuah | ND sebuah |
| 35 | Metilketena | 1,09 ± 0,08 miliar | 1,06 ± 0,07 satu | 1,10 ± 0,10 per menit |
| 36 | 2-Undekanon | 2,36 ± 0,12 detik | 2,19 ± 0,11 miliar | 1,65 ± 0,07 satu |
| 37 | 5, 9-Undecadienal-2-keton | 3,25 ± 0,15 per menit | 3,18 ± 0,18 per menit | 3,26 ± 0,45 satuan |
| Ester | ||||
| 38 | Etil butirat | 1,87 ± 0,09 miliar | 1,25 ± 0,76 per menit | 3,34 ± 0,34 detik |
| 39 | Etil-kaproat | 0,27 ± 0,11 satu | 0,25 ± 0,18 per menit | 0,23 ± 0,65 per menit |
| 40 | Etil-kaprat | 1,87 ± 0,12 miliar | 1,76 ± 0,12 satuan | 1,98 ± 0,28 miliar |
| 41 | Etil pelanoat | 1,65 ± 1,23 jam | 1,89 ± 0,98 miliar | 1,76 ± 0,12 miliar |
| 42 | Etil heksadekat | 2,78 ± 0,12 miliar | 2,98 ± 0,04 satuan | 2,87 ± 0,11 satuan |
| Pirazina | ||||
| 43 | Metilpirazina | 3,87 ± 0,67 detik | 2,45 ± 0,67 miliar | ND sebuah |
| 44 | 2,6-Dimetilpirazina | ND sebuah | 1,32 ± 0,57 miliar | 0,03 ± 0,65 satu |
| 45 | 2,3,5-Trimetilpirazina | ND sebuah | 1,90 ± 0,45 detik | 0,92 ± 0,14 miliar |
| Alkena | ||||
| 46 | Laurene | 15,25 ± 2,67 miliar | 13,16 ± 4,12 miliar | 9,68 ± 2,67 jam |
| 47 | stirena | ND sebuah | 4,89 ± 0,34 miliar | ND sebuah |
| 48 | 2,4-Dimetil-1-heptena | 2,89 ± 0,23 miliar | 2,25 ± 0,22 miliar | 1,89 ± 1,01 per menit |
| 49 | Undekana | ND sebuah | 1,02 ± 0,11 detik | ND sebuah |
| 50 | 2, 3-Di-tert-butil benzena | ND sebuah | 1,12 ± 0,34 miliar | ND sebuah |
| Yang lain | ||||
| 51 | 2,4-Di-tert-butilfenol | ND sebuah | 1,68 ± 0,12 miliar | ND sebuah |
| 52 | 2-Amil alkil furan | ND sebuah | 2,87 ± 0,26 miliar | ND sebuah |
| 53 | m-Kresol | ND sebuah | 2,56 ± 0,89 miliar | ND sebuah |
| 54 | Metoksifeniloksim | ND sebuah | 0,21 ± 0,09 satuan | ND sebuah |
| 55 | Divinil sulfida | ND sebuah | ND sebuah | 1,74 ± 0,26 miliar |
| 56 | 3,4-Dihidroksi-5-metildihidrofuran | 1,76 ± 0,11 miliar | 0,25 ± 0,18 per menit | 1,75 ± 0,45 per menit |
Catatan: Data menunjukkan mean ± SD; nilai mean dengan huruf yang berbeda menunjukkan perbedaan yang signifikan ( P < 0,05). Singkatan: ND, tidak terdeteksi.
Aldehida merupakan indikasi oksidasi lipid dan berperan penting dalam peningkatan rasa karena ambang penciumannya yang rendah. Senyawa ini terutama terbentuk melalui oksidasi asam lemak tak jenuh seperti asam oleat dan linoleat, yang sangat penting untuk pembentukan rasa pada daging yang diawetkan kering seperti ham Jinhua (Wang et al. 2020 ). Heksanal, benzaldehida, dan nonanal adalah aldehida dominan yang terdeteksi, dengan heksanal, produk oksidasi lipid penting yang memberikan rasa segar, seperti rumput dan berfungsi sebagai indikator oksidasi lipid, yang hadir dalam konsentrasi tertinggi. Kandungan heksanal dalam kelompok LLS adalah yang terendah dan berkurang secara signifikan dibandingkan dengan kelompok kontrol dan S015 ( p < 0,05), yang menunjukkan bahwa kultur starter menghambat oksidasi lipid. Alkohol, yang utamanya diproduksi sebagai produk sampingan oksidasi lipid, meliputi 2-etil-1-heksanol dengan aroma bunga, 1-okten-3-alkohol dengan aroma jamur, dan 3-metil-1-butanol dengan aroma buah (Wang, Aziz, et al. 2022 ; Wang, Hou, et al. 2022 ); konsentrasinya dalam kelompok LLS secara signifikan lebih tinggi daripada dalam kelompok kontrol dan S015 ( p < 0,05), khususnya untuk 1-okten-3-alkohol pada 36,17 ± 1,22 μg/kg. 2,6-dimetilpirazina dan 2,3,5-trimetilpirazina, yang mengingatkan pada kentang panggang, merupakan senyawa perasa penting dalam ham (Liu et al. 2020 ). Meskipun tidak terdeteksi dalam kelompok kontrol, senyawa ini lebih prevalen dalam kelompok LLS daripada dalam kelompok S015. Hasil ini menunjukkan bahwa kultur starter LAB lebih kondusif terhadap pembentukan senyawa volatil dalam ham daripada fermentasi alami, dengan LLS terbukti lebih unggul daripada fermenter komersial S015 untuk meningkatkan senyawa rasa, yang menunjukkan keunggulan potensial LLS sebagai kultur starter untuk ham Jinhua.
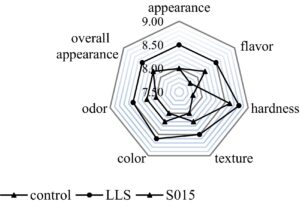
3.6 Evaluasi Sensorik
Peta radar digunakan untuk mengevaluasi sifat sensoris ham Jinhua yang mengalami fermentasi spontan dan ham yang diinokulasi dengan kultur starter, seperti yang digambarkan pada Gambar 6. Pada akhir fermentasi, analisis sensoris berbagai sampel ham Jinhua dilakukan, dengan mengukur skor rata-rata untuk warna, kekerasan, penerimaan keseluruhan, rasa, bau, dan tekstur. Kelompok LLS mendapat skor lebih tinggi daripada kontrol sebesar +0,7 poin untuk rasa, +0,5 poin untuk penampilan, dan +0,6 poin untuk tekstur. Secara keseluruhan, skor rata-rata untuk kelompok LLS lebih tinggi daripada kelompok S015, yang menunjukkan kualitas sensoris yang unggul pada ham yang diinokulasi dengan kultur starter LLS .
4 Kesimpulan
Dalam sampel kultur starter LLS , kelimpahan relatif yang lebih tinggi dari probiotik Staphylococcus dan Lactobacillaceae dan tingkat yang lebih rendah dari bakteri pembusuk Psychrobacteraceae dan Carnobaciliaceae diamati. Konsentrasi histamin, putresin, tiramin, dan kadaverin dalam kelompok LLS menunjukkan penghambatan yang lebih kuat daripada yang ada dalam kontrol dan starter komersial S015. Ham yang diinokulasi dengan kultur starter LLS juga menunjukkan pH, a w , dan TVBN yang lebih rendah. Selain itu, sampel LLS mengandung 11 senyawa volatil tambahan dan variasi rasa yang lebih besar dibandingkan dengan kontrol, menghasilkan evaluasi sensori dan sifat fisikokimia yang baik. Temuan ini menunjukkan bahwa kultur starter campuran yang terdiri dari Lactiplantibacillus plantarum, Lactilactobacillus sakei , dan S. xylosus berpotensi untuk mengurangi BA dan meningkatkan kualitas sensori pada ham Jinhua.

