ABSTRAK
Sonokimia telah menjadi semakin penting dalam penelitian bioteknologi, dan banyak bioaplikasi in vitro dan in vivo telah dikembangkan. Sitotoksisitas selalu menjadi perhatian dalam penerapannya. Untuk perawatan dan penelitian in vivo, indeks mekanis (MI) diketahui memastikan biokompatibilitas, dan bahkan MI in vitro telah digunakan. Karena karakteristik sel dan fenomena akustik berbeda in vitro dan in vivo, kami mempertanyakan penggunaan MI in vitro. Sitotoksisitas in vitro dari paparan ultrasound harus diselidiki untuk mendukung pengembangan sonokimia mutakhir. Dalam penelitian ini, sistem untuk menyinari sel yang dikultur dengan ultrasound rentang 1–2 MHz dikembangkan untuk menunjukkan ketidakabsahan penggunaan MI saja in vitro. Hasil penelitian menunjukkan bahwa kerusakan sel didefinisikan oleh MI, frekuensi ultrasound, dan waktu paparan, yang merupakan indeks baru untuk mengukur kerusakan sel. Lebih jauh, kavitasi dan aliran akustik terbukti menjadi faktor ilmiah utama yang melukai sel.
1 Pendahuluan
Penelitian interdisipliner telah menghasilkan inovasi di seluruh dunia, dan rekayasa akustik juga menarik dalam konteks ini. Dengan demikian, banyak kolaborasi dengan bidang penelitian lain, seperti sonokimia, telah berkembang. Sonokimia telah menarik perhatian besar di bidang bioteknologi. Ultrasonografi telah digunakan untuk pencitraan, operasi ultrasonografi, dan perawatan in vivo lainnya karena sifatnya yang non-invasif [ 1 – 4 ]. Bahkan ultrasonografi in vitro mendapatkan perhatian, dengan banyak aplikasi menggunakan berbagai intensitas ultrasonografi. Mikroskopi ultrasonografi dan pemecahan ultrasonik telah digunakan dalam alur kerja bioteknologi dengan intensitas akustik yang sangat halus dan kuat, masing-masing [ 5 ]. Lebih jauh lagi, menurut penelitian terbaru, ultrasonografi dengan intensitas antara mikroskopi ultrasonografi dan pemecahan dapat digunakan untuk mengembangkan aplikasi bio mutakhir dengan mengendalikan posisi fisik atau fungsi biokimia sel. Untuk kontrol posisi, sel dapat ditangani berdasarkan teori penjepit akustik [ 6 , 7 ] , dan pola sel, pembuatan jaringan, metode kultur baru, dan teknologi lab-on-a-chip telah dikembangkan [ 8-13 ]. Fungsi sel, migrasi, angiogenesis, apoptosis, dan diferensiasi dapat diatur menggunakan teori mekanotransduksi [ 14-18 ]. Bioaplikasi ini telah digunakan dalam studi medis yang luas seperti terapi sel, terapi regeneratif, sistem pengiriman obat, diagnosis, dan teknologi lab-on- a -chip. Singkatnya, sonokimia memimpin studi medis dalam bioteknologi untuk menyelamatkan hidup kita.
Ringkasan
• Tanpa diragukan lagi, pengaruh ultrasound pada sitotoksisitas sangat penting dalam semua skenario bidang penelitian bioteknologi.
• Aplikasi USG dalam bioteknologi semakin beragam.
• Bahkan secara in vitro, ultrasonografi dalam ilmu hayat dan teknologi mendapat perhatian, termasuk dalam hal peralihan kultur sel, rekayasa jaringan, transgenesis, dan teknik penyortiran sel menggunakan ultrasonografi.
• Mengenai penyaluran kultur sel, USG telah dimanfaatkan untuk pemisahan sel tanpa enzim, sehingga menghasilkan proses kultur sel yang efektif.
• Di bidang rekayasa jaringan, teknik penjepit akustik telah digunakan untuk menghasilkan agregasi sel, dan studi mekanotransduksi telah dilakukan dengan ultrasound.
• Salah satu metode umum untuk penyortiran sel didasarkan pada penangkapan ultrasonik, dan sonoporasi telah menjadi metode yang menjanjikan untuk transgenesis.
• Oleh karena itu, kami yakin penelitian kami bermanfaat bagi pengembangan dan studi bioaplikasi.
Sitotoksisitas selalu menjadi pusat perhatian dalam studi sonokimia di bidang bioteknologi. Untuk perawatan dan studi in vivo, indeks mekanis (MI) (MI = p /mathematical equation, di mana p dan f masing-masing mewakili tekanan akustik dan frekuensi) diketahui memastikan biokompatibilitas, dan peneliti serta penyedia layanan kesehatan dapat mengikuti kriteria intensitas ultrasonografi dalam pekerjaan mereka [ 19 ]. MI juga telah digunakan dalam studi in vitro [ 20 , 21 ], namun, apakah penggunaannya secara in vitro masuk akal belum ditentukan. Untuk mendukung pengembangan sonokimia mutakhir, sitotoksisitas in vitro di bawah paparan ultrasonografi harus diselidiki secara independen. Untuk melepaskan diri dari MI, kami mengembangkan sistem eksperimental yang mengevaluasi sitotoksisitas di bawah kondisi ultrasonografi tertentu dan menunjukkan bahwa sitotoksisitas untuk sel in vitro dapat ditentukan oleh MI, frekuensi ultrasonografi, dan waktu paparan. Dengan menggunakan ultrasonografi frekuensi MHz, kami juga mengidentifikasi faktor-faktor ilmiah yang memperkenalkan kematian sel ke dalam kavitasi dan aliran akustik dalam pengaturan eksperimental kami.
2 Hasil
2.1 Pengembangan Sistem Iradiasi Ultrasonik
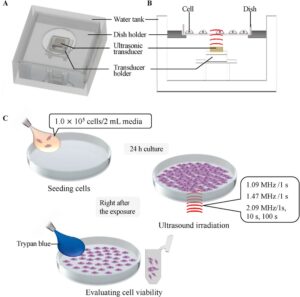
Gambar 1A,B memberikan gambaran umum dan tampilan penampang dari sistem iradiasi ultrasonik yang dikembangkan. Sistem ini terdiri dari piringan ø35, dudukan piringan, transduser ultrasonik, dudukan transduser, dan tangki air. Untuk sistem ini, tiga jenis transduser piezoelektrik (C213, Fuji Ceramics Corporation, Shizuoka, Jepang) dengan frekuensi resonansi rentang MHz yang berbeda yang banyak digunakan dalam penelitian bioteknologi digunakan sebagai transduser ultrasonik. Ultrasonografi yang dihasilkan oleh transduser ultrasonik disebarkan ke bagian tengah piringan melalui air (Gambar 1B ). Prosedur eksperimen menggunakan pengaturan ditunjukkan pada Gambar 1C .
2.2 Evaluasi Karakteristik Getaran Sistem
Frekuensi resonansi setiap transduser ultrasonik dalam sistem dan amplitudo getaran pada permukaan piringan dievaluasi. Frekuensi resonansi setiap transduser ultrasonik dievaluasi dengan mengukur impedansi listrik setiap transduser ultrasonik dalam sistem menggunakan penganalisa impedansi (FRA5097; NF Corporation, Kanagawa, Jepang), seperti yang ditunjukkan pada Gambar 2A–C . Frekuensi resonansi transduser ultrasonik adalah 1,09, 1,47, dan 2,09 MHz. Dengan demikian, frekuensi ini digunakan sebagai frekuensi penggerak transduser ultrasonik.
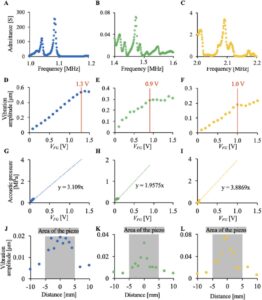
Hubungan antara tegangan masukan transduser dan amplitudo getaran di bagian tengah permukaan kultur cawan diukur menggunakan vibrometer Doppler laser (LDV) (LV-1800; Ono Sokki Co., Ltd., Kanagawa, Jepang), tanpa media kultur di dalam cawan, seperti yang ditunjukkan pada Gambar 2D–F . Tegangan masukan adalah tegangan keluaran dari generator fungsi V FG . Gambar-gambar ini menunjukkan bahwa amplitudo getaran di bagian tengah permukaan atas cawan sebanding dengan V FG dalam rentang 0 hingga 1,3 V, hingga 0,9 V, dan hingga 1,0 V pada frekuensi masing-masing 1,09, 1,47, dan 2,09 MHz. Dengan demikian, kami menyimpulkan bahwa V FG dalam rentang ini digunakan sebagai tegangan penggerak untuk transduser ultrasonik.
Lebih jauh lagi, untuk memperkirakan tekanan akustik, amplitudo getaran di bagian tengah permukaan atas piringan diukur menggunakan 2-mL air. Karena penyisipan hidrofon ke dalam ruang kecil dapat memengaruhi medan akustik, kami memperkirakan tekanan akustik dengan LDV dengan cara yang tidak invasif. Meskipun efek interaksi akustik-optik pada pengukuran perpindahan laser telah dilaporkan dalam penelitian sebelumnya [ 22 ], perubahan indeks bias tidak diharapkan memiliki dampak signifikan pada pengukuran perpindahan dalam pengaturan eksperimental kami. Dalam pengaturan ini, lintasan cahaya laser sejajar dengan arah perambatan ultrasound, dan fase ekspansi (tekanan positif) dan rarefaksi (tekanan negatif) yang terkait dengan lintasan ultrasound diharapkan saling melemahkan, sehingga hanya menghasilkan perubahan bersih yang sangat kecil dalam indeks bias. Jika ada perubahan yang sangat besar dalam medan akustik, semua sel akan terlepas [ 23 – 25 ]. Ketika tegangan input di atas level tertentu diterapkan pada transduser ultrasonik, permukaan air terangkat, mengganggu pengukuran amplitudo getaran dengan LDV. Jadi, untuk menghitung tekanan akustik dari Gambar 2 Kondisi penggerak pengaturan dengan tiga transduser ultrasonik berbeda yang memiliki area penyinaran yang sama tetapi frekuensi penggerak yang berbeda. Dalam studi ini, setiap transduser diberi nama UT 1,09 (dievaluasi dalam A, D, G, dan J), UT 1,47 (dievaluasi dalam B, E, F, dan K), dan UT 2,09 (dievaluasi dalam C, F, I, dan L), masing-masing. A–C: Frekuensi resonansi setiap transduser ultrasonik dievaluasi. D–F: Perpindahan getaran maksimum pada permukaan kultur diukur tanpa media kultur. G–I: Tekanan akustik maksimum pada permukaan kultur dievaluasi dan diprediksi dengan 2 mL air yang mensimulasikan media kultur. J–L: Distribusi getaran pada permukaan kultur diukur dengan LDV dengan tegangan input 0,2 V. Amplitudo getaran, V FG dalam rentang di mana kenaikan permukaan air tidak mengganggu pengukuran digunakan untuk mengukur amplitudo getaran dengan 2-mL air. Selanjutnya, tekanan akustik di luar rentang yang dihitung dari amplitudo getaran yang diukur diperkirakan dengan ekstrapolasi berdasarkan plot (Gambar 2G–I ). Diasumsikan bahwa getaran pada permukaan kultur meningkat secara linear, bahkan dengan air. Untuk menghitung tekanan akustik ultrasound yang diradiasi ke sel, tekanan akustik, p , dalam arah vertikal relatif terhadap permukaan transduser ultrasonik diberikan oleh:
![]()
di mana f , c ,
, dan A masing-masing mewakili frekuensi, kecepatan suara, densitas cairan, dan amplitudo getaran [ 35 ]. Dari Persamaan ( 1 ), tekanan akustik dihitung menggunakan amplitudo getaran permukaan atas piringan. Gambar 2D–F menunjukkan hubungan antara V FG dan amplitudo getaran. Karena asumsi peningkatan linier amplitudo getaran terhadap tegangan input, rumus perkiraan, yang konstanta proporsionalnya adalah 3,11, 1,96, dan 3,89 MPa/V untuk transduser dengan frekuensi penggerak masing-masing 1,09, 1,47, dan 2,09 MHz, diberikan, karena kami tidak mengubah frekuensi penggerak dan medan akustik yang memengaruhi frekuensi resonansi selama penelitian ini. Transduser ultrasonik diberi nama UT 1,09 , UT 1,47 , dan UT 2,09 .
Distribusi amplitudo getaran di permukaan atas piringan juga diukur pada Gambar 2J–L . Lebar transduser ultrasonik persegi adalah 10 mm. Gambar ini menunjukkan bahwa ultrasonik merambat ke dalam piringan melalui bagian bawah piringan.
2.3 Peningkatan Suhu Akibat Paparan Ultrasonik
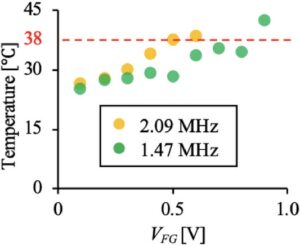
Suhu 2 mL media kultur yang dikenai paparan ultrasonik dalam cawan diukur menggunakan kamera termografik (CPA-E6; CHINO CORPORATION, Itabashi, Tokyo, Jepang). V FG sebesar 1,3 V, 0,9 V, dan 1,0 V dimasukkan ke dalam UT 1,09 , UT 1,47 , dan UT 2,09 dengan waktu penyinaran ultrasonik selama 1, 10, atau 100 detik. Suhu yang diukur setelah penyinaran ultrasonik tercantum dalam Tabel 1. Tabel ini menunjukkan beberapa kondisi di mana suhu dinaikkan melebihi 38°C. Perhatikan bahwa suhu setelah penyinaran ultrasonik selama 100 detik pada 2,09 MHz tidak dapat diukur karena cawan meleleh akibat pembangkitan panas yang disebabkan oleh ultrasonik. Khususnya, titik leleh polistirena, yang merupakan material cawan kultur, adalah sekitar 100°C. Karena sel rusak oleh panas pada suhu di atas 38°C [ 26 ], kondisi peningkatan suhu kultur ini tidak digunakan dalam percobaan, yang memungkinkan kita fokus pada kerusakan mekanis yang disebabkan oleh ultrasound pada sel. Dengan demikian, hubungan antara V FG dan suhu setelah penyinaran ultrasound selama 100 detik pada 1,47 atau 2,09 MHz diselidiki, seperti yang ditunjukkan pada Gambar 3 , yang menunjukkan bahwa suhu tidak melebihi 38°C dengan V FG sebesar 0,8 dan 0,7 V dengan UT 1,47 dan UT 2,09 . Oleh karena itu, V FG yang tidak melebihi 0,8 dan 0,5 V digunakan bersama dengan kondisi penyinaran ultrasound 1,47 MHz selama 100 detik dan ultrasound 2,09 MHz selama 100 detik.
| 1 detik | 10 detik | 100 detik | |
|---|---|---|---|
| 2,09MHz | 31.3 | 33.9 | Piring meleleh |
| 1,47MHz | 31.8 | 32.7 | 42.5 |
| 1,09MHz | 33.4 | 33 | 35.4 |
Catatan: Tegangan input 1,3, 0,9, dan 1,0 V masing-masing diterapkan ke UT 1,09 , UT 1,47 , dan UT 2,09 .
2.4 Kerusakan Akibat Ultrasonografi pada Sel yang Dikultur In-Vitro
Sel-sel tersebut diiradiasi dengan ultrasound pada frekuensi, tekanan akustik, dan durasi yang berbeda untuk mengevaluasi kerusakan yang disebabkan oleh ultrasound pada sel-sel yang dikultur secara in vitro. Kondisi dan prosedur eksperimen ditunjukkan pada Gambar 1C . Sel ovarium hamster Cina (CHO), yang umum digunakan dalam penelitian dan industri farmasi, telah digunakan sebagai model untuk sel-sel yang dikultur [ 27 ]. Untuk percobaan tersebut, 1,0
105 sel disemai dengan 2 mL medium kultur ke dalam cawan kultur sel dengan diameter 35 mm dan dikultur selama 1 hari dalam inkubator 5% CO2 yang dilembabkan pada suhu 37°C. Setelah inkubasi, medium kultur dibuang, dan 2 mL medium kultur segar ditambahkan ke dalam cawan. Cawan tersebut kemudian diletakkan pada sistem iradiasi ultrasonik, yang memaparkan sel pada ultrasonografi. V FG divariasikan dari 0,4 hingga 1,3 V pada frekuensi 1,09 MHz, dari 0,5 hingga 0,9 pada 1,47 MHz, atau dari 0,3 hingga 1,0 V pada 2,09 MHz, dan durasi iradiasi ultrasonik adalah 1 detik (Gambar 4A–C ). Di sisi lain, tiga waktu paparan diterapkan dengan frekuensi 2,09 MHz (Gambar 4C–F ). Keluaran ultrasonografi ditunjukkan sebagai MI pada setiap gambar. Gambar 4A–E menunjukkan jumlah sel dalam setiap kondisi: sel yang terlepas dan mati, sel yang terlepas dan hidup, dan sel yang menempel dan mati. Telah ditunjukkan bahwa sebagian besar sel yang mati tersuspensi dalam media kultur. Jumlah sel yang terlepas, baik hidup maupun mati, meningkat dengan MI pada frekuensi dan durasi pemacuan tertentu. Lebih jauh, rasio sel yang mati terhadap total sel yang terlepas cenderung meningkat dengan frekuensi pemacuan atau waktu pemaparan, sementara yang lainnya tetap. Hasil yang menunjukkan rasio sel yang mati terhadap semua sel dirangkum dalam Gambar 4F,G .
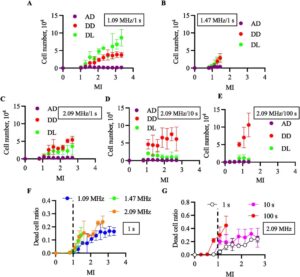
Hanya dengan mengintegrasikan jumlah sel yang mati tanpa mempedulikan kondisi adhesi dengan frekuensi penggerak tertentu, jumlah sel yang terlepas meningkat seiring dengan peningkatan MI dan waktu pemaparan.
Sebagai indikator sitotoksisitas, kami menerapkan rasio sel mati 5% dalam penelitian ini, dan ambang batas kondisi ultrasonografi sitokompatibel dievaluasi dengan paparan ultrasonografi. Gambar 5A, B menunjukkan rasio sel mati setelah paparan ultrasonografi selama 10 dan 100 detik, berturut-turut. Gambar 5C menunjukkan sitotoksisitas MI pada setiap kondisi perawatan. Untuk memperoleh gambar ini, kami menghitung titik perpotongan garis gambar dan nilai y sebesar 0,05 pada Gambar 5A, B. Ambang batas MI yang menunjukkan sitotoksisitas menurun dengan meningkatnya frekuensi ultrasonografi dan waktu paparan. Hasil ini menunjukkan bahwa kondisi ultrasonografi sitokompatibel in vitro tidak hanya ditentukan oleh MI dan bahwa frekuensi ultrasonografi dan waktu paparan merupakan faktor penting.

2.5 Distribusi Sel pada Cawan Setelah Iradiasi Ultrasonik
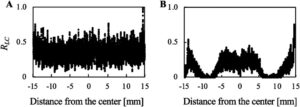
Distribusi sel hidup setelah 1 detik penyinaran ultrasonik dengan tegangan masukan 1,0 V hingga UT 2,09 dibandingkan dengan distribusi tanpa paparan ultrasonik, seperti yang ditunjukkan pada Gambar 6. Distribusi sel hidup yang ditunjukkan pada Gambar 6B tidak sesuai dengan distribusi getaran yang ditunjukkan pada Gambar 2J , yang menunjukkan bahwa amplitudo getaran tidak sekadar menunjukkan sitotoksisitas.
3 Diskusi
Dalam studi ini, kami menyelidiki efek MI dalam kultur sel. Sistem iradiasi ultrasonik untuk sel yang dikultur dikembangkan untuk menunjukkan validitas penggunaan MI secara in vitro. Meskipun kerusakan sel yang diinduksi pada setiap kondisi paparan ultrasonik dievaluasi menggunakan CHO, perangkat ini tidak memiliki keterbatasan dalam mengkultur spesies sel. Seperti yang ditunjukkan pada Gambar 4 dan 5 , semakin tinggi frekuensi penggerak atau semakin lama waktu penggerak, semakin banyak sel yang terluka. Lebih jauh lagi, ketika memfokuskan pada MI sebesar 1 sebagai ambang batas untuk kondisi penggerak yang aman [ 28 ], lebih dari 20% sel mati dengan durasi penggerak 10 dan 100 detik (Gambar 4G ). Meskipun tidak ada ambang batas yang jelas untuk definisi sitotoksisitas dalam literatur, nilai MI yang mencapai ambang batas tentatif 5% dalam studi ini menurun dengan meningkatnya frekuensi penggerak dan waktu paparan ultrasonik. Berdasarkan hasil ini, kami menyimpulkan bahwa sitotoksisitas iradiasi ultrasonik in vitro ditentukan oleh beberapa faktor, termasuk MI, waktu paparan, dan frekuensi penggerak. Sitotoksisitas akan terjadi akibat interaksi nonlinier antara berbagai fenomena: akustik, hidrodinamik, termodinamik, dan biologis. Di sini, kami menunjukkan dari percobaan saat ini bahwa sitotoksisitas tidak dapat dianalisis dengan satu parameter empiris MI dan dapat bergantung pada beberapa parameter dimensi. Karena evaluasi sitotoksisitas dengan USG dapat dihindari secara in vivo karena masalah etika, perangkat yang dikembangkan dapat memberikan referensi yang baik.
MI bukan satu-satunya indeks yang harus dipertimbangkan secara in vitro, seperti yang disebutkan di atas; oleh karena itu, faktor-faktor yang menyebabkan kerusakan sel dalam penelitian kami dibahas di bawah ini. Kematian sel dapat diklasifikasikan sebagai nekrosis atau apoptosis. Meskipun getaran mekanis telah diketahui memicu apoptosis bahkan dengan stimulasi ringan [ 17 , 29 ], dalam penelitian kami, sel-sel harus dibunuh oleh nekrosis. Ini karena apoptosis umumnya membutuhkan waktu yang lama setelah stres [ 30 ]. Faktor-faktor potensial yang menyebabkan kematian sel meliputi peningkatan suhu, kavitasi, deformasi, tekanan radiasi akustik, dan aliran akustik. Seperti yang ditunjukkan pada Gambar 3 , tidak ada peningkatan suhu yang diamati dalam percobaan kami. Tekanan akustik dan deformasi masing-masing sekitar 4 MPa dan kurang dari 0,5 µm seperti yang ditunjukkan pada Gambar 2 , yang seharusnya tidak hanya menyebabkan nekrosis dari penelitian sebelumnya [ 31-33 ]. Di sisi lain, kavitasi harus menjadi salah satu faktor, dan penelitian sebelumnya telah melaporkan bahwa ultrasound frekuensi MHz dapat menyebabkan kavitasi [ 34 , 35 ]. MI di atas 1,0 dapat menyebabkan kavitasi [ 36 ]. Catatan Tambahan 1 dalam informasi pendukung menunjukkan adanya kavitasi. Lebih jauh, ambang batas, yang menghasilkan kavitasi, dapat diturunkan karena inti kavitasi yang heterogen [ 37 ]. Dalam penelitian ini, karena protein dan udara dalam media kultur, sel, atau serpihan sel dapat menjadi inti, kavitasi mungkin telah terjadi dalam pengaturan eksperimen kami, bahkan dengan MI kurang dari 1,0. Kehadiran nanobubble atau microbubble dalam air telah dilaporkan sebelumnya [ 38 , 39 ]. Pekerjaan sebelumnya juga telah melaporkan bahwa ultrasound bahkan dengan frekuensi 1 MHz atau kurang nanobubble atau microbubble dapat dihasilkan [ 40 ]. Lebih jauh, bahkan dengan MI yang sama, ambang batas terjadinya kavitasi dapat lebih rendah pada waktu paparan karena difusi massa yang diperbaiki dan gaya Bjerknes [ 41-45 ] . Meskipun kavitasi mungkin tidak terjadi dengan waktu paparan yang singkat karena diameter nanobubbles di media yang kecil dibandingkan dengan frekuensi penggerak ultrasound, waktu paparan yang lebih lama memungkinkan gelembung tumbuh dan menyebabkan kavitasi [ 46 , 47 ]. Namun, meskipun ambang terjadinya kavitasi harus meningkat dengan peningkatan frekuensi ultrasound [ 36], frekuensi yang lebih tinggi tampaknya berbahaya bagi sel dalam penelitian kami. Ini menunjukkan bahwa ada faktor selain kavitasi yang menyebabkan kematian sel. Aliran akustik, yang tidak dapat dievaluasi dalam pengaturan eksperimen ini karena desainnya tetapi seharusnya ada dalam pengaturan kami, adalah faktor lain yang menyebabkan kematian sel. Keberadaan aliran akustik, khususnya aliran Eckart, dapat diprediksi karena semua panjang gelombang ultrasound yang digunakan lebih pendek daripada ketebalan media kultur (2,2 mm). Perhatikan bahwa bahkan untuk ultrasound 1,09 MHz, yang memiliki panjang gelombang terpanjang, panjang gelombang dalam air kira-kira 1,4 mm. Aliran akustik menjadi lebih intens dengan peningkatan frekuensi penggerak, seperti yang dilaporkan dalam literatur [ 48 – 50 ]. Peningkatan laju penyerapan ultrasound bersama dengan peningkatan frekuensi juga meningkatkan pembentukan aliran akustik [ 51 , 52 ]. Jika frekuensi penggerak meningkat dengan MI yang sama, tekanan akustik meningkat, yang juga meningkatkan aliran akustik. Lebih jauh lagi, karena gelembung menyerap ultrasound, yang menghasilkan peningkatan aliran akustik, waktu paparan yang lebih lama dapat menyebabkan peningkatan aliran akustik [ 53 ]. Tekanan geser kuat yang disebabkan oleh aliran media melukai sel yang dikultur [ 54 ]. Oleh karena itu, faktor potensial yang dapat melukai sel dalam pengaturan eksperimen kami diprediksi adalah kavitasi dan aliran akustik.
Meskipun kavitasi dan aliran akustik adalah faktor ilmiah yang melukai sel, banyak dari faktor-faktor tersebut mempengaruhi ketahanan sel secara in vitro. Variasi dalam lingkungan kultur, seperti monokultur, kultur 2D, media kultur, dan kepadatan sel yang relatif lebih rendah dibandingkan dengan kondisi in vivo, dapat menjadi faktor. Lebih jauh, pelepasan sel adalah pemicu yang harus dipertimbangkan ketika ultrasonografi diterapkan pada sel yang dikultur. Sel in vitro dapat dilepaskan dengan paparan ultrasonografi, dan aliran akustik adalah salah satu faktor yang melepaskan sel [ 24 , 55 , 56 ]. Setelah sel terlepas, mereka mengalami tekanan mekanis yang unik dibandingkan dengan kondisi in vivo, yang dapat membahayakan sel yang dikultur. Sel yang mengapung dalam labu pemutar diketahui rusak oleh agitasi yang kuat [ 57 ], yang menunjukkan bahwa sel yang mengapung dan teragitasi dapat terluka dalam penelitian ini. Secara khusus, dalam penelitian sebelumnya yang melaporkan kultur suspensi dengan paparan ultrasonografi, sel-sel terluka oleh intensitas ultrasonografi tertentu [ 37 ]. Distribusi sel ditunjukkan pada Gambar 6B ; Sel hidup dan sel yang melekat di area dengan amplitudo getaran terbesar pada permukaan kultur (pusat permukaan kultur) menunjukkan viabilitas yang lebih baik daripada sel di area permukaan kultur dengan amplitudo getaran yang lebih kecil. Dibandingkan dengan pusat permukaan kultur, area lain seharusnya menunjukkan aliran yang lebih kuat, yang dapat melukai sel. Prediksi pada seluruh aliran ini didukung oleh penelitian sebelumnya yang menunjukkan aliran ke atas di bawah pancuran akustik [ 20 , 58 ]. Di atas segalanya, meskipun kavitasi dan aliran akustik seharusnya menjadi pemicu langsung untuk menginduksi kematian sel, setiap kondisi kultur dan fungsi sel memengaruhi daya tahan sel. Oleh karena itu, dengan menggunakan pengaturan ini, pendekatan eksperimental diadopsi untuk menyelidiki kondisi ultrasound yang menginduksi kematian sel.
Perangkat kami menggunakan cawan kultur umum, yang memungkinkan kami untuk menyelidiki sitotoksisitas ultrasonografi dalam situasi kultur sel yang umum. Pengaturan saat ini memiliki distribusi fenomena akustik dan kepadatan sel, yang memberikan realitas untuk kultur in vitro. Namun, dengan mewujudkan kondisi eksperimen yang homogen di masa mendatang, daya tahan sel atau respons terhadap paparan ultrasonografi dapat diselidiki secara ketat dari sudut pandang ilmiah. Kami dapat menggunakan teknik yang dilaporkan untuk mencapai kepadatan kultur yang homogen, membuat kondisi sel menjadi homogen [ 59 – 61 ]. Lebih lanjut, pengaturan eksperimen di mana sel yang dikultur dapat terpapar pada stimulasi ultrasonografi yang seragam atau distribusi stimulasi ultrasonografi dapat diatur harus dikembangkan dalam penelitian mendatang. Seperti disebutkan di atas, penelitian ini menunjukkan ide mendasar untuk menyelidiki sitotoksisitas ultrasonografi secara in vitro dan mengembangkan sonokimia dalam bidang penelitian bioteknologi; perangkat baru di mana respons sel terhadap ultrasonografi dapat diselidiki harus dikembangkan di masa mendatang.
4 Metode
4.1 Evaluasi Karakteristik Getaran Sistem
Tangki air diisi dengan air, dan cawan berisi 2 mL air diletakkan pada dudukan cawan untuk meniru kondisi percobaan menggunakan sel untuk mengukur frekuensi resonansi. Hubungan antara frekuensi masukan AC dan admitansi transduser ultrasonik diukur pada tegangan masukan 1 V pp .
4.2 Persiapan Sel
Lini sel CHO (CHO-K1, RCB0403; Riken BioResource Center, Ibaraki, Jepang) digunakan untuk semua percobaan. Sel CHO dikultur dalam medium Ham’s F-12 (a- MEM Ham’s F-12; Wako, Tokyo, Jepang) yang diberi 10% serum sapi fetal (S1820; Biowest SAS, Nuaille, Prancis) dalam inkubator atmosfer humidifikasi 5% CO2 pada suhu 37°C. Pengalihan sel dilakukan dengan menerapkan 0,05% tripsin-EDTA (25300, Life Technologies, CA, AS), diikuti dengan pemipetan.
4.3 Evaluasi Viabilitas Sel
Setelah penyinaran ultrasonik, media kultur dalam cawan dikumpulkan, dan jumlah sel hidup dan mati dalam supernatan serta jumlah sel mati pada permukaan kultur diukur menggunakan larutan biru tripan (0,4%) (Thermo Fisher Scientific) pada hemocytometer. Kemudian, 250 µL larutan biru tripan ditambahkan ke cawan untuk mewarnai sel mati yang menempel pada cawan. Jumlah sel mati yang menempel dihitung sebagai berikut: Gambar seluruh cawan diambil, dan jumlah sel mati yang menempel yang diwarnai dengan biru tripan dihitung menggunakan kotak alat pemrosesan gambar MATLAB (Kotak Alat Pemrosesan Gambar; MathWorks, Natick, MA, AS).
4.4 Evaluasi Distribusi Sel
Setelah medium dibuang, sel dicuci tiga kali dengan 1 mL PBS. Setelah PBS dibuang, sitoplasma atau inti sel diwarnai dengan kalsein-AM (C0875; Sigma-Aldrich, St. Louis, MO, AS) selama 30 menit dan dicuci lagi dengan PBS. Gambar fluoresensi sel diambil menggunakan mikroskop terbalik. Ukuran gambar yang diambil adalah 1,63mathematical equation29,8 mm 2 dan bagian tengah gambar disejajarkan dengan bagian tengah piringan. Gambar fluoresensi yang diambil dianalisis menggunakan Image J sebagai berikut: gambar yang diambil dibinerisasi, yang mengubah sitoplasma atau inti sel yang diwarnai menjadi hitam. Rata-rata kolom dari nilai luminansi pada titik-titik sepanjang sumbu x kemudian diperoleh. Perhatikan bahwa rata-rata kolom adalah rata-rata dari nilai luminansi semua piksel yang didistribusikan secara vertikal pada suatu titik pada sumbu x .

