ABSTRAK
Manfaat kesehatan probiotik dapat dipengaruhi oleh penurunan viabilitas selama penyimpanan makanan dan transit gastrointestinal. Meskipun mikroenkapsulasi merupakan strategi perlindungan yang efektif, penerapannya pada probiotik terbatas. Saat ini, penelitian tentang biofilm probiotik sedang berkembang, dengan biofilm ini diakui sebagai probiotik generasi keempat. Penelitian ini bertujuan untuk menyelidiki efek pembentukan biofilm pada toleransi gastrointestinal dan mukoadhesi dari tiga probiotik yang berbeda: Ligilactobacillus salivarius Li01 ( L. salivarius Li01), Bifidobacterium longum ( B. longum ), dan Bifidobacterium pseudocatenulatum ( B. pseudocatenulatum ). Pertumbuhan biofilm sangat dihambat oleh pH rendah dan konsentrasi garam empedu yang tinggi. Pembentukan biofilm sangat meningkatkan kelangsungan hidup ketiga strain dalam kondisi gastrointestinal yang disimulasikan. Biofilm meningkatkan adhesi usus dan hidrofobisitas permukaan pada B. longum dan L. salivarius Li01, sementara mengurangi adhesi pada B. pseudocatenulatum karena penurunan hidrofobisitas. Selain itu, analisis transkriptomik L. salivarius Li01 mengidentifikasi 157 gen yang diekspresikan secara berbeda, yang diperkaya dalam jalur termasuk transporter ABC, penginderaan kuorum, metabolisme purin, biosintesis arginin, sistem fosfotransferase (PTS), RNA polimerase, dan jalur pensinyalan reseptor mirip NOD. Sebagai kesimpulan, pembentukan biofilm meningkatkan toleransi gastrointestinal dan adhesi usus probiotik, menghadirkan potensi terapan yang besar dalam meningkatkan kemanjuran probiotik.
1 Pendahuluan
Probiotik merujuk pada mikroorganisme hidup yang, ketika dikonsumsi dalam jumlah yang cukup, memberikan keuntungan kesehatan bagi inangnya (Hill et al. 2014 ). Probiotik telah dipelajari secara intensif karena manfaatnya bagi kesehatan inangnya sejak penemuannya (Barzegar et al. 2023 ; Lai et al. 2023 ; Suez et al. 2019 ). Dalam beberapa tahun terakhir, biofilm probiotik telah mendapatkan perhatian yang semakin meningkat, dan dianggap sebagai probiotik generasi keempat yang paling maju (Deng et al. 2020 ; Yang et al. 2024 ). Seperti yang kita semua tahu, bakteri terutama ada dalam dua keadaan: keadaan planktonik dan biofilm (Li et al. 2023 ). Keadaan planktonik menggambarkan bakteri yang mengambang bebas dalam cairan, biasanya ditandai dengan perkembangbiakan dan penyebaran yang cepat di lingkungan yang kaya sumber daya (Rumbaugh dan Sauer 2020 ). Biofilm adalah komunitas mikroba terstruktur yang melekat pada permukaan, dengan sel-sel terbungkus dalam matriks zat polimer ekstraseluler (EPS) yang diproduksi sendiri, yang merupakan bentuk dominan keberadaan bakteri di alam (Gao et al. 2022 ). Matriks EPS terdiri dari eksopolisakarida, asam nukleat ekstraseluler, protein, lipid, dan biomolekul lainnya (Karygianni et al. 2020 ). Sebagian besar penelitian berfokus pada biofilm yang dibentuk oleh bakteri patogen, karena mereka menunjukkan resistensi dan ketahanan antibiotik yang lebih besar di lingkungan yang merugikan dibandingkan dengan keadaan planktonik (Yan dan Bassler 2019 ). Biofilm yang dibentuk oleh bakteri patogen menimbulkan tantangan yang signifikan bagi manusia, terutama pada infeksi kronis (Barman et al. 2024 ). Namun, penelitian tentang biofilm yang dibentuk oleh mikroorganisme yang bermanfaat masih terbatas dan kurang dieksplorasi.
Telah diketahui bahwa terdapat sejumlah tantangan ketika mengaplikasikan probiotik secara klinis karena sensitivitasnya yang tinggi terhadap kondisi gastrointestinal (GI) yang keras (Centurion et al. 2021 ; Li et al. 2024 ). Enkapsulasi probiotik dalam pembawa yang menawarkan kemampuan pengiriman yang protektif dan terarah dapat meningkatkan toleransinya terhadap lingkungan eksternal dan gastrointestinal yang keras (Luo et al. 2022 ). Biofilm telah dianggap sebagai metode yang efektif untuk enkapsulasi dan pengiriman probiotik. Dibandingkan dengan metode enkapsulasi lainnya, seperti gel minyak dan hidrogel, enkapsulasi biofilm tampaknya lebih aman dan lebih sederhana, karena tidak memasukkan zat eksogen (Li et al. 2024 ; Luo et al. 2022 ).
Menurut literatur yang diterbitkan, pemberian probiotik dalam keadaan biofilm dapat meningkatkan kemampuan adhesi secara signifikan dan mempertahankan viabilitas tinggi di seluruh saluran gastrointestinal (Al-Hadidi et al. 2021 ; Gao et al. 2022 ; Hu et al. 2022 ). Liu et al. melaporkan bahwa sel biofilm Lactiplantibacillus paraplantarum LR-1 dan Lactobacillus paraplantarum L-ZS9 menunjukkan aktivitas imunomodulatori yang lebih tinggi daripada sel planktoniknya (Liu et al. 2023 , 2021 ). Liu et al. selanjutnya mengamati bahwa metabolisme asam amino dan karbohidrat dalam keadaan biofilm L. plantarum lebih aktif daripada dalam keadaan planktoniknya (Liu et al. 2021 ). Biofilm Lactobacillus dan Bifidobacterium mengaktifkan sel dendritik melalui pensinyalan Toll-like receptor 2, menghambat pertumbuhan tumor dan meningkatkan efikasi kemoterapi dan imunoterapi (Han et al. 2021 ). Lactobacillus reuteri dalam keadaan biofilm mengurangi keparahan dan insidensi infeksi Clostridium difficile (Shelby et al. 2020 ). Selain itu, Sun et al. menggunakan sekuensing transkriptom untuk membandingkan gen yang diekspresikan secara diferensial (DEG) antara keadaan biofilm dan planktonik Lactobacillus plantarum J26, menemukan bahwa DEG terutama diperkaya dalam jalur adhesi, metabolisme pirimidin, metabolisme gliserol, respons stres, dan quorum-sensing (Sun et al. 2020 ). Sebuah studi komprehensif tentang karakteristik biofilm probiotik diharapkan dapat mendorong penerapan klinis probiotik secara luas.
Banyak penelitian telah membuktikan bahwa Lactobacillus dan Bifidobacterium memiliki banyak manfaat kesehatan dan juga merupakan mikroorganisme yang paling umum digunakan untuk komersialisasi produk probiotik (Bober et al. 2018 ; Hojjati et al. 2020 ; Turroni et al. 2014 ). Penelitian terbatas tentang sifat biofilm probiotik Lactobacillus dan Bifidobacterium menunjukkan perlunya penyelidikan lebih lanjut (Silva et al. 2020 ). Penelitian ini memilih strain dari dua genera untuk membandingkan sifat probiotik dari biofilm dan keadaan planktoniknya. Ligilactobacillus salivarius Li01, dilaporkan memiliki efek terapeutik potensial pada kondisi gastrointestinal dan terkait hati, dipilih karena kemampuan pembentukan biofilm yang kuat yang ditunjukkan dalam penyaringan awal (Fei et al. 2022 ; Qiu et al. 2022 ; Zhuge et al. 2020 ). Demikian pula, dua galur Bifidobacterium , Bifidobacterium longum , dan Bifidobacterium pseudocatenulatum , dipilih karena kemampuan pembentukan biofilm yang kuat yang diidentifikasi selama pra-penyaringan. Dalam penelitian ini, toleransi gastrointestinal dan kemampuan adhesi usus dari tiga galur bakteri dalam keadaan biofilm dan planktonik diukur untuk mengeksplorasi keuntungan biofilm secara lebih komprehensif. Selain itu, analisis transkriptomik digunakan untuk mengeksplorasi mekanisme toleransi biofilm Li01 di lingkungan yang keras.
2 Bahan dan Metode
2.1 Strain Bakteri, Sel Caco-2 dan Kondisi Kultur
Ligilactobacillus salivarius Li01 diperoleh dari Rumah Sakit Afiliasi Pertama Fakultas Kedokteran Universitas Zhejiang dan dikultur dalam kaldu MRS (Oxoid, Basingstoke, Inggris) pada suhu 37°C dalam ruang anaerobik vinil (Laboratorium Coy, AS). Bifidobacterium longum dan Bifidobacterium pseudocatenulatum diisolasi dari feses manusia yang sehat dan dikultur dalam kaldu TPY (Hopebio, Tiongkok) pada suhu 37°C dalam ruang anaerobik vinil (Laboratorium Coy, AS). Sel Caco-2 dikultur dalam medium Dulbecco’s Modified Eagle (DMEM, Gibco, Tiongkok), ditambah dengan 10% serum sapi janin yang diinaktivasi panas (FBS, Gibco, Tiongkok) dan 1% penisilin-streptomisin (Gibco, Tiongkok). Sel-sel dipertahankan pada suhu 37°C dalam atmosfer 5% CO2 .
2.2 Pembentukan dan Pertumbuhan Biofilm
Uji pewarnaan kristal violet dilakukan untuk mengevaluasi pembentukan dan pertumbuhan biofilm bakteri (Zhang, Meng, et al. 2022 ). Suspensi bakteri diencerkan hingga 2% (v/v) dalam medium MRS atau TPY segar dan ditambahkan ke dalam pelat kultur sel 96-sumur pada 200 μL per sumur. Pelat diinkubasi pada suhu 37°C selama 6, 12, 24, 36, 48, 54, 60, dan 72 jam, setelah itu medium diangkat dengan hati-hati dan sumur dicuci tiga kali dengan PBS. Setelah kering, biofilm difiksasi dalam metanol selama 10 menit, dan metanol dibuang. Sumur diwarnai dengan 200 μL kristal violet per sumur selama 10 menit dan dicuci tiga kali dengan PBS. Setelah kering lagi, asam asetat glasial 33% ditambahkan ke setiap sumur, dan pelat diinkubasi pada suhu kamar selama 30 menit. Kepadatan optik pada 570 nm (OD 570 ) kemudian diukur menggunakan pembaca mikroplat. Media MRS dan TPY digunakan sebagai kontrol negatif. Nilai ODc dihitung sebagai tiga kali simpangan baku yang ditambahkan ke absorbansi rata-rata kelompok kontrol pada 570 nm. OD ≤ ODc, 2*ODc < OD ≤ 4*ODc, dan OD > 4*ODc ditafsirkan sebagai indikasi tidak terbentuknya biofilm, pembentukan biofilm sedang, dan kemampuan pembentukan biofilm kuat, masing-masing.
2.3 Faktor Eksternal yang Mempengaruhi Pembentukan Biofilm
Untuk menyelidiki pengaruh pH yang berbeda (3, 4, 5, 6, 7, 8, dan 9) dan garam empedu (0, 0,05%, 0,1%, 0,2%, dan 0,3%, b/v) pada pembentukan biofilm dalam media kultur, uji pewarnaan kristal violet dilakukan pada tiga strain bakteri yang dikultur selama 48 jam, mengikuti metode yang dijelaskan sebelumnya.
2.4 Pengamatan Morfologi Biofilm
Irisan sel yang merayap ditempatkan dalam pelat 12-sumur yang berisi 4 mL media kultur segar. Strain bakteri diinokulasi pada 2% (v/v) dan diinkubasi secara anaerobik pada 37°C selama 48 jam. Setelah inkubasi, irisan yang merayap diangkat dan dicuci tiga kali dengan PBS untuk menghilangkan bakteri planktonik. Irisan tersebut kemudian difiksasi dalam larutan glutaraldehida 2,5% pada suhu 4°C dalam gelap selama 16 jam. Untuk menyiapkan sel bakteri planktonik untuk mikroskopi elektron, pelet sel dikumpulkan dengan sentrifugasi dan disuspensikan kembali dalam 1 mL fiksatif glutaraldehida. Setelah fiksasi, irisan dan pelet sel dicuci tiga kali dengan PBS dan diperlakukan dengan 1% osmium tetroksida selama 1 jam. Sampel dicuci tiga kali dengan PBS. Selanjutnya, sampel didehidrasi menggunakan seri etanol gradien (30%, 50%, 70%, 80%, 90%, 95%, dan 100%). Sampel yang didehidrasi dikeringkan dengan pengering titik kritis Hitachi HCP-2 dan dilapisi untuk pengamatan. Terakhir, morfologi sampel divisualisasikan dengan mikroskop elektron pemindaian Hitachi SU-8010 (Hu et al. 2023 ).
2.5 Persiapan Strain Plankton dan Biofilm
Strain planktonik dikultur secara anaerobik pada suhu 37°C dan 150 rpm. Sel biofilm ditumbuhkan pada pelat kultur sel 12-sumur. Setelah inkubasi anaerobik dari tiga strain bakteri, suspensi disentrifugasi untuk membuang supernatan. Pelet disuspensikan kembali dalam PBS, dan 2% (v/v) suspensi diinokulasi ke dalam media MRS atau TPY. Kemudian, 2 mL ditambahkan per sumur dalam pelat mikro polistirena 12-sumur. Pelat diinkubasi secara anaerobik pada suhu 37°C. Setelah pembentukan biofilm, media dikeluarkan dengan hati-hati dari sumur, yang kemudian dicuci tiga kali dengan PBS untuk menghilangkan bakteri planktonik. Sel biofilm dikumpulkan menggunakan pengikis sel, dicuci dua kali dengan PBS, dan disuspensikan kembali dalam PBS. Sel bakteri planktonik disentrifugasi dan disuspensikan kembali dalam PBS dengan cara yang sama.
2.6 Toleransi Gastrointestinal In Vitro
Percobaan simulasi toleransi gastrointestinal diadaptasi dari penelitian sebelumnya (Qiu et al. 2024 ; Shi et al. 2022 ; Yao et al. 2017 ). Strain planktonik dan biofilm disiapkan menggunakan metode yang dijelaskan di atas. Secara singkat, larutan bakteri dicampur dengan cairan lambung simulasi (SGF, pH 2,0) atau cairan usus simulasi (SIF, 0,15% g/v garam empedu) (Source Leaf, Shanghai, Tiongkok) pada rasio volume 1:9. Campuran diinkubasi secara anaerobik pada pengocok (100 rpm) pada suhu 37°C selama 30, 60, 90, dan 120 menit. Sel biofilm diperlakukan dengan ultrasound selama 3 menit (40 kHz, 50 W, KQ-50B) untuk melepaskan sel biofilm. Penghitungan pelat pengenceran gradien dilakukan untuk mengukur bakteri yang hidup.
2.7 Analisis Hidrofobisitas Permukaan
Sel planktonik dan biofilm disiapkan menggunakan metode yang dijelaskan di atas. Suspensi bakteri disesuaikan dengan OD600 sebesar 0,4 (A0). 1 mL xilena ditambahkan ke dalam 3 mL suspensi bakteri, dan campuran tersebut diaduk selama 1 menit. Campuran tersebut diinkubasi pada suhu 37°C selama 20 menit, dan OD600 dari fase air (A1) diukur. Persentase hidrofobisitas dihitung menggunakan rumus: Hidrofobisitas (%) = (1 – A1/A0) × 100 (Berkes et al. 2020 ; Echresh et al. 2024 ).
2.8 Uji Adhesi
Berdasarkan metode Qiu dan Zhang, uji adhesi dilakukan dengan modifikasi minor (Berkes et al. 2020 ; Qiu et al. 2024 ; Zhang, Meng, et al. 2022 ). Sel Caco-2 disemai ke dalam pelat 12 sumur dan diinkubasi pada suhu 37°C dalam atmosfer 5% CO2 . Media kultur disegarkan setiap dua hari hingga terbentuk lapisan tunggal yang konfluen. Sel-sel kemudian dicuci sekali dengan DPBS. Setiap sumur diperlakukan dengan 800 μL suspensi bakteri, disiapkan seperti dijelaskan di atas, dan diinkubasi selama 1,5 jam pada suhu 37°C dalam atmosfer 5% CO2 . Bakteri yang tidak melekat dihilangkan dengan mencuci sumur dua kali dengan PBS setelah inkubasi. Sel-sel dilisiskan dengan 1% Triton X-100 selama 10 menit, dan bakteri yang melekat diukur menggunakan metode pelat pengenceran gradien. Kapasitas adhesi bakteri dihitung menggunakan rumus berikut:
![]()
2.9 Analisis Potensi Zeta
Sel planktonik dan biofilm disiapkan menggunakan metode yang dijelaskan di atas. Potensi zeta sel bakteri planktonik dan sel biofilm diukur menggunakan instrumen elektroforesis partikel (Zetasizer Nano-ZS, Malvern Panalytical, Malvern, Inggris) (Hojjati et al. 2020 ; Qiu et al. 2024 ).
2.10 Ekstraksi Biofilm dengan EPS
Persiapan biofilm dilakukan dengan menggunakan metode yang dijelaskan di atas. Suspensi biofilm diperlakukan dengan ultrasonik selama 3 menit (40 kHz, 50 W), diikuti dengan sentrifugasi pada 10.000 rpm dan 4°C selama 25 menit untuk memisahkan EPS dari sel (Homero et al. 2021 ). Supernatan yang diperoleh setelah sentrifugasi dibagi menjadi tiga volume yang sama untuk analisis komponen EPS (polisakarida, protein, dan DNA).
2.11 Ekstraksi dan Kuantifikasi Polisakarida
Supernatan yang mengandung EPS dicampur dengan etanol pada rasio volume 1:3 dan didinginkan pada suhu 4°C selama 18 jam untuk mengendapkan polisakarida. Polisakarida yang diendapkan dikumpulkan dengan sentrifugasi dan diukur menggunakan metode fenol-asam sulfat (Mathivanan et al. 2023 ). Larutan polisakarida, larutan fenol 5% (b/v), dan H2SO4 pekat dicampur pada rasio volume 1:1: 5 . Campuran diinkubasi dalam kegelapan pada suhu ruangan selama 30 menit. Kepadatan optik pada 490 nm (OD 490 ) diukur.
2.12 Kuantifikasi EPS dengan Protein dan DNA
Kandungan protein ekstraseluler diukur menggunakan Enhanced BCA Protein Assay Kit (Beyotime, Tiongkok). DNA diekstraksi menggunakan DNeasy PowerSoil Pro Kit (Qiagen, Jerman) dan diukur dengan spektrofotometer mikro-ultraviolet NanoDrop 2000 (Thermo Scientific, AS) (Lin et al. 2023 ).
2.13 Uji Transkripsi
Total RNA dari sel planktonik Ligilactobacillus salivarius Li01 dan sel biofilm diekstraksi menggunakan Reagen TRIzol atau RNeasy Mini Kit (Qiagen), diukur dan dinilai kualitasnya menggunakan Agilent 2100/2200 Bioanalyzer, NanoDrop, dan gel agarosa 1%. RNA (300–500 ng) dihibridisasi dengan probe DNA untai tunggal yang menargetkan rRNA, diikuti oleh pencernaan rRNA dan probe. RNA yang tersisa dimurnikan dengan RNA Clean Beads, difragmentasi dengan kation divalen, dan ditranskripsi balik menjadi cDNA menggunakan primer acak. Selama sintesis untai kedua, penggabungan dUTP memungkinkan fosforilasi 5′ dan adenilasi 3′. Adaptor sekuensing ditambahkan ke kedua ujung cDNA, yang dipilih ukurannya dan dimurnikan dengan DNA Clean Beads. Amplifikasi PCR dilakukan dengan UDG untuk menghilangkan untai kedua yang mengandung dUTP, dan pustaka tersebut diamplifikasi menggunakan primer P5 dan P7. Pemeriksaan kontrol kualitas dilakukan, dan pustaka, masing-masing ditandai dengan indeks unik, digabungkan dan dikenakan sekuensing PE150 pada Illumina Novaseq6000 atau MGI2000, mengikuti pedoman pabrik (Kechin et al. 2017 ; Trapnell et al. 2010 ).
2.14 Analisis Data Urutan Transkriptom
Untuk memastikan data berkualitas tinggi, pembacaan sekuensing mentah dalam format FASTQ diproses menggunakan Cutadapt (v1.9.1) untuk menghilangkan sekuens teknis, seperti adaptor, primer PCR, atau fragmennya, serta basa dengan skor kualitas phred di bawah 20. Parameter yang digunakan mencakup tingkat kesalahan 0,1, tumpang tindih adaptor minimum 1 bp, panjang sekuens minimum 75 bp, dan proporsi N maksimum 0,1. Selanjutnya, genom referensi Li01 diindeks menggunakan Bowtie2 (v2.2.6), dan pembacaan bersih diselaraskan dengan genom referensi menggunakan perangkat lunak yang sama. Tingkat ekspresi gen kemudian diperkirakan dengan HTSeq (v0.6.1p1), menggunakan transkrip yang dikonversi dari file anotasi GFF ke format FASTA dan diindeks sebagai referensi. Analisis ekspresi diferensial dilakukan menggunakan paket DESeq2 Bioconductor, yang menerapkan model distribusi binomial negatif. Gen dengan nilai p yang disesuaikan ( p adj) < 0,05, dikoreksi menggunakan metode Benjamini dan Hochberg untuk mengendalikan tingkat penemuan palsu, diidentifikasi sebagai terekspresi secara diferensial. Untuk pengayaan fungsional, GOSeq (v1.34.1) digunakan untuk mengidentifikasi istilah Gene Ontology (GO) yang diperkaya secara signifikan ( p < 0,05). KEGG (Kyoto Encyclopedia of Genes and Genomes) adalah kumpulan basis data yang membahas genom, jalur biologis, penyakit, obat-obatan, dan zat kimia ( http://en.wikipedia.org/wiki/KEGG ). Kami menggunakan skrip internal untuk memperkaya gen ekspresi diferensial yang signifikan dalam jalur KEGG.
2.15 Analisis Statistik
Setiap percobaan diulang tiga kali, dan hasilnya ditunjukkan sebagai mean ± simpangan baku (SD). * p < 0,05, ** p < 0,01, *** p < 0,001. Kami menggunakan uji t Student atau uji ANOVA satu arah untuk analisis statistik, dengan GraphPad Prism (versi 9.4.1).
3 Hasil dan Pembahasan
3.1 Pertumbuhan Biofilm dan Pengaruh pH dan Garam Empedu terhadap Pembentukan Biofilm
Pembentukan biofilm adalah proses dinamis dan multifaktorial yang dipengaruhi oleh kondisi lingkungan dan sifat intrinsik bakteri, termasuk waktu inkubasi, ketersediaan nutrisi, suhu, pH, karakteristik permukaan pembawa, dan sifat khusus strain (Guzmán-Soto et al. 2021 ; Salas-Jara et al. 2016 ). Seperti yang ditunjukkan pada Gambar 1A , setelah 12 jam inkubasi, B. longum , B. pseudocatenulatum , dan L. salivarius Li01 menunjukkan nilai OD melebihi 4ODc, yang menunjukkan kemampuan pembentukan biofilm yang kuat. Perkembangan biofilm bakteri umumnya berlangsung melalui empat fase berbeda: perlekatan awal, pembentukan arsitektur biofilm awal (perkembangan mikrokoloni), pematangan, dan dispersi (Kilic dan Bali 2023 ). Biomassa biofilm strain Bifidobacterium mencapai puncaknya pada 48 jam sebelum menurun. Biomassa biofilm L. salivarius Li01 terus meningkat hingga 60 jam, setelah itu menurun. Konsisten dengan penelitian sebelumnya, hasil kami menunjukkan bahwa biomassa biofilm meningkat terus menerus, mencapai maksimumnya, dan kemudian secara bertahap menurun karena penyebaran biofilm (Ding et al. 2019 ; Kilic dan Bali 2023 ). Dispersi biofilm dapat dikaitkan dengan penipisan nutrisi yang disebabkan oleh inkubasi yang berkepanjangan (Guzmán-Soto et al. 2021 ). Selain itu, ruang terbatas dalam sumur mikroplat dapat membatasi pertumbuhan mikroorganisme pembentuk biofilm. Perkembangan biofilm yang dinamis ini menyoroti strateginya untuk bertahan hidup di lingkungan dengan sumber daya terbatas dan memfasilitasi kolonisasi ceruk baru (Kilic dan Bali 2023 ).
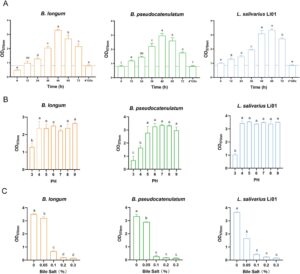
Dalam saluran pencernaan manusia, mikroorganisme menghadapi tantangan signifikan dari pH rendah dan konsentrasi garam empedu yang tinggi. Seperti yang ditunjukkan pada Gambar 1B , biomassa biofilm dari ketiga strain berkurang secara nyata pada pH 3 dibandingkan dengan kondisi pH lainnya. Stres asam mengganggu agregasi biofilm dengan mengurangi kadar komponen penting dalam matriks biofilm (Li et al. 2023 ). Stres asam mengubah sifat elektrostatik dan morfologi struktural matriks, yang selanjutnya memengaruhi stabilitas biofilm (di Biase et al. 2022 ). Namun, produksi biofilm mereka tetap tidak terpengaruh ketika dibudidayakan di lingkungan budidaya alkali. Selain itu, biomassa biofilm dari ketiga strain menurun tajam pada konsentrasi garam empedu 0,1% dan tetap rendah saat konsentrasi garam empedu meningkat lebih lanjut (Gambar 1C ). Temuan ini menyoroti sensitivitas pembentukan biofilm probiotik terhadap faktor lingkungan, khususnya pH rendah dan konsentrasi garam empedu tinggi di saluran pencernaan.
3.2 Pengamatan Morfologi Sel Biofilm dan Sel Plankton
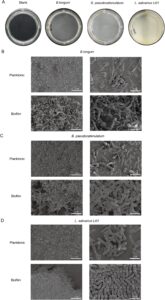
Mikroorganisme dalam saluran pencernaan manusia terutama ada sebagai biofilm (Kilic dan Bali 2023 ; Salas-Jara et al. 2016 ). Morfologi biofilm dari tiga strain pada pelat 12-sumur, seperti yang diamati secara makroskopis, ditunjukkan pada Gambar 2A . Biofilm menutupi dasar sumur secara seragam, melekat dengan kuat dan menahan penghilangan dengan pencucian PBS. Khususnya, biofilm yang dibentuk oleh L. salivarius Li01 lebih tebal dan lebih padat daripada dua strain lainnya. Untuk menyelidiki lebih lanjut struktur mikro biofilm, mikroskop elektron dilakukan (Gambar 2B,C ). Secara keseluruhan, biofilm ini menampilkan struktur yang rapat, berlapis-lapis, dan terorganisir secara tiga dimensi. Sebaliknya, mikroskop elektron bakteri planktonik mengungkapkan bahwa sel-sel tersebar, dengan morfologi yang terlihat jelas, dan fenomena agregasi timbal balik antara sel-sel bakteri tidak jelas. Sesuai dengan pengamatan makroskopis, biofilm L. salivarius Li01 menunjukkan sel-sel bakteri yang kontaknya sangat dekat satu sama lain dan memiliki struktur berlapis-lapis yang berbeda dibandingkan dengan biofilm dari dua galur lainnya. Struktur biofilm dapat meningkatkan penginderaan kuorum di antara mikroorganisme dan meningkatkan toleransi mereka terhadap kondisi lingkungan yang keras (Li et al. 2023 ).
3.3 Viabilitas Tiga Strain dalam Keadaan Planktonik dan Biofilm dalam Kondisi Gastrointestinal yang Disimulasikan
Memberikan probiotik yang cukup ke dalam usus dapat secara langsung meningkatkan kesehatan usus dan kesejahteraan secara keseluruhan. Namun, asam lambung, garam empedu, dan enzim pencernaan di dalam saluran gastrointestinal dapat merusak atau menonaktifkan probiotik, sehingga mengurangi efektivitasnya (Xu, Guo, et al. 2024 ). Biofilm dapat berfungsi sebagai kendaraan pengiriman dengan membungkus probiotik, sehingga menawarkan perlindungan yang lebih baik dari kondisi gastrointestinal yang keras (Salas-Jara et al. 2016 ). Studi ini menguji toleransi tiga strain bakteri dalam keadaan planktonik dan biofilm terhadap cairan gastrointestinal simulasi, seperti yang ditunjukkan pada Gambar 3 . Dalam pencernaan cairan lambung simulasi (SGF) (Gambar 3A ), keadaan biofilm sangat meningkatkan kelangsungan hidup bakteri dibandingkan dengan keadaan planktonik. Untuk B. longum , sel-sel planktonik dinonaktifkan sepenuhnya dalam waktu 30 menit, sementara sel-sel biofilm tetap merupakan sel yang dapat dideteksi hingga 1,5 jam. Demikian pula, biofilm B. pseudocatenulatum mengurangi kehilangan sel, mempertahankan 2,72 log 10 CFU/mL sel hidup setelah 1 jam pencernaan SGF, dibandingkan dengan inaktivasi lengkap sel planktonik. Untuk L. salivarius Li01, sel planktonik menunjukkan toleransi yang kuat terhadap cairan lambung dengan pengurangan minimal, sedangkan keadaan biofilmnya mempertahankan viabilitas yang hampir konstan selama 2 jam. Dalam pencernaan cairan usus yang disimulasikan (SIF) (Gambar 3B ), keadaan biofilm juga sangat meningkatkan kelangsungan hidup bakteri. Biofilm B. longum mempertahankan viabilitas yang hampir konstan selama 2 jam pencernaan cairan usus, sedangkan sel planktonik menunjukkan pengurangan 4,67 log 10 CFU/mL setelah 2 jam. Biofilm B. pseudocatenulatum memiliki kehilangan viabilitas yang lebih rendah (0,36 log 10 CFU/mL) setelah 2 jam, dibandingkan dengan pengurangan 1,83 log 10 CFU/mL pada sel planktonik. Selama jam pertama pencernaan SIF, kondisi biofilm L. salivarius Li01 menunjukkan resistensi yang lebih besar, dengan pengurangan jumlah sel hidup yang lebih kecil daripada kondisi planktonik. Namun, setelah 1,5–2 jam, jumlah sel hidup di kedua kondisi tersebut menyatu, kemungkinan karena kerusakan biofilm yang disebabkan oleh garam empedu.
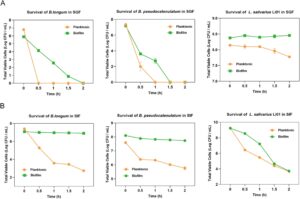
Secara keseluruhan, sel biofilm meningkatkan ketahanan probiotik terhadap cairan pencernaan, yang mengarah pada tingkat kelangsungan hidup yang lebih tinggi selama pencernaan gastrointestinal dibandingkan dengan bakteri planktonik, konsisten dengan temuan dari penelitian sebelumnya (Li et al. 2023 ; Zhang, Gu, et al. 2022 ). Peningkatan tingkat kelangsungan hidup yang diamati selama pencernaan gastrointestinal setelah pembentukan biofilm kemungkinan disebabkan oleh penghalang permeabilitas yang dibuat oleh biofilm. Karena struktur tiga dimensi biofilm, zat eksternal mungkin perlu melewati saluran matriks sebelum berinteraksi dengan bakteri di dalam biofilm. Selama pertumbuhan biofilm, bakteri menghasilkan sejumlah besar EPS, yang mengelilingi sel. Eksopolisakarida ini membatasi masuknya agen eksternal, sehingga meningkatkan resistensi bakteri terhadap pencernaan gastrointestinal (Karygianni et al. 2020 ; Toledo-Arana et al. 2001 ). Lebih jauh lagi, kepadatan sel yang tinggi dalam biofilm memfasilitasi interaksi sinergis, meningkatkan resistensi mereka terhadap lingkungan yang tidak menguntungkan (Yao et al. 2022 ). Bakteri di lapisan biofilm yang lebih dalam tidak aktif, yang berkontribusi pada ketahanan mereka terhadap tekanan lingkungan (Raad et al. 1998 ).
3.4 Perbandingan Kemampuan Adhesi dan Sifat Permukaan Sel Antara Sel Plankton dan Sel Biofilm
Adhesi tinggi probiotik pada epitel usus sangat penting untuk kolonisasi dan proliferasi cepatnya di dalam usus (Krausova et al. 2019 ). Kami mengembangkan model sel monolapis Caco-2 untuk menilai kapasitas adhesi usus dari ketiga strain (Gambar 4A ). B. longum menunjukkan laju adhesi yang secara signifikan lebih tinggi pada monolapis Caco-2 dalam keadaan biofilm daripada dalam keadaan planktonik ( p < 0,05). Selain itu, L. Salivarius Li01 menunjukkan laju adhesi 1,45 kali lipat lebih tinggi pada monolapis Caco-2 dalam keadaan biofilm daripada dalam keadaan planktonik. Namun, keadaan biofilm B. pseudocatenulatum menunjukkan laju adhesi yang secara signifikan lebih rendah pada monolapis Caco-2 dibandingkan dengan keadaan planktonik ( p < 0,01). Penelitian sebelumnya secara umum menunjukkan bahwa keadaan biofilm probiotik meningkatkan adhesi ke sel usus dibandingkan dengan keadaan planktonik (Berkes et al. 2020 ; Li et al. 2023 ; Zhang, Meng, et al. 2022 ).
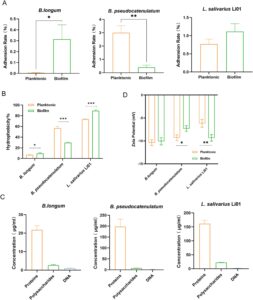
Adhesi probiotik pada sel-sel usus dapat diklasifikasikan menjadi dua jenis: adhesi non-spesifik dan adhesi spesifik reseptor. Di antara keduanya, adhesi non-spesifik terutama didorong oleh interaksi hidrofobik dan gaya elektrostatik (Monteagudo-Mera et al. 2019 ). Galur dengan hidrofobisitas yang lebih tinggi umumnya menunjukkan adhesi yang lebih kuat pada sel-sel epitel usus (Yang et al. 2023 ). Oleh karena itu, hidrofobisitas permukaan mungkin merupakan faktor penting dalam menentukan kemampuan adhesi probiotik. Seperti yang ditunjukkan pada Gambar 4B , hasil penelitian menunjukkan bahwa hidrofobisitas ketiga galur berkorelasi positif dengan adhesi mereka pada sel-sel epitel usus. Hidrofobisitas B. longum dan L. salivarius Li01 secara signifikan lebih tinggi dalam keadaan biofilm daripada dalam keadaan planktonik ( p < 0,05). Namun, sifat hidrofobisitas B. pseudocatenulatum dalam keadaan biofilm secara signifikan lebih rendah daripada sifat hidrofobisitas dalam keadaan planktonik ( p < 0,001), yang menjelaskan tingkat adhesi yang lebih rendah dalam keadaan biofilm. Sebagian besar penelitian juga menunjukkan bahwa probiotik dalam keadaan biofilm menunjukkan adhesi usus yang lebih kuat daripada yang dalam keadaan planktonik, yang mendorong proliferasi yang lebih baik di usus (Berkes et al. 2020 ; Li et al. 2023 ; Zhang, Meng, et al. 2022 ). Penelitian saat ini menunjukkan bahwa keadaan biofilm tidak selalu meningkatkan adhesi probiotik ke usus. Fenomena ini mungkin dipengaruhi oleh faktor-faktor seperti perbedaan spesifik strain, sifat hidrofobisitas, dan komposisi EPS. Misalnya, sebuah penelitian oleh Tahoun mengungkapkan bahwa polisakarida ekstraseluler menghambat kapasitas adhesi usus Bifidobacterium longum 105-A, sementara penelitian oleh Dertli menunjukkan efek serupa pada Lactobacillus johnsonii FI9785 (Dertli et al. 2015 ; Tahoun et al. 2017 ).
Biofilm adalah komunitas bakteri terstruktur yang terdiri dari bakteri yang diimobilisasi pada suatu permukaan, bersama dengan protein, DNA, dan polisakarida yang diproduksi sendiri. EPS ini dapat mengubah sifat fisikokimia permukaan sel, termasuk hidrofobisitas dan muatan permukaan, sehingga memengaruhi adhesi dan kolonisasi bakteri (Deepika et al. 2009 ; Dertli et al. 2015 ; Harimawan and Ting 2016 ). Interaksi antara EPS dan musin usus juga memainkan peran penting dalam adhesi bakteri (Karygianni et al. 2020 ). Dalam penelitian ini, kandungan protein, polisakarida, dan DNA EPS dari biofilm ketiga strain probiotik dianalisis secara kuantitatif (Gambar 4C ). Hasil yang diperoleh menunjukkan bahwa protein merupakan komponen dominan EPS di semua strain, sedangkan polisakarida dan DNA berkontribusi minimal. Savijoki et al. mengidentifikasi dan membandingkan protein terkait permukaan sel Lactobacillus rhamnosus GG dalam keadaan planktonik dan biofilm, menemukan bahwa ekspresi protein terkait adhesi meningkat secara signifikan (Savijoki et al. 2019 ). Namun, kandungan protein tinggi dalam B. pseudocatenulatum EPS (sekitar 200 μg/mL) dapat menyebabkan halangan sterik, membatasi paparan molekul adhesi ke permukaan usus, sehingga mengurangi kapasitas adhesi. Hasil di atas menunjukkan bahwa protein EPS mungkin merupakan faktor penting yang memengaruhi kapasitas adhesi usus dari ketiga strain probiotik. Selain itu, peran EPS dalam adhesi usus selama perkembangan biofilm perlu diselidiki lebih lanjut.
Potensial zeta permukaan dari tiga strain dianalisis untuk mengevaluasi efek EPS pada muatan permukaan sel biofilm. Seperti yang ditunjukkan pada Gambar 4D , potensi zeta B. longum tidak menunjukkan perbedaan signifikan antara keadaan planktonik dan biofilm, yang menunjukkan bahwa peningkatan adhesi biofilm B. longum dipengaruhi oleh faktor-faktor lain, seperti hidrofobisitas permukaan dan komponen EPS. Sel-sel biofilm B. pseudocatenulatum menunjukkan potensi zeta yang lebih tinggi daripada sel-sel planktoniknya ( p < 0,05), yang secara teoritis akan meningkatkan kemampuannya untuk melekat pada sel-sel usus melalui interaksi elektrostatik. Namun, hasil penelitian menunjukkan bahwa sel-sel biofilm B. pseudocatenulatum memiliki hidrofobisitas dan kemampuan adhesi yang lebih rendah dibandingkan dengan sel-sel planktoniknya. Hal ini dapat dikaitkan dengan kandungan tinggi dan muatan negatif yang relatif rendah dari zat-zat hidrofilik dalam EPS biofilmnya. Sel biofilm L. salivarius Li01 memiliki potensi zeta yang secara signifikan lebih rendah daripada sel planktonik ( p < 0,01), yang secara teoritis akan menyebabkan penurunan adhesi ke usus; namun, hasil menunjukkan bahwa adhesi dan hidrofobisitas biofilm Li01 sebenarnya meningkat. Hal ini mungkin disebabkan oleh muatan negatif yang kuat dan konsentrasi tinggi zat hidrofobik dalam EPS biofilm Li01. Oleh karena itu, konsisten dengan temuan Dertli (Dertli et al. 2015 ), pengukuran potensi zeta dalam penelitian ini menunjukkan bahwa EPS memengaruhi muatan permukaan probiotik.
Secara keseluruhan, adhesi probiotik pada sel epitel usus diatur oleh interaksi faktor yang kompleks, termasuk hidrofobisitas permukaan, komposisi dan struktur EPS, dan muatan permukaan bakteri, dengan masing-masing faktor berkontribusi secara berbeda tergantung pada strain spesifiknya.
3.5 Analisis Penyaringan dan Pengelompokan Gen yang Diekspresikan Secara Berbeda
Beberapa penelitian telah menunjukkan bahwa Lactobacillus salivarius Li01 memiliki potensi signifikan untuk mengobati berbagai penyakit (Fei et al. 2022 ; Xu, Qiu, et al. 2024 ; Yang et al. 2020 ; Zhuge et al. 2021 ). Temuan kami mengungkapkan bahwa Lactobacillus salivarius Li01 dalam keadaan biofilm menunjukkan adhesi yang lebih tinggi pada sel epitel usus dan toleransi gastrointestinal yang lebih besar dibandingkan dengan keadaan planktonik. Analisis transkriptomik L. sialicum Li01 dilakukan untuk menyelidiki mekanisme molekuler yang mendasari efek pembentukan biofilm pada karakteristik fisiologis. Data sekuensing disaring menggunakan ambang batas ≥ perubahan dua kali lipat dalam ekspresi gen dan nilai q (FDR, p adj) ≤ 0,05. Sebanyak 157 DEG diidentifikasi dalam keadaan biofilm L. salivarius Li01, termasuk 110 gen yang mengalami penurunan regulasi dan 47 gen yang mengalami peningkatan regulasi, dibandingkan dengan keadaan planktoniknya (Gambar 5A ). Analisis pengelompokan hierarkis DEG, berdasarkan nilai FPKM, menunjukkan perbedaan signifikan dalam ekspresi gen antara keadaan planktonik dan biofilm L. salivarius Li01 (Gambar 5B ). Hasilnya menyoroti perbedaan signifikan dalam ekspresi gen antara keadaan planktonik dan biofilm L. salivarius Li01, yang menekankan sifat kompleks dan adaptif dari pembentukan biofilm.
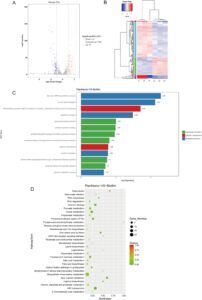
3.6 Analisis Pengayaan GO dan KEGG pada Gen yang Diekspresikan Secara Berbeda
Untuk lebih jauh mengeksplorasi fungsi biologis dan jalur molekuler DEG, kami melakukan analisis pengayaan GO dan Kyoto Encyclopedia of Genes and Genomes (KEGG). Analisis pengayaan GO dilakukan untuk mengidentifikasi fungsi biologis yang secara signifikan terkait dengan DEG, yang dikategorikan ke dalam fungsi molekuler, komponen seluler, dan proses biologis. Seperti yang ditunjukkan pada Gambar 5C , dalam kategori proses biologis, DEG terutama diperkaya dalam proses biosintesis IMP de novo, transpor asam amino, transpor peptida, dan transpor protein. Dalam kategori komponen seluler, DEG terutama dikaitkan dengan kompleks transporter kaset pengikat ATP (ABC), subunit pengikat substrat, dan membran plasma. Dalam kategori fungsi molekuler, DEG diperkaya dalam aktivitas gliseron kinase, pengikatan protein yang tidak terlipat, aktivitas sintase fosforibosilformilglikinamidina, dan aktivitas fosfoenolpiruvat-gliseron fosfotransferase.
Gen dalam organisme bekerja sama untuk melakukan fungsi biologis. Analisis pengayaan jalur menyoroti jalur biokimia, metabolik, dan pensinyalan utama yang terkait dengan DEG. Analisis pengayaan KEGG dari DEG dilakukan, dan 30 jalur teratas yang diperkaya secara signifikan dipilih untuk presentasi pada Gambar 5D . Tabel 1 menunjukkan semua jalur yang diperkaya secara signifikan dalam 30 jalur ini dengan nilai q < 0,05. Seperti yang ditunjukkan pada Gambar 5D dan Tabel 1 , DEG terutama diperkaya dalam jalur seperti transporter ABC, Satu kumpulan karbon oleh folat, Penginderaan kuorum, Metabolisme purin, Biosintesis arginin, Sistem fosfotransferase (PTS), RNA polimerase, dan jalur pensinyalan reseptor seperti NOD. Dalam keadaan planktonik, bakteri berkembang biak dengan cepat, bergantung pada sistem transportasi yang efisien untuk memperoleh nutrisi dan mempertahankan aktivitas metabolisme yang tinggi. Sebaliknya, sel biofilm memasuki “mode metabolisme rendah” untuk memastikan kelangsungan hidup dan stabilitas jangka panjang (Klopper et al. 2020 ; Zhao et al. 2023 ). Transporter ABC, yang umum ditemukan pada bakteri, berfungsi sebagai sistem transpor transmembran aktif yang didukung oleh hidrolisis ATP. Mereka melakukan berbagai peran fisiologis, seperti perolehan nutrisi, transpor molekul sinyal, dan pengeluaran toksin (Davidson dan Chen 2004 ). Selain itu, transporter ABC terkait erat dengan penginderaan kuorum (QS), mekanisme pengaturan utama untuk pembentukan dan pemeliharaan biofilm (Solano et al. 2014 ). Seperti yang ditunjukkan pada Tabel 1 , DEG yang terlibat dalam transporter ABC dan jalur QS terutama terkait dengan fungsi transporter ABC. Penurunan regulasi gen terkait transpor asam amino dan peptida menunjukkan bahwa bakteri terkait biofilm mengurangi ketergantungan mereka pada asam amino dan peptida eksternal. Aktivitas metabolisme bakteri dalam biofilm dapat menghasilkan produk limbah atau produk sampingan, termasuk asam organik dan metabolit toksik. Peningkatan regulasi gen transporter DMT dalam jalur QS menunjukkan bahwa transporter ini membantu menghilangkan zat-zat tersebut, berkontribusi pada stabilitas biofilm dan mencegah penghambatan metabolik (Jack et al. 2001 ; Tsuchiya et al. 2016 ). Selain itu, gen yang terkait dengan jalur metabolisme purin mengalami penurunan regulasi yang signifikan dalam keadaan biofilm dibandingkan dengan keadaan planktonik. Metabolisme purin sangat penting untuk sintesis nukleotida, yang mendorong proliferasi bakteri (Liu et al. 2024). Penurunan regulasi ini mencerminkan berkurangnya kebutuhan untuk pembelahan sel dan pertumbuhan pada bakteri terkait biofilm, yang menunjukkan laju proliferasi yang lebih lambat dan kebutuhan nukleotida yang lebih rendah. PTS, sistem transportasi karbohidrat dan fosforilasi utama pada bakteri, dapat memfasilitasi penyerapan karbohidrat dan fosforilasi untuk pemrosesan metabolisme (Deutscher et al. 2006 ). Adaptasi ini memungkinkan bakteri untuk secara efisien memanfaatkan sumber daya karbohidrat yang terbatas dalam biofilm, memastikan karbon dan energi yang cukup untuk stabilitas dan persistensi. Selain itu, dengan meningkatkan regulasi gen terkait tioredoksin dalam jalur pensinyalan reseptor seperti NOD, sel biofilm dapat mengurangi stres oksidatif dalam biofilm dan mempertahankan keseimbangan dinamis dengan sistem imun inang (Zeller dan Klug 2006 ).
| Ketentuan | ID Gen | Catatan 2 Fc | Jenis | Fungsi |
|---|---|---|---|---|
| Pengangkut ABC | Li01_GM000158 | -1,189 | Turun | Protein pengikat ATP transporter ABC metionin |
| Li01_GM000159 | -1.601 | Turun | Transporter ABC permease | |
| Li01_GM000160 | -1,341 | Turun | Protein pengikat substrat transporter ABC dari keluarga MetQ/NlpA | |
| Li01_GM001445 | -2.070 | Turun | Transporter asam amino ABC permease | |
| Li01_GM001446 | -1.669 | Turun | Transporter asam amino ABC permease | |
| Li01_GM001447 | -1.412 | Turun | Protein yang mengandung domain pengikat substrat transporter | |
| Li01_GM001448 | -1,167 | Turun | Protein pengikat ATP pengangkut glutamin | |
| Li01_GM001699 | -1,128 | Turun | Protein pengikat ATP transporter ABC | |
| Li01_GM001700 | -1,109 | Turun | Protein pengikat ATP transporter ABC | |
| Li01_GM001701 | -1.088 | Turun | Transporter ABC permease | |
| Li01_GM001702 | -1,103 | Turun | Transporter permease peptida ABC | |
| Li01_GM001703 | -1,007 | Turun | Protein pengikat substrat transporter peptida ABC | |
| Li01_GM001724 | -1,204 | Turun | Oligopeptida ABC superfamili ATP pengikat kaset transporter substrat protein pengikat | |
| Satu kumpulan karbon oleh folat | Li01_GM000628 | -1,231 | Turun | 5-formyltetrahidrofolat siklo-ligase |
| Li01_GM000750 | -5.199 | Turun | Fosforibosilaminoimidazolkarboksamida formiltransferase/IMP siklohidrolase bifungsional | |
| Li01_GM000749 | -4.955 | Turun | Fosforibosilglisinamida formiltransferase | |
| Li01_GM000852 | -1,083 | Turun | Ligase format-tetrahidrofolat | |
| Penginderaan kuorum | Li01_GM000353 | 1.205 | Naik | Transporter keluarga DMT |
| Li01_GM001702 | -1,103 | Turun | Transporter permease peptida ABC | |
| Li01_GM001700 | -1,109 | Turun | Protein pengikat ATP transporter ABC | |
| Li01_GM001703 | -1,007 | Turun | Protein pengikat substrat transporter peptida ABC | |
| Li01_GM001701 | -1.088 | Turun | Transporter ABC permease | |
| Li01_GM001699 | -1,128 | Turun | Protein pengikat ATP transporter ABC | |
| Li01_GM001724 | -1.203 | Turun | Oligopeptida ABC superfamili ATP pengikat kaset transporter substrat protein pengikat | |
| Metabolisme purin | Li01_GM001316 | -1.218 | Turun | Xantin fosforibosiltransferase |
| Li01_GM000751 | -5.357 | Turun | Fosforibosilamin–glisin ligase | |
| Li01_GM000750 | -5.198 | Turun | Fosforibosilaminoimidazolkarboksamida formiltransferase/IMP siklohidrolase bifungsional | |
| Li01_GM000748 | -4.846 | Turun | Siklo-ligase fosforibosilformilglisinamidin | |
| Li01_GM000749 | -4.955 | Turun | Fosforibosilglisinamida formiltransferase | |
| Li01_GM000747 | -4.283 | Turun | Amidofosforibosiltransferase | |
| Li01_GM000746 | -3.846 | Turun | Subunit sintase fosforibosilformilglikinamidina PurL | |
| Li01_GM000743 | -2,964 | Turun | Sintase fosforibosilaminoimidazol suksinokarboksamida | |
| Li01_GM000745 | -3.544 | Turun | Subunit sintase fosforibosilformilglikinamidina PurQ | |
| Biosintesis arginin | Li01_GM000326 | 1.579 | Naik | Argininosuksinat liase |
| Li01_GM000327 | 1.081 | Naik | Argininosuksinat sintase | |
| Sistem Fosfotransferase (PTS) | Li01_GM000106 | 1.198 | Naik | Subunit pengangkut mannosa/fruktosa/sorbosa PTS IIC |
| Li01_GM000107 | 1.347 | Naik | Subunit IID keluarga transporter mannosa/fruktosa/sorbosa PTS | |
| Li01_GM000802 | 1.136 | Naik | Subunit pengangkut galaktitol PTS IIC | |
| Li01_GM001978 | 1.714 | Naik | Subunit pengangkut glusitol/sorbitol PTS IIA | |
| Li01_GM001979 | 1.537 | Naik | PTS pengangkut glusitol/sorbitol subunit IIB | |
| Li01_GM001980 | 1.374 | Naik | PTS glukitol/sorbitol transporter subunit IIC | |
| RNA polimerase | Li01_GM000218 | -1.428 | Turun | Subunit beta RNA polimerase yang diarahkan DNA |
| Li01_GM000217 | -1.260 | Turun | Subunit beta RNA polimerase yang diarahkan DNA | |
| Jalur pensinyalan reseptor mirip NOD | Li01_GM001123 | 1.070 | Naik | Tioredoksin |
Catatan: Gen yang diekspresikan secara diferensial (DEG) diidentifikasi menggunakan kriteria berikut: |Log 2 Fold Change| ≥ 1 dan nilai-q ≤ 0,05. DEG dengan Log 2 Fold Change ≥ 1 dianggap mengalami peningkatan regulasi, dan DEG dengan Log 2 Fold Change ≤ − 1 dianggap mengalami penurunan regulasi dalam keadaan biofilm dibandingkan dengan keadaan planktonik. Singkatan: transporter ABC, transporter kaset pengikat ATP; Log 2 Fc, Log 2 Fold Change.
Singkatnya, dalam keadaan biofilm, Li01 mengurangi ketergantungannya pada sumber daya eksternal dan memastikan kelangsungan hidup jangka panjang dalam kondisi gastrointestinal yang keras melalui pemrograman ulang metabolisme, optimalisasi transportasi, dan pemanfaatan karbohidrat yang efisien.
4 Kesimpulan
Studi ini memberikan analisis komprehensif tentang karakterisasi fisiologis antara keadaan planktonik dan biofilm dari Ligilactobacillus salivarius Li01, Bifidobacterium longum , dan Bifidobacterium pseudocatenulatum . Pembentukan biofilm meningkatkan kelangsungan hidup semua strain dalam kondisi gastrointestinal yang disimulasikan, memberikan perlindungan yang lebih besar terhadap keasaman lambung dan garam empedu dibandingkan dengan rekan-rekan planktonik mereka. Lebih jauh lagi, pembentukan biofilm memengaruhi sifat-sifat khusus strain, termasuk adhesi usus dan sifat permukaan. L. salivarius Li01 dan B. longum menunjukkan peningkatan adhesi, sedangkan B. pseudocatenulatum menunjukkan adhesi yang berkurang karena hidrofobisitas yang lebih rendah dalam keadaan biofilm. Oleh karena itu, keadaan biofilm tidak secara universal meningkatkan adhesi probiotik karena sifat-sifat khusus strain. Analisis transkriptomik L. salivarius Li01 mengungkapkan perubahan ekspresi gen yang berbeda antara keadaan biofilm dan planktonik, khususnya dalam jalur yang terkait dengan transportasi nutrisi, adaptasi metabolik, dan penginderaan kuorum. Perubahan-perubahan ini mengurangi aktivitas metabolik dan mengoptimalkan pemanfaatan nutrisi, sehingga meningkatkan ketahanan terhadap stres.
Secara keseluruhan, temuan ini menunjukkan bahwa keadaan biofilm probiotik mungkin lebih efektif dalam mendorong kolonisasi usus dan meningkatkan ketahanan terhadap cairan gastrointestinal dibandingkan dengan keadaan planktonik. Probiotik pembentuk biofilm menawarkan keuntungan yang lebih besar untuk pengiriman gastrointestinal dibandingkan dengan keadaan planktoniknya, dengan aplikasi potensial dalam mengobati dan mencegah penyakit gastrointestinal. Namun, penelitian ini menyelidiki karakteristik biofilm dari hanya tiga galur probiotik, yang mungkin tidak mewakili seluruh jenis spesies probiotik. Penelitian di masa mendatang harus melibatkan galur probiotik yang lebih luas untuk mengeksplorasi manfaat pembentukan biofilm secara lebih komprehensif.

