
ABSTRAK
Sejalan dengan prinsip-prinsip bioekonomi sirkular, studi ini mengeksplorasi penggunaan produk sampingan pembuatan anggur sebagai sumber senyawa fenolik bioaktif. Kulit dan biji dari varietas anggur Tempranillo dan Graciano dikondisikan untuk menyiapkan minuman kaya fenolik. Untuk mempelajari sifat hipoglikemiknya, uji coba percontohan dilakukan untuk mengevaluasi glikemia pasca makan setelah mengonsumsi minuman berbasis produk sampingan anggur (WBB). Glikemia pasca makan dari 10 orang dewasa sehat diukur setelah mengonsumsi: (i) air + larutan gula, (ii) WBB + larutan gula, dan (iii) WBB + air. Secara paralel dengan pengukuran glukosa darah, sampel darah juga dikumpulkan menggunakan kartu bercak darah kering untuk menentukan metabolit fenolik dengan UHPLC-QqQ-MS/MS. Meskipun kadar glukosa darah cenderung menurun setelah intervensi WBB, perubahan ini tidak signifikan secara statistik terkait dengan variabilitas antarindividu. Para relawan yang menunjukkan penurunan kadar glukosa darah diklasifikasikan sebagai “responden”, dan mereka yang tidak menunjukkan perubahan diklasifikasikan sebagai “non-responden”. Produk sampingan anggur dapat digunakan secara efektif dalam formulasi minuman fungsional untuk meningkatkan kandungan senyawa bioaktif dan mengelola glukosa pasca makan pada beberapa individu.
1 Pendahuluan
Pemulihan produk sampingan agri-food, yang berasal dari pemrosesan sayuran, untuk penilaian ulang sebagai bahan makanan fungsional sejalan dengan prinsip bioekonomi sirkular. Makanan fungsional yang berkelanjutan sangat dihargai karena dampak lingkungannya yang lebih rendah dan manfaat kesehatan yang ditingkatkan dibandingkan dengan makanan konvensional [ 1 , 2 ]. Produk sampingan yang dihasilkan dari pemrosesan tanaman mempertahankan sejumlah besar senyawa bioaktif dari bahan baku asli, menjadikannya sumber bahan yang berharga untuk pengembangan makanan fungsional [ 1 – 4 ]. Sebuah publikasi baru-baru ini oleh kelompok kami menunjukkan bahwa proses pembuatan anggur menghasilkan berbagai produk sampingan padat yang kaya fenol. Ini termasuk batang dan pomace anggur (campuran kulit dan biji), dengan kulit anggur merah sangat kaya akan antosianin dan biji menjadi sumber senyawa fenolik tak berwarna yang sangat baik, terutama flavan-3-ol [ 5 ].
Produk sampingan anggur dapat digunakan secara langsung dalam formulasi makanan sebagai bahan setelah pemrosesan minimal, seperti pengeringan, penggilingan, atau pengayakan, atau dapat digunakan sebagai ekstrak setelah mengonsentrasikan senyawa bioaktifnya [ 1 , 6 ]. Pilihan pertama lebih ramah lingkungan karena menghasilkan limbah kimia yang rendah atau dapat diabaikan. Namun, pilihan ini kurang populer karena dapat menimbulkan atribut sensori negatif pada produk akhir. Formulasi makanan baru menggunakan jenis produk sampingan ini diharapkan dapat membuka peluang baru di berbagai bidang seperti keberlanjutan lingkungan, memperkuat penerapan bioekonomi sirkular, inovasi makanan, dan kesehatan dengan menawarkan alternatif alami untuk pencegahan penyakit kronis [ 1 , 2 , 4 ]. Atribut sehat dari produk sampingan agro-pangan telah dibuktikan dalam penelitian terkini. Misalnya, menambahkan tepung ampas anggur ke dalam biskuit akan meningkatkan tingkat (poli)fenol dan serat makanan, sehingga memberikan kontribusi positif terhadap asupan harian komponen bioaktif ini [ 1 ], sesuatu yang telah dikaitkan dengan penurunan risiko penyakit kronis seperti diabetes [ 6 – 8 ].
Penyakit kronis terkait erat dengan faktor gaya hidup, dengan pola makan menjadi aspek utama [ 9 ]. Pola makan tinggi karbohidrat olahan meningkatkan risiko perubahan glukosa metabolik. Misalnya, konsumsi makanan dengan indeks glikemik tinggi secara sering menyebabkan episode hiperglikemia pasca makan berulang, meningkatkan kemungkinan terjadinya serangkaian disfungsi metabolik yang pada akhirnya dapat berkembang menjadi diabetes tipe-2 [ 9 ]. Oleh karena itu, mengurangi kadar glukosa darah tinggi dengan mengelola penyerapan/metabolisme glukosa selama proses pencernaan membantu mencegah timbulnya dini gangguan metabolik yang terkait dengan manajemen glukosa pasca makan. Dalam konteks ini, menjaga homeostasis glukosa sangat penting untuk mengurangi risiko diabetes akibat hiperglikemia pasca makan. Lebih jauh lagi, paparan jangka panjang terhadap kadar glukosa darah tinggi dapat menyebabkan stres oksidatif dan peradangan, yang selanjutnya berkontribusi pada perkembangan gangguan metabolik [ 3 , 9 ]. Oleh karena itu, mengelola kadar glukosa selama periode pasca makan dapat mengurangi risiko timbulnya masalah metabolik lebih lanjut.
Sifat antidiabetik dari produk sampingan anggur, khususnya ampas anggur, telah diteliti dalam penelitian sebelumnya [ 1 , 6 ]. Berbagai mekanisme pengaturan glukosa oleh (poli)fenol ampas anggur telah diusulkan, termasuk pengurangan penyerapan glukosa di usus, penghambatan aktivitas enzim pencernaan, modulasi pelepasan glukosa dari hati, peningkatan sensitivitas insulin, stimulasi sekresi insulin, modulasi jalur pensinyalan intraseluler, dan ekspresi gen [ 3 , 6 ]. Namun, tidak ada penelitian ini yang mempertimbangkan analisis metabolit fenolik darah selama keadaan pasca makan pada manusia untuk menentukan peran potensialnya dalam manajemen metabolisme glukosa.
Sejauh pengetahuan kami, belum ada penelitian sebelumnya yang meneliti efektivitas produk sampingan anggur sebagai bahan fungsional untuk pengendalian glukosa darah selama keadaan pasca makan pada manusia. Dengan mempertimbangkan kesenjangan ini, kami mengusulkan untuk meneliti fungsi minuman berbahan dasar produk sampingan anggur (WBB) yang kaya akan senyawa (poli)fenolik yang sangat beragam untuk mengendalikan kadar glukosa darah pasca makan setelah asupan akut larutan gula pada individu yang sehat. Secara paralel, konsentrasi metabolit biologis fenol dalam sampel darah selama periode pasca makan ditentukan untuk menilai peran potensialnya dalam mengatur glikemia pasca makan. Kehadiran metabolit fenolik WBB dalam darah manusia selama periode pasca makan mungkin terlibat dalam modulasi jalur metabolisme yang bertanggung jawab atas regulasi metabolisme glukosa setelah asupan gula tinggi.
2 Bahan dan Metode
2.1 Bahan Kimia dan Reagen
Metanol (kadar HPLC), asam format (kadar HPLC), asetonitril (kadar HPLC), dan HCl dibeli dari VWR Chemicals BDH Prolabo (Leuven, Belgia). Airnya berkualitas Milli-Q (Millipore Corp, Bedford, MA, AS). Standar komersial quercetin, quercetin-3-glukuronida, trans- resveratrol, trans- resveratrol-glukosida, (−)-epicatechin, dimer B1 dan B2, dan 3- O -glukosida dari cyanidin, delphinidin, malvidin, peonidin, petunidin, isorhamnetin, dan syringetin dibeli dari Extrasynthese (Genay, Prancis). (+)-Katekin, asam p- hidroksibenzoat, asam 3,4-dihidroksibenzoat (asam protokatekuat), asam p -kumarat, asam galat, asam kafeat, asam ferulat, asam vanilat, asam siringat, matairesinol, dan sekoisolariciresinol diperoleh dari Sigma–Aldrich (St. Louis, AS). Asam kaftarat dan kaempferol-3-glukosa dibeli dari Purifa-Cymit (Barcelona, Spanyol). Naringerin dan asam kutarat masing-masing dibeli dari Fluochem (Hadfield, Inggris) dan Phytolab (Madrid, Spanyol). Asam 4,4- Bis (4-hidroksifenil)valerat (Sigma–Aldrich), 5-(3′,4′-dihidroksifenil)-δ-valerolakton (TransMIT, Gießen, Jerman), asam 3-(3,4-dihidroksifenil)propionat dan asam 3,4-dihidroksifenilasetat (Alfa Aesar, MA, AS), asam 3-(3-hidroksifenil)propionat (Biosynth Carbosynth, Compton, Inggris), asam hipurat (HA) dan asam 3-fenilpropionat (Thermo Fisher Scientific, Walthman, MA, AS), katekol (TCI, Tokyo, Jepang), pirogalol (Glentham Life Sciences, Corsham, Inggris), dan galokatekin (Target Mol, MA, AS). Larutan stok masing-masing standar disiapkan dalam metanol (1000 mg/L) dan disimpan pada suhu −20°C.
2.2 Pengolahan dan Analisis Minuman Berbahan Dasar Produk Sampingan Anggur
Produk sampingan anggur (kulit dan biji) yang digunakan sebagai bahan untuk pembuatan WBB diperoleh dari ampas anggur beku-kering dari kultivar anggur merah Tempranillo dan Graciano, yang merupakan ciri khas daerah penghasil anggur La Rioja. Produk sampingan anggur (panen 2021) dikumpulkan di kilang anggur eksperimental Instituto de Ciencias de la Vid y el Vino (ICVV, La Rioja, Logroño, Spanyol). Pemilihan varietas anggur ini karena kemungkinan adanya residu alkohol, sampel ampas anggur dikeringkan beku dalam Lyophilizer Telstar LyoQuest-85 (Terrassa, Spanyol). Setelah dikeringkan beku-kering, ampas anggur yang dikeringkan diayak untuk menghasilkan dua fraksi: kulit dan biji. Semua sampel yang dikeringkan (kulit dan biji) digiling (penggilingan analitis dasar IKA, Staufen, Jerman), diayak ( ø 0,5 mm), dan disimpan pada suhu −80°C hingga digunakan untuk formulasi WBB.
Empat formulasi WBB dieksplorasi untuk mencapai keseimbangan optimal antara penerimaan sensoris dan pemaksimalan konsentrasi (poli)fenol. WBB disiapkan menggunakan jumlah air mineral alami yang tetap, pengental (Resource Clear, Nestle Health Science), dan persentase yang berbeda dari kulit dan biji liofilisasi yang diayak (Tabel 1 ). Setiap formula WBB disiapkan dengan menimbang bahan-bahan kering dan mencampurnya dengan air melalui pengadukan manual yang kuat sebelum asupan WBB. Penambahan pengental membantu menstabilkan minuman dengan memperlambat pemisahan kulit dan biji (produk sampingan) dari fase air.
| Perumusan WBB | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Kulit Tempranillo (%) | 2.5 | 5.0 | 2.0 | 4.0 |
| Kulit Graciano (%) | 2.5 | 5.0 | 2.0 | 4.0 |
| Biji anggur (%) | – | – | 1.0 | 2.0 |
| Total produk sampingan anggur (%) | 5.0 | 10 | 5.0 | 10 |
| Pengental (%) | 0.4 | 0.4 | 0.4 | 0.4 |
| Air (%) | 94.6 | 89.6 | 94.6 | 89.6 |
| Konsentrasi (mg/200 mL WBB) | ||||
| Jumlah malvidin | 45,64 ± 2,38 jam | 91,29 ± 4,75 detik | 36,90 ± 0,01 miliar | 73,79 ± 0,02 hari |
| Jumlah petunidin | 9,59 ± 0,39 per menit | 19,19 ± 0,78 miliar | 7,73 ± 0,002 satuan | 15,45 ± 0,003 miliar |
| Jumlah delphinidin | 15,57 ± 0,45 per menit | 31,14 ± 0,90 miliar | 12,52 ± 0,003 satu | 25,04 ± 0,01 detik |
| Jumlah peonidin | 8,70 ± 0,59 per menit | 17,41 ± 1,18 miliar | 6,98 ± 0,002 satuan | 13,96 ± 0,005 miliar |
| Jumlah total sianidin | 1,72 ± 0,08 | 3,43 ± 0,17 | 1,38 ± 0,0004 | 2,76 ± 0,001 |
| Jumlah Pelargonidin | 0,02 ± 0,001 | 0,03 ± 0,001 | 0,01 ± 0,000001 | 0,03 ± 0,00001 |
| Senyawa minor (vitisin dan pinotin A) | 0,51 ± 0,02 | 1,01 ± 0,03 | 0,41 ± 0,0002 | 0,82 ± 0,0004 |
| Jumlah antosianin | 81,75 ± 3,90 per menit | 163,49 ± 7,80 detik | 65,93 ± 0,02 miliar | 131,87 ± 0,04 hari |
| Jumlah total asam hidroksi sinamat | 1,76 ± ± 0,11 | 3,52 ± 0,21 | 1,58 ± 0,003 | 3,16 ± 0,01 |
| Jumlah total asam hidroksibenzoat | 2,13 ± 0,07 | 4,26 ± 0,14 | 3,13 ± 0,001 | 6,27 ± 0,001 |
| Jumlah asam fenolik | 3,89 ± 0,16 per menit | 7,78 ± 0,32 inci | 4,72 ± 0,003 satuan | 9,43 ± 0,01 miliar |
| Jumlah total fenil alkohol | 1,11 ± 0,17 | 2,22 ± 0,35 | 1,05 ± 0,002 | 2,09 ± 0,005 |
| Jumlah Flavonon | 0,04 ± 0,001 | 0,08 ± 0,003 | 0,03 ± 0,00002 | 0,07 ± 0,00004 |
| Jumlah mirisetin | 2,94 ± 0,18 | 5,87 ± 0,36 | 2,37 ± 0,001 | 4,74 ± 0,003 |
| Jumlah kuersetin | 10,28 ± 0,49 per menit | 20,55 ± 0,99 miliar | 8,38 ± 0,003 satu | 16,75 ± 0,01 miliar |
| Jumlah senyawa minor | 1,36 ± 0,06 | 2,72 ± 0,12 | 1,10 ± 0,001 | 2,21 ± 0,001 |
| Jumlah Flavonol | 14,57 ± 0,73 jam | 29,15 ± 1,46 miliar | 11,85 ± 0,005 satu | 23,70 ± 0,01 detik |
| Total turunan katekin | 1,84 ± 0,05 satu | 3,68 ± 0,10 inci | 3,55 ± 0,001 pon | 7,11 ± 0,001 miliar |
| Jumlah prosianidin | 2,95 ± 0,13 satuan | 5,90 ± 0,26 inci | 4,81 ± 0,002 satuan | 9,62 ± 0,004 miliar |
| Jumlah flavan-3-ol | 4,79 ± 0,08 satuan | 9,58 ± 0,16 inci | 8,36 ± 0,002 pon | 16,72 ± 0,003 detik |
| Jumlah total stilbene | 0,47 ± 0,01 satu | 0,94 ± 0,02 satuan | 0,38 ± 0,00005 satu | 0,77 ± 0,0001 satu |
| Jumlah lignan | 0,43 ± 0,02 | 0,87 ± 0,04 | 0,70 ± 0,001 | 1,41 ± 0,001 |
| Total fenol tak berwarna | 25,31 ± 0,98 per menit | 50,63 ± 1,96 miliar | 27,10 ± 0,005 satu | 54,20 ± 0,01 miliar |
| Total (poli)fenol | 107,06 ± 4,83 detik | 214,12 ± 9,66 detik | 93,03 ± 0,021 miliar | 186,06 ± 0,04 hari |
| Serat larut (pektin) | 265,60 ± 5,60a | 531,20 ± 11,20c | 332,00 ± 2,20 miliar | 664,00 ± 4,40 hari |
Catatan : Kandungan (poli)fenol dan serat larut (pektin) dalam 200 mL, setara dengan dosis yang dikonsumsi melalui asupan akut. Huruf yang berbeda menunjukkan perbedaan yang signifikan secara statistik di antara rata-rata kelompok berdasarkan uji perbedaan signifikan jujur (HSD) Tukey setelah ANOVA satu arah ( p < 0,05).
Metode untuk menentukan komposisi (poli)fenol dari kulit, biji, dan WBB dengan kromatografi cair yang digabungkan dengan spektrometri massa (HPLC-MS/MS) telah dilaporkan baru-baru ini oleh kelompok kami [ 5 ]. Komposisi (poli)fenol dari kulit dan biji tersedia dalam Tabel S1 . Penentuan kandungan pektin (serat larut) dalam kulit anggur dilakukan dengan menggunakan prosedur gravimetri mengikuti petunjuk dalam Mosele et al. [ 5 ]. Untuk ini, 1 g sampel kulit diaduk pada suhu 85°C selama 40 menit dengan 20 mL HCl 0,02 M dan kemudian disaring. Setelah filtrat mendingin hingga 30°C, etanol pada suhu 60°C (1:4, tersaring/etanol, v/v) ditambahkan dan kemudian disentrifugasi selama 30 menit pada 9000 rpm setelah diistirahatkan selama 24 jam pada suhu 4°C. Residu cair dibuang, dan residu padat yang tersisa dikeringkan pada suhu 55°C hingga mencapai berat konstan. Persentase pektin dalam kulit kemudian dihitung dengan mempertimbangkan berat kering sampel kulit dan berat kering residu padat yang diekstraksi (pektin).
2.3 Evaluasi Sensorik WBB
Penerimaan konsumen terhadap empat formulasi WBB yang berbeda (Tabel 1 ) dinilai oleh sekelompok 10 sukarelawan yang tidak terlatih (berusia 26–56 tahun), yang terdiri dari 50% wanita. Peserta dipilih berdasarkan tidak adanya perubahan persepsi penciuman dan rasa, alergi atau intoleransi terhadap anggur, serta tidak menggunakan obat yang dapat memengaruhi pengalaman sensorik. Hanya data mengenai usia dan jenis kelamin yang dikumpulkan sebagai informasi demografis. Para sukarelawan menguji keempat formulasi WBB pada hari yang sama dan mengevaluasi karakteristik utama seperti penampilan, rasa, aroma, rasa di mulut (tekstur), dan penerimaan keseluruhan, seperti yang sebelumnya ditetapkan oleh seorang ahli. Kelima kategori ini, bersama dengan deskriptor masing-masing, disajikan pada lembar rasa dengan skala garis intensitas (skala hedonik tak terstruktur berlabuh 9 poin, Gambar SF1 ) di mana “tidak ada persepsi” dinilai sebagai 1 dan “persepsi ekstrem” sebagai 9 [ 10 ]. Formulasi disajikan pada suhu 10°C dalam urutan acak dan diidentifikasi dengan kode internal.
Frekuensi relatif ( F ), intensitas relatif ( I ), dan rerata geometrik (GM) dari deskriptor yang berbeda dihitung untuk setiap formulasi WBB. GM ditentukan sebagai akar kuadrat dari produk I dan F , dinyatakan sebagai GM (%) = √( I × F ) × 100. Dalam konteks ini, ( I ) mewakili jumlah intensitas yang ditetapkan oleh panel untuk deskriptor tertentu, dibagi dengan intensitas maksimum yang mungkin untuk deskriptor itu, sementara ( F ) sesuai dengan berapa kali deskriptor disebutkan, dibagi dengan jumlah maksimum kali itu dapat disebutkan.
2.4 Studi Glikemia Darah Pasca Makan
2.4.1 Peserta
Sebuah studi postprandial percontohan manusia dilakukan dengan 10 orang dewasa yang sehat (50% perempuan, 26-46 tahun, IMC <25 kg/m 2 ) yang direkrut dari ICVV. Para relawan melaporkan tidak ada riwayat gangguan metabolisme glukosa (misalnya, diabetes, hiperinsulinemia, dan pradiabetes), tidak ada intoleransi atau alergi terhadap anggur atau produk berbasis anggur, dan tidak hamil, menyusui, atau perokok. Semua peserta menerima informasi tertulis dan lisan tentang tujuan penelitian, dan persetujuan yang diinformasikan diperoleh dari masing-masing untuk mengonfirmasi partisipasi sukarela mereka. Staf medis hadir selama setiap kunjungan untuk membantu pengambilan darah dan untuk mendukung relawan jika terjadi efek samping yang diakibatkan oleh puasa, WBB, dan/atau asupan gula. Tidak ada efek samping yang dilaporkan oleh relawan mana pun selama intervensi apa pun.
2.4.2 Intervensi Manusia
Desain studi percontohan disetujui oleh Komite Bioetika dan Keamanan Hayati dari Consejo Superior de Investigaciones Científicas (CSIC, Madrid, Spanyol) (kode internal 034/2023). Prosedurnya melibatkan intervensi dalam subjek yang dilakukan selama tiga hari terpisah. Selama setiap sesi, relawan menerima salah satu dari tiga perawatan oral yang berbeda, yang setiap sesi berjarak 7 hari (Gambar 1 ). Pada setiap hari intervensi, para relawan tiba di pusat setelah puasa 12 jam dan setelah mengikuti diet rendah (poli)fenol selama 48 jam. Untuk mendorong kepatuhan terhadap diet rendah polifenol, seorang ahli diet memberikan daftar makanan yang dikategorikan ke dalam tiga kelompok: diizinkan, diizinkan dalam jumlah yang sangat kecil, dan tidak diizinkan. Kelompok “tidak diizinkan” mencakup semua produk turunan anggur (anggur merah dan putih, jus, dan kismis), beri merah, kopi, teh, minyak zaitun extra virgin, bir, biji-bijian utuh, dan cokelat. Selain itu, para relawan menerima daftar makanan yang disarankan untuk disiapkan selama diet terbatas selama 2 hari. Pada masing-masing dari tiga kesempatan terpisah, setiap peserta menerima perawatan yang berbeda. Intervensi melibatkan asupan akut dari dua persiapan berbeda yang ditelan dalam waktu 5–10 menit: (i) air + larutan gula (30 g karbohidrat yang tersedia, disediakan sebagai sukrosa komersial yang dilarutkan dalam 50 mL air mineral); (ii) WBB + air; dan (iii) WBB + larutan gula (Gambar 1 ).
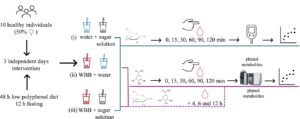
2.4.3 Pengambilan Sampel Darah
Sampel darah untuk menentukan glukosa dan metabolit biologis fenolik diperoleh melalui tusukan jari menggunakan lanset steril (kedalaman 21G-18 mm, Vitrex Medical, Denmark). Untuk memantau glikemia pasca makan, glukosa darah diukur pada menit ke-0, 15, 30, 60, 90, dan 120 setelah konsumsi menggunakan glukometer komersial (Contour XT, Bayer).
Untuk penentuan metabolit fenol, sampel darah dikumpulkan langsung pada kartu FTA DMPK-A (kertas saring DBS) (GB Healthcare, Buckinghamshire, Inggris) hingga seluruh lingkaran yang ditentukan pada kartu terisi. Untuk setiap relawan, sampel darah dikumpulkan pada menit ke-0, ke-15, ke-30, ke-60, ke-90, dan ke-120 setelah tiga intervensi, serta pada jam ke-4, ke-6, dan ke-12 setelah relawan mengonsumsi WBB + air (ii) dan WBB + larutan gula (iii) (Gambar 1 ). Sampel darah yang sesuai dengan 12 jam setelah intervensi (ii) dan (iii) dikumpulkan sendiri oleh relawan di rumah dengan mengikuti petunjuk yang diberikan. Untuk setiap pengambilan sampel, relawan mengisi empat lingkaran kertas saring DBS dengan sampel darah. Kartu DBS disimpan dalam desikator dalam gelap selama 15 hari hingga analisis kromatografi metabolit biologis fenol. Untuk konsentrasi glukosa dan senyawa fenolik dalam darah, luas tambahan di bawah kurva (iAUC) dihitung menggunakan metode trapesium, mengabaikan semua luas di bawah garis dasar.
2.5 Analisis Metabolit Fenolik Darah dengan Kromatografi Cair Kinerja Tinggi yang Digabungkan dengan Spektrometri Massa Tandem (UHPLC-QqQ-MS/MS)
2.5.1 Pretreatment Sampel Darah
Sampel darah yang dikumpulkan dalam kartu DBS diproses menurut metodologi yang dijelaskan oleh Yuste et al. [ 11 ]. Secara singkat, dua lingkaran penuh kartu DBS yang berisi sampel darah dilubangi menggunakan pelubang untuk memperoleh potongan yang lebih kecil, yang diekstraksi dengan 150 µL MeOH:H 2 O (50:50, v/v). Setelah disentrifugasi (14.000 rpm, 4°C, 15 menit), supernatan disuntikkan ke dalam sistem kromatografi. Setiap titik waktu pengumpulan darah (0, 15, 30, 60, 90, dan 120 menit dan 4, 6, dan 12 jam) dianalisis dalam duplikat menggunakan dua lingkaran kertas saring DBS yang mewakili satu replikasi.
2.5.2 UHPLC-QqQ-MS/MS
Metabolit fenol dalam sampel darah dianalisis dengan UHPLC-QqQ-MS/MS. Kromatografi cair dilakukan pada sistem Shimadzu Nexera (Shimadzu Corporation, Jepang), yang digabungkan dengan spektrometer massa QTRAP (AB Sciex 3200QTRAP, Sciex, AS). Pemisahan senyawa fenol dilakukan pada kolom Waters AcQuity BEH C18 (100 × 2,1 mm, ukuran partikel 1,7 µm; Waters, Milford, MA, AS) dengan VanGuardTM AcQuity BEH C18 Pre-Column (5 × 2,1 mm, ukuran partikel 1,7 µm; Waters). Dua metode kromatografi digunakan, satu untuk analisis metabolit antosianin dan yang lainnya untuk menganalisis senyawa fenolik lainnya. Kedua metode tersebut menggunakan laju alir 0,45 mL/menit dan volume injeksi sampel 2,5 µL. Suhu autosampler dan oven masing-masing ditetapkan pada 5 dan 40°C. Untuk pemisahan metabolit antosianin, fase gerak terdiri dari 2% asam format dalam air (Pelarut A) dan 2% asam format dalam asetonitril (Pelarut B). Untuk pemisahan senyawa fenolik lainnya, fase gerak adalah 0,1% asam format dalam air (Pelarut A) dan dalam asetonitril (Pelarut B).
Senyawa yang dielusi dianalisis menggunakan spektrometer massa triple quadrupole (qQq-MS/MS) yang dilengkapi dengan antarmuka elektrospray (ESI). ESI dioperasikan dalam mode ion positif [M–H] + untuk analisis metabolit antosianin dan dalam mode ion negatif [M–H] − untuk analisis metabolit fenol lainnya. Akuisisi data dilakukan menggunakan pemantauan reaksi berganda (MRM), di mana dua transisi MRM dipantau: satu untuk kuantifikasi dan yang kedua untuk konfirmasi. Tabel 2S memberikan rincian tentang waktu retensi ( t R ) dan transisi MRM dan parameter untuk setiap senyawa fenolik, termasuk potensi declustering (DP), potensi masuk (EP), potensi masuk sel tumbukan (CEP), energi tumbukan (CE), dan potensi keluar sel tumbukan (CXP) untuk setiap senyawa fenolik. Akuisisi data dilakukan dengan perangkat lunak Analyst 1.6.2 (AB Sciex, AS). Metabolit fenol dalam sampel darah diidentifikasi dengan membandingkan spektrum dan waktu retensi ( t R ) dengan standar yang disuntikkan secara eksternal. Senyawa yang standarnya tidak tersedia diidentifikasi sementara menggunakan transisi MRM dengan massa ion induk (M–H) dan pola fragmentasi MS khas yang dijelaskan dalam literatur. Beberapa senyawa dikuantifikasi menggunakan kurva kalibrasi standar komersial yang sesuai. Senyawa lainnya dikuantifikasi sementara menggunakan kurva kalibrasi standar dengan struktur kimia yang serupa. Semua kurva kalibrasi memiliki koefisien korelasi lebih besar dari 0,99 ( R 2 > 0,99).
2.6 Statistik
Analisis statistik dilakukan dengan menggunakan GraphPad Prism versi 6.0 untuk Windows (GraphPad Software, Boston, MA, USA). Data disajikan sebagai mean ± standard error of the mean (SEM) dari pengukuran independen yang dilakukan dalam rangkap dua. Analisis varians satu arah (ANOVA) digunakan untuk mengevaluasi perbedaan statistik ( p < 0,05) dalam mean iAUC di seluruh kelompok eksperimen (WBB + larutan gula, air + larutan gula, dan WBB + air), dengan mempertimbangkan semua relawan dan membandingkan responden dan non-responden. Ketika perbedaan signifikan terdeteksi, uji Tukey post hoc diterapkan untuk mengidentifikasi perbedaan berpasangan antara kelompok. Selain itu, hubungan linear antara kadar glukosa darah dan konsentrasi metabolit fenolik darah selama periode postprandial dievaluasi menggunakan koefisien korelasi Pearson ( r ). Korelasi ditafsirkan sebagai lemah ( r < 0,4), sedang (0,4 dan 0,8), atau kuat ( r > 0,8).
3 Hasil
3.1 Evaluasi Sensoris dan Pemilihan Minuman Berbasis Produk Sampingan Anggur (WBB)
Empat formulasi yang menggabungkan kulit anggur dan biji dari pomace anggur dalam proporsi yang berbeda disiapkan untuk pemilihan WBB untuk studi glikemia darah postprandial. Kriteria pemilihan didasarkan pada kombinasi kandungan (poli)fenol yang beragam dan tinggi tetapi juga menarik karena sifat organoleptiknya. Tabel 1 menunjukkan kandungan (poli)fenol dalam 200 mL setiap formulasi WBB, yang sesuai dengan dosis yang dicerna melalui setiap intervensi (asupan akut) (Gambar 1 ). Keragaman (poli)fenol yang luas diukur dengan UHPLC-MS/MS, antosianin menjadi fraksi utama, terutama dalam Formulasi 2 dan 4, yang sesuai dengan persentase fraksi kulit yang lebih tinggi yang digunakan sebagai bahan utama (Tabel 1 ). Mengenai fenol tak berwarna, flavonol adalah subfamili yang dominan, termasuk quercetin dan myricetin, dan flavan-3-ol, termasuk (epi)katekin dan prosianidin (Tabel 1 ). Kandungan serat larut (pektin) berhubungan dengan persentase kulit anggur yang lebih tinggi dalam formulasi, sesuai dengan Formula 2 dan 4, dengan total masing-masing 10% dan 8%.
Selain kandungan (poli)fenol dan serat larut, pemilihan formulasi WBB selanjutnya didasarkan pada evaluasi sensoriknya. Data untuk setiap atribut yang dievaluasi (penampakan, bau, rasa, dan tekstur, serta kualitas keseluruhan) bersama dengan deskriptor sensorik masing-masing disajikan dalam Tabel 2 , yang menawarkan wawasan tentang perbedaan utama dan persepsi konsumen di keempat formulasi. Penampilan terutama dipengaruhi oleh kecerahan dengan perbedaan yang signifikan secara statistik ( p < 0,05) yang diamati hanya antara Formulasi 1 dan 4, yang terakhir menunjukkan efek yang lebih jelas, mirip dengan persepsi yang meningkat dari tekstur berpasir (Tabel 2 ). Mengenai bau, deskriptor yang dievaluasi tidak menunjukkan perbedaan yang signifikan antara formulasi. Secara umum, nilai-nilai rendah diperoleh, menunjukkan karakteristik aroma nonspesifik dari keempat formulasi WBB. Profil pengecapan sangat dipengaruhi oleh keasaman, dengan perbedaan yang signifikan antara Formulasi 2 (10% kulit anggur) dan 3 (4% kulit anggur), yang sesuai dengan produk dengan persentase kulit tertinggi dan terendah, masing-masing. Namun, tren dalam atribut spesifik dicatat, yang menghasilkan skor serupa di keempat formulasi WBB.
| Perumusan | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Deskripsi sensorik * | Rata-rata ± SD | Rata-rata ± SD | Rata-rata ± SD | Rata-rata ± SD |
| Penampilan | ||||
| Kecerahan | 4,80 ± 2,10 detik | 6,20 ± 1,29 inci | 5,37 ± 1,56 inci | 7,04 ± 1,61 jam |
| merah muda-ungu | 7,55 ± 1,32 | 7,78 ± 1,54 | 6,16 ± 2,00 | 7,81 ± 1,52 |
| Kehomogenan | 5,99 ± 2,46 | 6,79 ± 2,50 | 7,44 ± 1,56 | 6,10 ± 1,98 |
| Kepadatan | 5,84 ± 2,46 | 6,65 ± 2,03 | 4,98 ± 2,74 | 6,88 ± 1,78 |
| berpasir | 7,51 ± 1,48 | 7,33 ± 1,58 | 6,15 ± 2,67 | 6,81 ± 1,72 |
| Bau | ||||
| Kulit anggur yang ditekan | 4,46 ± 2,55 | 5,81 ± 2,29 | 4,65 ± 1,63 | 5,20 ± 2,58 |
| Intensitas keseluruhan | 5,77 ± 2,49 | 5,67 ± 1,96 | 4,81 ± 2,53 | 6,64 ± 1,53 |
| Kualitas keseluruhan | 5,62 ± 2,46 | 5,88 ± 1,57 | 4,20 ± 2,50 | 6,35 ± 1,74 |
| Batang anggur | 3,54 ± 2,75 | 3,67 ± 2,91 | 3,01 ± 2,09 | 3,07 ± 2,48 |
| Rumputan | 3,95 ± 2,75 | 2,82 ± 2,73 | 2,80 ± 2,51 | 3,12 ± 2,56 |
| Asam | 2,62 ± 2,51 | 2,91 ± 2,86 | 2,61 ± 2,73 | 2,69 ± 2,60 |
| buah beri merah | 3,67 ± 3,23 | 2,96 ± 2,66 | 2,85 ± 2,87 | 3,59 ± 3,38 |
| Buah yang belum matang | 3,54 ± 3,23 | 2,90 ± 2,79 | 2,89 ± 2,59 | 2,51 ± 2,59 |
| Sitrat | 1,85 ± 1,89 | 1,49 ± 1,23 | 2,15 ± 2,47 | 1,95 ± 1,38 |
| Bunga | 2,67 ± 3,32 | 3,22 ± 2,78 | 3,06 ± 3,06 | 4,37 ± 3,11 |
| Mencicipi | ||||
| Kualitas keseluruhan | 4,50 ± 2,59 | 4,90 ± 2,59 | 4,46 ± 1,70 | 4,91 ± 2,03 |
| Manis | 2,28 ± 1,92 | 1,75 ± 1,78 | 1,84 ± 1,38 | 1,83 ± 2,19 |
| Garam | 1,23 ± 1,56 | 1,69 ± 2,51 | 2,17 ± 2,7 | 1,53 ± 2,39 |
| Asam | 5,30 ± 3,33 inci | 6,63 ± 2,95 per menit | 3,45 ± 2,07 miliar | 6,18 ± 2,73 inci |
| Pahit | 2,90 ± 3,24 | 3,31 ± 3,45 | 2,46 ± 3,14 | 3,20 ± 3,38 |
| Tekstur di mulut | ||||
| Rasa sepat | 3,60 ± 2,24 | 4,26 ± 2,72 | 3,07 ± 2,50 | 4,51 ± 2,70 |
| Tubuh | 5,42 ± 2,48 | 6,73 ± 1,65 | 4,22 ± 2,50 | 5,86 ± 2,49 |
| Kegigihan | 4,88 ± 2,45 | 6,62 ± 1,56 | 3,98 ± 2,07 | 6,24 ± 1,78 |
| Kekasaran | 3,19 ± 2,65 | 3,78 ± 3,16 | 3,12 ± 2,58 | 4,83 ± 3,32 |
| berpasir | 5,23 ± 2,76 jam | 7,08 ± 2,03 inci | 4,87 ± 2,90 per menit | 12,9 ± 6,8 miliar |
| Kualitas global | 5,00 ± 1,90 | 5,04 ± 1,78 | 4,66 ± 1,77 | 5,38 ± 1,87 |
Catatan : Penilaian hedonik rata-rata untuk penerimaan konsumen ( n = 10) dari deskriptor sensorik yang berbeda untuk formulasi WBB. * Huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang signifikan ( p < 0,05). Catatan : Angka yang dicetak tebal mencapai signifikansi statistik. Catatan : Angka yang dicetak miring mewakili kualitas global WBB dengan mempertimbangkan semua atribut WBB yang diteliti.
Berdasarkan hasil analisis sensorik, kecuali untuk persepsi kecerahan dan keasaman, memvariasikan suplementasi produk sampingan dalam kisaran 5%–10% tidak mengubah atribut sensorik minuman secara signifikan. Jadi, penambahan hingga 10% produk sampingan anggur (Formula 2 dan 4) tidak berdampak negatif pada atribut sensorik dibandingkan dengan Formula 1 dan 3 dengan 5% produk sampingan anggur-anggur (Tabel 1 ). Kecerahan minuman (Tabel 2 ) terutama dapat dikaitkan dengan senyawa (poli)fenol yang tertahan dalam kulit anggur setelah vinifikasi, terutama antosianin (Tabel 1 ). Tampaknya kandungan kulit anggur yang lebih tinggi meningkatkan kecerahan minuman WBB, tetapi efek ini hanya terlihat dengan adanya biji anggur. Ini mungkin menunjukkan interaksi yang meningkatkan kecerahan [ 12 ]. Selain menyebabkan kecerahan, senyawa fenolik juga memengaruhi rasa makanan, sering kali berkontribusi terhadap rasa pahit dan sepat [ 12 ]. Selain itu, persepsi keasaman yang nyata mungkin disebabkan oleh rendahnya atau tidak adanya kandungan gula dalam ampas anggur setelah fermentasi alkohol selama pembuatan anggur. Informasi terperinci tentang intensitas ( I , %), frekuensi ( F , %), dan media global (GM, %) dari setiap WBB disediakan dalam Tabel S3 .
Dengan demikian, data penerimaan konsumen dari empat minuman WBB yang diuji memandu keputusan kami untuk memilih Formulasi 4 (Tabel 1 ) untuk studi percontohan pada manusia. WBB yang dipilih mengandung 8% kulit anggur dan 2% biji. Dengan demikian, penyajian 200 mL WBB ini menyediakan rata-rata 187 mg total (poli)fenol, khususnya antosianin (132 mg), flavonol (24 mg), dan flavan-3-ol (17,2 mg) dan 664 mg serat larut (pektin) (Tabel 1 ).
3.2 Studi Kelebihan Glukosa pada Manusia: Glikemia Darah Pasca Makan
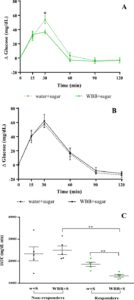
Untuk mengevaluasi potensi hipoglikemik WBB dalam keadaan pasca makan, kami menganalisis baik perjalanan waktu kadar glukosa darah dan iAUC untuk setiap intervensi akut (Gambar 1 ). Gambar 2A menunjukkan peningkatan glukosa darah (rata-rata ± SEM, n = 10) pada berbagai titik waktu (0, 15, 30, 60, 90, dan 120 menit) selama periode pasca makan. Seperti yang diharapkan, tidak ada peningkatan glukosa darah yang diamati ketika peserta mengonsumsi WBB + air (i) (Gambar 1 ), yang menunjukkan kandungan gula yang dapat diabaikan dalam minuman tersebut sebagai hasil dari fermentasi alkohol selama proses pembuatan anggur, sehingga membuat produk ini cocok untuk individu pradiabetes dan diabetes. Ketika membandingkan dua intervensi kelebihan glukosa (Gambar 1ii dan iii ), pola khas peningkatan glukosa darah yang sebelumnya dijelaskan pada orang dewasa sehat diamati, dengan kadar mencapai puncaknya 30 menit setelah asupan gula dan kemudian secara bertahap kembali ke garis dasar [ 13 , 14 ]. Dalam konteks ini, dalam penelitian kami, kadar glukosa darah pada menit ke-30 cenderung lebih rendah ketika larutan gula dikonsumsi bersamaan dengan WBB. Namun, perbedaan ini tidak signifikan secara statistik.

iAUC untuk glukosa darah [ 15 ] yang dihitung untuk setiap intervensi akut digambarkan dalam Gambar 2B . iAUC ini mencerminkan konsentrasi glukosa rata-rata waktu yang terakumulasi selama periode 2 jam pasca makan. iAUC yang lebih rendah diamati setelah asupan WBB + air dibandingkan dengan air + larutan gula. Namun, perbedaan ini tidak signifikan secara statistik. Ini mungkin merupakan konsekuensi dari variabilitas antar individu dalam respons glukosa darah setelah setiap perawatan, seperti yang diilustrasikan dalam Gambar 2C , yang menunjukkan variasi individu dalam iAUC antara intervensi air + larutan gula dan WBB + larutan gula (Gambar 1 ). Temuan ini mengarahkan kami untuk membentuk dua kelompok: individu yang menanggapi asupan perawatan minuman WBB (“responden”) dan “non-responden”, yang menunjukkan respons yang bervariasi terhadap kelebihan gula.
3.3 Variabilitas Glukosa Darah Individu Selama 2 Jam Periode Pasca Makan: Responden dan Non-Responden
Analisis individu (Gambar 2C ) mengungkapkan bahwa beberapa relawan merespons positif terhadap pengobatan WBB, sementara yang lain tidak menunjukkan respons dan bahkan, dalam kasus satu relawan, efek sebaliknya diamati. Berdasarkan pengamatan ini, kami mengidentifikasi dua kelompok berbeda: “responden” ( n = 5), yang mengalami pengurangan lebih dari 10% dalam iAUC mereka setelah asupan WWB dikombinasikan dengan larutan gula, dan “non-responden” ( n = 5). Setelah mengkategorikan relawan ke dalam dua kelompok ini, kami membandingkan waktu glukosa darah antara “responden” dan “non-responden” untuk kedua intervensi gula (air + larutan gula dan WBB + larutan gula). Seperti yang ditunjukkan pada Gambar 3A , responden menunjukkan pengurangan yang nyata dalam kadar glukosa tambahan setelah asupan WBB + larutan gula, mencapai signifikansi statistik pada 30 menit ketika kadar glukosa mencapai puncaknya. Sebaliknya, tidak ada perbedaan signifikan dalam peningkatan glukosa darah yang diamati setiap saat selama periode postprandial pada kelompok non-responden (Gambar 3B ). Selain itu, pada kelompok responder, perbedaan signifikan dalam iAUC diamati ketika membandingkan perawatan dengan larutan air + gula dengan larutan gula yang dikombinasikan dengan WBB. Namun, pada kelompok non-responden, tidak ada perbedaan signifikan secara statistik yang diamati (Gambar 3C ). Penurunan ini tampaknya terkait dengan asupan WBB, karena nilai iAUC untuk perawatan larutan air + gula serupa untuk “responden” dan “non-responden”.
3.4 Metabolit Biologis Fenol Darah Selama Periode Pasca Makan Setelah Kelebihan Gula
Mengidentifikasi biomarker asupan (poli)fenol dalam sampel darah setelah pemuatan gula dapat menawarkan wawasan berharga tentang peran senyawa ini dalam regulasi hiperglikemia postprandial. Berdasarkan premis ini, kami mengusulkan untuk menyelidiki apakah perbedaan dalam respons glukosa yang diamati antara “responden” dan “non-responden” dapat dikaitkan dengan perbedaan dalam bioavailabilitas dan/atau metabolisme (poli)fenol dari WBB. Untuk ini, kami menganalisis sampel darah yang dikumpulkan pada kartu DBS pada titik waktu yang berbeda (0, 15, 30, 60, 90, dan 120 menit dan 4, 6, dan 12 jam) setelah intervensi dengan WBB + air dan WBB + larutan gula (Gambar 1 ). Analisis UPLC-MS/MS dari sampel darah dari kedua intervensi mengungkapkan adanya empat metabolit fenolik utama: asam hidroksifenil propionat (OHPPA), HA, asam 4-hidroksibenzoat (4-OHBA), dan katekol-4-sulfat (CS) (Gambar 4A ). Untuk menormalkan data, iAUC dihitung untuk masing-masing dari empat metabolit fenol yang terdeteksi dalam darah selama periode pasca makan. Tidak ada perbedaan signifikan secara statistik yang diamati dalam iAUC metabolit fenol ini ketika WBB dikonsumsi dengan air atau dengan larutan gula, masing-masing, yang menunjukkan bahwa penyerapan dan/atau metabolisme senyawa fenolik tidak dipengaruhi oleh glikemia pasca makan.
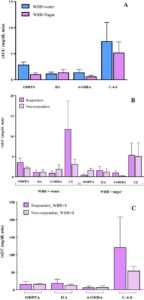
Bahasa Indonesia: Setelah mengidentifikasi metabolit fenolik darah, kami bertujuan untuk mengeksplorasi perbedaan dalam konsentrasi dan perilaku mereka antara “responden” dan “non-responden”. Seperti yang ditunjukkan pada Gambar 4B , tidak ada perbedaan signifikan dalam konsentrasi darah OHPPA, HA, 4-OHBA dan CS yang diamati selama periode pasca makan (0-120 menit) antara “responden” dan “non-responden”, setelah asupan WBB + air dan WBB + larutan gula, masing-masing. Untuk menyelidiki lebih lanjut, analisis diperluas ke fenolik darah pada fase pasca makan kemudian (4-12 jam), yang sesuai dengan metabolisme mikroba kolon dari (poli)fenol WBB (Gambar 4C ). Perlu dicatat bahwa iAUC HA dan C-4-S lebih tinggi pada responden, meskipun tidak ada perbedaan signifikan secara statistik yang diamati, mungkin terkait dengan variabilitas antarindividu yang tinggi.
4 Diskusi
Studi ini berawal dari minat dalam valorisasi produk sampingan pembuatan anggur yang dicirikan dalam penelitian sebelumnya yang mengungkapkan potensi besarnya sebagai sumber senyawa fenolik [ 5 ]. Mengingat meningkatnya masalah kesehatan terkait dengan perubahan metabolisme glukosa, kami menganggap penelitian ini sebagai bukti konsep untuk mengevaluasi penerapan WBB sebagai makanan fungsional untuk mengendalikan hiperglikemia pasca makan. Tujuan kami adalah untuk mengeksplorasi potensi minuman ini dalam mengatur kadar glukosa darah setelah asupan akut larutan gula dalam kondisi puasa. Penelitian kami sejalan dengan tujuan utama berikut: meningkatkan kesehatan metabolisme melalui makanan fungsional dan memajukan keberlanjutan lingkungan dengan menerapkan prinsip-prinsip bioekonomi sirkular. Penelitian saat ini didasarkan pada hipotesis bahwa mengonsumsi minuman ini bersama dengan makanan tinggi gula dapat membantu mengatur kadar glukosa pasca makan, yang berpotensi mengurangi kerusakan jangka panjang yang terkait dengan episode hiperglikemia berulang [ 9 ]. Untuk ini, alur kerja komprehensif dirancang, yang mencakup pengembangan produk, pemilihan formula minuman berdasarkan analisis sensorik, dan dilengkapi dengan evaluasi fungsional (Gambar 5 ). Untuk fokus pada produk sampingan anggur, kami menggunakan formulasi minuman sederhana yang hanya mencakup produk sampingan anggur dan pengental untuk meningkatkan stabilitas dan konsistensi minuman (Tabel 1 ). Namun, bahan-bahan produk sampingan anggur juga dapat dimasukkan ke dalam minuman yang lebih kompleks untuk meningkatkan nilai gizi dan fungsionalnya dengan meningkatkan konsentrasi dan keragaman (poli)fenol dan kandungan serat larut (pektin). Secara umum, penyempurnaan teknologi diperlukan untuk mengoptimalkan kualitas sensori minuman yang diperkaya dengan produk sampingan makanan [ 2 ]. Namun demikian, WBB yang dikembangkan dalam penelitian ini diterima dengan baik oleh para pencicip. Penerimaan konsumen terhadap produk sampingan anggur merupakan poin kunci dalam keberhasilan integrasi pasar makanan fungsional yang dibuat dari produk sampingan ini. Namun, penting untuk memperhitungkan bahwa penerimaan dipengaruhi oleh banyak faktor di luar sifat organoleptik. Salah satu aspek penting adalah kesadaran konsumen tentang asal dan manfaat konsumsi produk sampingan anggur, yang memerlukan inisiatif pendidikan untuk mengomunikasikan keuntungannya. Aspek positifnya termasuk kontribusi terhadap bioekonomi dengan mempromosikan keberlanjutan melalui konsumsi makanan ramah lingkungan, serta asupan senyawa bioaktif, terutama polifenol dan serat makanan yang memberikan manfaat kesehatan tambahan.
Dalam beberapa tahun terakhir, hasil yang menjanjikan telah diamati mengenai kemanjuran produk sampingan anggur saja atau dalam kombinasi dengan produk sampingan tanaman kaya fenolik lainnya untuk mengendalikan kadar glukosa darah [ 6 ]. Beberapa mekanisme, terkadang bekerja secara bersamaan, telah diusulkan untuk regulasi glukosa darah pasca makan oleh (poli)fenol. Ini termasuk penghambatan aktivitas enzim pencernaan, pengurangan penyerapan glukosa oleh sel-sel usus, peningkatan penggunaan glukosa oleh sel melalui stimulasi sekresi insulin dan peningkatan resistensi insulin, dan modulasi jalur pensinyalan intraseluler glukoregulatori [ 3 , 4 , 6 , 7 , 16 , 17 ].
Dalam penelitian ini, setelah membandingkan kadar glukosa darah menyusul asupan larutan WBB + gula dan air + gula, kami mengamati bahwa beberapa relawan merespons secara positif, menunjukkan penurunan iAUC (0–120 menit), sementara yang lain tidak menunjukkan perubahan atau peningkatan tak terduga pada kadar glukosa (Gambar 2C ). Kami berhipotesis bahwa variasi antarindividu dalam respons WBB dapat dikaitkan dengan perbedaan metabolik selama periode pasca makan, yang mungkin dipengaruhi oleh perbedaan individu dalam penyerapan dan/atau metabolisme senyawa fenolik. Untuk mengeksplorasi ini, kami mempelajari keberadaan metabolit fenolik dalam sampel darah dari relawan pada titik waktu pengukuran glukosa yang sama (0–120 menit) dan juga 4, 6, dan 12 jam pasca makan untuk menentukan metabolit kolon mikroba. Mengidentifikasi metabolit fenolik spesifik dalam darah dapat menjelaskan perbedaan antarindividu dalam pengurangan respons glikemik setelah asupan larutan gula dikombinasikan dengan WBB.
Berdasarkan hasil penelitian ini (Gambar 4 ), kami berhipotesis bahwa metabolit fenolik yang terdeteksi dalam darah menggunakan kartu DBS tidak secara langsung terlibat dalam mekanisme glukoregulasi pada glikemia postprandial akut. Hal ini didukung oleh kurangnya hubungan yang jelas antara konsentrasi darah mereka selama periode postprandial dan pengurangan yang diamati dalam kadar glukosa darah pada relawan responder (data tidak ditampilkan). Namun, kami berhipotesis bahwa kurangnya hubungan ini dapat disebabkan oleh metode analisis yang menggabungkan pengambilan sampel kartu darah DBS dengan analisis kromatografi, yang tidak cukup sensitif untuk mendeteksi metabolit fenol minor yang dapat bertanggung jawab atas efek hipoglikemik WBB.
Beberapa penelitian telah mengevaluasi efek penurunan glukosa postprandial dari produk kaya fenolik [ 8 , 18 ], tetapi di antara mereka, sebagian kecil juga telah mengevaluasi metabolit fenolik yang beredar pascaestion pada manusia. Sebuah penelitian oleh Prpa et al. [ 4 ] menentukan konsentrasi serum metabolit fenol setelah asupan jus apel yang diperkaya dengan dosis ekstrak apel yang berbeda. Pada 120- dan 240-menit pascaestion, efek dosis-respons pada konsentrasi lima metabolit fenol diamati, tetapi tidak ada perbedaan dalam iAUC yang mungkin terkait dengan variabilitas antarindividu yang tinggi. Ini mungkin menunjukkan bahwa setelah intervensi asupan akut, senyawa fenolik yang ada dalam sirkulasi mungkin tidak terlibat dalam regulasi kadar glukosa postprandial. Banyak penelitian telah menghubungkan efek hipoglikemik senyawa fenolik dengan kapasitasnya untuk mengganggu aktivitas hidrolitik enzim pencernaan, mengurangi pelepasan glukosa ke lumen usus dan dengan demikian mengurangi penyerapannya [ 8 ].
Namun demikian, asupan produk kaya fenolik yang teratur dan berkelanjutan dapat berkontribusi untuk mempertahankan konsentrasi spesies fenolik yang bersirkulasi yang stabil karena metabolisme Fase I dan II hati dengan kontribusi tambahan dari resirkulasi enterohepatik [ 19 ]. Dalam penelitian ini, kami bertujuan untuk mengeksplorasi peran potensial metabolit mikroba dari produk sampingan anggur dalam aliran darah untuk menilai kemungkinan kontribusinya terhadap efek hipoglikemik jangka panjang. Temuan kami menunjukkan peningkatan konsentrasi total metabolit mikroba fenolik selama 4–12 jam pasca makan dibandingkan dengan periode pasca makan (0–2 jam). Namun, tidak ada perbedaan signifikan secara statistik yang diamati antara relawan “responden” dan “non-responden”. Namun, hasil ini tidak membatalkan potensi efek regulasi metabolit fenolik yang bersirkulasi pada glikemia pasca makan, terutama dengan konsumsi produk kaya fenolik yang teratur dan berkelanjutan [ 20 ].
Efek hipoglikemik dari minuman WBB yang diamati dalam penelitian ini juga dapat dikaitkan dengan keberadaan pektin (serat makanan larut). Efek hipoglikemik jangka pendek dari serat makanan disebabkan oleh sifat fisikokimianya, yang dapat menghambat penyerapan glukosa dan/atau pencernaan karbohidrat dengan meningkatkan viskositas digesta [ 21 ]. Selain itu, serat makanan juga meningkatkan kontrol glikemik dalam jangka panjang dengan mendukung perkembangan bakteri usus yang bermanfaat dan meningkatkan produksi metabolit mikroba bioaktif [ 22 ]. Efek glukoregulasi ini biasanya memerlukan konsumsi serat yang teratur dan berkelanjutan untuk memaksimalkan efek hipoglikemiknya. Misalnya, pektin, sejenis serat larut yang ditemukan dalam produk sampingan anggur, mungkin terlibat dalam modulasi penyerapan glukosa selama pencernaan [ 1 , 23 ]. Namun, ada informasi terbatas mengenai kemungkinan peran pektin dalam mengelola glikemia pasca makan, yang menyoroti perlunya penelitian lebih lanjut dan pemahaman yang lebih baik tentang sifat hipoglikemiknya.
Hasil kami mendukung teori bahwa WBB mungkin memiliki efek hipoglikemik akut pada individu tertentu (“responden”), kemungkinan karena interaksi senyawa fenolik dan serat dalam lumen usus selama proses pencernaan. Besarnya sifat penurun glukosa tampaknya dipengaruhi oleh faktor-faktor dalam proses pencernaan, bukan oleh (poli)fenol yang tersedia secara hayati. Meskipun temuan kami berasal dari studi intervensi asupan akut, kami tidak dapat mengabaikan manfaat potensial dari konsumsi rutin produk kaya fenolik, yang dapat menawarkan keuntungan jangka panjang melalui pelepasan metabolit fenol secara terus-menerus, termasuk yang disediakan oleh mikrobiota usus. Metabolit mikroba ini dapat berkontribusi pada perbaikan berkelanjutan dalam regulasi glukosa dari waktu ke waktu.
Studi percontohan pembuktian konsep ini melibatkan 10 relawan sehat, dengan 5 diklasifikasikan sebagai responden, yang bertujuan untuk menilai kelayakan dan menyempurnakan metodologi untuk uji coba besar di masa mendatang. Variabilitas yang diamati dalam respons menyoroti perlunya pendekatan nutrisi yang dipersonalisasi dan membenarkan desain skala kecil yang hemat sumber daya sebelum studi yang lebih besar. Pemahaman yang lebih mendalam tentang faktor-faktor yang mendorong variasi antar individu dalam respons metabolik terhadap modifikasi pola makan dapat memandu rekomendasi diet yang lebih efektif dan tepat bagi individu dalam praktik klinis. Hal ini menyoroti pentingnya nutrisi presisi dalam memahami respons yang berbeda ini.
5 Kesimpulan
Hasil penelitian ini menunjukkan bahwa produk sampingan anggur dapat digunakan secara efektif sebagai bahan dalam formulasi minuman fungsional. Bahan-bahan ini dapat dimasukkan ke dalam formulasi padat dan cair untuk meningkatkan konsentrasi senyawa bioaktif. Dalam konteks kelebihan gula pada orang dewasa yang sehat, temuan kami menunjukkan bahwa asupan minuman WBB dapat membantu mengurangi hiperglikemia pasca makan pada beberapa individu yang dapat dianggap sebagai “responden”. Selain itu, penelitian ini menyoroti potensi produk sampingan anggur dalam mengelola iAUC glukosa dan variasi kadar glukosa maksimum pasca makan pada subjek yang sehat. Hal ini menekankan peran produk alami dalam mendukung manajemen glukosa dan meningkatkan kesehatan metabolisme. Selain itu, produk sampingan anggur dapat dikombinasikan dengan buah atau sayuran lain untuk membuat berbagai minuman, yang selanjutnya meningkatkan profil bioaktifnya sambil mempertahankan penerimaan sensorik dan memberikan manfaat kesehatan dan nutrisi tambahan sebagai sumber keragaman (poli)fenol dan serat larut (pektin). Hasil studi pembuktian konsep ini menunjukkan potensi yang signifikan untuk peningkatan nilai produk sampingan dari proses pembuatan anggur, mendorong pemanfaatan kembali dan peningkatan nilai produk sampingan tersebut dalam model bioekonomi sirkular.

