
ABSTRAK
Diet yang mencakup makanan dengan indeks glikemik rendah telah diusulkan untuk membalikkan meningkatnya insiden obesitas dan diabetes tipe 2. Sayangnya, banyak makanan pokok bertepung umum memiliki indeks glikemik tinggi. Beberapa strategi untuk memproduksi makanan dengan indeks glikemik rendah telah diusulkan, tetapi penerapannya oleh industri makanan dibatasi oleh kesulitan dan biaya pengukuran GI secara in vivo. Tujuan dari penelitian ini adalah untuk mengembangkan protokol yang sederhana dan andal untuk menilai pelepasan glukosa setelah pencernaan in vitro, dan menggunakannya untuk membandingkan makanan bertepung komersial. Untuk tujuan ini, langkah pencernaan pati terakhir disertakan dalam protokol pencernaan in vitro INFOGEST dengan menambahkan enzim amiloglukosidase, yang meniru aksi enzim brush border. Pelepasan glukosa dievaluasi dalam lima makanan bertepung (tepung, roti, kerupuk, dan pasta gandum durum dan pasta bebas gluten), tersedia di pasaran dalam dua bentuk yang diproduksi oleh perusahaan yang sama, satu standar dan satu kaya serat (> 6 g/100 g). Pelepasan glukosa dievaluasi 0, 30, 60, dan 120 menit setelah penambahan amiloglucosidase. Pada semua makanan, pelepasan glukosa pada T0 sangat rendah, yang mengonfirmasi bahwa pencernaan pati oleh amilase tidak lengkap. Tidak termasuk tepung, jumlah pelepasan glukosa terendah dan tertinggi (28,29 dan 49,36 g/50 g karbohidrat yang tersedia) masing-masing terdeteksi pada pasta gandum durum dan pasta bebas gluten, yang mengonfirmasi indeks glikemik tinggi yang sebelumnya terdeteksi pada banyak produk bebas gluten. Khususnya, ketika pelepasan glukosa dinyatakan sebagai g/50 g karbohidrat yang tersedia, dampak kandungan serat dapat diabaikan. Meskipun penilaian pelepasan glukosa secara in vitro tidak boleh disamakan dengan indeks glikemik, protokol yang dilaporkan di sini dapat membantu memprediksi dampak makanan pada glikemia, yang memfasilitasi formulasi produk yang lebih sehat.
1 Pendahuluan
Insiden obesitas dan diabetes tipe 2 (T2D) meningkat di seluruh dunia, dan manajemen nutrisi memainkan peran penting dalam pencegahan dan pengobatannya (Minari et al. 2024 ). Diet yang menggabungkan makanan dengan indeks glikemik (IG) rendah telah diusulkan sebagai cara yang berguna untuk mengelola respons glukosa (Ojo et al. 2018 ). IG adalah peningkatan konsentrasi glukosa darah sebagai respons terhadap makanan uji yang dikonsumsi dalam kondisi standar dan dinyatakan sebagai persentase area di bawah kurva (AUC) setelah konsumsi makanan referensi yang dikonsumsi individu yang sama pada hari yang berbeda (Singh et al. 2021 ). Karena nilai IG suatu makanan tidak didasarkan pada karakteristik individu yang mengonsumsinya tetapi bergantung pada karakteristik makanan itu sendiri (Vega-López et al. 2018 ), ia berfungsi sebagai sistem klasifikasi yang sistematis.
Karbohidrat mencakup 45%–60% dari total kebutuhan energi dalam makanan manusia (EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA) 2010 ), dan merupakan salah satu penentu utama glikemia pasca makan. Karbohidrat berhubungan langsung dengan GI, dan bentuk serta jumlah makanan kaya karbohidrat dalam makanan memainkan peran mendasar dalam timbulnya T2D (Feinman et al. 2015 ). GI suatu makanan dianggap sebagai indikator pilihan kesehatan dan dapat menawarkan panduan yang berguna tentang makanan mana yang harus dipilih (Zafar et al. 2019 ). Oleh karena itu, memperoleh informasi yang menghubungkan makanan kaya karbohidrat dan GI-nya sangat penting. Sayangnya, GI dari banyak makanan pokok, seperti roti, pasta, dan kentang, tinggi (Atkinson et al. 2021 ).
Beberapa strategi untuk memproduksi makanan dengan GI rendah telah diusulkan, terutama difokuskan pada memperlambat proses pencernaan pati (Wee dan Henry 2020 ; Yang et al. 2023 ). Faktanya, laju pencernaan pati berguna untuk memprediksi respons glikemik terhadap makanan bertepung karena berhubungan langsung dengan jumlah glukosa yang diserap ke dalam aliran darah. Namun, hubungan kompleks antara sifat kimia makanan kaya pati dan daya cerna pati belum sepenuhnya dijelaskan. Diketahui bahwa daya cerna pati, yaitu konversinya menjadi glukosa bebas, terkait dengan karakteristik morfologinya, organisasinya dalam lamela kristal, proporsi amilosa dan amilopektin, dan pembentukan kompleks inklusi amilosa-lemak (Bertoft 2017 ). Komponen nonpati (protein, lemak, dan zat terkait polisakarida) dapat berinteraksi dengan pati, mengubah strukturnya dan membuatnya tidak dapat diakses oleh enzim pencernaan (Qadir dan Wani 2022 ), dan pengolahan makanan bertepung dapat memengaruhi daya cerna dengan mengatur ulang struktur pati (Yan et al. 2020 ). Akibatnya, komposisi kimia suatu makanan saja tidak cukup untuk memprediksi IG-nya, dan diperlukan pengukuran yang lebih langsung.
Penentuan GI secara in vivo sangat rumit karena melibatkan pengawasan subjek manusia dengan variasi intra-individu dan mahal serta tidak praktis (Lal et al. 2021 ). Untuk mengatasi masalah ini, beberapa metode pencernaan in vitro telah dikembangkan untuk mempelajari perilaku pencernaan makanan kaya pati (Yang et al. 2023 ). Meskipun sederhana, nyaman, dan hemat biaya, model-model ini jarang divalidasi dengan hasil in vivo. Metode pencernaan statis in vitro yang dikembangkan di bawah tindakan COST INFOGEST memiliki reproduktifitas intra dan inter-laboratorium yang tinggi, efektivitas biaya, ketahanan, memungkinkan evaluasi hasil yang mudah pada setiap tahap pencernaan (Brodkorb et al. 2019 ), dan divalidasi dengan hasil in vivo untuk kecernaan protein makanan (Sousa et al. 2023 ). Terlepas dari semua keuntungan ini, metode pencernaan in vitro ini tidak mempertimbangkan fase terakhir hidrolisis pati. In vivo, disakarida seperti maltosa dan limit dekstrin, yang merupakan produk hidrolisis pati oleh α-amilase saliva dan pankreas, dihidrolisis menjadi glukosa oleh aksi ganda dari dua enzim brush border (BBE), yaitu maltase-glukosaamilase dan sukrase-isomaltase (Tannous et al. 2023 ). BBE tidak termasuk dalam protokol INFOGEST (Brodkorb et al. 2019 ), yang hanya menghasilkan pelepasan sebagian glukosa bebas dari pati yang tersedia.
Tujuan dari penelitian ini adalah untuk mengembangkan protokol yang sederhana dan andal untuk mengevaluasi pelepasan glukosa in vitro dari makanan bertepung dengan memasukkan dalam protokol INFOGEST langkah pencernaan pati akhir yang meniru pencernaan BBE dengan menambahkan enzim amiloglukosidase (AMG). Untuk memverifikasi keandalan protokol, pelepasan glukosa dievaluasi dalam lima makanan bertepung komersial (tepung, roti, kerupuk, dan pasta gandum durum dan pasta bebas gluten). Makanan tersebut dipilih berdasarkan pemrosesan yang berbeda dan ketersediaannya di pasaran dalam dua bentuk yang diproduksi oleh perusahaan yang sama, salah satunya kaya serat (lebih dari 6 g/100 g, menurut Peraturan [EC] 1924, Komisi Eropa, 2006 ). Faktanya, telah dilaporkan bahwa menambahkan serat makanan ke makanan bertepung dapat menurunkan laju pencernaan pati (Qi et al. 2018 ).
Meskipun penelitian lain telah menggabungkan protokol INFOGEST dan penambahan AMG untuk meniru fase terakhir pencernaan pati (Feng et al. 2023 ; Hammond et al. 2024 ; Miehle et al. 2024 ), sejauh pengetahuan kami, ini adalah penelitian pertama yang membandingkan berbagai makanan bertepung komersial, dan memperoleh hasil yang konsisten dengan penilaian GI in vivo sebelumnya.
2 Bahan dan Metode
2.1 Bahan
Kecuali ditentukan lain, bahan kimia dan pelarut memiliki mutu analitis tertinggi dan dibeli dari Merck (Darmstadt, Jerman) dan Sigma-Aldrich (St. Louis, MO, AS).
2.2 Sampel Makanan
Lima jenis makanan bertepung komersial yang berbeda dipertimbangkan: tepung terigu, roti gandum beku, kerupuk gandum, dan pasta gandum durum , serta pasta jagung bebas gluten. Dua jenis makanan yang berbeda—kontrol dan berserat tinggi (HF)—dari masing-masing makanan, yang diproduksi oleh perusahaan yang sama, dipelajari. Semua sampel makanan dibeli di pasar lokal.
Tepung terigu dan kerupuk dicerna tanpa proses lebih lanjut; roti beku dicairkan pada suhu ruangan, dipotong menjadi irisan setebal 1 cm, dan 5 g yang akan dicerna diambil dari irisan tengah, dengan tetap menjaga proporsi yang sama antara kulit dan remah. Pasta semolina gandum durum (fusilli) dan pasta bebas gluten (fusilli) dimasak menurut metode ISO 7304-1:2016(E), mengikuti waktu memasak yang ditentukan oleh produsen. Setelah penambahan minyak zaitun murni (1 g minyak/8 g pasta), pasta yang dimasak segera dicerna untuk menghindari retrogradasi pati.
2.3 Pencernaan In Vitro
Lima gram makanan dicerna secara in vitro menurut protokol INFOGEST (Minekus et al. 2014 ) dengan beberapa modifikasi. Pencernaan berlangsung selama 2 menit (pencernaan oral dengan cairan saliva tiruan pada pH 7) ditambah 120 menit (pencernaan lambung dengan getah lambung tiruan yang mengandung 2000 U/mL pepsin pada pH 3) ditambah 60 menit (pencernaan duodenum dengan getah pankreas tiruan yang mengandung 10 mM empedu dan sejumlah pankreatin sehingga aktivitas tripsin dalam campuran akhir adalah 100 U/mL pada pH 7) pada suhu 37°C. Pada akhir pencernaan duodenum, sampel disentrifugasi pada 4500× g selama 10 menit pada suhu 4°C. Supernatan dialiquot dalam vial 1 mL, dan 150 μL AMG (230 U/mL dalam gliserol, konsentrasi akhir 30 U/mL) atau air (T0) ditambahkan, seperti yang dilaporkan oleh Li et al. ( 2022 ). Sampel diinkubasi dalam bak goyang pada suhu 37°C. Inkubasi dihentikan setelah 30 (T0 dan T30), 60 (T60), atau 120 (T120) menit dengan menonaktifkan enzim pada suhu 100°C selama 10 menit. Sampel didinginkan, disentrifugasi pada 10.000× g selama 5 menit pada suhu 4°C, dan supernatan digunakan untuk penentuan glukosa.
2.4 Penentuan Aktivitas Amilase
Aktivitas amilase dinilai menggunakan kit Uji Aktivitas Amilase (Sigma-Aldrich, MO, AS) mengikuti petunjuk pabrik dan menggunakan ethylidenepNP-G7 sebagai substrat. Satu unit adalah jumlah enzim yang memecah ethylidene-pNP-G7 untuk menghasilkan 1,0 mmol p -nitrofenol per menit, yang diukur secara kolorimetri pada 405 nm.
2.5 Penentuan Aktivitas Amiloglukosidase
Aktivitas amiloglucosidase ditentukan menggunakan kit Uji Aktivitas Amiloglucosidase (Megazyme, Bray, Irlandia) mengikuti petunjuk pabrik dan menggunakan p- nitrofenil beta-maltosida ditambah beta-glukosidase termostabil sebagai substrat. Satu unit adalah jumlah enzim yang melepaskan 1,0 mmol p -nitrofenol per menit dari p- nitrofenil β-maltosida, yang diukur secara kolorimetri pada 400 nm.
2.6 Penentuan Kandungan Glukosa
Konsentrasi glukosa diukur dengan D-Glucose Assay Kit menggunakan reagen GOPOD (Megazyme, Bray, Irlandia) mengikuti petunjuk pabrik. Berdasarkan matriks yang dicerna, faktor pengenceran (dengan air) dipilih untuk sampel, yang dianalisis secara duplikasi. Seratus mikroliter air digunakan sebagai blanko, dan 100 μL larutan D-Glukosa sebagai standar. Tiga mililiter reagen GOPOD ditambahkan ke setiap tabung, dan setelah diaduk, tabung diinkubasi dalam penangas air panas pada suhu 45°C selama 20 menit. Perubahan kolorimetrik diukur pada 510 nm. Relatif terhadap absorbansi standar, kandungan D-Glukosa ditentukan menggunakan file perhitungan yang dapat diunduh dari situs web Megazyme ( https://www.megazyme.com/d-glucose-assay-kit ) dan persamaan berikut.
![]()
2.7 Analisis Statistik
Analisis statistik dilakukan dengan analisis varians satu arah (ANOVA) dengan Tukey sebagai uji pasca, dan dengan uji t Student , dengan mempertimbangkan p < 0,05 sebagai signifikan.
3 Hasil dan Pembahasan
Beberapa enzim intestinal diperlukan untuk pencernaan pati (Li et al. 2023 ): dua endo-glukosidase luminal yang disebut alfa-amilase dan berbagai maltase. Maltase ini adalah ekso-glukosidase yang terikat pada permukaan luminal enterosit yang menghidrolisis oligosakarida pati linear menjadi glukosa. Dalam penelitian ini, penambahan AMG setelah 1 jam fase duodenum dari pencernaan INFOGEST secara in vitro memfasilitasi hidrolisis residu terminal α-1,4 dan α-1,6 D-glukosa berturut-turut dari ujung non-pereduksi maltodekstrin, sehingga memecah pati yang tersedia sepenuhnya menjadi glukosa. Khususnya, AMG ditambahkan tanpa menghentikan aktivitas amilase pankreas, sehingga lebih meniru pencernaan mukosa secara in vivo.
Dalam metode INFOGEST (Minekus et al. 2014 ), jumlah pankreatin yang akan ditambahkan selama pencernaan dihitung berdasarkan aktivitas enzim tripsin. Karena tujuan kami adalah untuk mengevaluasi pelepasan glukosa dari pati, dalam percobaan pendahuluan kami menyesuaikan jumlah pankreatin berdasarkan aktivitas amilase (200 U/mL), kemudian membandingkan hasil yang diperoleh dalam sampel yang sama dengan memasukkan dalam pencernaan duodenum sejumlah pankreatin yang dihitung berdasarkan aktivitas enzim tripsin atau amilase. Pelepasan glukosa dievaluasi pada T0, T30, T60, dan T120 dari pencernaan AMG. Seperti yang ditunjukkan pada Gambar S1 , tidak ada perbedaan yang terdeteksi pada setiap titik waktu. Berdasarkan hal ini, dalam percobaan berikutnya jumlah pankreatin yang akan ditambahkan selama pencernaan duodenum dihitung menurut protokol INFOGEST.
Komposisi gizi produk komersial yang dipertimbangkan dalam penelitian ini ditunjukkan pada Tabel 1 menurut label produsen. Bahan-bahan dalam makanan yang dianalisis dilaporkan pada Tabel S1 .
| Kandungan (g/100 g) | Kontrol | serat tinggi |
|---|---|---|
| Tepung terigu | ||
| Pati | 68,7 (75,3 g glukosa a ) | 49,5 (54,9 g glukosa a ) |
| Gula | 1.5 | 0.5 |
| Serat | 1.6 | 20 |
| Lemak | 1.6 | 1.7 |
| Protein dan lemak | 12 | 17 |
| Roti beku | ||
| Pati | 45,6 (50,6 g glukosa a ) | 38,6 (42,5 g glukosa a ) |
| Gula | 1.4 | 0.3 |
| Serat | 4.4 | 11.3 |
| Lemak | 1.6 | 2.5 |
| Protein dan lemak | 9.7 | 10 |
| Kerupuk | ||
| Pati | 67,7 (74,15 g glukosa a ) | 59 (65,5 g glukosa a ) |
| Gula | 1.3 | 2 |
| Serat | 2.7 | 6.1 |
| Lemak | 15 | 16 |
| Protein dan lemak | 9.6 | 10 |
| Pasta gandum durum (fusilli) | ||
| Pati | 67,5 (74,3 g glukosa a ) | 60,5 (66,6 g glukosa a ) |
| Gula | 3.5 | 3.5 |
| Serat | 3 | 8 |
| Lemak | 3 | 2.5 |
| Protein dan lemak | 13 | 13 |
| Pasta bebas gluten (fusilli) | ||
| Pati | 79,4 (88,1 g glukosa a ) | 62,1 (68,3 g glukosa a ) |
| Gula | 0.6 | 0.7 |
| Serat | 1.7 | 7.8 |
| Lemak | 0.8 | 1.2 |
| Protein dan lemak | 7.1 | 12.1 |
Catatan: Data dinyatakan dalam g/100 g.
Berat pati diubah menjadi berat glukosa menggunakan 1,11 sebagai faktor konversi (rasio antara berat D-glukosa anhidrat dalam pati dan berat D-glukosa bebas) (Pérez-Donado et al. 2023 ).
Dengan menggunakan protokol yang dijelaskan, kami mengevaluasi waktu pelepasan glukosa selama pencernaan INFOGEST + AMG. Pencernaan in vitro dilakukan pada 5 g makanan bertepung yang berbeda, dan hasilnya dinormalisasi untuk 100 g produk yang tidak dicerna (mentah, dalam kasus tepung dan pasta) (Gambar 1 ).
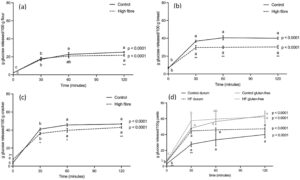
Dalam tepung (Gambar 1a ), pelepasan glukosa pada T0 sangat rendah dan serupa dalam dua produk, yang mengonfirmasi bahwa pencernaan pati oleh amilase tidak lengkap (Seigner et al. 1987 ). Dalam kontrol dan tepung HF, pelepasan glukosa meningkat secara signifikan setelah 30 menit pencernaan AMG dan terus meningkat selama 30 menit berikutnya, tanpa perbedaan yang signifikan antara kedua sampel. Setelah 2 jam, pelepasan glukosa secara signifikan lebih besar dalam kontrol daripada dalam tepung HF; namun, itu lebih rendah daripada dalam produk lain. Dapat dibayangkan bahwa pelepasan glukosa yang rendah dikaitkan dengan kuantitas tinggi pati yang tidak digelatinisasi, karena gelatinisasi pati, yaitu, kerusakan struktur yang teratur dalam pati granular yang dimediasi oleh panas dan kelembaban, dianggap sebagai prasyarat untuk penggunaannya. Selama proses gelatinisasi pati, juga disebut pemasakan (Yu et al. 2017 ), suhu tinggi dan air menyebabkan butiran pati menyerap air dan membengkak, melunak. Hal ini menyebabkan rantai pati linier dan bercabang dilepaskan ke dalam media pemasakan dan menjadi tergelatinisasi, membuat pati lebih rentan terhadap hidrolisis enzimatik (Gunathilaka dan Ekanayake 2015 ).
Pada T0, pelepasan glukosa rendah dan serupa pada kedua jenis roti (Gambar 1b ); namun, pelepasan glukosa lebih tinggi daripada tepung (tepung kontrol = 2,16 ± 0,16 g/100 g tepung; roti kontrol = 6,48 ± 0,32 g/100 g roti), yang menunjukkan bahwa gelatinisasi pati selama pemasakan roti memfasilitasi pelepasan glukosa bahkan selama pencernaan oro-gastrik-duodenal in vitro. Pelepasan glukosa meningkat secara signifikan setelah 30 menit pertama pencernaan mukosa, tanpa peningkatan signifikan lebih lanjut, dan secara signifikan lebih tinggi pada kontrol dibandingkan dengan roti HF di semua titik waktu. Perlu dicatat bahwa pati resistan (RS) disertakan sebagai bahan dalam tepung HF (17%) dan roti HF (9,3%). RS, molekul linier α-1,4-D-glukan yang diperoleh terutama dari retrogradasi fraksi amilosa (Dery dan Lou 2020 ), tidak dapat dihidrolisis oleh enzim pencernaan karena struktur molekulnya yang kompak (Dery dan Lou 2020 ; Wang et al. 2019 ), dan laporan sebelumnya menunjukkan bahwa keberadaan RS memiliki dampak signifikan pada GI makanan bertepung (Afandi et al. 2021 ).
Pada T0, pelepasan glukosa rendah pada kerupuk kontrol. Kerupuk HF menunjukkan kinetika pelepasan glukosa yang berbeda; memang, konsentrasi glukosa lebih tinggi daripada dalam kontrol pada T0 dan lebih rendah pada titik waktu selanjutnya (Gambar 1c ).
Dalam pasta gandum durum , kandungan glukosa bebas rendah pada awal pencernaan AMG (Gambar 1d ). Kemudian, perjalanan waktu pelepasan glukosa berbeda dalam kontrol dan produk HF. Bahkan, peningkatannya lebih lambat pada pasta kontrol daripada pada pasta HF, yang mencapai titik puncaknya lebih awal pada T30. Pada T0, pelepasan glukosa yang rendah dan serupa juga diamati pada pasta bebas gluten (Gambar 1d ), dan tidak ada perbedaan signifikan yang terdeteksi pada setiap waktu pencernaan AMG antara kontrol dan produk bebas gluten HF. Ketika membandingkan gandum durum dan pasta bebas gluten, pelepasan glukosa lebih besar pada yang terakhir, dan perbedaan lebih nyata pada kontrol daripada pada varian HF (kontrol: p < 0,001 pada setiap titik waktu; HF: T0 p < 0,01; T30 p = 0,052; T60 dan T120 p < 0,05).
Protokol yang dijelaskan memungkinkan kami untuk membandingkan berbagai makanan bertepung dengan mengevaluasi pelepasan glukosa bebas setelah pencernaan in vitro. Ini tidak boleh disamakan dengan GI. Faktanya, GI juga memperhitungkan penyerapan glukosa oleh enterosit, yang sebagian melepaskannya ke dalam aliran darah dan sebagian mengubahnya menjadi metabolit lain (Chiarello et al. 2022 ), dan modulasi oleh sekresi insulin. Namun, karena sebagian besar informasi dalam literatur berasal dari studi klinis yang mengevaluasi GI makanan bertepung, yang didefinisikan sebagai area tambahan di bawah kurva respons glukosa darah 2 jam setelah konsumsi makanan yang mengandung 50 g karbohidrat yang tersedia, kami menormalkan kembali pelepasan glukosa pada T120 pada kuantitas makanan yang mengandung 50 g karbohidrat yang tersedia untuk membuat hasil kami agak sebanding dengan yang in vivo dan untuk memverifikasi keandalannya (Gambar 2 ).
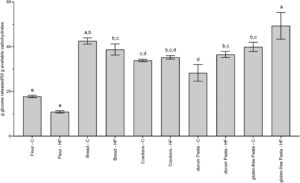
Pelepasan glukosa dipastikan sangat rendah dalam tepung, di mana pati tidak digelatinisasi. Di antara produk makanan lainnya, pelepasan glukosa terendah diamati dalam pasta gandum durum kontrol (28,29 ± 3,73 g/50 g karbohidrat yang tersedia). Pasta gandum durum dilaporkan menginduksi respons glikemik pasca makan yang lebih rendah daripada roti dan produk gandum lainnya pada subjek sehat dan subjek dengan T2D, mungkin berdasarkan struktur fisiknya yang padat dan kompak (pasta kering) dan jaringan gluten yang mengelilingi butiran pati (Di Pede et al. 2021 ). Dalam produk bebas gluten, tidak adanya gluten memengaruhi kecernaan pati dan meningkatkannya, sehingga meningkatkan respons glikemik pasca makan (Scazzina et al. 2015 ). Dengan demikian, kami mengamati pelepasan glukosa yang lebih tinggi dalam pasta bebas gluten dibandingkan dalam pasta gandum durum (39,91 ± 2,08 dan 49,36 ± 5,96 g/50 g karbohidrat yang tersedia masing-masing dalam pasta kontrol dan HF GF).
Yang perlu diperhatikan, ketika pelepasan glukosa dinyatakan sebagai g/50 g karbohidrat yang tersedia, tidak ada perbedaan signifikan yang diamati antara pasangan kontrol-HF dari tepung, roti, dan kerupuk, dan dalam pasta HF (baik durum dan bebas gluten) pelepasan glukosa lebih tinggi daripada pada kontrol yang sesuai. Seperti yang dilaporkan bahwa serat makanan berfungsi sebagai penghalang fisik dalam pencernaan, memperlambat interaksi antara enzim dan substrat (Qi et al. 2018 ), hasil kami tampak kontras dengan efek penurunan GI dari penyertaan serat dalam makanan. Istilah “serat” mencakup berbagai macam senyawa, biasanya diklasifikasikan sebagai serat tidak larut dan larut (kental). Meskipun secara umum tercantum pada label makanan sebagai “serat,” efeknya pada GI berbeda (Jenkins et al. 1988 ). Kami tidak mengetahui jenis serat yang ada dalam makanan yang diuji, selain keberadaan RS dalam tepung dan roti. Efek positif RS pada homeostasis glukosa telah dikonfirmasi oleh klaim kesehatan yang disetujui EFSA (Panel EFSA tentang Produk Diet, Nutrisi, dan Alergi (NDA) 2011 ) “mengganti pati yang dapat dicerna dengan RS menyebabkan kenaikan glukosa darah yang lebih rendah setelah makan”. Namun, ada lima jenis RS, RS1–RS5, dan semua bukti untuk klaim kesehatan EFSA didasarkan pada penelitian yang mengevaluasi bahan RS tipe 2 yang berasal dari pati jagung amilosa tinggi (Walsh et al. 2022 ). Sejauh pengetahuan kami, efek jenis RS lain dari asal tanaman yang berbeda belum dievaluasi. Jenis serat yang ada dalam formulasi makanan yang diuji dapat menjelaskan kurangnya efek pada pelepasan glukosa dan lebih jauh menggarisbawahi kebutuhan penting untuk menghindari generalisasi dan mempertimbangkan dengan hati-hati jenis serat saat merumuskan kembali makanan untuk memiliki dampak glikemik yang lebih rendah. Lebih jauh, perlu dicatat bahwa mekanisme kerja serat kental terkait dengan kemampuannya untuk mengurangi laju difusi nutrisi dari lumen usus halus, sehingga mengurangi penyerapannya. Hal ini mungkin berdampak pada GI makanan, tetapi tidak pada penilaian pelepasan glukosa secara in vitro.
Selain kemungkinan alasan untuk efek buruk dari keberadaan serat, perlu diperhatikan bahwa beberapa penelitian belum menyoroti perubahan apa pun dalam respons glikemik dan insulin pasca makan setelah eliminasi serat sereal dari makanan melalui penyulingan (Wolever dan Jenkins 2001 ). Secara khusus, data in vivo melaporkan hasil yang ambigu untuk spageti, dengan beberapa penelitian menunjukkan GI yang sama terlepas dari kandungan serat (Jenkins et al. 1988 ). Dapat dikatakan bahwa format pasta dapat memodulasi GI dan oleh karena itu perbandingan ini sulit, tetapi perlu dicatat bahwa Pugnaloni et al. ( 2022 ) menyoroti GI yang lebih tinggi dalam tepung utuh daripada fusilli non-tepung utuh, format pasta yang sama yang dipertimbangkan dalam penelitian ini.
Namun, berdasarkan hasil kami, dapat dikatakan bahwa pelepasan glukosa berkurang yang diamati dalam beberapa produk HF ketika evaluasi dilakukan pada 100 g makanan terutama terkait dengan penggantian karbohidrat yang tersedia dengan serat daripada efek langsung serat pada hidrolisis pati. Faktanya, efeknya menghilang ketika hasilnya dinormalisasi menjadi 50 g karbohidrat yang tersedia. Tentu saja, efek akhir pada pelepasan glukosa juga dapat dikaitkan dengan komponen selain serat dalam makanan yang diuji. Dalam tinjauan tentang efek menguntungkan dari konsumsi kacang-kacangan pada kadar glukosa darah dan insulin, dilaporkan bahwa efek positif dari konsumsi lentil mungkin karena kandungan makronutrien kompleksnya, dan kandungan protein dan serat makanan diidentifikasi sebagai faktor potensial dalam respons glikemik yang lebih rendah (Clarke et al. 2022 ). Namun, bukti langsung untuk keduanya masih belum meyakinkan. Sesuai dengan penelitian kami, meskipun dalam penelitian kami 3 dari 5 makanan bersifat isoprotein pada pasangan HF-kontrol, pada dua di antaranya (roti dan kerupuk) versi HF menunjukkan pelepasan glukosa yang lebih rendah (dinyatakan sebagai g/100 g makanan), sementara pasta menunjukkan tren yang berlawanan. Ketika pelepasan glukosa dinormalisasi pada 50 g karbohidrat yang tersedia, tidak ada perbedaan yang terdeteksi antara pasangan HF-kontrol.
Pelepasan glukosa dari makanan dapat dipengaruhi oleh beberapa faktor, termasuk jenis dan proporsi bahan, teknologi pemrosesan, dan parameter memasak, yang bekerja sama (Cui et al., 2024 ). Mengevaluasi dan menjelaskan karakteristik mana yang memiliki pengaruh lebih besar pada pelepasan glukosa bukanlah tujuan pekerjaan kami, tetapi hasil yang diperoleh mengonfirmasi bahwa hal itu tidak dapat diprediksi tanpa pengukuran langsung.
4 Kesimpulan
Evaluasi pelepasan glukosa dari pati melalui protokol in vitro yang dijelaskan dalam penelitian ini mudah dilakukan, hemat biaya, dan tidak memiliki masalah etika. Dengan menggunakan protokol baru ini, kami dapat membandingkan tingkat dan waktu hidrolisis pati dalam berbagai makanan komersial. Karena enzim sukrase dan laktase tidak disertakan dalam protokol, makanan yang dipertimbangkan dalam penelitian ini tidak memiliki atau memiliki kandungan sukrosa/laktosa yang sangat rendah.
Meskipun tidak setara dengan evaluasi GI, protokol in vitro ini dapat berguna untuk mengklasifikasikan makanan bertepung dan, setelah divalidasi lebih lanjut secara in vivo, protokol ini dapat memberikan informasi yang memungkinkan konsumen untuk menyesuaikan pilihan makanan mereka dengan tepat. Selain itu, karena ada banyak faktor yang memengaruhi GI, termasuk jenis pati, jumlah dan jenis serat, bahan nontepung, ukuran partikel makanan, pH, dan pemrosesan, dll., dan formulasi produk GI rendah merupakan tantangan bagi industri makanan, protokol in vitro yang dilaporkan di sini dapat membantu dalam langkah awal pengembangan prototipe, yang terbukti menguntungkan dalam hal waktu dan biaya.

