
ABSTRAK
Penelitian ini bertujuan untuk mengetahui bagaimana ekstrak hawthorn melindungi terhadap kerusakan yang disebabkan oleh torsi/detorsi (T/D). Dalam penelitian ini, empat kelompok dibentuk, masing-masing terdiri dari delapan tikus: kontrol, T/D, ekstrak hawthorn dosis rendah (T/D + LD), dan ekstrak hawthorn dosis tinggi (T/D + HD). Efek hormon testosteron dan parameter stres oksidatif dari tingkat antioksidan total (TAS), tingkat oksidan total (TOS), serta indeks stres oksidatif (OSI) dievaluasi. Kami memeriksa efek histopatologis dari ekstrak hawthorn. Selain itu, jumlah sperma dan motilitas dianalisis. Analisis dilakukan menggunakan program IBM SPSS v22, dan nilai p kurang dari 0,05 dianggap signifikan secara statistik. Parameter testosteron, TAS, TOS, dan OSI menunjukkan perbedaan statistik antara kelompok-kelompok ( masing-masing p = 0,014, p = 0,009, p = 0,021, p = 0,004). Perbedaan kelompok dalam volume testis signifikan secara statistik ( p = 0,001). Jumlah sperma menunjukkan perbedaan yang signifikan secara statistik antara kelompok-kelompok ( p = 0,00). Motilitas sperma hanya dipengaruhi oleh kelompok-kelompok pada tingkat yang signifikan secara statistik ( p = 0,00). Secara histopatologi, kerusakan jaringan menurun pada kelompok ekstrak hawthorn dibandingkan dengan kelompok T/D. Ekstrak hawthorn memiliki potensi untuk meringankan kerusakan yang disebabkan oleh T/D dengan mengurangi stres oksidatif dan melindungi jaringan testis. Temuan ini menunjukkan bahwa ekstrak hawthorn mungkin memiliki potensi terapeutik dalam mengurangi kerusakan oksidatif yang disebabkan oleh torsi testis dan memberikan efek perlindungan yang berkelanjutan. Studi jangka panjang harus menyelidiki efek ekstrak hawthorn secara lebih rinci, karena temuan ini menunjukkan bahwa ekstrak ini mungkin merupakan pilihan pengobatan yang menjanjikan untuk cedera testis akut.
1 Pendahuluan
Keadaan darurat bedah urogenital yang paling umum adalah torsio testis (TT) pada anak-anak, sementara itu dianggap sebagai keadaan darurat bedah paling umum kedua pada pria muda. Perkiraan menunjukkan bahwa satu dari setiap empat ribu pria berusia di atas 25 tahun terkena torsio testis (Jacobsen et al. 2020 ). Tingkat kerusakan bergantung pada durasi dan tingkat keparahan iskemia. Reperfusi memulihkan aliran darah ke jaringan testis; namun, selama proses ini, reoksigenasi jaringan menyebabkan produksi spesies oksigen reaktif (ROS) (Bozok et al. 2022 ). T/D adalah cedera iskemia/reperfusi (I/R) (Küçük et al. 2021 ). Kerusakan jangka panjang dalam jaringan testis diamati setelah detorsi. Khususnya, penelitian telah menunjukkan bahwa aktivitas oksidatif yang intens tetap ada bahkan 7 hari setelah detorsi, yang menyebabkan kerusakan pada testis iskemik dan kontralateral. Dalam TT, menjaga testis sangatlah penting. Metode pengobatan yang paling efektif untuk TT adalah intervensi bedah, yang meliputi detorsi dan fiksasi testis atau orkiektomi, tergantung pada tingkat kerusakan testis (Capraro et al. 2008 ). Atrofi testis dapat terjadi setelah detorsi karena produksi ROS dan sistem pertahanan antioksidan tidak seimbang. Lebih jauh lagi, produksi ROS yang berlebihan pada testis menyebabkan kerusakan langsung pada jaringan testis, yang menyebabkan penurunan jumlah dan viabilitas sperma, ketidakseimbangan lipid, dan peningkatan kerusakan DNA, yang semuanya pada akhirnya berkontribusi pada infertilitas pria. Oleh karena itu, mengurangi stres oksidatif pada jaringan testis setelah detorsi sangatlah penting. Baru-baru ini, antioksidan telah menjadi fokus dari penelitian yang menjanjikan yang bertujuan untuk mencegah atrofi dan kerusakan testis (Abadi et al. 2023 ; Ekşi et al. 2020 ; Moradi-Ozarlou et al. 2020 ; Yuluğ et al. 2014 ). Flavonoid adalah salah satu senyawa antioksidan utama. Flavonoid dicirikan oleh struktur polifenolnya dan menunjukkan sifat antioksidan dan antiinflamasi yang kuat (Maleki et al. 2019 ). Dengan sifat-sifat ini, flavonoid berkontribusi pada perlindungan jaringan testis dengan mengurangi stres oksidatif dan meningkatkan kualitas sperma. Selain itu, flavonoid memberikan efek gonadoprotektif melalui jalur STAT dan NF-κB, yang selanjutnya meningkatkan peran protektifnya dalam kesehatan testis (Abadi et al. 2023 ; Seker et al. 2024 ). Salah satu flavonoid ini adalah hawthorn ( Crataegi fructus ), yang juga dikenal sebagai thorn, maybush, atau whitehorn (Cui et al. 2006 ). Investigasi in vitro telah menunjukkan efek antiapoptotiknya melalui eliminasi ROS dalam keratinosit (Liu et al. 2019).) dan karakteristik anti-tumorigeniknya pada limfoma sel B dan melanoma (Liu et al. 2019 ; Mustapha et al. 2016 ). Penelitian pada makrofag menunjukkan bahwa ia mengurangi pembentukan sel busa melalui efek anti-inflamasinya (Bai et al. 2024 ) dan memiliki kemampuan imunomodulatori (Liao et al. 2024 ). Pada sel neuronal, ia diusulkan untuk meningkatkan mekanisme anti-penuaan melalui sifat antioksidannya (Wang et al. 2022 ). Studi in vivo telah menunjukkan sifat antiinflamasi (Seyidoglu et al. 2024 ), antioksidan (Liu et al. 2019 ), antiapoptotik (Wang et al. 2019 ), antitumor (Mustapha et al. 2016 ), antilipidemik (Mao et al. 2022 ), antiglikemik (Gu et al. 2023 ), antineurodegeneratif (Zhang et al. 2022 ), dan antiaterosklerosis (Koch dan Malek 2011 ). Ekstrak hawthorn telah ditemukan berfungsi sebagai imunomodulator yang kuat dengan menambah kuantitas dan proporsi keseluruhan splenosit T dan B (Lis et al. 2020 ). Salah satu mekanisme utama ekstrak hawthorn dalam memberikan efek biologisnya mungkin adalah pencegahan peroksidasi lipid melalui penghambatan pembentukan ROS (Wang et al. 2011 ). Oleh karena itu, kami berhipotesis bahwa ekstrak hawthorn dapat melindungi struktur dan fungsi jaringan testis dengan mengurangi stres oksidatif jangka panjang yang disebabkan oleh TT.
Tujuan dari penelitian ini adalah untuk mengevaluasi efek perlindungan ekstrak hawthorn dalam model T/D. Kami bertujuan untuk menyelidiki peran terapeutik potensial ekstrak hawthorn dalam mengurangi stres oksidatif, perubahan hormonal, dan kerusakan histologis yang disebabkan oleh torsi testis. Selain itu, kami berusaha untuk menentukan efek dari berbagai dosis ekstrak hawthorn pada jaringan dan fungsi testis, menilai apakah itu dapat berfungsi sebagai agen yang efektif dalam mengurangi kerusakan jaringan setelah torsi testis. Kami memilih ekstrak hawthorn untuk penelitian kami karena toksisitas dan efek sampingnya yang minimal yang terdokumentasi dengan baik (Kao et al. 2005 ), aksesibilitasnya, efektivitas biaya, dan sifat antioksidan yang kuat sebagai produk alami. Akibatnya, kami menunjukkan efek ekstrak hawthorn pada berbagai dosis pada jaringan dan fungsi testis pada hewan yang mengalami model torsi testis.
Temuan kami menunjukkan bahwa ekstrak hawthorn dapat memberikan manfaat perlindungan dengan mengurangi beberapa efek samping yang terkait dengan torsi testis. Penelitian selanjutnya harus bertujuan untuk menjelaskan mekanisme yang mendasari efek perlindungan ini dan menyelidiki potensi penerapannya pada manusia, yang pada akhirnya meningkatkan akses ke pilihan terapi alternatif.
2 Bahan dan Metode
2.1 Kelompok Belajar
Ukuran sampel yang diperlukan untuk penelitian ini ditentukan berdasarkan ukuran efek untuk uji Analisis Varians Satu Arah (ANOVA), yang dihitung sebagai η 2 = 0,30 ( f = 0,67). Estimasi ini memastikan daya statistik sebesar 80% dan tingkat keyakinan sebesar 95%. Akibatnya, total 32 tikus diikutsertakan dalam penelitian ini, dengan 8 tikus dialokasikan untuk setiap kelompok. Ukuran sampel penelitian ini ditentukan dengan menggunakan perangkat lunak Gpower 3.1. Hewan jantan albino Wistar yang akan digunakan dalam penelitian ini diperoleh dari 32 Nesa Experimental Animals Laboratory R&D and Consultancy Industry and Trade Ltd. Co. dengan biaya mereka sendiri. Hewan-hewan tersebut dialokasikan secara acak ke dalam empat kelompok. Kelompok 1 adalah kontrol (C), Kelompok 2 adalah T/D, Kelompok 3 adalah ekstrak hawthorn 100 mg/kg + T/D (LD + T/D), dan Kelompok 4 adalah ekstrak hawthorn 200 mg/kg + T/D (HD + T/D), dengan 8 ekor hewan dalam setiap kelompok. Anestesi menyebabkan satu ekor hewan mati selama penelitian, yang menyebabkan pemindahan satu ekor hewan dari kelompok kontrol ke kelompok eksperimen, sehingga kelompok kontrol menjadi beranggotakan tujuh ekor hewan.
2.2 Pengembangan Model Eksperimen
Semua kelompok bedah menerima manajemen intraperitoneal (ip) ketamin (35–50 mg/kg) dan xylazine (5–10 mg/kg) untuk tujuan anestesi. Kelompok 1 hanya menjalani laparotomi garis tengah. Setelah sayatan inguinoskrotal kiri, kelompok 2 T/D menginduksi torsi testis unilateral (TT) dengan memutar testis kiri 720° searah jarum jam (Gambar 1A,B ). Testis kemudian diamankan di dalam hemiskrotum menggunakan jahitan sutra atraumatik. Setelah 120 menit iskemia, tikus menjalani prosedur detorsi korda spermatika, diikuti oleh 120 menit reperfusi (Yesil et al. 2022 ), (Gambar 1C,D ). Untuk mempertahankan reperfusi setelah iskemia, natrium heparin (500 IU/kg) diinfus melalui vena perifer ekor (Yuluğ et al. 2014 ).
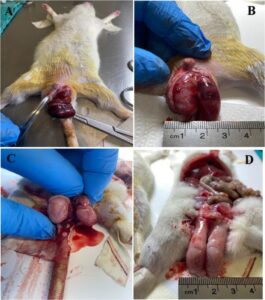
Untuk Kelompok 3 dan 4, ekstrak hawthorn 100 mg/kg dan ekstrak hawthorn 200 mg/kg (Te-Ha Agricultural Consultancy Industry Trade.-015071-03.11.2022) dibeli dan diberikan secara intraperitoneal ke T/D, 30 menit sebelum prosedur iskemik (Hosseinimehr et al. 2007 ). Selanjutnya, diakhiri dengan penerapan model T/D dan heparin seperti yang dijelaskan pada Kelompok 2.
Eutanasia dilakukan dengan mengambil darah dari aorta abdominalis dengan anestesi ketamin (35–50 mg/kg) dan xylazine (5–10 mg/kg). Sebelum dikorbankan, hewan dievaluasi untuk mengetahui tidak adanya refleks, termasuk refleks cubitan jari kaki dan refleks kornea, untuk memastikan ketidaksadaran. Prosedur eutanasia terakhir baru dilakukan setelah memastikan ketidaksadaran total. Setelah denyut jantung dan pernapasan berhenti, jaringan testis dikumpulkan untuk analisis histopatologi. Selain itu, sampel vesikula seminalis dikumpulkan untuk menghitung sperma dan menilai motilitas.
2.3 Jumlah Sperma dan Analisis Motilitas
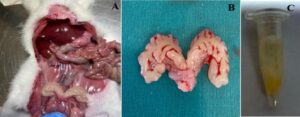
Vesikula seminalis dieksisi untuk mengekstraksi sperma yang terkandung (Gambar 2A,B ). Sperma yang dikumpulkan dengan spuit (Gambar 2C ) ditempatkan ke dalam tabung. Area mikroskopis menjalani pemindaian sistematis, dengan setiap sperma dievaluasi. Motilitas diukur dengan menghitung jumlah total spermatozoa yang tidak bergerak dan dinyatakan sebagai persentase. Nilai motilitas dikategorikan sebagai motil atau imotil. Penentuan jumlah sperma dilakukan dengan menggunakan hemocytometer. Dari setiap sampel yang tercampur dengan baik, rasio pengenceran 1:20 dicapai dengan menggabungkan 50 μL spermatozoa epididimis dalam larutan garam fisiologis yang sesuai menggunakan 950 μL pengencer. Jumlah dari kedua ruang hemocytometer dicatat, dan rata-ratanya dihitung, asalkan perbedaan antara kedua jumlah tersebut tidak melebihi 1/20 dari total, yang sesuai dengan perbedaan kurang dari 10%. Jumlah yang melebihi ambang batas ini dibuang, sehingga pengenceran sampel harus dicampur ulang dan hemocytometer baru harus disiapkan. Rata-rata enam hitungan (tiga dari setiap bilik) kemudian dihitung dan dinyatakan sebagai 106 / mL (Ikebuaso et al. 2012 ).
2.4 Analisis Testosteron
Sampel darah yang diambil secara intrakardial akan dianalisis untuk testosteron menggunakan metode ELISA. Kit uji imunosorben terkait enzim (katalog BT-lab no. EA0023Ra) dianalisis menggunakan pembaca untuk pelat mikro. Pencuci strip BIO-TEK EL X 800-Auto digunakan, bersama dengan perangkat BIO-TEK EL X 50. 10 μL larutan standar digunakan untuk mengalokasikan spesimen dan mengaturnya ke dalam sumur berlapis. Setelah penambahan 100 μL reagen konjugat dan 50 μL reagen anti-testosteron, inkubasi dilakukan selama 90 menit. Campuran dicuci dan diinkubasi selama 20 menit tambahan. Reaksi akan dihentikan dengan menambahkan 100 μL asam klorida 1 N. Absorbansi diukur pada 450 nm dengan spektrofotometer otomatis. Grafik absorbansi terhadap konsentrasi larutan referensi diplot untuk mendapatkan kurva standar, dan konsentrasi testosteron ditentukan (Tietz 1995 ).
2.5 Perhitungan Tingkat Total Oksidan/Antioksidan dan Indeks Stres Oksidatif
Tingkat TOS diukur menggunakan kit yang tersedia secara komersial (uji Rel, Turki). Oksidan dalam sampel mengubah kombinasi ion ferro-o-dianisidin menjadi ion ferri. Kehadiran banyak molekul gliserol dalam media reaksi memfasilitasi reaksi oksidasi. Ion ferri membentuk kombinasi warna-warni dengan jingga xilenol dalam lingkungan asam. Intensitas warna, diukur secara spektrofotometri pada serapan 530 nm (Mindray-BS400), sesuai dengan total kandungan molekul oksidan dalam sampel. Uji dikalibrasi menggunakan hidrogen peroksida, dan hasilnya dinyatakan sebagai μmol H 2 O 2 ekuivalen/L (Erel 2005 ).
TAS dinilai menggunakan kit yang tersedia secara komersial (Rel assay, Turki). Teknik otomatis yang revolusioner ini bergantung pada antioksidan yang menghilangkan warna khas dari kation radikal ABTS (2,2′-Azino-bis-3-ethylbenzothiazoline-6-sulfonic acid) yang lebih stabil. Hasil eksperimen dianalisis menggunakan spektrofotometer (Mindray-BS400) yang diatur pada panjang gelombang serapan 660 nm. Data disajikan sebagai mmol Trolox ekuivalen per liter (Erel 2004 ).
Rasio TOS terhadap TAS didefinisikan sebagai OSI. Satuan TAS diubah menjadi μmol/L untuk perhitungan, dan nilai OSI ditetapkan menggunakan rumus berikut:
OSI (satuan sembarang) = TOS (setara μmol H 2 O 2 /L)/TAC (setara μmol Trolox/L) (Harma dkk. 2003 ; Kosecik dkk. 2005 ; Yumru dkk. 2009 ).
2.6 Pengukuran Volume
Volume testis diukur dengan metode perpindahan air. Volume organ testis kiri setiap tikus dihitung, dan nilai rata-rata diperoleh. Hal ini dianggap sebagai pengamatan tunggal dan dinyatakan dalam mL (Ikebuaso et al. 2012 ).
2.7 Analisis Histopatologi
Segmen sampel biopsi dari testis direndam dalam reagen Bouin (Sigma-Aldrich, St. Louis, MO, AS) pada suhu +4°C selama 12 jam, diikuti dengan dehidrasi melalui seri klasifikasi etanol. Spesimen kemudian dibersihkan dalam xilena dan difiksasi dalam parafin. Potongan melintang serial, setebal 5 μm, diperoleh dari blok jaringan yang tertanam dalam parafin menggunakan mikrotom berputar (Leica, Nussloch, Jerman) dan dipasang pada slide kaca (Menzel Gläser, Braunschweig, Jerman) untuk pewarnaan hematoxylin dan eosin (HE) berikutnya. Evaluasi histopatologi spesimen biopsi jaringan testis dilakukan menggunakan pewarnaan HE, sesuai dengan penelitian kami sebelumnya. Para profesional menilai slide yang diwarnai HE menggunakan mikroskop medan terang (Olympus, Jena, Jerman) untuk memastikan karakteristik histologis dan skor Johnsen (Johnsen 1970 ). Sistem penilaian empat tingkat diperkenalkan untuk menilai perubahan histopatologis pada biopsi testis (Ozturk et al. 2016 ). Spermatogenesis dinilai dengan menganalisis profil seluler dalam tubulus seminiferus. Setiap sampel menjalani evaluasi tubulus seminiferus, yang dinilai pada skala 1–10 berdasarkan sistem penilaian Johnsen (Johnsen 1970 ).
2.8 Analisis Statistik
Analisis statistik menggunakan model linear umum-ANCOVA untuk menilai perbedaan signifikan di antara keempat kelompok: C, T/D, T/D + LD, dan T/D + HD. Model ini dipilih karena memenuhi asumsi uji parametrik dan memfasilitasi penilaian dampak kolektif Kelompok, Testosteron, TAS, dan TOS pada variabel dependen, yang meliputi volume testis, jumlah sperma, dan motilitas sperma. Koefisien korelasi peringkat Spearman digunakan untuk analisis korelasi, karena cocok untuk data yang terdistribusi tidak normal (dievaluasi menggunakan uji Shapiro–Wilk, p < 0,05). Untuk mengurangi kemungkinan kesalahan Tipe I dalam beberapa perbandingan, koreksi Bonferroni digunakan jika sesuai. Teknik bioinformatika dan basis data yang dapat diakses publik digunakan untuk analisis pengayaan jalur untuk menemukan jalur yang diperkaya secara signifikan yang terkait dengan indikator stres oksidatif. Kriteria untuk signifikansi statistik dalam pengayaan jalur ditetapkan pada p < 0,05, dengan modifikasi untuk beberapa perbandingan sebagaimana diperlukan. Untuk variabel yang gagal memenuhi asumsi normalitas atau homogenitas varians, uji Kruskal-Wallis digunakan untuk perbandingan beberapa kelompok, sedangkan uji Mann–Whitney U digunakan untuk perbandingan berpasangan. Semua analisis statistik dilakukan dengan menggunakan IBM SPSS v22, dengan nilai p di bawah 0,05 yang signifikan secara statistik.
3 Hasil
3.1 Sampel Serum Hormon Testosteron dan Analisis Stres Oksidatif
Dalam 4 parameter variabel yang berbeda, kontrol menunjukkan nilai rata-rata, deviasi standar, media, dan rata-rata sortasi untuk T/D, T/D + LD, dan T/D + HD. Ini menunjukkan bahwa terdapat perbedaan substansial antara kelompok untuk kadar testosteron ( p = 0,014). Peringkat rata-rata kelompok kontrol adalah yang tertinggi pada 12,57, diikuti oleh kelompok T/D + LD pada 22,94. Kadar TAS di antara kelompok-kelompok tersebut berbeda secara signifikan ( p = 0,009). Kelompok kontrol menunjukkan nilai peringkat rata-rata tertinggi, 23,29. Di antara semua kelompok, kelompok T/D + LD menunjukkan nilai TAS tertinggi, kedua setelah kelompok kontrol. Kadar TOS berbeda secara signifikan di antara kelompok-kelompok tersebut ( p = 0,021). T/D memiliki baris rata-rata tertinggi dengan 22,38, sedangkan T/D + LD memiliki derajat terendah dengan 8,50. OSI di antara kelompok-kelompok tersebut signifikan secara statistik ( p = 0,004). T/D mencapai rata-rata tertinggi yaitu 24,25, sedangkan T/D + LD memiliki baris rata-rata terendah. Hal ini menunjukkan bahwa T/D memiliki kinerja yang jauh lebih unggul dibandingkan dengan kelompok T/D + LD untuk kepuasan umum, seperti yang ditunjukkan pada peringkat rata-rata yang tinggi (Tabel 1 ).
| Variabel | Kelompok | Nomor | Berarti | SD | Rata-rata | Peringkat rata-rata | P |
|---|---|---|---|---|---|---|---|
| Testosteron | Kontrol | 7 | 4.24 | 1.15 | 3.89 | 12.57 | 0,014 * |
| T/D | 8 | 3.82 | 1.67 | 3.25 | 9.38 | ||
| T/D + LD | 8 | 5.90 | 1.55 | 6.02 | 22.94 | ||
| T/D + HD | 8 | 4.69 | 1.04 | 4.36 | 18.69 | ||
| TAS | Kontrol | 7 | 1.81 | 0.23 | 1.87 | Tanggal 23.29 | 0,009 * |
| T/D | 8 | 1.41 | 0.33 | 1.34 | 9.75 | ||
| T/D + LD | 8 | 1.98 | 0.29 | 1.63 | pukul 20.00 | ||
| T/D + HD | 8 | 1.41 | 0,07 | 1.41 | 11.88 | ||
| Persyaratan Layanan | Kontrol | 7 | 3.36 | 1.86 | 2.42 | pukul 18.00 | 0,021 * |
| T/D | 8 | 4.58 | 2.09 | 5.01 | 22.38 | ||
| T/D + LD | 8 | 1.98 | 0,89 | 1.55 | 8.50 | ||
| T/D + HD | 8 | 2.75 | 1.07 | 2.61 | 15.38 | ||
| Sistem Operasi | Kontrol | 7 | 0.18 | 0,08 | 0.13 | 15.71 | 0,004 * |
| T/D | 8 | 0.34 | 0.18 | 0.32 | tanggal 24.25 | ||
| T/D + LD | 8 | 0.12 | 0,06 | 0.11 | 7.63 | ||
| T/D + HD | 8 | 0.19 | 0,09 | 0.18 | 16.38 |
Catatan: (1) Kontrol (C), (2) Kelompok detorsi torsi testis (T/D), (3) Detorsi torsi testis + Ekstrak hawthorn dosis rendah (T/D + LD), (4) Detorsi torsi testis + Ekstrak hawthorn dosis tinggi (T/D + HD). Parameter testosteron, kadar antioksidan total (TAS), kadar oksidan total (TOS), indeks stres oksidatif (OSI) menunjukkan perbedaan statistik antara kelompok ( masing-masing p = 0,014, p = 0,009, p = 0,021, p = 0,004). Singkatan: SS, deviasi standar. * p < 0,05 signifikan secara statistik. Kruskal-Wallis H.
Dalam hal tingkat testosteron (ng/ml), kelompok T/D + LD dan T/D + HD menunjukkan perbedaan yang signifikan secara statistik relatif terhadap kontrol (keduanya, p = 0,008). Lebih jauh, diamati bahwa kadar testosteron meningkat secara signifikan secara statistik pada T/D + LD dibandingkan dengan T/D ( p = 0,01). Dalam hal TAS (mmol/L), T/D, dan T/D + HD menurun secara signifikan secara statistik dibandingkan dengan kontrol (dalam urutan p = 0,02, p = 0,01). TAS pada T/D + LD meningkat secara signifikan secara statistik dibandingkan dengan T/D + HD ( p = 0,01). TOS pada T/D meningkat secara signifikan secara statistik dibandingkan dengan T/D + HD ( p = 0,01 ). TOS pada T/D meningkat secara statistik dibandingkan dengan T/D + LD dan T/D + HD ( masing-masing p = 0,006, p = 0,04). TOS lebih tinggi daripada T/D + LD, signifikan secara statistik dibandingkan dengan kontrol. Dalam hal OSI, nilai T/D + LD OSI menurun dengan signifikansi statistik dibandingkan dengan kontrol dan T/D (dalam urutan p = 0,007, p = 0,001) (Gambar 3 ).

Pengaruh variabel bebas kelompok, testosteron, TAS, dan TOS, pada volume testis dianalisis (Tabel 1 ). Model menjelaskan 59,8% dari total varians ( R2 = 0,598, adjusted R2 = 0,426). Volume testis menunjukkan pengaruh signifikan pada variabel terikat ( p = 0,009) (Tabel 3 ). Perbedaan signifikan ditemukan antara volume testis dan kelompok ( p = 0,001, parsial η2 = 0,530) (Tabel 3 ). Ditemukan bahwa TOS memiliki pengaruh signifikan pada volume testis ( p = 0,033, parsial η2 = 0,199) (Tabel 3 ). Interaksi signifikan ditemukan antara kadar TOS antarkelompok (kelompok * TOS) dan volume testis ( p = 0,023 , parsial η2 = 0,359 ) (Tabel 2 ).
| Variabel dependen: Volume testis. IDFN | ||||||||
|---|---|---|---|---|---|---|---|---|
| Sumber | Jumlah kuadrat tipe III | df | Kuadrat rata-rata | F | Tanda tangan. | Eta kuadrat parsial | Nonsen. Parameter | Daya yang diamati b |
| Model yang Dikoreksi | 0,341 satuan | 9 | 0,038 | 3.476 | 0,009 | 0,598 | 31.284 | 0.926 |
| Mencegat | 0.249 | 1 | 0.249 | 22.812 | 0.000 | 0.521 | 22.812 | 0,995 |
| Kelompok | 0,259 | 3 | 0,086 tahun | 7.909 | 0,001 * | 0.530 | 23.726 | 0,972 tahun |
| Testosteron. IDFN | 0,026 | 1 | 0,026 | 2.341 | 0.141 | 0.100 | tahun 2341 | 0.309 |
| TAS.IDFN | 0,022 | 1 | 0,022 | 2.033 | 0.169 | 0,088 | tahun 2033 | 0,275 |
| TOS.IDFN | 0,057 tahun | 1 | 0,057 tahun | 5.224 | 0,033 * | 0,199 | 5224 | 0,587 tahun |
| Grup * TOS. IDFN | 0.128 | 3 | 0,043 tahun | 3.923 | 0,023 * | 0.359 | 110.770 | 0.750 |
| Kesalahan | 0.229 | 21 | 0,011 | |||||
| Total | 8.867 | 31 | ||||||
| Total yang Dikoreksi | 0,570 | 30 | ||||||
Catatan: ANCOVA, R kuadrat yang disesuaikan = 0,598 ( R kuadrat yang disesuaikan = 0,426), Kadar Antioksidan Total (TAS), Kadar Oksidan Total (TOS). Volume testis menunjukkan perbedaan yang signifikan secara statistik antara kelompok (a, b) ( p = 0,001). Volume testis dipengaruhi secara signifikan secara statistik oleh TOS dan kelompok ( masing-masing p = 0,033, p = 0,023). * p < 0,05 signifikan secara statistik.
Testosteron dan TAS tidak memiliki efek signifikan pada volume testis (dalam urutan p = 0,141, p = 0,169), (Tabel 2 ). Kelompok kontrol memiliki nilai rata-rata yang disesuaikan dari Testicular Volume IDFN 0,659 (kesalahan standar: 0,044) dan lebih besar daripada kelompok lain. Interval kepercayaan 95% dari kontrol berada di antara 0,568 dan 0,751, yang merupakan indikator potensial dari perbedaan substansial antara pengelompokan. Tingkat volume testis pada T/D + LD secara statistik menurun dibandingkan dengan kontrol ( p = 0,11). Volume testis meningkat secara statistik pada T/D dibandingkan dengan T/D + LD ( p = 0,40). Selain itu, volume testis menurun secara statistik pada T/D + LD dibandingkan dengan T/D + HD ( p = 0,14).
Perbedaan antara kelompok-kelompok berkenaan dengan volume testis signifikan secara statistik ( p = 0,019). Tingkat volume testis pada T/D + LD secara statistik menurun dibandingkan dengan kontrol ( p = 0,11). Volume testis meningkat secara statistik pada T/D dibandingkan dengan T/D + LD ( p = 0,40). Selain itu, volume testis menurun secara statistik pada T/D + LD dibandingkan dengan T/D + HD ( p = 0,14) (Tabel 3 ).
| Variabel Terikat: Volume Testis.IDFN | |||||||
|---|---|---|---|---|---|---|---|
| Kelompok | Rata-rata ± SD | Rata-rata | Peringkat rata-rata | P * | P * | P * | P * |
| Kontrol | 0,60 ± 0,111 | 0.641 | 21.57 | 0,152 (1–2) | 0,011 (1–3) * | 0,281 (1–4) | 0,019 * |
| T/D | 0,52 ± 0,090 | 0,534 tahun | 15.88 | 0,152 (2–1) | 0,040 (2–3) * | 0,878 (2–4) | |
| T/D + LD | 0,41 ± 0,064 | 0.403 | 7.14 | 0,011 (3–1) * | 0,040 (3–2) * | 0,014 (3–4) * | |
| T/D + HD | 0,54 ± 0,099 | 0.494 | Tanggal 17.13 | 0,281 (4–1) | 0,878 (4–2) | 0,014 (4–3) * | |
Catatan: (1) Kontrol (C); (2) Kelompok detorsi torsi testis (T/D); (3) Detorsi torsi testis + Ekstrak hawthorn dosis rendah (T/D + LD); (4) Detorsi torsi testis + Ekstrak hawthorn dosis tinggi (T/D + HD). Tingkat volume testis pada T/D + LD secara statistik menurun dibandingkan dengan kelompok kontrol ( p = 0,11). Volume testis meningkat secara statistik pada kelompok T/D dibandingkan dengan kelompok T/D + LD ( p = 0,40). Selain itu, volume testis menurun secara statistik pada kelompok T/D + LD dibandingkan dengan T/D + HD ( p = 0,14). * p < 0,05 signifikan secara statistik. Mann–Whitney U Kruskal-Wallis H.
3.2 Jumlah Sel Sperma dan Analisis Morfologi
Sampel sperma ditempatkan pada slide Thoma yang telah dibersihkan dan disiapkan sebelumnya. Pencitraan 100x juga memungkinkan penilaian yang lebih akurat tentang keadaan motilitas dan kualitas sperma (Gambar 4D ). Data yang diperoleh diperiksa dalam tabel. Sampel diperiksa di bawah mikroskop fluoresensi pada tingkat perbesaran yang berbeda untuk menilai motilitas, morfologi, dan jumlah sperma. Perbesaran 10x digunakan untuk mengevaluasi area umum (Gambar 4A ), perbesaran 20x untuk mengamati motilitas lebih detail dan menilai konsentrasi sperma (Gambar 4B ), dan perbesaran 40x untuk menganalisis fitur struktural (Gambar 4C ) . Perbedaan signifikan terdeteksi di antara kelompok berdasarkan jumlah sperma ( p = 0,000). Nilai eta kuadrat parsial ( η2 = 0,745) adalah 74,5% dari varians jumlah sperma kelompok, yang menunjukkan bahwa efek perbedaan pada jumlah sperma cukup tinggi. Jumlah sperma secara statistik hanya dipengaruhi oleh perubahan intragroup ( p = 0,00). Kadar testosteron dan TAS tidak secara signifikan mempengaruhi jumlah sperma (Tabel 4 ).

| Jumlah kuadrat tipe III | df | Kuadrat rata-rata | F | Tanda tangan. | Eta kuadrat parsial | Parameter nonsen | Daya yang diamati b | |
|---|---|---|---|---|---|---|---|---|
| Jumlah sperma | ||||||||
| Model yang dikoreksi | 2990.443 sebuah | 5 | 598.089 | 20.407 | 0.000 | 0.803 | Nomor telepon 102.035 | 1.000 |
| Mencegat | 734.209 | 1 | 734.209 | 25.052 | 0.000 | 0,501 tahun | 25.052 | 0,998 |
| Kelompok | 2143.701 | 3 | 714.567 | 24.381 | 0,000 * | 0,745 tahun | 73.144 | 1.000 |
| Motilitas sperma | ||||||||
| Model yang dikoreksi | 5336.100 sebuah | 6 | 889.350 | 18.268 | 0.000 | 0.820 | 109.609 | 1.000 |
| Mencegat | 2813.059 | 1 | 2813.059 | 57.783 | 0.000 | 0.707 | 57.783 | 1.000 |
| Kelompok | 4684.174 | 3 | 1561.391 | 32.073 | 0,000 * | 0.800 | 96.218 | 1.000 |
Catatan: ANCOVA, jumlah sperma yang disesuaikan dengan R kuadrat = 0,803 (R kuadrat = 0,764), ANCOVA, motilitas sperma yang disesuaikan dengan R kuadrat = 0,820 (R kuadrat = 0,775), p < 0,05 signifikan secara statistik. Kadar Antioksidan Total (TAS). Jumlah dan motilitas sperma menunjukkan perbedaan yang signifikan secara statistik antara kelompok (a, b) ( p = 0,00). * p < 0,05 signifikan secara statistik.
Jumlah sperma pada kelompok T/D secara statistik menurun secara signifikan dibandingkan dengan kelompok kontrol, T/D + LD, dan juga T/D + HD (dalam urutan p = 0,00, p = 0,021, p = 0,00). Jumlah sperma pada kelompok T/D + LD dan T/D + HD secara statistik sedikit lebih rendah secara signifikan dibandingkan dengan kelompok kontrol (dalam urutan p = 0,00, p = 0,01) (Tabel 5 ).
| (I) Kelompok | (J) Grup | Perbedaan rata-rata (I–J) | Kesalahan standar | Tanda tangan a | Interval keyakinan 95% untuk perbedaan a | |
|---|---|---|---|---|---|---|
| Batas bawah | Batas atas | |||||
| Kontrol | T/D | 25.843 * | 3.222 | 0,000 * | 16.613 | 35.073 |
| T/D + LD | 15.461 * | 2.902 | 0,000 * | 7.146 | 23.776 | |
| T/D + HD | 11.079 * | 3.159 | 0,010 * | 2.030 | 20.129 | |
| T/D | Kontrol | -25.843 * | 3.222 | 0,000 * | -35.073 | -16.613 |
| T/D + LD | -10.382 * | 3.212 | 0,021 * | -19.583 | -1,181 | |
| T/D + HD | -14.764 * | 2.934 | 0,000 * | -23.171 | -6.357 | |
| T/D + LD | Kontrol | -15.461 * | 2.902 | 0,000 * | -23.776 | -7.146 |
| T/D | 10.382 * | 3.212 | 0,021 * | 1.181 | 19.583 | |
| T/D + HD | -4.382 | 2.905 | 0.864 | -12.703 | 3.940 | |
| T/D + HD | Kontrol | -11.079 * | 3.159 | 0,010 * | -20.129 | -2.030 |
| T/D | 14.764 * | 2.934 | 0,000 * | 6.357 | 23.171 | |
| T/D + LD | 4.382 | 2.905 | 0.864 | -3.940 | 12.703 | |
Catatan: (1) Kontrol (C); (2) Kelompok detorsi torsi testis (T/D); (3) Detorsi torsi testis + Ekstrak hawthorn dosis rendah (T/D + LD); (4) Detorsi torsi testis + Ekstrak hawthorn dosis tinggi (T/D + HD). Jumlah sperma pada kelompok T/D secara statistik menurun secara signifikan dibandingkan dengan kontrol, T/D + LD, dan T/D + HD ( masing-masing p = 0,00, p = 0,021, p = 0,00). Jumlah sperma pada kelompok T/D + LD dan T/D + HD secara statistik lebih rendah secara signifikan dibandingkan dengan kelompok kontrol ( masing-masing p = 0,00, p = 0,01). Berdasarkan estimasi rata-rata marginal. Penyesuaian untuk beberapa perbandingan: Bonferroni. * Perbedaan rata-rata signifikan pada tingkat 0,05.
Ketika variabel independen yang mempengaruhi jumlah sperma dianalisis, terlihat bahwa variabel kelompok memiliki efek signifikan pada motilitas sperma dengan menjelaskan 80% dari total varians (parsial η 2 = 0,800). Ini mengungkapkan bahwa kelompok yang berbeda memiliki efek signifikan pada motilitas sperma ( p = 0,00) (Tabel 4 ). Variabel testosteron, TAS, dan TOS tidak memiliki efek signifikan pada motilitas sperma ( p = 0,394, p = 0,398, p = 0,725) (Tabel 6 ). Motilitas sperma kelompok T/D menurun dibandingkan dengan T/D + HD dan kontrol (keduanya p = 0,00). Motilitas sperma T/D + LD dan T/D + HD menurun dibandingkan dengan kontrol (dalam urutan p = 0,00, p = 0,001). Motilitas sperma T/D + HD meningkat secara statistik dibandingkan dengan T/D ( p = 0,00).
| (I) Kelompok | (J) Grup | Perbedaan rata-rata (I–J) | Kesalahan standar | Tanda tangan a | Interval keyakinan 95% untuk perbedaan a | |
|---|---|---|---|---|---|---|
| Batas bawah | Batas atas | |||||
| Kontrol | T/D | 37.296 * | 4.256 | 0,000 * | 25.061 | 49.531 |
| T/D + LD | 26.140 * | 4.033 | 0,000 * | 14.545 | 37.735 | |
| T/D + HD | 18.546 * | 4.072 | 0,001 * | 6.839 | 30.252 | |
| T/D | Kontrol | -37.296 * | 4.256 | 0,000 * | -49.531 | -25.061 |
| T/D + LD | -11.156 | 4.805 | 0,174 tahun | -24.970 | 2.657 | |
| T/D + HD | -18.751 * | 3.907 | 0,000 * | -29.985 | -7.517 | |
| T/D + LD | Kontrol | -26.140 * | 4.033 | 0,000 * | -37.735 | -14.545 |
| T/D | 11.156 | 4.805 | 0,174 tahun | -2.657 | 24.970 | |
| T/D + HD | -7.594 | 4.017 | 0.425 | -19.145 | 3.956 | |
| T/D + HD | Kontrol | -18.546 * | 4.072 | 0,001 * | -30.252 | -6.839 |
| T/D | 18.751 * | 3.907 | 0,000 * | 7.517 | 29.985 | |
| T/D + LD | 7.594 | 4.017 | 0.425 | -3.956 | 19.145 | |
Catatan: (1) Kontrol (C); (2) Kelompok detorsi torsi testis (T/D); (3) Detorsi torsi testis + Ekstrak hawthorn dosis rendah (T/D + LD); (4) Detorsi torsi testis + Ekstrak hawthorn dosis tinggi (T/D + HD). Motilitas sperma kelompok T/D menurun dibandingkan dengan T/D + HD dan kontrol (Keduanya p = 0,00). Motilitas sperma T/D + LD dan T/D + HD menurun dibandingkan dengan kontrol ( masing-masing p = 0,00, p = 0,001). Motilitas sperma T/D + HD meningkat secara statistik dibandingkan dengan T/D ( p = 0,00). Berdasarkan estimasi rata-rata marginal. Penyesuaian untuk beberapa perbandingan: Bonferroni. * Perbedaan rata-rata signifikan pada tingkat 0,05.
3.3 Analisis Histopatologi Jaringan Testis
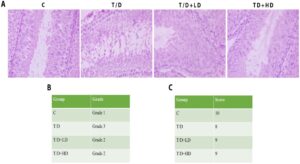
Potongan testis yang diwarnai dengan HE dinilai menggunakan mikroskop medan terang untuk menggambarkan fitur histopatologis, skor Johnsen, dan klasifikasi Cosentino (Yesil et al. 2022 ) (Gambar 5 ). Testis kelompok kontrol menunjukkan spermatogenesis lengkap, dengan keberadaan semua sel epitel germinal, termasuk spermatogonia, spermatosit primer dan sekunder, spermatid bulat, memanjang, dan memanjang, spermatozoa, dan sel Sertoli, serta sel intertubular. Kelompok T/D menunjukkan gangguan spermatogenik yang signifikan, ditandai dengan penurunan substansial pada spermatozoa dan spermatid akhir. Baik kelompok dosis rendah maupun tinggi menunjukkan peningkatan spermatogenesis, sebagaimana dibuktikan oleh peningkatan jumlah spermatid akhir relatif terhadap kelompok T/D. Evaluasi histopatologis, skor Johnsen, dan hasil klasifikasi Cosentino untuk semua kelompok disajikan pada Gambar 5 .
4 Diskusi
Studi ini menunjukkan bahwa ekstrak hawthorn dalam jumlah yang berbeda dapat membantu menurunkan kerusakan yang dilakukan model T/D testis terhadap struktur dan fungsi pada tingkat hormonal, oksidatif, dan histologis. Perbedaan signifikan dalam hormon testosteron, parameter biokimia (TAS, TOS, OSI), dan evaluasi histologis (klasifikasi Grade dan Johnsen) mendukung efek perlindungan ekstrak hawthorn pada jaringan testis. Torsi testis jangka panjang dapat menyebabkan atrofi testis (Grimsby et al. 2018 ), kehilangan testis (Okorie 2011 ), nekrosis sel germinal (Shamsi-Gamchi et al. 2018 ), penangkapan spermatogenesis (Turner et al. 2006 ), atau testosteron serum yang lebih rendah (Turner et al. 2004 ). Semua hal ini dapat membuat tidak mungkin untuk hamil atau memiliki anak. Testosteron adalah androgen dalam testis yang diperlukan untuk memulai dan mempertahankan spermatogenesis, dan produksi sperma matang sangat bergantung pada aksi androgen dalam testis. Karena itu, spermatogenesis berhenti pada tahap meiosis ketika testosteron atau reseptornya tidak ada, yang menyebabkan infertilitas pria (Grande et al. 2022 ). Dalam penelitian kami, diamati bahwa hormon testosteron meningkat secara signifikan pada kelompok ekstrak hawthorn dibandingkan dengan kelompok T/D (Tabel 1 , Gambar 3 ). Literatur telah menunjukkan efek signifikan dari flavonoid yang berbeda, termasuk ekstrak hawthorn, pada kadar testosteron dalam model torsi (Shokoohi et al. 2018 ; Soltani et al. 2018 ). Menurut temuan kami, perubahan yang diamati pada kadar TAS dan TOS dengan jelas menunjukkan bagaimana sifat antioksidan ekstrak hawthorn dapat melindungi jaringan testis (Tabel 1 , Gambar 3 ). ( 2023 ) melaporkan bahwa ekstrak hawthorn mengurangi stres oksidatif dan meningkatkan kadar TAS, yang mengonfirmasi perannya dalam mengoreksi ketidakseimbangan oksidatif intraseluler (Lu et al. 2023 ). Gao et al. ( 2024 ) melaporkan bahwa ekstrak hawthorn mengurangi stres oksidatif dan meningkatkan pertahanan antioksidan pada penyakit hati non-alkohol (Gao et al. 2024 ). Studi kami menghasilkan hasil yang serupa, yang menunjukkan bahwa ekstrak hawthorn menekan stres oksidatif melalui pengurangan TOS dan peningkatan TAS (Tabel 1 , Gambar 3 ). Temuan ini memberikan petunjuk penting untuk memahami dasar biokimia dari cara ekstrak hawthorn mencegah torsi testis. Sifat antioksidan kuat dari flavonoid dan proantosianidin dapat bekerja dengan, antara lain, membersihkan radikal bebas dan menghentikan peroksidasi lipid (Parcheta et al. 2021). Hal ini juga menunjukkan adanya efek flavonoid dari ekstrak hawthorn.
Durasi dan tingkat torsi pada torsi testis sangat penting. Diagnosis dan intervensi bedah yang tepat waktu untuk torsi sangat penting untuk pelestarian testis. Penelitian menunjukkan bahwa jika torsi diperbaiki dalam 6 jam pertama, tingkat penyelamatan testis dapat mencapai 100%. Meskipun demikian, seiring dengan bertambahnya periode torsi, kemungkinan mempertahankan viabilitas testis berkurang secara progresif (Zvizdic et al. 2025 ). Tingkat torsi secara langsung memengaruhi aliran darah testis, sehingga meningkatkan risiko nekrosis testis.
Torsi lebih dari 360° secara nyata mengurangi aliran darah testis, tetapi torsi 720° atau lebih menyebabkan iskemia yang berkepanjangan, yang berpuncak pada kerusakan jaringan testis yang tidak dapat diperbaiki. Menurut literatur, pada torsi 1080°, 50% testis menjadi tidak dapat diperbaiki (Herek et al. 2023 ). Akibatnya, durasi dan tingkat keparahan torsi testis merupakan faktor penting dalam terapi terapeutik. Investigasi kami menggunakan model torsi 720° yang konsisten dengan literatur yang ada (Soltani et al. 2018 ). Model ini dipilih karena menandakan ambang batas di mana deteksi dini dan intervensi segera untuk torsi testis masih layak. Kami tidak secara langsung mengukur aliran darah testis; sebaliknya, kami memvalidasi penghentian aliran darah melalui pengamatan makroskopis (Gambar 1 ). Kendala ini menghalangi kapasitas kami untuk secara langsung mengkorelasikan perubahan aliran darah dengan hasil dari penelitian lain dalam literatur.
Ekstrak hawthorn menunjukkan efek antioksidan dan antiinflamasi yang signifikan, yang berpotensi penting dalam meringankan cedera iskemia-reperfusi yang terkait dengan torsi testis (Tadić et al. 2008 ; Yoo et al. 2016 ). Ekstrak hawthorn mengandung flavonoid dan proantosianidin yang telah terbukti membersihkan radikal bebas, menghambat peroksidasi lipid, dan menambah aktivitas enzim antioksidan endogen, termasuk superoksida dismutase (SOD) dan glutathione peroksidase (GPx) (Shao et al. 2018 ; Tadić et al. 2008 ). Selain itu, ekstrak hawthorn telah terbukti mengatur jalur pensinyalan seluler yang terkait dengan stres oksidatif dan inflamasi. Ekstrak hawthorn telah terbukti mengaktifkan jalur Nrf2/HO-1, pengatur utama respons antioksidan seluler (Yoo et al. 2016 ). Aktivasi ini dapat mengakibatkan ekspresi berlebihan gen sitoprotektif dan peningkatan kapasitas sel untuk melawan kerusakan oksidatif. Selain itu, ekstrak hawthorn telah didokumentasikan untuk menunjukkan sifat vasorelaksan dan pelindung endotelium, yang berpotensi difasilitasi oleh peningkatan sintesis oksida nitrat (NO) dan modulasi aktivitas endotel oksida nitrat sintase (eNOS) (Brixius et al. 2006 ; Leung dan Mw Wong 2013 ). Tindakan vaskular ini dapat meningkatkan sirkulasi darah dan suplai oksigen ke jaringan testis, sehingga meringankan cedera iskemik yang disebabkan oleh torsi testis.
Minas dkk. ( 2023 ) menunjukkan efek parameter testosteron, TAS, dan TOS pada spermatogenesis. Untuk menunjukkan efek ini dan untuk menunjukkan apakah ekstrak hawthorn memiliki efek kuratif, kami mengamati volume testis, jumlah sperma, dan motilitas sperma sebelum data histologis (Tabel 2–6 ). Kami mengamati penurunan yang signifikan dalam volume testis pada T/D dibandingkan dengan kontrol, dan tingkat volume testis yang meningkat secara signifikan pada kelompok yang diobati dengan hawthorn dibandingkan dengan kelompok torsi (Tabel 3 ). Konsisten dengan data yang kami deteksi dalam penelitian kami, (Herek dkk. 2023 ) secara ultrasonografi menunjukkan bahwa salah satu titik data klinis dalam evaluasi torsi testis adalah sumbu pendek testis, dan yang lainnya adalah volume testis (Herek dkk. 2023 ). Data menunjukkan bahwa fluktuasi volume testis dapat secara signifikan memengaruhi keseimbangan hormonal dan kesehatan reproduksi secara keseluruhan. Testosteron sangat penting untuk berbagai fungsi fisiologis, termasuk pemeliharaan libido dan massa otot, dan interaksinya dengan kadar antioksidan menyoroti perlunya pendekatan komprehensif terhadap kesehatan pria. Analisis komprehensif ini akan memajukan pemahaman kita tentang fisiologi reproduksi pria dan memfasilitasi pengembangan pendekatan terapi potensial untuk mengoptimalkan fungsi testis dan keseimbangan hormonal (Tabel 2 ). Sebaliknya, temuan kami menunjukkan bahwa hormon testosteron dan TAS tidak berkontribusi terhadap penurunan volume testis selama torsi; sebaliknya, kadar TOS memengaruhi volume testis (Tabel 2 ). Fakta bahwa kadar TOS tinggi dan menyebabkan penurunan volume testis menunjukkan bahwa stres oksidatif menyebabkan kerusakan seluler yang serius pada jaringan testis (Küçük et al. 2021 ; Şahin et al. 2024 ). Pengamatan ini pentingnya pendekatan pengobatan yang menargetkan stres oksidatif, seperti ekstrak hawthorn, setelah torsi testis. Di sisi lain, perawatan yang secara khusus ditujukan untuk mengurangi stres oksidatif, daripada kadar testosteron atau antioksidan umum, mungkin lebih efektif dalam melindungi jaringan testis (Tabel 5 ). Jumlah sperma juga berbeda antara kelompok (Tabel 1 ), tetapi lebih rendah pada kelompok torsi dan meningkat pada kelompok perawatan ekstrak hawthorn (Gambar 4 , Tabel 4 dan 5 ). Hanya di sini kami menemukan bahwa dosis hawthorn yang lebih tinggi lebih signifikan (Tabel 4 dan 5) .), yang menunjukkan bahwa ekstrak hawthorn meningkatkan kualitas sperma. Jumlah sperma saja tidak cukup sebagai kriteria untuk mengevaluasi kualitas sperma. Kelangkaan dan kelimpahan sperma juga telah dikaitkan dengan infertilitas (Wang et al. 2021 ). Oleh karena itu, evaluasi penelitian kami terhadap motilitas sperma mengungkapkan penurunan kualitas sperma dalam model torsi (Tabel 5 dan 6 ), sementara ekstrak hawthorn muncul sebagai agen peningkat kualitas. Shahedi et al. ( 2021 ) menunjukkan bahwa efek pada motilitas sperma adalah pada produk yang berasal dari antioksidan (Shahedi et al. 2021 ). Ada juga penelitian yang menunjukkan bahwa flavonoid meningkatkan kualitas sperma karena sifat antioksidannya (Mishra et al. 2024 ). Untuk mempelajari mekanisme efek ini, testosteron, TAS, dan TOS dianalisis (Tabel 6 ). Kami tidak menemukan korelasi signifikan dengan ketiga parameter tersebut. Hal ini menunjukkan bahwa perlindungan seluler lokal, stabilisasi membran, peningkatan metabolisme energi, dan dukungan untuk kesehatan mikrovaskular testis, terlepas dari kadar testosteron, TAS, dan TOS, kemungkinan memediasi efek positif ekstrak hawthorn pada motilitas sperma dan jumlah sperma pada dosis yang berbeda. Hal ini juga dapat menunjukkan bahwa efek antioksidan ekstrak hawthorn memberikan perlindungan pada jaringan testis tidak hanya melalui parameter sistemik tetapi juga melalui mekanisme spesifik pada tingkat seluler lokal.
Secara khusus, setelah detorsi, ketidakseimbangan antara ROS dan sistem pertahanan antioksidan dapat menyebabkan atrofi ireversibel pada jaringan testis. Selain itu, akumulasi ROS di testis dapat mengakibatkan penurunan konsentrasi dan viabilitas sperma, gangguan komposisi lipid, dan peningkatan kerusakan DNA, yang semuanya berkontribusi terhadap kerusakan testis. Seiring waktu, ini menjadi faktor signifikan yang menyebabkan infertilitas pria (Dokmeci et al. 2007 ; de Grezzana Filho et al. 2020 ; Küçük et al. 2021 ). Oleh karena itu, mengurangi parameter stres oksidatif pada jaringan testis setelah detorsi sangatlah penting. Dalam beberapa tahun terakhir, penelitian tentang agen antioksidan yang ditujukan untuk mencegah atrofi testis dan meminimalkan kerusakan testis telah menghasilkan hasil yang menjanjikan (Abadi et al. 2023 ; Moradi-Ozarlou et al. 2020 ; Yuluğ et al. 2014 ). Dalam penelitian ini, kami bertujuan untuk menunjukkan efek antioksidan dari ekstrak hawthorn, yang menunjukkan bahwa ekstrak tersebut dapat memberikan efek perlindungan jangka panjang pada jaringan testis yang mengalami detorsi. Temuan kami, sejalan dengan literatur yang ada, menunjukkan bahwa ekstrak hawthorn mungkin memiliki sifat antioksidan yang signifikan, yang berkontribusi pada perlindungan jangka panjang pada jaringan testis yang mengalami detorsi. Hasil ini memberikan dasar untuk penelitian di masa mendatang dan mendukung potensi aplikasi terapeutik ekstrak hawthorn sebagai agen pelindung dalam pengobatan torsi testis.
Secara histologis, skor yang lebih tinggi dalam klasifikasi Johnsen diamati pada kelompok yang diobati dengan ekstrak hawthorn dalam penelitian kami (Gambar 5 ). Untuk skor, jumlah tubulus optimal per tubulus diamati; tubulus menunjukkan bahwa mereka bekerja secara normal dan produksi sperma matang optimal dalam kelompok kontrol. Dalam kelompok ekstrak hawthorn, ada lebih sedikit sperma daripada dalam kontrol, tetapi jumlah sperma lebih tinggi dalam struktur tubulus dibandingkan dengan T/D (Gambar 5 ). Ini menunjukkan bahwa ekstrak hawthorn mungkin memiliki kemampuan untuk melindungi struktur tubulus dan spermatogenesis. Dalam penelitian kami, ekstrak hawthorn diamati mendukung spermatogenesis dan meningkatkan integritas jaringan testis dengan melindungi struktur seluler dan histologis dalam jaringan testis (Gambar 5 ). Hasil ini menunjukkan bahwa ekstrak hawthorn mungkin merupakan alternatif terapi yang potensial terhadap cedera T/D testis. Studi tentang ekstrak herbal, yang mengevaluasi struktur testis, struktur tubulus, dan spermatogenesis, menghasilkan hasil positif yang serupa dengan studi kami (Nagy et al. 2024 ; Soltani et al. 2018 ). Temuan ini mengungkap potensi ekstrak hawthorn untuk melindungi struktur tubulus dan spermatogenesis dengan mengurangi kerusakan setelah T/D testis dan menunjukkan bahwa penyelidikan lebih lanjut tentang mekanisme molekuler yang mendasari efek menguntungkan ekstrak herbal pada jaringan testis dapat membuka pintu bagi pendekatan pengobatan baru dalam kesehatan reproduksi pria.
Studi ini memberikan kontribusi ilmiah penting dengan mengevaluasi secara komprehensif efek perlindungan ekstrak hawthorn terhadap torsi testis. Pemeriksaan gabungan dari parameter biokimia dan histologis meningkatkan keandalan dan kelengkapan temuan. Pengukuran berbagai parameter, seperti testosteron, TAS, TOS, OSI, dan skor Johnsen histologis, memungkinkan untuk menganalisis efek ekstrak hawthorn dari perspektif multifaset. Lebih jauh, pengacakan kelompok eksperimen dan ketersediaan kelompok kontrol yang tepat memperkuat kemantapan metodologis studi dan mendukung keakuratan hasil. Pendekatan yang ketat ini memastikan bahwa data yang diperoleh dapat direproduksi dan andal. Pengamatan efek perlindungan ekstrak hawthorn pada spermatogenesis dan efek pendukung pada integritas jaringan menekankan potensi terapeutik dari pilihan pengobatan herbal ini.
Meskipun temuan-temuan penting diperoleh, beberapa keterbatasan harus didiskusikan untuk penilaian hasil yang lebih jelas. Penelitian ini dilakukan pada sejumlah kecil hewan, yang dapat memengaruhi kekuatan statistik dan kekokohan temuan-temuan tersebut. Ukuran sampel yang lebih besar dapat memberikan kesimpulan yang lebih pasti dan meningkatkan keandalan analisis statistik. Penelitian ini difokuskan pada efek jangka pendek ekstrak hawthorn setelah T/D testis. Namun, evaluasi jangka panjang tidak dilakukan, sehingga membatasi pemahaman tentang efek perlindungan yang berkelanjutan dan potensi hasil buruk yang tertunda. Meskipun penilaian biokimia dan histologis dilakukan, penelitian ini tidak mencakup investigasi tingkat molekuler seperti analisis ekspresi gen, penilaian jalur stres oksidatif, atau penanda apoptosis. Menggabungkan analisis-analisis ini dapat memberikan wawasan mekanistik yang lebih mendalam tentang efek perlindungan ekstrak hawthorn. Meskipun penelitian ini mencakup kelompok kontrol yang tepat, tidak ada kelompok ekstrak hawthorn yang berdiri sendiri tanpa cedera iskemia-reperfusi. Hal ini dapat memberikan wawasan tambahan tentang efek langsung ekstrak hawthorn pada fisiologi testis normal. Untuk mengatasi keterbatasan ini, penelitian di masa mendatang harus menyertakan ukuran sampel yang lebih besar untuk meningkatkan kekuatan statistik, penelitian tindak lanjut jangka panjang untuk menilai efek perlindungan berkelanjutan, analisis tingkat molekuler untuk memahami mekanisme yang mendasarinya, kelompok kontrol tambahan untuk mengisolasi efek ekstrak hawthorn, dan uji klinis pada manusia untuk mengevaluasi potensi translasi ekstrak. Penelitian di masa mendatang harus bertujuan untuk menyempurnakan metodologi, memperluas analisis, dan melakukan penelitian translasi untuk memvalidasi temuan ini dalam pengaturan klinis. Mengenali kendala ini akan meningkatkan kredibilitas dan penerapan penelitian di bidang ini.
Temuan studi ini menjadi dasar penting untuk menilai potensi ekstrak hawthorn sebagai agen terapeutik untuk mencegah kerusakan akibat torsi testis. Studi kami akan menjadi batu loncatan untuk studi mendatang guna menentukan efek ekstrak hawthorn secara lebih rinci. Studi skala besar yang membandingkan efek berbagai dosis akan sangat penting dalam menentukan dosis optimal ekstrak herbal ini. Lebih jauh, eksperimen jangka panjang diperlukan untuk memahami efek jangka panjang dan manfaat perlindungan yang bertahan lama dari ekstrak hawthorn. Dengan demikian, keamanan dan kemanjuran ekstrak hawthorn jangka panjang dapat dievaluasi. Analisis ekspresi gen dan penelitian terhadap jalur pensinyalan seluler tertentu juga diperlukan untuk memahami sepenuhnya efek molekuler ekstrak hawthorn. Studi semacam ini dapat membantu kita memahami lebih lanjut tentang bagaimana ekstrak hawthorn memengaruhi spermatogenesis pada tingkat biologis. Temuan ini dapat mengarah pada terciptanya pengobatan baru untuk masalah yang terkait dengan kesehatan reproduksi pria. Oleh karena itu, penelitian ini merupakan batu loncatan dalam memahami potensi terapeutik ekstrak hawthorn dan menerapkannya pada aplikasi klinis.
5 Kesimpulan
Penelitian ini menunjukkan bahwa ekstrak hawthorn dapat melindungi testis dari cedera T/D dan menjaga integritas jaringan dengan menurunkan stres oksidatif dan mendorong spermatogenesis. Temuan menunjukkan bahwa ekstrak hawthorn dapat menjadi agen terapeutik yang menjanjikan dalam kasus cedera testis akut. Namun, untuk mendapatkan pemahaman yang lebih mendalam tentang efek jangka panjang dan dosis optimal ekstrak hawthorn, diperlukan penelitian skala besar dan jangka panjang yang menyelidiki mekanismenya pada tingkat molekuler. Penelitian semacam itu akan memberikan dasar yang lebih kuat untuk potensi penggunaan ekstrak hawthorn sebagai pilihan pengobatan yang aman dan efektif dalam praktik klinis.

