
ABSTRAK
Ekstrak kulit hijau pistachio (PGHE), produk sampingan agroindustri, kaya akan senyawa fenolik dengan aktivitas antioksidan dan antiinflamasi bawaan yang signifikan. Dalam penelitian ini, efek neuroprotektif PGHE terhadap penyakit Parkinson (PD), gangguan neurodegeneratif progresif, dievaluasi baik secara in vivo maupun in vitro. Dosis mematikan (LD 50 ) PGHE lebih besar dari 5000 mg/kg, yang menunjukkan keamanannya dan nontoksisitasnya. Tikus diobati secara oral dengan PGHE (800 mg/kg/hari) 24 jam setelah injeksi 6-OHDA (20 μg/tikus di MFB kanan) selama 14 hari. Fungsi motorik dievaluasi pada Hari ke-7 dan ke-15 setelah pemberian 6-OHDA menggunakan uji rotasi yang diinduksi silinder, balok sempit, tiang, rotarod, dan apomorfin. PGHE secara signifikan meningkatkan gangguan motorik yang diinduksi oleh 6-OHDA. Sebuah studi in vitro menunjukkan bahwa peningkatan konsentrasi PGHE hingga 250 μg/mL mengakibatkan penurunan agregasi α-sinuklein yang dicirikan oleh fluoresensi tioflavin T dan uji merah Kongo. Citra mikroskop elektron transmisi selanjutnya mengonfirmasi penurunan agregasi α-sinuklein dengan adanya PGHE. Sebagai kesimpulan, temuan ini menunjukkan bahwa PGHE memperbaiki defisit motorik pada model tikus PD dan menurunkan agregasi α-sinuklein in vitro, yang menunjukkan bahwa PGHE dapat dianggap sebagai suplemen makanan baru untuk terapi PD. Namun, diperlukan lebih banyak studi untuk mengklarifikasi mekanisme yang mendasari efek PGHE pada patogenesis PD dan aplikasi potensialnya dalam pengembangan makanan fungsional atau nutraseutika.
Singkatan
6-OHDA
6-Hidroksidopamin hidroklorida
α-sin
α-sinuklein
ROS
spesies oksigen reaktif
PD
Penyakit Parkinson
PGH
kulit hijau pistachio
BW
berat badan
PGHE
ekstrak kulit pistachio hijau
Bahasa Indonesia: IPTG
isopropil-β-D-tiogalaktosida
SNPC
substansia nigra pars compacta
Ukuran LD50
dosis mematikan
Itu
tioflavin T
MFB
bundel otak depan medial
1 Pendahuluan
Penyakit Parkinson (PD) adalah penyakit neurodegeneratif paling umum kedua setelah Alzheimer dan mempengaruhi sekitar 1% dari populasi dewasa berusia di atas 60 tahun (Ju et al. 2010 ; Perez-Pardo et al. 2017 ). Ciri khas patologis PD adalah hilangnya neuron dopaminergik di substantia nigra pars compacta (SNpc) di otak tengah dan pembentukan badan Lewy yang mengandung agregat α-synuclein (α-syn) di sitoplasma neuron yang bertahan hidup, yang menyebabkan gangguan motorik yang khas (Feng et al. 2019 ; Hemmati-Dinarvand et al. 2019 ; Perez-Pardo et al. 2017 ). Akibatnya, PD muncul melalui karakteristik perilaku seperti ketidakstabilan postural, bradikinesia, tremor, dan kekakuan. Selain itu, hal ini juga memengaruhi fungsi non-motorik (Beserra-Filho et al. 2019 ; Li et al. 2021 ). Namun, mekanisme dasar yang bertanggung jawab atas degenerasi selektif neuron dopaminergik dan penyebab PD masih belum diketahui. Produksi spesies oksigen reaktif (ROS) yang berlebihan diduga memainkan peran kunci dalam kerusakan oksidatif, pemrosesan protein yang tidak biasa seperti penggumpalan α-syn, dan akhirnya apoptosis neuron dopaminergik. Akibatnya, terjadi penurunan kemampuan produksi dopamin (Chang et al. 2019 ; Pignolo et al. 2022 ). Tingkat metabolisme yang intens bersama dengan kapasitas tinggi spesies yang dapat dioksidasi yang melibatkan zat besi dan asam lemak tak jenuh ganda dalam neuron dopaminergik menyebabkan kerusakan stres oksidatif pada neuron dopaminergik (Hemmati-Dinarvand et al. 2019 ). Selain itu, α-syn adalah salah satu protein yang bertanggung jawab untuk menghasilkan spesies reaktif dalam mitokondria. α-syn, melalui pengikatan ke membran luar mitokondria, menyebabkan disfungsi mitokondria. Oleh karena itu, spesies reaktif menyebabkan stres oksidatif dan merangsang pelepasan sitokin inflamasi dari mikroglia dan astrosit, yang pada akhirnya mengakibatkan degenerasi neuron (Feng et al. 2019 ). Sementara itu, kekurangan konstituen antioksidan dalam makanan sehari-hari dapat meningkatkan kadar ROS yang menyebabkan timbulnya dan berkembangnya PD.
Sayangnya, penyakit Parkinson tidak dapat disembuhkan dengan pengobatan konvensional. Obat-obatan ini hanya dapat mengurangi beberapa gejala. Misalnya, Levodopa (L-dopa), sebagai obat yang efektif untuk gejala motorik awal PD, dapat mengurangi kekakuan dan bradikinesia, tetapi gejala lain seperti masalah keseimbangan dapat menjadi lebih buruk. Lebih jauh lagi, pasien membutuhkan dosis L-dopa yang lebih tinggi dari waktu ke waktu, yang menyebabkan peningkatan efek samping seperti diskinesia dan gangguan motorik. Oleh karena itu, pendekatan terapi yang inovatif diperlukan untuk mencegah efek PD pada otak, seperti neurodegenerasi dan agregasi α-syn.
Oleh karena itu, penggunaan terapi komplementer dan fitonutrien direkomendasikan untuk pengobatan PD (Mittal et al. 2023 ). Oleh karena itu, komponen dengan sifat anti-inflamasi dan antioksidan dapat digunakan untuk membatasi jalur kerusakan akibat stres oksidatif (Pignolo et al. 2022 ).
Antioksidan seperti flavonoid, vitamin, dan polifenol memiliki kemampuan inheren untuk melindungi neuron dari oksidasi dengan melindungi atau memperbaiki konstituen seluler (Mittal et al. 2023 ). Karena alasan ini, banyak peneliti menjadi tertarik pada bidang ini, dan beberapa penelitian menyelidiki efek neuroprotektif dari antioksidan alami, terutama senyawa fenolik yang berasal dari tumbuhan seperti asam ellagic, myricetin, tirosol, dan kurkumin untuk pengobatan PD dan untuk mengurangi gejalanya (Baluchnejadmojarad et al. 2017 ; García-Moreno et al. 2019 ; Huang et al. 2018 ; Jin et al. 2022 ). Dengan demikian, menurut penelitian sebelumnya, senyawa fenolik dapat memiliki efek positif yang signifikan pada PD.
Laporan menunjukkan bahwa industri pengolahan menghasilkan sejumlah besar produk sampingan berbasis tanaman yang merupakan sumber senyawa polifenol yang kaya. Dengan demikian, produk sampingan agroindustri ini dapat digunakan sebagai antioksidan untuk meningkatkan manfaat kesehatan (Lalegani et al. 2018 ).
Di dunia, Iran merupakan produsen dan eksportir utama pistachio. Kulit hijau pistachio (PGH) merupakan produk sampingan dari produksi pistachio industri dan sumber senyawa fenolik yang hemat biaya seperti asam galat, phloroglucinol, naringin, dan asam vanili, yang memiliki aktivitas antioksidan yang cukup besar (Ghandahari Yazdi et al. 2019 ). Beberapa penelitian telah melaporkan sifat fungsional yang luar biasa dan manfaat yang meningkatkan kesehatan dari ekstrak kulit hijau pistachio (PGHE). Fitur-fitur ini termasuk bertindak sebagai agen antioksidan dan antimikroba dalam bahan pangan, dll. (Goli et al. 2005 ; Rafiee et al. 2018 ; Rajaei et al. 2010 ; Sadeghinejad et al. 2019 ; Sarteshnizi et al. 2019 ), anti-inflamasi (Grace et al. 2016 ), anti-mutagenisitas (Rajaei et al. 2010 ), anti-diabetes (Lalegani et al. 2018 ; Sarteshnizi et al. 2021 ), perlindungan seluler limfosit dan eritrosit dan pencegahan degradasi protein (Barreca et al. 2016 ), dan pencegahan hipertensi (Sila et al. 2014 ). Dengan demikian, penelitian-penelitian ini memperkenalkan PGH sebagai sumber senyawa penambah kesehatan yang murah dan luar biasa yang berpotensi untuk digunakan dalam suplemen makanan dan obat-obatan. Lebih jauh lagi, asam galat merupakan konstituen utama PGHE, dan efek neuroprotektifnya melalui peningkatan pertahanan antioksidan dan pelemahan neuroinflamasi telah dilaporkan sebelumnya (Liu et al. 2020 ; Mansouri et al. 2013 ). Oleh karena itu, kami berasumsi bahwa PGHE mungkin memiliki sifat anti-PD karena aktivitas antioksidannya yang tinggi dengan membatasi kerusakan stres oksidatif pada neuron dopaminergik.
Dalam penelitian ini, kami bertujuan untuk mengevaluasi efek PGHE pada penyakit Parkinson. Untuk tujuan ini, (i) PGHE digunakan dan diperiksa pada model tikus Wistar PD menggunakan uji perilaku untuk menilai efeknya dan (ii) jalur yang mungkin memengaruhi penyakit Parkinson diperiksa dengan mengevaluasi efek PGHE pada agregasi α-synuclein secara in vitro. Hal ini berfungsi sebagai indikator perkembangan toksisitas intraseluler pada jaringan otak.
2 Bahan dan Metode
2.1 Bahan
PGH ( varietas Ahmad Aghaei ) diperoleh dari Pusat Penelitian Pertanian Kerman di Iran. 6-hidroksi dopamin hidroklorida (6-OHDA) (Cat# H4381), Congo red (Cat# 234610), dan Thioflavin T (Cat# 596200) dibeli dari Sigma-Aldrich (AS). Apomorphine hidroklorida hemihidrat dari Santa Cruz Biotechnology Co. (Cat# sc-253341, AS). Desipramine-HCl dibeli dari Pars Daroo Co. (Teheran, Iran). Isopropyl-β-D-thiogalactoside (IPTG) diperoleh dari kelompok Molekula (Cat# 21689530, Prancis). Semua bahan kimia lain yang dibeli dari Merck Chemical Co. (Darmstadt, Jerman) adalah kelas analitis.
2.2 Persiapan PGHE
Bubuk PGH dan air suling (perbandingan 1:15) dicampur dan diaduk (8 jam, pada suhu 25°C). Selanjutnya, campuran disentrifugasi (10 menit, 3000 g), dan supernatan yang dihasilkan disaring menggunakan Whatman No. 42. Ekstrak air yang disaring dikeringkan dengan semprotan, dan bubuk PGHE yang diperoleh diawetkan dalam wadah tertutup pada suhu -20°C hingga dilakukan penelitian in vivo dan in vitro (Rajaei et al. 2010 ). Bubuk PGHE dilarutkan dalam air suling untuk perawatan hewan dan penelitian in vitro.
2.3 Penentuan Senyawa Fenolik PGHE dengan LC/MS
Analisis senyawa fenolik PGHE dilakukan menggunakan instrumen LC/MS (spektrum massa quad tunggal Agilent 6150, dilengkapi dengan pompa biner agilent1260, degasser, pemanas kolom pada 40°C, dan autosampler 1367C). Kolom XBridge C18 waters berukuran 150 × 4,6 mm dengan ukuran partikel 5 μm digunakan untuk pemisahan kromatografi. Pelarut A dan B masing-masing terdiri dari H 2 O + 0,1% (v/v) asam format dan asetonitril + 0,1% (v/v) asam format. Kondisi gradien digunakan sebagai berikut: 0–3 menit, 0% B; 3–9 menit, 3% B; 9–24 menit, 12% B; 24–30 menit, 20% B; 30–33 menit, 20% B; 33–43 menit, 30% B; 43–63 menit, 40% B; 63–67 menit, 100% B; 67–72 menit, 100% B. Selanjutnya, sistem diseimbangkan selama 7 menit, sehingga menghasilkan waktu proses keseluruhan selama 72 menit. Alirannya pada laju 1,0 mL/menit, dengan volume injeksi 5 μL. Spektrum UV–Vis senyawa fenolik PGHE direkam pada 260 nm. Identifikasi senyawa ini dilakukan dengan membandingkan waktu retensi, spektrum UV–Vis, spektrum massa pindaian (50–1350 sma), dan pola fragmentasi MS dengan standar terkait yang dianalisis dalam kondisi yang sama, bersama dengan laporan literatur sebelumnya (Barreca et al. 2016 ).
2.4 Hewan
Tikus Wistar jantan berasal dari koloni pengembangbiakan Pusat Penelitian Neurosains, Universitas Ilmu Kedokteran Shahid Beheshti (Teheran, Iran). Semua hewan diadaptasi dengan kondisi laboratorium selama 2 minggu. Jadwal di ruang hewan adalah siklus terang/gelap 12:12 jam pada suhu 23°C ± 2°C. Tikus memiliki akses terbuka terhadap air dan makanan.
2.5 Toksisitas Oral Akut PGHE
Menurut metode Lork (Chinedu et al. 2013 ), sembilan hewan dibagi menjadi tiga kelompok yang masing-masing terdiri dari tiga hewan pada Fase 1. Setiap kelompok hewan diberikan berbagai dosis tunggal PGHE secara oral (10, 100, dan 1000 mg/kg). Hewan-hewan tersebut dipantau selama 24 jam untuk mengetahui mortalitas dan pengamatan perilaku. Setelah itu, tiga hewan dibagi menjadi tiga kelompok yang masing-masing terdiri dari satu hewan. Tikus diberikan dosis PGHE yang lebih tinggi secara oral sebesar 1600, 2900, dan 5000 mg/kg. Mereka diikuti selama 24 jam untuk mengetahui mortalitas dan tanda-tanda perubahan perilaku. Selain itu, semua hewan dalam dua fase yang disebutkan diobservasi selama 14 hari.
2.6 Prosedur Bedah dan Kelompok Eksperimen
Untuk menginduksi model PD, hewan menerima neurotoksin 6-OHDA ke dalam medial forebrain bundle (MFB) kanan. 6-OHDA biasanya digunakan untuk menginduksi model hewan PD dalam studi eksperimental (Chia et al. 2020 ; Schober 2004 ). Desipramine (25 mg/kg, ip) diberikan 30 menit sebelum operasi untuk mencegah penyerapan 6-OHDA ke terminal noradrenergik. Setelah itu, tikus dibius dengan ketamin/xylazine (100/10 mg/kg, ip) dan difiksasi dalam peralatan bedah stereotaxic. 6-OHDA dilarutkan dalam larutan garam normal 0,9% yang mengandung 0,02% asam askorbat dan disuntikkan ke MFB kanan (20 g/5 l) pada koordinat berikut menurut atlas otak Paxinos dan Watson ( 2006 ): anterior–posterior (AP) = 4,3 mm, mediolateral (ML) = 1,8 mm dorsoventral (DV) = 8,2 mm. Pada kelompok sham, volume yang sama dari zat pembawa (5 l) disuntikkan ke MFB kanan.
Perawatan dimulai setelah 24 jam pembedahan dan berlanjut selama 14 hari (Gambar S1 ). Hewan diobati secara oral dengan PGHE (800 mg/kg BB/hari). Oleh karena itu, tikus Wistar jantan dewasa (220–270 g) dibagi secara acak menjadi empat kelompok ( n = 7-9/kelompok): (1) sham (vehicle dalam MFB, diobati dengan air suling, po), (2) 6-OHDA (6-OHDA dalam MFB, diobati dengan air suling, po), (3) 6-OHDA + PGHE 800 (6-OHDA dalam MFB, diobati dengan 800 mg/kg BB/hari PGHE, po), dan (4) PGHE 800 (vehicle dalam MFB, diobati dengan 800 mg/kg BB/hari PGHE, po).
2.7 Tes Perilaku
Eksperimen perilaku dilakukan 7 dan 15 hari setelah operasi. Sebelum operasi, semua hewan dilatih selama dua hari berturut-turut untuk uji balok sempit, tiang, dan rotarod.
2.7.1 Uji Silinder
Uji silinder, yaitu uji asimetri tungkai depan, dilakukan untuk menentukan preferensi penggunaan tungkai depan. Hewan ditempatkan ke dalam kaca plexiglass bening (diameter 20 cm dan tinggi 35 cm). Setelah itu, jumlah tungkai depan ipsilateral dan kontralateral yang menyentuh dinding silinder dalam 5 menit dicatat dan kemudian dihitung. Data disajikan sebagai persentase penggunaan tungkai depan kontralateral (Soner et al. 2021 ).
2.7.2 Uji Balok Sempit
Untuk mengevaluasi keseimbangan dan koordinasi motorik hewan, kami menggunakan uji balok sempit. Sebuah alat balok kayu berukuran panjang 100 cm, lebar 4 cm, dan tinggi 3 cm digunakan untuk penilaian ini. Balok tersebut diletakkan 80 cm di atas tanah. Dari awal balok, sebuah garis 20 cm ditarik, dan sebuah kandang rumah terletak di ujung lain balok tersebut. Pada hari-hari pelatihan dan pengujian, setiap tikus sepenuhnya ditempatkan dalam zona awal 20 cm yang menghadap kandang rumahnya. Sebuah stopwatch segera dimulai setelah tikus dilepaskan. Waktu untuk melewati zona awal menunjukkan latensi untuk memulai tugas (waktu untuk mulai berjalan). Total waktu pada balok kemudian dicatat ketika semua 4 kaki diletakkan di atas kandang rumah. Waktu untuk mulai berjalan dan total waktu dicatat dalam 3 kali percobaan untuk setiap tikus; rata-rata dari 3 kali percobaan dianggap sebagai skor akhir. Waktu batas bagi setiap tikus untuk melakukan tugas ini adalah 120 detik (Allbutt dan Henderson 2007 ).
2.7.3 Uji Tiang
Untuk melakukan uji pengukuran bradikinesia ini, hewan diletakkan dengan kepala menghadap ke atas di atas tiang vertikal dengan permukaan kasar (tinggi 100 cm; diameter 2,5 cm). Stopwatch segera dimulai saat tikus diletakkan di tiang. Waktu untuk berputar dan total waktu untuk turun dari tiang dicatat dalam tiga kali percobaan untuk setiap tikus dengan batasan waktu maksimum 120 detik. Rata-rata dari tiga kali percobaan dianggap sebagai skor akhir (Matsuura et al. 1997 ).
2.7.4 Uji Rotarod
Uji rotarod adalah salah satu pengujian yang paling umum untuk koordinasi motorik dan penilaian keseimbangan pada tikus (Buccafusco 2009 ). Pengujian ini dinilai menggunakan peralatan rotarod seperti yang dijelaskan sebelumnya (Iravanpour et al. 2021 ). Kecepatan rotarod pada hari pertama pelatihan konstan pada 10 rpm, dan meningkat dari 5 hingga 20 rpm selama 300 detik pada hari pelatihan kedua. Pada hari pengujian, kecepatan rotarod ditingkatkan pada kecepatan tetap dari 5 hingga 40 rpm selama 300 detik. Latensi jatuh setiap hewan dicatat dengan batas 300 detik. Rata-rata dari 3 percobaan untuk setiap tikus dianggap sebagai skor akhir.
2.7.5 Uji Rotasi yang Diinduksi Apomorfin
Apomorfin adalah agonis reseptor DA nonselektif yang menyebabkan rotasi kontralateral pada lesi dalam dosis rendah sebagai indeks disfungsi motorik dengan stimulasi reseptor D1 dan D2 supersensitif, sebagian besar pada sisi yang mengalami denervasi (Calou et al. 2014 ; Ünal et al. 2020 ). Injeksi subkutan apomorfin (0,25 mg/kg, dilarutkan dalam 0,02% askorbat dalam larutan garam normal) dilakukan pada hari pengujian untuk mengevaluasi perilaku berputar setiap tikus (Miyanishi et al. 2019 ). Kemudian, setelah 5 menit, rotasi kontralateral bersih dihitung selama 30 menit.
2.8 Ekspresi dan Pemurnian α-Syn
Ekspresi dan pemurnian α-syn mengikuti metode yang diuraikan dalam penelitian oleh Marvastizadeh et al. ( 2020 ). α-syn diekspresikan dalam E. coli BL21. Kultivasi sel terjadi dalam medium LB yang disuplemen dengan kanamisin (50 μg/mL) pada suhu 37°C dan 180 rpm. Setelah mencapai absorbansi 0,5 pada 600 nm (OD600), ekspresi diinduksi menggunakan 1 mM IPTG selama 4 jam. Sel dipanen, disuspensikan dalam buffer lisis (50 mM Tris, 5 mM imidazol, 2 M NaCl), dan diganggu menggunakan sonikasi. Sentrifugasi (12.000 g, 20 menit pada suhu 4°C) digunakan untuk menghilangkan sel yang terganggu, dan sampel ditempatkan dalam penangas air pada suhu 100°C untuk menghilangkan kotoran. Untuk memurnikan protein, supernatan dimasukkan ke dalam kolom Ni-agarose. Kolom dielusi dengan gradien linier dari 5 hingga 60 mM imidazol (pH = 7,8) dan untuk memisahkan protein dari kolom, digunakan buffer imidazol 250 mM (pH = 7,8). Kemurnian fraksi yang dielusi diverifikasi menggunakan elektroforesis SDS-PAGE (Gambar S2 ).
Dialisis α-syn yang dimurnikan dilakukan menggunakan membran dialisis 2-kDa terhadap buffer Tris 30 mM dan NaCl 200 mM (pH = 7,8) tiga kali selama 16 jam. Konsentrasi α-syn ditentukan menggunakan koefisien penyerapan molar ε = 5,960 cm −1 M −1 . Pembentukan fibril dilakukan dalam campuran yang mengandung α-syn (2 mg/mL) dalam buffer Tris 30 mM (pH = 7,8) dan NaCl 200 mM pada suhu 37°C sambil diaduk menggunakan batang pengaduk mikro. Untuk mendeteksi efek penghambatan PGHE pada pembentukan fibril α-syn, berbagai konsentrasi PGHE ditambahkan ke larutan α-syn (2 mg/mL) dan diinkubasi dalam kondisi yang disebutkan.
2.9 Deteksi Fibril α-Syn
Untuk menentukan dampak penghambatan PGHE pada fibrilasi α-syn, pengujian berikut dilakukan.
2.9.1 Uji Fluoresensi Thioflavin T
Pada interval waktu yang berbeda, 10 μL protein yang diinkubasi diambil dan dicampur dengan 990 μL thioflavin T 25 μM (ThT, dalam buffer fosfat 25 mM, pH = 6,0), dan kemudian, dengan dan tanpa PGHE, fibrilasi protein diselidiki. Selanjutnya, sampel dieksitasi pada 440 nm, dan spektrum fluoresensi ThT yang dihasilkan direkam dari 450 hingga 600 nm menggunakan Spektrofluorometer Perkin Elmer LS55 (Waltham, MA, AS). Intensitas ThT pada 485 nm versus waktu diplot. Setiap percobaan dilakukan tiga kali (Honarmand et al. 2019 ).
2.9.2 Uji Kongo Merah
Larutan merah Kongo harus baru disiapkan. Larutan stok yang diberikan adalah konsentrasi 50x. Oleh karena itu, 7 mg bubuk dilarutkan dalam kalium fosfat 5 mM yang mengandung 150 mM NaCl. Selanjutnya, larutan disaring menggunakan filter jarum suntik 0,2 μm dan kemudian diencerkan 50 kali lipat. Setelah itu, 440 μL larutan encer ditambahkan ke 60 μL larutan protein. Spektrum sampel dengan dan tanpa PGHE direkam dari 400 hingga 700 nm menggunakan spektrofotometer UV–Vis Perkin Elmer (Waltham, MA, AS). Setiap percobaan dilakukan tiga kali (Marvastizadeh et al. 2020 ).
2.9.3 Mikroskop Elektron Transmisi (TEM)
Untuk mempelajari agregat α-syn, 20 μL protein yang diinkubasi dengan dan tanpa PGHE ditempatkan pada kisi karbon. Kemudian, protein tersebut diwarnai dengan uranyl asetat (2%), dan gambar TEM diamati menggunakan mikroskop elektron transmisi TEM Philips EM 208S 100 kv setelah 5 menit (Honarmand et al. 2019 ).
2.10 Analisis Statistik
Untuk menganalisis data dari semua uji perilaku (uji in vivo), perangkat lunak GraphPad Prism 9.5.1 digunakan (GraphPad Software, San Diego, CA, AS). Hasil dinyatakan sebagai mean ± SEM, dan tingkat signifikansi adalah p < 0,05. Distribusi normal ditentukan oleh uji Kolmogorov–Smirnov. Analisis statistik data dilakukan dengan ANOVA satu arah diikuti oleh uji post hoc Tukey antara kelompok untuk setiap hari pengujian. ANOVA dua arah diikuti oleh uji post hoc Tukey untuk evaluasi efek durasi pengobatan juga dilakukan. Semua percobaan in vitro dilakukan dalam rangkap tiga, dan hasilnya dilaporkan sebagai mean ± simpangan baku. Untuk menganalisis nilai mean, ANOVA satu arah diikuti oleh uji post hoc Tukey HSD digunakan. Nilai p 0,05 dianggap signifikan secara statistik. Untuk menentukan perbedaan antara mean, SPSS v. 24 digunakan.
3 Hasil dan Pembahasan
3.1 Identifikasi Senyawa Fenolik PGHE
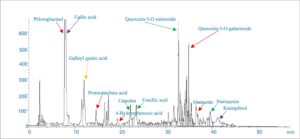
Seperti yang digambarkan dalam kromatogram LC/MS (Gambar 1 ), asam galat, floroglusinol, quercetin-3-O-rutinoside, dan quercetin-3-O-galactoside merupakan senyawa fenolik yang paling melimpah dalam ekstrak air PGH, konsisten dengan penelitian sebelumnya (Barreca et al. 2016 ; Lalegani et al. 2018 ).
3.2 Toksisitas Oral Akut PGHE
Studi toksisitas akut menentukan dosis mematikan (LD 50 ) dari agen farmakologis. LD 50 berarti dosis zat yang menyebabkan 50% kematian pada hewan uji (Chinedu et al. 2013 ). Dalam penelitian ini, studi toksisitas akut PGHE tidak menunjukkan kematian pada kelompok yang dipelajari hingga dosis tunggal yang diberikan sebesar 5000 mg/kg setelah 24 jam dan 14 hari. Selanjutnya, hewan bertambah berat badan selama 14 hari penelitian dan tampak sehat dan aktif (data tidak ditampilkan). Berdasarkan kondisi studi toksisitas oral akut ini, LD 50 PGHE lebih besar dari 5000 mg/kg, dan oleh karena itu PGHE memiliki tingkat keamanan yang tinggi dan praktis tidak beracun (Chinedu et al. 2013 ; Hayes et al. 2020 ).
3.3 Tes Perilaku
Dalam model PD yang diinduksi 6-OHDA, denervasi unilateral menyebabkan beberapa disfungsi perilaku yang mirip dengan pasien Parkinson karena penurunan dopamin. Jadi, berbagai uji perilaku diperluas dalam model PD untuk menilai intensitas lesi dan efek pengobatan (Calou et al. 2014 ; Monville et al. 2006 ). Dalam penelitian ini, evaluasi perilaku dilakukan pada Hari ke-7 dan ke-15 setelah operasi.
3.3.1 Uji Silinder
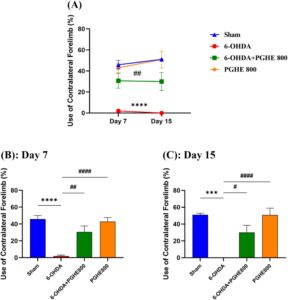
Dalam penelitian ini, tungkai kiri cacat (kontralateral terhadap lesi); oleh karena itu, persentase penggunaan kaki kontralateral dihitung. Pengukuran berulang (Gambar 2A ) menunjukkan efek signifikan dari perawatan [ F (3,27) = 20,07, p = 0,0001] pada penggunaan tungkai depan kontralateral. Analisis post hoc Tukey menunjukkan perbedaan signifikan antara kelompok 6-OHDA dan kelompok perawatan (6-OHDA+PGHE 800), serta kelompok semu. Dalam uji silinder, tikus dengan lesi unilateral menggunakan kaki kontralateral mereka lebih sedikit daripada tikus semu. Oleh karena itu, uji silinder dapat mengukur tingkat kehilangan dopamin unilateral (Hemmati et al. 2023 ; Soner et al. 2021 ). Oleh karena itu, perbedaan ini menunjukkan keberhasilan induksi penyakit melalui penurunan penggunaan tungkai depan kontralateral pada kelompok 6-OHDA dibandingkan dengan kelompok sham ( p < 0,0001); dan pengobatan PGHE memperbaiki penggunaan tungkai depan kontralateral pada kelompok 6-OHDA+PGHE800 dibandingkan dengan kelompok 6-OHDA ( p = 0,0011). Selain itu, pengukuran berulang tidak menunjukkan efek signifikan dari waktu [ F (1,25) = 0,4428, p = 0,5119] dan interaksi waktu × pengobatan [ F (3,25) = 0,5072, p = 0,6809] pada penggunaan tungkai depan kontralateral. ANOVA satu arah menunjukkan keberhasilan induksi penyakit (Sham vs. 6-OHDA) dan efek positif pengobatan PGHE (6-OHDA vs. 6-OHDA+PGHE) pada penggunaan persentase tungkai depan kontralateral pada hari ke-7 (Gambar 2B ) dan ke-15 (Gambar 2C ). Jadi, temuan ini menunjukkan bahwa pengobatan PGHE memengaruhi atenuasi gangguan motorik penyakit Parkinson dengan mengurangi kehilangan dopamin unilateral. Sebuah studi sebelumnya menunjukkan bahwa pengobatan pra dan pasca pistachio (800 mg/kg/hari, po selama 2 minggu) memberikan efek neuroprotektif dengan memperbaiki defisit motorik, meningkatkan kadar DA, dan melemahkan stres oksidatif dalam model tikus penyakit Parkinson yang diinduksi rotenon (Haider et al. 2020 ). Selain itu, seperti yang ditunjukkan pada Gambar 2 , PGHE 800 memiliki kinerja yang hampir sama dibandingkan dengan kelompok sham, yang menunjukkan bahwa PGHE tidak memiliki efek negatif pada hewan.
3.3.2 Narrow Beam Test
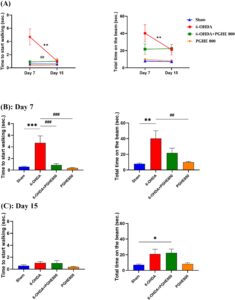
Tugas ini meneliti kemampuan hewan untuk berjalan pada balok sempit yang ditinggikan. Jadi, uji ini dapat mendeteksi hilangnya dopamin nigrostriatal (Buccafusco 2009 ). Seperti yang ditunjukkan pada Gambar 3A , pengukuran berulang menghasilkan efek waktu yang signifikan [ F (1,29) = 8,665, p = 0,0063], yang mencerminkan peningkatan aktivitas selama 15 hari evaluasi, efek pengobatan [ F (3,32) = 8,085, p = 0,0004], yang menunjukkan perbedaan keseluruhan antara kelompok, dan interaksi waktu × pengobatan [ F (3,29) = 9,323, p = 0,0002], yang menunjukkan perbedaan signifikan antara kelompok dari waktu ke waktu untuk mulai berjalan. Analisis post hoc Tukey menunjukkan perbedaan signifikan antara 6-OHDA dan kelompok pengobatan (6-OHDA + PGHE 800) serta kelompok semu. Perbedaan-perbedaan ini menunjukkan keberhasilan induksi penyakit dengan peningkatan waktu untuk mulai berjalan (6-OHDA vs. sham) dan efek positif PGHE pada kinerja hewan dengan penurunan waktu untuk mulai berjalan (6-OHDA + PGHE800 vs. 6-OHDA). Selain itu, analisis total waktu pada balok menunjukkan efek pengobatan yang signifikan (6-OHDA vs. sham), yang menunjukkan induksi penyakit ( p = 0,0036) dalam 7 hari (Gambar 3A, B ). Oleh karena itu, pengamatan ini mengonfirmasi pengobatan oral PGHE yang efektif pada degenerasi signifikan karena injeksi 6-OHDA. Bradikinesia sebagai penanda gangguan motorik yang diukur dengan uji ini membaik melalui pengobatan PGHE. Seperti yang ditunjukkan pada Gambar 3A, B , pemberian oral PGHE secara signifikan mengurangi waktu untuk mulai berjalan dibandingkan dengan 6-OHDA pada tikus pada Hari ke-7 ( p < 0,001). Sebuah studi sebelumnya yang menyelidiki efek quercetin menemukan bahwa itu mengurangi waktu untuk melintasi balok sempit pada tikus yang diobati dengan rotenon dan suplemen zat besi (Sharma et al. 2020 ). Meskipun perbedaan antara kelompok perlakuan dan 6-OHDA tidak signifikan pada hari ke-7 untuk total waktu untuk melintasi balok, grafik menunjukkan pengobatan oral PGHE yang efektif dalam penurunan waktu. 6-OHDA sebagai toksin katekolaminergik menyebabkan penurunan ekstrem neuron dopaminergik di SNpc. Penipisan dopamin di striatum menyebabkan keterlambatan waktu untuk mulai berjalan dan total waktu untuk melintasi balok. Keterlambatan ini menunjukkan akinesia dan bradikinesia, keseimbangan, dan ketidakstabilan postural pada hewan yang terkena penyakit Parkinson, masing-masing (Allbutt dan Henderson 2007 ). Gangguan motorik terjadi ketika 60%–70% neuron dopaminergik hilang; dengan kerusakan yang lebih sedikit, hewan dapat secara bertahap memulihkan gangguan gerakan yang disebutkan seperti akinesia dan bradikinesia (Matsuura et al. 1997). Jadi, perilaku pemulihan pada hari ke-15 uji sinar kelompok 6-OHDA (Gambar 3A,C ), dapat disebabkan oleh lebih sedikit kerusakan jalur nigrostriatal. Perlakuan PGHE dapat meningkatkan kinerja tikus pada sinar sempit dengan mengurangi stres oksidatif melalui peningkatan sistem pertahanan antioksidan, dan sebagai hasilnya, mengarah pada pencegahan hilangnya neuron dopaminergik SNpc. Kesh dkk. ( 2021 ) melaporkan bahwa naringenin, yang juga merupakan komponen PGHE, mengurangi biomarker stres oksidatif yang diinduksi oleh 6-OHDA dalam sel SHSY5Y. Selain itu, perlakuan PGHE tidak menunjukkan efek buruk pada kinerja hewan yang diperiksa, karena kinerja kelompok PGHE800 hampir setara dengan kelompok semu (Gambar 3A,B ).
3.3.3 Uji Tiang
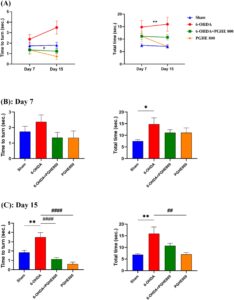
Tugas ini memerlukan ganglia basal utuh dan aktivasi jalur rubrospinal untuk keterampilan menggenggam dan bermanuver anggota tubuh depan. Oleh karena itu, uji tiang sangat sensitif terhadap disfungsi nigrostriatal. Seperti yang ditunjukkan pada Gambar 4A , pengukuran berulang tidak menunjukkan efek signifikan waktu [ F (1,27) = 0,1598, p = 0,6925] dan interaksi waktu × perlakuan [ F (3,27) = 2,439, p = 0,0862] pada waktu untuk berbalik. Meskipun demikian, perlakuan memiliki efek signifikan [ F (3,32) = 6,107, p = 0,0021] pada waktu untuk berbalik. Analisis post hoc Tukey menunjukkan perbedaan signifikan antara 6-OHDA dan kelompok perlakuan (6-OHDA + PGHE 800). Perbedaan ini menunjukkan efek positif PGHE pada kinerja hewan melalui pengurangan waktu untuk berbalik dibandingkan dengan kelompok 6-OHDA. Selain itu, analisis total waktu menunjukkan perbedaan signifikan antara kelompok 6-OHDA dan kelompok semu ( p = 0,0023), yang menunjukkan induksi penyakit [ F (3,32) = 5,673, p = 0,0031]. Sementara itu, waktu dan interaksi waktu × pengobatan tidak memiliki efek signifikan. Gambar 4B menunjukkan induksi PD dengan perbedaan signifikan dalam total waktu antara kelompok semu dan 6-OHDA ( p = 0,0373) pada hari ke-7. Selain itu, Gambar 4C menunjukkan induksi penyakit dengan perbedaan signifikan antara kelompok semu dan 6-OHDA dalam waktu untuk berbalik dan total waktu. Seperti yang ditunjukkan pada Gambar 4C , pemberian oral PGHE secara signifikan mengurangi waktu untuk berbalik ( p <0,0001) dibandingkan dengan 6-OHDA pada hari ke-15. Hasil ini mengkonfirmasi efek positif PGHE pada bradikinesia tikus. Oleh karena itu, untuk mengamati efek positif PGHE pada kinerja hewan dalam uji pole, diperlukan durasi pengobatan yang lebih lama, yaitu 15 hari. Selain itu, PGHE tidak memiliki efek buruk pada hewan seperti yang ditunjukkan pada Gambar 4 .
3.3.4 Uji Rotarod
Uji rotarod digunakan untuk mengevaluasi koordinasi motorik dan keseimbangan pada hewan pengerat. Waktu yang dihabiskan untuk memutar palang oleh hewan berbanding terbalik dengan hilangnya neuron (Calou et al. 2014 ). Seperti yang ditunjukkan pada Gambar 5 , kelompok kontrol yang dioperasi semu menunjukkan kinerja yang stabil selama 15 hari studi. Sedangkan, tikus dengan penyakit Parkinson dapat mempertahankan diri mereka lebih sedikit pada peralatan rotarod dibandingkan dengan kelompok semu karena mereka tidak dapat menjaga koordinasi motorik dan keseimbangan mereka. Efek pengobatan yang signifikan [ F (3,31) = 7,136, p = 0,0009] menunjukkan perbedaan keseluruhan antara kelompok dalam uji ini. Pengukuran berulang (Gambar 5A ) menunjukkan induksi penyakit pada model tikus dengan penurunan latensi untuk jatuh pada kelompok 6-OHDA dibandingkan dengan kelompok semu ( p = 0,0146). Konfirmasi induksi penyakit ini juga ditunjukkan dalam analisis ANOVA satu arah hari ke-7 ( p = 0,0311). Pemberian 6-OHDA pada tikus menyebabkan penurunan koordinasi motorik. Sementara itu, semua grafik pada Gambar 5 tidak menunjukkan efek perlindungan signifikan dari pengobatan PGHE terhadap kerusakan yang disebabkan oleh 6-OHDA pada apparatus rotarod. Meskipun demikian, kita juga dapat menilai postur dan langkah pada tikus dengan cedera otak menggunakan uji rotarod (Monville et al. 2006 ). Pengamatan kami selama percobaan menunjukkan peningkatan langkah pada kelompok 6-OHDA + PGHE 800 dibandingkan dengan kelompok 6-OHDA. Jadi, hal ini mungkin disebabkan oleh efek positif pengobatan PGHE yang berbeda dengan analisis statistik latensi jatuh. Pengobatan dengan kombinasi asam vanilat, senyawa yang juga terdapat dalam PGHE, dan levodopa karbidopa dilaporkan meningkatkan koordinasi otot secara signifikan pada model tikus penyakit Parkinson yang diinduksi rotenon (Sharma et al. 2021 ). Lebih jauh, PGHE 800 memiliki fungsi yang sama dibandingkan dengan kelompok sham. Jadi, sama seperti pengujian lainnya, PGHE 800 tidak memiliki efek negatif pada hewan saja.
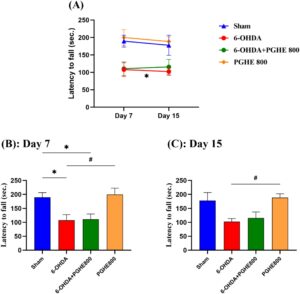
3.3.5 Uji Rotasi yang Diinduksi Apomorfin
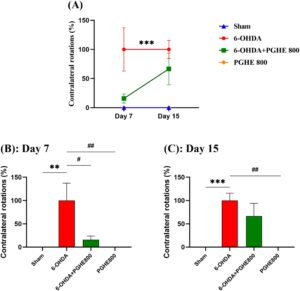
Dalam model tikus, uji rotasi yang diinduksi apomorfin digunakan secara luas untuk menilai efek neurotoksin 6-OHDA. Sedangkan perilaku tikus yang mengalami lesi sepenuhnya normal sebelum injeksi apomorfin (Hudson et al. 1993 ). ANOVA pengukuran berulang dari persentase rotasi kontralateral (Gambar 6A ) mengungkapkan efek signifikan dari perawatan [ F (3,32) = 8,221, p = 0,0003] dan waktu [ F (1,28) = 4,568, p = 0,0414]. Sedangkan efek interaksi waktu × perawatan tidak berbeda secara signifikan. Jumlah rotasi kontralateral yang diinduksi oleh injeksi apomorfin secara langsung berhubungan dengan kerusakan sistem dopaminergik (Huang et al. 2018 ). Seperti yang terlihat pada Gambar 6A , rotasi kontralateral yang signifikan (ke kiri) pada tikus dengan lesi 6-OHDA dibandingkan dengan kelompok sham ( p = 0,0008) menunjukkan keberhasilan induksi PD pada model tikus. Waktu minimum yang diperlukan untuk induksi PD adalah 7 hari seperti yang digambarkan pada Gambar 6B,C . Selain itu, pengobatan PGHE melemahkan rotasi kontralateral dibandingkan dengan kelompok dengan lesi 6-OHDA (64,53% ± 24,84%) tetapi tidak signifikan secara statistik seperti pada Hari ke-15 ( p = 0,4762; Gambar 6C ). Seperti yang ditunjukkan pada Gambar 6B , pengobatan PGHE secara signifikan mengurangi perilaku rotasi yang diinduksi apomorfin sebesar 84,20% ± 28,51% setelah 7 hari dibandingkan dengan kelompok dengan lesi 6-OHDA ( p = 0,0293). Berdasarkan penelitian sebelumnya tentang fitur antioksidan intens dari PGHE (Goli et al. 2005 ; Rafiee et al. 2018 ; Rajaei et al. 2010 ; Sadeghinejad et al. 2019 ; Sarteshnizi et al. 2019 ), hasil ini menunjukkan efek positif PGHE pada pencegahan kehilangan neuron dopaminergik dengan membersihkan radikal bebas di SNpc; sebagai hasilnya, disfungsi motorik menurun. Jadi, pengamatan ini menunjukkan efek perlindungan PGHE terhadap gangguan fungsi motorik yang diinduksi 6-OHDA dalam model Parkinson tikus. Seperti yang digambarkan dalam Gambar 6 , mirip dengan uji perilaku lainnya, PGHE tidak menunjukkan efek buruk pada kinerja hewan dalam uji rotasi yang diinduksi apomorfin.
3.4 Efek Penghambatan PGHE pada Fibrilasi α-Syn
α-syn merupakan protein normal yang terdapat di semua neuron; namun, pada PD, protein ini mengalami kesalahan pelipatan dan agregat ke dalam struktur fibrilar yang toksik (Negi et al. 2024 ). Penelitian telah menunjukkan bahwa mencegah atau mengurangi fibrilasi α-syn dapat memainkan peran penting dalam mengurangi gejala penyakit yang berhubungan dengan α-syn seperti PD (Bellucci et al. 2012 ). Berfokus pada α-syn menawarkan pendekatan yang efektif untuk memperlambat perkembangan PD (Singh et al. 2021 ).
Fluoresensi ThT meningkat dalam kontrol dan sampel yang mengandung 50 μg/mL PGHE (Gambar 7A ), yang menunjukkan peningkatan dalam kemajuan fibrilasi α-syn. Ini menunjukkan bahwa α-syn mengalami transisi konformasi ke struktur kaya β-sheet silang yang mengarah pada pembentukan fibril α-syn selama waktu yang ditentukan ini. Dapat disimpulkan bahwa pembentukan fibril tertinggi diamati pada kelompok kontrol. Uji ThT mengungkapkan bahwa 250 dan 500 μg/mL ekstrak memiliki efek penghambatan yang lebih tinggi (84%) daripada sampel yang mengandung 50 μg/mL PGHE (60%). Oleh karena itu, 250 μg/mL ekstrak dipilih sebagai konsentrasi optimum. Polifenol telah dilaporkan menghambat pembentukan fibril dengan mempertahankan konformasi asli α-syn dan mencegah perkembangan struktur β-sheet, yang penting untuk pembentukan fibril amiloid. Selain itu, berbagai flavonoid seperti Baicalein telah terbukti menghambat fibrilasi α-synuclein (Meng et al. 2010 ). Dalam konteks ini, konsentrasi tinggi senyawa bioaktif, termasuk polifenol, dalam PGHE telah dikonfirmasi sebelumnya (Arjeh et al. 2020 ), yang selanjutnya mendukung peran potensialnya dalam mengurangi fibrilasi amiloid.
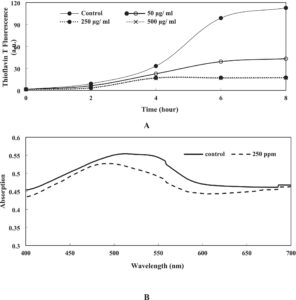
Uji Congo red juga diterapkan untuk mempelajari fibrilasi α-syn. Pewarna histologis yang umum digunakan untuk deteksi α-syn adalah Congo red. Spesifisitas pewarnaan ini muncul dari afinitas Congo red untuk mengikat protein fibril yang diperkaya dalam konformasi β-sheet (Frid et al. 2007 ). Interaksi antara Congo red dan fibril yang kaya dalam struktur β-sheet disertai dengan peningkatan penyerapan dan pergeseran merah dari 480 ke 540 nm (Gambar 7B ). Perubahan dalam spektrum penyerapan Congo red dalam rentang panjang gelombang 400–600 nm untuk kontrol dan 250 μg/mL ekstrak diselidiki setelah 8 jam inkubasi. Peningkatan spektrum penyerapan dan pergeseran merah pada penyerapan maksimum sampel kontrol menunjukkan adanya lebih banyak struktur fibrilar dan penghambatan fibrilasi α-syn pada 250 μg/mL ekstrak.
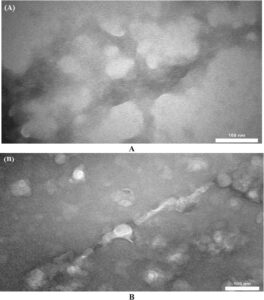
3.5 Mikroskop Elektron Transmisi (TEM)
TEM digunakan untuk mengonfirmasi temuan dari uji ThT dan Congo red dan untuk menunjukkan secara visual pembentukan fibril dengan dan tanpa PGHE (Gambar 8 ). Seperti yang ditunjukkan pada Gambar 8A , fibril α-syn matang seperti tali diamati ketika α-syn diinkubasi sendiri. Namun, sejumlah besar fibril α-syn telah berkurang secara nyata, dengan jumlah minimal oligomer kecil yang diamati dengan adanya ekstrak (Gambar 8B ).
4 Kesimpulan
Dalam studi ini, sifat anti-penyakit Parkinson dari PGHE dievaluasi secara in vivo dan in vitro. Studi toksisitas oral akut menemukan PGHE aman dan praktis tidak beracun (LD50 > 5000 mg/kg). Delapan ratus mg/kg BB PGHE menunjukkan efek positif yang signifikan pada kinerja perilaku dalam model tikus PD dengan peningkatan dalam melakukan uji silinder, sinar sempit, kutub, dan rotasi yang diinduksi apomorfin. Berdasarkan hasil ini, diasumsikan bahwa PGHE dapat melemahkan stres oksidatif neuron dopaminergik. Selain itu, studi in vitro menunjukkan bahwa 250 μg/ml PGHE memiliki efek penghambatan tertinggi pada pembentukan fibril α-syn. Oleh karena itu, PGHE dapat dianggap sebagai penghambat fibrilasi α-syn. Temuan ini menunjukkan aktivitas anti-PD potensial dari PGHE. Oleh karena itu, PGHE dapat dianggap sebagai suplemen baru untuk pengobatan PD. Penilaian tingkat agregasi α-syn dan perubahan biokimia terkait di otak direkomendasikan untuk penelitian masa depan untuk mengevaluasi efek PGHE secara komprehensif.

