
ABSTRAK
Dalam penelitian ini, kami menyelidiki potensi efek biologis protein dan peptida yang diekstrak dari empat varietas biji quinoa komersial yang berbeda: Hitam (B), Merah (R), Putih (W), dan Putih Kerajaan (RO), menggunakan sel Caco-2 sebagai model proliferasi. Kurva konsentrasi-respons dibuat untuk mengevaluasi sitotoksisitas dan efek antiproliferatif. Menariknya, peptida menunjukkan sitotoksisitas yang lebih tinggi daripada protein, khususnya pada varietas quinoa R dan RO. Berdasarkan temuan ini, kami menggunakan pendekatan penambangan data untuk mengidentifikasi dan membandingkan protein sitotoksik dalam empat varietas quinoa. Dengan menggunakan kelimpahan relatifnya, kami berhasil mengklasifikasikan quinoa R dan RO sebagai kelompok yang kohesif menggunakan model klasifikasi. Untuk mendapatkan wawasan yang lebih mendalam tentang efek biologis pada sel, kami menganalisis secara komprehensif ekspresi diferensial biomarker apoptosis menggunakan proteomik yang ditargetkan kromatografi cair-spektrometri massa tandem (LC-MS/MS). Akhirnya, kami mengkorelasikan profil apoptosis dengan kelimpahan relatif protein sitotoksik. Semua penelitian ini didukung oleh penerapan analisis data multivariat. Hasilnya menunjukkan potensi antikanker dari protein dan peptida biji quinoa dan memberikan dasar untuk studi mekanistik yang lebih terfokus yang bertujuan mengembangkan makanan fungsional dan nutraseutika.
1 Pendahuluan
Quinoa ( Chenopodium quinoa Willd.) adalah biji-bijian Andes yang telah menarik perhatian signifikan dalam beberapa tahun terakhir karena manfaat kesehatan dan nilai gizinya yang potensial, termasuk kandungan protein yang tinggi dengan profil asam amino yang seimbang [ 1 , 2 ]. Meskipun sudah diketahui bahwa konsumsi quinoa berkontribusi terhadap kesejahteraan, upaya khusus saat ini sedang dilakukan untuk mendapatkan informasi tentang efek potensial bahan-bahan quinoa [ 2 ], seperti protein yang menyajikan bioaktivitas antihipertensi [ 3 ], antidiabetik [ 4 ], dan antikanker [ 5 ]. Berusaha untuk mengungkap efek biologisnya, penelitian kami menyelidiki proteomik, uji fungsional, dan penambangan data untuk mengeksplorasi secara komprehensif potensi sifat antiproliferatif protein dan peptida yang berasal dari empat varietas biji-bijian quinoa yang dikomersialkan sebagai Hitam (B), Merah (R), Putih (W) (dari Peru), dan Royal white (RO) (dari Bolivia). Penelitian sebelumnya telah meletakkan dasar untuk investigasi kami dengan menetapkan peta protein komprehensif dari varietas quinoa ini dengan kromatografi cair bebas label-spektrometri massa tandem (LC-MS/MS) shotgun proteomik [ 6 ]. Selain itu, strategi penambangan data telah dikembangkan untuk mengeksplorasi bioaktivitas imunonutrisi protein quinoa secara siliko [ 7 ], sementara penelitian in vitro lainnya telah mengidentifikasi quinoa sebagai sumber potensial peptida bioaktif dengan aktivitas antikanker [ 5 ]. Berdasarkan ini, kami menyelidiki efek protein dan peptida yang berasal dari quinoa pada sel adenokarsinoma kolorektal (Caco-2), model yang banyak digunakan untuk proliferasi epitel dalam penelitian kanker [ 8 ]. Kanker kolorektal (CRC) adalah kanker ketiga yang paling sering didiagnosis di seluruh dunia, dengan tingkat kejadian yang meningkat di negara-negara berkembang [ 9 ]. Mengingat statistik yang mengkhawatirkan ini, ada kebutuhan mendesak untuk pendekatan inovatif untuk mencegah dan mengobati penyakit ini. Salah satu strategi yang menjanjikan adalah dengan menginduksi kematian sel terprogram (apoptosis) pada sel kanker, yang dapat menghambat proliferasi sel yang tidak terkendali dan perkembangan tumor [ 10 ]. Dalam konteks ini, senyawa yang berasal dari alam, termasuk protein dan peptida bioaktif, telah mendapatkan perhatian besar karena sifat antiproliferatif dan proapoptotiknya [ 11]. Penelitian kami bertujuan untuk mengevaluasi aktivitas antiproliferatif dan proapoptotik protein quinoa dan hidrolisat triptiknya (yaitu, peptida) menggunakan uji fungsional in vitro seperti 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida (MTT) untuk sitotoksisitas dan proliferasi. Kurva konsentrasi-respons untuk protein dan peptida mengungkapkan bahwa varietas quinoa tertentu secara signifikan mengurangi pertumbuhan sel pada konsentrasi tertentu. Untuk menyelidiki lebih lanjut mekanisme yang mendasarinya, kami menggunakan penambangan data untuk mengidentifikasi protein sitotoksik dalam peta protein komprehensif dari setiap varietas quinoa yang dibuat oleh shotgun proteomik LC-MS/MS. Analisis data multivariat memungkinkan diskriminasi varietas quinoa berdasarkan kelimpahan relatif protein sitotoksiknya dalam kaitannya dengan bioaktivitas yang diamati dalam uji fungsional. Selain itu, ekspresi diferensial biomarker terkait apoptosis pada sel Caco-2 dipelajari oleh proteomik LC-MS/MS yang ditargetkan, yang memberikan bukti adanya hubungan potensial antara protein sitotoksik yang berasal dari quinoa dan jalur apoptosis pada sel CRC, serta mengidentifikasi kandidat bioaktif yang potensial. Pendekatan komprehensif ini, termasuk uji fungsional, proteomik LC-MS/MS, penggalian data, dan analisis data multivariat, bertujuan untuk mengevaluasi efek biologis in vitro dan memberikan wawasan mekanistik awal tentang tindakan terkait apoptosis dari protein quinoa dan hidrolisat yang berasal dari biji quinoa. Pada akhirnya, tujuan dari penelitian kami adalah untuk menyoroti potensi multifaset biji quinoa dalam bidang makanan fungsional dan nutraceutical yang lebih luas.
2 Bahan dan Metode
2.1 Bahan Kimia
Amonium bikarbonat (ABC ≥ 99,5%), asetonitril (kemurnian HPLC), metanol (kemurnian HPLC), asam format (tingkat reagen analitis), dan urea dibeli dari Carlo Erba (Milan, Italia). Asam borat (≥99,5%) dipasok oleh Merck (Darmstadt, Jerman). Konsentrat reagen pewarna uji protein dibeli dari Bio-Rad (Hercules, CA, AS). Bovine serum albumin (BSA), tripsin dari pankreas sapi, iodoacetamide (IAA), dithiothreitol (DTT), natrium karbonat, reagen Folin–Ciocalteu (FC), asam klorida (HCl, 37% (v/v)), dan natrium hidroksida (NaOH, ≥ 98%) dibeli dari Sigma–Aldrich (Darmstadt, Jerman). Kit pengujian protein asam bicinchoninic (BCA) dibeli dari ThermoFisher Scientific (San José, CA, AS). Air ultramurni deionisasi (selanjutnya disebut air) dimurnikan (0,055 µS/cm, TOC 1 ppb) dengan sistem air ultramurni Purelab pulse + Flex (Elga Veolia, Milan, Italia).
2.2 Bahan Tanaman
Biji quinoa B, R, W, dan RO diperoleh dari supermarket lokal di Barcelona (Spanyol). Isi kemasan komersial 500 g (3 kemasan per varietas biji-bijian komersial) dihomogenkan, dikeringkan dalam oven berventilasi pada suhu 40°C selama 24 jam, digiling dalam penggiling kopi, dan disimpan pada suhu ruangan dalam desikator.
2.3 Kultur Sel
Sel adenokarsinoma kolorektal manusia Caco-2 (ATCC HTB37, American Type Culture Collection, Manassas, VA, AS) ditumbuhkan dalam media sel glukosa tinggi Dulbecco’s Modified Eagle’s Medium (DMEM) (Euroclone spa, Milan, Italia) yang dilengkapi dengan 10% serum sapi fetal (FBS, Euroclone spa), 1% penisilin-streptomisin (Gibco, NY, AS), dan 1% larutan asam amino nonesensial (Gibco, Paisley, Inggris). Lini sel ditumbuhkan dalam atmosfer lembap dengan 95% udara dan 5% CO 2 pada suhu 37°C.
2.4 Ekstraksi dan Persiapan Sampel Protein dan Peptida
Protein quinoa diekstraksi seperti yang dijelaskan oleh Galindo-Luján et al. [ 6 , 12 ]. Dua ratus lima puluh miligram sampel yang digiling dicampur dengan 1 mL air dan 39 µL NaOH 1 mol/L (nilai pH akhir 10,0) menggunakan vortex Genius 3 (Ika, Staufen, Jerman). Suspensi diinkubasi selama 1 jam pada suhu 36°C dengan pengocokan konstan pada kecepatan 900 rpm dalam thermoshaker TS-100 (Biosan, Riga, Republik Latvia). Pemisahan protein yang larut dari residu yang tidak larut dilakukan dengan sentrifugasi pada kecepatan 15.000 × g selama 20 menit pada suhu 4°C dalam centrifuge Rotanta 460 yang didinginkan (Hettich Zentrifugen, Tuttlingen, Jerman). Untuk pemurnian protein, pH supernatan disesuaikan dengan 22 µL 1 mol/L HCl hingga nilai pH akhir 5,0. Setelah disentrifugasi pada 15.000 × g selama 20 menit pada suhu 4°C, protein yang diendapkan disuspensikan kembali dalam 1 mL buffer natrium borat (60 mmol/LH3BO3 yang disesuaikan dengan pH 9,0 dengan NaOH). Campuran diinkubasi pada suhu 36°C selama 1 jam dengan pengocokan konstan pada kecepatan 1200 rpm untuk membantu pelarutan, dan larutan disaring melalui filter nilon 0,22 µm (Macherey-Nagel, Düren, Jerman). Ekstrak protein diuapkan hingga kering menggunakan konsentrator Savant SPD-111 V SpeedVac (ThermoFisher Scientific) dan disimpan pada suhu −20°C hingga digunakan. Untuk memfasilitasi pelarutan protein dan pencernaan tripsin, ekstrak protein kering dilarutkan kembali dalam larutan urea 3 mol/L dalam 50 mmol/L ABC (nilai pH akhir 8) selama 20 jam pada suhu ruangan dengan pengocokan konstan pada 900 rpm. Selanjutnya, ekstrak protein disentrifugasi pada 15.000 × g selama 10 menit pada suhu 4°C, dan supernatan dipekatkan dan dihilangkan garamnya dengan prosedur filtrasi sentrifugal pertukaran buffer menggunakan 50 mmol/L ABC (filter sentrifugal selulosa asetat Amicon Ultra-0,5; batas berat molekul 3 kDa, Millipore, Bedford, MA, AS). Singkatnya, 500 µL larutan sampel disentrifugasi pada 10.000 × g selama 10 menit pada suhu 25°C, dan residu dicuci dengan 50 µL ABC 50 mmol/L sebanyak lima kali dalam kondisi yang sama. Terakhir, air digunakan untuk melakukan dua langkah tambahan pencucian dan penghilangan garam. Residu yang diperoleh diambil kembali dengan cara membalikkan wadah atas dalam botol baru dan memutarnya pada gaya sentrifugal yang dikurangi (300 × g selama 2 menit). Kemudian, 50 mmol/L ABC ditambahkan untuk menyesuaikan volume akhir menjadi 500 µL. Larutan ekstrak protein murni diuji untuk kandungan protein total menurut metode Bradford [ 13]. Dua puluh mikroliter masing-masing larutan ekstrak atau larutan standar BSA ditambahkan ke 1000 µL reagen Bradford yang sebelumnya diencerkan (1:5 v/v), dan absorbansi diukur pada 595 nm. Larutan standar BSA disiapkan dengan pengenceran serial untuk mencakup rentang konsentrasi 25–400 µg/mL dari larutan stok BSA 1 mg/mL. Hidrolisat protein diperoleh setelah pencernaan triptik dari larutan ekstrak protein yang dimurnikan. Protein direduksi dengan DTT (100 mmol/L selama 30 menit pada suhu 37°C), diikuti oleh alkilasi dengan IAA (200 mmol/L selama 30 menit dalam gelap), dan sekali lagi penambahan DTT (100 mmol/L selama 15 menit pada suhu kamar) untuk menghindari alkilasi berlebihan. Akhirnya, sampel dicerna dengan inkubasi dengan tripsin (rasio enzim/substrat 1:50 m/m) pada suhu 37°C semalaman dengan pengocokan konstan pada 1200 rpm. Pencernaan dihentikan dengan penambahan asam format 1% (v/v). Supernatan dengan peptida tripsin dikumpulkan setelah disentrifugasi pada 15.000 × g selama 2 menit pada suhu 4°C. Hidrolisat peptida dikeringkan di bawah nitrogen dan disimpan pada suhu -20°C hingga digunakan.
2.5 Uji Sitotoksisitas dan Proliferasi MTT
Sitotoksisitas protein dan peptida biji quinoa pada sel Caco-2 dievaluasi pada 24 dan 72 jam, berturut-turut. Untuk memberikan gambaran umum yang luas tentang efek biologis, kurva konsentrasi-respons dibuat yang mencakup empat konsentrasi yang berbeda. Protein dan peptida diuji dalam duplikat pada 4, 2, 1, dan 0,5 mg/mL. Untuk menghindari gangguan eksternal, seperti interaksi antara buffer ekstraksi dan kultur sel, konsentrasi tertinggi untuk setiap ekstrak kering dilarutkan kembali menggunakan media sel (DMEM glukosa tinggi). Rekonstitusi ini dilakukan di dalam lemari pengaman biologis, tanpa sumber protein tambahan (FCS, BSA), untuk mengurangi risiko kontaminasi mikroba. Uji pendahuluan dilakukan untuk menilai kelarutan ekstrak dalam media sel dan untuk mencapai pH larutan akhir dalam kisaran 7–7,4. Sel Caco-2 disemai dalam pelat 96-sumur pada kepadatan 5·10 4 /0,2 mL, dalam medium lengkap hingga mencapai ~80% konfluensi, dan serum-starved semalaman. Keesokan harinya, sel diobati dengan ekstrak (100 µL/sumur) menurut desain konsentrasi-respons, di mana 10% FCS dan 10% dimetilsulfoksida (DMSO) masing-masing berfungsi sebagai kontrol negatif dan positif untuk kelangsungan hidup sel. Kelangsungan hidup sel dievaluasi setelah 24 jam pengobatan pada 37°C dan 5% CO 2 , menggunakan uji kolorimetri MTT [ 14 ]. MTT ditambahkan pada konsentrasi akhir 1 mg/mL dan diinkubasi selama 2 jam pada 37°C. Kristal formazan yang dihasilkan dilarutkan dengan 100 µL DMSO per sumur. Absorbansi diukur pada 570 nm menggunakan spektrofotometer TECAN Spark 10 M (Männedorf, Swiss). Untuk mengevaluasi dampak protein dan peptida quinoa pada proliferasi sel, protokol yang sama diikuti, tetapi dengan waktu paparan 72 jam [ 15 ]. Konsentrasi ekstrak yang mengurangi viabilitas sel lebih dari 20% dari kondisi basal (sel yang hanya diobati dengan medium, yang sesuai dengan viabilitas 100%) dikeluarkan dari eksperimen lebih lanjut. Sebaliknya, konsentrasi yang tidak beracun pada 24 jam tetapi menyebabkan pengurangan viabilitas sel pada 72 jam menjalani uji proliferasi kedua untuk menjelaskan mekanisme molekuler yang mendasari efek biologis in vitro ini. Kurva konsentrasi-respons dibuat, dengan merata-ratakan hasil viabilitas yang diperoleh dari dua replikasi biologis ( n = 2).
Data uji MTT dianalisis menggunakan uji statistik ANOVA satu arah dengan paket analisis statistik Prism versi 6 (GraphPad Software, Boston, MA, AS). Hasil diplot sebagai rata-rata ± simpangan baku (SD). Nilai p ≤ 0,05 dianggap signifikan secara statistik. Viabilitas sel dinormalisasi terhadap kondisi dasar (pertumbuhan sel dalam media seluler).
2.6 Persiapan Sampel untuk Uji Fungsional dan Wawasan Antiproliferatif Proteomik LC-MS/MS
Konsentrasi ekstrak protein quinoa yang menunjukkan aktivitas antiproliferatif potensial diekspos ke Caco-2 selama 72 jam mengikuti prosedur sebelumnya. Sel yang diobati dengan 4 mg/mL BSA dan 10% FCS digunakan sebagai kontrol negatif untuk menilai viabilitas sel in vitro. Langkah ini dilakukan untuk memastikan bahwa sel-sel tersebut fungsional dan viable sebelum melanjutkan dengan analisis proteomik yang ditargetkan dari biomarker apoptosis. Untuk analisis ini, sel yang tumbuh dalam kondisi medium basal (medium basal tanpa sumber protein tambahan) digunakan sebagai kontrol negatif. Sebaliknya, paclitaxel (taxol) digunakan sebagai kontrol positif karena efeknya yang menginduksi apoptosis yang diketahui [ 16 ]. Sel Caco-2 disemai di pelat 12-sumur pada kepadatan seluler yang tinggi (5·10 5 /mL) dan diekspos ke perlakuan (350 µL). Setelah 72 jam (pada 37°C dengan 5% CO 2 ), media sel yang mengandung ekstrak dan kontrol dibuang, dan lapisan sel tunggal dicuci dengan garam penyangga fosfat (PBS). Untuk memulihkan serpihan sel yang ada dalam larutan pencuci, sel disentrifugasi pada 15.000 × g selama 10 menit pada 25°C, dan pelet sel diisolasi. Untuk pengumpulan protein sel, seluruh kumpulan sel Caco-2 (lapisan tunggal + pelet) dilisiskan menggunakan larutan NaOH berair 0,1 mol/L semalaman pada 4°C dengan pengadukan lembut. Kandungan protein lisat ditentukan menggunakan kit uji BCA ( λ = 550 nm) [ 17 , 18 ], dikalibrasi dengan standar protein BSA dalam kisaran kandungan protein 2,5–100 µg. Lisat protein kemudian dikeringkan di bawah nitrogen dan dilarutkan kembali dalam 50 mmol/L ABC (pH = 8) untuk menciptakan kembali lingkungan yang optimal untuk pencernaan tripsin. Protein dicerna mengikuti prosedur pencernaan tripsin yang disebutkan sebelumnya. Peptida yang dihasilkan dikeringkan di bawah nitrogen dan dilarutkan kembali dalam 50 µL larutan berair air/asetonitril/asam format (49,95/49,95/0,1, v/v/v) untuk analisis LC-MS/MS.
2.7 Proteomik LC-MS/MS yang Ditargetkan
Pemisahan peptida dari pencernaan tripsin dilakukan dengan menggunakan kolom Xbridge Peptide BEH C18 (panjang total 250 mm ( L T ) × diameter internal 2,1 mm (id), ukuran partikel 5 µm) (Waters, Milford, MA, AS) yang dilengkapi dengan kolom pra-penyaringan C18 (5 mm L T × 2,1 mm id) (Waters). Fase mobil, yang terdiri dari Pelarut A (0,1% v/v asam format berair) dan Pelarut B (0,1% v/v asam format dalam asetonitril), disalurkan dalam elusi gradien pada laju alir 200 µL/menit. Gradien linier diprogram sebagai berikut: 0 menit 2% Pelarut B, 4 menit 2% Pelarut B, 150 menit 90% Pelarut B, 155 menit 90% Pelarut B, dan 160 menit 2% Pelarut B. Sepuluh mikroliter sampel disuntikkan. Semua analisis LC-MS/MS yang ditargetkan dilakukan menggunakan HPLC seri Agilent Technologies 1200 (Agilent Technologies, Waldronn, Jerman) yang digabungkan dengan antarmuka ionisasi elektrospray berbantuan pneumatik (ESI) ke spektrometer massa kuadrupol rangkap tiga QTRAP 4000 (AB SCIEX, Foster City, CA, AS). Tegangan ESI dan suhu kapiler ditetapkan pada 5,5 kV dan 350°C, masing-masing, dengan selubung dan gas tambahan yang disalurkan pada laju aliran 45 dan 5 (unit sembarang). Percobaan dilakukan dalam kondisi pemantauan reaksi tunggal ion positif (SRM) menggunakan nitrogen sebagai gas tumbukan (tekanan 2,1 × 10 −3 mbar) dan waktu ganda 20 ms untuk setiap transisi yang dipantau. Perangkat lunak Skyline (Perangkat Lunak MacCoss Lab, versi 22.2.0.351) digunakan untuk mensimulasikan pencernaan tripsin dari 13 biomarker protein untuk analisis proteomik bertarget LC-MS/MS. Transisi MS/MS (mengandung 3 fragmen y dan 3 fragmen b untuk setiap peptida) dianalisis secara ganda ( n = 2) untuk mengonfirmasi identitas peptida berdasarkan konsistensi koelusi fragmen dan waktu retensi antara replikasi; hanya protein yang ditemukan di kedua replikasi yang dipertimbangkan untuk analisis statistik. Nilai energi tumbukan diprediksi menggunakan model linier sederhana [ 19 ], dan data dianalisis secara statistik menggunakan MSstats, lingkungan berbasis R yang memungkinkan perbandingan beberapa data untuk eksperimen proteomik berbasis spektrometri massa bottom-up kuantitatif untuk mendeteksi protein yang berlimpah secara diferensial [ 20 ]. Potensi declustering ditetapkan pada 80 V, dan energi tumbukan dioptimalkan menurut urutan peptida. Rincian biomarker protein, peptida target, transisi SRM, dan energi tumbukan disediakan dalam Tabel S7 . Setiap sampel digest triptik dianalisis dalam duplikat, dan analit dikuantifikasi secara relatif dengan mempertimbangkan luas puncak relatifnya dan dinormalisasi terhadap total kandungan protein yang diukur dengan uji BCA.
2.8 Analisis dan Interpretasi Data
2.8.1 Identifikasi Protein Sitotoksik dalam Ekstrak Biji Quinoa
Dalam studi sebelumnya, kami menjelaskan strategi penambangan data proteomik untuk mengidentifikasi protein biji quinoa dengan potensi aktivitas imunonutrisi [ 7 ], yang diadaptasi di sini untuk mengungkap potensi protein sitotoksik. Urutan FASTA dari peptida dan protein yang berasal dari tumbuhan yang dikenal karena aktivitas sitotoksiknya dicari dan diambil dari database Pusat Informasi Bioteknologi Nasional (NCBI) ( https://www.ncbi.nlm.nih.gov/protein , diakses pada 1 Juli 2023). Tipe protein sitotoksik yang mengandung sekuens protein tertentu dengan persentase identitas ≥20% dengan peta proteom eksperimental biji quinoa [ 6 , 7 ], termasuk protein penonaktif ribosom (RIPs, 2877 protein dari berbagai spesies tanaman), penghambat protease (PIs, 238 protein dari Arabidopsis thaliana ), penghambat α-amilase (AIs, 670 protein dari A. thaliana ), toksin pembentuk pori (PFTs, 637 protein dari berbagai spesies tanaman), dan peptida antimikroba (AMPs, 675 protein dari berbagai spesies tanaman [ 7 ]). Seperti yang dapat diamati, pada tipe protein sitotoksik yang paling umum, pencarian difilter menurut organisme tanaman, dengan memilih organisme tanaman model A. thaliana , untuk menghindari informasi yang berlebihan. Beberapa protein lain dengan aktivitas sitotoksik juga dipertimbangkan dalam pencarian awal, tetapi tidak ditemukan kesamaan yang signifikan dengan peta proteom eksperimental biji quinoa. Jenis protein sitotoksik yang dibuang termasuk beta-purothionin (40 protein dari spesies tanaman yang berbeda), urease (208 protein dari spesies tanaman yang berbeda), dan arcelin (275 protein dari A. thaliana ). Entri protein untuk RIP, PI, AI, PFT, dan AMP terpilih dapat ditemukan di Tabel S1–S5 , secara berurutan. Untuk menilai kesamaan sekuens, sekuens FASTA yang diperoleh dari peptida dan protein sitotoksik yang berasal dari tanaman dibandingkan, seperti yang dijelaskan dalam penelitian kami sebelumnya, dengan database quinoa NCBI Reference Sequence (RefSeq) (63.373 entri protein) menggunakan Basic Local Alignment Search Tool (BLASTp) protein–protein dari NCBI ( https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM= blastp&PAGE_TYPE = BlastSearch&LINK_LOC = blasthome, diakses pada 1 Juli 2023). Alat BLASTp memungkinkan deteksi beberapa penyelarasan lokal antara dua urutan protein dan menyediakan informasi untuk kecocokan urutan internal. Perlu dicatat bahwa, untuk setiap protein quinoa, hanya kecocokan dengan urutan sitotoksik yang memberikan persentase identitas tertinggi yang dipilih. Selanjutnya, entri NCBI yang sesuai dengan protein quinoa dengan potensi bioaktivitas sitotoksik dicari terhadap peta proteom biji quinoa eksperimental dari biji quinoa R, B, W, dan RO yang diperoleh dengan shotgun proteomik LC-MS-MS dalam pekerjaan kami sebelumnya [ 6 ] (1211 protein). Rata-rata intensitas bebas label yang dinormalisasi (LFQ) dari protein sitotoksik potensial yang diidentifikasi dalam biji quinoa R, B, W, dan RO ( n = 2) (Tabel S6 ) dipertimbangkan untuk analisis komponen utama (PCA) dan PLS-DA. PCA memungkinkan identifikasi tren dan pengelompokan data tanpa pengawasan, serta deteksi outlier. PLS-DA kemudian diterapkan untuk membangun model klasifikasi dengan pemisahan kelas yang lebih baik dan untuk mengungkapkan pentingnya biomarker protein yang berbeda untuk diskriminasi, dengan mempertimbangkan pentingnya variabel mereka dalam skor proyeksi (VIP) (VIP> 1 dianggap relevan untuk model) [ 12 ]. Validasi silang model PLS-DA tanpa pengecualian dilakukan selama optimasi model, dan paket R “mdatools” (versi 0.12.0) digunakan untuk PCA dan PLS-DA [ 21 ].
2.8.2 Ekspresi Diferensial Biomarker Apoptosis pada Sel Caco-2
Biomarker molekuler terkait apoptosis dan jaringan biologisnya dijelaskan dengan baik dalam literatur [ 22 – 24 ]. Berangkat dari wawasan berharga ini, pemilihan biomarker protein apoptosis untuk diselidiki dilakukan dengan menggunakan analisis pengayaan jalur Cytoscape (versi 3.10.1, Cytoscape Consortium, https://cytoscape.org ) (g:SCS sebagai metode default untuk menghitung koreksi pengujian berganda), memeriksa jalur apoptosis manusia (WP254) (Tabel S7 ). File mentah MS diproses dengan Skyline untuk identifikasi peptida dan protein serta kuantifikasi relatif. Transisi peptida MS/MS diperoleh, dan parameter pencarian mencakup karbamidometilasi sistein sebagai modifikasi tetap, dan asetilasi N-terminal dan oksidasi metionina ditetapkan sebagai modifikasi variabel. Hingga dua pembelahan yang terlewat diizinkan untuk pencernaan tripsin. Keunikan urutan peptida kandidat dinilai menggunakan alat BLASTp. MSstats (terintegrasi dalam Skyline) digunakan untuk perbandingan kelompok dengan tingkat keyakinan 95% (algoritma Benjamini–Hochberg diterapkan untuk memperoleh nilai p yang disesuaikan ), dengan mempertimbangkan nilai kelimpahan protein relatif terhadap perbandingan kondisi berpasangan. Paket RStudio (versi 4.4.1) seperti “ggplo2” dan “gplots” digunakan untuk membuat peta panas (skala baris). Luas puncak LC-MS/MS dan nilai persentase Deviasi Standar Relatif (RSD) untuk biomarker apoptosis dan signifikansi statistik ( nilai p yang disesuaikan ) peptida quinoa RO dan R terhadap kontrol negatif (basal) dan positif (taxol) masing-masing dilaporkan dalam Tabel S8 dan S9 . Untuk mengevaluasi kemungkinan korelasi antara protein sitotoksik paling relevan yang diidentifikasi melalui penambangan data pada biji quinoa R dan RO dan area puncak proteomik LC-MS/MS yang ditargetkan dari biomarker apoptosis yang diekspresikan secara signifikan berbeda (setidaknya dibandingkan dengan kontrol negatif) yang dipicu oleh peptida R/RO, PCA dan matriks korelasi Pearson dihitung dari data skala baris.
3 Hasil dan Pembahasan
3.1 Potensi Sitotoksik dan Antiproliferatif Protein dari Berbagai Varietas Biji Quinoa
Dalam penelitian ini, kami bertujuan untuk menyelidiki apakah protein atau protein hidrolisat (yaitu, peptida) dari berbagai varietas quinoa komersial menunjukkan efek antiproliferatif pada sel adenokarsinoma kolorektal. Alasan kami adalah untuk menetapkan korelasi antara profil protein ekstrak biji quinoa dan dampaknya pada aktivitas seluler. Hal ini dicapai melalui pendekatan terpadu yang menggabungkan bukti eksperimental dari uji fungsional dengan shotgun LC-MS/MS dan proteomik yang ditargetkan. Dengan menggunakan penambangan data dan analisis data multivariat, kami mengidentifikasi protein bioaktif putatif dalam ekstrak yang mungkin bertanggung jawab atas efek biologis yang diamati. Selain itu, kami menganalisis ekspresi diferensial biomarker apoptosis dalam sel Caco-2, yang memberikan penjelasan mekanistik awal untuk tindakan biologis yang diamati.
3.1.1 Uji Fungsional Sitotoksisitas dan Proliferasi
Dalam konteks farmakologi dan toksikologi [ 25 ], uji MTT digunakan untuk menghasilkan kurva konsentrasi/dosis–respons untuk menilai sitotoksisitas pada 24 jam protein dan peptida biji quinoa. Selain itu, penurunan viabilitas sel pada 72 jam dipertimbangkan untuk mengevaluasi kemungkinan efek antiproliferatif. Viabilitas sel dinilai menggunakan uji MTT. Untuk memudahkan representasi visual hasil, varietas quinoa dengan aktivitas serupa dikelompokkan dalam Gambar 1 dan 2 . Gambar 1 menunjukkan kurva konsentrasi–respons sitotoksisitas dan proliferasi untuk protein dan peptida quinoa B dan W. Seperti yang dapat diamati pada Gambar 1A, protein quinoa B , B dan W menunjukkan efek sitotoksik yang jelas pada 4 dan 2 mg/mL, sedangkan konsentrasi yang lebih rendah (0,5 dan 1 mg/mL) tidak menunjukkan sitotoksisitas yang signifikan. Konsentrasi yang lebih rendah ini diuji ulang untuk mengetahui efeknya terhadap proliferasi sel pada 72 jam (Gambar 1C, D ), yang mengonfirmasi keamanannya. Sebaliknya, peptida mampu mengurangi viabilitas sel bahkan pada konsentrasi rendah, dengan kurva konsentrasi-respons yang terdefinisi dengan baik (Gambar 1A , B). Di antara ini, 0,5 mg/mL adalah satu-satunya konsentrasi yang menunjukkan sedikit penghambatan pertumbuhan sel yang tidak signifikan. Setelah mengonfirmasi keamanannya pada 72 jam (data tidak ditampilkan), peptida B dan W pada 0,5 mg/mL dipromosikan ke langkah investigasi apoptosis.
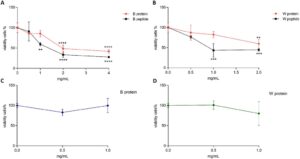

Gambar 2 menunjukkan hasil uji fungsional untuk protein dan peptida R dan RO. Seperti yang dapat diamati, tren toksik yang bergantung pada konsentrasi yang luar biasa terlihat pada 24 jam untuk protein dan peptida quinoa RO dan R, dimulai pada konsentrasi 0,5 mg/mL. Khususnya, efek seluler peptida tampak lebih kuat dibandingkan dengan protein. Perbedaan bioaktivitas antara protein dan peptida didukung oleh bukti eksperimental yang ada, di mana peptida lebih disukai dalam aplikasi terapeutik, seperti pengobatan antimikroba dan antikanker [ 26 , 27 ]. Peptida dapat menunjukkan toksisitas terhadap sel kanker karena beberapa sifat dan mekanisme kimia. Namun, penting untuk dicatat bahwa toksisitas dapat bervariasi secara signifikan tergantung pada urutan peptida spesifik dan jenis sel kanker yang menjadi target [ 28 ]. Peptida dapat terlibat dalam beberapa mekanisme antikanker, tergantung pada struktur spesifiknya, termasuk gangguan fungsi seluler (seperti replikasi DNA, transkripsi RNA, dan ekspresi protein), penetrasi membran, aktivasi imun, dan induksi apoptosis [ 28 ]. Berdasarkan temuan kami, konsentrasi 0,5 mg/mL dipilih untuk mengevaluasi efek antiproliferatif protein quinoa R dan RO, sementara konsentrasi 0,1 mg/mL dipilih untuk peptidanya. Meskipun konsentrasi yang lebih rendah ini tidak dinilai menggunakan uji MTT, masuk akal untuk memilih konsentrasi yang jauh lebih rendah daripada 0,5 mg/mL karena toksisitas peptida yang tinggi.
3.1.2 Identifikasi Protein Sitotoksik
Penambangan data untuk protein dan peptida dengan aktivitas toksik pada sel tumor melibatkan penggunaan teknik komputasi tingkat lanjut untuk menganalisis repositori data biologis yang luas. Pendekatan ini berfungsi untuk mengidentifikasi protein dan peptida spesifik yang mampu secara selektif menargetkan dan merusak sel kanker [ 29 ]. Meskipun proses ini memberikan wawasan berharga tentang agen antikanker potensial dan mekanisme molekulernya, menguraikan interaksi molekuler dapat menghadirkan tantangan yang signifikan [ 30 ]. Dalam penelitian terbaru, kami menggunakan proteomik shotgun LC-MS/MS bebas label untuk menghasilkan peta proteom komprehensif dari biji-bijian quinoa dari empat varietas quinoa komersial (R, B, W, dan RO) [ 6 ]. Peta-peta ini dianalisis lebih lanjut untuk mengidentifikasi protein dengan potensi bioaktivitas imunonutrisi [ 7 ]. Dengan menggunakan peta proteom eksperimental ini, strategi penambangan data serupa diterapkan dalam penelitian saat ini untuk mengidentifikasi protein dengan potensi aktivitas sitotoksik dalam varietas quinoa yang sama. Secara khusus, lima jenis protein sitotoksik dipertimbangkan untuk membangun basis data spesifik protein tanaman sitotoksik: RIP, PI, AI, PFT, dan AMP. Upaya ini dibatasi oleh keterbatasan literatur dan informasi basis data yang tersedia tentang protein sitotoksik dalam quinoa [ 31 ], yang terutama mengandalkan data dari tanaman lain, termasuk organisme model A. thaliana . Basis data yang dihasilkan, yang berisi 5097 entri protein, disaring terhadap peta proteom eksperimental dari biji quinoa R, B, W, dan RO [ 6 ]. Mengikuti prosedur ini, total 107 protein biji quinoa diidentifikasi di keempat varietas quinoa sebagai berpotensi sitotoksik. Informasi terperinci tentang protein yang diidentifikasi dapat ditemukan di Tabel S6 . Dari karakterisasi in-silico yang komprehensif ini dan mempertimbangkan kelimpahan relatif protein ini dalam varietas biji quinoa yang berbeda (yaitu, intensitas LFQ rata-rata yang dinormalisasi), alur kerja analisis data multivariat dikembangkan untuk menyelidiki variasi di antara varietas quinoa. Pertama, PCA dilakukan untuk mengevaluasi profil multivariat, yang bertujuan untuk mengidentifikasi kemungkinan klaster, pola, dan outlier. Selanjutnya, PLS-DA diterapkan untuk membangun model klasifikasi yang disempurnakan yang mampu menemukan korelasi antara potensi sitotoksisitas protein quinoa dan pengurangan pertumbuhan sel yang diamati dalam uji fungsional. Hasil dari PCA dan PLS-DA disajikan dalam Gambar 3 .

Secara keseluruhan, hasil dari penggalian data dan analisis data multivariat mendukung temuan dari uji fungsional. Mengingat beragamnya efek seluler yang ditunjukkan oleh protein sitotoksik yang paling diskriminatif dan potensi hubungannya dengan efek antiproliferatif, kami memutuskan untuk mengeksplorasi jalur apoptosis guna lebih memahami mekanisme molekuler yang mendasarinya.
3.2 Wawasan Proapoptotik Mengenai Aktivitas Antiproliferatif Potensial Protein dari Berbagai Varietas Gandum Quinoa
3.2.1 Uji Fungsional Proliferasi dan Proteomik LC-MS/MS yang Ditargetkan
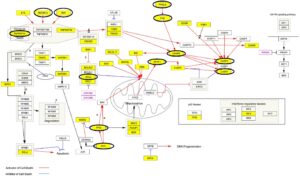
Untuk menyelidiki efek antiproliferatif potensial yang menjelaskan pengurangan yang diamati dalam viabilitas sel selama uji proliferasi, konsentrasi protein dan peptida biji quinoa terpilih diuji dalam kondisi eksperimen yang berbeda. Setelah 72 jam paparan, sel-sel dilisiskan, dan protein seluler dikumpulkan untuk dianalisis. Proteomik target LC-MS/MS kemudian digunakan untuk mengukur area puncak biomarker apoptosis terpilih (Tabel S8 ). Sebagai perbandingan, sel yang diobati dengan media basal atau paclitaxel 10 nmol/L masing-masing berfungsi sebagai kontrol negatif dan positif. Untuk memperhitungkan variabilitas inheren di antara lini sel, sumber protein alternatif, termasuk FCS (10%) dan BSA (4 mg/mL), dievaluasi untuk menyingkirkan potensi penghambatan pertumbuhan sel yang disebabkan oleh keberadaan protein, terlepas dari sumbernya. Analisis LC-MS/MS dalam kondisi ini tidak menunjukkan ekspresi diferensial dibandingkan dengan media basal. Mengenai biomarker apoptosis (Tabel S7 ), mereka dipilih dengan mempertimbangkan jalur apoptosis manusia (Cytoscape Consortium) dan analisis pengayaan ekspresi gen yang berfokus pada regulasi apoptosis. Kematian sel terprogram dan efek antiproliferatif saling berhubungan, karena menghambat proliferasi sel dapat menyebabkan apoptosis [ 32 ]. Menghentikan pembelahan sel kanker yang cepat dapat mendorongnya ke keadaan yang lebih rentan terhadap apoptosis. Gambar 4 mengilustrasikan jaringan apoptosis manusia yang dihasilkan, menyoroti gen yang terkait dengan regulasi jalur apoptosis dan biomarker apoptosis. Pemilihan biomarker apoptosis selanjutnya didukung oleh bukti dari literatur tentang ekspresi diferensial yang diinduksi oleh molekul antiproliferatif tumor, seperti paclitaxel [ 33-36 ] . Secara khusus, 13 biomarker apoptosis diselidiki, 12 di antaranya disorot dengan lingkaran pada Gambar 4. Khususnya, hanya satu biomarker yang tidak diidentifikasi melalui analisis pengayaan ekspresi gen (yaitu, reseptor faktor nekrosis tumor 10C [TNFRSF10C]). Kelimpahan relatif dari 13 biomarker apoptosis ini ditentukan secara memuaskan dengan mengukur luas puncaknya dengan LC-MS/MS (RSD ≤ 15% ( n = 2), Tabel S8 ).
3.2.2 Ekspresi Diferensial Biomarker Apoptosis
Kelimpahan relatif biomarker protein apoptosis dibandingkan di berbagai kondisi: kontrol negatif untuk proliferasi (media basal), kontrol positif (taxol), protein R/RO 0,5 mg/mL, peptida R/RO 0,1 mg/mL, dan peptida B dan W 0,5 mg/mL. Perbandingan kondisi berpasangan dilakukan menggunakan model efek campuran linier berdasarkan distribusi t Student [ 20 ]. Awalnya, profil ekspresi protein yang terkait dengan protein dan peptida biji quinoa dibandingkan dengan kontrol negatif proliferasi (media basal) untuk mengidentifikasi peningkatan regulasi aktivator kematian sel yang signifikan secara statistik atau penurunan regulasi inhibitor. Analisis ini mengecualikan mekanisme antiproliferatif yang dipicu oleh peptida B dan W, mendukung keamanannya pada 24 jam, seperti yang dievaluasi menggunakan uji MTT (Gambar 1A, B ). Demikian pula, tidak ada ekspresi diferensial yang diinduksi oleh protein R dan RO yang signifikan secara statistik dalam perbandingan berpasangan terhadap kontrol negatif ( nilai p > 0,05). Sitotoksisitas ringan yang diamati pada 24 jam dalam kondisi ini berpotensi dijelaskan oleh mekanisme alternatif, seperti yang disarankan oleh penambangan data protein biji quinoa dengan sifat sitotoksik (yaitu, RIP, PI, PFT, dan AMP). Sebaliknya, ekspresi diferensial yang signifikan secara statistik diamati untuk peptida R dan RO. Untuk menyelidiki lebih lanjut jalur apoptosis, kelimpahan relatif biomarker apoptosis untuk semua kondisi digunakan untuk membuat peta panas, seperti yang ditunjukkan pada Gambar 5. Perbandingan ini mengidentifikasi lima klade berbeda yang sesuai dengan taxol, medium basal, peptida B/W, protein R/RO, dan peptida R/RO.
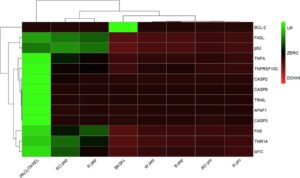
Seperti yang dapat diamati pada Gambar 5 , sampel yang berhubungan dengan protein R/RO dan peptida B/W dikelompokkan di bawah klade atas yang sama dan, pada gilirannya, dengan kondisi basal, karena mereka tidak dapat memicu efek terkait apoptosis apa pun. Sebaliknya, peptida R/RO membentuk klaster terpisah. Peningkatan regulasi yang diamati dari beberapa pemain kunci dalam jaringan apoptosis menunjukkan respons seluler yang menyerupai yang diinduksi oleh paclitaxel. Namun, sulit untuk membandingkan efek seluler yang diinduksi oleh campuran kompleks peptida dengan efek dari senyawa murni seperti paclitaxel, diterpena yang awalnya diisolasi dari kulit kayu Taxus brevifolia (yew Pasifik) [ 37 ] dan banyak digunakan sebagai obat kemoterapi dengan potensi yang terdokumentasi dengan baik [ 38 ]. Bagaimanapun, analisis jalur dilakukan untuk mengetahui hubungan yang wajar antara hasil proteomik fungsional dan yang ditargetkan.
Kami mulai dengan menganalisis profil antiproliferatif yang diinduksi paclitaxel. Beberapa faktor nekrosis tumor dan reseptor ditemukan meningkat dalam sel yang diobati dengan paclitaxel, termasuk faktor nekrosis tumor α (TNFA), reseptor faktor nekrosis tumor 1A (TNR1A), reseptor faktor nekrosis tumor 6 (FAS), dan ligannya (FASL). Selain itu, produk hilir tertentu dari kaskade pensinyalan TNF, seperti kaspase 2-3-8, meningkat secara signifikan ( nilai p < 0,01 dalam semua kasus). Mendukung kontribusi kaspase, faktor pengaktif protease apoptosis-1 (APAF1) juga sangat meningkat dalam sel yang diobati dengan paclitaxel ( nilai p < 0,001). APAF1 adalah molekul kunci dalam jalur apoptosis intrinsik (mitokondria), yang berkontribusi pada perakitan molekuler apoptosom, kompleks multiprotein besar. APAF1 memediasi aktivasi autokatalitik prokaspase-9 (APAF3) yang bergantung pada sitokrom c, sebuah kaspase inisiator yang direkrut dan diaktifkan oleh apoptosom. Aktivasi ini mengarah pada pemrosesan kaspase 3 hilir [ 39 ]. Lebih jauh, keseimbangan antara ekspresi protein proto-onkogen MYC (MYC) dan pengatur apoptosis BCL-2 diamati. BCL-2 diatur naik dalam kondisi basal ( nilai p < 0,001), sementara ekspresi MYC diatur naik dalam sel yang diobati dengan paclitaxel ( nilai p < 0,001). MYC memiliki aksi ganda, terlibat dalam apoptosis dan hiperproliferasi. Ekspresi MYC yang tidak terkendali merupakan ciri khas proliferasi sel yang tidak terkendali yang terkait dengan sebagian besar bentuk kanker [ 40 ]. Tumor belajar untuk mengekspresikan MYC secara berlebihan (melalui amplifikasi atau translokasi gen), menghindari apoptosis yang didorong oleh MYC dan mengaktifkan BCL-2 [ 41 ]. Pada dasarnya, sel kanker menoleransi kadar MYC yang tinggi dengan mengandalkan tindakan prosurvival BCL-2 untuk mengurangi efek apoptotik. Hal ini menunjukkan bahwa dalam kondisi normal, sel Caco-2 menghasilkan kadar BCL-2 yang tinggi untuk mengimbangi ekspresi MYC yang berlebihan, yang menyebabkan hiperproliferasi. Paclitaxel mengganggu keseimbangan ini dengan lebih meningkatkan ekspresi MYC sekaligus mengurangi kadar BCL-2 pada sel yang diobati. Paclitaxel dikenal luas karena menargetkan subunit β tubulin (TUBB1), menghambat pembentukan mikrotubulus selama mitosis. Namun, ia juga secara langsung menargetkan BCL-2 karena kesamaan molekuler antara tempat pengikatan paclitaxel pada BCL-2 dan β-tubulin [ 42 ]. Induksi jalur apoptosis oleh paclitaxel selanjutnya dikonfirmasi oleh peningkatan regulasi biomarker apoptosis tambahan, termasuk antigen tumor seluler p53 (produk hilir dari kaskade apoptosis yang digerakkan oleh MYC), ligan penginduksi apoptosis terkait faktor nekrosis tumor 10 (TRAIL), dan TNFRSF10C. TRAIL memainkan peran penting dalam kematian sel terprogram dan imunosurveilans tumor [ 23]. Secara selektif menginduksi apoptosis pada sel tumor, menjadikannya target yang menarik untuk senyawa antikanker yang bertujuan untuk memodulasi kadarnya [ 43 ]. Namun, sel tumor sering mengembangkan mekanisme resistensi terhadap TRAIL, membatasi potensi klinisnya [ 44 ]. Untuk mengevaluasi strategi tumor untuk mengatasi peningkatan regulasi TRAIL, kami memantau TNFRSF10C, reseptor umpan antagonis yang tidak memiliki domain kematian sitoplasma, membajak induksi apoptosis dengan bersaing dengan reseptor TRAIL-R1 dan R2 untuk pengikatan ligan. Sel Caco-2 yang diobati dengan paclitaxel menunjukkan peningkatan regulasi TRAIL dan reseptor umpan TNFRSF10C ( nilai p < 0,01 dalam kedua kasus). Bukti akhir ini menunjukkan strategi pertahanan yang diadopsi oleh sel tumor untuk menghindari kematian sel, bahkan dengan adanya ekspresi TRAIL yang diinduksi paclitaxel.
Secara keseluruhan, perbandingan berpasangan antara agen kemoterapi yang terkenal (paclitaxel) dan kondisi pertumbuhan normal sel tumor (media basal) memberikan titik referensi yang jelas untuk evaluasi awal efek seluler yang diinduksi oleh peptida R dan RO (Tabel S9 ). Baik peptida R maupun RO meningkatkan ekspresi FASL dan FAS ( nilai p < 0,05). Namun, peptida R menginduksi peningkatan regulasi FAS yang lebih tinggi dibandingkan dengan peptida RO ( nilai p < 0,01). Tanpa diduga, hanya peptida RO yang memicu ekspresi berlebih CASP2 yang signifikan secara statistik relatif terhadap sel dalam media basal ( nilai p < 0,05). Tidak adanya aktivasi kaspase sebagai respons terhadap peptida R dapat menunjukkan respons seluler yang berbeda, yang belum diselidiki. Jalur ligan FAS/FASL tidak secara eksklusif dikaitkan dengan aktivasi kaspase; perannya dalam patologi telah diperluas dengan temuan bahwa peningkatan regulasi reseptor FAS dapat diinduksi oleh lesi seluler dan kerusakan DNA [ 45 ]. Menariknya, peningkatan reseptor FAS tampaknya dimodulasi oleh p53 [ 45 ]. Mendukung hubungan ini, sel yang diobati dengan peptida R dan RO menunjukkan ekspresi berlebih p53 yang signifikan ( nilai p < 0,001), yang menunjukkan korelasi yang wajar antara ekspresi biomarker dan fenotipe yang diamati selama uji proliferasi. Selain peningkatan p53, peptida RO memicu ekspresi berlebih MYC ( nilai p < 0,001), yang menunjukkan mekanisme potensial terkait apoptosis lainnya. Sebaliknya, BCL-2 mengalami penurunan regulasi pada kedua kondisi peptida dibandingkan dengan media basal ( nilai p < 0,001). Oleh karena itu, efek antiproliferatif peptida RO mungkin melibatkan mekanisme gabungan peningkatan regulasi MYC dan penurunan regulasi BCL-2. Peptida R, di sisi lain, tidak menginduksi peningkatan regulasi MYC yang signifikan ( nilai p = 0,09), meskipun nilai p mendekati ambang batas signifikansi ( nilai p ≤ 0,05). Meskipun demikian, penurunan regulasi BCL-2 yang diamati sendiri mungkin masih berkontribusi pada hasil yang serupa. Meskipun tidak ada interaksi molekuler yang ditentukan antara BCL-2 dan peptida R/RO yang dapat diusulkan pada tahap ini, penelitian sebelumnya telah melaporkan gangguan yang dimediasi peptida pada perakitan homo dan heterodimer BCL-2 aktif, sehingga menghalangi aksi antiapoptotiknya [ 46 ]. Interaksi tersebut dapat membuat ekspresi gen tidak seimbang (misalnya, penghambatan umpan balik), yang menyebabkan penurunan regulasi BCL-2. Selain itu, peningkatan regulasi TNFA dan TNR1A diperiksa. Baik peptida R dan RO meningkatkan regulasi TNFA dibandingkan dengan media basal ( nilai p < 0,05). Demikian pula, TNR1A meningkat dengan nilai p < 0,05 untuk peptida R dan pnilai < 0,01 untuk peptida RO. Kaskade kejadian yang kompleks dan beraneka ragam yang diinduksi oleh jalur TNF/TNR1 menghadirkan tantangan signifikan dalam membangun hubungan langsung dengan respons seluler univokal [ 47 ]. Penjelasan sementara adalah aktivasi faktor transkripsi nuklir-κB (NF-κB). Meskipun NF-κB terutama dikenal karena peran antiapoptotiknya, ia juga berinteraksi dengan proses lain yang mengatur keseimbangan hidup-mati, seperti autofagi, nekroptosis, dan inflamasi [ 48 ]. Meskipun kami tidak mengumpulkan data spesifik tentang aktivasi NF-κB, jalur TNF/TNR1 secara masuk akal dapat berkontribusi pada apoptosis dan aktivasi gen proinflamasi, yang mengekspresikan sitokin dan kemokin [ 49 ]. Oleh karena itu, peningkatan jalur pensinyalan TNF/TNFR1 dapat menunjukkan respons biologis terhadap kerusakan seluler, yang menyediakan hubungan potensial antara ekspresi diferensial yang diamati oleh proteomik target LC-MS/MS dan hasil uji fungsional.
Akhirnya, untuk menguatkan korelasi antara penggalian data dan bukti eksperimental, kelompok yang diamati dari peta panas studi biomarker apoptosis (Gambar 5 ) konsisten dengan analisis PLS-DA dari profil protein sitotoksik dari berbagai varietas biji quinoa (Gambar 3 ). Untuk lebih memahami hubungan antara efek seluler dan protein biji quinoa, analisis kemometrik akhir dilakukan.
3.2.3 Korelasi Antara Protein Sitotoksik Varietas Gandum Quinoa, Biomarker Apoptosis, dan Potensi Efek Antiproliferatif
Analisis kemometrik akhir oleh PCA mempertimbangkan intensitas LFQ protein sitotoksik yang diungkapkan oleh penambangan data dan PLS-DA, dengan skor VIP lebih besar dari 1 dan LV1 dan LV2 positif (yang paling relevan untuk klasifikasi R/RO), bersama dengan kelimpahan relatif biomarker apoptosis yang secara signifikan berbeda dibandingkan dengan kontrol negatif (medium basal) dalam kondisi peptida R dan RO (proapoptotik) (Tabel S10 ). Gambar 6 menunjukkan biplot PCA dan matriks korelasi Pearson.
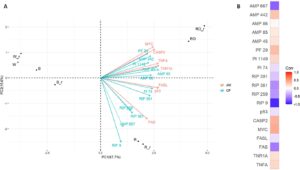
PCA mengonfirmasi hasil kami sebelumnya dan memberikan wawasan tambahan. Seperti yang diharapkan, biji quinoa R/RO keduanya terletak pada nilai positif PC1, berbeda dengan B dan W, yang kelimpahan relatif protein sitotoksik dan ekspresi diferensial biomarker apoptosisnya sangat berbeda dari kelas R/RO. Selain konfirmasi ini, pemisahan yang jelas diamati sepanjang PC2, yang menunjukkan perbedaan pada tingkat protein sitotoksik dan biomarker apoptosis. Untuk memfasilitasi interpretasi data, matriks korelasi Pearson digunakan. Untuk nilai positif PC2 (domain RO), korelasi positif diamati antara kelimpahan relatif beberapa AMP, PFT, dan protein sitotoksik PI dan peningkatan biomarker apoptosis seperti TNFA, CASP2, MYC, dan TNR1A. Sebaliknya, untuk nilai negatif PC2 (domain R), kelimpahan relatif AMP dan beberapa RIP terutama berkorelasi dengan peningkatan FAS. Analisis data ini menunjukkan bahwa perbedaan dalam profil protein sitotoksik dapat mengakibatkan efek seluler in vitro serupa yang disebabkan oleh mekanisme berbeda, sehingga menjadi dasar untuk penyelidikan lebih lanjut. Misalnya, mengisolasi dan menguji protein sitotoksik yang teridentifikasi atau fraksi yang diperkaya secara langsung pada sel Caco-2 tidak hanya dapat memvalidasi efek terkait apoptosisnya tetapi juga memberikan pemahaman yang lebih baik tentang mekanisme molekuler yang terlibat.
4 Penutup
Studi ini menunjukkan potensi protein dan peptida yang berasal dari varietas biji quinoa, khususnya R dan RO, untuk menginduksi apoptosis pada sel CRC (Caco-2). Dengan menggunakan pendekatan terpadu yang menggabungkan uji fungsional, proteomik LC-MS/MS, penggalian data, dan analisis data multivariat, kami mengidentifikasi protein sitotoksik tertentu, termasuk AMP, RIP, PFT, dan PI, sebagai kontributor utama terhadap efek proapoptotik yang diamati. Pengelompokan varietas R dan RO berdasarkan profil protein sitotoksiknya, bersama dengan peningkatan regulasi biomarker apoptosis yang signifikan, memberikan bukti kuat bahwa protein dan peptida dari varietas biji quinoa ini menjanjikan sebagai agen antikanker yang potensial. Lebih jauh, studi ini menggarisbawahi kegunaan pendekatan berbasis data dan pengetahuan untuk menghasilkan hipotesis yang kuat dan terdefinisi dengan baik tentang bioaktivitas campuran alami yang kompleks, sehingga memfasilitasi pengembangan makanan fungsional dan nutraseutika di masa mendatang dengan sifat-sifat yang meningkatkan kesehatan. Namun, pekerjaan ini bukannya tanpa keterbatasan. Hal ini bergantung pada model in vitro, yang, meskipun informatif dan kompatibel dengan model 3D canggih (kolonoid), tidak sepenuhnya mereplikasi kompleksitas CRC in vivo. Selain itu, meskipun analisis eksploratori memberikan wawasan berharga, mekanisme spesifik yang menyebabkan apoptosis oleh protein dan peptida ini perlu diselidiki dan divalidasi lebih lanjut melalui eksperimen pelengkap.

