ABSTRAK
Stres kekeringan mengubah metabolisme, fisiologi, dan pertumbuhan tanaman, dan respons tersebut mungkin berbeda dengan intensitas stres. Kami mengevaluasi keragaman genotipe dalam morfologi tanaman, respons fotosintesis, pergeseran metabolit, dan hubungan mereka dalam 23 inbrida barley yang beragam secara genetik di bawah kontrol, kekeringan (DD), dan stres kekeringan sedang (MD). DD memicu penghambatan kuat kesehatan fotosintesis, sementara mengurangi ukuran tanaman adalah strategi utama di bawah stres MD. Kami mengamati bahwa perubahan yang diinduksi di bawah kedua skenario stres terjadi dalam cara yang bergantung pada genotipe. Dibandingkan dengan kondisi kontrol, metabolisme gula sederhana dan asam polihidroksi meningkat pada MD dan DD, sementara akumulasi maksimum asam amino, lipid, dan fosfat terjadi pada stres DD. Akumulasi gula dan metabolit dengan klasifikasi yang tidak diketahui adalah tanda metabolik inbrida yang toleran kekeringan. Meskipun demikian, akumulasi sejumlah besar metabolit, termasuk lipid, asam polihidroksi, dan asam amino dalam tanaman inbrida tidak memiliki efek positif pada toleransi kekeringan dan mungkin mahal secara metabolik. Toleransi tanaman inbrida terhadap MD dan DD berasal dari daerah semi-kering atau sub-tropis, sementara tanaman inbrida yang sensitif terhadap kekeringan terutama berasal dari daerah beriklim sedang. Kepadatan stomata yang rendah, berkurangnya kehilangan air, dan pertumbuhan yang terhambat di bawah tekanan kekeringan adalah ciri-ciri utama tanaman inbrida dengan kapasitas bertahan hidup yang lebih baik di bawah dehidrasi parah. Kami mengidentifikasi tanaman inbrida barley yang toleran kekeringan, dan penelitian kami menawarkan sumber daya untuk penelitian genetik masa depan tentang berbagai strategi toleransi kekeringan.
1 Pendahuluan
Kekeringan pertanian adalah periode selama musim tanam ketika curah hujan dan kelembapan tanah tidak dapat memenuhi permintaan evapotranspirasi tanaman untuk mempertahankan pertumbuhan dan produksi yang optimal (Trenberth et al. 2013 ). Periode kering jangka pendek dan berkepanjangan telah terjadi dalam beberapa kejadian historis, yang terutama terkait dengan fluktuasi suhu laut tropis (Wang, Li, Lai, et al. 2018 ). Namun, perubahan suhu global karena emisi gas rumah kaca dan perubahan penggunaan lahan merupakan pendorong utama peningkatan frekuensi dan intensitas kejadian kekeringan dalam dua dekade terakhir, yang menyebabkan kerusakan tanaman yang parah dan kerugian ekonomi (Hari et al. 2020 ).
Stres air akut tidak terjadi secara tiba-tiba di alam (Verslues et al. 2023 ). Biasanya, stres kekeringan ringan selama tahap awal stres. Pada tahap selanjutnya, tanaman mengalami stres dehidrasi ketika kadar air di lapisan tanah atas sangat berkurang (Verslues et al. 2023 ), yang menyebabkan layu parah (Izanloo et al. 2008 ). Selain itu, intensitas stres kekeringan mungkin bervariasi menurut lokasi geografis. Misalnya, tingkat keterbatasan air di wilayah beriklim sedang biasanya ringan. Di wilayah ini, stres sedang jarang mengakibatkan kematian tanaman; sebaliknya, stres ini membatasi pertumbuhan dan produksi biomassa (Skirycz et al. 2011 ). Namun, dalam literatur ilmiah, stres kekeringan dinilai terutama dalam skenario kekeringan parah, yang dalam teks berikut disebut sebagai stres dry down (DD), dengan menghentikan pasokan air dan menilai kelangsungan hidup (Skirycz et al. 2011 ; Verslues et al. 2023 ). Kelangsungan hidup yang tinggi saat stres kekeringan terkait dengan strategi konservasi air, yang dapat menyebabkan penurunan pertumbuhan saat stres kekeringan sedang (MD) (Skirycz et al. 2011 ).
Penyesuaian morfologi dan fisiologi selama stres kekeringan bervariasi sesuai dengan intensitas kekeringan (Kooyers 2015 ). Jika laju transpirasi melebihi penyerapan air, respons awal sebagian besar tanaman adalah menghindari kehilangan air dengan menutup stomata (Daszkowska-Golec dan Szarejko 2013 ). Selain itu, stres kekeringan menginduksi produksi spesies oksigen reaktif, yang merusak makromolekul dan peralatan fotosintesis (Shrestha, Fendel, et al. 2022 ; Vendruscolo et al. 2007 ). Sebagian besar studi kekeringan yang tersedia yang melibatkan beberapa genotipe menilai perubahan morfologi tanaman dan kehijauan daun, sedangkan variasi genetik parameter fotosintesis biasanya tidak dinilai (Ahmed et al. 2022 ; Ed-Daoudy et al. 2024 ; Sallam et al. 2015 ; Siddiqui et al. 2024 ; Slawin et al. 2024 ; Tarawneh et al. 2020 ).
Selain perubahan dalam pertumbuhan tanaman dan parameter fotosintesis, stres kekeringan mengubah metabolisme tanaman (Templer et al. 2017 ). Akumulasi gula terlarut dan asam amino merupakan respons umum spesies tanaman, dan perubahan tersebut mungkin memiliki peran osmoprotektif di bawah stres kekeringan (Lawas et al. 2019 ). Demikian pula, perubahan yang disebabkan kekeringan pada poliol dan asam organik molekul rendah seperti askorbat dengan sifat antioksidan juga dilaporkan untuk barley, gandum, dan beras (Bowne et al. 2012 ; Templer et al. 2017 ; Todaka et al. 2017 ). Penelitian sebelumnya yang menjelaskan perubahan dalam profil metabolit di bawah kekeringan terminal atau stres sedang hanya terdiri dari beberapa genotipe (AbdElgawad et al. 2020 ; Bowne et al. 2012 ; Hochberg et al. 2013 ; Lawas et al. 2019 ; Todaka et al. 2017 ).
Aspek-aspek stres kekeringan yang disebutkan di atas menyebabkan perubahan morfologi, dan fisiologi merupakan topik yang banyak diteliti dalam model tanaman serta tanaman pertanian. Meskipun demikian, studi komprehensif yang secara simultan mengintegrasikan ketiga aspek tersebut pada berbagai genotipe di bawah stres DD dan MD masih langka. Dalam studi saat ini, kami menggunakan barley sebagai model untuk memahami aspek-aspek di atas. Barley merupakan salah satu tanaman utama yang ditanam di seluruh dunia dari dataran tinggi Nepal dan Ethiopia, di dataran tinggi Tibet hingga daerah hangat dan kering di Israel, Yordania, dan Maroko (Badr et al. 2000 ). Oleh karena itu, ia menawarkan sumber daya yang unik untuk mempelajari berbagai stres abiotik, termasuk stres kekeringan (Dawson et al. 2015 ).
Tujuan dari penelitian kami adalah untuk
- mengevaluasi perubahan morfologi tanaman, respon fisiologis, terutama parameter fotosintesis, dan profil metabolit berbagai varietas barley dalam kondisi stres DD dan MD;
- mengidentifikasi keragaman genotipe respon terhadap stres DD dan MD; dan
- memahami hubungan antara pergeseran metabolit, perubahan morfologi, dan fisiologis di bawah stres DD dan MD.
2 Bahan dan Metode
2.1 Bahan Tanaman, Kondisi Pertumbuhan, dan Perlakuan Stres
Kami melakukan eksperimen kekeringan di rumah kaca menggunakan 23 galur murni (Tabel S1 ) yang merupakan bagian dari koleksi 224 galur murni barley musim semi di seluruh dunia (Haseneyer et al. 2010 ). Ke-23 galur murni tersebut mewakili keragaman fenotipik dan genotipik maksimum dari panel keragaman yang disebutkan di atas (Weisweiler et al. 2019 ). Selain itu, ke-23 galur murni tersebut merupakan galur pendiri populasi pemetaan genetik double round robin (Shrestha, Cosenza, et al. 2022 ). Benih dari 23 galur murni barley disemai dalam baki 96 sumur yang diisi dengan campuran pot berbasis gambut. Baki-baki tersebut ditempatkan di ruangan dingin pada suhu 4°C selama 48 jam untuk perkecambahan yang seragam. Kemudian, baki-baki tersebut dipindahkan ke rumah kaca. Kelembaban relatif konstan sebesar 55% dan suhu siang-malam sebesar 20°C/18°C dipertahankan di rumah kaca. Rumah kaca dilengkapi dengan lampu LED untuk mempertahankan intensitas cahaya di atas 200 μmol m −2 s −1 yang diukur pada tingkat tajuk tanaman. Rumah kaca dilengkapi dengan unit peneduh otomatis untuk mencegah kelebihan cahaya alami pada hari-hari cerah. Bibit seragam dipindahkan ke pot 1,5 L 2 hari setelah perkecambahan. Setiap induk inbred menerima tiga tingkat perlakuan: kontrol, MD, dan stres DD. Kami menggunakan tiga ulangan per inbred per perlakuan dalam dua percobaan independen. Setiap perlakuan memiliki lima baki, masing-masing menampung 15 pot. Peluang inbred yang ditugaskan ke baki sepenuhnya diacak. Baki-baki tersebut dikocok melintasi rumah kaca setiap hari kedua untuk menghindari bias karena distribusi dan posisi cahaya. Selama fase pembentukan (hingga 2 minggu setelah penanaman, skala Zadok 13–14), pot disiram untuk mempertahankan kadar air volumetrik (VMC) 30%. Setelah 2 minggu, pot perlakuan kontrol menerima penyiraman secara teratur, dengan mempertahankan VMC 30%. Untuk perlakuan MD, stres air diterapkan dengan menahan penyiraman hingga VMC mencapai 15%. Setelah itu, VMC dalam pot yang terkena MD disiram setiap hari untuk mempertahankan VMC 15%. Perlakuan DD melibatkan pemantauan kadar air di setiap pot untuk mengendalikan laju dehidrasi. Pot dengan VMC di bawah rata-rata yang terkena DD disiram untuk menyeimbangkan variasi kadar air di bawah perlakuan dehidrasi. Butuh waktu 6 hari setelah perlakuan dehidrasi agar kadar air stabil di seluruh pot (7,2% ± 2,4% dalam percobaan 1 dan 9,2% ± 1,8% dalam percobaan 2). Tanaman terus-menerus terpapar stres DD selama 12 hari dan kemudian disiram kembali hingga 30% VMC untuk mengevaluasi potensi pemulihan stresnya. Hasil pembacaan kadar air selama percobaan diberikan pada Gambar S1 .
2.2 Karakterisasi Morfologi dan Fisiologi
Pengukuran non-destruktif dari parameter terkait fotosintesis dilakukan menggunakan multisensor genggam, MultispeQ V2.0 (PhotosynQ Inc., California, AS) (Kuhlgert et al. 2016 ). Hasil fluoresensi dan perubahan absorbansi direkam pada panjang gelombang berkisar dari 450 hingga 950 nm menggunakan protokol yang dirancang pabrik (Photosynthesis RIDES 2.0). Protokol ini memungkinkan kami untuk menentukan beberapa parameter fotosintesis, termasuk hasil fotokimia dalam PS II (Φ II ), hasil kuantum dari disipasi energi yang tidak diatur (Φ NO ), pendinginan non-fotokimia (Φ NPQ ), dan NPQ yang beradaptasi dengan cahaya (NPQ t ). Selain itu, ia memperkirakan indeks yang terkait dengan gaya motif proton (pmf) melintasi membran tilakoid, seperti besarnya pergeseran elektrokromik (ECS t ), fluks proton keadaan tunak (vH + ), dan konduktivitas proton maksimum (gH + ). Protokol juga memperkirakan kandungan klorofil relatif (RC) dan ketebalan daun (LT). Data dicatat dari tengah (memanjang) daun pertama yang berkembang penuh dari atas. Demikian pula, parameter morfologi seperti tinggi tanaman (PH) dan jumlah anakan (TN) dievaluasi selama periode stres. Fotosintesis dan data morfologi dikumpulkan pada 1, 4, dan 7 hari setelah paparan perlakuan DD dan 1, 4, 7, 11, 14, 18, 21, 25, dan 28 hari setelah paparan stres MD.
2.3 Kandungan Air Relatif
Status air daun diperkirakan sebagai kadar air relatif (RWC) menurut (Shrestha, Fendel, et al. 2022 ). Untuk pengukuran RWC, dua lembar bagian daun sekitar 1 cm dipotong dari tengah daun kedua yang telah berkembang penuh pada anakan tertinggi, dan berat segarnya dicatat (FW). Kemudian, bagian daun tersebut ditempatkan dalam tabung sentrifus (Falcon 15 mL) yang diisi dengan 10 mL air deionisasi selama 24 jam pada suhu ruangan. Bagian daun dikeluarkan dari tabung Falcon, dan kelebihan air dilap dengan handuk kertas sebelum mengukur berat turgor (TW). Berat kering dicatat setelah pengeringan oven pada suhu 70°C selama 72 jam. RWC diperkirakan sebagai [(FW−DW)/(TW−DW)]*100.
2.4 Analisis Metabolit
Kami mengumpulkan daun pertama yang berkembang penuh dari atas dari dua anakan tertinggi dari setiap tanaman. Sampel dibekukan sekejap dalam nitrogen cair. Sampel beku disimpan pada suhu -80°C sebelum diproses lebih lanjut. Pengambilan sampel daun dilakukan 7 dan 12 hari setelah dimulainya DD (VMC 5,3% ± 1,8% dalam percobaan 1 dan 6,8% ± 1,1% dalam percobaan 2) dan stres MD (VMC 12,5% ± 2,4% dalam percobaan 1 dan 13,7% ± 2,7% dalam percobaan 2), masing-masing. Karena alasan teknis, kami mengumpulkan sampel dari tanaman dalam kondisi terkendali, 7 dan 12 hari setelah dimulainya perlakuan stres. Oleh karena itu, kami memiliki enam kelompok independen per inbred untuk pembuatan profil metabolit dalam kondisi air yang baik, menghasilkan 414 sampel di ketiga perlakuan. Metabolit diekstraksi dari 25 mg bahan daun yang dihomogenisasi menggunakan campuran air:metanol:kloroform (1:2,5:1 v/v/v) seperti yang dijelaskan dalam (Fiehn et al. 2000 ). Profil metabolit dari setiap sampel dilakukan dengan mengikuti kromatografi gas yang digabungkan dengan spektrometri massa (5977B GC/MSD dari Agilent Technologies) menggunakan protokol derivatisasi seperti yang dijelaskan sebelumnya oleh (Gu et al. 2012 ) dan parameter instrumen yang dijelaskan dalam Shim et al. ( 2019 ). Spektrum massa dianotasi menggunakan pustaka spektrum massa Golm Metabolome Database (Kopka et al. 2005 ) dan kuantifikasi relatif seperti yang disebutkan dalam (Wu et al. 2022 ).
2.5 Pengolahan Data dan Analisis Statistik
Karena waktu dalam sehari dapat memengaruhi proses yang berhubungan dengan fotosintesis, awal dan akhir pengukuran dibagi menjadi jendela waktu konstan selama 30 menit. Misalnya, data yang dikumpulkan antara pukul 8:00 dan 8:30 dikelompokkan ke dalam jendela waktu satu, dan setiap setengah jam progresif dikelompokkan ke dalam interval waktu berikutnya. Oleh karena itu, untuk semua parameter fotosintesis, efek karena pengulangan eksperimen, jendela waktu, dan baki dapat disesuaikan. Lebih jauh lagi, intensitas cahaya yang diukur sebagai radiasi aktif fotosintesis (PAR) menunjukkan korelasi linier yang signifikan dengan parameter efisiensi fotosintesis yang diturunkan (Gambar S2 ). Oleh karena itu, efek intensitas cahaya disesuaikan menggunakan PAR sebagai kovariat aditif dalam model linier untuk memperkirakan rata-rata entri yang disesuaikan dari parameter fotosintesis (Gao et al. 2024 ). Uji signifikansi statistik, estimasi pengulangan, dan rata-rata entri yang disesuaikan (AEM) dihitung dari data yang dikumpulkan dari kontrol dan stres MD 1 hingga 28 hari bersama-sama. Hal yang sama berlaku untuk data yang dikumpulkan dari 1 hingga 7 hari dari kontrol dan stres DD. Untuk parameter fotosintesis, analisis varians (ANOVA) dilakukan menggunakan model berikut dua kali: (i) kontrol dan MD, dan (ii) kontrol dan DD secara bersamaan:

Kami menghitung AEM untuk parameter morfologi menggunakan versi modifikasi model 2, di mana kami menghilangkan efek jendela waktu dan PAR dari model. Karena kami melakukan profil metabolit dalam sampel yang dikumpulkan pada satu titik waktu dan satu sampel referensi kontrol dari kondisi yang diairi dengan baik (enam kolam independen dari 7 dan 12 hari setelah dimulainya perawatan stres),
- Analisis statistik untuk data metabolit untuk kontrol, DD, dan MD dilakukan bersama-sama menggunakan model 1 dan
- AEM metabolit inbred pada kondisi perlakuan yang berbeda dihitung menggunakan model 2,
di mana pengaruh hari, jendela waktu, dan PAR dihilangkan dari model.
Selanjutnya, kami memperkirakan pengulangan parameter per perlakuan, di mana genotipe digunakan sebagai variabel acak dalam model 2. Pengulangan dihitung untuk setiap kondisi perlakuan menggunakan rumus berikut:
![]()
di mana V g adalah varians genotipe dan η adalah rata-rata kesalahan standar dari semua pasangan kontras di antara genotipe (Piepho dan Mohring 2007 ). Selanjutnya, kami menginterpretasikan data dalam bentuk indeks respons stres (SRI) yang dihitung sebagai rasio nilai sifat dalam kondisi stres dibagi dengan kondisi kontrol. Kesalahan yang terkait dengan SRI dihitung berdasarkan aturan perambatan kesalahan. Indeks toleransi kekeringan dihitung untuk setiap inbred menggunakan nilai fungsi keanggotaan toleransi kekeringan (MFVD) mengikuti Chen et al. Singkatnya , MFVD diperkirakan menggunakan rumus berikut:

2.6 Evaluasi Kepadatan Stomata
Ke-23 inbred parental ditumbuhkan dalam percobaan ruang pertumbuhan independen selama 2 minggu. Kemudian, kami menyiapkan cetakan epidermis menggunakan cat kuku dari daun kedua yang telah berkembang penuh dari bawah. Cetakan disiapkan dari permukaan adaksial dan abaksial daun pada tiga posisi berbeda di helaian daun: atas, tengah, dan sepertiga bawah, yang berjumlah enam cetakan per daun. Gambar cetakan epidermis diperoleh menggunakan mikroskop stereo Nikon SMZ18 yang dilengkapi dengan kamera Nikon DS-Fi2 pada perbesaran 6x. Ukuran gambar adalah 1020 × 1024 piksel. Jumlah stomata dihitung secara manual menggunakan plugin penghitung sel di ImageJ. Kepadatan stomata (SD) dinyatakan sebagai jumlah stomata mm −2 . Percobaan dilakukan dua kali dengan enam replikasi biologis masing-masing mengikuti rancangan acak lengkap. ANOVA untuk SD dilakukan dengan menggunakan persamaan berikut:

3 Hasil
3.1 Pengaruh Stres Kekeringan terhadap Parameter Morfologi dan Fotosintesis
RWC daun genotipe barley dinilai dalam kondisi DD dan MD pada 7 dan 12 hari setelah dimulainya stres. Kami mengamati efek perlakuan yang signifikan ( p < 0,05) pada RWC saat menganalisis kontrol dan MD bersama-sama serta stres kontrol dan DD bersama-sama (Tabel 1 ). Efek genotipe yang signifikan untuk RWC diamati hanya saat menganalisis kontrol dan MD bersama-sama tetapi tidak di bawah stres DD (Tabel 1 ). Dirata-ratakan di antara 23 induk inbrida, RWC sekitar sepertiga lebih rendah pada stres DD (45%) daripada stres MD (71%), yang menggambarkan stres air yang lebih ringan dalam kondisi stres MD dibandingkan dengan DD (Tabel 1 dan Gambar S3 ). Selanjutnya, kami mengevaluasi beberapa parameter terkait pertumbuhan dan fotosintesis dalam inbrida ini di bawah stres DD dan MD yang disiram dengan baik. Data dikumpulkan hingga 7 dan 28 hari setelah dimulainya stres di bawah stres DD dan MD, masing-masing. Kami mengamati genotipe yang signifikan ( p < 0,001) serta efek perlakuan pada PH, TN, dan LT di bawah tekanan DD dan MD ketika menganalisis kontrol dan tekanan MD bersama-sama serta kontrol dan tekanan DD bersama-sama. Genotipe yang signifikan ( p < 0,05) melalui interaksi perlakuan juga terdeteksi untuk semua parameter terkait pertumbuhan di bawah tekanan MD dan DD (kecuali TN) ketika menganalisis kontrol dan MD bersama-sama serta kontrol dan tekanan DD bersama-sama (Tabel 1 ). Penurunan PH dan TN dibandingkan dengan kondisi kontrol lebih jelas pada MD daripada pada tekanan DD (Tabel 1 , Gambar S4 , dan S5 ). LT juga menurun pada DD dan MD dibandingkan dengan kondisi kontrol (Tabel 1 dan Gambar S6 ). Pengamatan pada semua inbred sangat berulang untuk PH ( h2 dari 0,91 hingga 0,99), TN ( h2 dari 0,79 hingga 0,95), dan LT ( h2 dari 0,85 hingga 0,96) pada kondisi kontrol, stres DD, dan MD (Tabel 2 ).
| Jenis stres | Karakter | Genotipe (G) | Pengobatan (T) | PAR | G:T | T:Rep | T: Nampan | T:DAT | T:Jendela:DAT | AEM_Kontrol | AEM_Stres |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Keringkan | Bagian II | *** | *** | *** | * | * | ** | *** | *** | 0.657 | 0.638 |
| Φ TIDAK | *** | *** | *** | * | *** | tidak ada | *** | *** | 0.193 | 0.188 | |
| Φ NPQ | *** | *** | *** | ** | *** | tidak ada | *** | *** | 0,149 | 0.173 | |
| NPQ untuk | *** | *** | *** | * | *** | tidak ada | *** | *** | 0,777 tahun | 0,937 tahun | |
| ECST (Elektroforesis) | *** | *** | *** | *** | *** | tidak ada | *** | ** | 0,00035 | 0,00043 | |
| gH + | *** | *** | *** | tidak ada | ** | tidak ada | *** | ** | 216 | 174 | |
| vH + | *** | *** | *** | tidak ada | *** | * | *** | *** | 0,0742 tahun | 0,071 tahun | |
| Bahasa Indonesia: RC | *** | *** | tidak ada | *** | *** | *** | *** | *** | 61.5 | 60.2 | |
| Liga Balap Mobil | Tidak ada | *** | Bahasa Indonesia | * | tidak ada | ** | Bahasa Indonesia | Bahasa Indonesia | 87.5 | 44.6 | |
| Ketebalan daun (μm) | *** | *** | Bahasa Indonesia | *** | *** | * | *** | Bahasa Indonesia | 0.833 | 0.703 | |
| Tinggi tanaman (cm) | *** | *** | Bahasa Indonesia | *** | *** | *** | *** | Bahasa Indonesia | 49.4 | 45.1 | |
| Nomor kemudi | *** | *** | Bahasa Indonesia | tidak ada | *** | *** | *** | Bahasa Indonesia | 3.3 | 2.95 | |
| Kekeringan sedang | Bagian II | *** | *** | *** | ** | * | tidak ada | *** | *** | 0.645 | 0.624 |
| Φ TIDAK | *** | *** | *** | tidak ada | tidak ada | *** | *** | *** | 0.189 | 0.180 | |
| Φ NPQ | *** | *** | *** | * | * | * | *** | *** | 0,165 | 0.194 | |
| NPQ untuk | *** | *** | *** | * | *** | tidak ada | *** | *** | 0,888 | 1.094 | |
| ECST (Elektroforesis) | *** | *** | *** | tidak ada | tidak ada | tidak ada | *** | *** | 0,00036 | 0,00041 | |
| gH + | *** | *** | *** | tidak ada | *** | tidak ada | *** | *** | 206 | 194 | |
| vH + | *** | *** | *** | ** | *** | ** | *** | *** | 0,0661 tahun | 0,06 | |
| Bahasa Indonesia: RC | *** | tidak ada | *** | *** | *** | tidak ada | *** | *** | 63.5 | 63.5 | |
| Liga Balap Mobil | *** | *** | Bahasa Indonesia | ** | *** | *** | Bahasa Indonesia | Bahasa Indonesia | 88.3 | 71.8 | |
| Ketebalan daun (μm) | *** | *** | Bahasa Indonesia | * | * | tidak ada | *** | Bahasa Indonesia | 0.604 | 0.513 | |
| Tinggi tanaman (cm) | *** | *** | Bahasa Indonesia | *** | *** | *** | *** | Bahasa Indonesia | 61.33 | 50.52 | |
| Nomor kemudi | *** | *** | Bahasa Indonesia | *** | *** | *** | *** | Bahasa Indonesia | 8.37 | 5.57 |
Catatan: Faktor percobaan meliputi genotipe (G), perlakuan (T), dua percobaan independen (Rep), nampan untuk menata pot (Nampan), hari setelah dimulainya perlakuan stres kekeringan (DAT) dan jendela waktu dalam hari pengukuran (Jendela). Radiasi aktif fotosintesis (PAR) dipasang sebagai kovariabel aditif dalam model linier untuk parameter fotosintesis. Tanda bintang menunjukkan tingkat signifikansi (*** p ≤ 0,001; ** p ≤ 0,01; * p ≤ 0,05; dan ns p > 0,05). Singkatan: Φ II , hasil kuantum dari fotosistem II; Φ NO , hasil kuantum dari disipasi energi non-regulasi; Φ NPQ , pemadaman non-fotokimia dari fluoresensi klorofil dalam fotosistem II; ECS t , besarnya pergeseran elektrokromik; gH + , konduktivitas proton; NA, tidak berlaku; NPQ t , indeks adaptasi cahaya NPQ; RC, indeks klorofil relatif; RWC, kandungan air relatif; vH + , fluks proton kondisi tetap.
| Jenis stres | Sifat | Kontrol | Menekankan |
|---|---|---|---|
| Keringkan | Bagian II | 0.42 | 0.69 |
| Φ TIDAK | 0,59 | 0.52 | |
| Φ NPQ | 0,15 | 0,65 | |
| NPQ untuk | 0.24 | 0,59 | |
| ECS untuk | 0,80 | 0.86 | |
| gH + | 0.63 | 0,70 | |
| vH + | 0.67 | 0.82 | |
| Kandungan air relatif (%) | 0.34 | 0.31 | |
| Indeks klorofil relatif | 0.84 | 0,80 | |
| Ketebalan daun (μm) | 0,94 | 0,85 | |
| Tinggi tanaman (cm) | 0,95 | 0.92 | |
| Nomor kemudi | 0,79 | 0,85 | |
| Kekeringan sedang | Bagian II | 0.61 | 0.71 |
| Φ TIDAK | 0,78 | 0.72 | |
| Φ NPQ | 0,55 | 0.69 | |
| NPQ untuk | 0,59 | 0.67 | |
| ECS untuk | 0,91 | 0.84 | |
| gH + | 0.42 | 0.61 | |
| vH + | 0,90 | 0,88 | |
| Kandungan air relatif (%) | 0.13 | 0,58 | |
| Indeks klorofil relatif | 0,94 | 0,88 | |
| Ketebalan daun (μm) | 0,96 | 0,95 | |
| Tinggi tanaman (cm) | 0,98 | 0,99 | |
| Nomor kemudi | 0,95 | 0,95 |
Catatan: Untuk perlakuan pengeringan, pot mengalami dehidrasi terkendali, dan data dikumpulkan 1, 4, dan 7 hari setelah dimulainya perlakuan stres kekeringan. Untuk stres kekeringan sedang, tanaman ditanam pada kadar air volumetrik konstan sebesar 15% dan data dikumpulkan 1, 4, 7, 11, 14, 18, 21, 25, dan 28 hari setelah paparan stres MD. Percobaan diulang dua kali dengan tiga replikasi biologis independen per genotipe. Pengulangan parameter yang dievaluasi diperkirakan di seluruh titik waktu dan dua percobaan independen. Singkatan: Φ II , hasil kuantum dari fotosistem II; Φ NO , hasil kuantum dari disipasi energi non-regulasi; Φ NPQ , pemadaman non-fotokimia dari fluoresensi klorofil dalam fotosistem II; ECS t , besarnya pergeseran elektrokromik; gH + , konduktivitas proton; NPQ t , indeks adaptasi cahaya NPQ; vH + , fluks proton kondisi tetap.
Varians genotipe dan pengaruh perlakuan stres kekeringan juga signifikan secara statistik ( p < 0,001) untuk semua parameter fotosintesis (Ecs t , gH + , vH + , Φ II , Φ NO , Φ NPQ , dan NPQ t ) dan RC yang diukur menggunakan MultispeQ ketika menganalisis kontrol dan MD bersama-sama serta kontrol dan stres DD bersama-sama (Tabel 1 ). Genotipe yang signifikan ( p < 0,05 hingga 0,001) melalui interaksi perlakuan diamati untuk vH + , Φ II , Φ NO , Φ NPQ , NPQ t , dan RC ketika kontrol dan MD dianalisis bersama-sama dan untuk Ecs t , Φ II , Φ NO , Φ NPQ , NPQ t , dan RC ketika kontrol dan DD dianalisis bersama-sama (Tabel 1 ). Kami tidak mengamati efek perlakuan pada RC di bawah tekanan MD, dan indeks RC sama antara kondisi MD dan kontrol (Tabel 1 dan Gambar S7 ). h 2 tertinggi untuk RC dibandingkan dengan gH + , vH + , Φ II , Φ NO , Φ NPQ , dan NPQ t di semua kondisi pertumbuhan. Ada perbedaan minimal dalam h 2 parameter fotosintesis antara kontrol dan MD, sedangkan perbedaan h 2 antara kontrol dan DD sangat tinggi, terutama untuk Φ II , Φ NO , Φ NPQ , dan NPQ t (Tabel 2 ). Salah satu alasan untuk temuan ini adalah bahwa jumlah pengamatan dari tanaman tiga kali lipat lebih tinggi dalam kumpulan data kontrol yang digunakan dalam MD (sembilan pengamatan) daripada DD (tiga pengamatan) karena durasi percobaan yang lebih pendek pada yang pertama. Kesimpulannya, nilai fenotip gH + , Φ II , dan Φ NO menurun di bawah DD dan MD dibandingkan dengan kondisi kontrol, sementara vH + , Ecs t , Φ NPQ , dan NPQ t meningkat di bawah kedua tekanan (Gambar S8–S14 ). Namun, dibandingkan dengan kumpulan data kontrol, penurunan Φ NO lebih jelas pada tekanan MD (−5%) daripada tekanan DD (−2%) berdasarkan rata-rata awal. Hal yang sebaliknya berlaku untuk NPQ t, yang rata-rata meningkat sebesar 20% dan 23% pada kondisi DD dan MD dibandingkan dengan kondisi kontrol, masing-masing (Tabel 1 dan Gambar S9–S11 ).
3.2 Respon Spesifik Genotipe terhadap Stres Kekeringan dan Kekeringan Sedang
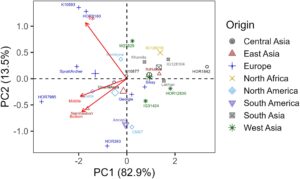
Pertama, kami melakukan analisis komponen utama (PCA) berdasarkan rata-rata entri yang disesuaikan dari tiga perlakuan secara terpisah. Inbrida yang berasal dari Eropa mengelompok bersama, sementara yang berasal dari Asia Selatan, Asia Barat, dan Afrika Utara mengelompok bersama dalam kondisi kontrol (Gambar S15A ). Demikian pula, inbrida dari Asia Timur dan Lakhan (dari Asia Selatan) dan yang berasal dari Amerika membentuk kelompok terpisah (Gambar S15A ). Kelompok genotipe di bawah tekanan kekeringan sedang mirip dengan kondisi kontrol, tetapi outlier diamati, seperti SprattArcher dan UnumliArpa (Gambar S15C ). Pengelompokan inbrida yang dijelaskan sebelumnya menurut asal geografisnya terganggu di bawah tekanan kekeringan (Gambar S15B ).
Pada langkah kedua, kami menghitung indeks respons yang diinduksi stres (SRI) untuk setiap inbred sebagai rasio rata-rata entri yang disesuaikan di bawah kondisi stres dibagi dengan kondisi kontrol. Oleh karena itu, SRI yang mendekati satu menunjukkan perubahan yang rendah hingga tidak ada karena stres, yang merupakan kasus untuk PH, TN, LT, RWC, RC, gH, + dan Φ II , sementara nilai SRI yang lebih rendah menunjukkan respons yang kuat terhadap stres DD dan MD. Karena Ecs t , vH + , NPQ t , dan Φ NPQ meningkat di bawah kekeringan, SRI lebih tinggi dari 1 untuk sifat-sifat tersebut, dan inbred dengan nilai yang lebih tinggi sesuai dengan yang memiliki respons lebih besar terhadap stres (Gambar 1 ). Untuk mendapatkan gambaran umum tentang respons terhadap stres kekeringan, kami melakukan analisis komponen utama (PCA) menggunakan SRI dari semua sifat yang dievaluasi. SRI parameter terkait PSII merupakan kontributor utama komponen utama 1 (PC1) dan SRI RWC serta sifat morfologi merupakan kontributor utama PC2 di bawah tekanan DD. SRI parameter terkait Φ NO dan pmf berkontribusi pada PC1 dan PC2 di bawah tekanan DD (Gambar S16A ). Sebaliknya, baik PSII (kecuali Φ NO hanya berkontribusi pada PC1) maupun parameter terkait pmf (kecuali gH + hanya berkontribusi pada PC1) berkontribusi pada variasi yang dijelaskan oleh PC1 dan PC2 di bawah MD (Gambar S16B ).

Berikutnya, kami menghitung skor MFVD ( U ij ) untuk setiap sifat dan inbred menggunakan SRI. Inbred dengan U ij mendekati 1 atau 0 menunjukkan respons yang sangat toleran atau sangat sensitif, masing-masing, untuk sifat tertentu. Dengan pengecualian Φ NO dan vH + , tiga inbred (Namhaebori, Lakhan, dan UnumliArpa) secara konsisten memiliki nilai U ij yang tinggi di bawah tekanan DD dibandingkan dengan inbred lainnya. Di sisi lain, ItuNative, Sissy, HOR7985, dan Sanalta memiliki nilai U ij yang tinggi untuk sifat fotosintesis tetapi nilai U ij yang rendah untuk sifat terkait pertumbuhan. K10693 memiliki nilai U ij yang rendah , dengan skor U ij terendah untuk lima sifat tetapi nilai U ij yang lebih tinggi untuk Φ NO (tertinggi kedua) dibandingkan dengan inbred lainnya (Gambar 2A ). HOR12830, Ancap2, dan IG31424 memiliki skor U ij rendah hingga menengah (Gambar 2A ). Mirip dengan stres DD, kami juga mendeteksi perbedaan genotipe untuk skor U ij di antara inbred di bawah stres MD. Misalnya, Kombyne, HOR8160, dan Sanalta memiliki skor rendah atau menengah untuk sifat fotosintesis dan morfologi (Gambar 2B ). Meskipun SprattArcher memiliki nilai U ij tertinggi untuk vH + di bawah MD, ia tampil agak buruk untuk parameter yang tersisa. UnumliArpa, ItuNative, HOR7985, IG128216, dan Kharsila adalah inbred yang berkinerja lebih baik dengan skor U ij yang lebih tinggi untuk beberapa parameter di bawah stres MD (Gambar 2B ).
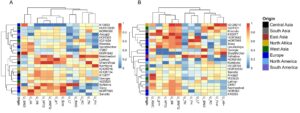
Akhirnya, kami menghitung MFVD untuk setiap inbred di 12 sifat untuk memperkirakan toleransi kekeringan dan sensitivitas inbred. Berdasarkan skor MFVD, 23 inbred dapat ditugaskan ke tujuh kelompok (Tabel 3 ). Kelompok A terdiri dari K10693, Ancap2, HOR12830, CM67, HOR383, dan IG31424, yang sangat sensitif atau sensitif terhadap DD tetapi cukup toleran terhadap stres MD. HOR8160 adalah satu-satunya inbred dalam kelompok B yang sensitif terhadap stres MD dan DD. Kombyne, SprattArcher, dan Sanalta termasuk dalam kelompok C, yang sangat sensitif atau sensitif terhadap MD tetapi cukup toleran terhadap stres DD. Genotipe dalam kelompok A, B, dan C terutama berasal dari Eropa, Amerika Utara, Amerika Selatan, dan Asia Barat. Asal geografis kelompok D terbesar dengan delapan inbred (cukup toleran terhadap DD dan MD) berkisar dari wilayah beriklim sedang (Eropa) hingga subtropis (Tabel 3 ). Berikutnya, kami mengidentifikasi bahwa semua inbred yang toleran terhadap DD juga toleran atau cukup toleran terhadap stres MD dan sebaliknya. Misalnya, Namhaebori dan Lakhan, yang digabungkan dalam kelompok E, toleran atau sangat toleran terhadap DD dan cukup toleran terhadap stres MD. Inbred kelompok F toleran terhadap MD sementara UnumilArpa (kelompok G) toleran terhadap DD dan MD (Tabel 3 ). Semua inbred kelompok E hingga G berasal dari wilayah semi-kering atau lebih hangat di Asia Selatan, Afrika, Asia Timur, dan Asia Tengah. Meskipun demikian, dua inbred barley, HOR12830 dan IG31424 (kelompok A) yang berasal dari iklim Mediterania di Asia Barat, sensitif terhadap DD (Tabel 3 ).
| Bawaan | U_DD | Respon_DD | U_MD | Respon_MD | Kelompok | SD | Pemulihan | Asal |
|---|---|---|---|---|---|---|---|---|
| K10693 | 0.27 | Sangat sensitif | 0.51 | Cukup toleran | A | Tinggi | Rendah | Eropa |
| HOR12830 | 0,35 | Peka | 0.49 | Cukup toleran | A | Rendah | Tinggi | Asia Barat |
| IG31424 | 0.37 | Peka | 0.57 | Cukup toleran | A | Rendah | Tinggi | Asia Barat |
| Ancap2 | 0,35 | Peka | 0.51 | Cukup toleran | A | Tinggi | Tinggi | Amerika Selatan |
| CM67 | 0.41 | Peka | 0,55 | Cukup toleran | A | Pertengahan | Pertengahan | Amerika Utara |
| HOR383 | 0.41 | Peka | 0.52 | Cukup toleran | A | Tinggi | Pertengahan | Eropa |
| HOR8160 | 0.42 | Peka | 0.33 | Sangat sensitif | B | Tinggi | Pertengahan | Eropa |
| Kombyne | 0.52 | Cukup toleran | 0.33 | Sangat sensitif | C | Tinggi | Tinggi | Amerika Utara |
| Pemanah Spratt | 0.47 | Cukup toleran | 0.37 | Peka | C | Tinggi | Rendah | Eropa |
| Sanalta | 0.53 | Cukup toleran | 0.41 | Peka | C | Tinggi | Tinggi | Amerika Utara |
| Georgie | 0,55 | Cukup toleran | 0.42 | Cukup toleran | D | Pertengahan | Rendah | Eropa |
| Banci | 0,58 | Cukup toleran | 0.48 | Cukup toleran | D | Rendah | Pertengahan | Eropa |
| HOR7985 | 0.54 | Cukup toleran | 0,58 | Cukup toleran | D | Tinggi | Pertengahan | Eropa |
| HOR1842 | 0.49 | Cukup toleran | 0.56 | Cukup toleran | D | Rendah | Pertengahan | Asia Tengah |
| Nomor 10877 | 0,59 | Cukup toleran | 0,58 | Cukup toleran | D | Pertengahan | Rendah | Asia Tengah |
| ItuAsli | 0.57 | Cukup toleran | 0.57 | Cukup toleran | D | Rendah | Pertengahan | Asia Timur |
| W23829 | 0.46 | Cukup toleran | 0,55 | Cukup toleran | D | Pertengahan | Pertengahan | Asia Barat |
| IG128104 | 0.54 | Cukup toleran | 0.44 | Cukup toleran | D | Rendah | Tinggi | Asia Selatan |
| Namhaebori | 0,70 | Sangat toleran | 0.52 | Cukup toleran | Bahasa Inggris | Tinggi | Rendah | Asia Timur |
| Lakhan | 0.63 | Toleran | 0.48 | Cukup toleran | Bahasa Inggris | Rendah | Tinggi | Asia Selatan |
| Kharsila | 0.47 | Cukup toleran | 0,59 | Toleran | F | Rendah | Tinggi | Asia Selatan |
| IG128216 | 0.52 | Cukup toleran | 0.61 | Toleran | F | Rendah | Tinggi | Afrika |
| UnumliArpa | 0.67 | Toleran | 0,59 | Toleran | G | Tinggi | Rendah | Asia Tengah |
Catatan: U_DD dan U_MD adalah nilai fungsi keanggotaan rata-rata toleransi kekeringan di semua sifat yang dievaluasi untuk setiap inbred di bawah tekanan kekeringan dan kekeringan sedang. Inbred dikategorikan sebagai kepadatan stomata (SD) dan jumlah pemulihan setelah stres dehidrasi yang tinggi, sedang, atau rendah jika rata-rata entri yang disesuaikan (AEM) dari sifat-sifat tersebut untuk inbred lebih besar dari, sama dengan, atau kurang dari nilai median AEM yang diperkirakan di 23 inbred.
3.3 Profil Metabolit pada Kondisi Stres Kekeringan
Kami membuat profil metabolit di bawah ketiga kondisi lingkungan menggunakan pendekatan metabolomik tak bertarget. Pengumpulan sampel untuk pembuatan profil metabolit dilakukan pada satu hari dengan satu kelompok kontrol referensi, yang merupakan enam kelompok independen untuk setiap inbred dari 7 dan 12 hari setelah dimulainya perlakuan stres dan dengan demikian berbeda dari prosedur yang dijelaskan sebelumnya untuk parameter morfologi dan fisiologi. Dari percobaan ini, kami memperoleh kuantifikasi relatif dari 42 metabolit yang secara luas dapat diklasifikasikan menjadi asam amino, asam organik berat molekul rendah, gula, asam polihidroksi, dan turunan asam lemak (Gambar 3 ). Kami mengamati perbedaan genotipe yang signifikan ( p < 0,05–0,001) untuk semua metabolit. Efek interaksi perlakuan dan genotipe melalui perlakuan yang signifikan ( p < 0,05–0,001) terdeteksi untuk hampir semua metabolit (Tabel S3 ). Untuk lebih dari dua pertiga metabolit, pengulangan lebih tinggi dari 47% (Kontrol), 37% (DD) dan 50% (MD) (Tabel S4 ).
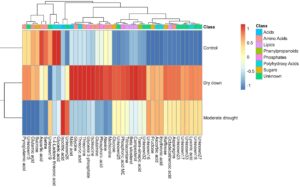
Pola akumulasi metabolit dalam kondisi kontrol dikelompokkan secara terpisah dari stres kekeringan (DD dan MD). DD dan MD menunjukkan respons yang tumpang tindih serta berbeda untuk tujuh jenis metabolit primer yang berbeda (Gambar 3 ). Asam amino dan asam organik berat molekul rendah sangat melimpah pada DD dibandingkan dengan kondisi MD dan kontrol. Kecuali sukrosa, gula seperti glukosa, fruktosa, dan rafinosa menunjukkan akumulasi yang lebih tinggi pada DD dan MD dibandingkan dengan kondisi kontrol. Mayoritas metabolit yang tidak diketahui (enam dari sembilan) berperilaku serupa dengan gula dengan kelimpahan yang lebih tinggi pada stres DD dan MD dibandingkan dengan kondisi kontrol. Sebaliknya, turunan asam lemak sangat melimpah pada DD, diikuti oleh MD dan kurang melimpah pada kondisi kontrol (Gambar 3 ).
Pengelompokan metabolit yang diperkaya di bawah DD mengungkapkan empat kelompok berbeda (Gambar 4A ). Yang pertama adalah tipe Lakhan, yang menunjukkan kelimpahan monosakarida (glukosa dan fruktosa), asam askorbat, dan unknown33 yang lebih tinggi dibandingkan dengan inbred lainnya. Kelompok kedua adalah tipe UnumliArpa, di mana kami mengamati SRI yang lebih tinggi untuk semua metabolit di bawah DD dibandingkan dengan kelompok inbred lainnya. W23829 adalah kelompok ketiga yang memiliki SRI yang lebih tinggi untuk metabolit kecuali glukosa dan fruktosa (Gambar 4A ). Sekelompok besar 10 inbred dengan SRI rendah hingga sedang untuk semua metabolit membentuk kelompok keempat (Gambar 4A ). Selanjutnya, kami mengelompokkan inbred menurut metabolit dengan nilai relatif yang lebih tinggi di bawah MD dibandingkan dengan kondisi kontrol. Lakhan, UnumliArpa, dan IG128216 berperilaku serupa dengan SRI yang lebih tinggi untuk gula, asam askorbat, asam polihidroksi, dan enam metabolit yang tidak diketahui daripada inbred lainnya. Kelompok lain yang terdiri dari tiga inbred (SprattArcher, W23829, dan HOR383) menunjukkan SRI yang rendah untuk metabolit yang disebutkan di atas tetapi mengakumulasi asam amino dan lipid dalam jumlah relatif yang lebih tinggi (Gambar 4B ). Demikian pula, HOR8160, Georgie, K10693, dan Sissy memiliki aktivitas metabolik intermediet untuk berbagai metabolit di bawah tekanan MD. Kharsila, Ancap2, dan HOR1842 adalah akumulator terendah dari semua metabolit yang terdeteksi dalam penelitian ini (Gambar 4B ).

3.4 Variasi Kepadatan Stomata pada Inbrida Jelai
Kami mengukur SD dari permukaan adaksial dan abaksial daun dari bagian bawah, tengah, dan sepertiga atas daun. Kami mengamati variasi signifikan ( p < 0,001) dalam SD di antara inbred, permukaan daun, dan posisi pada helai daun serta inbred signifikan berdasarkan efek interaksi posisi (Tabel S2 ). h 2 SD adalah 77% hingga 88% pada posisi daun yang berbeda. SD berkisar dari 18 hingga 33, 21 hingga 34, dan 28 hingga 38 stomata/mm 2 pada posisi bawah, tengah, dan atas helai daun, masing-masing. PCA dari informasi SD menunjukkan bahwa SD serupa di bagian tengah dan bawah helai daun tetapi berbeda dari SD ke arah ujung helai daun (Gambar 5 ). PC1 memisahkan inbred Eropa dari Asia dan Afrika, sementara PC2 memisahkan inbred asal Eropa (Gambar 5 ). HOR1842 dan HOR7985 merupakan inbred dengan SD tertinggi dan terendah, masing-masing (Gambar 6C ).