
ABSTRAK
Studi ini menyelidiki komposisi fitokimia dan potensi biofarmakologis dari tiga spesies Hypericum ( H. scabrum , H. lysimachioides , dan H. uniglandulosum ) dari Turki. Ekstrak air dan hidroalkohol dianalisis untuk kandungan fenolik total (TPC), kandungan flavonoid total (TFC), dan komponen individual (dengan teknik UHPLC–HRMS). Aktivitas antioksidan diselidiki oleh DPPH, ABTS, CUPRAC, FRAP, fosfomolibdenum, dan uji khelasi logam. Efek penghambatan ekstrak yang diuji pada asetilkolinesterase (AChE), butirilkolinesterase (BChE), tirosinase, amilase, dan glukosidase diperiksa. Seratus senyawa diidentifikasi dalam komposisi kimia, dan senyawa spesifik untuk genus Hypericum , seperti hiperosida, hiperisin, dan pseudohiperisin, dideteksi. TPC tertinggi terdeteksi dalam ekstrak etanol/air dari H. lysimachioides dengan 69,21 mg GAE/g. Lebih jauh lagi, ekstrak etanol/air menunjukkan radikal bebas dan efek reduksi yang paling kuat. Ekstrak etanol/air dari spesies Hypericum yang diuji lebih aktif dalam tirosinase, amilase, dan glukosidase daripada ekstrak air. Penilaian neuroprotektif menunjukkan penurunan regulasi gen COX-2 dan NOS-2 dalam model korteks tikus yang distimulasi LPS, bersamaan dengan modulasi ekspresi SERT dan NET, yang menunjukkan berkurangnya neuroinflamasi dan peningkatan pelepasan neurotransmitter. Analisis docking dan dinamika molekuler menyoroti interaksi pengikatan yang kuat, terutama dalam kompleks NET_hyperoside dan NET_myricitrin. Hasilnya menunjukkan potensi terapeutik yang signifikan untuk ekstrak ini, yang mendukung pengembangannya sebagai agen alami melawan stres oksidatif, neuroinflamasi, dan penyakit neurodegeneratif terkait.
1 Pendahuluan
Tanaman obat merupakan sumber daya fundamental untuk pencegahan dan pengobatan berbagai penyakit, berkat sifat antioksidannya. Antioksidan yang berasal dari tanaman memainkan peran penting dalam mengurangi stres oksidatif, sebuah proses yang terkait erat dengan patogenesis berbagai penyakit kronis, termasuk kondisi kardiovaskular, neurodegeneratif, dan onkologis (Kasote et al. 2015 ). Fitokimia seperti polifenol dan vitamin dapat memodulasi akumulasi spesies oksigen reaktif (ROS), memberikan perlindungan yang signifikan terhadap kerusakan oksidatif pada tingkat sel (Lee dan Park 2021 ). Tanaman memiliki mekanisme pertahanan antioksidan enzimatik dan nonenzimatik. Enzim antioksidan, seperti superoksida dismutase (SOD), katalase (CAT), dan glutathione peroksidase (GPx), bekerja dengan menetralkan radikal bebas, sementara senyawa nonenzimatik, termasuk asam askorbat dan flavonoid, secara efektif berkontribusi untuk mengurangi stres oksidatif (Kasote et al. 2015 ). Kemampuan untuk menghasilkan antioksidan tersebut sebagai respons terhadap stres lingkungan merupakan aspek penting dari sifat fitoterapi tanaman. Penelitian terkini berfokus pada aplikasi terapeutik antioksidan yang berasal dari tanaman untuk pengobatan penyakit degeneratif dan inflamasi (Tyler dan Tyler 2023 ).
Dalam konteks ini, spesies dari genus Hypericum , yang dikenal karena sifat biologisnya, merupakan contoh penting tentang bagaimana tanaman obat dapat digunakan untuk mengembangkan pendekatan terapi inovatif yang lebih efektif dan memiliki lebih sedikit efek samping. Genus Hypericum , yang termasuk dalam famili Hypericaceae, terdiri dari lebih dari 500 spesies yang tersebar di seluruh dunia, dengan konsentrasi tertentu di daerah pegunungan beriklim sedang, subtropis, dan tropis (Crockett dan Robson 2011 ; Robson 2010 ). Genus ini telah menarik minat ilmiah yang signifikan karena banyaknya sifat obatnya dan potensi terapeutik yang ditunjukkan oleh berbagai spesies, yang secara tradisional digunakan untuk mengobati berbagai macam penyakit (Far et al. 2024 ). Spesies Hypericum tersebar luas dan beradaptasi dengan berbagai jenis habitat dan kondisi iklim, mulai dari daerah perbukitan hingga daerah lembab dan kering, menunjukkan kapasitas yang luar biasa untuk adaptasi dan ketahanan. Spesies dari genus Hypericum dikenal karena berbagai aktivitas biologis, termasuk efek antioksidan, antimikroba, antiinflamasi, dan penyembuhan luka (Barnes et al. 2001 ; Whiskey et al. 2001 ; Zirak et al. 2019 ). Properti ini dikaitkan dengan spektrum luas metabolit sekunder, seperti flavonoid, asilfloroglusinol, dan naftodiantron, yang memberikan fleksibilitas terapeutik yang signifikan pada tanaman ini. Flavonoid yang ada dalam spesies Hypericum telah menunjukkan aktivitas antioksidan yang kuat, membuatnya berguna dalam memerangi stres oksidatif dan mengurangi kerusakan sel (Kakouri et al. 2023 ). Selain itu, asilfloroglusinol, seperti hiperforin, memiliki efek antimikroba dan antiinflamasi yang kuat, terbukti efektif dalam mengobati infeksi dan peradangan kronis (Avato 2005 ; Ramos-Hryb et al. 2018 ). Naphthodianthrones, termasuk hypericin, dikenal karena sifat antivirus dan antidepresannya, menjadikan tanaman ini pilihan yang menarik untuk mengelola gangguan suasana hati dan infeksi virus (Far et al. 2024 ). Banyak penelitian telah menyoroti potensi spesies ini tidak hanya sebagai agen fitoterapi untuk penyakit umum tetapi juga sebagai sumber senyawa bioaktif baru untuk pengembangan pendekatan terapi yang inovatif (Marrelli et al. 2020 ). Spesies Hypericum telah dipelajari karena potensinya dalam mengobati gangguan neurodegeneratif, seperti penyakit Alzheimer dan Parkinson, karena kemampuannya untuk memodulasi neuroinflamasi dan melindungi sel saraf dari stres oksidatif (Suryawanshi et al. 2024 ). Selain itu, aktivitas penyembuhan luka dari Hypericum telah menjadi subjek penelitian mendalam, yang menunjukkan hasil yang menjanjikan dalam mendorong regenerasi jaringan dan mempercepat penyembuhan luka (Altıparmak et al. 2019 ). Dari perspektif fitokimia, spesies Hypericum dicirikan oleh berbagai macam senyawa kimia, termasuk hypericin, hyperforin, pseudohypericin, rutin, quercetin (Marrelli et al. 2014 ), xanthone, tanin, proantosianidin, dan katekin, yang berkontribusi pada sifat farmakologis tanaman ini (Alahmad et al. 2022 ; Çirak et al. 2009 ). Keragaman kimia dari spesies ini memungkinkan berbagai macam aplikasi terapeutik, yang membuatnya menjanjikan untuk penemuan obat baru. Selain itu, minyak atsiri yang diekstrak dari tanaman Hypericum memiliki sifat antimikroba yang dapat dimanfaatkan untuk mengobati infeksi kulit, sementara tanin berkontribusi terhadap aktivitas astringen dan antiinflamasi (Far et al. 2024 ). Di antara spesies genus Hypericum , Hypericum perforatum adalah spesies yang paling banyak dipelajari; namun, spesies lain, termasuk Hypericum scabrum , Hypericum lysimachioides , dan Hypericum uniglandulosum , juga menunjukkan sifat obat dan akan diselidiki lebih lanjut dalam penelitian ini. H. scabrum dikenal karena sifat farmakologisnya, termasuk efek antidepresan, antioksidan, dan antikonvulsan. Penelitian telah menunjukkan bahwa ekstrak dari spesies ini menunjukkan aktivitas protektif terhadap hipoksia dan kapasitas penyingkiran radikal bebas sedang, yang menunjukkan kemungkinan penggunaannya dalam mengelola stres oksidatif (Eslami et al. 2011 ). Selain itu, aktivitas antimikroba dan antijamur yang diamati dalam H. scabrum dikaitkan dengan minyak atsirinya dan keberadaan asam lemak omega-3 dan omega-6, yang memainkan peran penting dalam profil kimianya (Shafaghat 2011 ). Sifat-sifat ini menjadikan H. scabrum sebagai pilihan yang menjanjikan untuk pengembangan terapi alami yang ditujukan untuk mengatasi infeksi dan kondisi yang berhubungan dengan stres oksidatif. H. lysimachioides telah dipelajari karena manfaat potensialnya dalam mengatur metabolisme lipid, terutama dengan meningkatkan profil lipid dan mengurangi kadar kolesterol LDL. Ekstrak etanol spesies ini telah menunjukkan aktivitas antioksidan yang sebanding dengan vitamin E, yang menunjukkan kemungkinan perannya dalam mencegah penyakit kardiovaskular (Hakimoğlu et al. 2007 ). Selain itu, minyak atsiri H. lysimachioidesmengandung senyawa bioaktif dengan sifat antimikroba, membuatnya berguna untuk mengobati infeksi bakteri (Toker et al. 2006 ). H. uniglandulosum , spesies endemik Turki, terkenal karena konsentrasi tinggi senyawa fenoliknya, seperti hypericin dan hyperforin, yang sebagian besar bertanggung jawab atas sifat antimikroba dan antioksidannya (Turkoglu et al. 2015 ). Penelitian telah menunjukkan bahwa minyak esensial dari spesies ini kaya akan α-pinene, komponen yang berkontribusi pada aktivitas biologisnya, terutama efek antimikrobanya (Babacan dan Bagci 2017 ). Karakteristik ini membuat H. uniglandulosum layak untuk diselidiki lebih lanjut, dengan aplikasi potensial dalam mengembangkan agen antibakteri alami. Secara keseluruhan, ketiga spesies Hypericum ini — H. scabrum , H. lysimachioides , dan H. uniglandulosum — menunjukkan berbagai aktivitas farmakologis yang dapat berguna untuk tujuan terapeutik. Senyawa bioaktif dan aktivitas biologis yang teramati menunjukkan bahwa spesies ini dapat berkontribusi pada pengembangan pengobatan alami, menawarkan alternatif potensial untuk obat sintetis konvensional dengan efek samping yang lebih sedikit.
Tujuan dari penelitian ini adalah untuk menyelidiki sifat fitokimia dan biofarmakologis dari ekstrak polaritas yang berbeda dari tiga spesies Hypericum yang disebutkan di atas . Secara khusus, kandungan fenolik dan flavonoid dinilai dan sifat pemulungan/pengurangan dan penghambatan enzim juga diuji. Selain itu, ekstrak diuji pada spesimen korteks tikus yang diisolasi yang terpapar stimulus inflamasi yang dibentuk oleh lipopolisakarida (LPS) Escherichia coli untuk mengevaluasi efek antiinflamasi dan neuromodulatori. Evaluasi in silico, termasuk farmakologi jaringan, docking molekuler, dan analisis dinamika, juga dilakukan untuk mengungkap mekanisme yang mendasari sifat biofarmakologis ekstrak. Hasilnya mengonfirmasi potensi aplikasi ekstrak bioaktif dari spesies ini untuk bekerja sebagai agen antidepresan.
2 Bahan dan Metode
2.1 Koleksi Tanaman
Pada tahun 2023, spesimen botani dikumpulkan dari kota Elazığ, Turki. ( H. lysimachioides : lokasi Alibeyköy; H. scabrum : Harput, desa Gümüşbağlar; H. uniglandulosum : lokasi Alibeyköy). Dr. Ugur Cakilcioglu melakukan identifikasi taksonomi, dan spesimen voucher diawetkan di herbarium di Universitas Munzur (nomor voucher: 17-21 UC, 16-21 UC, dan 22-11 UC). Bagian udara dipisahkan, dikeringkan di tempat teduh pada suhu ruangan, dihaluskan, dan selanjutnya disimpan jauh dari cahaya.
2.2 Persiapan Ekstrak Tumbuhan
Prosedur ekstraksi meliputi dua pelarut: campuran etanol/air 70% dan air. Setiap 10 g sampel dimaserasi dengan 200 mL etanol/air dan air selama 24 jam pada suhu ruangan. Ekstrak air disiapkan dengan merendam 10 g bahan tanaman dalam air mendidih selama 15 menit. Pelarut organik dihilangkan melalui penguapan di bawah tekanan rendah, dan ekstrak air mengalami pengeringan beku.
2.3 Uji Kandungan Total Fenolik dan Flavonoid
Total fenolik dan flavonoid dihitung menurut prosedur yang diuraikan oleh (Slinkard dan Singleton 1977 ). Asam galat (GA) dan rutin digunakan sebagai standar acuan dalam penelitian, dengan hasil dinyatakan sebagai ekuivalen asam galat (GAE) dan ekuivalen rutin (RE).
2.4 Profil UHPLC–HRMS
2.4.1 Bahan Kimia
Asetonitril (untuk LC–MS), asam format (untuk LC–MS), dan metanol (tingkat analitis) dibeli dari Chromasolv (Sofia, Bulgaria). Standar referensi yang digunakan untuk identifikasi senyawa diperoleh dari Extrasynthese (Genay, Prancis) (untuk asam galat, protokatekuat; 4-hidroksibenzoat; kafeat; o -, m -, dan p -kumarat; dan vanilat; untuk rutin, mirisetin, mirisitrin, hiperosida, isoquercitrin, luteolin 7- O -rutinoside, luteolin 7- O -glukosaida, quercitrin, quercetin, apigenin, kaempferol, orientin, homoorientin, katekin, isovitexin, vitexin) dan Phytolab (Vestenbergsgreuth, Bavaria, Jerman) (asam neoklorogenik, klorogenik, dan rosmarinat, dan hispidulin).
Analisis UHPLC–HRMS dari spesies Hypericum yang diteliti dilakukan seperti yang dijelaskan sebelumnya (Gevrenova et al. 2020 ) pada spektrometer massa Q Exactive Plus (ThermoFisher Scientific Inc.) yang dilengkapi dengan probe ionisasi elektrospray yang dipanaskan (HESI-II) (ThermoScientific). Peralatan dioperasikan dalam mode ion negatif dalam rentang m/z dari 150 hingga 1500. Pemisahan kromatografi dicapai pada kolom fase terbalik Kromasil EternityXT C18 (1,8 μm, 2,1 × 100 mm) pada suhu 40°C. Fase mobil mengandung 0,1% asam format dalam air (A) dan 0,1% asam format dalam asetonitril (B). Waktu pengoperasian adalah 33 menit; laju alir adalah 0,3 mL/menit. Program elusi gradien adalah sebagai berikut: 0–1 menit, 0%–5% B; 1–20 menit, 5%–30% B; 20–25 menit, 30%–50% B; 25–30 menit, 50%–70% B; 30–33 menit, 70%–95%; dan 33–34 menit, 95%–5% B. Kemudian, penyeimbangan dilakukan selama 4 menit. Volume injeksi dan laju alir masing-masing adalah 1 μL dan 300 μL/menit. Data diproses oleh perangkat lunak kontrol instrumen/penanganan data Xcalibur 4.2 (ThermoScientific, Waltham, MA, AS) dan perangkat lunak MZmine 2.
2.4.2 Uji Kapasitas Antioksidan In Vitro
Sesuai dengan metodologi yang dirinci dalam publikasi kami sebelumnya (Grochowski et al. 2017 ), berbagai uji antioksidan dilakukan. Hasilnya dinyatakan sebagai miligram ekuivalen Trolox (TEs) per gram untuk uji DPPH, penangkapan radikal ABTS, CUPRAC, dan FRAP. Dalam milimol TEs per gram ekstrak, uji fosfomolibdenum (PBD) menguji potensi antioksidan, dan dalam miligram ekuivalen dinatrium edetat (EDTAEs) per gram ekstrak, aktivitas khelasi logam (MCA) ditentukan.
2.4.3 Efek Penghambatan terhadap Beberapa Enzim Utama
Sesuai dengan protokol yang ditetapkan (Grochowski et al. 2017 ), percobaan penghambatan enzim dilakukan pada sampel. Ekuivalen akarbosa (ACAE) per gram ekstrak digunakan untuk mengukur aktivitas penghambatan amilase dan glukosidase, sedangkan miligram ekuivalen galantamine (GALAE) per gram ekstrak digunakan untuk menguji penghambatan asetilkolinesterase (AChE) dan butirilkolinesterase (BChE). Jumlah penghambatan tirosinase untuk setiap gram ekstrak diukur dalam miligram ekuivalen asam Kojic (KAE).
2.4.4 Studi Ex Vivo
Tikus jantan dewasa C57/BL6 (berusia 3 bulan, berat 20–25 g) ditempatkan di kandang Plexiglass (dua hingga empat ekor per kandang; 55 × 33 × 19 cm) dan dipelihara dalam kondisi laboratorium standar (21°C ± 2°C; kelembapan 55% ± 5%) pada siklus terang/gelap 14/10 jam, dengan akses air dan makanan sepuasnya. Kondisi kandang dan prosedur eksperimen sepenuhnya sesuai dengan peraturan etika Komunitas Eropa (Petunjuk UE no. 26/2014) tentang perawatan hewan untuk penelitian ilmiah. Sesuai dengan prinsip yang diakui dari “penggantian, penyempurnaan, dan pengurangan pada hewan dalam penelitian,” spesimen kolon diperoleh sebagai bahan sisa dari tikus yang diobati dengan kendaraan yang diacak dalam percobaan kami sebelumnya, disetujui oleh komite etik setempat (Universitas ‘G. d’Annunzio’, Chieti, Italia) dan Kementerian Kesehatan Italia (Proyek No. 885/2018-PR). Spesimen korteks yang diisolasi disimpan dalam inkubator yang dilembabkan dengan 5% CO 2 pada suhu 37°C selama 4 jam (periode inkubasi) dalam buffer RPMI yang ditambahkan dengan LPS bakteri (50 μg/mL). Selama periode inkubasi, jaringan ditantang dengan konsentrasi skalar ekstrak (50–100 μg/mL).
Terakhir, berkenaan dengan ekspresi gen COX-2, NOS-2, SERT, dan NET, spesimen korteks dibedah dan disimpan dalam larutan RNAlater (Ambion, Austin, TX) pada suhu -20°C hingga diproses lebih lanjut. Total RNA diekstraksi dari korteks menggunakan TRI Reagent (Sigma-Aldrich, St. Louis, MO). Secara keseluruhan, 1 μg total RNA yang diekstraksi dari setiap sampel dalam volume reaksi 20 μL ditranskripsi balik menggunakan High Capacity cDNA Reverse Transcription Kit (Applied Biosystems, Foster City, CA, AS). Reaksi diinkubasi dalam Thermal Cycler 2720 (Applied Biosystems, Foster City, CA, AS) awalnya pada suhu 25°C selama 10 menit, kemudian pada suhu 37°C selama 120 menit, dan akhirnya pada suhu 85°C selama 5 detik. Ekspresi gen ditentukan dengan PCR kuantitatif real-time menggunakan kimia berbasis probe TaqMan (Applied Biosystems, Foster City, CA, AS). PCR real-time dilakukan dalam rangkap tiga untuk setiap sampel cDNA dalam kaitannya dengan masing-masing gen yang diteliti. Data diproses dengan perangkat lunak Sequence Detection System (SDS), Versi 2.3 (Applied Biosystems, Foster City, CA, AS).
2.5 Penyaringan Target Potensial
Identifikasi target terapeutik merupakan tahap penting dalam pengembangan agen farmasi baru dalam bidang penelitian medis. GeneCards dan Comparative Toxicogennomics Database (CTD) merupakan sumber daya yang sangat berharga untuk mengidentifikasi target terapeutik potensial, khususnya dalam konteks depresi, gangguan kecemasan, dan neuroinflamasi. Dengan menanyakan basis data ini dengan istilah yang terkait dengan penyakit yang dipilih, sejumlah gen terkait diidentifikasi. Lebih jauh, basis data PubChem dan CTD digunakan untuk melakukan investigasi yang lebih rinci terhadap gen yang terkait dengan kondisi ini dan senyawanya masing-masing. Untuk mengidentifikasi target umum di antara penyakit ini, alat web Venny V2.1 ( https://bioinfogp.cnb.csic.es/tools/venny/ ) digunakan, yang mengungkapkan target kritis bersama yang dapat memainkan peran penting dalam efek terapeutik pada depresi, gangguan kecemasan, dan neuroinflamasi (Yagi et al. 2024 ; Zengin et al. 2024 ).
2.6 Analisis Pengayaan KEGG
Untuk mengeksplorasi secara komprehensif proses dan jalur biologis yang berpotensi dipengaruhi oleh target utama spesies Hypericum , analisis pengayaan jalur KEGG dilakukan. Analisis tersebut secara khusus difokuskan pada jalur yang terkait dengan depresi, gangguan kecemasan, dan neuroinflamasi, yang mengungkap total 15 jalur yang diperkaya. Untuk tujuan ini, Database for Annotation, Visualization, and Integrated Discovery (DAVID, Versi 6.8, https://david.ncifcrf.gov/home.jsp ) digunakan (Huang et al. 2009 ). Analisis tersebut memanfaatkan simbol gen resmi untuk identifikasi target, dengan daftar gen ditetapkan sebagai input dan Homo sapiens sebagai spesies yang diinginkan. Jalur dengan nilai p kurang dari 0,05 dianggap signifikan secara statistik. Jalur yang diperkaya divisualisasikan menggunakan perangkat lunak R bersama dengan plugin Pathview ( https://pathview.uncc.edu/ ) di R (V4.3.3) (Yagi et al. 2024 ; Zengin et al. 2024 ).
2.7 Docking Molekuler
Dalam studi ini, protein dan enzim bersumber dari Protein Data Bank (PDB). Untuk deskripsi terperinci tentang enzim standar dan protein relevan, silakan lihat Tabel S1 , yang mencantumkan sumber-sumber berikut: AChE, BChE, tyr, amilase, dan glukosidase (Yagi et al. 2024 ; Cetiz et al. 2024 ; Cusumano et al. 2024 ; Duran et al. 2024 ; Kurt-Celep et al. 2025 ). Protein yang dipilih untuk studi ini dikategorikan menurut hubungannya dengan neuromodulasi dan neuroinflamasi. Protein neuromodulasi COX2, NET, NOS2, dan SERT dipilih berdasarkan kriteria regulasi gen, sedangkan protein yang terkait dengan neuroinflamasi (IL1B, IL6, dan PTGS2) diidentifikasi melalui analisis jalur STRING dan KEGG. Pemilihan protein-protein ini diinformasikan oleh penelitian sebelumnya yang mengidentifikasi target terapeutik potensial, serta hasil yang diperoleh dari analisis jalur dan KEGG. Setelah pengambilan, ligan, kofaktor, dan molekul air yang terkokristalisasi dikeluarkan dari struktur protein menggunakan BIOVIA Discovery Studio Visualizer V4.5, untuk mempersiapkannya untuk studi docking molekuler. Ligan dioptimalkan menggunakan OpenBabel V3.1.1 setelah diunduh dari basis data PubChem. Selanjutnya, struktur protein dan enzim disiapkan untuk docking molekuler menggunakan MGL Tools V1.5.6. Situs pengikatan aktif diidentifikasi melalui CavitOmiX V1.0 di PyMOL, POCASA V1.1, atau berdasarkan situs pengikatan inhibitor yang didokumentasikan dalam literatur (Tabel S1 ) (Yu et al. 2010 ). Untuk memvalidasi keakuratan proses docking, protein didocking ulang dengan ligannya masing-masing dan nilai deviasi akar rata-rata kuadrat (RMSD) dihitung. Rumus berikut digunakan untuk menghitung RMSD:
Docking molekular dilakukan menggunakan AutoDock Vina V1.1.2, dengan kotak-kotak grid yang digambarkan sesuai dengan metodologi yang diusulkan oleh Trott dan Olson (Trott dan Olson 2010 ). Interaksi protein-ligan menjadi sasaran analisis lebih lanjut menggunakan PLIP, dengan fokus khusus pada interaksi ikatan hidrogen untuk memastikan kekokohan dan keakuratan hasil docking.
2.8 Perhitungan Energi Bebas MM/PBSA untuk Menentukan Afinitas Pengikatan Ligand
Perhitungan stabilitas dan energi bebas molekul dilakukan menggunakan alat gmx_MMPBSA ( https://valdes-tresanco-ms.github.io/gmx_MMPBSA/dev/getting-started/ ). Awalnya, simulasi dinamika molekul (MD) dilakukan selama 10 ns untuk mengevaluasi stabilitas setiap molekul. Senyawa yang menunjukkan stabilitas tertinggi dipilih untuk analisis lebih lanjut. Selanjutnya, molekul yang dipilih dikenakan simulasi MD 100 ns untuk mendapatkan wawasan yang lebih mendalam tentang perilaku dan stabilitasnya dalam jangka waktu yang lebih lama (Miller III et al. 2012 ; Valdés-Tresanco et al. 2021 ).
2.9 Pengaturan Simulasi MD untuk Stabilitas dan Fleksibilitas Ligand
Simulasi MD dilakukan dengan menggunakan antarmuka pengguna grafis (GUI) CHARMM ( https://charmm-gui.org ). Alat Solution Builder digunakan untuk konfigurasi sistem sesuai dengan protokol yang diuraikan oleh Jo et al. (Jo et al. 2008 ). Medan gaya CHARMM36m digunakan untuk parameterisasi protein, sesuai dengan metodologi yang diuraikan oleh Yagi et al. [28] dan Maier et al. (Maier et al. 2015 ). Kondisi batas periodik dengan molekul air TIP3P digunakan untuk memastikan bahwa jarak minimum antara protein dan tepi kotak adalah 10 Å. Untuk menetralkan sistem dan mengatur konsentrasi NaCl ke 0,15 M, counterion diperkenalkan. Skema cutoff Verlet digunakan untuk manajemen interaksi elektrostatik dan van der Waals, sementara algoritma LINCS digunakan untuk kendala panjang ikatan. Elektrostatik jarak jauh dihitung menggunakan metode particle mesh Ewald (PME). Minimalisasi energi dicapai melalui algoritma steepest descent hingga energi potensial berkurang ke nilai kurang dari 1000 kJ/mol/nm. Sistem kemudian diseimbangkan dalam kondisi NVT dan NPT pada 303,3 K untuk memastikan stabilitas termodinamika. Selanjutnya, simulasi produksi dilakukan selama periode 100 ns (nstep = 50.000.000) dengan menggunakan perangkat lunak GROMACS 2023.2.
2.10 Analisis Statistik
Analisis statistik dilakukan dengan perangkat lunak GraphPad Prism (Versi 5.01) (GraphPad Software Inc., San Diego, CA, AS). Signifikansi statistik ( p < 0,05) dievaluasi melalui analisis varians (ANOVA) yang diikuti oleh uji kelipatan perbandingan Newman–Keuls.
3 Hasil dan Pembahasan
3.1 Total Kandungan Fenolik dan Flavonoid
Senyawa fenolik dan flavonoid merupakan metabolit sekunder tanaman yang banyak dipelajari karena sifat biologisnya, termasuk aktivitas antioksidan, antiinflamasi, dan antimikroba. Oleh karena itu, penentuan kandungan fenolik total (TPC) dan kandungan flavonoid total (TFC) merupakan titik awal yang penting untuk menilai potensi biologis ekstrak tanaman. Dalam penelitian ini, TPC dan TFC ekstrak air dan 70% hidroalkohol H. scabrum , H. lysimachioides , dan H. uniglandulosum diuji. Nilai-nilai tersebut dinyatakan sebagai GAE per gram ekstrak untuk TPC dan sebagai ekuivalen rutin (RE) per gram ekstrak untuk TFC. Hasilnya, dilaporkan dalam Tabel 1 , menunjukkan bahwa ekstrak H. lysimachioides yang diperoleh dengan etanol/air (70%) menyajikan nilai TPC tertinggi (69,21 ± 0,78 mg GAE/g), diikuti oleh ekstrak air (65,35 ± 1,53 mg GAE/g). Ini menunjukkan bahwa kedua pelarut efektif dalam mengekstraksi senyawa fenolik dari H. lysimachioides , meskipun pelarut etanol sedikit lebih unggul. Demikian pula, untuk H. scabrum , kandungan fenolik lebih tinggi dengan etanol/air (63,17 ± 1,09 mg GAE/g) dibandingkan dengan air (54,56 ± 0,81 mg GAE/g). Ekstrak H. uniglandulosum menunjukkan nilai TPC terendah dengan etanol/air (42,00 ± 0,34 mg GAE/g) dan air (41,25 ± 0,23 mg GAE/g), yang menunjukkan konsentrasi senyawa fenolik yang lebih rendah pada spesies ini. Secara keseluruhan, ekstrak etanol/air terbukti menjadi pelarut yang paling efektif untuk semua spesies, meskipun perbedaannya tidak terlalu menonjol untuk beberapa spesies, seperti H. uniglandulosum . Mengenai TFC, ekstrak air H. uniglandulosum memiliki TFC tertinggi (78,70 ± 0,20 mg RE/g), sedangkan ekstrak air H. scabrum mengandung TFC terendah (40,54 ± 0,04 mg RE/g). Dalam H. lysimachioides , ekstrak etanol/air melaporkan nilai yang tinggi (72,63 ± 0,81 mg RE/g), meskipun lebih rendah daripada ekstrak etanol/air H. uniglandulosum . Studi tentang TPC dan TFC spesies Hypericum yang dianalisis di sini terbatas atau langka. Hakimoğlu dkk. (Hakimoğlu dkk. 2007 ) menentukan TPC dari ekstrak etanol 70% H. lysimachioides , memperoleh nilai 307 μg GAE/mg ekstrak, yang secara signifikan lebih tinggi daripada hasil kami. Perbedaan ini mungkin disebabkan oleh perbedaan kondisi eksperimen atau metode ekstraksi. Demikian pula, TPC H. scabrum yang dilaporkan oleh Safapour dkk. (Safapour dkk. 2023)), setara dengan 2,733 mg GAE/g untuk ekstrak air etanol 50%, lebih rendah daripada nilai kami, yang menunjukkan kemungkinan pengaruh konsentrasi etanol yang berbeda atau variabilitas dalam komposisi ekstrak.
| Pelarut | Jenis | TPC (mg GAE/gram) | TFC (mg RE/gram) |
|---|---|---|---|
| Etanol/Air (70%) | H. lisimachia | 69,21 ± 0,78 per menit | 72,63 ± 0,81 miliar |
| H.scabrum (kudis) | 63,17 ± 1,09 miliar | 67,51 ± 1,10 detik | |
| H. uniglandulosum | 42,00 ± 0,34 hari | 78,70 ± 0,20 per menit | |
| Air | H. lisimachia | 65,35 ± 1,53 miliar | 49,72 ± 0,15 e |
| H.scabrum (kudis) | 54,56 ± 0,81 detik | 40,54 ± 0,04 derajat Fahrenheit | |
| H. uniglandulosum | 41,25 ± 0,23 hari | 53,01 ± 0,15 hari |
Catatan: Huruf yang berbeda menunjukkan perbedaan yang signifikan antara ekstrak yang diuji ( p < 0,05). Singkatan: GAE, gallic acid equivalent; RE, rutin equivalent. * Nilai dilaporkan sebagai rata-rata ± SD dari tiga pengukuran paralel.
3.2 Profil UHPLC–HRMS
Berdasarkan waktu retensi, massa akurat MS dan MS/MS, pola fragmentasi dalam spektrum MS/MS, kelimpahan ion relatif, dan perbandingan dengan standar referensi dan data literatur, total 100 metabolit sekunder secara tentatif dianotasi atau diidentifikasi dalam ekstrak Hypericum yang diteliti (Tabel 2 ). Tiga puluh senyawa dari kelompok asam hidroksibenzoat, hidroksisinamat, asilkuinat, dan turunannya; 61 flavonoid; empat santon; dua benzofenon; satu kromon; dan dua naftodiantron (hiperisin dan pseudo hiperisin) ditemukan dalam ekstrak tersebut.
| TIDAK | Senyawa yang diidentifikasi/diberi anotasi sementara | Rumus molekul | Massa tepat [MH] − | Pola fragmentasi dalam (−) ESI-MS/MS | t R (menit) | Δ ppm | Tingkat kepercayaan | Distribusi |
|---|---|---|---|---|---|---|---|---|
| Asam hidroksibenzoat, hidroksisinamat, asilkuinat, dan turunannya | ||||||||
| 1 | Asam quinat O -heksosida | C19H34O17 | 533.1723 | 533.1746 (2.6), 191.0553 (100), 173.0444 (0.6), 153.0180 (0.1), 127.0386 (2.0) | 0,70 | 2.29 | 2 | 1,2,3,4,5,6 |
| 2 | Asam sitrat/isositrat | C6H8O7 adalah | 191.0197 | 191.0191 (7.7), 173.0082 (1.5), 154.9978 (0.6), 129.0181 (5.7), 111.0074 (100), 85.0280 (28.5) | 0,89 | -3,33 | 2 | 1,2,3,4,5,6 |
| 3 | Asam hidroksibenzoat- O -heksosida | C13H16O8 | 299.0772 | 299.0770 (0.7), 137.0231 (100), 93.0331 (64.5) | 1.27 | -0,91 | 2 | 1,2,3,4,5,6 |
| 4 | Asam galat O -heksosida | C13H16O10 | 331.0671 | 331.0677 (7.9), 169.0133 (100), 125.0231 (42.9), 97.0280 (1.4), 79.0176 (0.3) | 1.57 | 1.78 | 2 | 1,2,3,4,5,6 |
| 5 | Asam protocatechuic- O -heksosida | C13H16O9 adalah | 315.0722 | 315.0727 (100), 225.0411 (0.4), 153.0184 (27.7), 152.0103 (55.5), 108.0202 (86.9), 109.0286 (10.3) | 1.68 | 1.69 | 2 | 1,2,3,4,5,6 |
| 6 | Vanilil- O -heksosida | C14H18O9 | 329.0878 | 329.0883 (2.1), 167.0340 (100), 152.0104 (21.2), 123.0438 (13.8), 108.0202 (37.9) | 1.74 | 1.47 | 2 | 1,2,3,4,5,6 |
| 7 | Asam protocatechuic | C7H6O4 adalah | 153.0193 | 153.0182 (16.7), 109.0281 (100) | 2.02 | -3,81 | 1 | 1,2,3,4,5,6 |
| 8 | Isomer asam protocatechuic- O -heksosida | C13H16O9 adalah | 315.0722 | 315.0733 (55.7), 153.0546 (36.7), 125.0232 (0.2), 123.0438 (50.7), 109.0281 (44.6) | 2.08 | 3.54 | 2 | 1,2,3,4,5 |
| 9 | Asam siringat 4- O -heksosida | C15H20O10 | 359.0984 | 359.0991 (8.3), 197.0449 (100), 182.0212 (18.7), 153.0547 (12.3), 138.0311 (25.3), 123.0075 (30.9) | 2.28 | 1.92 | 2 | 2,4,5,6 |
| 10 | Asam neoklorogenik (3-kafeoilkuinat) | C16H18O9 adalah | 353.0878 | 353.0885 (41.9), 191.0555 (100), 179.0342 (63.1), 161.0233 (3.7), 135.0439 (47.2), 102.0279 (0.6) | 2.36 | 1.97 | 1 | 1,2,3,4,5,6 |
| 11 | Asam 4-Hidroksibenzoat | C7H6O3 | 137.0244 | 137.0232 (100), 119.0124 (2.4), 108.0202 (9.7), 93.0330 (6.9) | 2.83 | -8,96 | 1 | 2,3,4,5,6 |
| 12 | p -asam kumarat | C9H8O3 | 163.0401 | 163.0391 (17.8), 135.0438 (3.0), 119.0488 (100) | 3.00 | -6,06 | 1 | 1,2,3,4,5,6 |
| 13 | 5- p – Asam kumaroilkuinat | C16H18O8 | 337.0929 | 337.0941 (7.7), 191.0555 (10.2), 173.0447 (3.9), 163.0391 (100), 135.0437 (1.1), 119.0489 (25.9), 111.0436 (1.1), 93.0330 (2.7) | 3.01 | 1.23 | 2 | 1,2,3,4,5,6 |
| 14 | Asam quinat | C7H12O6 | 191.0561 | 191.0553 (100), 173.0446 (1.8), 127.0388 (3.8), 111.0438 (1.8), 93.0331 (6.6), 85.028 (18.9) | 3.18 | -4,40 | 2 | 1,2,3,4,5,6 |
| 15 | Asam klorogenat (5-caffeoylquinic) | C16H18O9 adalah | 353.0878 | 353.0888 (4.8), 191.0554 (100), 179.0343 (1.1), 161.0235 (1.5) | 3.20 | 2.85 | 1 | 1,2,3,4,5,6 |
| 16 | m -asam kumarat | C9H8O3 | 163.0401 | 163.0390 (7.1), 135.0436 (0.2), 119.0488 (100) | 3.35 | -6,24 | 1 | 1,2,3,4,5,6 |
| 17 | Asam 4-kafeoilkuinat | C16H18O9 adalah | 353.0878 | 353.0885 (34.9), 191.0554 (69.2), 179.0341 (63.9), 173.0446 (100), 135.0439 (54.3), 111.0438 (3.8), 93.0331 (20.5) | 3.36 | 1.88 | 2 | 1,2,3,4,5,6 |
| 18 | Asam 3-feruloylquinic | C17H20O9 | 367.1035 | 367.1041 (20.3), 193.0499 (100), 173.0444 (4.6), 134.0360 (51.9), 127.0332 (5.8), 93.0331 (1.8) | 3.42 | 0.61 | 2 | 1,2,3,4,5,6 |
| 19 | Asam kafeat | C9H8O4 | 179.0350 | 179.0342 (20.3), 135.0439 (100), 117.0335 (0.7), 107.0124 (4.3) | 3.52 | -0,80 | 1 | 1,2,3,4,5,6 |
| 20 | Asam ferulat 4- O -heksosida | C16H20O9 | 355.1035 | 355.1039 (6.2), 235.0610 (0.9), 193.0499 (100), 178.0263 (15.5), 175.0392 (19.8), 149.0598 (10.7), 134.0361 (35.6) | 3.75 | 1.19 | 2 | 1,2,3,4,5,6 |
| 21 | 1-Asam kafeoilkuinat | C16H18O9 adalah | 353.0878 | 353.0887 (6.4), 191.0554 (100), 179.0346 (0.7), 161.0237 (2.2), 111.0436 (1.7) | 3.88 | 2.39 | 2 | 1,2,3,4,5,6 |
| 22 | Asam shikimat | C7H10O5 adalah | 173.0455 | 173.0445 (100), 155.0341 (1.8), 127.0392 (1.3), 111.0437 (9.7), 93.0331 (70.2) | 4.01 | -5,88 | 2 | 1,2,3,4,5,6 |
| 23 | 4- p – Asam kumaroilkuinat | C16H18O8 | 337.0929 | 337.0937 (9.1), 191.0547 (0.4), 173.0445 (100), 163.0390 (19.1), 137.0231 (3.7), 119.0489 (7.7), 109.0279 (0.8), 111.0438 (3.0), 93.0331 (20.0) | 4.02 | 2.28 | 2 | 1,2,3,4,5,6 |
| 24 | Asam vanili | C8H8O4 | 167.0350 | 167.0340 (60.8), 152.0103 (100), 123.0438 (5.8), 108.0202 (42.2) | 4.12 | -6,06 | 1 | 1,2,3,4,5,6 |
| 25 | Asam 4-feruloylquinic | C17H20O9 | 367.1035 | 367.1031 (13.8), 193.0499 (17.4), 173.0445 (100), 134.0361 (13.6), 127.0386 (0.7), 93.0331 (21.9) | 4.37 | -0,39 | 2 | 1,2,3,4,5,6 |
| 26 | o -asam kumarat | C9H8O3 | 163.0401 | 163.0391 (8.4), 135.0444 (0.3), 119.0489 (100) | 4.53 | -5,99 | 1 | 1,2,3,4,5,6 |
| 27 | Asam galat | C7H6O5 | 169.0142 | 169.0133 (77.4), 151.0025 (100), 125.0231 (25.8), 107.0125 (18.4), 83.0123 (28.9) | 5.50 | -5,45 | 1 | 1,2,3,4,5,6 |
| 28 | Asam 3,5-Dicaffeoylquinic | C25H24O12 | 515.1195 | 515.1211 (18.8), 353.0884 (83.0), 335.0776 (0.9), 191.0554 (100), 179.0342 (40.2), 173.0444 (3.5), 161.0232 (5.1), 135.0439 (37.4), 127.0387 (1.8), 111.0432 (11.4) | 5.84 | Tanggal 3.09 | 2 | 1,2,3,4,5,6 |
| 29 | Asam 4,5-Dicaffeoylquinic b | C25H24O12 | 515.1195 | 515.1207 (100), 353.0884 (56.9), 335.0777 (1.8), 203.0345 (2.8), 191.0554 (34.0), 179.0341 (63.2), 173.0446 (96.6), 135.0439 (58.4), 111.0436 (4.9) | 6.23 | 2.27 | 2 | 1,2,3,4,5,6 |
| 30 | Asam rosmarinat | C18H16O8 | 359.0772 | 359.0783 (13.3), 197.0450 (28.3), 179.0342 (12.3), 161.0233 (100), 133.0280 (19.8) | 6.34 | 2.89 | 1 | 1,2,3,4,5,6 |
| Flavonoid | ||||||||
| 31 | (Epi) Galokatekin | C15H14O7 adalah | 305.0667 | 305.0673 (94.1), 287.0566 (0.5), 261.0774 (8.7), 243.0669 (1.6), 179.0341 (26.7), 165.0183 (22.5), 137.0232 (27.8), 125.0231 (100), 109.0281 (16.7), 151.0336 (0.7), 203.0342 (4.2) | 1.74 | 1.91 | 2 | 1,2,3,4 |
| 32 | Katekin | C15H14O6 | 289.0718 | 289.0721 (100), 271.0612 (1.6), 245.0818 (37.9), 203.0707 (14.7), 179.0341 (8.9), 151.0389 (7.5), 123.0438 (19.0), 109.0281 (30.6) | 3.11 | 1.10 | 2 | 1,2,3,4 |
| 33 | Prosianidin B2 | C30H26O12 | 577.1351 | 577.1369 (100), 559.1246 (0.8), 425.0890 (67.0), 407.0782 (55.9), 381.0976 (2.3), 289.0722 (60.9), 245.0816 (13.9), 203.0713 (7.7), 161.0234 (23.8), 151.0389 (10.2), 137.0233 (17.4), 125.0231 (86.7), 109.0282 (15.9) | 3.58 | 3.03 | 2 | 1,2,3,4 |
| 34 | Naringenin-6,8-di- C -hexoside | C27H32O15 | 595.1678 | 595.1686 (100), 475.1269 (4.2), 457.1152 (2.5), 415.1045 (10.9), 385.0939 (33.7), 355.0832 (36.5), 271.0629 (0.8), 163.0024 (1.2), 151.0025 (1.4), 119.0489 (14.8), 107.0125 (2.8) | 3.61 | 2.92 | 2 | 1,2,3,4,5,6 |
| 35 | Epikatekin | C15H14O6 | 289.0718 | 289.0721 (100), 271.0623 (0.8), 245.0819 (36.5), 203.0707 (16.9), 179.0341 (11.9), 151.0389 (11.1), 123.0437 (20.7), 125.0230 (21.0), 109.0280 (35.2) | 3.89 | 0,99 | 2 | 1,2,3,4,6 |
| 36 | Quercetin O -heksosil-deoksiheksosida isomer I | C27H30O16 | 609.1461 | 609.1480 (100), 447.0944 (9.4), 301.0358 (39.3), 300.0267 (5.2), 271.0252 (28.3), 255.0302 (4.1), 227.0346 (2.3), 178.9979 (1.3), 151.0025 (5.4), 121.0279 (1.1), 107.0125 (1.6) | 3.83 | 3.12 | 3 | 1,2,3,4,5,6 |
| 37 | Wakil II | C27H30O15 | 593.1512 | 593.1528 (100), 503.1212 (5.2), 473.1100 (15.9), 455.0999 (1.4), 413.0889 (1.1), 383.0781 (17.7), 353.0674 (32.4), 325.0712 (2.2), 297.0772 (10.6), 253.0885 (0.7), 203.0356 (0.7), 149.0604 (0.7), 117.0332 (3.7), 107.0495 (0.2) | 4.01 | 2.76 | 2 | 1,2,3,4,5,6 |
| 38 | Apigenin-6,8-di- C- heksosida | C27H29O15 | 593.1512 | 593.1528 (100), 503.1236 (4.5), 473.1100 (16.2), 413.0887 (2.1), 395.0769 (1.9), 383.0780 (22.3), 353.0674 (34.7), 325.0726 (2.1), 297.0768 (11.5), 161.0236 (1.8), 117.0331 (4.1) | 4.04 | 2.66 | 2 | 1,2,3,5 |
| 39 | Quercetin C -heksosida | C21H20O12 | 463.0882 | 463.0894 (100), 373.0573 (28.8), 343.0464 (90.4), 327.0518 (1.3), 313.0359 (0.4), 301.0355 (5.1), 300.0279 (7.4), 241.0510 (1.5), 229.0513 (0.9), 163.0028 (2.6), 151.0026 (1.1), 149.0233 (18.9), 121.0282 (2.0), 107.0126 (1.2) | 4.11 | 2.51 | 3 | 1,2,3,4,5,6 |
| 40 | Quercetin O- hexuronyl-heksosida | C27H28O18 | 639.1203 | 639.1219 (100), 463.0896 (61.4), 301.0357 (32.3), 300.0281 (23.9), 283.0254 (4.2), 255.0300 (7.9), 227.0347 (2.3), 178.9986 (0.3), 151.0028 (0,5) | 4.36 | 2.51 | 2 | 1,2,3,4,5,6 |
| 41 | Quercetin O- hexuronyl-deoxyhexoside | C27H28O17 | 623.1254 | 623.1268 (98.9), 447.0941 (37.4), 301.0357 (100), 300.0280 (8.6), 271.0249 (6.3), 243.0300 (1.9), 178.9981 (1.9), 151.0024 (14.8), 121.0278 (2.7), 107.0123 (4.9) | 4.42 | 2.34 | 2 | 1,2,3,4 |
| 42 | Mirisetin 3- O -heksosida | C21H20O13 | 479.0831 | 479.0841 (100), 317.0298 (15.7), 316.0229 (91.2), 287.0204 (11.7), 271.0252 (19.1), 178.9978 (3.0), 151.0024 (2.9), 107.0122 (1.1), 124.0150 (1.3) | 4.49 | 2.14 | 2 | 1,2,3,4,5,6 |
| 43 | Mirisetin 3- O- heksuronida | C21H18O14 | 493.0624 | 493.0636 (77.3), 317.0306 (100), 316.0231 (2.2), 299.0204 (3.6), 271.0245 (4.3), 243.0296 (2.6), 178.9977 (15.2), 151.0024 (27.3), 107.0124 (9.3) | 4.50 | 2.48 | 2 | 1,2,3,4 |
| 44 | Homoorientin (luteolin 6- C -glukosa) | C21H20O11 | 447.0933 | 447.0944 (100), 357.0623 (46.9), 327.0516 (60.7), 311.0567 (2.9), 299.0565 (11.6), 298.0480 (7.5), 297.0406 (10.1), 285.0407 (6.8), 133.0283 (13.5), 151.0027 (0.4), 107.0125 (0.4) | 4.55 | 2.54 | 1 | 2,3,5,6 |
| 45 | Orientin (luteolin 8- C -glukosa) | C21H20O11 | 447.0933 | 447.0945 (92.4), 357.0623 (30.8), 327.0517 (100), 311.0568 (1.5), 297.0408 (12.8), 299.0565 (9.4), 298.0479 (6.0), 285.0410 (4.9), 133.0283 (17.0), 151.0382 (0.4), 107.0122 (0.3) | 4.68 | 2.67 | 1 | 1,2,3,4,5,6 |
| 46 | Mirisetin 3- O -pentosida | C20H18O12 | 449.0726 | 449.0709 (100), 317.0285 (14.3), 316.0229 (99.2), 287.0203 (15.1), 271.0253 (26.9), 243.0299 (47.4), 178.9977 (3.0), 151.0026 (2.6), 107.0129 (1.9), 124.0155 (3.8) | 4.96 | -3,76 | 2 | 1,2,3,4,5,6 |
| 47 | Mirisetin 3- O -hidroksibutyrilasetilheksosida | C27H28O17 | 623.1263 | 623.1263 (100), 521.0944 (10.4), 479.0842 (16.8), 317.0297 (17.4), 316.0228 (73.7), 299.0193 (3.5), 271.0250 (25.8), 178.9981 (3.6), 151.0027 (5.4), 107.0126 (1.9) | 4.97 | 2.05 | 3 | 1,2,3,4,5,6 |
| 48 | Quercetin O- heksosil-heksoronida | C27H28O18 | 639.1238 | 639.1221 (25.3), 477.0685 (58.9), 301.0357 (100), 300.0467 (1.5), 155.0299 (3.5), 211.0397 (1.8), 178.9977 (6.0), 151.0025 (19.8), 121.0280 (6.5), 107.0123 (7.7) | 5.00 | 2.88 | 2 | 1,2,3,4,5 |
| 49 | Quercetin O -heksosil-deoksiheksosida isomer II | C27H30O16 | 609.1461 | 609.1481 (86.7), 447.0943 (68.5), 301.0357 (100), 300.0280 (64.2), 271.0252 (36.9), 211.0397 (1.9), 178.9980 (4.9), 151.0026 (15.7), 121.0284 (3.4), 107.0126 (5.1) | 5.05 | 3.32 | 2 | 1,2,3,4,5,6 |
| 50 | Rutin | C27H30O16 | 609.1461 | 609.1478 (100), 301.0356 (39.8), 300.0280 (55.1), 271.0251 (31.7), 255.0300 (12.9), 227.0352 (2.9), 211.0395 (0.5), 178.9982 (2.7), 151.0027 (5.9), 121.0283 (1.6), 107.0125 (1.9) | Tanggal 5.08 | 2.83 | 1 | 1,2,3,4,5,6 |
| 51 | mirisitrin | C21H20O12 | 463.0882 | 463.0894 (100), 317.0296 (23.2), 316.0229 (90.7), 287.0201 (14.1), 271.0251 (24.3), 243.0299 (3.1), 178.9977 (4.2), 151.0023 (5.2), 107.0120 (1.7) | Tanggal 5.09 | 2.70 | 1 | 1,2,3,4,5,6 |
| 52 | isoviteksin | C21H20O10 | 431.0984 | 431.0992 (100), 341.0671 (8.4), 311.0567 (94.8), 283.0614 (27.4), 239.0717 (1.7), 211.0755 (0.7), 121.0279 (2.9), 117.0332 (12.0), 161.0235 (4.1) | 5.14 | 3.08 | 1 | 1,2,3,4,5,6 |
| 53 | Isoquercitrin | C21H20O12 | 463.0882 | 463.0894 (100), 301.0352 (35.4), 300.0280 (79.8), 271.0252 (37.8), 255.0299 (16.0), 243.0299 (9.3), 227.0335 (2.3), 211.0396 (1.2), 178.9976 (2.3), 163.0026 (1.5), 151.0025 (7.4), 121.0280 (0.6), 107.0125 (2.5) | 5.19 | 2.57 | 1 | 1,2,3,4,5,6 |
| 54 | Luteolin 7- O- rutinosida | C27H30O15 | 593.1512 | 593.1528 (93.3), 285.0406 (100), 151.0027 (4.2), 133.0282 (4.9), 107.0123 (2.0) | 5.22 | 2.76 | 1 | 2,5,6 |
| 55 | Quercetin O- heksuronida | C21H18O13 | 477.0675 | 477.0687 (75.8), 301.0358 (100), 300.0287 (0.6), 283.0251 (1.8), 255.0302 (3.6), 211.0398 (2.1), 178.9978 (9.0), 151.0026 (22.2), 107.0125 (7.9), 121.0282 (6.0), 163.0027 (3.7) | 5.25 | 2.51 | 2 | 2,5 |
| 56 | Hiperosida | C21H20O12 | 463.0887 | 463.0894 (100), 301.0356 (29.7), 300.0286 (53.2), 271.0251 (28.7), 255.0300 (12.6), 243.0301 (7.3), 227.0339 (2.0), 211.0397 (1.1), 178.9979 (2.0), 151.0026 (4.7), 163.0029 (1.2), 121.0278 (0.6), 107.0124 (2.3) | 5.29 | 2.64 | 1 | 1,2,3,4,5,6 |
| 57 | Asetilorientin | C23H22O12 | 489.1038 | 489.1049 (100), 447.0917 (0.4), 429.0830 (5.9), 339.0515 (12.5), 327.0515 (68.9), 311.0565 (2.1), 297.0408 (12.4), 285.0406 (5.1), 133.0282 (19.1), 151.0025 (0.5), 107.0121 (0.9) | Jam 5.30 | 2.13 | 2 | 1,2,3,4 |
| 58 | Quercetin 3- O- asetilheksosida | C23H22O13 | 505.0988 | 505.1000 (100), 463.0891 (1.4), 301.0352 (33.9), 300.0278 (81.5), 343.0459 (0.3), 271.0251 (40.5), 178.9978 (2.9), 163.0027 (1.9), 151.0026 (5.5), 121.0283 (1.0), 107.0125 (2.2) | 5.58 | 2.41 | 2 | 1,2,3,4,5,6 |
| 59 | Asetilhomorientin | C23H22O12 | 489.1038 | 489.1051 (100), 447.0918 (1.3), 429.0837 (9.3), 339.0515 (14.5), 327.0516 (17.1), 309.0410 (37.4), 311.0576 (2.8), 297.0409 (10.1), 285.0403 (3.2), 133.0282 (21.6) | 5.60 | 2.49 | 2 | 1,2,3,4 |
| 60 | Quercetin 3- O -hidroksibutyrilasetilheksosida | C27H28O16 | Nomor telepon 607.1340 | 607.1323 (100), 505.1007 (12.7), 463.0894 (26.1), 301.0355 (47.9), 300.0280 (71.9), 271.0252 (38.9), 255.0299 (17.9), 227.0352 (2.1), 178.9979 (2.8), 151.0029 (7.8), 121.0280 (1.2), 107.0123 (2.9) | 5.63 | 2.97 | 3 | 1,2,3,4,5,6 |
| 61 | Luteolin 7- O -glukosida | C21H20O11 | 447.0933 | 447.0943 (100), 285.0397 (16.3), 284.0331 (56.3), 255.0300 (34.9), 227.0347 (32.7), 211.0401 (1.5), 151.0026 (2.3), 107.0122 (0.3) | 5.64 | 2.27 | 1 | 1,2,3,4,5,6 |
| 62 | Quercetin O -heksosil-deoksiheksosida isomer III | C27H30O16 | 609.1461 | 609.1479 (100), 301.0358 (74.8), 271.0251 (19.2), 211.0399 (1.4), 178.9978 (5.5), 151.0027 (12.8), 107.0125 (5.4) | 5.71 | 3.02 | 2 | 1,2,3,4,5,6 |
| 63 | Quercetin 3- O -pentosida | C20H18O11 | 433.0776 | 433.0784 (100), 301.0355 (73.2), 300.0279 (7.9), 271.0251 (35.7), 255.0301 (16.6), 211.0393 (1.5), 178.9975 (2.6), 151.0025 (8.5), 121.0278 (2.1), 107.0123 (3.1) | 5.75 | 1.84 | 2 | 1,2,3,4,5,6 |
| 64 | Asetilisoviteksin | C23H22O11 | 473.1089 | 473.1099 (100), 413.0887 (15.5), 353.0681 (0.8), 341.0671 (13.2), 377.0675 (0.4), 323.0566 (4.9), 311.0566 (8.1), 293.0457 (1.8), 283.0615 (24.9), 269.0459 (4.1), 239.0711 (1.4), 211.0759 (0.9), 151.0031 (0.2), 117.0332 (14.3), 107.0120 (0.6) | 5.78 | 1.96 | 2 | 1,2,3,4 |
| 65 | Mirisetin 3- O -asetildeoksiheksosida | C23H22O13 | 505.0988 | 505.1003 (100), 463.0876 (0.3), 445.0792 (1.2), 317.0292 (13.7), 316.0229 (73.3), 301.0346 (6.5), 300.0281 (26.2), 287.0202 (11.7), 271.0252 (29.7), 255.0299 (5.0), 243.0300 (5.7), 178.9976 (3.7), 151.0025 (4.9), 107.0124 (1.6) | 5.82 | 3.12 | 2 | 1,2,3,4,5,6 |
| 66 | Kaempferol 3- O- heksuronida | C23H22O13 | 461.0725 | 461.0736 (48.8), 285.0407 (100), 229.0502 (7.2), 211.0401 (1.6), 151.0021 (0.5), 135.0070 (1.3), 107.0125 (2.3) | 5.84 | 2.17 | 2 | 1,2,3,4 |
| 67 | Kuersitrin | C21H20O11 | 447.0933 | 447.0944 (100), 301.0358 (52.8), 300.0280 (60.3), 271.0252 (23.3), 243.0299 (6.4), 227.0350 (1.9), 211.0402 (1.1), 178.9977 (3.1), 151.0025 (7.5), 121.0281 (1.8), 107.0125 (2.9) | 5.90 | 2.54 | 1 | 1,2,3,4,5,6 |
| 68 | Isorhamnetin 3- O -glukosa | C22H22O12 | 477.1038 | 477.1049 (100), 315.0502 (8.9), 314.0440 (48.4), 299.0203 (3.1), 271.0251 (19.7), 257.0458 (4.2), 243.0299 (21.9), 227.0348 (3.3), 215.0348 (3.2), 199.0394 (3.7), 151.0025 (2.6), 107.0120 (0.9) | 6.02 | 2.31 | 2 | 1,2,3,5,6 |
| 69 | Kaemferol 3- O -pentosida | C20H18O10 | 417.0827 | 417.0836 (100), 285.0396 (15.9), 284.0330 (66.6), 255.0300 (41.2), 227.0348 (39.2), 211.0397 (1.2), 151.0026 (1.8), 135.0069 (0.6), 107.0118 (0.6) | 6.07 | 1,99 | 2 | 1,2,3,4,5,6 |
| 70 | Mirisetin 3- O -asetilheksuronida | C23H20O15 | 535.0729 | 535.0730 (100), 475.0484 (3.6), 317.0305 (56.9), 316.0224 (28.2), 299.0204 (9.9), 271.0257 (11.1), 243.0298 (3.5), 178.9976 (12.7), 151.0025 (17.2), 107.0124 (6.3) | Tanggal 6.09 | 0.11 | 2 | 1,2,3,4 |
| 71 | Kaempferida 3- O -diheksosida | C27H30O15 | 593.1512 | 593.1528 (67.3), 299.0563 (100), 284.0329 (76.1), 271.0258 (0.2), 227.0352 (1.3), 211.0394 (0.5), 151.0029 (1.7), 107.0126 (0.9) | 6.11 | 2.76 | 2 | 1,2,3,4,5,6 |
| 72 | Asetilviteksin | C23H22O11 | 473.1089 | 473.1099 (42.7), 413.0887 (72.9), 353.0681 (2.4), 323.0562 (5.3), 311.0567 (4.3), 293.0460 (100), 283.0611 (1.5), 269.0463 (2.2), 149.0226 (0.7), 117.0332 (25.5) | 6.12 | 1.96 | 2 | 1,2,3,4 |
| 73 | Mirisetin | C15H10O8 | 317.0303 | 317.0305 (100), 271.0252 (1.4), 227.0345 (0.7), 178.9978 (27.4), 151.0026 (30.6), 107.0124 (11.2) | 6.25 | 0.82 | 1 | 1,2,3,4,5,6 |
| 74 | Luteolin 7- O- asetilheksosida | C23H22O12 | 489.1038 | 489.1051 (100), 327.0518 (3.7), 285.0399 (24.1), 284.0330 (77.4), 255.0300 (38.4), 227.0348 (26.1), 211.0399 (1.6), 151.0221 (1.9), 133.0278 (1.3), 107.0124 (0.8) | 6.28 | 2.35 | 2 | 1,2,3,4,5,6 |
| 75 | Kaempferol 3- O -asetilheksosida | C23H22O12 | 489.1038 | 489.1051 (100), 327.0515 (0.4), 285.0406 (67.8), 284.0330 (69.9), 255.0300 (46.3), 227.0347 (28.6), 211.0395 (1.9), 151.0023 (1.6), 135.0074 (1.32), 107.0124 (1.8) | 6.29 | 2.32 | 2 | 1,2,3,4,5,6 |
| 76 | Kaempferol 3- O -hidroksibutirilasetilheksosida | C27H28O15 | 591.1391 | 591.1379 (100), 529.1369 (5.8), 489.1057 (16.0), 447.0947 (19.4), 327.0505 (0.7), 285.0406 (81.9), 284.0330 (53.9), 255.0300 (40.1), 227.0348 (19.4), 151.0027 (1.9), 135.0077 (0.9), 107.0123 (0.1) | Jam 6.30 | 4.06 | 3 | 1,2,4,5,6 |
| 77 | Quercetin 4′- O -heksosida | C21H20O12 | 463.0882 | 463.0893 (92.3), 301.0358 (100), 300.0283 (6.8), 271.0247 (4.2), 255.1601 (1.5), 227.0349 (0.9), 178.9978 (14.9), 163.0026 (0.5), 151.0026 (38.2), 121.0282 (8.9), 107.0124 (14.2) | 6.48 | 2.42 | 2 | 1,2,3,4,5,6 |
| 78 | Kaempferol 3- O -deoksiheksosida | C21H20O10 | 431.0984 | 431.0991 (100), 285.0406 (75.7), 284.0331 (52.6), 255.0300 (35.6), 227.0347 (32.9), 211.0399 (2.2), 135.0072 (1.2), 107.0119 (1.4) | 6.58 | 3.01 | 2 | 1,2,3,4,5,6 |
| 79 | Quercetin 3- O -malonyldeoxyhexoside | C24H22O14 | 533.0937 | 533.0891 (2.8), 489.1051 (100), 447.0945 (1.6), 386.0679 (0.4), 301.0355 (39.5), 300.0281 (68.5), 271.0253 (29.5), 255.0301 (14.4), 227.0347 (2.5), 178.9973 (2.9), 151.0028 (6.4), 121.0279 (1.2), 107.0126 (2.2) | 6.68 | -4,57 | 2 | 1,2,3,4,5,6 |
| 80 | Quercetin 3- O -asetilheksuronida | C23H20O14 | 519.0780 | 519.0791 (100), 459.0583 (5.1), 301.0357 (71.4), 300.0278 (16.8), 283.0257 (1.9), 271.0251 (8.6), 227.0345 (2.1), 211.0398 (1.7), 178.9977 (6.5), 151.0025 (16.5), 121.0281 (4.6), 107.0124 (5.8) | 6.76 | 2.06 | 2 | 1,2,3,4 |
| 81 | Quercetin 3- O- asetildeoksiheksosida | C23H22O12 | 489.1038 | 489.1051 (100), 447.0935 (0.5), 301.0355 (44.5), 300.0280 (76.6), 271.0252 (36.7), 255.0301 (18.4), 227.0345 (3.7), 211.0398 (1.3), 178.9980 (3.7), 151.0025 (8.2), 121.0281 (2.0), 107.0124 (3.1) | 7.34 | 2.35 | 2 | 1,2,3,4,5,6 |
| 82 | Luteolin 7- O -asetilheksuronida | C23H20O13 | 503.0831 | 503.0844 (76.7), 443.0638 (6.5), 285.0406 (100), 255.0301 (4.8), 229.0505 (10.3), 151.0027 (2.1), 113.0230 (7.8), 107.0125 (2.3) | 7.35 | 2.52 | 2 | 1,2,3,4 |
| 83 | Lutein | C15H10O6 | 285.0405 | 285.0407 (100), 241.0499 (0.3), 217.0505 (1.0), 151.0027 (3.7), 133.0282 (21.0), 121.0280 (0.9), 107.0125 (3.6) | 7.58 | 0,87 | 2 | 1,2,3,4,5,6 |
| 84 | Kuersetin | C15H10O7 adalah | 301.0354 | 301.0357 (100), 273.0412 (2.6), 257.0450 (0.9), 229.0505 (0.7), 178.9977 (19.5), 151.0025 (43.1), 121.0281 (12.8), 107.0124 (14.4) | 7.59 | 1.21 | 1 | 1,2,3,4,5,6 |
| 85 | Apigenin | C15H10O5 adalah | 269.0455 | 269.0457 (100), 225.0550 (1.4), 151.0025 (5.5), 149.0233 (4.9), 117.0332 (17.3), 107.0124 (5.2) | 8.60 | 0.49 | 1 | 1,2,3,4,5 |
| 86 | Kaempferol | C15H10O6 | 285.0405 | 285.0407 (100), 257.0452 (0.7), 229.0499 (0.9), 211.0392 (1.0), 151.0026 (1.7), 161.0033 (0.5), 135.0076 (0.3), 107.0123 (1.0) | 8.83 | 0,77 | 1 | 1,2,3,4,5,6 |
| 87 | Quercetin 3- O -coumaroyl-deoxyhexoside | C30H26O13 | 593.1301 | 593.1318 (100), 447.0947 (13.7), 301.0354 (45.2), 300.0280 (63.3), 271.0251 (30.2), 255.0300 (14.1), 211.0398 (2.1), 178.9978 (9.0), 151.0026 (22.2), 107.0125 (7.9), 121.0282 (6.0), 163.0027 (3.7) | Tanggal 9.10 | 2,99 | 2 | 2,3,4,5,6 |
| 88 | Biapigenin | C30H18O10 | 537.0827 | 537.0841 (100), 493.0936 (1.1), 386.0769 (3.2), 385.0726 (31.5), 267.0305 (2.8), 223.0403 (3.5), 152.0057 (2.2), 151.0025 (66.2), 117.0332 (7.9), 107.0124 (15.9) | 9.35 | 2.59 | 2 | 1,2,3,4,5,6 |
| 89 | Amentoflavon | C30H18O10 | 537.0827 | 537.0842 (100), 493.0906 (0.4), 376.0546 (4.3), 375.0518 (54.4), 223.0401 (1.9), 151.0025 (3.1), 117.0332 (7.9), 107.0123 (2.5) | 9.98 | 2.70 | 2 | 1,2,3,4,5,6 |
| 90 | Hispidulin (scutellarein-6-metil eter) | C16H12O6 adalah | 299.0563 | 299.0564 (65.6), 284.0329 (100), 255.0305 (1.0), 227.0344 (2.6), 211.0394 (1.3), 165.9901 (0.6), 136.9868 (14.0), 117.0329 (1.8) | 8.84 | 1.07 | 1 | 1,2,3,4,5,6 |
| 91 | Kaempferida | C16H12O6 adalah | 299.0561 | 299.0564 (100), 284.0329 (81.1), 271.0253 (8.5), 243.0306 (0.5), 227.0347 (3.4), 211.0406 (0.4), 151.0026 (3.6), 107.0124 (3.1) | 8.93 | 0,97 | 2 | 1,2,3,4,5,6 |
| Xanthone, benzophenone dan chromone | ||||||||
| 92 | Maclurin O -heksosida | C19H20O11 | 423.0933 | 423.0942 (92.6), 261.0408 (100), 243.0309 (3.5), 169.0141 (2.9), 151.0025 (68.1), 125.0232 (6.1), 109.0281 (41.5), 107.0125 (25.9) | 2.23 | 2.12 | 2 | 1,2,3,4,5,6 |
| 93 | Mangiferin/isomangiferin | C19H18O11 | 421.0776 | 421.0786 (100), 403.0685 (1.3), 331.0466 (62.9), 313.0359 (6.4), 301.0358 (88.9), 271.0252 (19.9), 259.0244 (13.9), 215.0339 (2.0), 125.0231 (1.5), 109.0283 (2.0), 161.0231 (1.0) | 3.96 | 2.39 | 2 | 1,2,3,4,5,6 |
| 94 | Mangafenon O- deoksiheksosida | C20H22O10 | 421.1140 | 421.1143 (28.5), 275.0565 (100), 257.0453 (2.1), 243.0300 (56.9), 231.0658 (1.9), 199.0395 (24.3), 175.0392 (15.0), 155.0493 (7.3), 131.0489 (4.2), 109.0279 (1.3) | 4.38 | 0.71 | 2 | 1,2,3,4,5,6 |
| 95 | Norathyriol O -heksosida | C19H18O11 | 421.0776 | 421.0786 (9.1), 259.0248 (100), 215.0346 (6.2), 187.0391 (2.5), 159.0439 (0.8), 115.0534 (0.2) | 5.44 | 2.39 | 2 | 1,2,3,4 |
| 96 | 5-hidroksi-2-isopropilkromon-7- O -heksosida | C18H22O9 | 381.1191 | 427.1235 (4.3) (MH + HCOOH), 381.1198 (7.9), 261.0771 (0.3), 219.0658 (100), 204.0424 (6.5), 175.0768 (0.2), 145.0287 (0.2) | 6.59 | -2,61 | 2 | 1,2,3,4,5,6 |
| 97 | Trihidroksimetoksisanton O -heksosida isomer I | C20H22O11 | 435.0933 | 435.0942 (100), 273.0407 (79.1), 258.0171 (44.6), 229.0140 (9.5), 201.0188 (23.5), 245.0098 (0.5), 185.0226 (0.4), 173.0226 (0.4), 145.0285 (0,5) | 7.16 | 2.06 | 2 | 1,2,3,4,5,6 |
| 98 | Trihidroksimetoksisanton O -heksosida isomer II | C20H22O11 | 435.0933 | 435.0941 (46.0), 273.0406 (100), 258.0170 (60.9), 245.0096 (0.2), 229.0145 (1.8), 201.0187 (5.2), 185.0228 (0.3) | 7.61 | 2.13 | 2 | 1,2,3,4,5,6 |
| Naftodiantron | ||||||||
| 99 | Pseudohiperisin | C30H16O9 adalah | 519.0722 | 519.0733 (100), 503.0424 (0.6), 487.0465 (2.9), 475.0450 (0.4), 449.0562 (0.7), 431.0591 (0.2), 421.0750 (0.6), 403.0588 (0.2) | 16.91 | 2.32 | 3 | 1,2,3,4 |
| 100 | Hiperisin | C30H16O8 | 503.0772 | 503.0785 (100), 487.0456 (0.9), 459.0883 (1.0), 433.0745 (2.0), 405.0784 (2.6), 361.0884 (0.3), 276.2488 (0.2) | 20.77 | 2.48 | 3 | 2,3 |
Catatan: 1- Hypericum lysimachioides— ekstrak etanol–air, 2- Hypericum lysimachioides —ekstrak air; 3- Hypericum scabrum —ekstrak etanol–air; 4- Hypericum scabrum— ekstrak air; 5- Hypericum uniglandulosum —ekstrak etanol–air; 6- Hypericum uniglandulosum —ekstrak air.
Flavonoid merupakan kelompok senyawa terbesar yang ditemukan dalam spesies yang diuji. Spektrum MS/MS 31 dengan [MH]- pada m/z 305.067 diperoleh (Tabel 2 ). Ion fragmen yang menonjol pada m/z 261.077 dihasilkan dari hilangnya CO2 dan pembelahan cincin A, dan hilangnya etenon (C2H2O) berikutnya pada m /z 219.066. Hilangnya cincin-B netral menghasilkan ion yang melimpah pada m /z 179.034 (26,7%), sedangkan puncak basa pada m /z 125.021 mengacu pada cincin-A dari kerangka flavanolik setelah pembelahan cincin heterosiklus. Dengan demikian, 31 dianotasi sebagai (epi)gallocatechin (Gevrenova et al. 2024 ).
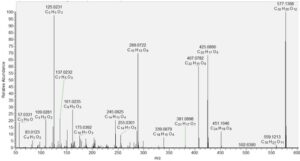
Senyawa 32 dan 35 mempunyai [М-Н] − yang sama pada m/z 289.072, konsisten dengan С 15 Н 14 О 7 dan ion fragmen pada m/z 245.082 [М-Н-CO 2 ] − , 179.034 [MHC 6 H 6 O 2 ], 125.023 ( 1,4 A − ), 137.023 ( 1,3 A − ), dan 109.0280 [М-Н-C 9 H 8 O 4 ] − ( https://doi.org/10.3390/ph14030266 ). Senyawa 32 diidentifikasi sebagai katekin berdasarkan perbandingan standar asli, sedangkan senyawa 35 diberi anotasi sebagai isomernya epikatekin. Jalur fragmentasi serupa ditunjukkan oleh senyawa 33, dimer prosianidin B2 (Gambar 1 ) (Marinov et al. 2024 ).
Pada spektrum MS/MS senyawa 37, 38, 52, 64, dan 72, aglikon diidentifikasi sebagai flavon apigenin (85) berdasarkan ion RDA 1,3 B − pada m/z 117,033, 1,3 A − pada m/z 151,003, dan 0,4 A − pada m/z 107,012. Luteolin (83) dan O -glikosidanya (54, 61, 74, dan 82) dan C -glikosidanya (44, 45, 57, 59) juga ditemukan dalam ekstrak yang diteliti.
Identifikasi aglikon luteolin ditentukan berdasarkan serangkaian ion fragmen pada m/z 285,041 [Lu-H] − , 255,030 [Lu-H-CH 2 O] − , 257,042 [Lu-H-CO] − , 241,051 [Lu-H-CO 2 ] − , 227,034 [Lu-H-CH 2 O-CO] − , dan 211,039 [Lu-HH 2 O-2CO] − , bersama dengan ion RDA 1,3 B − pada m/z 133,029, 1,3 A − pada m/z 151,003, dan 0,4 A − pada m/z 107,012 (Tabel 2) . ). Kaempferol (86) dan O -glikosidanya (69, 71, 75, 76, 78) didereplikasi oleh ion fragmen pada m/z 285.041 [KH] − , 135.008 ( 0,3 A − ), 151.003 ( 1,3 A − ), dan 107.012 ( 0,4 A − ). Quercetin (84) dan C – (39) dan O -glikosidanya (40, 41, 48, 49, 50, 53, 55, 56, 58, 60, 62, 63, 67, 77, 79, 80, 81, 87) diberi anotasi berdasarkan ion fragmen pada m/z 301,036 [QH] − , 257,045 [QH-CO 2 ] − , 229,051 [QH-CO 2 -CO] − , 178,998 ( 1,2 A − ), 121,028 ( 1,2 B − ), 151,003 ( 1,3 A − ), dan 107,012 ( Demikian pula, myricetin (73) dan O -glikosidanya (42, 43, 46, 47, 51, 65, dan 70) diidentifikasi secara tentatif oleh ion fragmen pada m/z 317.031 [Myr-H] − , 178.998 ( 1,2 A − ) , 151.003 ( 1,3 A − ) , dan 107.012 ( 0.4 A − ). Langkah penting dalam dereplikasi/anotasi glikosida flavonoid adalah kehilangan netral sebesar 162,05, 146,05, 132,04, 176,03, 204,06, 188,07, 218,04, 232,05, 338,09, 322,089, 308,11, dan 294,09 Da, yang masing-masing sesuai dengan heksosa, deoksiheksosa, pentosa, asam heksuronat, asetilheksosa, asetildeoksiheksosa, asam asetilheksuronat, malonilheksosa, heksuronilheksosa, heksuronildeoksiheksosa, heksosildeoksiheksosa/rutinosa, dan diheksosa (Zheleva-Dimitrova et al. 2023 ). Senyawa 47 [MH] − padam/z 623.126, 60 [MH] − pada m/z 607.134, dan 76 [MH] − pada m/z 591.139 menunjukkan jalur fragmentasi yang sama, termasuk kehilangan 102,03, 42,01, dan 162,05 berikutnya, yang masing-masing berhubungan dengan gugus hidroksibutiril, asetil, dan heksosil. Berdasarkan ion aglikon yang berbeda, senyawa-senyawa tersebut terkait dengan hidroksibutirilasetilheksosida dari mirisetin (47), quercetin (60), dan kaempferol (76) (Tabel 2 ; Gambar 2 ).

Dua isobar (88 dan 89) memiliki molekul terdeprotonasi yang sama [MH] − pada m/z 537.083. Senyawa 88 menunjukkan ion yang menonjol pada m/z 385.07, sedangkan 89 menunjukkan fragmen pada m/z 375.05. Berdasarkan perbandingan dengan jalur fragmentasi yang dijelaskan sebelumnya, senyawa 88 dan 89 diidentifikasi sebagai biapigenin dan amentoflavone, masing-masing [DOI 10.1002/pca.1249 ] (Gambar 3 ).
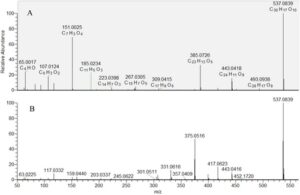
Xanthone, benzophenone, dan chromone (92–98) diidentifikasi sementara berdasarkan perbandingan dengan metabolit sekunder Hypericum yang ditemukan sebelumnya dari kelas-kelas ini (Marinov et al. 2024 ; See et al. 2014 ; Trevisan et al. 2016 ). Senyawa 100 [MH] − pada m/z 503,0772 menghasilkan ion fragmen pada m/z 487,046 [MH-CH 4 ] − , 459,089 [MH-CH4-CO] − , 433,074 [MH-CH 4 -CO-C 2 H 2 ] − , dan 405,078 [MH-CH 4 -2CO-C 2 H 2 ] − . Jalur fragmentasi ini telah dijelaskan sebelumnya, dan senyawa 100 diberi anotasi sebagai hiperisin (Riedel et al. 2004 ). Senyawa 99 berbeda dari 100 oleh satu gugus OH dan menunjukkan spektrum MS/MS yang serupa. Oleh karena itu, 99 dikaitkan dengan pseudohiperisin (Tabel 2 ).
3.3 Efek Antioksidan
Aktivitas antioksidan ekstrak tanaman dapat dievaluasi menggunakan berbagai uji komplementer, seperti DPPH, ABTS, CUPRAC, FRAP, kelasi logam, dan PBD, karena metode ini mengukur berbagai aspek aktivitas antioksidan, seperti kemampuan untuk menyumbangkan elektron atau hidrogen, atau kapasitas untuk mengkelat logam. Pendekatan multi-metode ini berguna karena memberikan pemahaman yang komprehensif tentang potensi antioksidan ekstrak tanaman. Dalam penelitian ini, ekstrak air dan 70% hidroalkohol dari tiga spesies Hypericum diuji untuk kapasitas pembersihan menggunakan uji DPPH dan ABTS; kapasitas reduksi menggunakan uji CUPRAC, FRAP, dan PBD; dan kapasitas kelasi logam. Hasilnya dilaporkan dalam Tabel 3 . Mengenai uji aktivitas pendinginan, dalam uji DPPH, ekstrak etanol/air H. lysimachioides menunjukkan aktivitas antioksidan tertinggi (224,80 ± 0,86 mg TE/g), diikuti oleh ekstrak etanol/air H. scabrum (189,35 ± 4,81 mg TE/g). Ekstrak air H. lysimachioides dan H. scabrum menunjukkan nilai yang lebih rendah (masing-masing 126,76 ± 6,98 mg TE/g dan 95,81 ± 2,97 mg TE/g) dibandingkan dengan pelarut etanol, yang menunjukkan efisiensi etanol/air yang lebih baik dalam mengekstraksi senyawa antioksidan. H. uniglandulosum memiliki nilai terendah dengan kedua pelarut (102,11 ± 1,77 mg TE/g untuk etanol/air dan 71,48 ± 1,30 mg TE/g untuk air), yang menunjukkan jumlah senyawa antioksidan aktif yang lebih rendah dalam spesies ini. Dalam uji ABTS, ekstrak etanol/air H. lysimachioides menunjukkan nilai tertinggi (313,00 ± 8,86 mg TE/g), diikuti oleh ekstrak etanol/air H. scabrum dengan nilai 257,89 ± 28,62 mg TE/g dan kemudian ekstrak air H. lysimachioides (197,43 ± 4,57 mg TE/g). Ekstrak lainnya menunjukkan kemampuan pemulungan yang lebih rendah (170,78 ± 3,20 mg TE/g untuk ekstrak air H. scabrum , 155,91 ± 1,50 mg TE/g untuk ekstrak etanol/air H. uniglandulosum , dan 100,01 ± 2,50 mg TE/g untuk ekstrak air H. uniglandulosum ). Mengenai kapasitas reduksi, dalam uji CUPRAC, hasil terbaik diperoleh oleh ekstrak etanol/air H. lysimachioides (462,93 ± 3,70 mg TE/g), sedangkan ekstrak air melaporkan nilai yang lebih rendah (357,81 ± 7,56 mg TE/g). H. scabrum menunjukkan nilai yang relatif tinggi dengan etanol/air (365,63 ± 18,02 mg TE/g) dan air (335,53 ± 6,77 mg TE/g). H. uniglandulosum menunjukkan nilai terendah, dengan ekstrak etanol/air (225,99 ± 8,34 mg TE/g) lebih unggul daripada ekstrak air (164,91 ± 2,46 mg TE/g). Dalam uji FRAP, H. lysimachioidesmenunjukkan kapasitas reduksi tertinggi dengan pelarut etanol/air (273,18 ± 3,83 mg TE/g). Ekstrak airnya menunjukkan nilai 223,34 ± 2,57 mg TE/g. H. scabrum juga menunjukkan aktivitas reduksi yang baik, dengan etanol/air (235,06 ± 7,57 mg TE/g) dan air (210,56 ± 2,19 mg TE/g). H. uniglandulosum memiliki nilai yang jauh lebih rendah dalam kedua kasus (128,81 ± 5,81 mg TE/g untuk etanol/air dan 101,93 ± 0,56 mg TE/g untuk air). Dalam uji PBD, H. uniglandulosum melaporkan nilai tertinggi dengan etanol/air (3,13 ± 0,41 mmol TE/g). Ekstrak airnya menunjukkan nilai yang lebih rendah (2,03 ± 0,03 mmol TE/g). H. lysimachioides juga menunjukkan aktivitas yang baik dengan pelarut air (2,74 ± 0,05 mmol TE/g), sedangkan H. scabrum memiliki aktivitas yang sedikit lebih rendah dengan kedua pelarut (2,29 ± 0,11 mmol TE/g untuk etanol/air dan 2,26 ± 0,02 mmol TE/g untuk air). Aktivitas kelasi logam sangat tinggi dalam ekstrak air H. uniglandulosum (20,94 ± 0,16 mg EDTAE/g), diikuti oleh ekstrak air H. scabrum (20,82 ± 0,08 mg EDTAE/g). Hal ini menunjukkan bahwa ekstrak air spesies ini mengandung senyawa dengan afinitas yang kuat terhadap logam. Di sisi lain, ekstrak air H. lysimachioides menunjukkan nilai yang lebih rendah (7,50 ± 0,54 mg EDTAE/g). Mengenai ekstrak etanol/air, nilainya adalah 16,76 ± 0,32 mmol TE/g, 8,36 ± 0,50 mmol TE/g, dan 6,66 ± 0,54 mmol TE/g untuk H. uniglandulosum , H. lysimachioides , dan H. scabrum , masing-masing. Hasilnya menunjukkan bahwa ekstrak H. lysimachioides baik yang berair maupun yang hidroalkohol adalah yang paling berhasil dalam hampir semua pengujian, diikuti oleh ekstrak H. scabrum dan terakhir H. uniglandulosum . Hal ini dapat dijelaskan oleh kandungan fenolik yang lebih tinggi dalam ekstrak H. lysimachioides dan kandungan yang lebih rendah yang ditemukan dalam ekstrak H. uniglandulosum , seperti yang dilaporkan dalam uji Folin–Ciocalteu (Tabel 1 ). Hasil eksperimen kami secara umum sejalan dengan literatur. Misalnya, untuk H. lysimachioides , nilai tinggi yang diamati dalam uji DPPH dan ABTS sejalan dengan Hakimoğlu et al. (Hakimoğlu et al. 2007 ), yang melaporkan IC50 sebesar 28 μg/mL untuk ekstrak etanol dalam uji DPPH. Dalam literatur, terdapat penelitian lain tentang ekstrak berbeda yang diperoleh dari spesies yang termasuk dalam genus Hypericum . Untuk H. scabrum , Keser et al. (Keser et al. 2020)) melaporkan bahwa etanol (ABTS: 98,99% dan OH: 97,33% pada 500 μg/mL) dan ekstrak air (ABTS: 97,89% dan OH: 96,36% pada 500 μg/mL) dari bunga menunjukkan aktivitas pemulungan yang kuat terhadap radikal ABTS dan OH, dengan ekstrak air (91,66% pada 500 μg/mL) menunjukkan aktivitas pemulungan radikal DPPH yang lebih baik daripada antioksidan standar BHA (90,16% pada 500 μg/mL). Selain itu, Shafaghat (Shafaghat 2011 ) menemukan bahwa ekstrak heksana dari berbagai bagian tanaman, seperti bunga, daun, batang, dan biji, menunjukkan aktivitas antioksidan yang cukup besar, dengan aktivitas pemulungan radikal tertinggi terdeteksi dalam ekstrak biji. Dalam studi tahun 2022, ekstrak metanol dari bunga H. scabrum menunjukkan aktivitas antioksidan tertinggi dibandingkan dengan pelarut seperti aseton, etil asetat, dan air (Ergin et al. 2022 ). Mengenai H. uniglandulosum , Turkoglu et al. ( 2015 ) menyoroti bahwa ekstrak metanol memiliki kapasitas yang kuat untuk menetralkan radikal bebas dalam uji DPPH, sementara ekstrak air juga menunjukkan sifat antioksidan yang signifikan. Baik ekstrak air maupun metanol menunjukkan kemampuan khelasi logam yang penting, yang berkontribusi pada potensi antioksidan keseluruhannya. Studi yang dilakukan pada genus ini, termasuk milik kami, menunjukkan bahwa ada baiknya untuk mengeksplorasi lebih lanjut kapasitas antioksidan spesies lain dalam genus Hypericum , yang, setelah penyelidikan lebih lanjut dan studi mendalam, dapat menjadi kandidat untuk pengembangan obat di masa depan yang ditujukan untuk memerangi stres oksidatif.
| Pelarut | Jenis | DPPH (mg TE/gram) | ABTS (mg TE/gram) | CUPRAC (mg TE/gram) | FRAP (mg TE/gram) | Khelasi (mg EDTAE/g) | PBD (mmol TE/gram) |
|---|---|---|---|---|---|---|---|
| Etanol/Air (70%) | H. lisimachia | 224,80 ± 0,86 per menit | 313,00 ± 8,86 per bulan | 462,93 ± 3,70 per menit | 273,18 ± 3,83 detik | 8,36 ± 0,50 detik | 2,40 ± 0,19 SM |
| H.scabrum (kudis) | 189,35 ± 4,81 miliar | 257,89 ± 28,62 miliar | 365,63 ± 18,02 miliar | 235,06 ± 7,57 miliar | 6,66 ± 0,54 hari | 2,29 ± 0,11 SM | |
| H. uniglandulosum | 102,11 ± 1,77 hari | 155,91 ± 1,50 hari | 225,99 ± 8,34 hari | 128,81 ± 5,81 hari | 16,76 ± 0,32 miliar | 3,13 ± 0,41 satuan | |
| Air | H. lisimachia | 126,76 ± 6,98 detik | 197,43 ± 4,57 detik | 357,81 ± 7,56 SM | 223,34 ± 2,57 miliar | 7,50 ± 0,54 kDa | 2,74 ± 0,05 pon |
| H.scabrum (kudis) | 95,81 ± 2,97 hari | 170,78 ± 3,20 kd | 335,53 ± 6,77 detik | 210,56 ± 2,19 detik | 20,82 ± 0,08 satu | 2,26 ± 0,02 SM | |
| H. uniglandulosum | 71,48 ± 1,30 | 100,01 ± 2,50 | 164,91 ± 2,46 tahun | 101,93 ± 0,56 | 20,94 ± 0,16 per menit | 2,03 ± 0,03 detik |
Catatan: Huruf yang berbeda menunjukkan perbedaan yang signifikan antara ekstrak yang diuji ( p < 0,05). Singkatan: EDTAE, ekuivalen EDTA; MCA, aktivitas khelasi logam; PBD, fosfomolibdenum; TE, ekuivalen trolox. * Nilai dilaporkan sebagai rata-rata ± SD dari tiga pengukuran paralel.
3.4 Efek Penghambatan Enzim
Penghambatan enzim-enzim tertentu, seperti AChE, BChE, tirosinase, amilase, dan glukosidase, merupakan minat farmakologis tertentu. AChE dan BChE merupakan target terapeutik untuk penyakit Alzheimer, sedangkan amilase dan glukosidase merupakan enzim-enzim kunci dalam pengendalian diabetes. Oleh karena itu, pencarian penghambat alami enzim-enzim ini merupakan strategi penting untuk pengembangan agen-agen terapeutik baru. Dalam penelitian ini, ekstrak dari tiga spesies genus Hypericum dievaluasi kemampuannya untuk menghambat enzim-enzim kunci seperti AChE, BChE, tirosinase, amilase, dan glukosidase. Hasil, yang dilaporkan dalam Tabel 4 , menunjukkan bahwa untuk penghambatan AChE, ekstrak etanol/air H. scabrum menunjukkan aktivitas terbaik (2,91 ± 0,09 mg GALAE/g), diikuti oleh etanol/air H. lysimachioides (2,81 ± 0,09 mg GALAE/g). Ekstrak air H. lysimachioides menunjukkan aktivitas yang jauh lebih rendah (1,04 ± 0,06 mg GALAE/g), dan ekstrak air H. scabrum menunjukkan nilai terendah (0,54 ± 0,01 mg GALAE/g). Tidak ada aktivitas yang diamati untuk H. uniglandulosum — ekstrak etanol/air dan air. Untuk BChE, ekstrak air H. scabrum menunjukkan aktivitas penghambatan terbaik, dengan nilai 1,13 ± 0,03 mg GALAE/g, diikuti oleh ekstrak hidroalkohol H. uniglandulosum (1,05 ± 0,11 mg GALAE/g), ekstrak hidroalkohol H. scabrum dan H. lysimachioides (masing-masing 0,99 ± 0,02 mg GALAE/g dan 0,43 ± 0,04 mg GALAE/g), dan ekstrak air H. uniglandulosum , dengan nilai 0,23 ± 0,04 mg GALAE/g. Tidak ada penghambatan terhadap BChE yang diamati untuk ekstrak air H. lysimachioides . Penghambatan tirosinase tertinggi untuk H. lysimachioides dengan etanol/air (67,39 ± 0,52 mg KAE/g), sedangkan ekstrak air menunjukkan aktivitas yang secara signifikan lebih rendah (13,29 ± 1,28 mg KAE/g). Ekstrak hidroalkohol H. scabrum melaporkan nilai 61,19 ± 3,49 mg KAE/g, lebih tinggi daripada ekstrak airnya (15,71 ± 1,07 mg KAE/g). Ekstrak etanol/air H. uniglandulosum menunjukkan nilai penghambatan tirosinase sebesar 48,87 ± 0,10 mg KAE/g. Ekstrak airnya menunjukkan aktivitas terendah, dengan nilai 4,10 ± 0,29 mg KAE/g. Aktivitas penghambatan terhadap amilase cukup rendah pada semua spesies dan pelarut, dengan nilai berkisar antara 0,04 ± 0,01 mmol ACAE/g untuk semua ekstrak air dan 0,24 mmol ACAE/g untuk ekstrak hidroalkohol H. uniglandulosum . Namun, untuk glukosidase, aktivitas terbaik diamati pada ekstrak hidroalkohol H. scabrum dan H. lysimachioides., dengan nilai masing-masing 3,35 ± 0,03 mmol ACAE/g dan 3,30 ± 0,01 mmol ACAE/g. Ekstrak H. uniglandulosum adalah yang terlemah terhadap glukosidase, dengan ekstrak airnya menunjukkan nilai 0,72 ± 0,06 mmol ACAE/g. Ada sedikit atau tidak ada penelitian dalam literatur tentang kemampuan penghambatan enzimatik dari ketiga spesies Hypericum ini , dengan hasil yang sering tidak sebanding dengan penelitian kami, terutama karena metodologi yang berbeda yang digunakan untuk mengevaluasi kapasitas ini. Sebuah penelitian tentang ekstrak H. scabrum menemukan bahwa minyak esensial menunjukkan efek penghambatan yang tinggi pada AChE dan BChE, melampaui senyawa standar galantamine. Selain itu, spesies ini menunjukkan aktivitas penghambatan yang signifikan pada tirosinase dan efek penghambatan sedang pada elastase (Akdeniz et al. 2022 ). H. lysimachioides dan H. uniglandulosum belum diteliti secara ekstensif untuk kapasitas penghambatan enzimnya. Akan tetapi, banyak penelitian menunjukkan bahwa banyak spesies Hypericum memiliki kemampuan penghambatan enzimatik yang baik. Misalnya, Hypericum laricifolium Juss. menunjukkan penghambatan aktivitas AChE yang nyata, dengan nilai IC50 berkisar antara 432,74 hingga lebih dari 1500,00 μg ekstrak kering per mililiter (Božin et al. 2013 ). Hypericum humifusum dan Hypericum perfoliatum juga menunjukkan potensi penghambatan terhadap AChE dan enzim utama yang terkait dengan diabetes tipe 2 (Béjaoui et al. 2017 ). Studi lain terhadap ekstrak H. laricifolium menyoroti aktivitas penghambatan signifikan terhadap α-glukosidase (97,2% pada 500 μg/mL) dan aldosa reduktase (56,9% pada 500 μg/mL), enzim yang terkait dengan diabetes (Guillen Quispe et al. 2017 ).
| Pelarut | Jenis | AChE (mg GALAE/gram) | BChE (mg GALAE/gram) | Tirosinase (mg KAE/g) | Amilase (mmol ACAE/g) | Glukosidase (mmol ACAE/g) |
|---|---|---|---|---|---|---|
| Etanol/Air (70%) | H. lisimachia | 2,81 ± 0,09 satuan | 0,43 ± 0,04 miliar | 67,39 ± 0,52 satuan | 0,18 ± 0,01 detik | 3,30 ± 0,01 satu |
| H.scabrum (kudis) | 2,91 ± 0,09 satuan | 0,99 ± 0,02 satuan | 61,19 ± 3,49 miliar | 0,19 ± 0,01b | 3,35 ± 0,03 satu | |
| H. uniglandulosum | di | 1,05 ± 0,11 satu | 48,87 ± 0,10 detik | 0,24 ± 0,01 satuan | 1,95 ± 0,22 detik | |
| Air | H. lisimachia | 1,04 ± 0,06 miliar | di | 13,29 ± 1,28 hari | 0,04 ± 0,01 hari | 2,85 ± 0,04 miliar |
| H.scabrum (kudis) | 0,54 ± 0,01c | 1,13 ± 0,03 satu | 15,71 ± 1,07 hari | 0,04 ± 0,01 hari | 2,95 ± 0,03 miliar | |
| H. uniglandulosum | di | 0,23 ± 0,04 detik | 4,10 ± 0,29 e | 0,04 ± 0,01 hari | 0,72 ± 0,06 hari |
Catatan: Huruf yang berbeda menunjukkan perbedaan yang signifikan antara ekstrak yang diuji ( p < 0,05). Singkatan: ACAE, ekuivalen akarbosa; GALAE, ekuivalen galantamin; KAE, ekuivalen asam kojic; na, tidak aktif. ** Nilai dilaporkan sebagai rata-rata ± SD dari tiga pengukuran paralel.
3.5 Efek Neuroprotektif dan Neuromodulator
Neuroinflamasi diduga terlibat dalam timbulnya gangguan neuropsikiatri, termasuk depresi, (Capuron dan Castanon 2017 ) dan dalam konteks ini, stimulus inflamasi seperti LPS dilaporkan meningkatkan beban inflamasi dan stres oksidatif dan, secara paralel, pergantian neurotransmitter monoamina, di otak tikus (de Monchaux Oliveira et al. 2023 ). Sebaliknya, praperlakuan dengan saffron ( Crocus sativus L.), tanaman antidepresan yang terkenal (Dobrek dan Głowacka 2023 ), mampu mengembalikan perubahan suasana hati. Selain itu, ekstrak H. perforatum telah lama dilaporkan efektif sebagai antidepresan (Dobrek dan Głowacka 2023 ). Di sisi lain, khasiat antidepresan dari tiga spesies Hypericum yang menjadi objek penelitian saat ini masih menjadi bahan perdebatan, dengan hanya beberapa makalah yang melaporkan potensi efek antidepresan dan antikecemasan dari fitokimia H. scabrum (Ganji et al. 2017 ; Ma et al. 2021 ).
Oleh karena itu, dalam penelitian saat ini, kami menyelidiki efek ekstrak etanol dan air (50–100 μg/mL) dari H. scabrum , H. lysimachioides , dan H. uniglandulosum pada ekspresi gen COX-2 dan NOS-2, sebagai indeks peradangan, dan SERT dan NET, sebagai biomarker sinyalisasi serotonin dan norepinefrin, masing-masing, dalam spesimen otak tikus terisolasi yang terpapar LPS, model eksperimental neuroinflamasi yang tervalidasi (Chichiriccò et al. 2019 ).
Stimulan LPS menyebabkan peningkatan signifikan dalam ekspresi gen COX-2 dan NOS-2 (Gambar 4 , 5 ), yang menunjukkan stimulasi inflamasi dan stres nitrosatif, masing-masing. Peningkatan kedua enzim tersebut telah dikaitkan dengan timbulnya depresi (Beheshti et al. 2020 ; He et al. 2022 ). Secara paralel, stimulus inflamasi menyebabkan peningkatan ekspresi gen SERT dan NET (Gambar 6 , 7 ) yang dapat menjelaskan pengurangan pelepasan serotonin dan norepinefrin dari ujung presinaptik, sedangkan penghambatan kedua transporter adalah target farmakologis klasik untuk terapi antidepresan (Hamon dan Blier 2013 ).
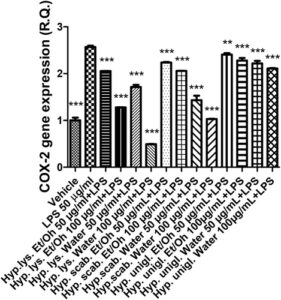
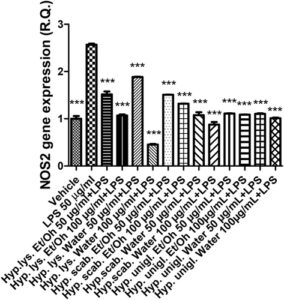
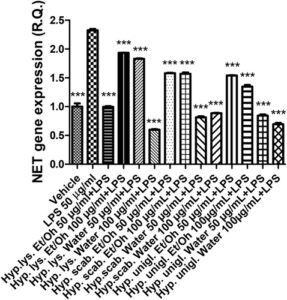
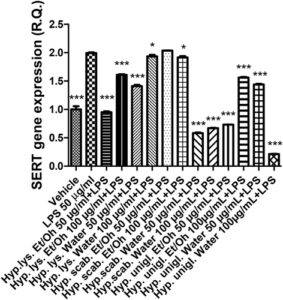
Semua ekstrak efektif dalam mencegah stimulasi LPS pada COX-2, NOS-2, SERT, dan NET; dengan demikian, menunjukkan adanya efek antineuroinflamasi dan stimulasi pada pelepasan monoamina yang menjadi dasar bagi aplikasi potensial ekstrak bioaktif H. scabrum , H. lysimachioides , dan H. uniglandulosum sebagai bahan dalam agen antidepresan inovatif.
Dengan mempertimbangkan kekayaan metabolit khusus dari fitokompleks yang diselidiki, berbagai mekanisme bersamaan dapat menjadi dasar dari efek antiinflamasi yang diamati. Misalnya, keberadaan flavonoid, seperti katekin, dapat menjelaskan, meskipun sebagian, penghambatan ekspresi gen COX-2 dan NOS-2 (Recinella et al. 2022 ). Hal ini khususnya relevan untuk ekstrak H. scabrum dan H. lysimachioides yang, selain menjadi agen antiinflamasi yang paling efektif, juga paling efektif sebagai agen penghambat enzim dan antiradikal (Tabel 3–4 ). Ekstrak-ekstrak ini juga menampilkan kandungan tertinggi dalam total fenol dan flavonoid (Tabel 2 ), dan dalam hal ini, penting untuk menyoroti bagaimana penghambatan enzim dan efek pemulungan/pengurangan juga sangat terkait dengan kandungan ekstrak dalam total fenol dan flavonoid (di Giacomo et al. 2021 ). Mengenai ekspresi gen NET dan SERT, ekstrak H. uniglandulosum menunjukkan potensi tertinggi sebagai inhibitor. Meskipun mengandung hypericin yang dapat bertindak sebagai inhibitor monoamine oxidase (Tusevski et al. 2024 ), masih dipertanyakan apakah senyawa ini dapat memediasi efek penghambatan yang diamati pada penghambatan transporter monoamine (Butterweck 2003 ). Selain itu, mengingat kandungan terendah dalam total fenol dan flavonoid yang ditunjukkan oleh ekstrak H. uniglandulosum , lebih masuk akal bahwa fitokompon lain yang tidak teridentifikasi yang ada dalam ekstrak dapat bertanggung jawab atas efek tersebut.
3.6 Wawasan Lebih Lanjut tentang Senyawa Aktif: Menargetkan Kanker
Bahasa Indonesia: Setelah identifikasi gen yang terkait dengan fitokimia yang berasal dari spesies Hypericum yang diuji , diagram Venn digunakan untuk menyelidiki hubungan antara gen-gen ini dan yang khusus untuk gangguan kecemasan, depresi, dan neuroinflamasi. Analisis komparatif mencakup 696 gen yang terkait dengan senyawa Hypericum yang diuji dengan derajat lebih besar dari 2 (Gambar 8 ). Dalam kasus depresi, 39 gen diidentifikasi menggunakan basis data STRING V12.0. Setelah validasi, 136 dari gen ini ditemukan berinteraksi, membentuk total 152 tepi. Teknik sentralitas klik maksimal (MCC), yang diimplementasikan melalui plugin CytoHubba, mengungkapkan gen hub utama seperti TP53, HIF1A, HSPA5, dan BCL2. Dalam analisis gangguan kecemasan, sembilan gen diidentifikasi menggunakan basis data STRING V12.0. Setelah validasi, sembilan dari gen ini ditemukan berinteraksi, membentuk total 17 tepi. Teknik MCC, yang diterapkan melalui plugin CytoHubba, mengungkap gen hub utama seperti INS, APOE, APP, dan ACE2. Dalam analisis neuroinflamasi, 35 gen diidentifikasi menggunakan basis data STRING V12.0. Setelah validasi, 35 gen ini ditemukan berinteraksi, membentuk total 407 tepi. Teknik MCC, yang diterapkan melalui plugin CytoHubba, mengungkap gen hub utama seperti IFNG, IL1B, IL6, dan STAT3.
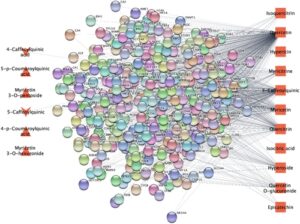
Asosiasi gen diambil dari basis data CTD dan GeneCards (Gambar 9 ). Diagram Venn menggambarkan tumpang tindih antara set gen yang terkait dengan fitokimia ini dan jenis penyakit yang dipilih. Berdasarkan jumlah tepi, molekul quercetin dan 3-caffeoyquinic diidentifikasi memiliki asosiasi yang berpotensi signifikan (Gambar 8 ).

3.7 Analisis KEGG terhadap Jalur Molekuler Senyawa Hypericum yang Terkait Kanker
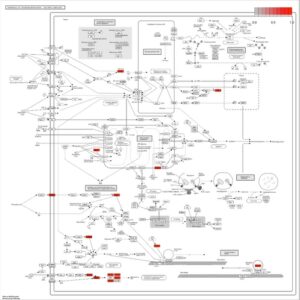
Studi pengayaan jalur target dilakukan menggunakan alat DAVID 6.8 untuk menyelidiki kemungkinan efek biologis dari komponen Hypericum yang diuji pada depresi, gangguan kecemasan, dan neuroinflamasi. Studi ini mengidentifikasi 23 jalur yang terkait dengan depresi, 2 jalur yang terkait dengan gangguan kecemasan, dan 153 jalur yang terkait dengan neuroinflamasi, berdasarkan signifikansi statistik ( p < 0,05). Analisis jalur biologis dalam depresi, gangguan kecemasan, dan neuroinflamasi mengungkapkan mekanisme biologis yang tidak berbeda dan bersama untuk setiap jenis penyakit. Dalam konteks depresi, pengayaan penting diamati dalam jalur seperti lipid dan aterosklerosis, pemrosesan protein dalam retikulum endoplasma, jalur neurodegenerasi—berbagai penyakit, dan jalur dalam kanker. Di antara ini, jalur lipid dan aterosklerosis merupakan fitur bersama antara depresi dan neuroinflamasi, tetapi tidak menunjukkan pengayaan dalam gangguan kecemasan. Temuan ini mungkin mencerminkan keberadaan mekanisme biologis bersama antara depresi dan neuroinflamasi. Dalam konteks neuroinflamasi, jalur yang berkaitan dengan infeksi dan respons imun, termasuk yang terkait dengan kanker, hepatitis B, tuberkulosis, diferensiasi osteoklas, dan leishmaniasis, menunjukkan pengayaan yang nyata. Lebih jauh, jalur pensinyalan MAPK dan PI3K-Akt diperkaya secara signifikan dalam neuroinflamasi, memainkan peran penting dalam proses pensinyalan seluler. Mengenai gangguan kecemasan, pengayaan sedikit diamati dalam jalur seperti penyakit Alzheimer dan jalur pengatur umur panjang—berbagai spesies. Namun, tingkat pengayaan dalam jalur ini kurang jelas dibandingkan dengan yang terkait dengan depresi dan neuroinflamasi. Temuan ini menekankan pentingnya jalur lipid dan aterosklerosis, yang dibagi antara depresi dan neuroinflamasi, sementara juga menggarisbawahi pengayaan substansial jalur MAPK dan PI3K-Akt, khususnya dalam konteks neuroinflamasi. Jalur ini dapat dianggap sebagai target terapi yang potensial. Secara keseluruhan, data mengungkapkan mekanisme biologis yang berbeda untuk setiap kondisi, serta jalur yang sama (Gambar 10 ).
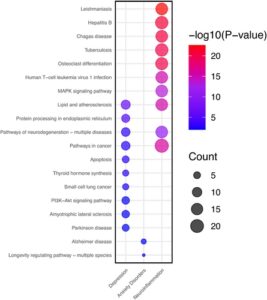
Analisis pengayaan jalur yang dilakukan pada jalur neurodegenerasi—jalur berbagai penyakit menunjukkan bahwa 16 gen memainkan peran penting dalam memahami hubungan jalur ini dengan proses neurodegeneratif. Gen-gen ini meliputi NOS2, PRKCB, BDNF, CAMK2A, PTGS2, MAPK14, TNFRSF1B, RELA, TNFRSF1A, IL1A, IL6, MAPK8, IL1B, BCL2, MAPK1, dan MAPK3. Jalur ini meliputi gen-gen yang penting untuk proses pensinyalan dalam patofisiologi penyakit neurodegeneratif. Misalnya, IL-6, IL1B, dan PTGS2 sangat penting karena perannya dalam respons inflamasi yang merupakan inti dari neuroinflamasi pada penyakit neurodegeneratif. IL-6 adalah sitokin pro-inflamasi yang memengaruhi respons imun dan telah terlibat dalam memperburuk neuroinflamasi, yang berkontribusi pada perkembangan penyakit neurodegeneratif. IL1B, sitokin kunci lainnya, memediasi sinyal inflamasi dan terlibat dalam mempromosikan respons seluler yang dapat menyebabkan neurotoksisitas dan kerusakan jaringan di otak. PTGS2 (juga dikenal sebagai COX-2) adalah enzim yang memainkan peran kunci dalam sintesis prostaglandin, senyawa lipid yang memediasi peradangan dan nyeri; peningkatan ekspresi PTGS2 sering dikaitkan dengan kondisi neuroinflamasi kronis. Gen lain dalam jalur ini juga berkontribusi pada proses patologis neurodegenerasi. Misalnya, NOS2 dan PTGS2 mengatur respons inflamasi, sementara BDNF dan CAMK2A dikaitkan dengan kelangsungan hidup dan plastisitas neuronal. Anggota keluarga MAPK, termasuk MAPK14, MAPK8, MAPK1, dan MAPK3, sangat penting untuk pensinyalan intraseluler dan respons stres. Selain itu, reseptor faktor nekrosis tumor seperti TNFRSF1A dan TNFRSF1B mengatur kematian dan kelangsungan hidup sel, yang dapat memengaruhi perkembangan penyakit neurodegeneratif. Pengayaan gen-gen ini dalam jalur ini menggarisbawahi konvergensi proses biologis seperti peradangan, kematian sel, plastisitas sinaptik, dan transduksi sinyal dalam perkembangan penyakit neurodegeneratif. Menargetkan proses-proses ini, khususnya berfokus pada mediator inflamasi seperti IL-6, IL1B, dan PTGS2, memberikan harapan untuk mengembangkan strategi terapi baru untuk mengobati penyakit neurodegeneratif (Gambar 11 ).
3.8 Mengevaluasi Hasil Docking: Energi Pengikatan Ligand dan Profil Interaksi
Studi ini menggunakan pendekatan evaluasi komprehensif untuk memeriksa sifat antipenyakit dari senyawa yang diidentifikasi dalam ekstrak yang diuji terhadap enzim standar dan protein serta enzim yang terkait dengan penyakit. Koordinat dan dimensi grid yang digunakan dalam analisis disediakan dalam Tabel S1 sebagai referensi. Profil kimia mengungkapkan sejumlah besar senyawa bioaktif, termasuk myricetin 3- O -hexuronide, myricetin 3- O -heksosida, quercetin O -glucuronide, quercitrin, epicatechin, myricitrin, myricetin, asam 3- O -caffeoylquinic, dan asam 5- O -caffeoylquinic, hypericin, asam 4- p -coumaroylquinic, hyperoside, isoquercitrin, asam 4- O -caffeoylquinic, quercetin, asam isositrat, myricetin 3- O -pentoside, asam 5- p -coumaroylquinic, dan pseudohypericin. Enzim standar AChE, BChE, tirosinase, amilase, dan glukosidase dianalisis bersama dengan protein kunci yang berasal dari neuroblastoma, karsinoma hepatoseluler, dan adenokarsinoma paru. Tujuan utama adalah untuk mengeksplorasi aktivitas antikanker dari fitokimia ini dalam kaitannya dengan protein terkait kanker dan enzim standar. Tabel 1 menyoroti senyawa dengan energi pengikatan di bawah −9 kkal/mol, sementara Tabel S2 mencantumkan senyawa dengan energi pengikatan di atas ambang batas ini. Hasil docking menunjukkan kisaran energi pengikatan dari −10,8 hingga −4,4 kkal/mol dan RMSD dari 1,2 hingga 0,1 (Tabel S2 ; Tabel 5 ; Gambar 12 ).
| Menggabungkan | Target | ID PDB | Energi pengikat | RMSD | Interaksi | Situs pengikatan | |
|---|---|---|---|---|---|---|---|
| Jenis | Nomor | ||||||
| Mirisetin 3- O- heksuronida | BChE | 3djy | -10,4 | 1.0 | ikatan H | 8 | THR A:120, TYR A:128, TYR A:128, GLU A:197, ALA A:199, TYR A:332, TYR A:332, HIS A:438 |
| Mirisetin 3- O -heksosida | BChE | 3djy | -9,9 | 0.1 | ikatan H | 8 | ASP A:70, ASP A:70, TRP A:82, GLY A:115, GLY A:115, TYR A:128, GLU A:197, HIS A:438 |
| Quercetin O -glukuronida | BChE | 3djy | -10,2 | 0.8 | ikatan H | 7 | ASP A:70, GLY A:115, GLY A:116, GLY A:117, GLU A:197, ALA A:199, ALA A:199 |
| Kuersitrin | BChE | 3djy | -10,4 | 1.1 | ikatan H | 12 | ASP A:70, ASP A:70, GLY A:78, GLY A:115, GLY A:117, TYR A:128, TYR A:128, TYR A:128, GLU A:197, SER A:287, TYR A:332, HIS A:438 |
| Epikatekin | BChE | 3djy | -9,2 | 0.2 | ikatan H | 5 | ASP A:70, ASP A:70, ASP A:70, TRP A:82, TYR A:332 |
| Obat Mricitrin | BChE | 3djy | -10,4 | 1.0 | ikatan H | 11 | ASP A:70, TRP A:82, GLY A:115, GLY A:116, GLY A:117, TYR A:128, TYR A:128, GLU A:197, ALA A:199, TYR A:332, TYR A:332 |
| Mirisetin | BChE | 3djy | -9,3 | 1.0 | ikatan H | 5 | ASP A:70, ASP A:70, ASP A:70, ASN A:83, TYR A:332 |
| Hiperisin | BChE | 3djy | -12,2 | 1.0 | ikatan H | 5 | ASP A:70, ALA A:199, PRO A:285, LEU A:286, HIS A:438 |
| Hiperosida | BChE | 3djy | -10,4 | 0.7 | ikatan H | 10 | ASP A:70, TRP A:82, GLY A:115, GLY A:115, TYR A:128, TYR A:128, ALA A:199, ALA A:199, TYR A:332, HIS A:438 |
| Isoquercitrin | BChE | 3djy | -10,4 | 1.1 | ikatan H | 11 | GLY A:115, GLY A:115, GLY A:116, THR A:120, TYR A:128, GLU A:197, GLU A:197, ALA A:199, TYR A:332, TYR A:332, HIS A:438 |
| Kuersetin | BChE | 3djy | -9,4 | 0.4 | ikatan H | 4 | ASP A:70, ASP A:70, ASN A:83, TYR A:332 |
| Mirisetin 3- O -pentosida | BChE | 3djy | -9,5 | 3.6 | ikatan H | 9 | ASN A:68, ASP A:70, GLY A:115, GLY A:115, GLY A:116, GLY A:117, GLU A:197, ALA A:199, HIS A:438 |
| Pseudohiperisin | BChE | 3djy | -11,6 | 0.3 | ikatan H | 5 | GLY A:115, TYR A:128, ALA A:199, SER A:287, HIS A:438 |
| Epikatekin | Amilase | 2qv4 | -9,0 | 1.0 | ikatan H | 6 | GLN A:63, ARG A:195, ARG A:195, ASP A:197, ASP A:300, HIS A:305 |
| Mirisitrin | Amilase | 2qv4 | -9,3 | 0.5 | ikatan H | 11 | THR A:163, ARG A:195, ARG A:195, ASP A:197, LYS A:200, HIS A:201, HIS A:299, ASP A:300, ASP A:300, ASP A:300, HIS A:305 |
| Mirisetin | Amilase | 2qv4 | -9,3 | 1.0 | ikatan H | 5 | GLN A:63, ARG A:195, HIS A:299, ASP A:300, ASP A:300 |
| Hiperisin | Amilase | 2qv4 | -10,8 | 0.1 | ikatan H | 5 | TRP A:59, GLN A:63, HIS A:101, ALA A:198, GLU A:233 |
| Kuersetin | Amilase | 2qv4 | -9,2 | 0.1 | ikatan H | 6 | TYR A:62, GLN A:63, ARG A:195, ASP A:197, ASP A:197, HIS A:299 |
| Mirisetin 3- O -pentosida | Amilase | 2qv4 | -9,0 | 1.1 | ikatan H | 8 | GLN A:63, GLN A:63, ASP A:197, NYA A:299, ASP A:300, ASP A:300, NYA A:305, NYA A:305 |
| Pseudohiperisin | Amilase | 2qv4 | -10,1 | 0.7 | ikatan H | 7 | TRP A:59, GLN A:63, HIS A:101, ASP A:197, ALA A:198, GLU A:233, HIS A:305 |
| Hiperisin | Glukosidase | 3w37 | -9,0 | 0.1 | ikatan H | 5 | ASP A:362, ASP A:362, LEU A:369, ARG A:412, ARG A:412 |
| Mirisetin 3- O- heksuronida | Sakit | 2 tahun 2 tahun | -10,8 | 0.4 | ikatan H | 10 | ASP A:74, TRP A:86, ASN A:87, GLY A:121, GLY A:122, GLU A:202, GLU A:202, ALA A:204, TYR A:341, HIS A:447 |
| Mirisetin 3- O -heksosida | Sakit | 2 tahun 2 tahun | -9,8 | 0.1 | ikatan H | 12 | TRP A:86, GLY A:121, GLY A:122, TYR A:124, TYR A:133, TYR A:133, GLU A:202, GLU A:202, PHE A:295, ARG A:296, TYR A:341, HIS A:447 |
| Quercetin O -glukuronida | Sakit | 2 tahun 2 tahun | -10,4 | 0.2 | ikatan H | 16 | TYR A:72, ASP A:74, ASP A:74, TRP A:86, GLY A:121, GLY A:122, TYR A:124, SER A:125, GLY A:126, GLU A:202, ALA A:204, ALA A:204, PHE A:295, ARG A:296, TYR A:341, HIS A:447 |
| Kuersitrin | Sakit | 2 tahun 2 tahun | -10,1 | 0.8 | ikatan H | 11 | GLY A:121, GLY A:122, TYR A:124, SER A:125, SER A:125, GLU A:202, ALA A:204, PHE A:295, ARG A:296, TYR A:341, HIS A:447 |
| Epikatekin | Sakit | 2 tahun 2 tahun | -9,6 | 1.1 | ikatan H | 4 | TYR A:72, TYR A:72, ASP A:74, SER A:125 |
| Mirisitrin | Sakit | 2 tahun 2 tahun | -10,2 | 0.9 | ikatan H | 10 | TRP A:86, TRP A:86, GLY A:121, GLY A:122, TYR A:124, TYR A:124, PHE A:295, ARG A:296, TYR A:341, HIS A:447 |
| Mirisetin | Sakit | 2 tahun 2 tahun | -10,2 | 1.0 | ikatan H | 6 | TYR A:72, ASP A:74, ASP A:74, ASN A:87, TYR A:133, GLU A:202 |
| 3-Kafeoilkuinat | Sakit | 2 tahun 2 tahun | -9,4 | 0.9 | ikatan H | 8 | GLY A:121, GLY A:122, GLU A:202, ALA A:204, PHE A:295, ARG A:296, ARG A:296, HIS A:447 |
| 5-Kafeoilkuinat | Sakit | 2 tahun 2 tahun | -9,3 | 1.0 | ikatan H | 2 | SER A:125, PHE A:295 |
| Hiperisin | Sakit | 2 tahun 2 tahun | -11,4 | 1.1 | ikatan H | 7 | TYR A:72, THR A:75, TYR A:124, SER A:293, SER A:293, SER A:293, ARG A:296 |
| 4- p – Asam kumaroilkuinat | Sakit | 2 tahun 2 tahun | -9,2 | 0.4 | ikatan H | 1 | TIRA A:341 |
| Hiperosida | Sakit | 2 tahun 2 tahun | -10,0 | 1.1 | ikatan H | 12 | ASP A:74, TRP A:86, ASN A:87, GLY A:121, GLY A:122, TYR A:124, TYR A:133, PHE A:295, ARG A:296, ARG A:296, TYR A:341, HIS A:447 |
| Asam 4-kafeoilkuinat | Sakit | 2 tahun 2 tahun | -9,2 | 0.9 | ikatan H | 9 | GLN A:71, ASP A:74, ASN A:87, GLY A:121, GLY A:122, GLU A:202, ALA A:204, ALA A:204, HIS A:447 |
| Kuersetin | Sakit | 2 tahun 2 tahun | -9,5 | 6.0 | ikatan H | 5 | TYR A:72, ASP A:74, GLY A:120, TYR A:133, GLU A:202 |
| Mirisetin 3- O -pentosida | Sakit | 2 tahun 2 tahun | -10,5 | 0.7 | ikatan H | 6 | TRP A:86, GLY A:120, TYR A:124, GLU A:202, GLU A:202, HIS A:447 |
| 5- p – Asam kumaroilkuinat | Sakit | 2 tahun 2 tahun | -9,5 | 0.2 | ikatan H | 5 | TRP A:86, SER A:125, PHE A:295, TYR A:341, TYR A:341 |
| Pseudohiperisin | Sakit | 2 tahun 2 tahun | -10,5 | 9.2 | ikatan H | 7 | TYR A:72, TYR A:72, TYR A:124, SER A:293, SER A:293, SER A:293, ARG A:296 |
| Mirisetin 3- O- heksuronida | PTGS2 | 5F19 | -9,3 | 0.8 | ikatan H | 9 | ASN A:34, ASN A:34, CYS A:36, CYS A:47, CYS A:47, SER A:49, SER A:49, GLY A:135, ASP A:157 |
| Epikatekin | PTGS2 | 5F19 | -9,0 | 9.9 | ikatan H | 4 | ASN A:34, GLY A:45, CYS A:47, GLN A:461 |
| Mirisitrin | PTGS2 | 5F19 | -9,2 | 0.5 | ikatan H | 7 | ASN A:34, ASN A:34, CYS A:36, CYS A:47, SER A:49, SER A:49, TYR A:130 |
| Mirisetin | PTGS2 | 5F19 | -9,1 | Tidak ada | ikatan H | 5 | ASN A:34, NYA A:39, CYS A:47, GLY A:135, GLN A:461 |
| Hiperisin | PTGS2 | 5F19 | -9,9 | 9.3 | ikatan H | 5 | CYS A:47, SER A:49, GLY A:135, GLY A:135, ASP A:157 |
| Kuersetin | PTGS2 | 5F19 | -9,5 | Tidak ada | ikatan H | 6 | A:39, GLY A:45, CYS A:47, CYS A:47, GLU A:465, GLU A:465 |
| Pseudohiperisin | PTGS2 | 5F19 | -9,3 | 0.4 | ikatan H | 6 | CYS A:47, CYS A:47, SER A:49, GLY A:135, GLY A:135, PRO A:154 |
| Mirisetin 3- O- heksuronida | BERSIH | 8hff | -9,8 | 0.9 | ikatan H | 9 | ARG A:81, ARG A:81, LYS A:88, ASP A:310, ALA A:384, LYS A:541, LYS A:541, PRO A:542, THR A:544 |
| Quercetin O -glukuronida | BERSIH | 8hff | -9,7 tahun | 1.1 | ikatan H | 7 | TYR A:84, ALA A:384, ASP A:473, ASP A:473, THR A:544, ASP A:546, ASP A:546 |
| Kuersitrin | BERSIH | 8hff | -9,9 | 0.6 | ikatan H | 3 | LYS A:88, ALA A:384, LYS A:541 |
| Epikatekin | BERSIH | 8hff | -9,1 | 1.0 | ikatan H | 3 | VAL A:148, PHE A:317, SER A:318 |
| Mirisitrin | BERSIH | 8hff | -10,3 | 0.6 | ikatan H | 7 | ARG A:81, ARG A:81, LYS A:88, ASP A:310, ALA A:384, LYS A:541, LYS A:541 |
| Mirisetin | BERSIH | 8hff | -9,2 | 0.6 | ikatan H | 6 | ARG A:81, ASP A:473, THR A:474, THR A:479, ASN A:539, ASN A:539 |
| Hiperosida | BERSIH | 8hff | -9,8 | 0.3 | ikatan H | 6 | ARG A:81, ARG A:81, THR A:306, ASP A:473, THR A:479, LYS A:541 |
| Isoquercitrin | BERSIH | 8hff | -9,5 | 0.9 | ikatan H | 8 | LYS A:88, THR A:306, ALA A:384, ASP A:473, ASP A:473, THR A:474, LYS A:541, LYS A:541 |
| Kuersetin | BERSIH | 8hff | -9,2 | 0.8 | ikatan H | 5 | ARG A:81, ARG A:81, TYR A:84, SER A:536, SER A:536 |
| Mirisetin 3- O -pentosida | BERSIH | 8hff | -9,7 tahun | 0.5 | ikatan H | 6 | ARG A:81, ARG A:81, LYS A:88, THR A:313, ALA A:384, THR A:474 |
| Mirisetin 3- O- heksuronida | NOS2 | 2bhj | -9,9 | 0.3 | ikatan H | 8 | ILE A:195, GLY A:196, GLY A:196, GLN A:199, SER A:236, TRP A:366, TRP A:366, TRP A:366 |
| Mirisetin 3- O -heksosida | NOS2 | 2bhj | -9,3 | 0.5 | ikatan H | 7 | ARG A:193, GLY A:196, ALA A:237, ASN A:364, ASN A:364, TRP A:366, TYR A:483 |
| Quercetin O -glukuronida | NOS2 | 2bhj | -9,9 | 0.9 | ikatan H | 3 | GLY A:196, GLN A:199, TYR A:483 |
| Kuersitrin | NOS2 | 2bhj | -10,0 | 0.9 | ikatan H | 3 | GLN A:199, SER A:236, VAL A:346 |
| Epikatekin | NOS2 | 2bhj | -9,1 | 0.7 | ikatan H | 4 | GLY A:196, GLN A:199, TRP A:366, TRP A:366 |
| Mirisitrin | NOS2 | 2bhj | -9,2 | 1.0 | ikatan H | 5 | Nomor GLN:199, SER:236, PRO:344, VAL:346, TRP:366 |
| Mirisetin | NOS2 | 2bhj | -9,2 | 3.0 | ikatan H | 4 | SER A:236, ASN A:364, TRP A:366, TRP A:366 |
| 3-kafeoilkuinat | NOS2 | 2bhj | -9,2 | tidak ada | ikatan H | 8 | ILE A:195, GLY A:196, GLY A:196, GLY A:196, GLY A:196, TRP A:366, TRP A:366, TYR A:483 |
| Hiperisin | NOS2 | 2bhj | -11,0 | 1.0 | ikatan H | 5 | Nomor GLN:257, PRO:344, ALA:345, VAL:346, TRP:366 |
| Hiperosida | NOS2 | 2bhj | -9,2 | 7.8 | ikatan H | 6 | GLY A:196, GLN A:199, TRP A:366, TRP A:366, TRP A:366, TYR A:483 |
| Isoquercitrin | NOS2 | 2bhj | -9,2 | 0.7 | ikatan H | 7 | GLY A:196, GLN A:199, PRO A:344, TRP A:366, TRP A:366, TRP A:366, TYR A:483 |
| Kuersetin | NOS2 | 2bhj | -9,4 | 1.0 | ikatan H | 3 | GLY A:196, GLN A:199, TYR A:483 |
| Mirisetin 3- O -pentosida | NOS2 | 2bhj | -9,2 | 0.8 | ikatan H | 6 | TRP A:188, GLY A:196, GLY A:196, SER A:236, SER A:236, TRP A:366 |
| Pseudohiperisin | NOS2 | 2bhj | -10,6 | 0.4 | ikatan H | 7 | GLN A:257, PRO A:344, ALA A:345, ALA A:345, VAL A:346, TRP A:366, TRP A:366 |
| Quercetin O -glukuronida | SERT | 7 mgw | -9,1 | 0.5 | ikatan H | 10 | ASN A:211, THR A:221, SER A:224, ARG A:390, GLU A:392, ASP A:400, ALA A:401, GLU A:412, GLU A:412, PHE A:566 |
| Hiperisin | SERT | 7 mgw | -11,4 | 1.0 | ikatan H | 4 | Glu A:229, Glu A:229, ASP A:400, GLN A:567 |
| Pseudohiperisin | SERT | 7 mgw | -10,7 tahun | 0.0 | ikatan H | 2 | THR A:221, GLN A:567 |
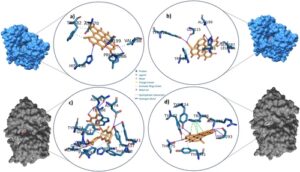
Studi ini menyelidiki potensi penghambatan senyawa alami pada berbagai protein target melalui analisis docking molekuler. Dengan berfokus pada target seperti AChE, amilase, BChE, glukosidase, NET, NOS2, PTGS2, dan SERT, penelitian ini memberikan perbandingan komprehensif berdasarkan energi pengikatan, ikatan hidrogen, dan interaksi dengan residu asam amino penting. Untuk target AChE, senyawa seperti myricetin 3- O -hexuronide (10 ikatan hidrogen, -10,8 kkal/mol), myricetin 3- O -heksosida (12 ikatan hidrogen, -9,8 kkal/mol), quercetin O -glucuronide (16 ikatan hidrogen, -10,4 kkal/mol), quercitrin (11 ikatan hidrogen, -10,1 kkal/mol), dan hypericin (7 ikatan hidrogen, -11,4 kkal/mol) menunjukkan potensi penghambatan yang kuat. Residu seperti ASP A:74, TRP A:86, ASN A:87, GLY A:121, GLY A:122, GLU A:202, dan TYR A:341 sering menjadi target, yang menyoroti pentingnya mereka dalam pengikatan inhibitor. Untuk target amilase, senyawa seperti epikatekin (6 ikatan hidrogen, -9,0 kkal/mol), mirisitrin (11 ikatan hidrogen, -9,3 kkal/mol), mirisetin (5 ikatan hidrogen, -9,3 kkal/mol), hiperisin (5 ikatan hidrogen, -10,8 kkal/mol), dan pseudohiperisin (7 ikatan hidrogen, -10,1 kkal/mol) menunjukkan interaksi yang signifikan, dengan GLN A:63, ARG A:195, dan ASP A:197 muncul sebagai tempat pengikatan umum. Untuk target BChE, myricetin 3- O -hexuronide (8 ikatan hidrogen, -10,4 kkal/mol), quercitrin (12 ikatan hidrogen, -10,4 kkal/mol), hypericin (5 ikatan hidrogen, -12,2 kkal/mol), dan isoquercitrin (11 ikatan hidrogen, -10,4 kkal/mol) menunjukkan potensi penghambatan yang tinggi, dengan TYR A:128, GLU A:197, ALA A:199, dan HIS A:438 diidentifikasi sebagai residu pengikatan utama. Untuk glukosidase, hanya hypericin (5 ikatan hidrogen, -9,0 kkal/mol) yang menunjukkan interaksi sedang, yang menunjukkan potensi penghambatan yang lebih rendah untuk target ini (Tabel 5 ; Gambar 12 ). Untuk target NET, senyawa seperti myricetin 3- O -hexuronide (9 ikatan hidrogen, -9,8 kkal/mol), quercetin O -glucuronide (7 ikatan hidrogen, -9,7 kkal/mol), myricitrin (7 ikatan hidrogen, -10,3 kkal/mol), dan isoquercitrin (8 ikatan hidrogen, -9,5 kkal/mol) menunjukkan potensi penghambatan yang kuat, sering berinteraksi dengan residu ARG A:81, LYS A:88, dan ALA A:384. Untuk NOS2, myricetin 3- O -hexuronide (8 ikatan hidrogen, -9,9 kkal/mol), epicatechin (4 ikatan hidrogen, -9,1 kkal/mol), hypericin (5 ikatan hidrogen, -11,0 kkal/mol), dan pseudohypericin (7 ikatan hidrogen, -10,6 kkal/mol) menunjukkan sifat penghambatan yang luar biasa, dengan residu GLY A:196, GLN A:199, dan TRP A:366 yang menonjol. Untuk PTGS2, myricetin 3- O-hexuronide (9 ikatan hidrogen, -9,3 kkal/mol), myricitrin (7 ikatan hidrogen, -9,2 kkal/mol) dan pseudohypericin (6 ikatan hidrogen, -9,3 kkal/mol) adalah beberapa senyawa yang penting, dengan ASN A:34, CYS A:47, dan SER A:49 sering bertindak sebagai situs interaksi. Pada target SERT, quercetin O -glukuronida (10 ikatan hidrogen, -9,1 kkal/mol) dan hypericin (4 ikatan hidrogen, -11,4 kkal/mol) menunjukkan potensi pengikatan terkuat, khususnya berinteraksi dengan residu TYR A:124 dan HIS A:447. Sebagai kesimpulan, senyawa seperti hypericin, pseudohypericin, quercetin O -glukuronida, dan myricitrin menunjukkan afinitas pengikatan yang tinggi di beberapa target, yang melibatkan berbagai residu asam amino. Residu seperti ASP A:74, TYR A:128, dan GLY A:121 berperan penting dalam menjelaskan karakteristik pengikatan inhibitor ini dengan target yang berbeda. Analisis ini menggarisbawahi potensi senyawa ini sebagai inhibitor multitarget dan menyoroti pentingnya residu asam amino tertentu dalam memediasi interaksi inhibitor.
3.9 Analisis Energi Bebas Pengikatan: Hasil MM/PBSA dan Implikasinya terhadap Efikasi Ligand
Dalam penelitian ini, efek komponen energi pada stabilitas pengikatan dievaluasi dengan menghitung dan menganalisis serangkaian kompleks protein-ligan. Investigasi difokuskan pada beberapa parameter energi penting, termasuk interaksi van der Waals (VDWAALS), energi elektrostatik (EEL), energi solvasi polar (EGB), tegangan permukaan (ESURF), energi fase gas (GGAS), energi solvasi (GSOLV), dan energi total (TOTAL). Evaluasi aktivitas enzim terkait kanker dari senyawa yang berasal dari Hypericum spp. dilakukan dengan menggunakan perhitungan energi bebas pengikatan MM/PBSA bersama dengan simulasi MD. Lima kompleks dipilih untuk analisis lebih lanjut berdasarkan faktor-faktor seperti RMSD rendah, energi pengikatan tinggi, dan jumlah ikatan hidrogen yang terbentuk. Kompleks yang dipilih untuk analisis lebih lanjut adalah kompleks NET_hyperoside, NET_myricitrin, NOS2_pseudohypericin, dan NOX2_myricetin-3- O -hexuronide yang ditunjukkan pada Tabel S3 (Gambar 13 ).
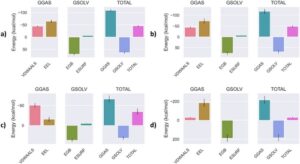
Kompleks yang dipilih untuk analisis lebih lanjut adalah sebagai berikut: Kompleks dengan energi total terendah adalah NET_hyperoside (energi total = -45,7 kkal/mol), NET_myricitrin (energi total = -48,3 kkal/mol), NOS2_pseudohypericin (energi total = -34,6 kkal/mol), dan NOX2_myricetin-3- O -hexuronide (energi total = -31,1 kkal/mol). Kompleks ini dipilih berdasarkan nilai energi total yang menguntungkan, profil pengikatan yang stabil, dan kontribusi energi elektrostatik dan solvasi yang signifikan, yang secara kolektif menunjukkan potensi pengikatan yang kuat dengan target protein masing-masing. Kompleks NET_hyperoside menunjukkan energi total yang signifikan sebesar -45,7 kkal/mol, didukung oleh interaksi van der Waals yang kuat (VDWAALS = -44,2 kkal/mol) dan kontribusi elektrostatik (EEL = -64,8 kkal/mol). Energi solvasi (GSOLV = 63,3 kkal/mol) menyeimbangkan profil interaksi, yang menunjukkan konformasi pengikatan yang baik dan stabilitas dalam kantong pengikatan protein. Demikian pula, kompleks NET_myricitrin menunjukkan karakteristik pengikatan yang kuat, dengan energi total sebesar -48,3 kkal/mol. Interaksi elektrostatik (EEL = -73,4 kkal/mol) sangat menonjol, yang menunjukkan tarikan elektrostatik yang kuat antara ligan dan protein. Energi van der Waals (VDWAALS = -44,0 kkal/mol) dan energi solvasi (GSOLV = 69,1 kkal/mol) berkontribusi pada profil interaksi yang menguntungkan secara keseluruhan, sehingga menjadikannya kandidat utama untuk simulasi MD lanjutan. Dalam kasus NOS2_pseudohypericin, energi total tercatat pada -34,6 kkal/mol. Meskipun interaksi van der Waals (VDWAALS = -50,6 kkal/mol) kuat, kontribusi elektrostatik yang relatif lebih lemah (EEL = -15,5 kkal/mol) dan energi solvasi sedang (GSOLV = 31,6 kkal/mol) menunjukkan profil pengikatan yang seimbang, meskipun kurang kuat. Kompleks ini menunjukkan fluktuasi yang lebih besar dalam komponen energi pengikatan, yang menunjukkan interaksi yang agak kurang stabil dibandingkan dengan kompleks NET. Kompleks NOX2_myricetin-3- O -hexuronide, dengan energi total −31,1 kkal/mol, menunjukkan profil energi khas yang dicirikan oleh interaksi elektrostatik yang kuat (EEL = −185,7 kkal/mol) dan energi solvasi yang signifikan (GSOLV = 184,5 kkal/mol). Meskipun komponen individualnya kuat, energi pengikatan keseluruhan diredam oleh kontribusi van der Waals yang relatif berkurang (VDWAALS = −29,9 kkal/mol). Stabilisasi yang diamati setelah fluktuasi awal menunjukkan konformasi pengikatan yang dapat beradaptasi, namun sedikit kurang stabil. Sebagai kesimpulan, kompleks yang dipilih—NET_hyperoside, NET_myricitrin, NOS2_pseudohypericin, dan NOX2_myricetin-3- O-hexuronide—menunjukkan interaksi pengikatan yang menjanjikan, sebagaimana dibuktikan oleh profil energinya yang menguntungkan. Gaya van der Waals yang kuat, elektrostatika yang seimbang, dan energi solvasi yang sesuai menunjukkan bahwa senyawa ini berpotensi untuk bertindak sebagai inhibitor yang efektif untuk protein target. Sementara NOS2_pseudohypericin dan NOX2_myricetin-3- O -hexuronide menunjukkan profil interaksi yang sedikit lebih dinamis, NET_hyperoside dan NET_myricitrin dibedakan oleh stabilitas dan karakteristik pengikatannya yang kuat (Gambar 13 ). Temuan ini menekankan perlunya mengevaluasi berbagai komponen energi untuk menentukan kandidat yang paling menjanjikan untuk studi MD lanjutan. Mereka menunjukkan bahwa senyawa yang berasal dari Hypericum spp. memiliki potensi yang kuat sebagai agen terapeutik untuk menargetkan interaksi protein yang terkait dengan jalur kanker.
3.10 Stabilitas dan Fleksibilitas dalam Simulasi MD
Tujuan dari penelitian ini adalah untuk mengidentifikasi obat terapeutik potensial melalui penyelidikan komprehensif terhadap interaksi molekuler antara ligan spesifik dan protein target, dengan fokus khusus pada penjelasan situs pengikatannya. Berdasarkan hasil kompleks NET_hyperoside, NET_myricitrin, NOS2_pseudohypericin, dan NOX2_myricetin-3- O -hexuronide, empat kompleks dipilih untuk evaluasi. Kompleks ini menunjukkan selektivitas dan stabilitas yang kuat dalam interaksinya, serta kriteria penting seperti keberadaan residu ikatan hidrogen dan hasil perhitungan energi bebas pengikatan MM/PBSA. Selanjutnya, kompleks tersebut menjalani simulasi MD, yang memberikan wawasan lebih besar tentang kemanjuran biologis dan kapasitas pengikatan proteinnya, sehingga memfasilitasi evaluasi yang lebih komprehensif tentang potensinya sebagai agen terapeutik.
Stabilitas struktural dari empat kompleks ligan-protein yang berbeda dievaluasi melalui analisis RMSD, yang diperoleh dari simulasi MD 100-ns. Kompleks NET_hyperoside menunjukkan stabilitas struktural yang tinggi, dengan nilai RMSD yang berosilasi antara 0,1 dan 0,3 nm, yang menunjukkan interaksi yang kuat dalam wilayah pengikatan. Demikian pula, kompleks NET_myricitrin menunjukkan nilai RMSD yang rendah antara 0,2 dan 0,3 nm, yang menunjukkan profil konformasi yang stabil. Sebaliknya, kompleks NOS2_pseudohypericin menunjukkan variabilitas struktural yang lebih tinggi, dengan fluktuasi RMSD berkisar antara 0,2 hingga 0,7 nm selama 5 ns awal simulasi. Setelah itu, nilai RMSD stabil pada 0,6–0,7 nm setelah 50 ns, yang menunjukkan bahwa kompleks tersebut awalnya mengalami penyesuaian konformasi sebelum mencapai struktur yang relatif stabil. Kompleks NOX2_myricetin-3- O -hexuronide menunjukkan fluktuasi RMSD terbesar di antara kompleks yang dianalisis, dengan variasi ekstensif yang diamati hingga 60 ns, setelah itu nilai RMSD menjadi stabil. Secara umum, kompleks NET_hyperoside dan NET_myricitrin menunjukkan profil konformasi yang paling stabil, menunjukkan nilai RMSD yang rendah dan konsisten, yang menunjukkan interaksi pengikatan yang lebih kuat. Sebaliknya, kompleks NOS2_pseudohypericin dan NOX2_myricetin-3- O -hexuronide menunjukkan fleksibilitas struktural yang lebih tinggi dan stabilitas yang lebih rendah. Temuan ini menunjukkan bahwa daerah pengikatan kompleks NET_hyperoside dan NET_myricitrin dikonfigurasikan dengan lebih baik dan lebih stabil, sehingga menyoroti dampak positif dari interaksi pengikatan yang kuat pada stabilitas struktural (Gambar 14a ). Plot RMSF adalah alat yang berguna untuk memvisualisasikan tingkat fleksibilitas dan kemampuan beradaptasi residu dalam kompleks protein. Kompleks NET_hyperoside dan NET_myricitrin menunjukkan nilai RMSF yang rendah di seluruh residu, dengan fluktuasi umumnya tetap di bawah 0,5 nm. Hal ini menunjukkan bahwa residu dalam wilayah pengikatan menunjukkan mobilitas terbatas, dengan demikian menunjukkan konformasi struktural yang stabil. Sebaliknya, kompleks NOS2_pseudohypericin menunjukkan peningkatan fleksibilitas yang nyata, khususnya di sekitar residu 102, di mana nilai RMSF mencapai hingga 3 nm. Fluktuasi ini terjadi di wilayah loop protein, yang menunjukkan peningkatan mobilitas dan perubahan dinamis di area yang tidak terlibat langsung dalam situs pengikatan. Demikian pula, peningkatan fleksibilitas yang nyata diamati di sekitar residu 502, yang dapat menunjukkan terjadinya perubahan struktural lokal. NOX2_myricetin-3- OKompleks -hexuronide umumnya menunjukkan nilai fluktuasi akar rata-rata kuadrat (RMSF) yang rendah, meskipun sedikit peningkatan diamati di sekitar residu 102 dan 402. Peningkatan ini tidak berlokasi di daerah pengikatan, namun menunjukkan fleksibilitas terlokalisasi dan potensi mobilitas konformasi. Sebagai kesimpulan, kompleks NET_hyperoside, NET_myricitrin, dan NOS2_pseudohypericin menunjukkan struktur yang paling stabil dan kaku, sebagaimana dibuktikan oleh nilai RMSF yang rendah dan fleksibilitas yang berkurang di daerah pengikatan. Sebaliknya, kompleks NOX2_myricetin-3- O -hexuronide menunjukkan fluktuasi RMSF yang lebih tinggi di sekitar residu tertentu, yang menunjukkan fleksibilitas struktural dan gerakan dinamis yang lebih besar. Ini menunjukkan bahwa daerah loop dan permukaan di luar tempat pengikatan berkontribusi secara signifikan terhadap fleksibilitas struktural keseluruhan (Gambar 14b ). Tingkat paparan pelarut dari kompleks ligan-protein dievaluasi menggunakan metode solvent accessible surface area (SASA). Temuan menunjukkan bahwa kompleks NOX2_myricetin-3- O -hexuronide menunjukkan nilai SASA tertinggi, dengan rata-rata sekitar 260 nm 2 . Nilai SASA yang tinggi ini menunjukkan bahwa kompleks tersebut memiliki luas permukaan yang lebih besar dan lebih banyak terpapar pada interaksi pelarut. Sebaliknya, kompleks NOS2_pseudohypericin menunjukkan nilai SASA rata-rata terendah, sekitar 220 nm 2 , yang menunjukkan bahwa ia memiliki struktur yang lebih padat dengan paparan pelarut yang terbatas. Kompleks NET_hyperoside dan NET_myricitrin menunjukkan nilai SASA menengah, berkisar antara 240 dan 245 nm 2 , yang menunjukkan paparan pelarut sedang. Nilai-nilai ini menunjukkan bahwa kedua kompleks tersebut memiliki struktur yang relatif padat dan interaksi yang terbatas dengan pelarut. Profil SASA dari kompleks NET_myricitrin menunjukkan kesamaan dengan NET_hyperoside, meskipun dengan sedikit fluktuasi. Secara umum, nilai SASA yang meningkat yang diamati untuk kompleks NOX2_myricetin-3- O -hexuronide mencerminkan luas permukaan yang lebih besar dan interaksi pelarut yang meningkat, sedangkan nilai SASA yang berkurang dari kompleks NOS2_pseudohypericin menunjukkan struktur yang lebih padat dan terlindungi pelarut. Temuan ini menggarisbawahi pengaruh potensial dari luas permukaan dan interaksi pelarut pada stabilitas struktural dan dinamika kompleks (Gambar 14c ). Selama simulasi 100-ns, pengukuran jarak minimum kompleks ligan-protein menjadi sasaran analisis. NOX2_myricetin-3- OKompleks -hexuronide menunjukkan profil jarak minimum tertinggi di antara kompleks yang diteliti, dengan nilai berkisar antara 2,7 hingga 3,2 nm. Kompleks ini menunjukkan fluktuasi yang cukup besar selama 40 ns awal periode simulasi, tetapi kemudian mencapai konfigurasi yang lebih stabil. Profil jarak minimum kompleks NET_hyperoside dan NET_myricitrin ditemukan serupa, dengan keduanya stabil dalam kisaran 1,2–1,3 nm. Kedua kompleks menunjukkan fluktuasi minimal, yang menunjukkan bahwa interaksi dalam wilayah pengikatan berkelanjutan dan stabil. Sebaliknya, kompleks NOS2_pseudohypericin menunjukkan nilai jarak minimum yang lebih rendah, dengan fluktuasi antara 0,3 dan 0,7 nm. Fluktuasi minor yang diamati selama periode 60 ns awal mungkin merupakan indikasi fase adaptasi dalam wilayah pengikatan, diikuti oleh profil jarak yang lebih stabil setelah periode ini. Secara umum, nilai jarak minimum yang lebih tinggi yang diamati untuk kompleks NOX2_myricetin-3- O -hexuronide menunjukkan konfigurasi spasial yang lebih luas dalam wilayah pengikatan dan konformasi pengikatan yang lebih fleksibel. Sebaliknya, kompleks NET_hyperoside, NET_myricitrin, dan NOS2_pseudohypericin menunjukkan nilai jarak minimum yang lebih rendah dan lebih konsisten, yang menunjukkan interaksi pengikatan yang lebih ketat. Temuan ini menekankan sifat dinamis dari interaksi pengikatan dan perubahan stabilitas dari waktu ke waktu dalam wilayah pengikatan kompleks ini (Gambar 14d ).

Dinamika ikatan hidrogen dari empat kompleks ligan–protein dianalisis selama simulasi MD 100 ns. Dalam kompleks NET_hyperoside (Gambar 15a ), jumlah ikatan hidrogen menunjukkan fluktuasi antara 1 dan 9 selama simulasi. Selama 20 ns awal, fluktuasi yang cukup besar diamati, dengan jumlah ikatan hidrogen biasanya berosilasi antara 4 dan 8. Dari 20 hingga 60 ns, pola yang lebih stabil muncul, dengan mayoritas ikatan hidrogen stabil antara 5 dan 7. Dalam fase akhir simulasi (60–100 ns), jumlah ikatan hidrogen umumnya tetap antara 4 dan 6, yang menunjukkan pembentukan jaringan ikatan hidrogen yang stabil secara struktural di wilayah pengikatan. Dalam kompleks NET_myricitrin (Gambar 15b ), jumlah ikatan hidrogen menunjukkan variabilitas antara 2 dan 10. Berbeda dengan variabilitas awal yang diamati dalam kompleks sebelumnya, jumlah ikatan hidrogen tetap relatif stabil selama 20 ns awal, berfluktuasi antara 2 dan 8. Antara 20 dan 50 ns, jumlah ikatan hidrogen menunjukkan konsistensi yang berkurang, berfluktuasi antara 5 dan 8. Meskipun demikian, setelah periode 50 ns, ikatan hidrogen menunjukkan kecenderungan ke arah stabilitas, dengan jumlah yang konsisten diamati selama sisa simulasi. Mengenai kompleks NOS2_pseudohypericin (Gambar 15c ), diamati bahwa jumlah ikatan hidrogen secara konsisten lebih rendah, berfluktuasi terutama antara 0 dan 4, dengan rentang dominan 0–1 selama sebagian besar simulasi. Dalam interval antara 60 dan 100 ns, jumlah ikatan hidrogen berkisar dari 1 hingga 3, dengan kecenderungan ke arah dua ikatan hidrogen. Namun, polanya kurang stabil, yang menunjukkan interaksi pengikatan yang lebih lemah dan kurang konsisten. Kompleks NOX2_myricetin-3- O -hexuronide (Gambar 15d ) menunjukkan rentang fluktuasi ikatan hidrogen yang lebih luas, dengan nilai yang berkisar antara 1 dan 9. Selama 20 ns awal, variabilitas yang cukup besar terlihat jelas, dengan jumlah ikatan hidrogen sering mencapai nilai antara 8 dan 10. Dari 20 hingga 60 ns, hitungan menunjukkan periode stabilitas, dengan rentang dominan 4–5. Setelah periode 70 ns, jumlah ikatan hidrogen menunjukkan stabilisasi lebih lanjut, yang menunjukkan pembentukan interaksi pengikatan yang lebih konsisten pada tahap simulasi selanjutnya.
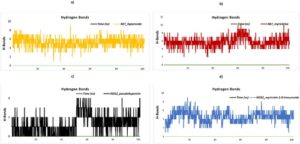
Sebagai kesimpulan, hasil simulasi MD dan analisis ikatan hidrogen menunjukkan bahwa kompleks NET_hyperoside dan NET_myricitrin menunjukkan interaksi pengikatan yang relatif stabil, ditandai dengan ikatan hidrogen yang konsisten dan konformasi struktural yang kompak. Kompleks ini menunjukkan interaksi pengikatan yang kuat, didukung oleh jaringan ikatan hidrogen yang stabil. Sebaliknya, kompleks NOS2_pseudohypericin menunjukkan pola ikatan hidrogen yang lebih lemah dan lebih tidak konsisten, yang mencerminkan interaksi pengikatan yang kurang stabil. Meskipun terdapat variabilitas awal, kompleks NOX2_myricetin-3- O -hexuronide mencapai stabilisasi setelah 70 ns, yang menunjukkan proses adaptasi bertahap di wilayah pengikatan. Sebagai kesimpulan, profil ikatan hidrogen yang stabil dari NET_hyperoside dan NET_myricitrin menunjukkan potensinya sebagai kandidat terapeutik yang kuat, sedangkan variabilitas yang diamati dalam NOS2_pseudohypericin menunjukkan konformasi pengikatan yang kurang stabil.
4 Kesimpulan
Kesimpulannya, penelitian ini menyelidiki komposisi kimia dan potensi biofarmakologis dari etanol/air (70%) dan ekstrak air dari tiga spesies Hypericum , yaitu H. scabrum , H. lysimachioides , dan H. uniglandulosum . Secara khusus, penelitian ini menunjukkan efek antioksidan dan antiinflamasi yang lebih menonjol untuk H. scabrum dan H. lysimachioides , yang juga menunjukkan kandungan tertinggi dalam senyawa fenolik dan flavonoid. Sebaliknya, ekstrak H. uniglandulosum memberikan peran neuromodulatori yang lebih kuat pada pelepasan serotonin dan norepinefrin melalui penghambatan ekspresi gen SERT dan NET, masing-masing, yang menjadi dasar untuk eksplorasi masa depan tentang efek antidepresan dalam model depresi in vivo. Analisis bioinformatika mengungkapkan pengayaan dalam jalur yang terkait dengan neurodegenerasi dan gangguan suasana hati, mengidentifikasi target utama seperti IL-6, MAPK, dan NOS2. Docking molekuler semakin memvalidasi temuan ini, menunjukkan afinitas pengikatan yang kuat dari fitokimia utama terhadap protein target, sementara simulasi MD mengonfirmasi stabilitas interaksi ligan-protein, terutama untuk kompleks NET_hyperoside dan NET_myricitrin. Penelitian lebih lanjut masih diperlukan untuk menjelaskan mekanisme yang mendasari penghambatan transporter monoamina yang dilakukan oleh ekstrak saat ini.

