
ABSTRAK
Polisakarida tersulfat (SP), kelas makromolekul bioaktif yang dibedakan dengan keberadaan gugus ester sulfat pada unit monosakaridanya, terutama terlokalisasi dalam jumlah besar di dalam matriks ekstraseluler makroalga laut. Makalah pedoman ini mencakup pendekatan konvensional dan inovatif, termasuk ekstraksi air panas, ekstraksi berbantuan asam/alkali, ekstraksi berbantuan enzim, ekstraksi berbantuan gelombang mikro, dan ekstraksi cairan bertekanan. Makalah ini selanjutnya menguraikan strategi pemurnian yang canggih, terutama berfokus pada kromatografi pertukaran anion dietilaminoetil selulosa, kromatografi pengecualian ukuran, dan filtrasi membran. Selain itu, makalah ini menyediakan teknik karakterisasi struktural yang mendalam, termasuk kromatografi cairan kinerja tinggi fase terbalik, kromatografi gas-spektrometri massa, kromatografi pengecualian ukuran kinerja tinggi, dan spektroskopi resonansi magnetik nuklir.
1 Pendahuluan
Makroalga laut, umumnya disebut rumput laut, secara luas diakui sebagai sumber polisakarida alami yang melimpah di ekosistem laut. Organisme ini mengakumulasi sejumlah besar polisakarida struktural dan penyimpanan di dinding sel mereka, dengan kandungan polisakarida mencapai hingga 70% dari total berat keringnya (Jegadeshwari dan Rajaram 2024 ). Di antara ini, polisakarida tersulfat (SP), kelas unik makromolekul bioaktif yang dicirikan oleh gugus ester sulfat pada residu glikosilnya, sebagian besar terlokalisasi dalam matriks ekstraseluler makroalga laut. SP menunjukkan distribusi taksonomi yang berbeda di seluruh kelompok alga: alga merah ( Rhodophyta ) terkenal karena produksi SP yang bernilai komersial seperti agar dan karagenan; alga coklat ( Phaeophyceae ) adalah sumber utama fukoidan; dan alga hijau ( Chlorophyta ) terutama mensintesis ulvan dan galaktan tersulfat.
Persiapan polisakarida alga, khususnya SP, berbeda secara signifikan dari polisakarida yang berasal dari tumbuhan atau jamur karena struktur kimianya yang berbeda dan lingkungan matriks yang kompleks. Polisakarida alga sering mengandung substituen fungsional, seperti gugus sulfat dan asam uronat, dan tertanam dalam matriks ekstraseluler yang kaya akan protein, lipid, pigmen, dan mineral. Misalnya, ekstraksi karagenan dan fukoidan memerlukan metode yang ditargetkan untuk mengganggu struktur dinding sel yang kaku, yang terdiri dari jaringan selulosa-alginat, untuk melepaskan polisakarida target secara efisien. Selain itu, ekstraksi polisakarida alga harus dengan hati-hati menyeimbangkan pengawetan gugus sulfat (untuk mencegah desulfasi dalam kondisi asam atau basa), sedangkan isolasi polisakarida tanaman (misalnya, pati dan selulosa) terutama berfokus pada pelarutan komponen yang larut dalam air (Martins et al. 2023 ).
Kelompok sulfat yang ada pada SP merupakan fitur struktural yang penting, tidak hanya memberikan sifat fisikokimia yang unik tetapi juga memfasilitasi interaksi spesifik dengan protein seluler dan ekstraseluler. Interaksi ini mendukung kemampuan SP untuk memodulasi proses biologis yang penting, termasuk adhesi sel, proliferasi, dan kaskade koagulasi. Dalam beberapa tahun terakhir, ada minat ilmiah yang berkembang untuk mengeksplorasi potensi bioaktif polisakarida alga, yang didorong oleh biokompatibilitas, biodegradabilitas, hidrofilisitas, dan non-toksisitasnya yang luar biasa, serta sifatnya yang ramah lingkungan dan terbarukan (Nagahawatta et al. 2023 ). Sifat-sifat ini membuat SP sangat menarik untuk aplikasi dalam farmasi, nutraseutika, dan biomaterial.
Pedoman komprehensif ini secara sistematis mengevaluasi metodologi terkini untuk ekstraksi, pemurnian, dan karakterisasi struktural SP dari makroalga (Gambar 1 ). Pedoman yang disajikan di sini bertujuan untuk menjadi sumber daya yang berharga untuk memajukan produksi berkelanjutan produk berbasis SP bernilai tinggi dari biomassa makroalga.

2. Pretreatment Makroalga
- Makroalga mentah menjalani pencucian menyeluruh dengan air suling untuk menghilangkan sisa garam dan kotoran permukaan, diikuti dengan pengeringan pada suhu yang sesuai (40–60°C) untuk mencapai berat konstan;
- Biomassa yang dikeringkan kemudian digiling secara mekanis menjadi bubuk homogen menggunakan penggiling berkecepatan tinggi, memastikan keseragaman ukuran partikel untuk ekstraksi berikutnya;
- Bahan yang berbentuk serbuk mengalami penghilangan lipid dan pigmen melalui ekstraksi pelarut berurutan. Perlakuan awal ini melibatkan penggunaan pelarut organik atau campurannya, termasuk etanol absolut, aseton, metanol, atau sistem pelarut terner yang terdiri dari metanol-kloroform-air (4:2:1, v/v/v) (Dobrinčić et al. 2020 ). Penghilangan pelarut selama proses ekstraksi dan pemurnian (misalnya, etanol, aseton) dicapai melalui penguapan putar (suhu terkontrol pada < 50°C) atau pengeringan vakum untuk memenuhi standar pelarut residu FDA (misalnya, batas residu etanol: < 500 ppm). Pelarut residu diukur melalui kromatografi gas (GC), mengikuti protokol regulasi yang ditetapkan seperti Metode Resmi AOAC 996.11 (Aguilar-Briseño et al. 2015 ; Nagahawatta et al. 2023 ).
3 Ekstraksi
3.1 Ekstraksi Pelarut
3.1.1 Prinsip
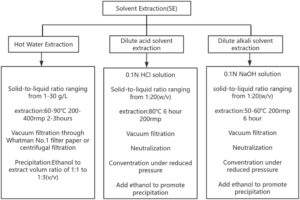
Proses ekstraksi pelarut (SE) dilakukan melalui praperlakuan biomassa makroalga dengan berbagai sistem pelarut, termasuk air panas, asam encer, dan larutan alkali, dalam kondisi suhu yang terkendali. Strategi ekstraksi berbantuan termal ini secara signifikan meningkatkan kelarutan dan efisiensi ekstraksi SP dengan mengganggu struktur dinding sel dan memutus interaksi non-kovalen antara polisakarida dan komponen seluler lainnya dalam makroalga (Xue et al. 2022 ) (Gambar 2 ).
3.1.2 Prosedur Percobaan
- Ekstraksi air panas: Bubuk makroalga yang telah diolah terlebih dahulu disuspensikan dalam air suling pada rasio padat-cair berkisar antara 1 hingga 30 g/L. Ekstraksi dilakukan pada suhu tinggi (60–90°C) dengan pengadukan mekanis terus-menerus (2,0–400 rpm) selama 2–3 jam. Setelah ekstraksi, campuran disaring vakum melalui kertas saring Whatman No. 1 untuk memisahkan residu yang tidak larut. Filtrat yang mengandung SP mentah kemudian dikenai presipitasi etanol, menggunakan rasio volume etanol terhadap ekstrak yang bervariasi dari 1:1 hingga 1:3 (v/v), untuk memfasilitasi presipitasi dan pemurnian polisakarida. Presipitasi diikuti oleh filtrasi vakum atau sentrifugasi (9000 rpm, 10 menit), dengan yang terakhir sangat menguntungkan untuk ekstrak kental karena waktu pemrosesannya yang berkurang dan penyumbatan filter yang diminimalkan. Namun, potensi adhesi polisakarida pada dinding tabung sentrifus harus dipertimbangkan untuk menghindari kehilangan sampel (Alboofetileh, Rezaei, Tabarsa, dan You 2019 ).
- Ekstraksi pelarut asam encer: Bubuk makroalga yang telah diolah terlebih dahulu mengalami hidrolisis asam menggunakan larutan asam klorida (HCl) 0,1 N pada rasio padat-cair 1:20 (b/v). Ekstraksi dilakukan pada suhu 80°C selama 6 jam dengan pengadukan mekanis konstan (200 rpm) untuk memastikan pencampuran yang homogen. Setelah proses ekstraksi, hidrolisat disaring secara berurutan melalui kertas saring Whatman No. 1 dalam vakum untuk memisahkan residu yang tidak larut dalam asam dari ekstrak yang mengandung polisakarida. Filtrat asam kemudian dinetralkan hingga pH 7,0 menggunakan larutan natrium hidroksida (NaOH) 6 N, diikuti dengan pemekatan pada tekanan rendah pada suhu 50°C menggunakan evaporator putar. Ekstrak pekat selanjutnya dicampur dengan etanol dingin untuk mencapai konsentrasi etanol akhir sebesar 75% (v/v) dan dipertahankan pada suhu 25°C selama 24 jam untuk memfasilitasi presipitasi SP (Peasura et al. 2015 ).
- Ekstraksi pelarut alkali encer: Bubuk makroalga yang telah diolah terlebih dahulu didispersikan secara homogen dalam larutan NaOH 0,1 N pada rasio padat-cair 1:20 (b/v). Ekstraksi alkali dilakukan pada suhu 50–60°C selama 6 jam dengan pengadukan mekanis terus-menerus (200 rpm) untuk memastikan efisiensi ekstraksi yang seragam. Setelah proses ekstraksi, campuran alkali disaring secara berurutan melalui kertas saring Whatman No. 1 dalam vakum untuk memisahkan residu yang tidak larut dari ekstrak yang kaya polisakarida. Filtrat alkali kemudian dinetralkan hingga pH 7,0 menggunakan larutan HCl 1 N. Ekstrak yang dinetralkan selanjutnya dipekatkan pada tekanan rendah pada suhu 50°C menggunakan rotary evaporator, diikuti dengan presipitasi dengan etanol dingin untuk mencapai konsentrasi etanol akhir sebesar 75% (v/v). Presipitasi dibiarkan berlangsung pada suhu 25°C selama 24 jam untuk memastikan pemulihan polisakarida yang lengkap (Peasura et al. 2015 ).
3.2 Ekstraksi dengan Bantuan Ultrasonografi
3.2.1 Prinsip
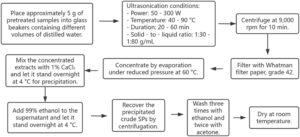
Ekstraksi berbantuan ultrasonik (UAE) memanfaatkan ultrasonik frekuensi tinggi (20–40 kHz) untuk menghasilkan kavitasi akustik, yang menghasilkan kondisi ekstrem terlokalisasi yang mengganggu dinding sel alga. Hal ini meningkatkan penetrasi pelarut dan perpindahan massa, sehingga memudahkan pelepasan SP melalui pencampuran yang lebih baik dan ekstraksi yang efisien (Xue et al. 2022 ) (Gambar 3 ).
3.2.2 Prosedur Percobaan
Sekitar 5 g sampel yang telah diolah terlebih dahulu ditempatkan ke dalam gelas kimia yang berisi berbagai volume air suling. Suspensi tersebut mengalami ultrasonikasi (Hangzhou Hanspire Automation Co. Ltd., Zhejiang, Tiongkok) pada tingkat daya ultrasonik yang ditentukan (50–300 W), suhu (40–90°C), durasi (20–60 menit), dan rasio padatan terhadap air (1,30–1:80 g/mL). (9000 rpm, 10 menit) dan penyaringan (kertas saring Whatman, kelas 42), diikuti oleh konsentrasi melalui penguapan di bawah tekanan rendah pada suhu 60°C. Ekstrak pekat dicampur dengan 1% CaCl2 dan dibiarkan semalam pada suhu 4°C untuk mengendap. Etanol (99%) kemudian ditambahkan ke supernatan dan dibiarkan semalam pada suhu 4°C. SP mentah yang diendapkan dipulihkan dengan sentrifugasi, dicuci tiga kali dengan etanol dan dua kali dengan aseton, kemudian dikeringkan pada suhu kamar (Alboofetileh, Rezaei, Tabarsa, dan You 2019 ).
3.3 Ekstraksi dengan Bantuan Gelombang Mikro
3.3.1 Prinsip
Ekstraksi berbantuan gelombang mikro (MAE) memanfaatkan radiasi elektromagnetik dalam rentang frekuensi 300 MHz hingga 300 GHz untuk menginduksi pemanasan sampel melalui dua mekanisme utama: konduksi ionik dan rotasi dipol molekul pelarut polar. Mekanisme pemanasan unik ini menghasilkan peningkatan suhu internal yang cepat dan penumpukan tekanan berikutnya, yang menyebabkan terganggunya dinding sel alga dan memfasilitasi pelepasan SP intraseluler yang efisien ke dalam pelarut ekstraksi (Xue et al. 2022 ).
3.3.2 Prosedur Percobaan
Sampel yang telah diolah terlebih dahulu (0,85 g) dicampur dalam 15 mL larutan HCl 0,1 M dan dipindahkan ke dalam tabung tahan gelombang mikro 35 mL. Sampel kemudian dikenakan iradiasi gelombang mikro menggunakan sistem Discover and Explorer SP (CEM Corporation, Mathews, NC, AS) dalam kondisi suhu terkendali berkisar antara 90 hingga 130 °C selama 5–30 menit. Setelah iradiasi, campuran disentrifugasi pada 9000 rpm selama 10 menit untuk memisahkan supernatan dari padatan residu. Untuk menghilangkan alginat, supernatan diolah dengan larutan CaCl2 2% (b/v) dan dipertahankan pada suhu 4 °C selama 12 jam. Selanjutnya, presipitasi polisakarida dicapai dengan menambahkan dua volume etanol absolut ke supernatan. SP mentah yang dihasilkan dikumpulkan dengan sentrifugasi dan akhirnya dikeringkan pada suhu 40 °C untuk memperoleh ekstrak (Yuan dan Macquarrie 2015 ).
3.4 Ekstraksi Cairan Bertekanan
3.4.1 Prinsip
Ekstraksi cairan bertekanan (PLE), yang juga dikenal sebagai ekstraksi pelarut yang dipercepat, merupakan teknik yang ramah lingkungan yang memanfaatkan suhu tinggi dan tekanan tinggi untuk meningkatkan efisiensi penetrasi pelarut dan kelarutan senyawa target secara signifikan. Metode ekstraksi canggih ini menghasilkan gangguan efektif pada matriks dinding sel alga melalui gabungan gaya termal dan mekanis, sehingga memfasilitasi pelepasan dan pemulihan SP secara efisien dari biomassa alga.
3.4.2 Prosedur Percobaan
Proses PLE dilakukan dengan menggunakan sistem ekstraksi pelarut yang dipercepat (ASE 350, Dionex, Sunnyvale, CA, AS) yang dilengkapi dengan pengontrol pelarut otomatis. Prosedur ekstraksi melibatkan pengemasan berurutan sel ekstraksi baja tahan karat 22 mL sebagai berikut: dua filter serat kaca ditempatkan di bagian bawah, diikuti oleh lapisan tanah diatom setebal 2 cm, 1 g sampel kering yang telah diolah terlebih dahulu yang dihomogenkan dengan 2 g tanah diatom, dan akhirnya lapisan tanah diatom tambahan untuk mengisi penuh volume sel. Ekstraksi dilakukan dengan menggunakan air suling dan 0,1 MH 2 SO 4 sebagai pelarut di bawah tekanan konstan 1500 psi. Untuk mengoptimalkan efisiensi ekstraksi, berbagai parameter operasional diselidiki, termasuk suhu ekstraksi (60, 100, dan 140 °C), siklus ekstraksi (1 atau 2 siklus), dan durasi ekstraksi (5, 10, dan 15 menit). Setelah ekstraksi, ekstrak yang diperoleh disaring melalui filter membran 0,45 μm, dan presipitasi SPs dicapai dengan menambahkan dua volume etanol absolut ke supernatan, diikuti dengan inkubasi pada suhu 4 °C selama 12 jam (Dobrinčić et al. 2021 ).
3.5 Ekstraksi dengan Bantuan Enzim
3.5.1 Prinsip
Ekstraksi berbantuan enzim (EAE) memanfaatkan hidrolisis enzimatik yang ditargetkan untuk mengganggu integritas struktural dinding sel alga. Teknik ini menggunakan enzim khusus substrat, termasuk protease (misalnya, Alcalase dan Flavourzyme ) untuk degradasi protein dan karbohidrase (misalnya, α-amilase , Viscozyme , dan Celluclast ) untuk pemecahan karbohidrat, yang beroperasi pada suhu dan kondisi pH sedang. Tindakan enzimatik secara selektif membelah ikatan spesifik dalam matriks dinding sel, sehingga memfasilitasi pelepasan polisakarida intraseluler yang efisien sekaligus meningkatkan hasil ekstraksi dan menjaga integritas struktural senyawa target.
3.5.2 Prosedur Percobaan
Bubuk yang telah diolah terlebih dahulu (20 g) dicampur dalam pelarut ekstraksi, dan pH disesuaikan ke tingkat optimal menggunakan larutan NaOH atau HCl 0,1 M. Selanjutnya, jumlah enzim yang telah ditentukan sebelumnya ditambahkan untuk memulai proses ekstraksi. Hidrolisis enzimatik dilakukan dalam kondisi optimal yang spesifik untuk setiap enzim: Alcalase (5% v/v, pH 8,0, 50°C, 24 jam), Celluclast (5% w/v, pH 4,5, 50°C, 24 jam), Viscozyme (5% v/v, pH 4,5, 50°C, 24 jam), dan Flavourzyme (5% v/v, pH 7,0, 50°C, 24 jam). Setelah masa inkubasi, inaktivasi enzim dicapai dengan perlakuan panas pada suhu 95°C selama 15 menit, dengan pendinginan segera dalam penangas es untuk mencegah degradasi termal polisakarida. Hidrolisat kemudian disentrifugasi pada 9000 rpm selama 10 menit untuk membuang serpihan sel dan residu yang tidak terhidrolisis. Supernatan yang telah dijernihkan dipekatkan menggunakan evaporator putar dengan tekanan rendah, dan penghilangan alginat dilakukan melalui presipitasi CaCl2 . Akhirnya, SP dipulihkan melalui presipitasi etanol, yang dicapai dengan menambahkan etanol absolut (99%) secara bertahap ke supernatan yang terkonsentrasi hingga konsentrasi etanol akhir 70% (v/v) tercapai (Alboofetileh, Rezaei, dan Tabarsa 2019 ).
4 Pemurnian
4.1 Kromatografi Kolom Pertukaran Anion Dietilaminoetil Selulosa
4.1.1 Prinsip
Dietilaminoetil selulosa (DEAE-C) adalah resin bermuatan positif yang digunakan dalam kromatografi pertukaran ion untuk pemurnian SP, yang membawa muatan negatif karena adanya gugus sulfat. Resin tersebut terdiri dari manik-manik matriks gel yang difungsikan dengan gugus DEAE, yang mengikat SP bermuatan negatif melalui interaksi elektrostatik. SP yang terikat dapat dielusi dari resin dengan secara bertahap meningkatkan konsentrasi garam pelarut atau menyesuaikan pH larutan, sehingga mengubah interaksi muatan dan melepaskan SP (Martins et al. 2023 ).
4.1.2 Prosedur Percobaan
Sebanyak 200 mg SP mentah dilarutkan dalam 4 mL buffer natrium asetat 0,5 M (pH 6,0) dan selanjutnya dimuat ke kolom kromatografi pertukaran anion yang diisi dengan selulosa DEAE (50 g, Whatman International Ltd., Maidstone, Inggris). Konsentrasi pemuatan adalah parameter kritis dalam kromatografi DEAE-selulosa yang memerlukan pengoptimalan cermat untuk mencapai resolusi optimal, karena sampel polisakarida menunjukkan variasi signifikan dalam viskositas dan komposisi. Untuk SP yang sangat bermuatan dan kental (misalnya, fukoidan), konsentrasi pemuatan yang lebih rendah (<50 mg/mL) direkomendasikan untuk mencegah penyumbatan kolom dan mempertahankan profil elusi yang dapat direproduksi. Sebaliknya, polisakarida yang kurang kental (misalnya, karagenan) dapat mentoleransi konsentrasi pemuatan yang lebih tinggi (50–100 mg/mL), meskipun pengujian pendahuluan diperlukan untuk mengonfirmasi resolusi dan mencegah pelebaran puncak atau ko-elusi (Martins et al. 2023 ; Majdoub et al. 2009 ). Kolom tersebut diekuilibriumkan terlebih dahulu dengan tiga volume kolom buffer natrium asetat 0,5 M (pH 6,0). Setelah aplikasi sampel, kolom dielusi secara bertahap dengan larutan NaCl (0,1, 0,2, 0,4, 0,6, dan 0,8 M) yang disiapkan dalam buffer natrium asetat 0,5 M pada laju alir konstan 2,5 mL/menit. Pencucian akhir dengan larutan amonium karbonat jenuh dilakukan untuk memastikan elusi lengkap. Fraksi polisakarida utama dikumpulkan menggunakan pengumpul fraksi dan diidentifikasi dengan metode fenol-asam sulfat. Fraksi yang sesuai digabungkan, didialisis, dipekatkan, dan dikeringkan beku untuk mendapatkan fraksi SP murni untuk analisis selanjutnya (Majdoub et al. 2009 ) (Gambar 4 ).

4.2 Kromatografi Pengecualian Ukuran
4.2.1 Prinsip
Kromatografi pengecualian ukuran (SEC) merupakan teknik pemisahan yang banyak digunakan untuk mengisolasi dan memfraksinasi SP berdasarkan ukuran molekul dan distribusi beratnya. Mekanisme pemisahan didasarkan pada partisi molekul yang berbeda antara fase gerak dan fase diam, di mana matriks gel berpori dengan ukuran pori yang terkontrol berfungsi sebagai fase diam (Martins et al. 2023 ).
4.2.2 Prosedur Percobaan
Pemurnian SPs dengan kromatografi pengecualian ukuran (SEC) dilakukan menggunakan kolom Sephadex G-100 (2,6 cm × 70 cm) yang diseimbangkan dengan 0,1 M NaCl dalam 0,05 M buffer fosfat (pH 7,0). Ekstrak SPs mentah dilarutkan dalam buffer yang sama, disentrifugasi pada 10.000 × g selama 10 menit, dan disaring melalui membran 0,22 μm sebelum dimasukkan ke dalam kolom. Elusi dilakukan pada laju alir 0,5 mL/menit, dan fraksi dikumpulkan dan dipantau pada 280 dan 490 nm menggunakan metode fenol-asam sulfat. Fraksi-fraksi yang kaya polisakarida dikumpulkan, didialisis terhadap air suling selama 24–48 jam untuk menghilangkan garam, dipekatkan, dan dikeringkan beku untuk memperoleh SP murni, yang disimpan pada suhu −20°C untuk analisis lebih lanjut (Shi et al. 2012 ).
4.3 Filtrasi Membran
4.3.1 Prinsip
Teknik filtrasi membran, yang meliputi diafiltrasi, ultrafiltrasi, reverse osmosis, dan nanofiltrasi, merupakan pendekatan yang efektif untuk pemurnian dan fraksinasi SP menurut karakteristik berat molekulnya. Teknik-teknik ini menggunakan membran semipermeabel dengan batas berat molekul (MWCO) yang ditetapkan secara tepat yang memungkinkan lewatnya molekul secara selektif berdasarkan ukurannya (Aguilar-Briseño et al. 2015 ).
4.3.2 Prosedur Percobaan
Larutan SPs yang diekstraksi awalnya diolah terlebih dahulu dengan penyaringan melalui membran dengan ukuran pori 0,45 μm untuk mencegah pengotoran pada membran ultrafiltrasi. Ultrafiltrasi dilakukan menggunakan Sistem Ultrafiltrasi Millipore (Millipore, AS) yang dilengkapi dengan membran dengan luas efektif 0,1 m 2 . Larutan umpan dipompa secara tangensial melintasi permukaan membran, dan filtrat dikumpulkan sementara retentat disirkulasikan kembali ke tangki umpan. Proses ini berlanjut hingga larutan umpan dipekatkan hingga sekitar seperenam dari volume aslinya. Retentat pekat diproses lebih lanjut dengan penguapan putar, presipitasi etanol, dan liofilisasi. Filtrat dari setiap langkah ultrafiltrasi berfungsi sebagai larutan umpan untuk ultrafiltrasi berikutnya menggunakan membran dengan batas berat molekul nominal yang semakin kecil. Fraksinasi berurutan ini memungkinkan identifikasi distribusi berat molekul SPs (Aguilar-Briseño et al. 2015 ).
5 Karakterisasi Struktural
5.1 Kromatografi Cair Kinerja Tinggi Fase Terbalik (RP-HPLC)
Komposisi monosakarida SP diukur dengan RP-HPLC setelah derivatisasi pra-kolom seperti yang dijelaskan oleh Qi et al. ( 2012 ) dan Zhang et al. ( 2009 ). Proses pengukuran terperinci ditunjukkan di bawah ini:
5.1.1 Hidrolisis SP
Sampel SPs (15,0–20,0 mg) dilarutkan dalam 2,0 mL asam trifluoroasetat (TFA) 2 mol/L dalam ampul tertutup 10 mL di bawah atmosfer nitrogen. Ampul diinkubasi pada suhu 110°C selama 4 jam untuk memastikan hidrolisis lengkap. Setelah inkubasi, ampul didinginkan hingga suhu ruangan, dan campuran reaksi dinetralkan hingga pH 7,0 menggunakan 2 mol/L NaOH. Selanjutnya, 2,0 mL larutan standar internal ditambahkan ke dalam campuran, yang kemudian diaduk secara menyeluruh dan diencerkan hingga volume akhir 10 mL dengan air suling. Larutan disaring melalui membran 0,22 μm, dan filtrat dikumpulkan untuk diderivatisasi dengan 1-fenil-3-metil-5-pirazolon (PMP) sebelum analisis lebih lanjut.
5.1.2 Persiapan Larutan Referensi Monosakarida
Sejumlah ribosa yang ditimbang secara akurat (sekitar 1 mmol) dilarutkan dalam air suling dan diencerkan hingga volume akhir 50 mL untuk menyiapkan larutan standar internal. Secara terpisah, campuran standar monosakarida, termasuk manosa, rhamnosa, asam glukuronat, glukosa, galaktosa, xilosa, dan fukosa (masing-masing 0,1 mmol), dilarutkan dalam air suling. Selanjutnya, 5,0 mL larutan standar internal ditambahkan ke campuran monosakarida, dan larutan gabungan diencerkan hingga volume akhir 50 mL dengan air suling. Larutan yang dihasilkan disimpan untuk derivatisasi dengan PMP sebelum analisis lebih lanjut.
5.1.3 Derivatisasi Dengan PMP
Larutan metanol PMP 0,5 mol/L (100 μL) dan NaOH 0,3 mol/L (100 μL) ditambahkan ke larutan referensi monosakarida (masing-masing 100 μL). Campuran diinkubasi pada suhu 70°C selama 30 menit untuk memfasilitasi derivatisasi. Setelah inkubasi, campuran reaksi didinginkan hingga 8°C dan dinetralkan dengan HCl 0,3 mol/L. Selanjutnya, 1 mL kloroform ditambahkan ke dalam larutan, dan campuran diaduk dengan cepat untuk memastikan pencampuran menyeluruh. Campuran kemudian disentrifugasi pada 5000 putaran/menit selama 10 menit pada suhu 6–8°C untuk memisahkan fase-fase tersebut. Lapisan kloroform dibuang dengan hati-hati, dan lapisan air diekstraksi dua kali dengan kloroform untuk menghilangkan sisa PMP dan pengotor lainnya. Lapisan air terakhir disaring melalui membran 0,22 μm dan dianalisis langsung dengan HPLC.
5.1.4 Kromatografi
Analisis kromatografi dilakukan dalam kondisi berikut: kolom YMC-Pack ODS-AQ (250 × 4,6 mm, 5 μm) yang dipertahankan pada suhu 25°C digunakan untuk pemisahan. Fase bergerak terdiri dari dua pelarut: pelarut A, campuran 0,4% trietilamina dalam 20 mmol/L buffer amonium asetat (pH 6,30, disesuaikan dengan asam asetat) dan asetonitril (9:1, v/v), dan pelarut B, campuran 0,4% trietilamina dalam 20 mmol/L buffer amonium asetat (pH 6,30) dan asetonitril (4:6, v/v). Program elusi gradien diterapkan sebagai berikut: 10%–14% pelarut B selama 9 menit, 14%–64% pelarut B dari 9 hingga 30 menit, dan 64% pelarut B selama 5 menit berikutnya, dengan laju alir konstan 1 mL/menit. Eluat dipantau pada panjang gelombang deteksi 245 nm menggunakan detektor UV.
5.1.5 Perhitungan Kandungan Monosakarida
Menggunakan ribosa sebagai standar internal, faktor koreksi untuk setiap monosakarida dihitung menggunakan Persamaan ( 1 ):
![]()
di mana A s dan A i masing-masing merupakan luas puncak standar ribosa internal dan monosakarida standar dalam larutan referensi; W s dan W i masing-masing merupakan kandungan standar ribosa internal dan monosakarida standar dalam larutan referensi.
Kandungan setiap monosakarida dalam larutan hidrolisis polisakarida ( W ) dihitung dengan Persamaan ( 2 ):
![]()
di mana A s dan A i masing-masing merupakan luas puncak ribosa standar internal dan monosakarida dalam larutan pereduksi polisakarida; W s merupakan kandungan ribosa standar internal dalam larutan hidrolisis polisakarida.
5.2 Kromatografi Pertukaran Anion Kinerja Tinggi (HPAEC)
Komposisi monosakarida dianalisis menggunakan kromatografi pertukaran anion kinerja tinggi dengan deteksi amperometrik berdenyut (HPAEC-PAD), mengikuti metodologi yang ditetapkan (Jol et al. 1999 ; De Ruiter et al. 1992 ). Prosedur spesifiknya adalah sebagai berikut:
5.2.1 Hidrolisis SP
Di bawah perlindungan nitrogen, 15,0–20,0 mg sampel SP ditempatkan dalam ampul tertutup 10 mL, dan 2,0 mL asam trifluoroasetat (TFA) 2 mol/L ditambahkan. Ampul diinkubasi pada suhu 110°C selama 4 jam untuk memastikan hidrolisis sampel yang lengkap. Setelah inkubasi, didinginkan hingga suhu ruangan, dan campuran reaksi dinetralkan hingga pH 7,0 dengan larutan NaOH 2 mol/L. Selanjutnya, 2,0 mL larutan standar internal ditambahkan ke dalam campuran, diaduk secara menyeluruh, lalu diencerkan hingga 10 mL dengan air suling. Larutan yang diperoleh disaring melalui membran 0,22 μm, dan filtrat dikumpulkan untuk derivatisasi selanjutnya dengan 1-fenil-3-metil-5-pirazolon (PMP).
5.2.2 Persiapan Larutan Referensi Monosakarida
Sekitar 1 mmol ribosa ditimbang dengan teliti, dilarutkan dalam air suling, dan diencerkan hingga 50 mL untuk menyiapkan larutan standar internal. Secara terpisah, manosa, rhamnosa, asam glukuronat, glukosa, galaktosa, xilosa, dan fukosa (masing-masing 0,1 mmol) ditimbang dan dilarutkan dalam air suling. Kemudian, 5,0 mL larutan standar internal yang disebutkan di atas ditambahkan, dan larutan akhirnya diencerkan hingga 50 mL dengan air suling. Larutan ini digunakan untuk derivatisasi dan analisis PMP berikutnya.
5.2.3 Derivatisasi Dengan PMP
Seratus mikroliter masing-masing larutan referensi monosakarida diambil, dan 100 μL larutan metanol PMP 0,5 mol/L dan 100 μL larutan NaOH 0,3 mol/L ditambahkan. Campuran diinkubasi pada suhu 70°C selama 30 menit untuk menyelesaikan reaksi derivatisasi. Setelah inkubasi, campuran didinginkan hingga 8°C dan dinetralkan dengan larutan HCl 0,3 mol/L. Selanjutnya, 1 mL kloroform ditambahkan ke dalam larutan, yang kemudian diaduk dengan kuat untuk pencampuran menyeluruh. Campuran disentrifugasi pada 5000 r/menit selama 10 menit pada suhu 6–8°C untuk memisahkan fase organik dan fase berair. Lapisan kloroform dibuang dengan hati-hati, dan fase berair diekstraksi dua kali dengan kloroform untuk menghilangkan sisa PMP dan pengotor lainnya. Akhirnya, fase air disaring melalui membran 0,22 μm dan langsung digunakan untuk analisis HPAEC.
5.2.4 Kromatografi
Analisis kromatografi dilakukan menggunakan kromatografi ion Dionex ICS-5000+ yang dilengkapi dengan kolom analitis yang sesuai. Kondisi kromatografi adalah sebagai berikut: suhu kolom dipertahankan pada 30°C; fase mobil A adalah larutan natrium hidroksida 100 mmol/L, dan fase mobil B adalah campuran natrium asetat 500 mmol/L dan natrium hidroksida 100 mmol/L. Program elusi gradien diterapkan: dari 0 hingga 10 menit, konsentrasi fase mobil B meningkat secara linear dari 0% menjadi 20%; dari 10 hingga 30 menit, konsentrasi fase mobil B meningkat dari 20% menjadi 60%; dari 30 hingga 35 menit, konsentrasi fase mobil B dipertahankan pada 60%, dan laju alir ditetapkan pada 0,8 mL/menit. Eluat dipantau oleh detektor amperometrik berdenyut (PAD) dalam kondisi deteksi tertentu. Metode ini dapat mendeteksi berbagai monosakarida secara bersamaan, dan batas kuantifikasi untuk setiap gula adalah sekitar 12,5 × 10 −3 nmol, dengan linearitas yang baik pada rentang konsentrasi yang luas (De Ruiter et al. 1992 ).
5.2.5 Perhitungan Kandungan Monosakarida
Menggunakan ribosa sebagai standar internal, faktor koreksi untuk setiap monosakarida dihitung menurut Persamaan ( 3 ):
![]()
di mana A s dan A i masing-masing merupakan luas puncak standar ribosa internal dan monosakarida standar dalam larutan referensi; W s dan W i masing-masing merupakan kandungan standar ribosa internal dan monosakarida standar dalam larutan referensi.
Kandungan masing-masing monosakarida ( W ) dalam hidrolisat polisakarida dihitung menurut Persamaan ( 4 ):
![]()
di mana A s dan A i masing-masing merupakan luas puncak standar ribosa internal dan monosakarida dalam hidrolisat polisakarida; W s merupakan kandungan standar ribosa internal dalam hidrolisat polisakarida.
5.3 Kromatografi Gas-Deteksi Massa
Pola ikatan glikosidik dan posisi gugus sulfat dalam SP ditentukan menggunakan analisis kromatografi gas-spektrometri massa/deteksi ionisasi nyala (GC-MS/FID) dari alditol asetat yang termetilasi sebagian (PMAA), mengikuti metodologi yang dijelaskan oleh Hentati et al. ( 2022 ) dan Hentati et al. ( 2018 ).
5.3.1 Permetilasi
Sepuluh gram bubuk SPs disuspensikan dalam 2 mL dimetil sulfoksida (DMSO) dan diaduk pada suhu 60°C dalam tabung gelas yang disegel dengan tutup ulir berlapis PTFE di bawah atmosfer nitrogen (N2 ) . Setelah mendinginkan tabung ke suhu ruangan, sekitar 200 mg pelet natrium NaOH yang baru digiling ditambahkan, dan campuran tersebut diaduk secara magnetis selama 2 jam dalam tabung tertutup rapat di bawah N2 . Selanjutnya, 1,2 mL metil iodida (MeI) ditambahkan, dan tabung ditutup kembali dengan tutup ulir berlapis PTFE, dibungkus dengan aluminium foil, dan diaduk secara magnetis selama 3 jam tambahan. Campuran reaksi kemudian didinginkan di atas es, dan 3 mL diklorometana (DCM) ditambahkan. Campuran tersebut dipartisi dua kali dengan 5 mL asam asetat 10% dalam air deionisasi (v/v), diikuti oleh dua partisi dengan 5 mL air deionisasi. Setelah setiap langkah partisi, fase air bagian atas dikumpulkan dengan hati-hati dan ditampung ke dalam tabung baru. Fase bagian bawah diuapkan hingga kering di bawah aliran N 2 yang lembut . Fase air yang ditampung dipekatkan hingga setengah volumenya di bawah aliran N 2 , kemudian dipindahkan kembali ke dalam tabung asal yang berisi fase bawah yang telah dikeringkan. Campuran gabungan dipindahkan ke dalam tabung dialisis selulosa yang diregenerasi dengan batas berat molekul (BMCO) 60,0–8000 Da. Tabung gelas asal dibilas dua kali dengan 1 mL etanol, dan setiap pencucian dipindahkan ke dalam tabung dialisis. Dialisis dilakukan terhadap air mengalir semalaman, diikuti oleh 24 jam dialisis terhadap 4 L trietilamonium karbonat (TEAC) 0,1 M dan 24 jam dialisis lainnya terhadap 4 L air deionisasi. Sampel yang didialisis dikeringkan beku untuk memperoleh produk kering dalam bentuk garam trietilamonium (TEA).
5.3.2 Hidrolisis Asam
Setiap sampel dihidrolisis dengan pengadukan magnetik dalam 2 mL asam trifluoroasetat (TFA) 4 M pada suhu 100°C selama 4 jam dalam tabung gelas yang disegel dengan tutup ulir berlapis PTFE di bawah atmosfer N 2 . Setelah hidrolisis, tabung didinginkan hingga suhu ruangan, dan campuran reaksi diuapkan hingga kering di bawah aliran N 2 yang lembut .
5.3.3 Pengurangan
Sekitar 2 mL larutan natrium borodeuterida (NaBD 4 ) yang baru disiapkan dalam air deionisasi (10 mg/mL, b/v) ditambahkan ke setiap tabung. Campuran tersebut diaduk secara magnetis semalaman pada suhu ruangan dalam tabung tertutup dengan tutup berlapis PTFE. Setelah reaksi, tutupnya dilepas dengan hati-hati, dan asam asetat glasial ditambahkan tetes demi tetes hingga desisan berhenti, yang menunjukkan pelepasan gas hidrogen (H 2 ) secara menyeluruh. Campuran reaksi tersebut kemudian diuapkan hingga kering di bawah aliran N 2 yang lembut .
5.3.4 Perasetilasi dan Pembersihan Akhir
Bahasa Indonesia: Pada setiap tabung yang berisi sampel kering, ditambahkan 0,25 mL TFA dan 1,25 mL anhidrida asetat. Campuran diaduk secara magnetis pada suhu 60°C selama 1 jam dalam tabung tertutup rapat di bawah atmosfer nitrogen. Setelah dingin, campuran reaksi diuapkan hingga kering. Residu kemudian dikenakan partisi: pertama, dengan 3 mL DCM dan 3 mL larutan natrium bikarbonat jenuh (NaHCO 3 ) dalam air deionisasi, diulang dua kali. Selama langkah ini, tabung ditutup longgar dan diaduk dengan kuat selama 10 menit untuk memungkinkan pelepasan karbon dioksida (CO 2 ) yang dihasilkan selama reaksi. Selanjutnya, sampel dipartisi tiga kali dengan 3 mL air deionisasi, dengan tabung tertutup rapat dan diputar pada pemutar tabung selama 20 menit per partisi. Setelah setiap langkah partisi, fase air atas dikeluarkan dan dibuang dengan hati-hati, sedangkan fase DCM bawah dipertahankan. Setelah pemisahan akhir, fase DCM disaring melalui pipet Pasteur yang disumbat wol kaca yang berisi natrium sulfat anhidrat (Na2SO4 ) untuk menghilangkan sisa air. Larutan DCM yang disaring diuapkan hingga kering di bawah aliran N2 yang lembut . Sampel yang dikeringkan dilarutkan kembali dalam etil asetat dan dipindahkan ke botol GC untuk analisis GC-MS berikutnya .
5.3.5 Analisis GC-MS
Semua PMAA dianalisis menggunakan sistem GC-MS Agilent 7890A-5977B (Agilent Technologies, Santa Clara, CA, AS) yang dilengkapi dengan kolom kapiler Supelco SP-2380 berpolaritas sedang (60 m × 0,25 mm × 0,2 μm; Sigma-Aldrich, St. Louis, MO, AS). Helium digunakan sebagai gas pembawa pada laju aliran konstan 0,8 mL/menit. Suhu saluran masuk dipertahankan pada 250°C, dan setiap sampel (1 μL) disuntikkan secara otomatis dengan rasio split 10:1. Penundaan pelarut selama 12 menit diterapkan untuk menghindari saturasi detektor. Program suhu oven dimulai pada 120°C (dipertahankan selama 1 menit), ditingkatkan pada kecepatan 3°C/menit hingga 200°C (dipertahankan selama 50 menit), dan selanjutnya ditingkatkan hingga 250°C (dipertahankan selama 20 menit). Suhu jalur transfer ditetapkan pada 280°C. Spektrum massa diperoleh dalam mode ionisasi elektron (EI) pada 70 eV, dengan suhu sumber ion 230°C dan suhu kuadrupol 150°C. Spektrometer massa dioperasikan dalam mode pemindaian penuh, memindai rentang massa m / z 45–350 pada kecepatan 4,59 pemindaian per detik. Akuisisi data, penugasan puncak, dan integrasi puncak dilakukan menggunakan perangkat lunak Agilent OpenLab CDS versi 2.5 (Agilent Technologies, Santa Clara, CA, AS).
5.4 Kromatografi Pengecualian Ukuran Kinerja Tinggi
Berat molekul ( M W ) dan distribusi berat molekul SP dapat dicapai melalui kromatografi pengecualian ukuran kinerja tinggi yang digabungkan dengan hamburan cahaya laser multisudut dan deteksi indeks bias (HPSEC-MALLS-RI) (Tabarsa et al. 2012 ; Tabarsa et al. 2018 ).
5.4.1 Persiapan Solusi SP
Dua puluh miligram SP dilarutkan dalam 2 mL air suling, dan larutan dipanaskan selama 30 detik menggunakan oven gelombang mikro (Model #4872, Parr Instrument Co., Moline, IL, AS). Setelah pemanasan, larutan sampel disaring melalui membran selulosa asetat dengan ukuran pori 3,0 μm (Whatman International) untuk menghilangkan partikel apa pun. Larutan yang disaring kemudian disuntikkan ke dalam sistem HPSEC-MALLS-RI untuk analisis lebih lanjut.
5.4.2 HPSEC-MALLS-RI
Sistem HPSEC-MALLS-RI terdiri dari komponen-komponen berikut: sebuah pompa (Model 321, Gilson, Middleton, WI, AS), sebuah katup injektor yang dilengkapi dengan loop sampel 100 μL (Model 7072, Rheodyne), sebuah kolom pelindung (TSK PWxl, TosoBiosep, Montgomeryville, PA, AS), dan tiga kolom kromatografi pengecualian ukuran (SEC) (TSK G5000 PW, 7,5 × 600 mm; TSK G3000 PWxl, 7,8 × 300 mm; TSK G2500 PWxl, 7,8 × 300 mm; TosoBiosep, Montgomeryville, PA, AS). Deteksi dicapai dengan menggunakan detektor MALLS (HELEOS, Wyatt Technology Corp., Santa Barbara, CA, AS) dan detektor RI (RI-150, Thermo Electron Corp., Yokohama, Jepang). Fase bergerak terdiri dari larutan berair yang mengandung 0,15 M natrium nitrat (NaNO 3 ) dan 0,02% natrium azida (NaN 3 ), yang disalurkan pada laju alir konstan 0,4 mL/menit.
5.4.3 Analisis HPSEC-MALLS-RI
M w , jari-jari girasi ( R g ) dan polidispersitas ditentukan menggunakan perangkat lunak ASTRA 5.3 (Wyatt Technology Corp., Santa Barbara, CA, AS). Volume girasi spesifik (SV g ) dihitung menggunakan persamaan berikut:
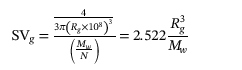
di mana N adalah bilangan Avogadro (6,02 × 10 23 /mol) dan satuan untuk SV g , M w dan R g masing-masing adalah cm 3 /g, g/mol dan nm.
5.5 Spektroskopi Resonansi Magnetik Nuklir
Konfigurasi anomerik, urutan gula, dan posisi substituen, seperti gugus sulfat, dapat ditentukan menggunakan spektroskopi resonansi magnetik nuklir (NMR), termasuk eksperimen satu dimensi (1D) dan dua dimensi (2D), seperti yang dijelaskan oleh Kravchenko et al. ( 2020 ).
5.5.1 Persiapan Sampel
Sekitar 1–2 mg SP dilarutkan dalam 0,5 mL deuterium oksida (D2O , 99,9%) dan mengalami siklus pengeringan beku berulang untuk menghilangkan proton yang dapat dipertukarkan. Sampel kemudian disimpan dalam desikator yang berisi fosfor pentoksida dalam kondisi vakum semalaman pada suhu ruangan untuk memastikan pengeringan yang menyeluruh. Sampel yang benar-benar kering kemudian dilarutkan kembali dalam 0,5 mL D2O dengan kemurnian tinggi ( 99,96%), disaring melalui filter jarum suntik 0,45 μm untuk menghilangkan partikel, dan dipindahkan ke dalam tabung NMR berdiameter luar 5,0 mm × 25 cm (Wilmad Glass Co., Buena, NJ, AS). Pergeseran kimia dilaporkan dalam bagian per juta (ppm) relatif terhadap standar eksternal, asam trimetilsililpropionat (TSP).
5.5.2 Instrumen NMR
Spektrum NMR diperoleh menggunakan spektrometer BRUKER Advance DRX 500 (Bruker BioSpin, Rheinstetten, Jerman) yang dilengkapi dengan kepala probe gradien tidak langsung 5 mm yang mampu mendeteksi 1 H, 13 C, dan 31 P.
5.5.3 Proses Pengukuran NMR 1D
Percobaan NMR dioperasikan dengan lebar spektral 3000 Hz dengan parameter akuisisi berikut: (i) untuk percobaan 1 H, pemulihan = 5 detik (untuk pengembalian lengkap setelah pulsa 90°), mode akuisisi = 2 detik, pulsa 90° = 8 µsec; jumlah pemindaian = 64; dan (ii) untuk percobaan 13 C, jumlah pemindaian = 16.384, mode akuisisi = 0,34 detik, pemulihan = 2 detik, pulsa = 7 µsec, akumulasi selama 11 jam.
5.5.4 Proses Pengukuran NMR 2D
Spektrum korelasi 2D 1 H– 1 H diperoleh dengan urutan pulsa standar yang digunakan untuk spektroskopi korelasi filter kuantum ganda (DQF-COSY). Spektrum spektroskopi korelasi total (TOCSY) diperoleh dengan menggunakan waktu pencampuran 100 ms dan penundaan relaksasi 2 detik. Spektroskopi efek Overhauser nuklir (NOESY) dan spektrum koherensi kuantum tunggal heteronuklir (HSQC) diperoleh dengan menggunakan urutan pulsa standar. Spektrum korelasi ikatan ganda heteronuklir (HMBC) yang peka terhadap fase direkam dengan penundaan relaksasi 1,5 detik. Data eksperimen diproses pada perangkat lunak MestReNOVA 5.3.1 (Mestrelab Research SL, CA) (Ferreira et al. 2012 ).
6 Kesimpulan
Studi ini menyajikan evaluasi komprehensif atas metodologi ekstraksi, pemurnian, dan karakterisasi struktural untuk SP yang berasal dari makroalga. Tinjauan ini menetapkan kerangka metodologi standar untuk optimasi produksi SP, yang menyoroti potensi signifikannya dalam pengembangan pangan fungsional, aplikasi farmasi, dan biomaterial canggih. Keterbatasan saat ini, khususnya kendala ekonomi dari proses enzimatik dan kurangnya standar karakterisasi yang seragam, diperiksa secara kritis. Arah penelitian di masa mendatang harus memprioritaskan: (1) pengembangan teknologi ekstraksi yang hemat biaya, (2) pembentukan protokol analitis standar, dan (3) investigasi sistematis hubungan struktur-aktivitas untuk sepenuhnya mewujudkan potensi bioteknologi SP makroalga.

