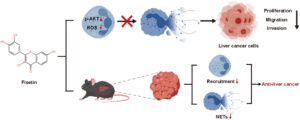
ABSTRAK
Kanker hati (KHL) merupakan salah satu tumor ganas yang paling umum di saluran pencernaan. Angka kejadian yang tinggi, tingkat metastasis dan kekambuhan yang tinggi, prognosis yang buruk, dan heterogenitas kanker hati sangat mengancam kesehatan manusia. Sangat penting untuk mencari obat baru dan target baru untuk melawan kanker hati. Obat alami telah terbukti memiliki efek antitumor yang baik. Fisetin, flavonoid makanan yang sering ditemukan dalam buah-buahan dan sayuran, memiliki banyak fungsi farmakologis seperti antiperadangan, antioksidasi, pengaturan kekebalan tubuh, dan antitumor. Pertama, kami menemukan secara in vitro bahwa fisetin dapat menghambat proliferasi, migrasi, dan invasi sel kanker hati. Analisis bioinformatika berspekulasi bahwa mekanisme antikanker hati mungkin terkait dengan pembentukan perangkap ekstraseluler neutrofil (NET). Kemudian, neutrofil diekstraksi dari relawan yang sehat, dan ditemukan bahwa fisetin dapat menghambat pembentukan NET melalui sumbu AKT/ROS. Kemudian, sel kanker hati dikultur dalam medium yang mengandung NET. Kami menemukan bahwa fisetin dapat melemahkan proliferasi, migrasi, dan invasi sel kanker hati yang disebabkan oleh NET. Terakhir, kami menemukan bahwa fisetin dapat menghambat pertumbuhan tumor pada tikus C57BL/6. Fisetin dapat menghambat perekrutan neutrofil dan tingkat NET dalam jaringan tumor. Sebagai kesimpulan, kami menemukan bahwa fisetin dapat digunakan sebagai penghambat NET baru dan semakin memperjelas efek antikanker hati dari fisetin.
1 Pendahuluan
Kanker hati (LC) adalah salah satu tumor ganas yang paling umum. Insiden kanker globalnya menempati urutan keenam, dan tingkat kematiannya menempati urutan ketiga. Di Tiongkok, insiden kankernya menempati urutan keempat, dan tingkat kematiannya menempati urutan kedua (Sung et al. 2021 ). Insentif umum untuk kanker hati meliputi infeksi virus hepatitis, gangguan metabolisme, alkohol, disfungsi imun, dan cedera hati akibat obat (Reig et al. 2018 ). Transplantasi hati, reseksi tumor, terapi target molekuler, terapi intervensi, dan kemoterapi obat semuanya saat ini merupakan metode pengobatan kanker hati klinis yang umum digunakan. Namun, karena karakteristik klinis kanker hati, seperti tidak ada gejala yang jelas pada tahap awal, perkembangan penyakit yang cepat, metastasis tinggi, dan ketidakpekaan terhadap kemoterapi, kemanjuran bedah sebagian besar pasien tidak baik, dan mereka rentan terhadap berbagai komplikasi. Selain itu, obat kemoterapi rentan terhadap resistensi obat selama penggunaan, dan kualitas hidup pasien belum meningkat secara signifikan (Anwanwan et al. 2020 ). Oleh karena itu, sangat penting untuk mencari obat baru dan target baru untuk antikanker hati.
Banyak penelitian telah menemukan bahwa beberapa komponen alami yang diekstrak dari tanaman memiliki keuntungan yang jelas dalam proses pengobatan tumor, seperti toksisitas rendah, efek samping kecil, beberapa target aksi, dan kecenderungan rendah untuk mengembangkan resistansi obat, yang dapat memberikan opsi baru untuk menghambat terjadinya dan perkembangan tumor (Zhang et al. 2025 ; Zhu et al. 2023 ). Fisetin adalah flavonoid makanan umum, banyak terdapat dalam buah-buahan dan sayuran seperti apel, stroberi, bawang, dan mentimun. Fisetin banyak digunakan dalam pengobatan penyakit (Kashyap et al. 2019 ). Penelitian telah menunjukkan bahwa fisetin dapat memberikan efek anti-tumor secara in vitro dan in vivo melalui beberapa target dan jalur, termasuk jalur sinyal seperti mTOR (Roy et al. 2021 ), Wnt/β-catenin (Fu et al. 2025 ), NF-κB, dan AMPK (Afroze et al. 2022 ), tetapi mekanisme anti-kanker hati masih harus diklarifikasi.
Lingkungan mikro tumor (TME) adalah “tanah” untuk pertumbuhan sel tumor dan terdiri dari berbagai faktor seluler dan non-seluler. Neutrofil adalah sel darah putih heterogen yang ada di TME. Di bawah stimulasi sitokin yang disekresikan oleh berbagai tumor, mereka akan melepaskan asam nukleat, protein, dan zat lainnya sendiri. Struktur retikuler dengan DNA sebagai rangka dan tertanam dengan protein granular seperti elastase neutrofil (NE) dan mieloperoksidase (MPO) terbentuk, yang disebut perangkap ekstraseluler neutrofil (NETs) (Herre et al. 2023 ), dan proses ini disebut NETosis. Penelitian telah menunjukkan bahwa kadar penanda NETs dalam serum dan jaringan tumor pasien dengan kanker hati lebih tinggi daripada orang sehat (Kajioka et al. 2021 ). NET meningkatkan pertumbuhan dan metastasis karsinoma hepatoseluler (HCC), yang terutama terwujud sebagai peningkatan angiogenesis, peningkatan migrasi sel yang terkait dengan transisi epitel-mesenkim (EMT) (Jiang et al. 2022 ), peningkatan degradasi matriks ekstraseluler (ECM) yang diinduksi oleh metaloproteinase matriks (MMP), dan peningkatan penangkapan sel yang dimediasi oleh NET (Yang et al. 2020 ). Oleh karena itu, menghambat pembentukan NET dapat menjadi target potensial untuk pengobatan kanker hati.
Kami menyelidiki efek antikanker hati fisetin baik secara in vivo maupun in vitro. Mekanismenya mungkin terkait dengan penghambatan perangkap ekstraseluler neutrofil. Kami menawarkan dukungan penelitian dasar untuk efek antitumor fisetin dan juga menyajikan strategi baru untuk pengobatan kanker hati.
2 Bahan dan Metode
2.1 Reagen dan Antibodi
Media DMEM (GIBICO, 11965092), serum sapi janin (GIBICO, A5670801), media RPMI 1670 (GIBICO, 12633020), PBS (GIBICO, 10010023), Fisetin (Herb-substance, PCS0750), larutan pewarna kristal violet (Beyotime, C0121), matrigel (Beyotime, C0372) dan DAPI (Beyotime, C1005), bilik Transwell (Corning, 353097), PMA (Aladdin, P408905), antibodi CitH3 (Abcam, Ab5103), GAPDH (Proteintech, 10494-1-AP), MPO (Proteintech, 22225-1-AP), Ki67 (Proteintech, 27309-1-AP), antibodi Ly6G (Biolegend, 127636), dan kit CCK-8 (C0038, Beyotime).
2.2 Kultur Sel
Sel kanker hati, yaitu HepG2, Huh-7, Hepa1-6, dan MHCC97H, dikultur dalam medium lengkap DMEM yang mengandung 10% FBS dan 1% antibiotik (penisilin dan streptomisin). Ketika kepadatan sel mencapai 80%, sel-sel tersebut dikultur ulang untuk langkah percobaan berikutnya. Neutrofil dikultur dalam medium lengkap RPMI 1640.
2.3 CCK-8
Sel kanker hati diinokulasi ke dalam pelat 96-sumur dengan kepadatan 5 × 103 sel per sumur. Obat yang berbeda digunakan untuk mengobati sel selama 24 jam atau 48 jam. Selanjutnya, media dengan reagen CCK-8 10% ditambahkan. Setelah inkubasi berkelanjutan selama 1–2 jam, absorbansi pada 450 nm diukur dengan penanda enzim.
Neutrofil diinokulasi ke dalam pelat 96-sumur pada 1 × 105 sel /sumur. Reagen CCK-8 sepuluh persen ditambahkan langsung pada waktu yang ditentukan setelah pemberian obat, dan absorbansi diukur setelah 1–2 jam inkubasi lanjutan.
2.4 Uji Pembentukan Koloni
Sel diinokulasi dalam pelat 12-sumur dengan kepadatan 1 × 103 sel /sumur. Kemudian medium diganti menjadi medium lengkap yang mengandung berbagai konsentrasi fisetin setelah sel-sel menempel pada dinding. Setelah 10 hari budidaya berkelanjutan, sel-sel difiksasi dengan paraformaldehida 4% pada suhu kamar selama 15 menit. Kemudian diwarnai dengan kristal violet 0,1% selama 10 menit, untuk menghitung jumlah komunitas sel.
2.5 Uji Penyembuhan Luka
Sel diinokulasi ke dalam pelat 6-sumur pada 6 × 105 sel /sumur. Ketika kepadatan sel mencapai 90–100%, garis lurus seragam digores di setiap sumur dengan ujung 10 μL. Setelah membersihkan serpihan sel dengan PBS, 2 mL media yang mengandung obat yang mengandung 2% FBS ditambahkan. Foto diambil di bawah mikroskop (Olympus, Jepang) pada 0 jam dan 48 jam. Area di antara goresan direkam menggunakan perangkat lunak ImageJ untuk menghitung persentase area yang bermigrasi.
2.6 Uji Transwell
Untuk mendeteksi migrasi sel menggunakan uji transwell, 800 μL medium yang mengandung obat dengan 15% FBS ditambahkan ke pelat 24-well. Suspensi sel dibuat menggunakan medium bebas serum. Dua ratus mikroliter sel diinokulasi ke dalam bilik dengan kepadatan 1 × 105 sel /well. Bilik diangkat setelah 48 jam inkubasi dalam inkubator. Sel-sel di dalam bilik kemudian dibersihkan dengan kapas basah. Sel-sel kemudian difiksasi dan diwarnai. Akhirnya, sel-sel dibersihkan dengan PBS, diperiksa di bawah mikroskop, dan difoto dalam 3-5 bidang pandang.
Saat menggunakan uji transwell untuk mendeteksi invasi sel, 60 μL gel matriks yang dicampur dengan medium bebas serum disebarkan secara merata di dasar bilik. Gel diinkubasi dalam inkubator selama 2 jam untuk koagulasi, lalu ditambahkan 100 μL medium bebas serum untuk hidrasi. Diperiksa apakah ada cairan yang masuk ke bilik bawah. Jika tidak, cairan tersebut dapat digunakan untuk inokulasi sel. Langkah-langkah yang tersisa sama seperti di atas.
2.7 Farmakologi Jaringan
Target fisetin terkait diambil dan duplikatnya dihapus dalam basis data TCMSP, Pharmmapper, dan SwissTargetPrediction. Target terkait penyakit diambil dan duplikatnya dihapus dengan menggunakan kata kunci “kanker hati” dalam Basis Data Gen Manusia dan Basis Data Warisan Mendelian Online pada Manusia. Informasi target penyakit dan target komponen diimpor ke Venny 2.1.0 untuk mendapatkan irisannya, dan target potensial awalnya diperoleh. Target diimpor ke basis data STRING untuk mendapatkan diagram jaringan PPI dan melakukan analisis visual melalui perangkat lunak Cytoscape 3.10.0. Kemudian, 197 target diimpor ke perangkat lunak daring Metascape untuk analisis pengayaan GO dan KEGG. Hasil yang diperoleh dari analisis divisualisasikan melalui platform daring Weishengxin.
2.8 Docking Molekuler
Struktur 3D fisetin diperoleh dari basis data PubChem. Struktur protein target AKT (PDB ID: 3O96), NE (PDB ID: 5ABW), dan MPO (PDB ID: 5FIW) diambil dari basis data RCSB PDB. Struktur protein target disiapkan dengan menghilangkan ligan nonesensial dan molekul pelarut menggunakan perangkat lunak PyMOL 2.5.7. Praproses selanjutnya—termasuk penambahan atom hidrogen, penetapan muatan, dan definisi jenis atom—dilakukan dalam perangkat lunak AutoDockTools 1.5.7. Kompleks yang didok dianalisis dalam PyMOL, dengan afinitas pengikatan dievaluasi berdasarkan energi pengikatan yang dihitung.
2.9 Bioinformatika
Hubungan antara kanker hati, neutrofil, HIST3H3, dan MPO masing-masing diambil dalam modul Diff Exp, SCNA, dan Gene dari basis data publik TIMER. Hasil imunohistokimia MPO dalam jaringan hati orang sehat dan jaringan tumor pasien kanker hati diambil dalam basis data HPA. Lihat materi tambahan untuk alamat web.
2.10 Ekstraksi Neutrofil dan Induksi NET
Neutrofil diekstraksi dengan menggunakan larutan pemisah polymorphprep (AS111468, Axis-Shield). Kumpulkan darah lengkap antikoagulan EDTA dari relawan yang sehat, dan tambahkan cairan pemisah sel Polymorphprep dalam tabung sentrifus 15 mL. Lapisi darah dengan hati-hati di atas Polymorphprep dengan rasio 1:1. Sentrifus pada kecepatan 500 g selama 30 menit, lalu aspirasi lapisan annular putih di tengah. Sentrifus pada kecepatan 400 g selama 10 menit, buang supernatan, cuci dengan PBS, lalu tambahkan buffer lisis sel darah merah. Sentrifus pada kecepatan 400 g selama 10 menit dan buang supernatan. Kemudian, dicuci dengan PBS sekali lagi untuk mendapatkan neutrofil.
Neutrofil yang diisolasi disuspensikan kembali dalam medium dan disemai dalam pelat 96-sumur pada kepadatan 1 × 105 sel /sumur dalam medium 100 μL. Sel-sel tersebut kemudian diobati dengan PMA 25 nM dan fisetin selama 4 jam. Setelah inkubasi, supernatan dibuang dengan hati-hati. Sel-sel tersebut dibilas dengan PBS. Sentrifus pada 1500 rpm selama 10 menit pada suhu 4°C untuk memisahkan NET, yang kemudian dikumpulkan dari supernatan untuk analisis lebih lanjut.
2.11 Analisis cfDNA
cfDNA dideteksi oleh kit deteksi dsDNA (P7581, Thermo Fisher Scientific). Pertama-tama, siapkan larutan kerja dengan rasio Reagen DMSO:dsDNA = 1:199. Ambil 50 μL dari setiap sampel dan tambahkan ke dalam 50 μL TE Buffer, lalu tambahkan 100 μL larutan kerja. Inkubasi dalam gelap selama 2–5 menit. Intensitas fluoresensi diukur menggunakan pembaca mikroplat multifungsi. EX = 480 nm dan EW = 520 nm. Kurva standar kemudian diplot, dan kandungan cf DNA dihitung.
2.12 Imunofluoresensi
Neutrofil diinokulasi pada kepadatan 5 × 105 sel /sumur ke penutup kaca berlapis polilisin. Setelah 4 jam perawatan, sel diblokir selama 30 menit dengan 5% BSA dan difiksasi selama 20 menit dengan 4% paraformaldehid. Antibodi sekunder fluoresen diinkubasi selama 1 jam pada suhu kamar setelah antibodi primer dirawat sepanjang malam pada suhu 4°C. Inti sel diwarnai menggunakan larutan pewarna DAPI. Setelah pembilasan PBS, sel diperiksa dan ditangkap di kamera menggunakan mikroskop fluoresen.
2.13 Analisis ROS
Neutrofil disemai dalam pelat 6-sumur dengan kepadatan 5 × 105 sel /sumur. 3 jam setelah perawatan, kontrol positif ditambahkan ke sel dan diinkubasi pada suhu 37°C selama 1 jam dalam gelap untuk meningkatkan kadar spesies oksigen reaktif. Sel dikumpulkan dengan sentrifugasi, probe H2DCFDA yang diencerkan ditambahkan, dan diinkubasi pada suhu 37°C selama 30 menit dalam gelap. Intensitas fluoresensi diamati di bawah mikroskop. Intensitas fluoresensi rata-rata (MFI) sel ditentukan dengan flow cytometry.
2.14 Percobaan Hewan
Tikus C57BL/6J jantan (4–6 minggu, 18–20 g) diambil dari Guangdong Medical Laboratory Animal Center dan ditempatkan dalam kondisi bebas patogen spesifik (SPF). Untuk mengembangkan model kanker hati subkutan, 2 × 106 sel Hepa1-6 disuntikkan ke daerah skapula kiri setiap tikus. Ketika ukuran tumor mencapai 100–200 mm3 , tikus-tikus tersebut dialokasikan secara acak ke dalam kelompok-kelompok eksperimen. Kelompok yang diobati dengan fisetin diberikan suntikan fisetin intraperitoneal setiap hari dengan dosis 80 mg/kg/hari selama 24 hari, sedangkan kelompok kontrol menerima volume pembawa yang sama. Setiap 4 hari, jangka sorong digunakan untuk mencatat dimensi tumor, dan rumus: Volume = Panjang × Lebar 2/2 digunakan untuk menghitung volume tumor. 24 jam setelah pengobatan terakhir, tikus-tikus tersebut di-eutanasia secara manusiawi, dan tumor dipanen, ditimbang, dan difoto untuk dokumentasi.
2.15 Western Blotting
RIPA digunakan untuk mengekstrak protein dari jaringan atau sel. SDS-PAGE digunakan untuk memisahkan protein pada gel 10%–12%. Protein kemudian dimasukkan ke dalam PVDF. Setelah menyumbat membran, membran menjalani tiga kali pencucian TBST. Inkubasi antibodi primer semalaman pada suhu 4°C dan antibodi sekunder selama 1 jam pada suhu ruangan. Reagen yang disebut enhanced chemiluminescence (ECL) digunakan untuk melihat pita protein. Perangkat lunak ImageJ digunakan untuk mengukur intensitas pita.
2.16 Imunohistokimia
Sampel jaringan ditempatkan dalam larutan fiksatif selama 48 jam dan kemudian mengalami dehidrasi dan penempelan. Setelah lilin dihilangkan, irisan dihidrasi ulang dalam buffer sitrat 10 mmol/L. Kemudian, irisan diperlakukan dengan 3% H 2 O 2 /MeOH. Untuk mencegah pengikatan nonspesifik, irisan diperlakukan dengan larutan pemblokiran BSA 5%. Inkubasi antibodi primer semalaman pada suhu 4°C dan antibodi sekunder selama 1 jam pada suhu kamar. Irisan dicuci dengan PBS dan diwarnai dengan kit substrat DAB. Kemudian, irisan difoto di bawah mikroskop, dan dianalisis secara statistik untuk persentase irisan positif menggunakan perangkat lunak ImageJ.
2.17 Analisis Statistik
Analisis statistik dan visualisasi data dalam penelitian ini dilakukan dengan menggunakan perangkat lunak SPSS 27.0 dan GraphPad Prism 9.4.0. Untuk perbandingan antara dua kelompok, uji- t sampel independen diterapkan jika data menunjukkan distribusi normal dan homogenitas varians. Dalam kasus yang melibatkan perbandingan antara beberapa kelompok, analisis varians satu arah (ANOVA) digunakan, asalkan data memenuhi asumsi normalitas dan varians yang sama. Ketika data menyimpang dari distribusi normal atau menunjukkan heterogenitas varians, uji non-parametrik digunakan. Uji-t sampel berpasangan digunakan ketika data berpasangan mengikuti distribusi normal. Nilai P kurang dari 0,05 dianggap signifikan secara statistik.
3 Hasil
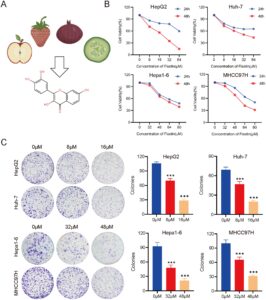
3.1 Fisetin Menghambat Proliferasi Sel Kanker Hati Secara In Vitro
Pengaruh fisetin terhadap proliferasi sel kanker hati dieksplorasi melalui uji CCK-8 dan pembentukan koloni. CCK-8 menunjukkan bahwa tingkat kelangsungan hidup sel menurun setelah pengobatan fisetin. IC50 fisetin pada sel HepG2, Huh-7, Hepa1-6, dan MHCC97H pada 48 jam adalah 18,18 μM, 37,61 μM, 65,45 μM, dan 60,58 μM (Gambar 1B ). Hasil uji pembentukan koloni menunjukkan bahwa fisetin dapat menghambat kemampuan proliferasi sel kanker hati (Gambar 1C ). Hasil di atas menunjukkan bahwa fisetin dapat menghambat proliferasi sel kanker hati.
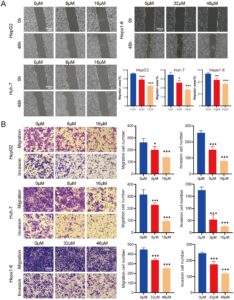
3.2 Fisetin Menghambat Migrasi dan Invasi Sel Kanker Hati Secara In Vitro
Kemampuan migrasi dan invasi sel kanker hati dalam kaitannya dengan fisetin dieksplorasi melalui penyembuhan luka dan uji transwell. Hasil uji penyembuhan luka menunjukkan bahwa, dibandingkan dengan kelompok 0 μM, persentase area migrasi sel HepG2, Huh-7, dan Hepa1-6 menurun setelah pengobatan fisetin (Gambar 2A ). Hasil uji transwell menunjukkan bahwa, dibandingkan dengan kelompok 0 μM, jumlah sel yang mengalami migrasi dan invasi menurun setelah pengobatan fisetin (Gambar 2B ). Hasil di atas menunjukkan bahwa fisetin dapat menghambat migrasi dan invasi sel kanker hati secara in vitro.
3.3 Jelajahi Mekanisme Fisetin Melawan LC
Fisetin dapat menghambat karakteristik biologis ganas sel kanker hati secara in vitro. Oleh karena itu, kami mengeksplorasi mekanisme fisetin terhadap kanker hati dengan menggunakan farmakologi jaringan. Sebanyak 387 target terkait fisetin dikumpulkan dengan mencari di basis data TCMSP, SwissTargetPrediction, dan Pharmmapper. Sebanyak 2701 target terkait kanker hati diperoleh dengan mencari di basis data GeneCards dan OMIM. Seratus sembilan puluh tujuh target umum diperoleh (Gambar 3A ). Jaringan PPI mengungkapkan target inti termasuk TP53, TNF, AKT, dan IL-6 (Gambar S1 ). Analisis GO menunjukkan bahwa respons hormon, proses fosforilasi, dan aktivitas kinase terkait erat dengan regulasi lingkungan mikro imun tumor. Selain itu, komponen seluler seperti rakit membran dan kompleks reseptor terlibat dalam transduksi sinyal imun, yang menunjukkan bahwa fisetin dapat memberikan efeknya dengan memodulasi respons inflamasi dan fungsi sel imun (Gambar S2 ). Analisis KEGG menunjukkan bahwa ada total 108 jalur pensinyalan terkait, termasuk AMPK, mTOR, dan pembentukan NET (Gambar 3B ).
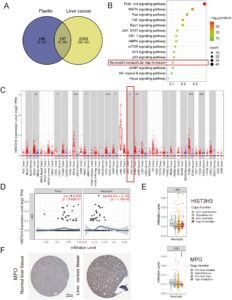
Dalam lingkungan mikro tumor, neutrofil yang direkrut oleh sel tumor akan melepaskan NET di bawah stimulasi berbagai sitokin (Zhang et al. 2024 ). Banyak model hewan dan studi klinis telah menunjukkan bahwa NET memainkan peran penting dalam terjadinya dan perkembangan kanker hati. CitH3 adalah protein rekombinan histon H3, dan ekspresi tinggi HIST3H3 terkait erat dengan perkembangan tumor. Melalui basis data TIMER, kami menemukan bahwa tingkat HIST3H3 dalam jaringan kanker hati lebih tinggi daripada yang ada di jaringan normal (Gambar 3C ). Tingkat HIST3H3 pada pasien dengan kanker hati berkorelasi positif dengan infiltrasi neutrofil ( p < 0,05) (Gambar 3D ). Selain itu, perubahan dalam jumlah salinan HIST3H3 dan MPO berkorelasi signifikan dengan infiltrasi neutrofil ( p < 0,05) (Gambar 3E ). Dengan membandingkan hasil imunohistokimia MPO dalam basis data HPA, ditemukan bahwa tingkat ekspresi MPO pada tumor hati lebih tinggi daripada di jaringan hati normal, yang menunjukkan tingkat infiltrasi neutrofil yang lebih tinggi (Gambar 3F ). Oleh karena itu, intervensi pada neutrofil terkait tumor dan penghambatan pembentukan NET dapat menjadi arah baru untuk pengobatan kanker hati.
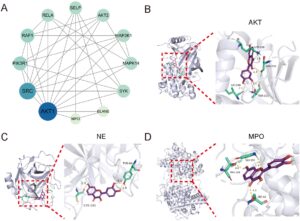
3.4 Verifikasi Docking Molekuler
Selanjutnya kami berusaha untuk mengeksplorasi interaksi potensial fisetin dengan protein terkait NET. Target yang diperkaya dalam jalur pembentukan NET ditunjukkan pada Gambar 4A . Khususnya, AKT berfungsi sebagai target penting baik dalam sel kanker hati maupun selama pembentukan NET. Studi terkini menunjukkan bahwa pembentukan NET adalah proses yang bergantung pada ledakan ROS. Aktivasi AKT dapat secara langsung meningkatkan aktivitas NADPH oksidase (NOX), dengan demikian mendorong pembentukan ROS dan selanjutnya memengaruhi pembentukan NET (Jiao et al. 2020 ). Selama NETosis, MPO dan NE dilepaskan dari granula azurofilik neutrofil, tempat mereka berpartisipasi dalam dekompresi kromatin dan perakitan NET. Hasil docking molekuler menunjukkan bahwa fisetin mengikat AKT, NE, dan MPO dengan energi pengikatan -7,29, -7,24, dan -4,88 kkal/mol (Gambar 4B–D ). Hasil-hasil ini menunjukkan fisetin dapat mengatur NETosis, dan prediksi tersebut kemudian divalidasi melalui pengujian eksperimental.
3.5 Fisetin Menghambat Pembentukan NET yang Diinduksi PMA Secara In Vitro
Analisis bioinformatika mengungkapkan peningkatan ekspresi penanda NETs pada kanker hati, sementara target inti fisetin secara fungsional tumpang tindih dengan regulasi NETs. Bukti ganda ini mendukung hipotesis bahwa aksi anti-kanker hati fisetin mungkin sebagian bergantung pada penekanan NETs. Kemudian, kami mengumpulkan darah utuh yang diantikoagulasi EDTA dari relawan yang sehat dan mengekstraksi neutrofil untuk mengeksplorasi efek fisetin pada NETs secara in vitro. Pertama, kemurnian ekstraksi neutrofil ditentukan dengan pewarnaan Swiss Giemsa (> 95%) (Gambar 5B ), dan viabilitas sel dideteksi dengan pewarnaan trypan blue (> 95%). Hasil CCK-8 menunjukkan bahwa tingkat kelangsungan hidup neutrofil menurun secara signifikan setelah 4 jam kultur in vitro, sementara tingkat kelangsungan hidup sel dalam kelompok perlakuan fisetin lebih tinggi daripada kelompok yang tidak diobati. Ini menunjukkan bahwa fisetin 8 μM dan 16 μM tidak memiliki sitotoksisitas yang jelas terhadap neutrofil (Gambar 5C ). Selanjutnya, PMA digunakan untuk merangsang neutrofil untuk menginduksi produksi NET. Tingkat cfDNA dalam larutan ditentukan secara kuantitatif menggunakan kit dsDNA PicoGreen, dan tingkat protein CitH3 dalam sel dideteksi dengan imunofluoresensi. Hasil penelitian menunjukkan bahwa tingkat cfDNA dan CitH3 dalam kelompok PMA secara signifikan lebih tinggi daripada yang ada dalam kelompok kontrol, yang menunjukkan bahwa NET berhasil diinduksi. Namun, setelah pengobatan bersama dengan fisetin dan PMA, tingkat cfDNA dan CitH3 menurun, yang menunjukkan bahwa NET dihambat ( p < 0,05) (Gambar 5D,E ).
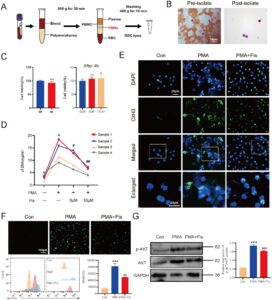
Kami menggunakan probe fluoresens H2DCFDA untuk mendeteksi ROS dalam sel. Hasilnya menunjukkan bahwa MFI sel dalam kelompok PMA lebih tinggi daripada yang ada dalam kelompok kontrol, sementara MFI menurun setelah pengobatan bersama dengan fisetin dan PMA. Ini menunjukkan bahwa fisetin dapat mengurangi ROS yang diinduksi oleh PMA (Gambar 5F ). Hasil WB menunjukkan bahwa tingkat protein p-AKT/AKT dalam kelompok PMA lebih tinggi daripada yang ada dalam kelompok kontrol, sementara itu menurun setelah pengobatan bersama dengan fisetin dan PMA (Gambar 5G ), yang sejalan dengan hasil docking molekuler kami sebelumnya. Oleh karena itu, diperkirakan bahwa fisetin dapat menghambat pembentukan NET dengan mengatur sumbu AKT/ROS dalam neutrofil.
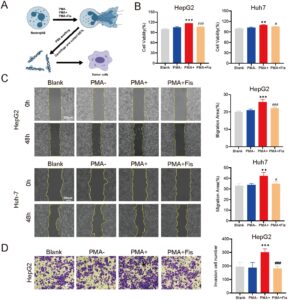
3.6 Efek NET pada Proliferasi, Migrasi, dan Invasi Sel Kanker Hati
Untuk mengeksplorasi dampak NET pada sel kanker hati, kami menggunakan pendekatan eksperimental berbasis medium terkondisi, di mana komponen NET yang dihasilkan oleh neutrofil dari kelompok eksperimen yang berbeda dikultur bersama dengan sel HepG2 dan Huh-7 (Gambar 6A ). Kelompok kosong ditambahkan dengan volume PBS yang sama. Hasil penelitian menunjukkan bahwa viabilitas sel, area migrasi, dan jumlah sel invasif sel kanker hati pada kelompok PMA+ semuanya lebih tinggi daripada yang ada pada kelompok PMA-, yang menunjukkan bahwa NET dapat meningkatkan proliferasi, migrasi, dan invasi sel kanker hati ( p < 0,05). Namun, viabilitas sel, migrasi, dan kemampuan invasi pada kelompok PMA + Fis lebih rendah daripada yang ada pada kelompok PMA+ ( p < 0,05). Ini menunjukkan bahwa pembentukan NET menurun setelah neutrofil diobati dengan fisetin, dan efeknya pada sel tumor melemah (Gambar 6B–D ).
3.7 Fisetin Menghambat Pertumbuhan Kanker Hati In Vivo dan Menekan NET pada Jaringan Tumor
Selanjutnya, kami membuat model transplantasi kanker hati subkutan pada tikus. Hasilnya menunjukkan bahwa berat dan volume tumor pada kelompok fisetin lebih kecil dibandingkan dengan kelompok kontrol ( p < 0,05) (Gambar 7B ). Hasil imunohistokimia menunjukkan bahwa ekspresi Ki67 pada kelompok fisetin lebih rendah, yang menunjukkan bahwa fisetin dapat menghambat pertumbuhan kanker hati ( p < 0,05) (Gambar 7C ). Setelah pemberian fisetin, ekspresi Ly6G pada jaringan tumor menurun, yang menunjukkan bahwa fisetin dapat mengurangi derajat infiltrasi neutrofil tumor ( p < 0,05) (Gambar 7D ). Hasil WB menunjukkan bahwa kadar protein MPO dan CitH3 pada kelompok fisetin lebih rendah daripada yang ada pada kelompok kontrol ( p < 0,05) (Gambar 7E ). Hasil di atas menunjukkan bahwa fisetin memberikan efek antikanker hati secara in vivo dengan menghambat perekrutan neutrofil dan pembentukan NET (Gambar 8 ).