
ABSTRAK
Penelitian ini bertujuan untuk menyelidiki peran polifenol daun kemiri (HLP) dalam mengatur kerusakan hati alkoholik kronis (CALD) dan mengeksplorasi kemungkinan mekanisme molekulernya. Dengan mengukur laju pembersihan DPPH·, ABTS + , dan ·OH, serta daya reduksi dan kapasitas antioksidan total, aktivitas antioksidan HLP dievaluasi. Eksperimen in vivo dan in vitro dilakukan untuk memeriksa efek HLP pada CALD. Hasil penelitian menunjukkan bahwa HLP menunjukkan aktivitas antioksidan yang kuat dan dalam rentang konsentrasi tertentu, dapat mengatur tingkat stres oksidatif yang diinduksi etanol dalam sel LO2. Selain itu, HLP meningkatkan fungsi hati dengan memodulasi jalur Nrf2/Keap1, mengurangi kadar ALT dan AST pada tikus, dan memperbaiki ketidakseimbangan redoks tubuh. Efek perlindungan ini membantu melindungi hati dari kerusakan yang diinduksi etanol, mengungkapkan bahwa polifenol daun kemiri memiliki sifat antioksidan yang kuat dan secara signifikan meningkatkan CALD.
1 Pendahuluan
Penyakit hati alkoholik (ALD) adalah suatu kondisi yang ditandai dengan berbagai perubahan patologis pada jaringan hati yang disebabkan oleh konsumsi alkohol yang berlebihan. Perubahan ini dapat menyebabkan kondisi seperti degenerasi lemak, hepatitis alkoholik, fibrosis, sirosis, dan bahkan kanker hati (Cao et al. 2022 ). Sebuah studi terbaru yang diterbitkan dalam The Lancet menunjukkan bahwa penyakit hati kronis menyebabkan hampir 287.000 kematian di Eropa pada tahun 2019 (Karlsen et al. 2022 ), yang mencakup 3% dari semua kematian di wilayah tersebut, dengan alkohol sebagai penyebab utamanya. Studi tersebut, yang mencakup data dari 32 negara Eropa, juga menemukan bahwa penyakit hati menyebabkan hampir 200.000 kematian dini setiap tahunnya di Eropa, dan harapan hidup di benua itu diperkirakan akan menurun sekitar 0,4–1,3 tahun selama 30 tahun ke depan. Dari kematian ini, 46% disebabkan oleh konsumsi alkohol. Alkohol meningkatkan angka kematian akibat penyakit hati sekitar 260 kali, meningkatkan kematian kardiovaskular hingga 3,2 kali, dan kematian akibat kanker hingga 5,1 kali (Hagström et al. 2021 ). Cara terbaik untuk mencegah kerusakan hati alkoholik kronis tahap awal adalah dengan berhenti minum. Mengadopsi pola makan sehat dan melakukan olahraga sedang dapat lebih membantu mengurangi beban hati dan mendorong pemulihan fungsi hati (Abenavoli et al. 2018 ; Connor et al. 2016 ). Untuk pasien yang sudah menunjukkan gejala, obat-obatan seperti metadoxine, silymarin, dan reduced glutathione umumnya digunakan. Obat-obatan ini memiliki berbagai tingkat efek antioksidan, anti-inflamasi, dan perlindungan sel hati, yang dapat meringankan gejala toksisitas alkohol dan perilaku abnormal (Gao dan Bataller 2011 ; Shrivastava et al. 2023 ). Namun, penggunaan obat jangka panjang juga dapat membebani hati (Zhao et al. 2020 ). Selain pengobatan farmasi, sejumlah penelitian in vivo telah menunjukkan bahwa suplemen makanan atau ekstrak tumbuhan alami yang kaya nutrisi memiliki efek pencegahan dan terapi yang signifikan terhadap ALD (Higbee et al. 2022 ; Lan et al. 2024 ). Oleh karena itu, pemilihan suplemen alami, yang memiliki lebih sedikit kekurangan dibandingkan dengan pengobatan Barat konvensional, telah menjadi fokus penelitian yang menonjol.
Kemiri ( Corylus avellana L.), anggota famili birch, telah terbukti dalam banyak penelitian kaya akan senyawa fenolik dengan berbagai potensi bioaktif. Senyawa-senyawa ini menjanjikan untuk aplikasi dalam industri makanan, farmasi, produksi hewan, dan kosmetik (Allegrini et al. 2022 ; Zhao et al. 2023 ). Penelitian oleh Gallego et al. ( 2017 ) mengungkapkan bahwa ekstrak daun kemiri dapat menghambat aktivitas sel HeLa, HepG2, dan MCF-7, yang menunjukkan efek antitumor (Oliveira et al. 2007a ). mengidentifikasi delapan senyawa fenolik dalam berbagai varietas daun kemiri, yang menunjukkan aktivitas antioksidan tinggi dan sifat antibakteri yang efektif. Dengan demikian, daun kemiri telah menunjukkan aktivitas antimikroba, antiinflamasi, antioksidan, dan antitumor, yang menunjukkan potensi besar untuk digunakan dalam terapi kesehatan dan diet (Alberti et al. 2016 ).
Percobaan ini bertujuan untuk menyelidiki apakah ekstrak daun kemiri (HLP) dapat mengatur stres oksidatif yang disebabkan oleh kerusakan hati akibat alkohol, memberikan referensi untuk pencegahan dan perlindungan terhadap stres oksidatif yang disebabkan oleh etanol.
2 Bahan dan Metode
2.1 Bahan dan Reagen
Daun kemiri dibeli di Guangyu Han Native Specialty Store di Yanji (Yanji, Tiongkok). Diamonium 2,2-difenil-1-pikrilhidrazil (DPPH), 2,2-azinobis-(3-etilbenziazolin-6-sulfonat) (ABTS), dan asam askorbat dibeli dari Yuanye Biotechnology Co. (Shanghai, Tiongkok). Feri sulfat (FeSO 4 ), dan semua reagen analitis murni lainnya dibeli dari Ruiyong Biotechnology Co. Kit berikut, alanin aminotransferase (ALT), aspartat aminotransferase (AST), superoksida dismutase (SOD), katalase (CAT), malondialdehid (MDA), dan kit uji glutathione (GSH) dibeli dari Nanjing Jiancheng Bioengineering Institute, Tiongkok (Nanjing, Tiongkok). Nrf2, HO-1, Keap1, NQO1, dan Anti-β-actin dibeli dari Cell Signaling Technology Inc. (Beverly, MA, AS).
2.2 Ekstraksi Polifenol Daun Kemiri (HLP)
Pilih daun kemiri utuh yang bebas hama dan penyakit, cuci bersih, dan keringkan. Setelah kering, remas daun dan saring melalui saringan 20 mesh. Tambahkan etanol 65% pada rasio bahan terhadap cairan 1:60, dan lakukan ekstraksi ultrasonik selama 100 menit. Setelah ekstraksi, sentrifus campuran pada 3000 putaran/menit selama 15 menit, lalu saring supernatan untuk mendapatkan ekstrak polifenol kasar (Diaz-Herrera et al. 2023 ).
2.3 Pengujian Antioksidan In Vitro
2.3.1 Kemampuan Pembersihan Radikal DPPH
Dalam kondisi terlindungi cahaya, larutkan standar DPPH· dalam etanol untuk menyiapkan larutan standar radikal DPPH·. Tambahkan 20 µL ekstrak HLP yang diencerkan dengan gradien dan 180 µL larutan standar DPPH· ke setiap sumur dalam pelat 96 sumur, lalu ukur absorbansi pada 517 nm. Gunakan larutan Vc dengan konsentrasi yang sama sebagai kontrol, dan lakukan setiap kelompok dalam rangkap tiga untuk pengujian paralel (Yan et al. 2023 ).
2.3.2 ABTS + Kemampuan Pembersihan Radikal
Larutkan 0,18 mg standar ABTS + dalam 50 mL air suling dalam tabung reaksi. Kemudian, tambahkan 33 mg kalium persulfat ke dalam tabung reaksi. Diamkan larutan pada suhu ruangan, terlindungi dari cahaya, selama 12–24 jam. Sesuaikan absorbansi larutan dengan air suling untuk mencapai nilai 0,70 ± 0,02 pada 405 nm, sehingga diperoleh larutan standar ABTS + . Tambahkan 30 µL ekstrak HLP yang diencerkan secara gradien dan 270 µL larutan standar ABTS + ke setiap sumur dalam pelat 96 sumur, dan ukur absorbansi pada 405 nm. Gunakan larutan Vc dengan konsentrasi yang sama sebagai kontrol, dan lakukan setiap kelompok dalam rangkap tiga untuk pengujian paralel.
2.3.3 Kemampuan Menangkap Radikal OH
Timbang 0,08 mg asam salisilat dan encerkan hingga volume tertentu dengan etanol anhidrat untuk menyiapkan larutan asam salisilat. Tambahkan 2 mL larutan FeSO4 , larutan H2O2 , dan larutan asam salisilat secara berurutan ke dalam 2 mL ekstrak HLP yang diencerkan dengan gradien dan biarkan selama 30 menit. Ukur absorbansi pada 510 nm . Gunakan larutan Vc dengan konsentrasi yang sama sebagai kontrol, dan lakukan setiap kelompok dalam rangkap tiga untuk pengujian paralel.
2.3.4 Mengurangi Daya
Tambahkan buffer H₃PO₄ dan larutan K₃Fe(CN)₆ 1% secara berurutan ke dalam 2 mL larutan HLP yang diencerkan secara gradien. Setelah diinkubasi dalam penangas air bersuhu 45°C selama 25 menit, tambahkan asam trikloroasetat 10% dan sentrifus pada 3000 rpm selama 10 menit. Setelah sentrifugasi, tambahkan 2,5 mL air suling dan 0,5 mL larutan FeCl₃ 0,1% ke dalam supernatan dan diamkan selama 5 menit. Ukur absorbansi pada 700 nm. Gunakan larutan Vc dengan konsentrasi yang sama sebagai kontrol, dan lakukan setiap kelompok dalam rangkap tiga untuk pengujian paralel.
2.3.5 Kapasitas Antioksidan Total
Tambahkan 60 µL ekstrak HLP yang diencerkan secara gradien ke dalam 6,00 mL larutan kerja FRAP dan inkubasi pada suhu 37°C selama 10 menit. Ukur absorbansi pada 593 nm dan gunakan kurva standar y = 0,0319 x + 0,1242 y = 0,0319 x + 0,1242 y = 0,0319 x + 0,1242 ( R 2 = 0,9973) untuk menghitung nilai FRAP dari ekstrak HLP. Gunakan larutan Vc dengan konsentrasi yang sama sebagai kontrol, dan lakukan setiap kelompok dalam rangkap tiga untuk pengujian paralel.
2.4 Kultur Sel LO2
Campurkan medium Eagle yang dimodifikasi Dulbecco, serum sapi fetal, dan larutan penisilin-streptomisin dengan rasio 100:10:1 untuk menyiapkan medium kultur sel. Sel LO2 dikultur dalam tabung reaksi dalam kondisi terkendali pada suhu 37°C dan 5% CO₂. Amati sel secara teratur dan ganti medium berdasarkan pertumbuhan sel dan perubahan warna medium. Setelah kepadatan sel dalam tabung reaksi mencapai 80%–90%, berbagai pengujian dapat dilakukan. Untuk pengujian lebih lanjut, tumbuhkan sel dalam pelat 96 sumur hingga mencapai kepadatan 80%–90%, lalu keluarkan pelat dari inkubator dan tambahkan 100 μL larutan HLP konsentrasi rendah, sedang, dan tinggi yang dipilih ke setiap sumur (disebut sebagai kelompok LH, MH, dan HH). Siapkan sumur yang diberi perlakuan silymarin sebagai kontrol positif (kelompok PC) dan sumur yang diberi perlakuan etanol sebagai kontrol negatif (kelompok NC). Setelah diinkubasi selama 24 jam, angkat pelat untuk pengukuran berikutnya.
Uji Kit Penghitungan Sel 2.5 (CCK-8)
Setelah menyesuaikan kepadatan sel menjadi 5 × 10⁴ sel/mL, masukkan 100 μL suspensi sel ke dalam setiap sumur pelat 96 sumur, dengan sumur kontrol dan sumur kosong disiapkan secara bersamaan. Saat sel mencapai kepadatan 80%–90%, lakukan uji CCK-8. Untuk menentukan waktu perlakuan etanol, konsentrasi etanol, dan konsentrasi HLP yang optimal, modifikasi medium di setiap kelompok sesuai kebutuhan. Tambahkan 10 µL larutan CCK-8 ke setiap sumur, inkubasi pada suhu 37°C selama 2 jam, lalu ukur absorbansi pada 450 nm. Nyatakan viabilitas sel sebagai persentase.
2.6 Pengukuran Indikator Terkait Stres Oksidatif pada Sel LO2
Hancurkan sel di atas es dengan buffer Radioimmunoprecipitation Assay (RIPA) dalam jumlah yang sesuai, dan kumpulkan lisat sel. Sentrifus selama 15 menit, lalu kumpulkan supernatan untuk pengukuran kadar SOD, MDA, GSH, dan CAT.
2.7 Percobaan Hewan
Pilih 36 tikus jantan C57BL/6, berusia 6-8 minggu dan berat 18-20 g, Komite Etik Universitas Yanbian (Yanji, Tiongkok) menyetujui semua percobaan hewan (nomor lisensi: 2020-0009). Tikus ditempatkan pada suhu 23°C ± 2°C, kelembapan 40%–50%, dengan siklus terang-gelap 12 jam. Semua prosedur secara ketat mengikuti panduan untuk penggunaan hewan. Setelah periode aklimatisasi 1 minggu, tikus dibagi secara acak menjadi enam kelompok: Kelompok normal (BC); Kelompok model (NC); Kelompok HLP dosis rendah (LH, 50 mg·kg −1 ); Kelompok HLP dosis sedang (MH, 100 mg·kg −1 ); Kelompok HLP dosis tinggi (HH, 200 mg·kg −1 ); dan Kelompok kontrol positif (PC, silymarin, 200 mg·kg −1 ). Kecuali untuk kelompok BC, setiap kelompok menerima larutan etanol 50% 2 jam setelah pemberian obat untuk menginduksi model (Wu et al. 2024 ), dengan dosis 0,1 mL per 10 g berat badan melalui gavage. Semua tikus memiliki akses bebas ke makanan dan air, dengan pemberian dan pemodelan berkelanjutan selama 28 hari. Pada hari terakhir, setelah 12 jam puasa, kumpulkan serum dan korbankan tikus untuk mendapatkan jaringan hati untuk analisis lebih lanjut.
2.8 Pengambilan Sampel Darah dan Jaringan
Kumpulkan darah tikus dan sentrifus selama 10 menit untuk mendapatkan serum guna mengukur kadar ALT dan AST. Di atas es, timbang 0,5 g jaringan hati tikus dan homogenkan dengan rasio 1:9. Sentrifus homogenat selama 10 menit dan kumpulkan supernatan untuk mengukur kadar SOD, MDA, GSH, dan CAT.
2.9 Pewarnaan Hematoksilin-Eosin (HE)
Fiksasi jaringan hati dalam formalin buffer netral 10%, lalu pindahkan ke xilena untuk dibersihkan. Masukkan jaringan ke dalam parafin dan potong menjadi irisan setebal 4 µm. Warnai irisan dengan HE dan ambil fotomikrograf dengan perbesaran 200x dan 400x menggunakan mikroskop cahaya.
2.10 Analisis Western Blot
Lisis jaringan hati dengan buffer RIPA untuk mengekstrak protein, dan ukur konsentrasi protein menggunakan uji BCA. Tambahkan buffer pemuatan protein 5x, lalu denaturasi protein pada suhu 100°C selama 5 menit sebelum didinginkan dan dialiquot ke dalam tabung EP 0,5 mL untuk disimpan pada suhu -20°C. Pisahkan protein dengan elektroforesis gel poliakrilamid-natrium dodecyl sulfate dan pindahkan ke membran. Blokir membran dengan susu skim 5% selama 1 jam. Inkubasi dengan antibodi primer semalaman pada suhu 4°C, diikuti dengan inkubasi dengan antibodi sekunder pada suhu ruangan selama 2 jam. Analisis intensitas setiap pita menggunakan perangkat lunak ImageJ (Wayne Rasband, National Institutes of Health, Bethesda, MD, AS).
2.11 Metode Statistik
Gunakan perangkat lunak SPSS 26.0 untuk analisis statistik, dengan hasil disajikan sebagai rata-rata ± simpangan baku. Terapkan analisis varians satu arah dalam SPSS untuk membandingkan apakah ada perbedaan signifikan antara kelompok. Dalam analisis statistik, nilai p umumnya digunakan untuk menilai signifikansi statistik hasil eksperimen, dengan p > 0,05 menunjukkan tidak ada perbedaan signifikan, p < 0,05 menunjukkan perbedaan signifikan, dan p < 0,01 menunjukkan perbedaan yang sangat signifikan. Gunakan perangkat lunak GraphPad Prism 8.0 untuk visualisasi data.
3 Hasil
3.1 Aktivitas Antioksidan HLP
Seperti yang ditunjukkan pada Gambar 1 , dalam rentang konsentrasi 0,4–2,0 mg/mL, laju pemulungan HLP untuk DPPH·, ABTS + , dan ·OH, beserta daya reduksi dan total kapasitas antioksidannya, meningkat seiring dengan konsentrasi. Laju pemulungan DPPH· dari HLP mencapai maksimum 92,11%, laju pemulungan ABTS + mencapai 98,41%, dan laju pemulungan ·OH mencapai 81,89%. Pada 2,0 mg/mL, HLP menunjukkan daya reduksi dan total kapasitas antioksidan yang signifikan.

Hasil ini menunjukkan bahwa HLP memiliki efek pemulungan yang kuat pada DPPH·, ABTS + , dan ·OH, bersama dengan daya reduksi yang substansial dan kapasitas antioksidan secara keseluruhan, yang menunjukkan aktivitas antioksidannya yang kuat. Selanjutnya, percobaan seluler dilakukan untuk menyelidiki lebih lanjut efek perlindungan HLP terhadap ALD dalam sel LO2.
3.2 Viabilitas Sel LO2
Sel LO2 diobati dengan etanol pada berbagai konsentrasi (0, 25, 50, 100, 200, dan 400 mmol/L) selama 24 jam, dan dengan konsentrasi etanol tetap untuk durasi yang bervariasi (0, 3, 6, 12, 24, dan 48 jam) untuk menentukan konsentrasi dan durasi pengobatan yang optimal. Seperti yang ditunjukkan pada Gambar 2 , dengan peningkatan konsentrasi etanol, viabilitas sel LO2 menurun secara bergantung dosis, yang menunjukkan bahwa etanol memiliki efek toksik pada sel. Viabilitas sel menurun secara signifikan pada 6 jam dan menunjukkan penurunan yang sangat signifikan pada 24 jam ( p < 0,01), yang menunjukkan kerusakan seluler yang parah. Berdasarkan dosis dari model cedera hati akibat etanol lainnya, kondisi optimal untuk membangun model cedera sel LO2 ditentukan menjadi 100 mmol/L etanol selama 24 jam.
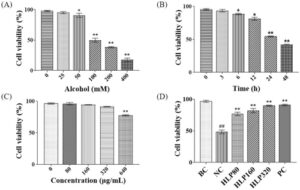
Percobaan lebih lanjut dilakukan untuk mengidentifikasi kisaran konsentrasi yang tepat untuk HLP. Sel LO2 diobati dengan HLP pada berbagai konsentrasi (0, 40, 80, 160, 320, dan 640 μg/mL) selama 24 jam, dan kelangsungan hidup sel diukur.
Seperti yang ditunjukkan pada Gambar 2 , pengobatan HLP dalam kisaran 0–320 μg/mL mempertahankan viabilitas sel di atas 90%, yang menunjukkan tidak adanya efek sitotoksik pada konsentrasi ini. Namun, konsentrasi 640 μg/mL mengakibatkan penurunan viabilitas sel yang sangat signifikan ( p < 0,01). Oleh karena itu, konsentrasi HLP rendah, sedang, dan tinggi ditetapkan masing-masing pada 80 μg/mL, 160 μg/mL, dan 320 μg/mL.
Penelitian selanjutnya meneliti efek berbagai dosis HLP pada viabilitas sel cedera hati normal dan yang diinduksi etanol. Hasil penelitian menunjukkan bahwa, dibandingkan dengan kelompok BC, viabilitas sel dalam kelompok NC (diinduksi etanol 100 mmol/L) berkurang secara signifikan ( p < 0,01). Sebaliknya, sel LO2 yang diobati terlebih dahulu dengan berbagai konsentrasi HLP dan kemudian diinduksi etanol menunjukkan peningkatan viabilitas yang signifikan dibandingkan dengan kelompok NC ( p < 0,01), yang menunjukkan bahwa HLP dapat memberikan efek perlindungan terhadap kerusakan yang diinduksi etanol pada sel LO2.
3.3 Efek HLP pada Indikator Terkait Stres Oksidatif pada Sel LO2
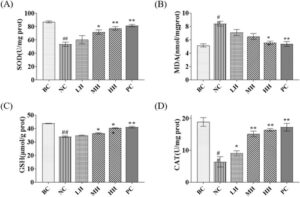
Perubahan kadar SOD, MDA, GSH, dan CAT dalam sel dapat digunakan untuk menilai status stres oksidatif dan mekanisme pertahanan antioksidan dalam hepatosit. Seperti yang ditunjukkan pada Gambar 3 , dibandingkan dengan kelompok NC, kadar SOD, GSH, dan CAT dalam kelompok HH (sel LO2 yang diobati dengan HLP) meningkat secara signifikan ( p < 0,01), sedangkan kandungan MDA menurun secara signifikan ( p < 0,01). Hal ini menunjukkan bahwa HLP dapat meringankan kerusakan oksidatif yang disebabkan oleh etanol dalam sel dan memodulasi status stres oksidatif seluler.
3.4 Efek HLP pada Indikator Serum pada Tikus dengan Cedera Hati Kronis yang Disebabkan Etanol
Tingkat ALT dan AST serum merupakan indikator utama untuk mengevaluasi fungsi hati dan kerusakan hepatosit. Seperti yang ditunjukkan pada Gambar 4 , tingkat ALT dan AST pada kelompok NC secara signifikan lebih tinggi daripada kelompok BC ( p < 0,05), yang menunjukkan keberhasilan pembentukan model cedera hati alkoholik kronis. Pengobatan HLP menyebabkan penurunan kadar ALT dan AST yang bergantung pada dosis, dengan kelompok HH dan PC menunjukkan kadar yang secara signifikan lebih rendah daripada kelompok NC ( p < 0,01). Hasil ini menunjukkan bahwa HLP dosis tinggi memiliki efek yang nyata dalam mengatur kadar ALT dan AST, yang menunjukkan potensi kemampuannya dalam hepatoprotektif dan menurunkan enzim.

3.5 Efek HLP pada Indikator Terkait Stres Oksidatif pada Tikus dengan Cedera Hati Kronis yang Disebabkan Etanol
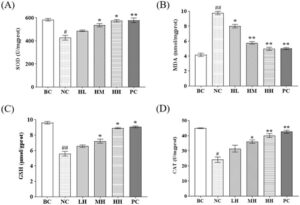
Seperti yang ditunjukkan pada Gambar 5 , HLP mengurangi stres oksidatif pada hati tikus dengan cara yang bergantung pada dosis dibandingkan dengan kelompok NC, yang menunjukkan bahwa HLP dapat mengurangi kerusakan oksidatif yang disebabkan oleh etanol pada tikus. Ia mengurangi peroksidasi lipid sampai batas tertentu, secara signifikan mengurangi akumulasi MDA ( p < 0,05), sementara secara nyata meningkatkan kadar SOD, GSH, dan CAT ( p < 0,01), sehingga meningkatkan kapasitas antioksidan tubuh. Hasil ini konsisten dengan temuan dari pengukuran terkait stres oksidatif pada sel LO2.
3.6 Efek HLP terhadap Morfologi Histopatologi Jaringan Hati pada Tikus dengan Cedera Hati Kronis yang Disebabkan oleh Etanol
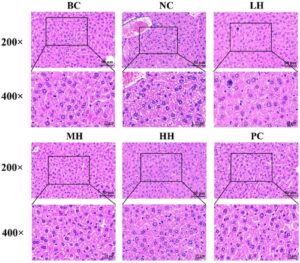
Seperti yang ditunjukkan pada Gambar 6 , struktur jaringan hati pada kelompok tikus BC utuh, dengan sel-sel bulat dan batas yang jelas. Hepatosit tersusun secara radial di sekitar vena sentral. Setelah induksi etanol, kelompok NC menunjukkan struktur jaringan hati yang terganggu, batas-batas sel yang kabur, adanya vakuola lemak, akumulasi tetesan lipid yang signifikan, dan tanda-tanda penyusutan inti, pembubaran, dan hilangnya, yang menunjukkan kerusakan hati yang parah. Setelah intervensi HLP, sementara beberapa tetesan lipid tetap ada dalam kelompok LH, kelompok HH menunjukkan penyusutan inti yang berkurang, batas-batas sel yang lebih jelas, dan penurunan tetesan lipid yang nyata, yang mengurangi kerusakan hati. Temuan-temuan ini menunjukkan bahwa etanol dapat menginduksi patologi hati pada tikus, sementara intervensi HLP dapat mengurangi kerusakan hati yang disebabkan oleh etanol dan mengurangi beban hati.
3.7 Efek HLP pada Protein Jalur Sinyal Nrf2/Keap1 pada Tikus dengan Cedera Hati Kronis yang Disebabkan Etanol
Kami mengevaluasi tingkat ekspresi protein yang terlibat dalam aktivasi jalur pensinyalan Nrf2/Keap1 di jaringan hati untuk mengeksplorasi mekanisme molekuler yang digunakan HLP untuk meringankan CALD. Seperti yang ditunjukkan pada Gambar 7 , setelah stimulasi etanol jangka panjang, ekspresi Keap1 di hati meningkat secara signifikan ( p < 0,01), sementara tingkat protein Nrf2, HO-1, dan NQO1 menurun secara signifikan, yang menunjukkan bahwa aktivasi jalur pensinyalan Nrf2/Keap1 dihambat pada titik ini. Dibandingkan dengan kelompok NC, HLP menurunkan ekspresi Keap1 dalam cara yang bergantung pada dosis dan meningkatkan ekspresi Nrf2, HO-1, dan NQO1 ( p < 0,01). Temuan ini menunjukkan bahwa HLP dapat mengaktifkan jalur pensinyalan Nrf2/Keap1, yang memulai transkripsi gen respons stres antioksidan seperti HO-1 dan NQO1, yang membantu menghilangkan radikal bebas, mengurangi stres oksidatif, menjaga keseimbangan redoks, dan melindungi hati, sehingga memperbaiki cedera hati akibat etanol.

4 Diskusi
Cedera hati akibat alkohol (ALI) adalah penyakit hati yang disebabkan oleh konsumsi alkohol kronis atau berlebihan, dengan kerusakan hati akibat alkohol kronis (CALD) sebagai kondisi patologis mendasar dalam perkembangannya. Mekanisme yang mendasari cedera hati akibat alkohol melibatkan stres oksidatif, respons inflamasi, gangguan metabolisme hepatosit, ketidakseimbangan mikrobiota usus, dan kelainan dalam autofagi dan apoptosis, dengan stres oksidatif dianggap sebagai faktor patogenik utama (Im et al. 2021 ; Wu et al. 2021 ). Banyak senyawa alami, termasuk saponin, polisakarida, dan polifenol, telah dieksplorasi potensinya dalam pengobatan dan pencegahan CALD (Brimson et al. 2021 ; Qi et al. 2023 ; Wang et al. 2023 ; Xiang et al. 2023 ). Misalnya, total ginsenosida menunjukkan sifat antioksidan yang kuat dan mengurangi akumulasi lipid, sehingga mengurangi cedera hati akibat alkohol akut (Qu et al. 2019 ). Demikian pula, polisakarida Dendrobium officinale melindungi terhadap cedera hati yang diinduksi etanol melalui jalur pensinyalan TLR4/NF-κB/NLRP3 (Yang et al. 2020 ), sementara ekstrak buah Solanum nigrum membantu menjaga homeostasis usus, meningkatkan disfungsi sawar usus, dan meningkatkan produksi asam lemak rantai pendek (SCFA), berkontribusi terhadap perlindungan hati melalui regulasi metabolisme lipid, inflamasi, dan stres oksidatif (Wang et al. 2024 ). Namun, penelitian tentang peran polifenol daun kemiri (HLP) dalam pencegahan dan pengobatan CALD masih terbatas (Li et al. 2023 ). Oleh karena itu, dalam penelitian ini, kami menyelidiki efek perlindungan HLP terhadap cedera hati alkoholik kronis melalui eksperimen in vitro dan in vivo.
Studi ekstensif telah menunjukkan bahwa polifenol, karena struktur cincin fenoliknya yang unik, dapat secara langsung menyumbangkan atom hidrogen untuk menetralkan radikal bebas yang berasal dari peroksidasi lipid (Kurek-Górecka et al. 2013 ; Pignatelli et al. 2006 ; Wu et al. 2010 ). Selain itu, polifenol dapat menghambat aktivitas oksidase, sehingga mengurangi produksi anion superoksida (Chala et al. 2024 ; Lv et al. 2024 ; Maheshwari et al. 2022 ). Pada awal percobaan kami, kami melakukan studi pendahuluan untuk menentukan kandungan polifenol dalam biji, daun, dan kulit kemiri. Hasilnya menegaskan bahwa daun kemiri mengandung kandungan polifenol tertinggi di antara semua komponen yang diuji. Pada saat yang sama, hasil eksperimen kami menunjukkan bahwa HLP menunjukkan kapasitas antioksidan yang signifikan, sebagaimana dibuktikan oleh kemampuannya untuk membersihkan radikal DPPH·, ABTS + , dan ·OH, dalam cara yang bergantung pada dosis. Lebih jauh, HLP menunjukkan daya reduksi yang kuat dan peningkatan kapasitas antioksidan total. Hal ini konsisten dengan temuan dari (Oliveira et al. 2007 ), yang mengekstraksi polifenol daun kemiri dari tiga varietas kemiri yang dibudidayakan di Portugal dan melaporkan aktivitas antioksidan yang kuat dalam cara yang bergantung pada konsentrasi. Temuan ini mendukung penyelidikan lebih lanjut tentang peran HLP dalam memodulasi stres oksidatif dan mencegah CALD.
Silymarin, senyawa aktif yang berasal dari ( Silybum marianum (L.) Gaertn.), dikenal luas karena sifat antioksidan, antiinflamasi, dan hepatoprotektifnya dan digunakan secara klinis dalam pengobatan cedera hati akibat alkohol (Gao et al. 2023 ; Marmouzi et al. 2021 ). Mengingat khasiatnya yang terdokumentasi dengan baik, silymarin dipilih sebagai kontrol positif dalam percobaan in vivo dan in vitro kami.
Studi kami mengungkapkan bahwa HLP menunjukkan kapasitas antioksidan yang kuat baik secara in vivo maupun in vitro, yang secara efektif meningkatkan kadar CAT, SOD, dan GSH sekaligus mengurangi akumulasi MDA (He et al. 2022 ). Temuan serupa dilaporkan oleh Tao et al. ( 2024 ), yang menyelidiki efek ekstrak daun tebu pada metabolomik hati dan mikrobiota usus pada cedera hati akibat alkohol. Hasil penelitian mereka menunjukkan bahwa ekstrak daun tebu meningkatkan aktivitas SOD dan GSH di hati tikus yang terpapar etanol, sehingga memperbaiki perubahan histopatologis. Demikian pula, Cheng et al. ( 2023 ) mempelajari efek ekstrak tangkai dan biji Hovenia dulcis pada sel LO2 yang dikultur dalam etanol, yang menunjukkan bahwa ekstrak ini meningkatkan viabilitas sel, meningkatkan aktivitas SOD dan CAT, serta mengurangi akumulasi MDA pada model yang rusak akibat alkohol—temuan yang konsisten dengan hasil penelitian kami. Secara kolektif, penelitian kami mendukung peran HLP dalam meningkatkan aktivitas enzim antioksidan, mengurangi kerusakan oksidatif, dan mengurangi stres oksidatif.
Peningkatan kadar ALT dan AST merupakan indikator klinis yang mapan untuk cedera hati akibat alkohol (Kobayashi et al. 2011 ; Mu et al. 2012 ; Sun et al. 2021 ; Wang et al. 2021 ). Penelitian telah menunjukkan bahwa polifenol teh efektif mengurangi kadar ALT dan AST, sehingga meringankan kerusakan hati yang disebabkan oleh alkohol (Wang et al. 2021 ). Dalam penelitian kami, tikus dalam kelompok NC menunjukkan peningkatan yang signifikan atau sangat signifikan dalam kadar ALT dan AST serum, yang mengonfirmasi keberhasilan pembentukan model cedera hati yang disebabkan oleh etanol. Setelah intervensi HLP, kadar ALT dan AST serum menurun secara signifikan ( p < 0,01) dalam cara yang bergantung pada dosis, yang menunjukkan bahwa HLP efektif meringankan cedera hati akibat alkohol kronis. Analisis pewarnaan HE hati selanjutnya mengungkapkan perubahan patologis pada jaringan hati. Khususnya, pada kelompok HLP dosis tinggi, degenerasi granular hati berkurang, batas hepatosit tampak lebih jelas, penyusutan nukleus berkurang, dan akumulasi vakuola lipid menurun secara signifikan, yang secara kolektif menunjukkan efek perlindungan HLP terhadap kerusakan hati.
Jalur pensinyalan Nrf2 adalah mekanisme pertahanan intraseluler utama yang mengatur respons seluler terhadap stres oksidatif (Loboda et al. 2016 ; Xiong et al. 2021 ; Zhou et al. 2023 ). Fungsi utamanya adalah untuk menjaga keseimbangan redoks seluler dan mengurangi kerusakan oksidatif dengan memodulasi ekspresi enzim antioksidan dan detoksifikasi (Wu et al. 2024 ; Yu et al. 2024 ). Studi telah menunjukkan bahwa disregulasi jalur Nrf2 terkait erat dengan timbulnya dan perkembangan berbagai penyakit, termasuk diabetes, cedera hati, dan kanker (Bangar et al. 2025 ; Liu et al. 2024 ; Yu et al. 2020 ). Akibatnya, Nrf2 dianggap sebagai target terapi yang menjanjikan untuk kondisi ini. ( 2021 ) menunjukkan bahwa intervensi dengan triterpen dari Rosa roxburghii secara signifikan meningkatkan gen target Nrf2 seperti HO-1 dan SOD1 pada tikus yang mengalami cedera hati akibat etanol, yang menunjukkan bahwa triterpen mengurangi cedera hati akibat alkohol melalui jalur pensinyalan Keap1-Nrf2. Dalam penelitian kami, efek penyeimbangan redoks dari HLP dapat dikaitkan dengan aktivasi jalur Nrf2/Keap1. Jalur ini memfasilitasi disosiasi Nrf2 dari Keap1, sehingga meningkatkan ekspresi protein Nrf2, mengurangi ekspresi Keap1, dan meningkatkan kadar HO-1 dan NQO1, yang pada akhirnya meningkatkan aktivitas enzim antioksidan (Liu et al. 2022 ). Analisis western blot kami mengonfirmasi bahwa HLP mengaktifkan jalur Nrf2, yang mengarah pada pemulihan aktivitas enzim antioksidan, pengurangan akumulasi peroksida, dan pengurangan cedera hati akibat etanol.
5 Kesimpulan
HLP memperbaiki stres oksidatif hati yang disebabkan oleh asupan etanol jangka panjang dengan mendorong aktivasi jalur pensinyalan Nrf2/Keap1, mengurangi kadar enzim hati, dan mengatur ketidakseimbangan redoks dalam tubuh. Studi ini adalah yang pertama menunjukkan bahwa HLP dapat mencegah CALD dengan memodulasi stres oksidatif, yang berpotensi memberikan wawasan terapeutik baru untuk cedera hati alkoholik kronis. Di masa mendatang, kami akan lebih jauh mengeksplorasi mekanisme pengaturan tambahan HLP pada CALD, serta potensi efek terapeutik komponen nutrisi lain dalam HLP pada cedera hati alkoholik, untuk lebih mengembangkan nilai pengobatan daun kemiri.

