
ABSTRAK
Hiperplasia prostat jinak (BPH) ditandai dengan pertumbuhan sel epitel dan stroma prostat yang abnormal, yang menyebabkan obstruksi saluran keluar kandung kemih (BOO) dan gejala saluran kemih bagian bawah (LUTS). Patogenesis BPH melibatkan jalur pensinyalan utama, termasuk androgen/reseptor androgen (AR) dan transforming growth factor-beta (TGF-β)/Smad, yang berkontribusi terhadap proliferasi sel, transformasi, dan transisi epitel-mesenkim (EMT). Hingga saat ini, efek madu Hovenia dulcis (HH) pada BPH belum dilaporkan. Dalam hal ini, model BPH in vivo dan in vitro digunakan untuk menentukan apakah HH memiliki efek terapeutik dan mekanisme yang mendasarinya, jika ada. Untuk mengevaluasi efek anti-BPH dari HH in vivo, tikus diobati dengan testosteron propionat (TP; 10 mg/kg, sc), finasterida (Fi; 10 mg/kg, ip), atau HH (600 mg/kg, po) selama 4 minggu. Selain itu, efikasi HH in vitro dievaluasi menggunakan model sel prostat RWPE-1 yang distimulasi oleh dihidrotestosteron (DHT). HH secara signifikan mengurangi ukuran prostat, ketebalan epitel, dan penanda sinyal AR (antigen spesifik prostat [PSA], antigen inti sel yang berkembang biak [PCNA], dan DHT) serta menunjukkan efek antiinflamasi dengan menurunkan ekspresi inducible nitric oxide synthase (iNOS), cyclooxygenase-2 (COX-2), interleukin-6 (IL-6), dan tumor necrosis factor-α (TNF-α) dan menghambat proses EMT dengan menurunkan kadar α-smooth muscle actin (α-SMA), neural cadherin (N-cadherin), dan vimentin sambil memulihkan ekspresi epitel cadherin (E-cadherin). Temuan ini menunjukkan bahwa HH menghambat jalur pensinyalan androgen/AR dan TGF-β/Smad dan dapat menawarkan pendekatan terapi baru untuk pengobatan BPH.
Singkatan
5ARI
Penghambat 5α-reduktase
AR
reseptor androgen
HUUU
obstruksi saluran keluar kandung kemih
BPH
hiperplasia prostat jinak
BW
rasio berat badan
COX-2
siklooksigenase-2
DHT
dihidrotestosteron
Petugas medis
transisi epitel-mesenkim
HH
Madu Hovenia dulcis
Pesawat IL-6
interleukin-6
Bahasa Indonesia:
sintase oksida nitrat yang dapat diinduksi
Penyakit Lut
gejala saluran kemih bagian bawah
PSA/KLK3
antigen spesifik prostat/Kallikrein 3
PW
berat prostat
TGF-β
transformasi faktor pertumbuhan-beta
TNF-α
faktor nekrosis tumor-α
T.P.
testosteron propionat
1 Pendahuluan
Hiperplasia prostat jinak (BPH) adalah kelainan umum terkait usia yang ditandai dengan proliferasi abnormal sel epitel dan stroma di zona transisi prostat. Kondisi ini dapat menyebabkan obstruksi saluran keluar kandung kemih (BOO) dan gejala saluran kemih bagian bawah (LUTS), yang secara signifikan memengaruhi kualitas hidup pada pria lanjut usia (Lee et al. 2017 ; Collaborators 2022 ). Perawatan farmakologis saat ini untuk BPH meliputi penghambat reseptor α1 afinitas tinggi dan penghambat 5α-reduktase (5ARI), seperti terazosin, finasterida, dan dutasterida (Xu et al. 2020 ). Namun, obat-obatan ini terutama meringankan gejala daripada menargetkan mekanisme patologis yang mendasari BPH, seperti fibrosis (Rodriguez-Nieves dan Macoska 2013 ) dan peradangan kronis (Inamura dan Terada 2024 ). Lebih jauh lagi, penggunaan obat-obatan ini dalam jangka panjang dikaitkan dengan efek samping, termasuk pusing, penurunan libido, dan disfungsi ereksi, yang membatasi kepatuhan pasien dan memerlukan pengembangan pendekatan terapi alternatif.
Sinyal androgen adalah pendorong dominan patogenesis BPH. Jalur reseptor androgen (AR) memainkan peran penting dalam pertumbuhan dan fungsi prostat, dan disregulasinya berkontribusi secara signifikan terhadap perkembangan BPH. Dihidrotestosteron (DHT), androgen kuat yang diubah dari testosteron oleh 5α-reduktase, mengikat AR dan meningkatkan proliferasi sel epitel dan stroma di prostat (Carson dan Rittmaster 2003 ; Ho dan Habib 2011 ). Sinyal androgen tidak hanya merangsang pertumbuhan hiperplastik tetapi juga berinteraksi dengan jalur inflamasi dan fibrotik, memperburuk perkembangan BPH (Abdel-Aziz et al. 2020 ). Mengingat hal ini, terapi yang menargetkan AR, termasuk 5ARI dan antagonis AR, tetap menjadi strategi utama untuk manajemen BPH. Namun, peran sinyal androgen dalam transisi epitel-mesenkimal (EMT) dan fibrosis, kontributor utama perkembangan BPH, memerlukan penyelidikan lebih lanjut.
Patogenesis pasti BPH masih belum jelas; namun, studi terbaru menyoroti peran penting peradangan kronis dan EMT dalam perkembangan penyakit. Menurut teori interaksi epitel-mesenkimal, stroma prostat memainkan peran penting dalam perkembangan BPH (Broster dan Kyprianou 2015 ). Selain itu, EMT telah terlibat dalam akumulasi abnormal sel-sel mirip mesenkimal yang berasal dari sel-sel epitel prostat, yang berkontribusi terhadap fibrosis dan pembesaran prostat (Hu et al. 2014 ; Broster dan Kyprianou 2015 ). EMT adalah proses fisiologis normal yang terlibat dalam perkembangan jaringan, perkembangan kanker, dan gangguan fibrotik (Rout-Pitt et al. 2018 ; Georgakopoulos-Soares et al. 2020 ). Namun, aktivasi abnormalnya pada BPH berkontribusi pada remodeling patologis, yang mengakibatkan fibrosis dan peningkatan volume prostat (Yang et al. 2022 ). Setelah fibrosis berlanjut, prostat membesar lebih lanjut, sehingga memperburuk gejala BPH (Alonso-Magdalena et al. 2009 ; Broster dan Kyprianou 2015 ).
Beberapa jalur pensinyalan kunci mengatur EMT, termasuk transforming growth factor-beta (TGF-β), Wnt/β-catenin, dan Notch, yang memengaruhi perubahan struktural dan motilitas seluler. Misalnya, aktivasi TGF-β menyebabkan hilangnya kadherin epitel (E-kadherin) dan peningkatan penanda mesenkimal seperti vimentin dan kadherin saraf (N-kadherin) (Alonso-Magdalena et al. 2009 ). Pada BPH, EMT menyebabkan mobilitas sel epitel dan adopsi karakteristik mesenkimal, yang menyebabkan penyebaran atau reorganisasi dalam jaringan di sekitarnya, yang menyebabkan peningkatan volume prostat dan perubahan fungsional (Odero-Marah et al. 2018 ). Mengingat hal ini, penargetan EMT telah muncul sebagai strategi terapi potensial untuk BPH, dan obat yang memodulasi jalur terkait EMT saat ini sedang dalam pengembangan.
Madu, produk alami dengan manfaat kesehatan yang terdokumentasi dengan baik, mengandung berbagai senyawa bioaktif, termasuk gula, mineral, vitamin, dan senyawa fenolik, yang menunjukkan sifat anti-inflamasi, antioksidan, dan antimikroba (Estevinho et al. 2008 ; Khalil et al. 2012 ; Samarghandian et al. 2017 ). Di antara mereka, madu Hovenia dulcis (HH) dikenal karena kandungan polifenolnya yang tinggi dan aktivitas biologis yang lebih unggul dibandingkan dengan madu akasia (Park et al. 2020 ; You et al. 2022 ). Namun, meskipun manfaat farmakologisnya terdokumentasi dengan baik, efek langsung HH pada mekanisme utama terkait BPH, termasuk pensinyalan AR, EMT, dan fibrosis, belum diselidiki secara menyeluruh.
Madu dari pohon kismis oriental ( H. dulcis) ) digunakan untuk semua percobaan; sampel disediakan oleh Korea Beekeeping Cooperative (Namyangju, Gyeonggi-do, Republik Korea) dan Rural Development Administration (Jeonju, Jeollabuk-do, Republik Korea). Studi ini bertujuan untuk mengevaluasi apakah HH memodulasi EMT yang dimediasi TGF-β/Smad2 dan pensinyalan AR dalam model hewan BPH yang diinduksi testosteron propionat (TP) dan model sel prostat yang distimulasi DHT. Secara khusus, kami berhipotesis bahwa HH dapat memberikan efek perlindungan terhadap perkembangan BPH dengan menghambat EMT, mengurangi ekspresi sitokin inflamasi, dan memodulasi jalur terkait AR. Dengan menjelaskan tindakan mekanistiknya dalam model in vivo dan in vitro, studi kami memberikan wawasan baru tentang potensi HH sebagai agen terapeutik alami untuk manajemen BPH.
2 Bahan dan Metode
2.1 Bahan Kimia dan Material
Madu dari pohon kismis oriental ( H. dulcis ) digunakan untuk semua percobaan; sampel disediakan oleh Korea Beekeeping Cooperative (Namyangju, Gyeonggi-do, Republik Korea) dan Rural Development Administration (Jeonju, Jeollabuk-do, Republik Korea). DHT dan finasteride dibeli dari Thermo Fisher Scientific, Co. Ltd. (AS); AR (PA1-110) dibeli dari Invitrogen. Antigen spesifik prostat/Kallikrein 3 (PSA/KLK3; #5356), β-aktin (#4967), siklooksigenase-2 (COX-2; #12282), sintase oksida nitrat yang dapat diinduksi (iNOS; #13120), faktor nekrosis tumor-α (TNF-α; #8184), interleukin-6 (IL-6; #12153), fosfo-supresor dari Mothers against Decapentaplegic (p-Smad2; #18338), supresor dari Mothers against Decapentaplegic (Smad2; #5339), TGF-β (#3711), E-kadherin (#14472), N-kadherin (#14215), vimentin (#5741), dan α-aktin otot polos (α-SMA; #14968) diperoleh dari Cell Signaling Technology (Danvers, MA, AS). Antibodi sekunder dibeli dari Bio-Rad (Hercules, CA, AS).
2.2 Analisis Kualitatif HH Menggunakan Spektrometri Massa UHPLC-Q-Exactive Orbitrap
Analisis kromatografi dilakukan dengan sistem Thermo Dionex UltiMate 3000, dilengkapi dengan pompa biner, auto-sampler, oven kolom, dan detektor UV/VIS dioda array (Thermo Scientific Dionex, Sunnyvale, CA, AS). Singkatnya, pemisahan kromatografi HH dilakukan dengan menggunakan kolom analitis Acquity BEH C 18 (100 × 2,1 mm 2 , 1,7 µm), dengan elusi gradien, menggunakan fase mobil A (asam format 0,1% [v/v] dalam air) dan fase mobil B (asetonitril). Laju alir ditetapkan pada 0,3 mL/menit, dan suhu kolom dipertahankan pada 40°C. Identifikasi fitokimia dalam HH dilakukan dengan menggunakan spektrometer massa quadrupole-Q-Exactive Orbitrap yang dilengkapi dengan antarmuka ionisasi elektrospray yang dipanaskan (Thermo Scientific, Waltham, MA, AS). Analisis MS HH dilakukan dalam mode ionisasi positif dan negatif menggunakan sumber HESI untuk pengumpulan spektral MS yang akurat dan pengukuran massa molekular analit. Spektrum MS diperoleh pada energi tumbukan ternormalisasi sebesar 25 eV dalam mode pemindaian MS penuh dan ddMS2, yang mencakup rentang pemindaian 100–1500 m / z . Kondisi analitis spesifik dan parameter spektrometri massa dirinci dalam penelitian sebelumnya (Hwang dan Ma 2018 ; Pak et al. 2022 ). Akuisisi dan analisis data diselesaikan menggunakan perangkat lunak Xcalibur v.4.2 dan Tracefinder v.4.0 (Thermo Fisher Scientific, Foster, CA, AS). Metanol, asetonitril, air, dan asam format kadar MS bersumber dari Thermo Fisher Scientific (Pittsburgh, PA, AS). Standar referensi analitis, masing-masing dengan kemurnian di atas 97%, diperoleh dari Sigma-Aldrich Co. (St. Louis, MO, AS), Targetmol (Wellesley Hills, MA, AS), dan ChemFaces (Wuhan, Cina).
2.3 Model Sel RWPE-1 dan Kondisi Kultur
Garis sel epitel prostat manusia RWPE-1 dibeli dari American Type Culture Collection (Manassas, VA, Amerika Serikat). Sel RWPE-1 yang tidak ditransformasi berasal dari sel epitel prostat manusia normal dan diabadikan tetapi tidak bersifat tumorigenik (Benbrahim-Tallaa et al. 2005 ). Sel RWPE-1 berfungsi sebagai model representatif untuk mempelajari BPH karena mereka mempertahankan karakteristik sel epitel prostat normal, yang memungkinkan penyelidikan respons seluler terhadap stimulasi hormonal dan faktor pertumbuhan. Kesesuaian sel RWPE-1 untuk mempelajari EMT terletak pada kemampuannya untuk menjalani EMT saat distimulasi oleh androgen, menjadikannya model ideal untuk memeriksa proses EMT yang penting dalam patogenesis BPH (Munoz-Moreno et al. 2022 ). Hal ini membuat sel RWPE-1 sangat berguna untuk memeriksa jalur pensinyalan AR dan proses EMT, yang penting dalam patogenesis BPH. Sel RWPE-1 ditumbuhkan dalam inkubator CO2 pada suhu 37°C dengan 5% CO2 dalam K-SFM yang mengandung 50 µg/mL BPE dan 5 ng/mL EGF, dilengkapi dengan campuran antibiotik/antimikotik 1% dan streptomisin.
2.4 Uji Viabilitas dan Proliferasi Sel
Proliferasi sel diukur menggunakan kit CCK-8 (Dojindo Molecular Technologies Inc., Doc, AS). Sel BPH-1 pertama kali disemai ke dalam pelat 96-sumur (1 × 105 sel /sumur) dan dikultur selama 24 jam. Selanjutnya, sel diobati dengan HH (20 mg/mL) saja atau dengan berbagai kombinasi HH (20 mg/mL) dan DHT (10 nM) selama 24 jam, diikuti dengan inkubasi dengan larutan CCK-8 selama 4 jam. Jumlah sel yang hidup kemudian ditentukan dengan mengevaluasi pada 450 nm menggunakan pembaca mikroplat Epoch (Biotek, Winooski, VT, AS).
2.5 Model Hewan dan Protokol Perawatan
Tikus jantan C57BL/6J (20–25 g; 5 minggu; n = 7) dibeli dari Doo Yeol Biotech (Seoul, Korea). Tikus ditempatkan dalam siklus terang/gelap 12 jam pada kelembapan relatif 50% ± 10% dan suhu 22°C ± 2°C. Semua percobaan dilakukan sesuai dengan pedoman Institutional Animal Care and Use Committee (IACUC) dari Korea Institute of Oriental Medicine, dan protokol percobaan disetujui berdasarkan Persetujuan No. 24-039. Untuk menghilangkan efek intrinsik testosteron endogen, tikus dalam semua kelompok percobaan, kecuali kelompok kontrol (CON) dan kelompok perlakuan agen tunggal (HH dan Fi), menjalani orkiektomi bilateral, diikuti oleh periode pemulihan selama 7 hari. Kelompok CON dan kelompok perlakuan agen tunggal menerima operasi semu untuk mempertahankan kadar testosteron dasar sebagai perbandingan. Tikus secara acak dimasukkan ke dalam salah satu dari enam kelompok ( n = 7 per kelompok) dan menerima perawatan khusus selama 5 minggu sebagai berikut: (1) kelompok CON ( n = 7), (2) kelompok TP 10 mg/kg (sc, n = 7), (3) kelompok Finasteride 10 mg/kg (Fi, ip, n = 7), (4) kelompok madu Hovenia 600 mg/kg (HH, po, n = 7), (5) kelompok TP + 600 mg/kg HH (po, n = 7) dan (6) kelompok TP + 10 mg/kg Fi (ip, n = 7). Dosis TP (10 mg/kg) dipilih berdasarkan penelitian sebelumnya yang menetapkan kemanjurannya dalam menginduksi kondisi seperti BPH pada model hewan pengerat, meniru kadar androgen yang diamati pada kasus BPH klinis. Demikian pula, dosis finasterida (10 mg/kg) mencerminkan konsentrasi yang umum digunakan dalam model praklinis, yang sesuai dengan dosis terapeutik yang efektif dalam pengobatan BPH manusia (Kim et al. 2020 ). Durasi pengobatan (5 minggu) dipilih untuk memastikan waktu yang cukup untuk perkembangan BPH dan evaluasi terapeutik HH dan finasterida. Pada akhir periode pengobatan, tikus di-eutanasia, dan prostat dipanen dengan hati-hati, dikeringkan, dan segera ditimbang. Rasio berat prostat (PW) relatif dihitung dengan menormalkan berat setiap prostat dengan berat rata-rata kelompok CON untuk menilai perubahan hipertrofi yang disebabkan oleh TP dan intervensi terapeutik.
2.6 Pemeriksaan Histologis dan Morfometri Prostat
Jaringan prostat difiksasi dalam formalin 4%, ditanamkan dalam parafin, dan diiris menjadi irisan setebal 4 mm. Selanjutnya, irisan diwarnai dengan hematoksilin dan eosin (H&E), dan gambar diambil menggunakan mikroskop (Leica DFC 295; Wetzlar, Jerman). Ketebalan epitel dalam prostat diukur menggunakan Leica Application Suite (v3.3.0; Leica Microsystems Inc., Buffalo Grove, IL, AS).
2.7 Uji Imunosorben Terkait Enzim DHT (ELISA)
Untuk ELISA serum, sampel darah diambil dari tikus, dan serum dipisahkan dengan sentrifugasi pada kecepatan 1700 × g selama 30 menit pada suhu 20°C. Konsentrasi DHT serum kemudian ditentukan menggunakan kit ELISA komersial (Cusabio Biotech Co. Ltd., Houston, TX, AS) dengan semua prosedur mengikuti rekomendasi produsen.
2.8 Analisis Western Blot
Protein diisolasi menggunakan reagen ekstraksi komersial (iNtRON Biotechnology, Gyeonggi-do, Korea) dan diukur menggunakan kit uji protein BCA (#23225, Thermo Fisher). Protein yang diekstraksi kemudian dipisahkan melalui SDS-PAGE 4%–12% dan ditransfer secara elektrik ke membran PVDF (Merck Millipore, Burlington, MA, AS). Membran kemudian diimunoblot dengan antibodi primer dan sekunder. Antibodi primer terhadap AR, PSA, COX-2, iNOS, TNF-α, IL-6, p-Smad2, Smad2, TGF-β, E-kadherin, N-kadherin, Vimentin, α-SMA, dan β-aktin digunakan.
2.9 Reaksi Rantai Polimerase Kuantitatif Real-Time (qRT-PCR)
Untuk qRT-PCR, RNA diekstraksi dari jaringan prostat menggunakan QIAzol (Qiagen, Hilden, Jerman). RNA yang dimurnikan kemudian ditranskripsi balik menjadi cDNA menggunakan Maxima First Strand cDNA Synthesis Kit (Thermo Fisher). Amplifikasi dengan qPCR dilakukan dalam volume reaksi 10-µL yang berisi primer dan Power SYBR Green Master Mix (Thermo Fisher); deteksi sinyal menggunakan C1000 Touch Thermal Cycler (Bio-Rad, Hercules, CA, AS). Sampel kemudian dibandingkan menggunakan metode CT relatif, dan β-aktin digunakan untuk normalisasi untuk kuantifikasi menggunakan metode 2 − ΔΔCq. Semua urutan primer tercantum dalam Tabel 1 dan 2 .
| Gen manusia | Depan (5′–3′) | Mundur (3′–5′) |
|---|---|---|
| AR | TCGTCCACGTGTAAGTTGCG | GAGCCAGGTGTAGTGTGTG |
| PSA | CTGACCTCAAATACCTGGCCT | ACAAAAGGGTGATCTTGCTGG |
| SRC-1 | TGGCGTTGCTTGTTGTTGTGGTG | GCTGGTATCCTTCCTTAGTG |
| Bahasa Indonesia: PCNA | AGGAAAGTCTAGCTGGTTTCG | TTAAACGGTTGCAGGCGTAG |
| TNF-α | CCCATCTATCTGGGAGGGGGT | ATCCCAAAAGTAGACCTGCCC |
| Pesawat IL-6 | CCGGGAACGAAAGAGAAGCT | AGGGCCTGTGGAGAAGG |
| IL-1β | AGCTGATGGCCCTAAACAGA | TCGGAGATTTCGTAGCTGGAT |
| E-Kaderin | GGGTGTCGAGGGAAAATAGG | CGAGAGCTACACGTTCAGG |
| N-Kaderin | ATGCACATCCTTCGATAAGACTG | TCAGGCGTCTGTAGAGGCTT |
| Vimentin | CTTTGTCGTGGTTGTAGCTGGT | GACGCCATCAACACCGAGTT |
| SMA alfa | TCAAATACCCCATTGAACACGG | GGTGCTCTCAGGTGCTACA |
| β-Aktin | CTTGCGGATGTCCACGTCA | GGGCCAGGTCATCACCATTGG |
Singkatan: AR, reseptor androgen; E-kadherin, kadherin epitel; IL-1β, interleukin-1 beta; IL-6, interleukin-6; N-kadherin, kadherin saraf; PCNA, antigen nuklir sel yang berkembang biak; PSA, antigen spesifik prostat; SRC-1, koaktivator reseptor steroid-1; TNF-α, faktor nekrosis tumor-α; α-SMA, α-aktin otot polos.
| Gen tikus | Depan (5′–3′) | Mundur (3′–5′) |
|---|---|---|
| AR | GGGCCACTGAACACTGAAGA | TAGCGGAGCTTTGTGACTGG |
| Bahasa Indonesia: PCNA | BERTINDAKLAH | AGAGCTTGGCAATGGGAACA |
| PSA | ATTGGGTTTAGCGCATGGGA | CAAAGACACTTGTGCGGGTG |
| TNF-α | TGGTGGTTTGTGAGTGTGAGG | AGGCACTCCCCCAAAAAGATG |
| Pesawat IL-6 | ATAACGCACTAGGTTTGCCGA | AGTCTTCCTACCCCAATTTCC |
| SMA alfa | TATAGGTTTGTTCGTGATGC | CCTTCGTGACTACTGCCGAG |
| β-Aktin | BERTINDAK PADATTTGGGGGGATGTTTGTCC | BERTINDAKGAGCTGCGTTTTACACCC |
Singkatan: AR, reseptor androgen; E-kadherin, kadherin epitel; IL-1β, interleukin-1 beta; IL-6, interleukin-6; N-kadherin, kadherin saraf; PCNA, antigen nuklir sel yang berkembang biak; PSA, antigen spesifik prostat; SRC-1, koaktivator reseptor steroid-1; TNF-α, faktor nekrosis tumor-α; α-SMA, α-aktin otot polos.
2.10 Analisis Statistik
Semua percobaan dilakukan dalam rangkap tiga, dan hasilnya disajikan sebagai mean ± standard error of the mean (SEM) dari tiga percobaan independen. Analisis statistik dan visualisasi data dilakukan menggunakan GraphPad Prism v8.0.
Normalitas data dinilai menggunakan uji Shapiro–Wilk, dan semua kumpulan data mengikuti distribusi normal. Oleh karena itu, untuk perbandingan di antara beberapa kelompok, analisis varians satu arah (ANOVA) diikuti oleh uji post hoc perbedaan signifikan jujur (HSD) Tukey diterapkan. Nilai p kurang dari 0,05 dianggap signifikan secara statistik. Untuk perbandingan dengan kelompok BPH, signifikansi statistik ditunjukkan menggunakan tanda bintang: p < 0,05*, p < 0,01**, dan p < 0,001***. Untuk perbandingan dengan kelompok CON, signifikansi dilambangkan menggunakan simbol hash: p < 0,05#, p < 0,01##, dan p < 0,001###.
3 Hasil
3.1 Identifikasi Fitokimia dalam HH Menggunakan UHPLC-Q-Exactive Orbitrap MS
Analisis fitokimia HH menggunakan UHPLC-Q-Exactive Orbitrap MS mengidentifikasi lima komponen flavonoid: mirisetin, ampelopsin (dihidromirisetin), pinosembrin (dihidrokrisin), quercetin, dan taksifolin. Madu, termasuk HH, berfungsi sebagai sumber alami flavonoid, asam fenolik, dan turunannya. Penelitian sebelumnya menunjukkan bahwa komposisi dan konsentrasi komponen-komponen ini dalam madu sangat penting dalam menentukan sifat biologisnya, seperti potensi antioksidan (Meda et al. 2005 ; Khalil dan Sulaiman 2010 ; Chan et al. 2013 ). Selain itu, di antara berbagai teknik yang tersedia untuk mengidentifikasi komponen fenolik dan flavonoid dalam madu, yang paling umum digunakan adalah kombinasi MS dan HPLC. Lima komponen flavonoid, termasuk myricetin, ampelopsin, pinocembrin, quercetin, dan taxifolin, yang diidentifikasi dalam HH dianalisis dengan membandingkan waktu retensi ( t R ), ion prekursor yang diukur, dan fragmen MS/MS dengan yang ada pada zat standar referensi. Hasil analisis mengonfirmasi bahwa mode ionisasi negatif memberikan kondisi yang paling sesuai untuk menganalisis senyawa ini. Hal ini dikonfirmasi oleh sifat ionisasi elektrospray dalam mode ion negatif flavonoid yang diketahui dari penelitian sebelumnya (Cuyckens dan Claeys 2004 ). Dengan demikian, kami menyajikan bahwa rincian flavonoid yang melekat pada HH dalam kondisi ionisasi negatif dirangkum dalam Tabel 3. Oleh karena itu, kami bertujuan untuk melakukan percobaan tentang efek perbaikan HH, yang mengandung flavonoid ini, pada BPH.
| TIDAK | t R (menit) | Komposisi unsur | adukan | Diperkirakan ( m/z) ) | Dihitung ( m/z ) | Kesalahan (ppm) | Identifikasi |
|---|---|---|---|---|---|---|---|
| 1 | 5.88 | C15H12O | [M–H] − | 319.0459 | 319.0462 | 0.7306 | Ampelopsin |
| 2 | Tanggal 7.08 | C15H10O | [M–H] − | 303.0510 | 303.0511 | 0.3876 | Taksi |
| 3 | 8.03 | C42H62O | [M–H] − | 317.0303 | 317.0305 | 0.7178 | Mirisetin |
| 4 | 9.66 | C15H10O | [M–H] − | 301.0354 | Nomor telepon 301.0357 | 1.0815 | Kuersetin |
| 5 | 14.46 | C15H12O | [M–H] − | 255.0663 | 255.0665 | 1.0334 | Pinosembrin |
Madu biasa terkenal karena kandungan senyawa fenoliknya yang kaya, yang meliputi flavonoid seperti quercetin, kaempferol, apigenin, dan krisin (Valverde et al. 2022 ). Senyawa bioaktif ini berkontribusi secara signifikan terhadap sifat antioksidan, antiinflamasi, dan antimikroba dari madu. Namun, dalam madu yang berasal dari HH, konstituen fenolik yang dominan bergeser ke arah ampelopsin, taksifolin, dan mirisetin. Ampelopsin, flavonoid yang dikenal karena efek antioksidan dan antiinflamasinya yang kuat, bersama dengan taksifolin dan mirisetin, yang keduanya dikenal karena sifat terapeutik potensialnya, dapat memainkan peran penting dalam mengelola kondisi seperti BPH. Mengingat keterlibatan stres oksidatif dan inflamasi yang diketahui dalam patogenesis BPH, senyawa bioaktif ini dapat berkontribusi untuk meringankan gejala dan berpotensi memperlambat perkembangan kondisi melalui mekanisme antioksidan dan antiinflamasinya. Profil fenolik yang khas dari madu honeysuckle menunjukkan bahwa konstituen spesifiknya dapat menawarkan manfaat terapeutik yang ditargetkan dalam pengobatan BPH.
3.2 HH Menghambat Proliferasi Sel melalui Sinyal AR pada Sel RWPE-1 yang Diinduksi DHT
Untuk menguji efek antiproliferatif HH, sel epitel prostat RWPE-1 (normal) digunakan untuk membuat model BPH in vitro melalui induksi DHT. Hasil eksperimen kami mengevaluasi viabilitas sel menurut standar ISO 10993-5 (ISO 2009 ). Tidak ada efek sitotoksik yang diamati pada sel RWPE-1 pada konsentrasi HH berapa pun (Gambar 1A ), dan proliferasi sel dihambat secara signifikan pada sel RWPE-1 yang distimulasi DHT (Gambar 1B ), yang menunjukkan bahwa HH menangkal proliferasi yang diinduksi DHT. Pemeriksaan selanjutnya terhadap ekspresi biomarker prostat (misalnya, AR, PSA, steroid receptor coactivator-1 [SRC-1], dan proliferating cell nuclear antigen [PCNA]) mengungkapkan bahwa HH secara signifikan mengurangi ekspresi AR, yang diinduksi oleh respons androgen terhadap DHT, PSA, biomarker androgen-sensitif spesifik prostat, SRC-1, koaktivator reseptor nuklir termasuk AR, dan PCNA, penanda utama proliferasi sel (Gambar 1C ). Penurunan ekspresi PCNA setelah pengobatan HH secara langsung mendukung efek penghambatan pada proliferasi sel. Selain itu, HH secara signifikan mengurangi ekspresi protein AR dan PSA (Gambar 1D ). Kami menyimpulkan bahwa HH menghambat proliferasi sel melalui pengaturan pensinyalan androgen/AR.

3.3 HH Menghambat Respons Peradangan pada Sel RWPE-1 yang Diinduksi DHT
Peradangan mendorong proliferasi sel dalam jaringan prostat, sehingga menyebabkan BPH (Gandaglia et al. 2013 ). Pasien dengan BPH dan peradangan menunjukkan tingkat tinggi penanda BPH histologis dan molekuler, yang menunjukkan bahwa peradangan menyertai gejala BPH yang memburuk (Chughtai et al. 2011 ). Oleh karena itu, kami menyelidiki apakah HH menunjukkan efek anti-inflamasi. Pertama, kami memeriksa enzim respons inflamasi COX-2 dan iNOS (Wu et al. 2007 ; Abdel-Aziz et al. 2020 ). Kami mengamati bahwa aktivitas COX-2 dan iNOS yang diinduksi oleh DHT berkurang oleh HH (Gambar 2A ). Namun, COX-2 menghasilkan PGE2, iNOS menghasilkan NO, dan keduanya mendorong ekspresi sitokin inflamasi (misalnya, IL-6 dan TNF-α). Kami kemudian menyelidiki apakah ekspresi sitokin inflamasi yang diinduksi DHT dalam sel RWPE-1 dihambat oleh HH, dan mengamati bahwa induksi DHT meningkatkan ekspresi protein IL-6 dan TNF-α, sementara HH menguranginya (Gambar 2B ). Lebih jauh lagi, tingkat mRNA IL-6, TNF-α, dan interleukin-1 beta (IL-1β) yang diatur naik oleh DHT diatur turun oleh HH (Gambar 2C ). Hasil-hasil ini menunjukkan bahwa HH secara efektif menekan respons inflamasi dalam sel RWPE-1 yang diinduksi DHT dengan menghambat ekspresi sitokin pro-inflamasi, yang menunjukkan potensinya sebagai agen anti-inflamasi dalam pengobatan BPH.
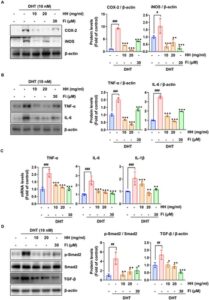
3.4 HH Mengatur Aktivasi Sinyal TGF-β/Smad2 pada Sel RWPE-1 yang Diinduksi DHT
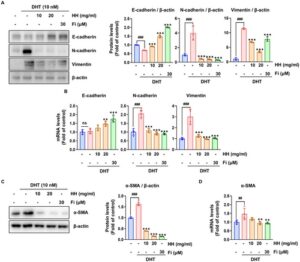
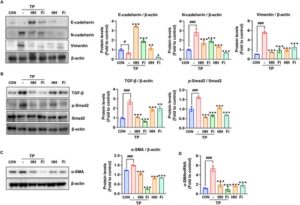
Bahasa Indonesia: Pada BPH, jalur pensinyalan TGF-β/Smad mengatur pertumbuhan sel, diferensiasi, dan apoptosis (Alonso-Magdalena et al. 2009 ; Kim et al. 2023 ; Li et al. 2024 ), dan aktivasi abnormalnya menyebabkan fibrosis dan proliferasi sel stroma, yang menyebabkan pembesaran prostat (Giarratana et al. 2024 ). Kami kemudian menguji apakah HH menghambat EMT melalui aktivasi jalur pensinyalan TGF-β/Smad2 dengan menilai ekspresi penanda. Kadar protein TGF-β dan p-Smad2 yang tinggi pada sel RWPE-1 yang terstimulasi DHT berkurang secara signifikan oleh HH (Gambar 2D ). Kami kemudian mengonfirmasi ekspresi penanda terkait EMT dan menemukan bahwa pengobatan HH secara signifikan meningkatkan ekspresi E-kadherin, sedangkan kadar protein (Gambar 3A ) dan mRNA (Gambar 3B ) dari N-kadherin dan vimentin menurun. Selain itu, ekspresi mRNA dan protein α-SMA berkurang secara signifikan oleh HH (Gambar 3C , D ). Temuan ini menunjukkan bahwa HH menghambat EMT dalam sel RWPE-1 yang diinduksi DHT dengan menurunkan regulasi jalur pensinyalan TGF-β/Smad2, sehingga mengurangi penanda terkait fibrosis dan meningkatkan karakteristik epitel. Hal ini menyoroti peran potensial HH dalam memodulasi proses fibrotik utama pada BPH.
3.5 HH Mencegah BPH pada Tikus BPH yang Diinduksi TP
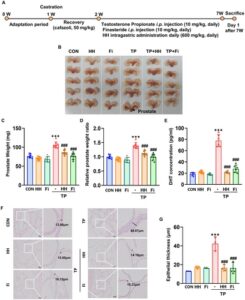
Jaringan prostat dari tikus BPH yang diinduksi TP dianalisis untuk menilai apakah HH mengurangi hipertrofi prostat. Prostat membesar karena injeksi TP berkurang ukurannya setelah pengobatan HH dan Fi (Gambar 4B ). PW dan rasio PW terhadap berat badan (PW/BW) secara signifikan lebih tinggi pada kelompok TP daripada kelompok CON tetapi secara signifikan berkurang setelah pengobatan HH dan Fi (Gambar 4C , D ). Kadar DHT pada tikus ditentukan melalui serum ELISA. Kadar DHT serum meningkat secara signifikan oleh injeksi TP tetapi secara signifikan dikurangi oleh HH dan Fi (Gambar 4E ). Pewarnaan H&E kemudian digunakan untuk mengidentifikasi perubahan histologis dalam sampel jaringan prostat dari setiap kelompok. Relatif terhadap kelompok CON, kelompok TP menunjukkan gejala BPH, termasuk epitel berlapis-lapis. Namun, gejala-gejala ini berkurang pada kelompok HH dan Fi (Gambar 5F ), dengan efek terapeutik yang sangat penting pada ketebalan epitel prostat (Gambar 5G ). Data menunjukkan bahwa HH secara efektif mengurangi pembesaran prostat, kadar DHT, dan kelainan histologis yang terkait dengan BPH pada tikus yang diinduksi TP. Hasil ini menunjukkan bahwa HH memiliki efek perlindungan terhadap hipertrofi prostat, menjadikannya kandidat yang menjanjikan untuk penanganan BPH.
3.6 HH Menunjukkan Sinyal AR dan Efek Anti-Inflamasi pada Tikus yang Diinduksi TP
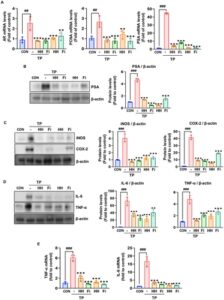
Efek pengobatan HH pada penanda sinyal AR dan faktor inflamasi pada tikus BPH yang diinduksi TP diselidiki. Kami menemukan bahwa mRNA AR, PCNA, dan PSA meningkat pada tikus BPH yang diinduksi TP tetapi menurun setelah pemberian HH dan Fi (Gambar 5A ). Ekspresi protein PSA mengikuti pola yang sama (Gambar 5B ), seperti halnya tingkat ekspresi mediator inflamasi, seperti protein COX-2 dan iNOS (Gambar 5C ), dan protein sitokin inflamasi IL-6 dan TNF-α (Gambar 5D ). Ekspresi mRNA TNF-α dan IL-6 juga meningkat pada kelompok TP tetapi lebih rendah pada kelompok HH dan Fi (Gambar 5E ). Hasil ini menunjukkan bahwa HH tidak hanya menekan sinyal AR tetapi juga mengurangi inflamasi pada tikus BPH yang diinduksi TP. Efek ganda ini menunjukkan bahwa HH dapat memberikan manfaat terapeutik dengan menargetkan jalur hormonal dan inflamasi yang terlibat dalam perkembangan BPH.
3.7 HH Menghambat Aktivitas EMT melalui Modulasi Jalur Sinyal TGF-β/Smad
Pada BPH, ekspresi TGF-β menginduksi EMT (He et al. 2016 ). Pada kelompok TP, kami menemukan bahwa ekspresi protein penanda epitel E-kadherin menurun, sedangkan ekspresi penanda mesenkimal N-kadherin dan vimentin meningkat. Namun, pada kelompok HH dan Fi, EMT dihambat melalui peningkatan regulasi E-kadherin dan penurunan regulasi N-kadherin dan vimentin (Gambar 6A ). Pada jaringan BPH, TGFBR2 diekspresikan secara berlebihan, mengaktifkan pensinyalan TGF-β/Smad melalui fosforilasi Smad2/3, dan aktivasi abnormal jalur ini dapat meningkatkan perkembangan BPH. Hasil penelitian mengungkapkan bahwa hal itu menginduksi EMT pada kelompok TP dan mengaktifkan pensinyalan TGF-β/Smad, sedangkan kelompok HH dan Fi menunjukkan penurunan ekspresi TGF-β dan p-Smad2 (Gambar 6B ). Selama perkembangan EMT, α-SMA diekspresikan sebagai indikator transisi mesenkimal dan memainkan peran penting dalam kondisi fisiologis atau patologis seperti fibrosis jaringan dan penyembuhan luka (Yang et al. 2017 ). Misalnya, ekspresi EMT dan α-SMA dapat meningkat pada BPH dan sel kanker (Speca et al. 2012 ; Hu et al. 2014 ). Hasil kami menunjukkan bahwa ekspresi protein dan mRNA α-SMA secara signifikan lebih tinggi pada kelompok TP daripada kontrol tetapi menurun pada kelompok HH dan Fi (Gambar 6C , D ). Oleh karena itu, hasil kami menunjukkan bahwa BPH yang diinduksi TP dapat dicegah dan diobati dengan mengatur pensinyalan TGF-β/Smad dan EMT oleh HH.
4 Diskusi
Kami menyelidiki efek HH pada pensinyalan AR dan TGF-β/Smad2, jalur pensinyalan terkait EMT yang berhubungan dengan BPH. Pada BPH, pensinyalan androgen/AR meningkatkan proliferasi sel epitel prostat, yang mendukung pertumbuhan sel stroma selama perkembangan BPH (Silva et al. 2001 ). Oleh karena itu, aktivasi abnormal pensinyalan androgen/AR dapat menyebabkan BPH atau kanker prostat (Izumi et al. 2013 ). Kami menggunakan model tikus BPH yang diinduksi TP untuk menyelidiki efek terapeutik HH dan menemukan bahwa HH secara signifikan mengurangi ukuran prostat, ketebalan epitel, kadar DHT serum, dan kadar mRNA AR, PCNA, dan PSA. Eksperimen in vitro tambahan menunjukkan bahwa pengobatan HH menurunkan ekspresi mRNA AR, PSA, SRC-1, dan PCNA yang diinduksi DHT. Penelitian sebelumnya telah menunjukkan bahwa aktivasi AR oleh androgen memengaruhi neutrofil dan makrofag, sehingga meningkatkan respons inflamasi (Pace dan Werz 2020 ). Di sini, kami mengonfirmasi bahwa ekspresi iNOS, COX-2, IL-6, dan TNF-α ditekan oleh pengobatan HH pada tikus BPH yang diinduksi TP dan sel RWPE-1 yang diinduksi DHT. Hasil ini menunjukkan bahwa HH dapat memberikan manfaat terapeutik melalui penghambatan sinyal AR selama BPH dan dengan mengelola peradangan dan perkembangan penyakit.
HH tidak hanya mengurangi sinyal AR tetapi juga memberikan efek terapeutiknya dengan memodulasi jalur EMT. Penelitian BPH yang ada sering kali berfokus pada bagaimana sinyal androgen dan TGF-β mengatur proliferasi dan transformasi sel. Misalnya, satu penelitian menunjukkan bahwa sinyal TGF-β sangat penting untuk berbagai proses seluler, termasuk EMT dalam fibrosis dan kanker (Wang et al. 2023) ; Giarratana et al. 2024 ). DHT dan androgen lainnya meningkatkan sinyal TGF-β, yang dapat mengaktifkan jalur Smad dan meningkatkan EMT (Kang et al. 2001 ). Hal ini penting untuk perkembangan BPH dan kanker prostat, karena jalur ini terlibat dalam proliferasi sel patologis dan remodeling jaringan (Alonso-Magdalena et al. 2009 ). Di sini, kami menunjukkan bahwa pengobatan TP menginduksi EMT dalam model hewan BPH, sedangkan pengobatan dengan HH dan Fi membalikkan efek ini. Hasil kami menyoroti peran α-SMA dalam perkembangan BPH, dengan pengobatan TP secara signifikan meningkatkan ekspresi α-SMA, dan pengobatan HH dan Fi menekan kadar α-SMA, yang menunjukkan bahwa hal itu dapat mencegah fibrosis dan pertumbuhan stroma yang abnormal. Secara khusus, HH terbukti menurunkan ekspresi AR, PSA, dan SRC-1, sementara secara bersamaan mengatur penanda terkait EMT—meningkatkan E-kadherin dan menurunkan kadar N-kadherin, vimentin, dan α-SMA. Hal ini menunjukkan bahwa HH menghambat EMT melalui penekanan jalur pensinyalan TGF-β/Smad2, yang sangat penting dalam perkembangan BPH. Lebih jauh, HH mengurangi ekspresi sitokin pro-inflamasi seperti IL-6, TNF-α, COX-2, dan iNOS, yang menunjukkan potensinya untuk mengurangi pembesaran prostat terkait peradangan. Pengaturan terpadu dari pensinyalan hormonal, perkembangan EMT, dan peradangan ini menyoroti HH sebagai kandidat terapi multi-target yang menjanjikan untuk manajemen BPH.
Meskipun kami tidak melakukan percobaan khusus untuk mengisolasi efek masing-masing komponen dalam HH, literatur yang ada menunjukkan bahwa senyawa fenolik tertentu yang ada dalam HH, seperti ampelopsin, taksifolin, dan mirisetin, dapat memainkan peran penting dalam efek terapeutiknya. Ampelopsin dikenal karena sifat antioksidannya yang kuat (Zhang et al. 2021 ) dan anti-inflamasinya (Qi et al. 2012 ), yang dapat berkontribusi pada penekanan sitokin pro-inflamasi yang diamati dalam penelitian ini. Taksifolin dan mirisetin telah dilaporkan memengaruhi jalur proliferasi dan apoptosis sel (Zhu et al. 2020 ; Butt et al. 2021 ), yang berpotensi memengaruhi proses pensinyalan AR dan EMT (Das et al. 2021 ; Yuan et al. 2024 ). Tindakan sinergis dari senyawa bioaktif ini mungkin mendasari efek anti-inflamasi, anti-fibrotik, dan antiproliferatif yang diamati dari HH dalam model BPH. Penelitian lebih lanjut diperlukan untuk mengisolasi dan mengkarakterisasi kontribusi spesifik komponen-komponen ini terhadap efek terapeutik HH.
5 Kesimpulan
Sebagai kesimpulan, penelitian kami menunjukkan bahwa HH memberikan efek terapeutik yang signifikan pada BPH dengan menargetkan beberapa jalur patologis. HH secara efektif mengurangi pembesaran prostat, menekan sinyal AR, dan menghambat proses EMT yang dimediasi TGF-β/Smad2. Selain itu, HH menunjukkan sifat antiinflamasi yang kuat, sebagaimana dibuktikan oleh penurunan regulasi sitokin dan enzim proinflamasi seperti IL-6, TNF-α, COX-2, dan iNOS. Efek gabungan HH pada sinyal androgen, fibrosis, dan inflamasi menunjukkan potensinya sebagai agen terapeutik alami untuk mengelola BPH. Meskipun komponen bioaktif yang tepat yang bertanggung jawab atas efek ini masih harus dijelaskan sepenuhnya, senyawa seperti ampelopsin, taksifolin, dan mirisetin kemungkinan merupakan kontributornya. Penelitian lebih lanjut yang berfokus pada mekanisme spesifik dan aplikasi klinis HH diperlukan untuk memvalidasi kemanjurannya dalam pengobatan BPH.

