
ABSTRAK
Penelitian ini bertujuan untuk mengisolasi polisakarida Gentian dan mengeksplorasi efek perlindungan polisakarida Gentian pada lipopolisakarida yang dikombinasikan dengan D-galaktosamin (D-GaLN/LPS) yang diinduksi cedera hati kimiawi, dasar teoritis dan material untuk pencegahan dan pengobatan cedera hati. Polisakarida yang larut dalam air (GSBP-Na-1), dengan berat molekul rata-rata 3,82 kDa, diisolasi dan dimurnikan dari ekstrak air Gentian menggunakan kromatografi kolom Dietilaminoetil-selulosa (DEAE), kromatografi gel agarosa CL-6B, dan kromatografi Sephadex G25. Model cedera hati kimiawi dibuat pada tikus melalui injeksi intraperitoneal D-GalN/LPS. Percobaan in vivo menunjukkan bahwa polisakarida mentah Gentian memiliki efek perlindungan pada model cedera hati yang diinduksi oleh lipopolisakarida yang dikombinasikan dengan D-galaktosamin. Ini dapat bertindak dengan mengaktifkan jalur Nrf2-HO-1 untuk menghambat oksidasi dan mengurangi pelepasan peradangan.
1 Pendahuluan
Hati, yang merupakan organ parenkim utama dalam anatomi manusia, berfungsi sebagai pengatur utama metabolisme xenobiotik dan pengaturan homeostasis glukosa dan lipid (Neshat et al. 2021 ). Paradoksnya, tanggung jawab metabolik kritis dan kecanggihan biokimianya membuat organ ini rentan terhadap kerusakan multifaktorial. Cedera hati merupakan prekursor patofisiologis mendasar dalam hepatologi, dengan paparan kronis terhadap rangsangan yang merugikan, memulai kontinum patologis yang berkembang melalui fibrosis dan sirosis hingga hepatokarsinoma—pola perkembangan penyakit yang merupakan tantangan kesehatan global utama (Yi 2022 ). Studi epidemiologi kontemporer mengungkapkan peningkatan yang mengkhawatirkan dalam hepatotoksisitas yang diinduksi secara kimia, terutama yang terkait dengan polutan lingkungan dan agen farmakologis (melebihi 1000 senyawa yang terdokumentasi), sebuah tren yang sangat berkorelasi dengan perkembangan sosial ekonomi dan kemajuan farmasi (Olennikov et al. 2015 ).
Penelitian farmakologi kontemporer telah menyaksikan pergeseran paradigma ke arah intervensi fitoterapi, dengan turunan botani yang menunjukkan kemanjuran profilaksis dan terapeutik yang luar biasa di seluruh spesies sambil mempertahankan profil keamanan yang baik. Kebangkitan fitomedisin ini secara khusus telah menyoroti kebutuhan kritis untuk pengembangan sistematis fitokompon hepatoprotektif, mengingat potensinya untuk mengatasi kesenjangan terapeutik dalam mengelola patologi hati dengan biokompatibilitas yang ditingkatkan.
Gentiana scabra Bunge merupakan herba menahun dari famili Gentianaceae, merupakan tanaman obat tradisional asli Tiongkok Timur Laut, terutama tersebar di provinsi timur laut (Heilongjiang, Jilin, Liaoning), Mongolia Dalam, dan Yunnan (Xu et al. 2021 ). Komponen obat utamanya adalah akar dan rimpang kering, yang memiliki rasa pahit dan sifat dingin. Menurut teori pengobatan tradisional Tiongkok, tanaman ini dikaitkan dengan meridian hati dan kantong empedu dan dikenal karena efeknya dalam membersihkan panas, mengeringkan kelembapan, dan membersihkan api hati-kantong empedu (Zhao et al. 2023 ). Selain itu, Gentian menunjukkan sifat antijamur, antibakteri, antimalaria, antiinflamasi, hepatoprotektif, dan sedatif (Cao et al. 2021 ). Tiongkok memiliki sumber daya Gentian yang melimpah , dan tanaman ini mengandung beragam senyawa bioaktif dengan nilai obat yang signifikan (Shi et al. 2021 ). Sebagai bahan obat homologus obat-obatan dan makanan, Gentian memiliki prospek pengembangan yang besar dalam pengobatan penyakit dan pengembangan makanan fungsional (Feng et al. 2023 ).
Polisakarida memiliki aktivitas biologis yang kaya seperti menurunkan gula darah, antiperadangan, melindungi hati dan antitumor. Polisakarida Gentian memiliki berbagai aktivitas biologis yang signifikan. Dalam hal pengaturan kekebalan tubuh, ia dapat meningkatkan proliferasi dan aktivasi makrofag dan limfosit, mengatur sekresi dan ekspresi faktor imun, dan meningkatkan fungsi kekebalan tubuh. Dalam hal aktivitas antioksidan, ia dapat meningkatkan aktivitas oksidase antioksidan dan mengurangi kerusakan oksidatif in vivo. Dalam hal aktivitas antiperadangan, polisakarida Gentian dapat menghambat pelepasan faktor inflamasi dan mengurangi respons inflamasi pada model inflamasi seluler dan hewan, dan mekanisme antiperadangannya terkait dengan penghambatan jalur pensinyalan inflamasi NF-κB. Dalam aspek aktivitas hipolipidemik, ia dapat mengurangi kadar kolesterol dan trigliserida serum. Dalam hal aktivitas perlindungan hati, ia dapat mengurangi indikator fungsi hati dan meningkatkan morfologi jaringan hati, dan mekanisme perlindungan hatinya termasuk meningkatkan regenerasi sel hati, antioksidasi, antiperadangan dan sebagainya.
2 Bahan dan Metode
2.1 Bahan dan Reagen
Gentian dibeli dari Yuefeng Chinese Medicine Technology Co. Ltd di Provinsi Anhui. DEAE-cellulose-52, Sepharose CL-6B, dan SephadexG-25 dibeli dari organisme daun sumber. Kit ELISA TNF-α, IL-10, dan IL-6 dibeli dari Shanghai Enzyme Linked Biotechnology Co. Ltd. Aspartate transaminase (AST), alanine transaminase (ALT), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), dan malondialdehyde (MDA) dibeli dari Nanjing Jiancheng Bioengineering Institute.
Tujuh puluh dua tikus ICR jantan (20–22 g) dibeli dari Changchun Yisi Laboratory Animal Technology Co. Ltd.
Nomor lisensi hewan percobaan: SCXK(Ji)2023-0002. Selama percobaan, tikus dipelihara dalam lingkungan siklus (23 ± 1) °C, kelembaban 55% ± 10%, terang dan gelap selama masing-masing 12 jam.
2.2 Metode Percobaan
2.2.1 Ekstraksi Polisakarida Kasar Dari Gentian
Akar Gentian yang dibeli dibilas, dan 30 g bahan ditempatkan dalam botol kerucut 1000 mL, tambahkan 750 mL air suling, rasio bahan terhadap cairan 1:25 (b/v). Rendam dalam air suling semalaman. Dalam kondisi penangas air 100°C, ekstraksi refluks dilakukan dua kali, masing-masing selama 3 jam. Filtrat gabungan dipekatkan hingga sekitar 100 mL menggunakan penguapan putar, perlahan-lahan tambahkan etanol anhidrat ke dalamnya dan aduk hingga fraksi volume akhir etanol menjadi 80%. Dan didiamkan pada suhu 4°C selama 24 jam. Tuangkan supernatan, endapan ke dalam tabung sentrifus, tambahkan etanol dalam jumlah yang sesuai, dan seimbangkan sentrifus. Sentrifus 3 kali, 3500 rpm selama 5 menit. Protein dihilangkan menggunakan metode Sevage. Buang endapan putih telur dan keringkan dalam oven. Akhirnya, polisakarida kasar Gentian diperoleh, bernama GSBP, dan hasilnya 3,73%.
2.2.2 Isolasi dan Pemurnian Polisakarida Gentian
Selulosa DEAE direndam dan diaktifkan dalam air suling untuk memastikan pembengkakan lengkap dan penghilangan gelembung udara. Kolom kromatografi (1,5 × 60 cm 2 ) dipasang dengan aman pada rangka besi dan diposisikan pada permukaan horizontal. Batang kaca digunakan untuk drainase, menahan sejumlah kecil fase mobil (air suling) di dalam kolom untuk mencegah pembentukan gelembung selama pengepakan. Pengisi disuntikkan perlahan ke dalam kolom untuk memungkinkan pengendapan alami, diikuti oleh pemadatan lembut dengan batang kaca untuk memastikan pengisian yang seragam. Setelah keseimbangan, fase mobil terdiri dari air suling, larutan NaCl 2 mol/L, dan air suling lagi, dengan setiap fase mobil keluar dua kali volume kolom pada laju aliran 2 mL/menit.
Ambil 1 g bubuk polisakarida mentah Gentian (GSBP) dan larutkan sepenuhnya dalam 10 mL air suling, sentrifus supernatan, saring dengan membran filter 0,45 mikron. Sampel kemudian dimasukkan secara merata dan perlahan ke dalam kolom. Elusi gradien dilakukan dengan menggunakan air suling, larutan natrium klorida 0,2 mol/L, dan larutan natrium klorida 0,5 mol/L pada laju alir 1 mL/menit. Fraksi 10 mL dikumpulkan dan diberi label hingga tidak ada polisakarida yang terdeteksi. Kolom kemudian didaur ulang dan dibersihkan, dengan pengisi dipulihkan dan disimpan dalam etanol 20%. Eluen diencerkan dengan tepat, dan kandungan polisakarida ditentukan menggunakan metode fenol-asam sulfat. Absorbansi UV diukur pada panjang gelombang 490 nm, dan kurva elusi diplot berdasarkan nilai absorbansi. Setiap komponen dipekatkan pada volume yang sesuai menurut puncak elusi, fraksi polisakarida netral (GSBP-N, dielusi dengan air suling) dan dua fraksi polisakarida asam (GSBP-A, elusi dengan 0,2 M NaCl, dan GSBP-B, elusi dengan 0,5 M NaCl).
GSBP-N selanjutnya diisolasi dan dimurnikan dengan kolom SepharoseCl-6B (2,6 × 100 cm). Komponen polisakarida dari kurva elusi diberi nama GSBP-Na dan GSBP-Nb. Kedua komponen tersebut selanjutnya dimurnikan dengan kolom SephadexG-25 untuk memperoleh GSBP-NA-1. Hasil GSBP-Na-1 adalah 57,4%.
2.2.3 Penentuan Berat Molekul
Konfigurasi larutan sampel: Timbang jumlah komponen Gentian murni yang sesuai dan larutkan dalam larutan NaCl 0,2 M untuk menyiapkan larutan sampel 5 mg/mL. Residu disaring dengan membran filter 0,22 μm dan dianalisis menggunakan kromatografi permeasi gel kinerja tinggi (HPGPC). Menggunakan sistem Shimadzu LC-10Avp, penentuan detektor refraksi diferensial RID-10A, kolom kromatografi: kolom TSK-gel G-3000 PWXL (7,8 × 300 mm) dipasang pada suhu 35°C, NaCl 0,2 M adalah fase mobil, laju alir 0,6 mL/menit, dan ukuran sampel 20 μL. Serangkaian glukan dengan berat molekul berbeda (1, 5, 12, 25, 50 kDa) dikalibrasi untuk kolom kromatografi, dan kurva standar disiapkan.
2.2.4 Analisis Komposisi Monosakarida
Komponen Gentian yang dimurnikan ditimbang dan dilarutkan dalam larutan HCl-metanol 2M untuk menyiapkan larutan sampel 2 mg/mL. Larutan diisi dengan N2, larutan sampel reaksi dimurnikan pada suhu 120°C dengan pemurni nitrogen selama 1 jam untuk menghilangkan asam metanol-asetat, dan kemudian 1 mL asam trifluoroasetat (TFA) 2M ditambahkan selama 1 jam untuk memurnikan dan mengeringkan lagi. Hidrolisat dibuat dari kolom awal dengan 1-fenil-3-metil-5-pirazolinon dan disaring melalui membran penyaring 0,22 μM. Sistem kromatografi cair kinerja tinggi (HPLC) dan kolom COSMOSIL 5C18PAQ (4,6 mm × 250 mm) digunakan untuk deteksi. Komposisi monosakarida GSBP-Na-1 diidentifikasi dan kandungannya dihitung.
2.2.5 Pengelompokan Hewan Percobaan dan Pemodelan Administrasi
Tikus ICR: 72 jantan, kelas bersih, berat (20 ± 2) g, diberi makanan bergizi, bebas makan dan minum. Setelah diberi makan selama 3 hari, hewan-hewan tersebut dibagi secara acak menjadi 6 kelompok dengan 12 hewan di setiap kelompok, termasuk kelompok kontrol normal (kelompok Con), kelompok model (kelompok Mod), kelompok obat positif (DDB), kelompok dosis rendah polisakarida Gentian (L-GSBP), kelompok dosis sedang polisakarida Gentian (M-GSBP) dan kelompok dosis tinggi polisakarida Gentian (H-GSBP). Tikus-tikus di setiap kelompok diberi makan di kandang. Selama percobaan, kelompok Con dan kelompok Mod diberi larutan natrium klorida 0,9%, kelompok obat positif diberi emulsi bifenilat 150 mg/kg, dan tiga kelompok dosis diberi masing-masing 50 mg/kg, 100 mg/kg dan 200 mg/kg polisakarida Gentian , dengan pemberian intragathral sekali sehari. Semua kelompok bebas makan dan minum. Pada hari ke-10, cetakan dibuat 2 jam setelah pemberian. Selain kelompok Con, D-GaLN/LPS 10 mL/kg GalN (700 mg/kg) + LPS (10 μg/kg) disuntikkan secara intraperitoneal ke setiap kelompok untuk menginduksi cedera hati kimia akut pada tikus. Kelompok Con disuntikkan secara intraperitoneal dengan dosis larutan natrium klorida yang sama, dan tikus tidak diberi air selama periode pemodelan (dalam waktu 24 jam). Darah diambil dari bola mata tikus, dan tikus dibunuh dengan cara mengangkat lehernya. Hati diambil, darah yang tersisa dicuci dengan garam fisiologis, dikeringkan dengan kertas saring, ditimbang dan dicatat. Hitung indeks hati. Tikus dalam setiap kelompok dipilih secara acak untuk anestesi peritoneal dengan 10% kloral hidrat (300 mg/kg), dan fiksasi multi-mode dilaksanakan melalui sistem perfusi intrakardiak: pertama, irigasi sirkulasi dengan salin normal dilakukan, dan kemudian larutan paraformaldehida 4% disuntikkan dengan pompa aliran konstan (0,5 mL/menit) selama 30 menit. Setelah mengonfirmasi keadaan anestesi dalam melalui pemantauan refleks saraf (ambang batas flutter yang diperlukan > level 3, sudut kanan tungkai kuat > 90°), ekstraksi lengkap organ hati dilakukan. Unit anatomi terbesar dari lobus lateral kiri (sekitar 500 mg) difiksasi dengan buffer netral formaldehida 4% (6 jam, 25°C), dan penanaman parafin dilakukan setelah perawatan dehidrasi gradien. Potongan-potongan berikutnya diwarnai dengan HE.
2.2.6 Uji Indeks Hati
Berat tikus sebelum pemberian, berat sebelum eksekusi dan berat jaringan hati ditimbang dan dicatat.
2.2.7 Penentuan Faktor Terkait dalam Serum Tikus
AST dan ALT dalam serum diukur sesuai dengan petunjuk kit. Kadar serum TNF-α, IL-6 dan IL-10 ditentukan dengan ELISA.
2.2.8 Penentuan Faktor Terkait pada Jaringan Hati Tikus
Jaringan hati diambil, larutan garam fisiologis ditambahkan, dihomogenkan, dan homogenat jaringan 10% disiapkan. GSH-PX, MDA, dan SOD dalam jaringan hati ditentukan sesuai dengan petunjuk kit.
2.2.9 Pengamatan Histomorfologi Hati
Jaringan yang difiksasi dicuci dengan air 3 kali selama 20 menit setiap kali. Kemudian didehidrasi dengan etanol gradien, xilena transparan dan diresapi dengan lilin. Jaringan yang tertanam diiris (4 μm), dipanggang dan diwarnai (HE), didehidrasi dan disegel, dan perubahan histopatologi diamati di bawah mikroskop.
2.2.10 Western Blotting Digunakan untuk Mendeteksi Tingkat Ekspresi Protein Nrf2 dan HO-1 pada Jaringan
Jumlah jaringan hati yang sesuai diambil dan diawetkan dengan cepat pada suhu -80°C. Jaringan hati ditambahkan ke buffer lisat, dihomogenkan dan dilisiskan di atas es selama 30 menit. Kemudian homogenat disentrifugasi pada suhu 4°C untuk mendapatkan supernatan. Rebus sampel untuk mengubah bentuk sampel protein. Protein diisolasi dan kemudian dipindahkan ke membran. Tempatkan film dalam susu skim pada suhu kamar selama 1 jam. Antibodi protein Nrf2 dan HO-1 pertama diinkubasi semalaman pada suhu 4°C. Film pencuci TBST 3 kali, setiap kali 10 menit. Inkubasi membran dengan antibodi sekunder berlabel yang sesuai (diencerkan sesuai dengan petunjuk) pada suhu kamar selama 1 jam. Film pencuci TBST 3 kali, setiap kali 10 menit. Menggunakan pengembang ECL, paparan dan pencitraan dilakukan di ruangan gelap. Ekspresi relatif Nrf2 dan HO-1 dihitung dengan menggunakan ImageJ dan perangkat lunak lainnya.
3 Hasil
3.1 Komponen Homogen GSBP-NA-1 Disiapkan
Polisakarida kasar GSBP diekstraksi dari Gentian dan hasilnya 3,73%. Seperti yang ditunjukkan pada Gambar 1A , GSBP memperoleh komponen gula netral GSBP-N (hasil 13,69%) dan komponen gula asam GBP-A (hasil 28,57%) dan GBP-B (hasil 25,71%) dengan menggunakan elusi gradien kolom pertukaran ion selulosa DEAE, seperti yang ditunjukkan pada Gambar 1B . Komponen GSBP-N selanjutnya dimurnikan dengan SepharoseCl-6B, dan diperoleh dua puncak elusi yang berbeda. Kedua komponen dikumpulkan, dihilangkan garamnya dengan dialisis, dan dikeringkan beku. Mereka diberi nama GSBP-Na (hasil 37,14%) dan GSBP-Nb (hasil 11,3%). Seperti yang ditunjukkan pada Gambar 1C . Komponen GSBP-Na-1 dimurnikan lebih lanjut dengan Sephadex G-25. Hasil penelitian menunjukkan bahwa komponen GSBP-Na dimurnikan dengan SephadexG-25 sehingga diperoleh komponen homogen sebanyak 104 mg (hasil 57,4%), yang diberi nama GBP-Na-1.
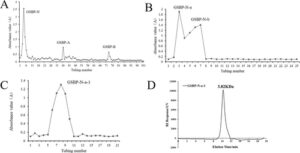
HPGPC digunakan untuk menganalisis residu dan menentukan berat molekul polisakarida yang dimurnikan dari Sephadex G25, seperti yang ditunjukkan pada Gambar 1D . Berat molekul GSBP-Na-1 seragam, dan berat molekul GSBP-Na-1 sekitar 1,433 kDa.
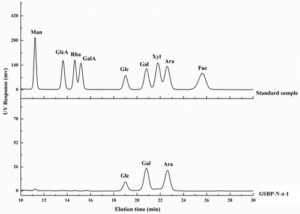
Seperti yang ditunjukkan pada Gambar 2 , hasil analisis HPLC menunjukkan bahwa GSBP-Na-1 sebagian besar terdiri dari Glc (13,8%), Gal (42,6%), Ara (43,6%).
3.2 Hasil Indeks Massa Tubuh dan Hati Tikus
Seperti yang ditunjukkan pada Tabel 1 , dibandingkan dengan kelompok con, berat hati pada kelompok Mod meningkat secara signifikan ( p < 0,05), yang mungkin disebabkan oleh pembengkakan hati yang disebabkan oleh peradangan yang berhasil diinduksi oleh induksi model. Indeks hati kelompok Mod secara signifikan lebih tinggi daripada kelompok Con ( p < 0,01), yang mengonfirmasi keberhasilan pemodelan dan pembesaran hati. Indeks hati tikus dalam kelompok DDB dan H-GSBP secara signifikan lebih rendah daripada kelompok Mod ( p < 0,05), yang menunjukkan bahwa polisakarida Gentian dosis tinggi memiliki efek anti-inflamasi.
TABEL 1. Hasil indeks berat badan dan berat hati tikus.
| Kelompok | Berat | Berat hati | Indeks hati (%) |
|---|---|---|---|
| Menipu | 21,20 ± 1,15 | 0,87 ± 0,07 | 4,16 ± 0,3 |
| Mod | 22,53 ± 0,46 | 1,24 ± 0,07 | 5,51 ± 0,23 ## |
| DDB | 21,41 ± 1,55 | 1,02 ± 0,14 | 4,72 ± 0,58 * |
| L-GSBP | 20,68 ± 0,56 | 1,06 ± 0,04 | 5,06 ± 0,2 |
| M-GSBP | 22,91 ± 2,02 | 1,17 ± 0,08 | 4,91 ± 0,33 |
| H-GSBP | 21,58 ± 0,87 | 1,05 ± 0,1 | 4,8 ± 0,47 * |
3.3 Aktivitas Enzim ALT dan AST (U/L) dalam Serum Tikus Ditentukan
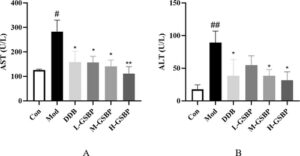
Hasil aktivitas enzim ALT dan AST (U/L) dalam serum tikus seperti yang ditunjukkan pada Gambar 3 adalah sebagai berikut: Dibandingkan dengan kelompok Con, aktivitas enzim ALT dan AST (U/L) pada tikus kelompok Mod secara signifikan lebih tinggi dibandingkan dengan kelompok Con ( p < 0,05); Dibandingkan dengan kelompok Mod, kadar ALT dan AST pada kelompok pemberian menurun ( p < 0,05), dan kadar AST pada kelompok H-GSBP menurun secara signifikan ( p < 0,01), yang mana hal ini sama atau lebih baik dibandingkan dengan kelompok DDB.
3.4 Hasil Penentuan Kadar TNF-α, IL-6 dan IL-10 dalam Serum Mencit
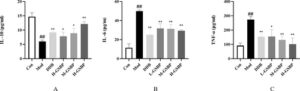
IL-6, IL-10, dan TNF-α adalah sitokin inflamasi penting yang mengatur aktivasi, proliferasi, dan diferensiasi sel T selama respons inflamasi. Pada Gambar 4 , kelompok model menunjukkan kadar IL-6 dan TNF-α yang meningkat secara signifikan dibandingkan dengan kelompok kosong ( p < 0,01), sedangkan kadar IL-10 berkurang secara nyata ( p < 0,01). Sebaliknya, pengobatan dengan polisakarida Gentian dosis tinggi secara signifikan melemahkan konsentrasi IL-6 dan TNF-α dan secara bersamaan meningkatkan kadar IL-10 ( p < 0,01).
3.5 Hasil Penentuan Faktor-Faktor Terkait pada Jaringan Hati Tikus
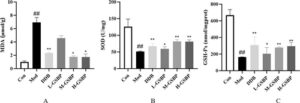
MDA adalah produk sampingan yang dihasilkan selama proses peroksidasi lipid, berfungsi sebagai indikator biokimia untuk secara tidak langsung menilai tingkat kerusakan oksidatif pada membran sel dan biomolekul. Hubungan ini menetapkan MDA sebagai penanda pengganti untuk mengukur cedera seluler yang disebabkan oleh stres oksidatif dalam sistem biologis. GSH-Px memiliki fungsi menghilangkan radikal bebas dan stres antioksidan, sementara aktivitas SOD mencerminkan kemampuan tubuh untuk menghilangkan radikal bebas oksigen. Pengukuran MDA dan GSH-Px secara simultan dapat secara akurat mencerminkan tingkat kerusakan jaringan hati. Hasil penentuan kandungan MDA, SOD, dan GSH-Px dalam jaringan hati tikus ditunjukkan pada Gambar 5 : Dibandingkan dengan kelompok Kontrol, kandungan MDA dalam kelompok Mod tikus meningkat secara signifikan ( p < 0,01), dan aktivitas SOD dan GSH-Px menurun secara signifikan ( p < 0,05), menunjukkan bahwa oksidasi hati telah terjadi dan kemampuan untuk menghilangkan radikal bebas oksigen lemah. Dibandingkan dengan kelompok Mod, kandungan MDA dalam kelompok perlakuan Polisakarida Longdan berkurang secara signifikan ( p < 0,05), dan aktivitas SOD dan GSH-Px meningkat secara signifikan ( p < 0,01). Tingkat oksidasi hati telah berkurang.
3.6 Pengamatan Histopatologi Hati Tikus
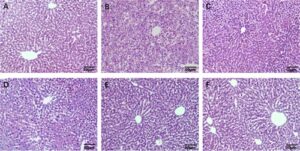
Pewarnaan HE jaringan hati tikus ditunjukkan pada Gambar 6. Pada kelompok kosong, hepatosit utuh, nukleus berbentuk bulat dan terletak di bagian tengah, sitoplasma utuh, dan lobulus hati tidak rusak. Pada kelompok model, hepatosit pecah dan nekrosis serta infiltrasi inflamasi terjadi di sekitar vena sentral. Setelah pemberian polisakarida, struktur lobulus setiap kelompok dosis menjadi jelas, area nekrotik hepatosit berkurang, tingkat kerusakan berkurang secara signifikan, dan morfologi sel dipulihkan dan ditingkatkan pada kelompok dosis rendah.
3.7 Western Blotting Digunakan untuk Mendeteksi Tingkat Ekspresi Protein Nrf2 dan HO-1 pada Jaringan
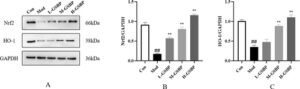
Seperti yang ditunjukkan pada Gambar 7 , Dibandingkan dengan kelompok Con, tingkat ekspresi Nrf2 dan HO-1 menurun secara signifikan ( p < 0,01). Dibandingkan dengan kelompok Mod, tingkat ekspresi Nrf2 dan HO-1 pada L-GSBP meningkat, dan pada M-GSBP, dibandingkan dengan kelompok MOD, tingkat ekspresi meningkat secara signifikan ( p < 0,01). Pada kelompok H-GSBP, tingkat ekspresi Nrf2 dan HO-1 meningkat secara signifikan dibandingkan dengan kelompok model ( p < 0,01). Dari grafik data, dapat dilihat bahwa tingkat ekspresi Nrf2 dan HO-1 menunjukkan tren naik dengan peningkatan dosis pemberian, dan ada hubungan yang bergantung pada dosis.
4 Diskusi
Sumber polisakarida alami sangat luas, dan komposisi kimianya kompleks. Polisakarida mentah sering kali disertai dengan protein, lemak, dan pigmen, yang dapat mengganggu identifikasi struktural dan analisis aktivitas selanjutnya (Yang et al. 2022 ) . Oleh karena itu, polisakarida mentah biasanya mengalami deproteinisasi, penghilangan lemak, dan penghilangan warna. Dalam penelitian ini, hanya metode Savage yang digunakan untuk penghilangan protein, karena pigmen dan lemak diharapkan akan dihilangkan selama pemisahan kromatografi beberapa kolom, sehingga tidak ada perawatan tambahan yang dilakukan. Polisakarida adalah polimer dengan berat molekul tinggi, yang terdiri dari campuran homolog dengan berat molekul yang bervariasi. Pemisahan dan pemurnian sangat penting untuk mendapatkan komponen polisakarida dengan distribusi berat molekul yang seragam (Wang et al. 2016 ).
Dalam bidang teknologi pemisahan dan pemurnian makromolekul biologis, kromatografi kolom telah menjadi standar emas ilmu pemisahan modern dengan resolusi dan skalabilitasnya yang sangat baik. Di antara keduanya, aplikasi sinergis kromatografi pertukaran anion dan kromatografi permeasi gel telah menunjukkan keunggulan unik dalam pemisahan halus zat polisakarida, dan merupakan sistem pendukung teknis yang penting untuk penelitian glikomik saat ini. Efisiensi pemisahan kromatografi pertukaran anion berdasarkan DEAE-selulosa disebabkan oleh heterogenitas kerapatan muatan permukaan polisakarida. Dalam sistem penyangga fosfat pH 7,0–8,5, gugus karboksil atau asam sulfat dari polisakarida asam memiliki interaksi elektrostatik reversibel dengan gugus DEAE, sedangkan polisakarida netral menunjukkan karakteristik retensi yang lemah karena kurangnya gugus pengion. Dengan membangun sistem elusi gradien 0→0,5 mol/L NaCl, desorpsi progresif komponen gula asam dapat diwujudkan. Perlu dicatat bahwa bentuk puncak karakteristik dalam kurva elusi tidak hanya dapat mencerminkan distribusi muatan polisakarida, tetapi juga menetapkan model kuantitatif substituen rantai gula dengan menghitung korelasi antara waktu retensi dan perubahan konduktivitas listrik. Media dekstran ikatan silang Sepharose CL-6B digunakan untuk kromatografi gel. Prinsip pemisahan didasarkan pada efek saringan molekuler yang disebabkan oleh perbedaan volume dinamis fluida. Dalam mode iso-elusi, molekul polisakarida dinilai menurut jari-jari Stokes, dan ada korelasi linier yang signifikan antara koefisien partisi (Kav) dan logaritma berat molekul ( R 2 > 0,98). Teknologi ini memiliki efek pemurnian sekunder pada komponen pra-terpisah DEAE, dan secara efektif dapat menghilangkan fragmen oligosakarida dan pengotor protein dengan sifat muatan yang sama. Indeks dispersi (PDI) polisakarida yang dimurnikan oleh GPC lebih rendah dari 1,05 dan mencapai standar monodispersitas.
Setelah komponen polisakarida dengan distribusi berat molekul yang seragam diperoleh, kandungan, komposisi, dan strukturnya dapat dianalisis. Metode fenol-asam sulfat diterima secara luas untuk menentukan kandungan polisakarida. Untuk analisis komposisi monosakarida, HPLC derivatisasi pra-kolom PMP umumnya digunakan karena kesederhanaan dan keakuratannya dibandingkan dengan kromatografi gas asetilasi. Kromatografi lapis tipis kurang sensitif, dan elektroforesis kapiler berkinerja tinggi merupakan alternatif lain (Li et al. 2021 ).
Pemisahan dan pemurnian polisakarida menjadi fraksi-fraksi yang berbeda bukan sekadar langkah metodologis, tetapi sangat penting untuk memahami aktivitas biologis dan karakteristik strukturalnya yang unik. Setiap fraksi dapat menunjukkan bioaktivitas yang berbeda, seperti sifat imunomodulatori, antioksidan, atau antikanker, yang sering dikaitkan dengan berat molekul spesifiknya, komposisi monosakarida, dan hubungan glikosida (Z. Liu et al. 2021 ). Misalnya, fraksi dengan berat molekul tinggi dapat menunjukkan efek peningkatan kekebalan yang lebih kuat, sementara fraksi dengan berat molekul rendah dapat menunjukkan bioavailabilitas dan aktivitas antioksidan yang lebih baik. Selain itu, fitur struktural fraksi-fraksi ini, seperti pola percabangan dan keberadaan gugus fungsi tertentu, dapat memengaruhi interaksinya dengan target biologis. Oleh karena itu, studi mendalam tentang struktur halus polisakarida tidak hanya memerlukan teknologi analitik canggih, tetapi juga perlu menggabungkan berbagai metode seperti inframerah, resonansi magnetik nuklir, spektrometri massa, dan analisis instrumental lainnya untuk analisis yang komprehensif, tetapi juga dapat menggunakan hidrolisis asam, metilasi, dan metode kimia lainnya untuk sepenuhnya mengungkap hubungan antara struktur dan aktivitas biologisnya.
Karena bioaktivitasnya yang luas dan toksisitasnya yang rendah, polisakarida telah menjadi fokus penelitian dan pengembangan di bidang kedokteran, makanan, dan produk kesehatan. Namun, karena kompleksitas struktur polisakarida dan keterbatasan metode penelitian, sebagian besar penelitian saat ini berfokus pada analisis struktur primer, dan eksplorasi hubungan antara struktur polisakarida yang lebih tinggi dan aktivitas biologisnya masih belum memadai. Oleh karena itu, studi mendalam tentang struktur halus polisakarida tidak hanya memerlukan teknologi analisis canggih, tetapi juga perlu menggabungkan berbagai metode seperti inframerah, resonansi magnetik nuklir, spektrometri massa dan analisis instrumental lainnya untuk analisis komprehensif, tetapi juga dapat menggunakan hidrolisis asam, metilasi dan metode kimia lainnya untuk sepenuhnya mengungkapkan hubungan antara struktur dan aktivitas biologisnya.
LPS/D-GalN merupakan zat hepatotoksik yang umum (Jin et al. 2020 ). D-GalN dapat menyebabkan nekrosis difus dan peradangan hati, mirip dengan perubahan patologis hati pada hepatitis virus klinis. LPS dapat meningkatkan hepatotoksisitas galaktosamin, sementara galaktosamin juga dapat menyebabkan hipersensitivitas terhadap lipopolisakarida, yang menyebabkan nekrosis hati yang meluas ketika kedua obat tersebut digabungkan (Zhang et al. 2020 ). Oleh karena itu, model hewan yang diinduksi oleh LPS/D-GalN digunakan secara luas untuk mengeksplorasi mekanisme gagal hati fulminan klinis dan menguji obat terapeutik yang potensial.
Injeksi intraperitoneal dapat menyebabkan nekrosis difus pada hepatosit. Proses ini mirip dengan perubahan patologis hati yang terjadi setelah hepatitis virus akut klinis (Suriguga et al. 2020 ). Kerusakan yang disebabkan oleh injeksi intraperitoneal cepat dan jelas, mudah diamati, dan lesinya serius. Oleh karena itu, kita harus melakukan pra-eksperimen terlebih dahulu dan memilih dosis yang tepat untuk pemodelan agar tidak menyebabkan kematian kelompok model.
LPS adalah endotoksin yang dapat mengaktifkan monosit dan makrofag, dan terutama bekerja melalui protein pengikat lipopolisakarida dan CD14 dalam tubuh. Ia mengikat reseptor transmembran Toll-like receptor 4 pada sel target seperti monosit dan sel endotel, dan dengan bantuan antigen limfosit 96, ia mentransfer sinyal ke dalam sitoplasma (Shu et al. 2020 ). Melalui jalur pensinyalan intraseluler yang kompleks, ia menyebabkan produksi faktor inflamasi, yang mengakibatkan kerusakan sel hati (Yan et al. 2024 ).
Oleh karena itu, dalam penelitian ini, ELISA digunakan untuk menentukan kandungan TNF-α, IL-6 dan IL-10 dalam serum tikus, dan ditemukan bahwa kadar berbagai faktor inflamasi dalam serum tikus pada kelompok Mod meningkat, dan kadar faktor anti-inflamasi menurun, sedangkan kandungan TNF-α dan IL-6 dalam serum tikus pada kelompok perlakuan menurun, dan kandungan IL-10 meningkat. Hasil ini menunjukkan bahwa polisakarida Gentian memiliki efek meredakan peradangan (Y. Wang et al. 2024 ).
ALT dan AST dalam serum merupakan indikator khas untuk mengevaluasi fungsi hati, dan peningkatan tajamnya dapat dianggap sebagai salah satu penanda cedera hati (He et al. 2022 ). Dalam penelitian ini, indeks hati dan kandungan ALT dan AST serum dalam kelompok model yang diuji secara signifikan lebih tinggi daripada yang ada dalam kelompok kosong, yang menunjukkan bahwa sel-sel hati rusak parah dan model cedera hati berhasil dibuat. Dibandingkan dengan kelompok model, indeks semua kelompok dosis GSBP menurun, dan kerusakan sel hati berkurang.
Mekanisme yang digunakan polisakarida Gentian untuk melindungi hati terkait dengan pengurangan stres oksidatif dan pengurangan ekspresi faktor inflamasi. Hasil percobaan menunjukkan bahwa polisakarida Gentian dapat meningkatkan aktivitas enzim antioksidan SOD dan GSH-Px secara signifikan, mengurangi tingkat produk peroksidasi lipid MDA, dan mengatur ekspresi faktor inflamasi IL-6, IL-10, dan TNF-α, sehingga secara efektif mengurangi kerusakan oksidatif dan respons inflamasi (H. Liu et al. 2015 ). Studi mekanisme lebih lanjut telah menunjukkan bahwa efek perlindungan polisakarida Gentian terkait erat dengan aktivasi jalur pensinyalan Nrf2-HO-1. Nrf2 adalah pengatur utama respons antioksidan seluler (Mehdi et al. 2022 ). Dalam kondisi stres oksidatif, Nrf2 bertranslokasi dari sitoplasma ke nukleus dan mengaktifkan ekspresi gen antioksidan hilir (seperti HO-1). HO-1 mendegradasi heme untuk menghasilkan metabolit dengan efek antioksidan dan antiinflamasi (seperti bilirubin dan karbon monoksida), sehingga meningkatkan kapasitas antioksidan sel dan menghambat respons inflamasi (Ding et al. 2025 ). Polisakarida Gentian selanjutnya dapat meningkatkan aktivitas SOD dan GSH-Px dengan mengaktifkan jalur Nrf2-HO-1, mengurangi akumulasi MDA, dan mengatur ekspresi faktor inflamasi, seperti mengurangi kadar faktor proinflamasi IL-6 dan TNF-α, dan meningkatkan ekspresi faktor antiinflamasi IL-10. Regulasi multitarget ini tidak hanya meredakan stres oksidatif dan respons inflamasi tetapi juga memberikan penjelasan mekanisme molekuler yang lebih mendalam untuk efek perlindungan hati dari polisakarida Gentian (Yang et al. 2020 ). Sebagai kesimpulan, polisakarida Gentian berperan penting dalam perlindungan hati melalui mekanisme antioksidan dan anti-inflamasi yang dimediasi oleh jalur Nrf2-HO-1, yang memberikan landasan teoritis yang kuat untuk pengembangan lebih lanjut sebagai makanan atau obat fungsional. Jalur Nrf2-HO-1 berperan penting dalam antioksidan, anti-inflamasi, dan perlindungan sel dengan mengatur enzim antioksidan (SOD, GSH-Px), faktor inflamasi (TNF-α, IL-6, IL-10), dan penanda cedera hati (AST, ALT). Aktivasi jalur Nrf2-HO-1 dapat menjadi strategi yang efektif untuk mengobati cedera hati dan penyakit yang berhubungan dengan stres oksidatif.
5 Kesimpulan
Melalui ekstraksi, pemisahan dan pemurnian polisakarida Gentian , serta penentuan berat molekul dan komposisi monosakarida dari polisakarida homogen yang diperoleh, telah terbukti secara in vivo bahwa polisakarida Gentian dapat menghambat pembentukan produk peroksida, mengurangi infiltrasi inflamasi pada jaringan hati, mengurangi pelepasan faktor inflamasi, dan melindungi terhadap cedera hati.

