ABSTRAK
Polisakarida Morchella esculenta (MEP) diketahui memiliki banyak sifat bioaktif, termasuk imunomodulatori, antikanker, antioksidan, anti-inflamasi, dll. Dalam penelitian ini, kami menilai dampak MEP pada kolitis yang diinduksi dekstran sulfat natrium (DSS) pada tikus, dengan fokus pada penghalang usus dan modulasi mikrobiota. Dengan menggunakan analisis NMR, MEP ditemukan sebagian besar terdiri dari 1,4,6- α – d -Glc p dan 1,4- α – d -Glc p . MEP mampu secara signifikan meringankan penurunan berat badan, mengurangi pemendekan panjang usus besar, dan mengurangi patologi usus besar pada tikus. Khususnya, MEP menekan peningkatan kadar sitokin pro-inflamasi tetapi meningkatkan kadar sitokin anti-inflamasi. Selain itu, MEP memodulasi mikrobiota usus, meningkatkan keanekaragaman mikroba dan mendorong homeostasis dibandingkan dengan yang tidak diobati. Lebih jauh lagi, ada kelimpahan relatif bakteri menguntungkan yang lebih tinggi, yang menunjukkan bahwa MEP dapat meningkatkan komposisi mikrobiota usus. Secara kolektif, MEP memiliki potensi terapeutik yang menjanjikan dalam mencegah kolitis, dan oleh karena itu dapat dikembangkan sebagai strategi nutraseutika baru.
1 Pendahuluan
Meningkatnya prevalensi penyakit radang usus (IBD) global menghadirkan tantangan kesehatan masyarakat yang substansial. Kolitis ulseratif (UC), subtipe IBD primer dengan etiologi kompleks yang melibatkan faktor genetik dan lingkungan, ditandai dengan peradangan dalam epitel kolon dan rektal (Niu et al. 2021 ). Timbulnya UC dimulai dengan peradangan rektal yang memicu respons peradangan (Q. Li et al. 2022 ), dan seiring peradangan berlanjut, hal itu dapat menyebabkan cacat penghalang epitel usus, seperti gangguan fungsi mukosa dan perubahan permeabilitas sel epitel (J. Huo et al. 2022 ). Sekuel kejadian ini mungkin terjadi bersamaan dengan cedera stres oksidatif dan disbiosis mikrobiota usus (L. Li et al. 2023 ). Meskipun patofisiologi UC tidak sepenuhnya dipahami, predisposisi genetik dan faktor lingkungan, termasuk aspek psikologis dan kebiasaan makan, dianggap sebagai kontributor utama terhadap perkembangan UC (Marotto et al. 2020 ). Berbagai macam regimen terapi untuk UC tersedia, seperti asam 5-aminosalisilat, glukokortikoid, antibiotik, antibodi monoklonal, dan imunomodulator, tetapi penggunaannya dalam jangka panjang terbatas karena efek samping gastrointestinal atau hati yang serius, seperti nyeri perut, diare, dan cedera hati (Ban et al. 2022 ). Oleh karena itu, ada kebutuhan mendesak untuk mencari pilihan pengobatan alternatif yang lebih aman dan lebih efektif, seperti bahan aktif alami.
Faktor utama yang berkontribusi pada inisiasi dan kemajuan UC adalah disbiosis mikrobiota usus dan gangguan penghalang usus (Shen et al. 2021 ). Studi telah menunjukkan bahwa ketidakseimbangan mikrobiota usus dapat mengakibatkan reaksi inflamasi berkelanjutan yang menghancurkan penghalang usus, sehingga memperburuk UC. Selain itu, faktor-faktor lain, termasuk merokok, pola makan yang tidak sehat, dan obat-obatan berpotensi mengganggu homeostasis mikrobiota usus secara signifikan, mengurangi keanekaragamannya, dan akibatnya memicu atau memperburuk UC (X. Chen et al. 2022 ). Asam lemak rantai pendek (SCFA) yang diproduksi oleh mikrobiota usus juga dapat mengaktifkan beberapa jalur pensinyalan untuk meredakan stres oksidatif dan memperbaiki gejala terkait UC (Yao et al. 2024 ). Oleh karena itu, sangat penting untuk mengeksplorasi bagaimana modifikasi dalam komposisi mikrobiota usus dan integritas penghalang usus dapat digunakan untuk mengelola UC secara efektif.
Meskipun jamur morel telah digunakan sebagai terapi yang telah lama ada di Tiongkok selama ribuan tahun, teknik budidaya industri tingkat lanjut dari berbagai spesies morel dan efeknya yang meningkatkan kesehatan telah menarik perhatian penelitian dalam beberapa tahun terakhir (Longley et al. 2019 ). Di antara spesies morel, Morchella esculenta ( M. esculenta ) telah banyak digunakan untuk keperluan pengobatan dan kuliner, terutama di Tiongkok, karena komposisi nutrisinya yang kaya, dan kelimpahan fenolik, polisakarida, dan tokoferol. Kehadiran senyawa-senyawa ini dalam M. esculenta menjelaskan sifat-sifatnya yang meningkatkan kesehatan dan potensi penggunaannya sebagai nutraceutical dalam suplemen dan pengobatan kesehatan (Wen et al. 2021 ).
Polisakarida adalah makromolekul karbohidrat kompleks yang terbentuk dari monosakarida yang dihubungkan melalui ikatan glikosidik yang memiliki aplikasi luas dalam pengobatan berbagai penyakit (Lu et al. 2023 ). Banyak penelitian telah mengungkapkan bahwa polisakarida yang berasal dari tubuh buah M. esculenta (MEPs) memiliki fungsi biologis yang beragam, termasuk antioksidan, antiinflamasi, potensi antikanker, pengaturan imun, dan pelindung hati (S. Li et al. 2017 ). Dalam penelitian tikus, intervensi polisakarida Morchella esculenta (MEPs) dapat secara signifikan meningkatkan kelimpahan bakteri usus yang bermanfaat dan kadar SCFA usus (W. Huo et al. 2020 ). MEP memiliki efek perlindungan gastrointestinal pada tikus diabetes tipe 2 yang diinduksi streptozotocin dan tikus disfungsi usus yang diinduksi diet tinggi lemak (HFD), di mana mereka dilaporkan memodulasi mikrobiota usus dan meningkatkan kelimpahan dan komposisi relatif bakteri menguntungkan (Rehman et al. 2022 ). Namun, efek perlindungan MEP pada tikus UC yang diinduksi dekstran sulfat natrium (DSS) belum dilaporkan.
Tujuan dari penelitian saat ini adalah untuk menguji potensi MEP untuk memperbaiki gejala UC pada tikus yang diinduksi DSS. Pertama, struktur MEP dikarakterisasi menggunakan mikroskop elektron pemindaian (SEM) dan analisis resonansi magnetik nuklir (NMR) diikuti oleh isolasi dan pemurnian dengan ekstraksi air suling panas dan presipitasi alkohol absolut. Potensi terapeutik MEP kemudian dievaluasi dalam model tikus UC yang diinduksi DSS dengan mengukur perubahan kadar sitokin inflamasi dan protein sambungan ketat. Akhirnya, kandungan SCFA dan perubahan komposisi mikrobiota usus juga diukur untuk menyelidiki lebih lanjut mekanisme MEP pada tikus yang diinduksi DSS.
2 Bahan dan Metode
2.1 Bahan dan Bahan Kimia
Sampel M. esculenta segar dan kering dibeli dari pasar lokal di Guangdong, Cina. DSS diperoleh dari MP Biochemicals Co. Ltd. (Shanghai, Cina). Sulfasalazine (SASP) dibeli dari J&K Scientific Co. Ltd. (Beijing, Cina). Kit asam bicinchoninic (BCA) diperoleh dari Beyotime Biotechnology (Shanghai, Cina), sedangkan antibodi ZO-1, Occludin, dan Claudin-1 dari Proteintech Group Inc. (Wuhan, Cina). Antibodi β-aktin dan antibodi sekunder (IgG anti-kelinci kambing dan IgG anti-tikus kambing) dibeli dari Wuhan Servicebio Technology Co. Ltd. (Wuhan, Cina). Kit ELISA untuk faktor inflamasi (IFN-γ, TNF-α, IL-6, IL-1β, TGF-β1, dan IL-10) bersumber dari MultiSciences (Lianke) Biotech Co. Ltd. (Hangzhou, Tiongkok). Kit DNA tinja HiPure dibeli dari Magen Biotechnology Co. Ltd. (Guangzhou, Tiongkok). Semua standar SCFA dibeli dari Aladdin Biochemical Technology Co. Ltd. (Shanghai, Tiongkok). Bahan kimia dan pelarut tingkat analitis digunakan di seluruh percobaan.
2.2 Persiapan dan Karakterisasi SEM MEP
MEP disiapkan mengikuti protokol presipitasi etanol multitahap dan air suling panas yang telah ditetapkan sebelumnya (S. Chen et al. 2023 ). MEP yang diperoleh dikarakterisasi dalam hal penentuan berat molekul, komposisi monosakarida, dan jenis gugus fungsi. MEP juga dikarakterisasi menggunakan SEM seperti yang dijelaskan sebelumnya dengan sedikit modifikasi (Lu et al. 2022 ) dan mikroskopi elektron pemindaian kriogenik (JSM-6360LA, JEOL, Jepang), yang digunakan untuk menganalisis struktur mikro dan karakteristik permukaan. Untuk mikroskopi elektron pemindaian kriogenik, jumlah MEP yang sesuai ditempatkan pada platform sampel dan ditempelkan dengan lem konduktif untuk pelapisan emas. Struktur permukaan polisakarida diperiksa dan dicitrakan menggunakan intensitas medan listrik 8 kV.
2.3 Analisis NMR
Spektroskopi NMR digunakan untuk menentukan struktur rumit MEP seperti yang dijelaskan sebelumnya (Yu, Wang, et al. 2023 ). Singkatnya, sampel MEP awalnya dilarutkan dalam D 2 O. Selanjutnya, spektrum NMR 1 H, spektrum NMR 13 C, dan spektrum NMR dua dimensi: eksperimen korelasi 1 H– 1 H (COSY), koherensi kuantum tunggal heteronuklir (HSQC), dan korelasi ikatan rangkap heteronuklir (HMBC) direkam dengan Spektrometer Bruker Avance 500 (Bruker BioSpin Corporation, Billerica, MA, AS), yang dioperasikan pada 500 MHZ.
2.4 Percobaan Hewan dan Pengumpulan Sampel
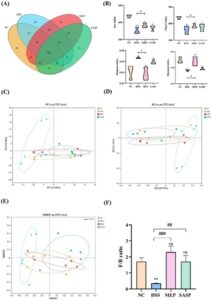
Percobaan hewan dilakukan dengan mengikuti panduan yang disetujui dari Animal Centre Laboratory di Guangdong Ocean University (Nomor Persetujuan: GDOU-LAE-2022-029). Sejumlah tikus jantan C57BL/6, berusia 6–8 minggu dan berat 18–22 g, diperoleh dari Guangdong Sijia Jingda Biotechnology Co. Ltd. (Guangzhou, Tiongkok). Setelah aklimatisasi selama 1 minggu dalam lingkungan yang terkontrol (suhu ruangan: 23°C ± 2°C, kelembapan: 50% ± 10%, siklus terang/gelap: 12 jam), tikus-tikus tersebut dialokasikan secara acak ke dalam empat kelompok eksperimen ( n = 5), yaitu kelompok normal (NC), kelompok model (DSS), kelompok intervensi MEPs (MEP), dan kelompok positif (SASP) (Gambar 2A ). Semua kelompok kecuali kelompok normal diberikan perlakuan selama 7 hari dengan larutan berair DSS 3% ( b / v ) untuk menginduksi kolitis. Tikus dalam kelompok MEP diberikan MEP secara oral dengan dosis 0,1 mg/g bb, sedangkan tikus dalam kelompok positif diberikan larutan intragastrik SASP dengan dosis 0,1 mg/g bb. Tikus kelompok normal menerima salin steril secara oral dan diet hewan komersial konvensional selama 3 minggu. Perubahan harian berat badan, kejadian perdarahan tinja, dan diare dicatat dan direkam. Indeks aktivitas penyakit (DAI) dihitung berdasarkan skor rata-rata penurunan berat badan, tingkat keparahan diare, dan kondisi perdarahan tinja. Satu hari sebelum selesai, semua tikus dipuasakan sebelum dibedah dan di-eutanasia. Sampel darah diambil dari bola mata dan disentrifugasi untuk mendapatkan serum. Sampel serum diperoleh dengan membiarkan darah utuh selama 30 menit pada suhu 4°C, diikuti dengan sentrifugasi pada 4000 rpm selama 10 menit dalam kondisi dingin. Isi kolon segera dikumpulkan untuk pengurutan mikrobiota usus dan analisis kandungan SCFA, sementara kolon dibilas dengan garam steril sebelumnya dan jaringan disimpan pada suhu −80°C untuk analisis selanjutnya.
2.5 Pewarnaan Histopatologi H&E dan AB-PAS
Jaringan kolon dibilas dengan larutan penyangga fosfat (PBS) yang didinginkan terlebih dahulu sebelum segera difiksasi dalam larutan paraformaldehid 4% untuk analisis histologis mengikuti protokol yang telah ditetapkan sebelumnya (Nexoe et al. 2021 ). Rinciannya disertakan dalam Informasi Pendukung: S1 .
2.6 Analisis Biokimia, Western Blot, dan Imunofluoresensi
Konsentrasi sitokin inflamasi pada jaringan kolon diukur menggunakan kit ELISA sesuai dengan panduan produsen. Analisis western blot dan imunofluoresensi digunakan untuk menentukan ekspresi protein tight junction (yaitu, ZO-1, Occludin, dan Claudin-1) menurut penelitian sebelumnya (Qin et al. 2024 ). Rincian lebih lanjut diberikan dalam Informasi Pendukung .
2.7 SCFA Feses, Isolasi RNA Ribosomal 16S, dan Analisis Mikrobiota Usus
Kadar SCFA feses ditentukan menggunakan metode yang dijelaskan sebelumnya (Guo et al. 2020 ) dengan sedikit modifikasi. Rincian lebih lanjut tersedia dalam Informasi Pendukung .
Mikrobiota usus dianalisis menggunakan metode yang dijelaskan sebelumnya dengan sedikit modifikasi (Lu et al. 2022 ). Secara singkat, sampel feses dari empat kelompok dikumpulkan ke dalam tabung steril 5 mL ( n = 5/kelompok). Berikutnya, total DNA mikroba diekstraksi menggunakan HiPure Stool DNA Kits mengikuti protokol produsen. Wilayah V3–V4 dari gen 16S rRNA diperkuat menggunakan primer maju 341F (5′-CCTACGGGNGGCWGCAG-3′) dan primer mundur 806R (5′-GGACTACHVGGGTATCTAAT-3′). Amplikon yang dihasilkan divisualisasikan pada gel agarosa 2% sebelum dimurnikan dengan AxyPrep DNA Gel Extraction Kit sesuai protokol produsen. Sampel ekuimolar kemudian dikumpulkan dan digunakan untuk pengurutan ujung berpasangan (PE250) pada platform Illumina mengikuti prosedur standar. Data sekuensing dianalisis menggunakan paket perangkat lunak quantitative insights into microbial ecology (QIIME) versi 1.9.1. Data unit taksonomi operasional (OTU) dengan ambang batas kesamaan sekuens sebesar 97% digunakan untuk menghitung indeks kekayaan dan keanekaragaman komunitas bakteri usus, dan kelimpahan relatifnya dalam sampel tinja. Alat bioinformatika, termasuk UPARSE (versi 9.2.64), QIIME (versi 1.9 atau yang lebih baru), Muscle (versi 3 atau yang lebih tinggi), dan ChiPlot ( https://www.chiplot.online ), digunakan untuk menganalisis data mentah dalam hal pengelompokan OTU, komposisi komunitas, keragaman alfa, keragaman beta, dan analisis korelasi faktor lingkungan.
2.8 Analisis Statistik
Data dianalisis dengan GraphPad Prism 9.3 dan ditampilkan sebagai mean ± SD (simpangan baku). Perbandingan berganda ANOVA satu arah dilakukan untuk menilai perbedaan signifikan di antara kelompok eksperimen, dengan signifikansi statistik dianggap pada p < 0,05.
3 Hasil
3.1 Struktur Utama MEP
Berat molekul dan komposisi monosakarida MEP dilakukan dalam penelitian kami sebelumnya (S. Chen et al. 2023 ), yang mengungkapkan berat molekul 19,714 kDa dan terdiri dari glukosamin hidroklorida (0,9%, b/b ), galaktosa (5,3%, b/b ), glukosa (90,0%, b / b ), dan manosa (3,7%, b / b ), yang menunjukkan bahwa MEP memiliki berat molekul relatif lebih rendah dengan komponen monosakarida utama adalah glukosa. Ketika MEP dikarakterisasi menggunakan SEM (Gambar 1A ), permukaannya tampak relatif halus pada perbesaran rendah (200×), tetapi berpori dan longgar pada perbesaran lebih tinggi (500×). Struktur permukaan MEP tampaknya dipengaruhi oleh beberapa faktor, seperti sumber, komposisi kimia, dan berat molekul. Porositas dan kelonggaran yang ditunjukkan oleh MEP membuatnya menguntungkan untuk diaplikasikan dalam makanan fungsional.
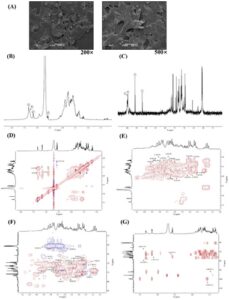
3.2 Komposisi Struktur MEP Berdasarkan Analisis NMR
Ketika struktur kompleks MEP dievaluasi berdasarkan komposisi monosakarida menggunakan NMR, spektrum 1 H NMR ( δ 5,5–4,5 ppm) memiliki empat puncak menonjol pada δ 5,33, 5,32, 5,16, dan 4,57 ppm di daerah anomerik (Gambar 1B ). Sinyal anomerik dengan pergeseran kimia > 5 ppm ditetapkan untuk proton komponen konfigurasi -α , ditetapkan sebagai residu A, B, dan C menurut kekuatan sinyal. Sinyal pada δ 4,57 ppm dikaitkan dengan proton komponen konfigurasi -β , ditetapkan sebagai residu D. Penetapan pergeseran kimia H-2 dikonfirmasi melalui spektrum 1 H– 1 H COSY yang mengikuti prinsip bahwa H-2 sesuai dengan H-1. Demikian pula, penunjukan sinyal hidrogen lainnya (H-3–H-6) dibuat menggunakan koreksi ini (Gambar 1D,E ). Pada spektrum NMR 13 C, empat sinyal karbon anomerik terdeteksi (Gambar 1C ). Berdasarkan spektrum HSQC dan referensi lain ke data pergeseran kimia, puncak silang kopling C–H pada δ 5,33/99,54, 5,32/99,62, 5,16/92,08, dan 4,57/95,90 ppm berkorespondensi dengan empat residu berikut: →4,6)- α – d -Glc p -(1→ (A), →4)- α – d -Glc p -(1→ (B), →6)- α – d -Gal p -(1→ (C), dan →6)- β – d -Man p -(1→ (D) (Gambar 1F ) (J. Li et al. 2021 ; S. Li et al. 2017 ; Qiu et al. 2024 ; Wen Berdasarkan data ini , pergeseran kimia dalam spektrum NMR 1 H dan 13 C MEP dirangkum dalam Tabel 1 .
| Residu | 1 | 2 | 3 | 4 | 5 | 6 | |
|---|---|---|---|---|---|---|---|
| A→4,6) -α – d- Glc p- (1→ | H | 5.33 | 3.50 | 3.68 | 3.41 | 3.68 | 3.34 |
| C | 99.54 | 71.43 | 72.84 | 75.94 | 74.85 | 69.60 | |
| B→4) -α – d- Glc p- (1→) | H | 5.32 | 3.52 | 3.90 | 3.57 | 3.71 | 3,81/3,67 |
| C | 99.62 | 71.48 | 72.76 | 76.70 | 73.33 | 60.75 | |
| C→6)-α – d – Gal p- (1→) | H | 5.16 | 3.47 | 3.63 | 3.41 | 3.75 | 3.32 |
| C | 92.08 | pukul 71.30 | 72.69 | 71.39 | 71.29 | 69.35 | |
| D → 6) – β – d – Manusia p – (1 → | H | 4.57 | 3.18 | 3.41 | 3.38 | 3.66 | 3.65 |
| C | 95.90 | 74.13 | 75.75 | 69.64 | 72.87 | 69.35 |
Dalam wilayah anomerik spektrum HSQC MEP, puncak dominan diamati pada δ 5,33/99,54 ppm untuk residu A. Sinyal untuk proton dan karbon yang tersisa (dari H/C-2 hingga H/C-6) diidentifikasi pada δ 3,50/71,43, 3,68/72,84, 3,41/75,94, 3,68/74,85, dan 3,34/69,60 ppm, berturut-turut. Dengan membandingkan dengan data dari berbagai sumber literatur, residu A dikonfirmasi sebagai 1,4,6- α – d -Glc p (A) (Cai et al. 2018 ). Penugasan ini dikuatkan oleh sinyal intens proton anomerik dalam spektrum 1 H NMR dan peningkatan kandungan glukosa yang ditentukan melalui analisis monosakarida. Selanjutnya, residu B–D dikarakterisasi sebagai 1,4- α – d -Glc p , 1,6- α – d -Gal p , dan 1,6- β – d -Man p . Hasil kami sesuai dengan referensi literatur yang ada.
Spektrum HMBC MEP disimpulkan untuk menunjukkan hubungan glikosidik (Gambar 1G ). Puncak silang pada δ 5,33/69,35 ppm ditampilkan dalam spektrum HMBC yang menunjukkan bahwa sinyal pada δ 5,33 ppm berkorespondensi dengan H-1 pada residu A dan sinyal pada δ 69,35 ppm berkorespondensi dengan C-4 pada residu B, yang menunjukkan bahwa residu A dan B saling terkait sebagai A-(1→4)-B. Demikian pula, hasil berikut dari spektrum HMBC mengungkapkan bahwa H-1 dari →4,6)- α – d -Glc p- (1→ (A) terikat pada C-4 dari →4)- α – d -Glc p- (1→ (B) dan C-6 dari →6)- α – d -Gal p- (1→ (C). H-1 dari →6)- α – d -Gal p- (1→ (C) terikat pada C-6 dari →4,6)- α – d -Glc p- (1→ (A). H-1 dari →6)- β – d -Man p- (1→ (D) terikat pada C-4 dari →4)- α – d -Glc p- (1→ (B). C-1 dari →6)- β – d -Man p- (1→ (D) dikaitkan dengan H-4 dari →4,6)- α – d -Glc p- (1→ (A). C-1 dari →4,6)- α – d -Glc p- (1→ (A) dikaitkan dengan H-4 dari →4)- α – d -Glc p- (1→ (B). Berdasarkan analisis di atas, tulang punggung MEP terutama terdiri dari →4,6)- α – d -Glc p- (1→ dan →4)- α – d -Glc p- (1→, sedangkan rantai lateral terdiri dari →6)- α – d -Gal p- (1→ dan →6)- β – d -Man p- (1→.
3.3 MEP Memperbaiki Gejala Klasik UC pada Tikus
Mengingat bahwa manifestasi eksternal UC meliputi penurunan berat badan, diare, pembengkakan usus besar, dan pemendekan, pemantauan harian berat badan dan DAI untuk setiap kelompok dinilai selama fase pemodelan. Tikus yang diobati DSS mengalami penurunan berat badan yang nyata dan peningkatan skor DAI, yang mengonfirmasi efektivitas induksi (Gambar 2B,C ). Namun, setelah pemberian MEP dan SASP secara oral, gejala-gejala ini berkurang. Selain itu, panjang usus besar tikus DSS menurun secara signifikan dibandingkan dengan kelompok NC ( p < 0,05). Di sisi lain, panjang usus besar meningkat pasca intervensi MEP dan SASP, tetapi tanpa perbedaan signifikan dibandingkan dengan kelompok NC (Gambar 2D,E ). Ketika indeks organ tikus dihitung (Gambar 2F ), indeks hati pada kelompok DSS meningkat secara signifikan dibandingkan dengan kelompok MEP ( p < 0,0001), yang menunjukkan bahwa ada cedera hati pada tikus kolitis yang diinduksi DSS. Sebaliknya, untuk indeks ginjal dan limpa tidak ada perbedaan signifikan antara tikus kelompok DSS dan MEP.
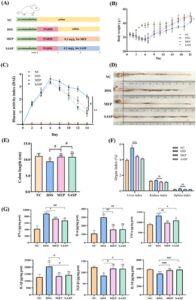
3.4 MEP Meredakan Respons Peradangan pada Tikus yang Diinduksi DSS
Peradangan usus adalah indikator utama kolitis, dan intensitas kolitis berkorelasi dengan konsentrasi sitokin inflamasi (Gong et al. 2024 ). Ketika keadaan inflamasi lokal pada jaringan usus besar diukur (Gambar 2G ), kadar TNF-α, IL-1β, IL-6, dan IFN-γ pada kelompok yang diinduksi DSS meningkat secara signifikan ( p < 0,05) sebesar 1,48, 1,42, 2,78, dan 1,95 kali lipat pada jaringan usus besar dibandingkan dengan kelompok NC. Namun, setelah pengobatan MEP, konsentrasi sitokin pro-inflamasi menurun secara signifikan ( p < 0,05) pada kelompok MEP, yang menunjukkan efek anti-inflamasi dari MEP. Mengingat sel Treg mengeluarkan sitokin anti-inflamasi, seperti IL-10 atau TGF-β1, yang penting untuk pengaturan imun dan perbaikan jaringan (Wang et al. 2019 ), ketika sitokin ini ditentukan, konsentrasi TGF-β1 dan IL-10 meningkat pada kelompok MEP relatif terhadap kelompok DSS ( p < 0,05), dengan penurunan masing-masing sebesar 0,69 dan 0,83 kali lipat pada jaringan kolon dibandingkan dengan kelompok NC. Dengan demikian, pengobatan tikus dengan MEP dapat membantu mengurangi fenomena inflamasi pada UC.
3.5 MEP Mengurangi Kerusakan Penghalang Usus pada Tikus UC
Pemeriksaan histologis, menggunakan pewarnaan H&E dan AB-PAS, dari jaringan kolon dari tikus dalam berbagai kelompok (Gambar 3A ) mengungkapkan bahwa struktur jaringan kolon tikus kelompok DSS rusak parah dibandingkan dengan kelompok normal. Hal ini ditandai dengan infiltrasi sel inflamasi, struktur kripta yang terganggu, dan sel epitel yang rusak (ditunjukkan dengan panah merah). Ketika tikus diberikan MEP, tingkat keparahan gejala-gejala ini membaik, menghasilkan kripta dan sel yang tersusun teratur. Mengingat bahwa sel goblet memainkan peran penting dalam mengeluarkan lendir yang membentuk penghalang lendir kolon, mempertahankan dan menjaga epitel usus dari ancaman eksternal, pewarnaan AB-PAS mengungkapkan pengurangan yang signifikan pada sel goblet dalam kelompok DSS (ditunjukkan dengan panah merah), dibandingkan dengan kelompok normal yang memiliki banyak sel goblet. Di sisi lain, intervensi MEP mengurangi pengurangan sel goblet yang diinduksi DSS, dibuktikan dengan peningkatan area biru pada gambar yang diwarnai (Gambar 3A ). Ketika tingkat keparahan jaringan kolon diukur dengan skor berdasarkan arsitektur mukosa, infiltrasi sel inflamasi, dan pengurangan sel goblet (Gambar 3B ), kelompok DSS memiliki skor tertinggi di antara kelompok eksperimen. Namun, setelah intervensi MEP, kondisi pada tikus yang diobati dengan DSS membaik secara drastis. Hasil ini menunjukkan bahwa MEP dapat meringankan kerusakan penghalang usus pada tikus dengan UC.
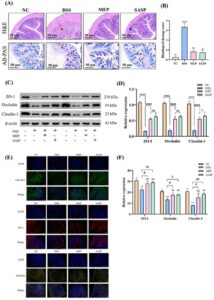
3.6 MEP Meningkatkan Protein Tight Junction untuk Mengurangi Gangguan Penghalang Kolon pada Tikus Kolitis yang Diinduksi DSS
Mengingat bahwa protein tight junction sangat penting untuk integritas barier epitel intestinal, kami menggunakan western blotting (WB) dan imunohistokimia untuk menentukan dampak MEP pada regulasi protein tight junction di kolon tikus kolitis yang diinduksi oleh DSS (Gambar 3C–F ). Kadar protein ZO-1, Occludin, dan Claudin-1 menurun secara signifikan ( p < 0,0001) pada kelompok tikus yang diinduksi DSS, tetapi kembali normal dengan intervensi MEP (Gambar 3D ). Hasil yang sama juga ditampilkan pada Gambar 3E,F . Hasil ini menunjukkan bahwa MEP dapat meningkatkan ekspresi protein tight junction untuk mempertahankan fungsi barier intestinal.
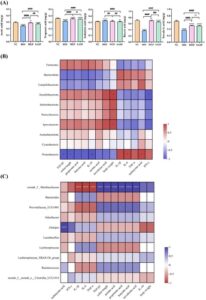
3.7 Pengobatan MEPs Meningkatkan Homeostasis Mikrobiota Usus dan Meningkatkan Kadar SCFAs pada Tikus yang Diinduksi DSS
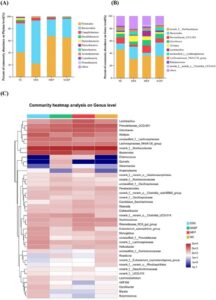
Disbiosis mikrobiota usus signifikan dalam timbulnya dan perkembangan UC, karena mengurangi komposisi dan kelimpahan mikrobiota yang bermanfaat (de Vos et al. 2022 ). Ketika sequencing 16S rRNA digunakan untuk menganalisis komposisi dan kelimpahan mikrobiota usus pada tikus yang diinduksi DSS dengan dan tanpa intervensi MEP (Gambar 4-6 ) , semua sampel yang dianalisis memiliki 563 OTU (Gambar 4A ), dengan 28, 20 , 10, dan 11 OUT unik yang diidentifikasi dalam kelompok NC, DSS, MEP, dan SASP. Analisis keragaman alfa digunakan untuk mengevaluasi variasi dan keragaman spesies dalam lingkungan usus, dengan indeks Chao1 dan Ace digunakan untuk menentukan kelimpahan mikrobiota, dan indeks Shannon dan Simpson untuk keragaman (Kai et al. 2022 ). Ada perbedaan signifikan ( p < 0,05) antara kelompok DSS dan NC untuk indeks Chao1, Ace, Shannon dan Simpson, yang menunjukkan bahwa pengobatan DSS mempengaruhi komunitas mikroba usus (Gambar 4B ). Namun, untuk indeks Chao1 dan Ace, tidak ada variasi signifikan yang diamati antara kelompok MEP dan kelompok DSS, dan kami berspekulasi bahwa waktu intervensi obat dapat memengaruhi kondisi ini. Sementara itu, untuk indeks Shannon dan Simpson, perbedaan signifikan ( p < 0,05) diamati antara kelompok DSS dan MEP, yang selanjutnya mendukung kesimpulan kami di atas. Oleh karena itu, intervensi MEP dapat meningkatkan kekayaan dan keragaman mikrobiota usus pada tikus yang diobati DSS.