
ABSTRAK
Kami menganalisis potensi antioksidan dan komposisi senyawa fenolik dalam enam kultivar pohon kurma Australia (Mejhoul, Barhee, Deglet nour, Thoory, Halawi, dan Khadrawy) pada tiga tahap pematangan: Kimri , Khalal , dan Tamar . Total kandungan fenolik dalam buah kurma pada tahap Kimri berkisar antara 19,7 hingga 117,5 mg GAE/g, secara signifikan melebihi tahap Khalal (1,22–24,4 mg GAE/g) dan tahap Tamar (0,47–8,72 mg GAE/g). Buah kurma pada tahap Kimri memiliki potensi antioksidan yang lebih tinggi yang diukur dalam pengujian seperti DPPH, FRAP, ABTS, RAP, FICA, dan TAC dibandingkan dengan yang berada pada tahap Khalal dan Tamar . Analisis LC-ESI-QTOF-MS/MS mengidentifikasi 28 senyawa fenolik, yang dikategorikan sebagai 4 asam fenolik, 17 flavonoid, dan 7 senyawa fenolik lainnya. Analisis kuantitatif menggunakan LC-DAD menunjukkan variasi spesifik kultivar dalam profil fenolik, dengan kultivar Khadrawy memiliki kandungan quercetin tertinggi selama tahap Kimri . Pada tahap pematangan Khalal , kultivar Thoory dan Mejhoul masing-masing memiliki konsentrasi quercetin dan prosianidin A2 yang lebih tinggi. Pada tahap Tamar , kultivar Deglet nour memiliki konsentrasi prosianidin A2, asam galat, dan asam kafeat yang lebih tinggi dibandingkan dengan kultivar kurma lainnya. Temuan kami menunjukkan bahwa kandungan fenolik menurun saat buah kurma matang dari tahap Kimri ke Tamar , dengan variasi yang signifikan dalam komposisi fenolik dan kapasitas antioksidan di berbagai kultivar.
1 Pendahuluan
Kesadaran konsumen akan gaya hidup sehat telah mendorong peralihan ke arah makanan fungsional. Perubahan ini telah mengakibatkan transformasi dalam sikap konsumen terhadap makanan fungsional (Dhara dan Nayak 2022 ). Senyawa bioaktif adalah zat yang terjadi secara alami yang ditemukan dalam buah-buahan yang diklasifikasikan sebagai metabolit sekunder yang memiliki potensi manfaat kesehatan (Uwineza dan Waśkiewicz 2020 ). Buah-buahan dan sayuran merupakan sumber yang kaya akan senyawa bioaktif seperti karotenoid, polifenol, flavonoid, dan tanin, yang memiliki penerimaan tinggi konsumen karena potensi manfaat kesehatannya (Socaci et al. 2017 ).
Penelitian terkini telah mengidentifikasi konsentrasi tinggi senyawa fenolik dalam pohon kurma ( Phoenix dactylifera L.), yang merupakan molekul aktif secara biologis dengan sifat antioksidan dan sangat menarik karena potensi manfaatnya bagi kesehatan (Zihad et al. 2021 ). Buah kurma merupakan sumber yang kaya akan senyawa ini, yang dapat membantu menghambat stres oksidatif dan masalah kesehatan terkait (AlFaris et al. 2021 ; Zhang et al. 2013 ). Penelitian tentang senyawa fenolik dalam buah kurma menunjukkan potensi besar untuk mengembangkan makanan fungsional dan nutraseutika.
Tahap pematangan dapat memiliki dampak besar pada konsentrasi fenolik dalam buah kurma. Saat buah kurma matang, komposisi kimia dan konsentrasi senyawa fenoliknya dapat berubah. Misalnya, Mohamed Lemine et al. ( 2014 ) menilai enam kultivar pohon kurma dari Atar dan Tijigja dan mengidentifikasi bahwa kandungan flavonoid dan total fenolik lebih besar selama tahap Blah (tahap pertama pematangan) dibandingkan dengan tahap Tamar (tahap akhir pematangan). Total kandungan fenolik rata-rata 728,5 mg GAE/100 g DM pada tahap Blah dan 558,9 mg GAE/100 g DM pada tahap Tamar . Demikian pula, kandungan flavonoid rata-rata 67,3 dan 119,6 mg QE/100 g DM pada tahap Tamar dan Blah .
Kultivar merupakan faktor penting lain yang dapat memengaruhi kandungan fenolik pohon kurma. Kultivar pohon kurma yang berbeda mungkin memiliki profil fenolik yang unik, yang berpotensi memengaruhi kualitas nutrisinya (Khatib et al. 2022 ). Mengidentifikasi perbedaan kandungan fenolik di antara kultivar diperlukan untuk menginformasikan praktik pertanian dan program pemuliaan untuk membudidayakan kultivar pohon kurma dengan manfaat kesehatan yang ditingkatkan. Penelitian lanjutan diperlukan untuk sepenuhnya memahami perubahan komposisi fenolik dan kapasitas antioksidan di berbagai kultivar pohon kurma dan tahap pematangan. Penelitian ini bertujuan untuk menilai kapasitas antioksidan dan mengidentifikasi senyawa fenolik dalam enam kultivar pohon kurma yang ditanam di Australia pada tiga tahap pematangan yang berbeda, yang belum pernah diteliti secara sistematis sebelumnya. Tujuan pertama kami adalah melakukan penilaian awal, termasuk uji kolorimetri umum untuk kuantifikasi total fenolik, flavonoid, tanin terkondensasi, dan kapasitas antioksidan. Tujuan kedua adalah karakterisasi senyawa fenolik menggunakan analisis LC-ESI-QTOF-MS/MS dan LC-DAD.
2 Bahan dan Metode
2.1 Reagen dan Bahan Kimia
Reagen Folin–Ciocalteu, vanilin, asam galat, asam L-askorbat, katekin, aluminium klorida heksahidrat, quercetin, DPPH, ABTS, 2,4,6-Tris(2-piridil)-s-triazin (TPTZ), dan alizarin diperoleh dari Sigma-Aldrich (Castle Hill, NSW, Australia). Asam sulfat (98%) dibeli dari RCI Labscan (Rongmuang, Thailand). Metanol, besi klorida (Fe[III]Cl3 • 6H2O ) , asetonitril, natrium asetat terhidrasi, asam asetat glasial, dan asam klorida disediakan oleh Thermo Fisher Scientific Inc. (Scoresby, VIC, Australia). Natrium karbonat (anhidrat) disediakan oleh Chem-Supply Pty Ltd. (Adelaide, Australia Selatan, Australia).
2.2 Persiapan Sampel
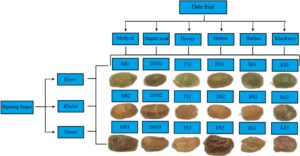
Enam kultivar kurma, yaitu Mejhoul, Barhee, Deglet nour, Halawi, Thoory, dan Khadrawy, dipasok dari The Dessert Fruit Company (Australia), dan dikumpulkan pada tahun 2023 pada tiga tahap pematangan: Kimri , Khalal , atau Tamar . Ini menghasilkan total 18 sampel buah kurma. Singkatan yang mewakili setiap kultivar dan tahap pematangan, serta tampilan visual buah kurma diilustrasikan dalam Gambar 1. Sampel dipotong dan dicampur menjadi bubur menggunakan penggiling (Model 400Y, Yongkang, Zhejiang, Cina). Kemudian, sampel dibekukan selama 12 jam di bawah −80 °C dan kemudian dikeringkan beku selama 72 jam dan dihaluskan dengan penggiling, dan disimpan pada suhu −20 °C.
2.3 Proses Ekstraksi
Proses ekstraksi dilakukan dengan mencampur 5 g sampel bubuk dengan 40 mL etanol 70% yang mengandung 0,1% asam format. Ekstraksi dilakukan menggunakan pengganggu sel ultrasonik (Branson, Digital Sonifier 450) dalam penangas air es. Amplitudo ditetapkan pada 40%. Kemudian, sampel ditempatkan dalam inkubator pengocok pada suhu 4°C dan 120 rpm selama 12 jam. Setelah itu, ekstrak disentrifugasi pada kecepatan 8000 rpm (15 menit, 4°C). Supernatan dipanen dan disimpan pada suhu -20°C.
2.4 Estimasi Senyawa Fenolik
2.4.1 Kandungan Fenolik Total (TPC)
Analisis TPC dilakukan menggunakan metode Folin–Ciocalteu (Slinkard dan Singleton 1977 ) sebagaimana dijelaskan secara rinci oleh Shi et al. ( 2024 ). Asam galat digunakan sebagai standar, dan hasilnya disajikan dalam bentuk mg ekuivalen asam galat (GAE)/berat segar.
2.4.2 Kandungan Flavonoid Total (TFC)
Metode kolorimetri AlCl3 dari Christ dan Müller ( 1960 ) digunakan untuk analisis TFC. Deskripsi terperinci tentang metodologi ini dilaporkan oleh Shi et al. ( 2024 ). Quercetin digunakan sebagai standar, dan hasilnya disajikan sebagai mg ekuivalen quercetin (QE)/berat segar .
2.4.3 Total Condensed Tannin (TCT)
Metode vanillin-asam sulfat dari Price et al. ( 1978 ) digunakan untuk pengukuran TCT, seperti yang dijelaskan secara rinci oleh Shi et al. ( 2024 ). Katekin digunakan sebagai standar, dan hasilnya disajikan sebagai mg ekuivalen katekin (CE)/berat segar.
2.5 Aktivitas Antioksidan
2.5.1 Uji 2,2-Difenil-1-Pikrilhidrazil (DPPH)
Aktivitas penangkal radikal bebas ditentukan menggunakan uji DPPH (Blois 1958 ), seperti yang dijelaskan secara rinci oleh Shi et al. ( 2024 ). Trolox digunakan sebagai standar, dan hasilnya disajikan dalam bentuk mg ekuivalen Trolox (TE)/berat segar.
2.5.2 Uji Daya Antioksidan Pengurang Feri (FRAP)
Pengujian FRAP dilakukan menurut metodologi Sogi et al. ( 2013 ), dengan sedikit modifikasi seperti yang dijelaskan oleh Shi et al. ( 2024 ). Trolox digunakan sebagai standar, dan hasilnya disajikan dalam bentuk mg ekuivalen Trolox (TE)/berat segar.
2.5.3 Aktivitas Chelating Ion Besi (FICA)
Uji FICA dilakukan dengan mengikuti prosedur yang dilakukan oleh Dinis et al. ( 1994 ), sebagaimana dijelaskan secara rinci oleh Shi et al. ( 2024 ). Asam etilendiamintetraasetat (EDTA) digunakan untuk pembuatan kurva standar, dan hasilnya disajikan dalam bentuk mg ekuivalen EDTA (EE)/berat segar.
2.5.4 Uji 2,2′-Azino-Bis-3-Etilbenzotiazolin-6-Asam Sulfonat (ABTS)
Aktivitas ABTS diukur dengan mengikuti prosedur Re et al. ( 1999 ) dengan modifikasi seperti yang dijelaskan secara rinci oleh Shi et al. ( 2024 ). Trolox digunakan untuk pembuatan kurva standar, dan hasilnya disajikan sebagai mg ekuivalen Trolox (TE)/berat segar.
2.5.5 Uji Aktivitas Pembersihan Radikal Hidroksil ( • OH-RSA)
• Uji OH-RSA dilakukan mengikuti prosedur Salgado et al. ( 2013 ) dengan modifikasi seperti yang dijelaskan secara rinci oleh Shi et al. ( 2024 ). Trolox digunakan untuk pembuatan kurva standar, dan hasilnya disajikan dalam bentuk mg ekuivalen Trolox (TE)/berat segar.
2.5.6 Uji Daya Reduksi (RPA)
Pengujian RPA dilakukan dengan mengikuti prosedur yang dijelaskan oleh Oyaizu ( 1986 ) sebagaimana dijelaskan secara rinci oleh Shi et al. ( 2024 ). Trolox digunakan untuk pembuatan kurva standar dan hasilnya disajikan sebagai mg ekuivalen Trolox (TE)/berat segar.
2.5.7 Kapasitas Antioksidan Total (TAC)
Uji TAC dilakukan dengan mengikuti prosedur yang dijelaskan oleh Prieto et al. ( 1999 ), sebagaimana dijelaskan secara rinci oleh Shi et al. ( 2024 ). Asam askorbat digunakan untuk pembuatan kurva standar, dan hasilnya disajikan dalam mg ekuivalen asam askorbat (AAE)/berat segar.
2.6 Karakterisasi Senyawa Fenolik
Delapan belas sampel buah kurma dikarakterisasi untuk senyawa fenolik menggunakan LC-ESI-QTOF-MS/MS. Sistem HPLC seri Agilent 1200 yang digabungkan dengan sistem LC/MS Agilent 6530 Accurate-Mass Quadrupole Time-of-Flight (Q-TOF), yang dilengkapi dengan sumber ionisasi elektrospray (ESI), digunakan untuk tujuan ini. Informasi terperinci mengenai persiapan sampel, kondisi kromatografi, dan parameter spektrometri massa telah dijelaskan sebelumnya oleh Shi et al. ( 2024 ) dan Xie et al. ( 2024 ).
2.7 Kuantifikasi Senyawa Fenolik
Kuantifikasi senyawa fenolik dilakukan menggunakan HPLC (Waters Alliance 2690, Chromatograph Separation Module) yang dilengkapi dengan detektor dioda array (Model 2998, Waters), mengikuti metodologi yang dijelaskan oleh Shi et al. ( 2024 ). Kurva kalibrasi dibuat menggunakan 12 senyawa fenolik standar yang umum ditemukan dalam buah kurma, termasuk asam galat, asam p -hidroksibenzoat, asam kafeat, katekin, asam kumarat, asam siringat, epikatekin, asam trans-ferulat, prosianidin A2, asam sinapik, kaempferol, dan quercetin. Peta panas dibuat untuk menggambarkan secara visual distribusi dan konsentrasi senyawa fenolik di enam kultivar buah kurma dan tiga tahap pematangan.
2.8 Analisis Statistik
Analisis data dilakukan menggunakan analisis varians satu arah dalam Minitab for Windows versi 19.0 (Minitab LLC, State College, PA, AS). Uji Tukey’s HSD digunakan untuk pemisahan rata-rata pada ambang batas signifikansi p < 0,05. Analisis korelasi Pearson dilakukan untuk menilai hubungan antara kandungan fenolik (TPC, TCT, TFC) dan uji antioksidan (DPPH, FRAP, ABTS, •OH-RSA, RAP, FICA, dan TAC). PCA juga digunakan untuk menetapkan korelasi antara uji antioksidan dan kandungan fenolik pada 6 kultivar kurma pada 3 tahap pematangan.
3 Hasil dan Pembahasan
3.1 Estimasi Kandungan Fenolik (TPC, TFC, dan TCT)
Data TPC, TFC, dan TCT dari kultivar buah kurma pada tiga tahap pematangan dilaporkan dalam Tabel 1. TPC tertinggi diukur pada tahap Kimri , diikuti oleh tahap Khalal dan Tamar . Selain itu, perbedaan kultivar yang signifikan dalam TPC diamati ( p < 0,05). Mendukung hal ini, Mohamed et al. ( 2014 ) melaporkan dampak perbedaan kultivar pada kandungan TPC dalam buah kurma.
| Barang | Kultivar kurma | |||||
|---|---|---|---|---|---|---|
| Mejhoul | Deglet makanan | Bahasa Indonesia: Thori | Bahasa Halawi | Barhee | Khadrawy | |
| Panggung Kimri | Bahasa Inggris MS1 | DNS1 | Bahasa Indonesia: TS1 | Bahasa Inggris: HS1 | Bahasa Inggris BS1 | Kelas KS1 |
| TPC (mg GAE/gram) | 42,1 ± 1,77 sen * | 98,8 ± 7,91 b * | 117,5 ± 8,62 tahun * | 33,1 ± 2,57 hari * | 19,7 ± 1,49 tahun * | 48,9 ± 3,65 sen * |
| TCT (mg CE/g) | ND | 0,26 ± 0,20 * | 0,15 ± 0,12 * | ND | ND | ND |
| TFC (mg QE/gram) | 0,63 ± 0,05c * | 0,96 ± 0,07 sebuah * | 0,78 ± 0,05 b * | 0,25 ± 0,04 e * | 0,08 ± 0,01 f * | 0,41 ± 0,03 hari * |
| DPPH (mg TE/gram) | 9,66 ± 0,09 e | 38,9 ± 1,23 b * | 42,4 ± 0,69 tahun * | 8,98 ± 0,29 e * | 14,3 ± 0,60 hari * | 33,2 ± 1,09 sen * |
| FRAP (mg TE/gram) | 49,4 ± 0,22 cd * | 64,1 ± 0,12 b * | 63,9 ± 0,10 b * | 47,8 ± 0,82 cd * | 42,0 ± 3,61 hari * | 81,7 ± 11,8 tahun * |
| ABTS (mg AAE/gram) | 23,7 ± 1,81 sen * | 15,7 ± 0,10 e * | 62,5 ± 0,18 tahun * | 19,0 ± 2,23 hari * | 23,3 ± 0,05 detik * | 31,3 ± 0,37 b * |
| • OH – RSA (mg TE/gram) | 1,90 ± 0,11 SM | 1,32 ± 0,11 hari | 1,33 ± 0,05 hari | 2,37 ± 0,06 satuan | 2,60 ± 0,09 satuan | 1,74 ± 0,15 detik |
| RAP (mg TE/gram) | 21,3 ± 2,34 detik * | 35,4 ± 2,61 tahun * | 26,9 ± 1,17 b * | 17,2 ± 0,35 cd * | 14,9 ± 0,50 hari * | 27,7 ± 0,95 b * |
| FICA (mg EE/gram) | 2,34 ± 0,25 ab * | 2,57 ± 0,21 satuan | 2,36 ± 0,18 sebuah * | 2,43 ± 0,38 ab * | 2,07 ± 0,20 miliar | 2,09 ± 0,21 b * |
| TAC (mg AAE/gram) | 35,0 ± 2,15 sen * | 49,1 ± 1,45 tahun * | 44,8 ± 1,22 b * | 21,0 ± 0,29 hari * | 13,0 ± 1,24 jam * | 37,1 ± 2,19 detik * |
| Tahap Khalal | Bahasa Inggris MS2 | DNS2 | Bahasa Indonesia: TS2 | Bahasa Inggris HS2 | Bahasa Inggris BS2 | Bahasa Inggris KS2 |
|---|---|---|---|---|---|---|
| TPC (mg GAE/gram) | 10,1 ± 0,17 miliar | 24,4 ± 1,12 jam | 24,1 ± 2,03 jam | 7,53 ± 0,55 detik | 1,88 ± 0,05 hari | 1,22 ± 0,06 hari |
| TCT (mg CE/g) | ND | ND | ND | ND | ND | ND |
| TFC (mg QE/gram) | ND | ND | ND | ND | ND | ND |
| DPPH (mg TE/gram) | 10,5 ± 0,10c * | 21,8 ± 0,67 jam | 18,2 ± 0,62 miliar | 8,20 ± 0,14 hari | 5,40 ± 0,31 hari | 5,16 ± 0,64 hari |
| FRAP (mg TE/gram) | 26,6 ± 3,28 detik | 55,3 ± 3,12 jam | 45,0 ± 2,48 miliar | 13,9 ± 1,09 hari | 4,33 ± 0,22 jam | 2,33 ± 0,17 hari |
| ABTS (mg AAE/gram) | 14,6 ± 0,32 miliar | 15,4 ± 0,53 miliar | 18,3 ± 0,56 satuan | 7,82 ± 0,97 detik | 3,97 ± 0,08 hari | 15,37 ± 0,30 miliar |
| • OH – RSA (mg TE/gram) | 3,02 ± 0,18 miliar | 2,45 ± 0,08 detik | 2,49 ± 0,04 detik | 3,23 ± 0,05 miliar | 3,51 ± 0,02 satuan | 3,58 ± 0,01 satuan * |
| RAP (mg TE/gram) | 4,15 ± 2,10 detik | 29,4 ± 0,67 jam | 11,0 ± 1,20 miliar | 4,61 ± 0,67 detik | ND | ND |
| FICA (mg EE/gram) | 2,27 ± 0,32 satuan | 2,13 ± 0,28 pon | 2,32 ± 0,33 satuan | 2,26 ± 0,05 satuan | 2,45 ± 0,05 satuan * | 1,99 ± 0,26 miliar |
| TAC (mg AAE/gram) | 11,6 ± 0,59 hari | 28,0 ± 0,69 per menit | 22,9 ± 1,12 miliar | 15,3 ± 0,30 detik | 11,2 ± 0,77 hari | 2,68 ± 0,20 e |
| Tahap Tamar | Bahasa Inggris MS3 | DNS3 | Bahasa Indonesia: TS3 | Kelas 3 | BS3 | Kelas 3 |
|---|---|---|---|---|---|---|
| TPC (mg GAE/gram) | 8,72 ± 0,07 satu | 1,30 ± 0,06 detik | 0,47 ± 0,04 hari | 1,74 ± 0,03 miliar | 0,59 ± 0,04 hari | 1,71 ± 0,14 miliar |
| TCT (mg CE/g) | ND | ND | ND | ND | ND | ND |
| TFC (mg QE/gram) | ND | ND | ND | ND | ND | ND |
| DPPH (mg TE/gram) | 5,41 ± 0,79 per menit | 3,71 ± 0,36 miliar | 5,24 ± 0,66 inci | 5,26 ± 0,49 inci | 4,67 ± 0,66 inci | 4,61 ± 0,35 inci |
| FRAP (mg TE/gram) | 1,34 ± 0,08 miliar | 2,11 ± 0,25 per menit | 2,37 ± 0,16 per menit | 0,71 ± 0,04 detik | 1,42 ± 0,04 miliar | 1,66 ± 0,09 miliar |
| ABTS (mg AAE/gram) | 0,79 ± 0,08 detik | 2,41 ± 0,29 miliar | 2,09 ± 0,19 miliar | 1,39 ± 0,07 detik | 7,35 ± 0,40 per menit | 7,83 ± 0,16 satuan |
| • OH-RSA (mg TE/gram) | 3,74 ± 0,01 satuan * | 3,58 ± 0,02 cd * | 3,61 ± 0,01 SM * | 3,54 ± 0,02 detik * | 3,53 ± 0,01 detik * | 3,51 ± 0,04 e |
| RAP (mg TE/gram) | ND | ND | ND | ND | ND | ND |
| FICA (mg EE/gram) | 2,08 ± 0,33 inci | 2,63 ± 0,26 satuan * | 1,71 ± 0,36 miliar | 1,75 ± 0,18 miliar | 1,70 ± 0,08 miliar | 1,85 ± 0,11 miliar |
| TAC (mg AAE/gram) | 13,1 ± 0,07 satu | 9,62 ± 1,40 SM | 11,1 ± 0,22 inci | 10,4 ± 0,10 SM | 7,93 ± 0,50 hari | 9,22 ± 1,21 bcd |
Catatan: nilai superskrip menunjukkan rata-rata dalam satu baris dengan perbedaan yang signifikan ( p < 0,05; uji Tukey). Singkatan: AAE, ekuivalen asam askorbat; CE, ekuivalen katekin; EE, ekuivalen EDTA; GAE, ekuivalen asam galat; ND, tidak terdeteksi; QE, ekuivalen quercetin; TE, ekuivalen Trolox. * Nilai tertinggi di antara tiga tahap pematangan. Singkatan contoh didefinisikan pada Gambar 1 .
TPC menurun secara signifikan dari tahap Kimri ke tahap Tamar di semua kultivar kurma. Nilai TPC pada tahap Kimri adalah yang tertinggi di TS1 dan terendah di BS1. Nilai TPC pada tahap Khalal adalah yang tertinggi di kultivar kurma TS2 dan DNS2. TPC berkisar antara 8,72 hingga 42,07 mg GAE/g di Mejhoul, 1,30 hingga 98,77 mg GAE/g di Deglet nour, 0,47 hingga 117,46 mg GAE/g di Thoory, 1,74 hingga 33,1 mg GAE/g di Halawi, 0,59 hingga 19,68 mg GAE/g di Barhee, dan 1,71 hingga 48,9 mg GAE/g di Khadrawy. TPC terendah (0,47 mg GAE/g) teramati pada kultivar Thoory pada tahap Tamar . Penelitian sebelumnya telah melaporkan bahwa saat buah kurma matang, TPC menurun terutama karena oksidasi oleh polifenol oksidase (Bano et al. 2022 ). Shahdadi et al. ( 2015 ) melaporkan bahwa TPC menurun seiring dengan tahap pematangan progresif pada buah kurma. Dalam penelitian mereka, TPC dalam dua kultivar (Mozafati dan Kalute) menurun dari sekitar 11 dan 9 mg GAE/g pada tahap Khalal menjadi sekitar 8 dan 7 mg GAE/1 g pada tahap Tamar . Mohamed Lemine et al. ( 2014 ) juga mengamati tren serupa, mengidentifikasi bahwa TPC pada tahap Khalal rata-rata 7,28 mg GAE/g, secara signifikan lebih tinggi dari nilai rata-rata 5,59 mg GAE/g pada tahap Tamar . Rashidinejad dan Ahmmed ( 2024 ) juga melaporkan bahwa TPC pada buah damson menurun seiring dengan pematangan.
Tren serupa juga diamati untuk TFC dan TCT. Pada tahap Kimri , TFC dan TCT berkisar antara 0,08 hingga 0,96 mg QE/g dan 0,15 hingga 0,26 mg CE/g, berturut-turut. Namun, flavonoid dan tanin terkondensasi tidak terdeteksi pada tahap Khalal dan Tamar . Tren yang diamati dalam TFC konsisten dengan penelitian sebelumnya oleh Bano et al. ( 2022 ) dan Amira et al. ( 2012 ). Mohamed et al. ( 2014 ) melaporkan TFC yang lebih tinggi (1,74–3,39 mg CE/100 g) pada kultivar kurma Sudan dibandingkan dengan buah kurma pada tahap Tamar dalam penelitian ini. Perbedaan ini dapat disebabkan oleh faktor-faktor seperti metode ekstraksi, asal geografis, waktu panen, jenis kultivar, dan kondisi lingkungan. Konsentrasi TCT juga menunjukkan tren penurunan saat buah matang. Pengurangan tanin ini berkontribusi pada rasa yang tidak terlalu sepat dan peningkatan palatabilitas buah matang (Souli et al. 2018 ).
3.2 Estimasi Antioksidan
Aktivitas penangkal radikal bebas DPPH bervariasi secara signifikan di seluruh kultivar dan tahap pematangan. Pada tahap Kimri , kultivar Thoory memiliki aktivitas tertinggi (42,35 mg TE/g). Namun, aktivitas penangkal terendah ada pada kultivar Mejhoul (9,66 mg TE/g). Demikian pula, kultivar Deglet nour memiliki aktivitas tertinggi pada tahap Khalal (21,76 mg TE/g). Pada tahap Tamar , kultivar Mejhoul dan Deglet nour memiliki aktivitas tertinggi dan terendah masing-masing sebesar 5,41 dan 3,71 mg TE/g. Penurunan aktivitas DPPH dengan pematangan buah mirip dengan tren pada TPC dan konsisten dengan penelitian sebelumnya pada buah kurma (Amira et al. 2012 ; Bano et al. 2022 ; Haider et al. 2018 ; Mohamed et al. 2014 ). Variasi aktivitas antioksidan di antara kultivar mungkin disebabkan oleh faktor-faktor seperti praktik pertanian, jenis tanah, dan suhu. Sebaliknya, perubahan aktivitas DPPH di antara tahap pematangan kemungkinan besar disebabkan oleh penurunan aktivitas enzimatik saat buah matang (Bano et al. 2022 ).
Uji FRAP mengukur aktivitas antioksidan melalui reduksi ferri Fe 3+ menjadi fero Fe 2+ . Uji ini mengevaluasi daya reduksi, bukan kemampuannya langsung dalam membersihkan radikal bebas (Jdaini et al. 2023 ). Kultivar Khadrawy memiliki FRAP tertinggi pada tahap Kimri (81,7 mg TE/g); namun, kultivar Deglet nour memiliki daya reduksi tertinggi pada tahap Khalal (55,3 mg TE/g). Pada tahap Tamar , kultivar Thoory memiliki FRAP tertinggi (2,37 mg TE/g). Mendukung pengamatan ini, Haider et al. ( 2018 ) juga melaporkan penurunan aktivitas FRAP seiring dengan kematangan buah yang meningkat dari tahap Kimri ke tahap Tamar .
Dalam penelitian ini, kultivar Thoory memiliki ABTS tertinggi pada tahap Kimri dan Khalal , masing-masing dengan rata-rata 62,5 dan 18,3 mg AAE/g. Kultivar Deglet nour memiliki ABTS tertinggi pada tahap Tamar (2,41 mg AAE/g). Secara keseluruhan, nilai ABTS di antara kultivar buah kurma pada berbagai tahap pematangan berkisar antara 0,79 hingga 62,5 mg AAE/g, yang menunjukkan tren penurunan seiring pematangan buah kurma. Untuk mendukung temuan ini, Rashidinejad dan Ahmmed ( 2024 ) melaporkan bahwa nilai ABTS pada buah plum damson menurun seiring dengan pematangan buah, menurun dari sekitar 6,60 μmol TE/g menjadi 5,90 μmol TE/g.
Di antara kultivar buah kurma, Deglet nour memiliki RPA tertinggi pada tahap Kimri (35,4 TE/g), dengan penurunan RPA yang signifikan seiring dengan pematangan (Tabel 1 ). Kultivar Barhee dan Khadrawy menunjukkan penurunan nilai RPA secara menyeluruh hingga nol pada tahap ini. Pada tahap Tamar , keenam kultivar tidak menunjukkan daya reduksi. Bertentangan dengan pengamatan ini, Amira et al. ( 2012 ) melaporkan penurunan kapasitas antioksidan selama pematangan akibat faktor enzimatik atau kondisi lingkungan.
Uji •OH-RSA mengevaluasi kapasitas sampel untuk menetralkan radikal hidroksil, spesies yang sangat reaktif yang terlibat dalam stres oksidatif. Dengan menilai kemampuan sampel untuk melawan radikal ini, uji ini memberikan informasi tentang potensi sifat antioksidan dan manfaat kesehatan terkait (Kutlu et al. 2014 ). Di antara semua kultivar dan tahap pematangan, nilai •OH-RSA tertinggi diukur pada tahap Tamar , dengan kultivar Mejhoul memiliki nilai tertinggi 3,74 mg TE/g. Sebaliknya, nilai terendah diukur pada tahap Kimri . Berlawanan dengan uji antioksidan lainnya, kapasitas antioksidan yang diukur menggunakan uji •OH-RSA meningkat seiring pematangan buah dari tahap Kimri ke tahap Tamar .
Kultivar Deglet nour pada tahap Kimri memiliki nilai FICA dan TAC tertinggi (masing-masing 2,57 mg EE/g dan 49,1 mg AAE/g). Namun, kultivar Halawi pada tahap Tamar memiliki nilai terendah (masing-masing 1,75 mg EE/g dan 2,68 mg AAE/g).
Secara keseluruhan, hasil sebagian besar uji antioksidan sesuai dengan pengamatan bahwa kapasitas antioksidan buah kurma cenderung menurun seiring pematangan. Namun, tren yang kontras diamati dengan uji •OH-RSA dan FICA, dengan •OH-RSA meningkat dan FICA tidak menunjukkan perubahan signifikan seiring pematangan. Investigasi lebih lanjut diperlukan untuk menentukan apakah perbedaan ini disebabkan oleh faktor biologis yang mendasarinya terkait dengan perbedaan kultivar.
3.3 Analisis Korelasi
Seperti yang disajikan dalam Tabel 2 , TPC berkorelasi positif dengan TFC, TCT, DPPH, FRAP, ABTS, dan TAC ( r = 0,923, 0,886, 0,895, 0,760, 0,798 dan 0,912, berturut-turut; p < 0,05). Korelasi negatif yang signifikan terjadi antara TPC dan • OH-RSA ( r = −0,909, p < 0,05). Namun, korelasi antara FICA dan TPC tidak signifikan ( r = 0,474, p < 0,05). Tren serupa diamati di antara berbagai uji fenolik dan antioksidan. Secara keseluruhan, korelasi tersebut berkorelasi positif secara signifikan dan sejalan dengan penelitian sebelumnya yang melaporkan bahwa flavonoid berkontribusi lebih sedikit terhadap total kapasitas antioksidan dan bahwa korelasi antara FICA dan kandungan fenolik, tanin terkondensasi, dan flavonoid tidak signifikan (Shi et al. 2023 ; Suleria et al. 2020 ).
| Variabel | TPC | TFC | TCT | DPPH | FRAP | Bahasa Indonesia: ABTS | • OH – RSA | Bahasa Indonesia: RPA | Bahasa Indonesia: FICA |
|---|---|---|---|---|---|---|---|---|---|
| TFC | 0,923 ** | ||||||||
| TCT | 0,886 ** | 0,813 ** | |||||||
| DPPH | 0,895 ** | 0,855 ** | 0,796 ** | ||||||
| FRAP | 0,760 ** | 0,860 ** | 0,697 * | 0,884 ** | |||||
| Bahasa Indonesia: ABTS | 0,798 ** | 0,769 ** | 0,601 * | 0,823 ** | 0,810 * | ||||
| • OH RSA | -0,909 * | -0,947 * | -0,853 * | -0,886 * | -0,928 * | -0,813 * | |||
| Bahasa Indonesia: RPA | 0,824 ** | 0,865 ** | 0,821 ** | 0,833 ** | 0,901 ** | 0,690 * | -0,951 ** | ||
| Bahasa Indonesia: FICA | 0.474 | 0.482 | 0,533 | 0,367 tahun | 0,399 | 0.304 | -0,470 | 0.415 | |
| TAK | 0,912 ** | 0,935 ** | 0,856 ** | 0,893 ** | 0,875 ** | 0,723 ** | -0,951 ** | 0,921 ** | 0.442 |
** Korelasi signifikan pada p ≤ 0,01. * Korelasi signifikan pada p ≤ 0,05.
Grafik PCA menunjukkan bahwa dua komponen pertama (F1 dan F2) menjelaskan 84,78% variabilitas data awal (Gambar 2 ). Setelah mengevaluasi data, kami menemukan bahwa uji antioksidan (RPA, TAC, DPPS, FRAP, dan ABTS) sangat terkait dengan TPC dan TFC sementara ada korelasi positif yang lebih tinggi antara FICA dan TCT.
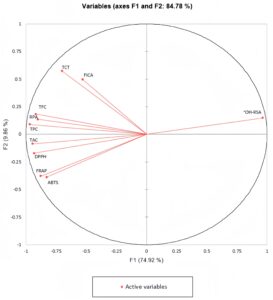
Evaluasi data menunjukkan bahwa aktivitas antioksidan ekstrak kurma juga dapat dipengaruhi oleh faktor non-fenolik. Sementara sebagian besar uji antioksidan menunjukkan korelasi positif dengan konsentrasi senyawa fenolik. Namun, uji seperti aktivitas penangkal radikal hidroksil (•OH-RSA), menunjukkan hasil yang berlawanan. Hal ini menunjukkan potensi keberadaan komponen lain dalam kurma yang dapat memengaruhi kemampuan penangkal radikal hidroksil. Namun, tren keseluruhan masih menunjukkan bahwa kandungan fenolik yang lebih tinggi sesuai dengan kapasitas antioksidan yang lebih tinggi.
3.4 Karakterisasi Senyawa Fenolik
Analisis LC-ESIQTOF-MS/MS dalam mode ionisasi positif dan negatif mengidentifikasi total 28 senyawa fenolik yang berbeda di seluruh 18 sampel (Tabel 3 ). Karakterisasi ini mencakup 4 asam fenolik, 17 flavonoid, dan 7 senyawa fenolik lainnya.
| TIDAK. | Senyawa yang diusulkan | Rumus molekul | RT (menit) | Ionisasi (ESI+/ESI−) | Berat molekul | Teoritis (m/z) | Diamati (m/z) | Kesalahan (ppm) | Produk ion MS/MS | Mencicipi |
|---|---|---|---|---|---|---|---|---|---|---|
| Asam fenolik
Asam hidroksibenzoat |
||||||||||
| 1 | 3,4- O – Asam dimetilgalat | C9H10O5 | 12.447 | [M + H] + | 198.0544 | 199.0617 | Nomor telepon 199.0609 | -4,0 | 153, 139, 125, 111 | HS2 * |
| 2 | 4- O – Asam metilgalik | C8H8O5 | 51.955 | [M + H] + | 184.0357 | 185.043 | 185.0422 | -4,3 | 170, 142 | MS2 * , DNS1, KS2, BS2, DNS2 |
| Asam hidroksi sinamat | ||||||||||
| 3 | Asam dehidrodiferulik 5–5′ | C20H18O8 | 56.910 | [M + H] + | 386.0974 | 387.1047 | 387.1066 | 4.9 | 369 | TS3 * , TS2 |
| Asam hidroksifenilpentanoat | ||||||||||
| 4 | 5-(3′-Metoksi-4′-hidroksifenil)-γ-valerolakton | C12H14O4 | 56.910 | [M + H] + | 222.0885 | 223.0958 | 223.0957 | -0,4 | 205 | HS1 * , KS3 |
| Flavonoid
Antosianin |
||||||||||
| 5 | 4- O -Metildelfinidin 3- O -D-glukosa | C22H23O12 | 54.929 | [M + H] + | 479.1219 | 480.1292 | 480.1276 | -3,3 | nomor 317, 302, 285, 271 | TS1 * |
| 6 | Sianidin 3- O -(2- O -(6- O -(E)-kafeoil-D-glukosida)-D-glukosida)-5- O -D-glukosida | C43H49O24 | 62.291 | [M + H] + | 949.2569 | 950.2642 | 950.2677 | 3.7 | 162, 324, 514 | DNS2 * |
| Dihidrokalkon | ||||||||||
| 7 | 3-Hidroksifloretin 2′- O -xilosil-glukosa | C26H32O15 | 43.996 | [MH] − | 584.1767 | 583.1694 | 583.1697 | 0.5 | 289 | TS2 * , KS1, TS3 |
| Flavonol | ||||||||||
| 8 | 4”- O -Metilepigallocatechin 3-O-gallate | C23H20O11 | 12.231 | [M + H] + | 320.0915 | 321.0988 | 321.0974 | -4,4 | 169, 319 | Bahasa Indonesia: HS2 * ,TS1,KS2,BS2 |
| 9 | 4′- O -Metilepigalokatekin | C16H16O7 adalah | 12.716 | [M + H] + | 472.0992 | 471.0919 | 471.0907 | -2,5 | 92, 121 | DNS3 * |
| Flavonon | ||||||||||
| 10 | 8-Prenilnaringenin | C20H20O5 | 57.621 | [M + H] + | 340.1302 | 341.1375 | 341.1373 | -0,6 | 323, 271, 137 | HS3 * |
| Flavon | ||||||||||
| 11 | Apigenin 7- O -apiosil-glukosa | C26H28O14 | 11.885 | [M + H] + | 564.1456 | 565.1529 | 565.1548 | 3.4 | 296 | HS3 * |
| 12 | Apigenin 7- O -glukuronida | C21H18O11 | 12.931 | [M + H] + | 446.0829 | 447.0902 | 447.0922 | 4.5 | 271, 253 | BS3 * , HS3 |
| 13 | Luteolin 7- O – (2-apiosil-glukosa) | C26H28O15 | 58.253 | [M + H] + | 580.1459 | 581.1532 | 581.1557 | 4.3 | 180, 324 | TS3 * , MS1, BS1, DNS1, TS1, HS1, KS2, TS2, KS3, BS3 |
| 14 | Berkebun di B | C19H18O7 adalah | 58.839 | [M + H] + | 358.1054 | 359.1127 | 359.1132 | 1.4 | 344, 329, 311 | DNS1 * |
| 15 | Krisoeriol 7- O -(6″-malonil-apiosil-glukosa) | C30H32O18 | 57.032 | [M + H] + | 680.1583 | 681.1656 | 681.1674 | 2.6 | 301, 531 | Bahasa Inggris: MS3 * , BS2 |
| Flavonol | ||||||||||
| 16 | 3-Metoksinobiletin | C22H24O9 | 56.651 | ** [P + H] + | 432.1446 | 433.1519 | 433.1512 | -1,6 | 403, 385, 373,
345 |
KS1 * , BS1, DNS1, HS1, HS3 |
| Isoflavonoid | ||||||||||
| 17 | 3′-Hidroksidaidzein | C15H10O5 adalah | 7.841 | [M + H] + | 270.0509 | 271.0582 | 271.0585 | 1.1 | 253, 241, 225 | HS1 * , BS1 |
| 18 | 5,6,7,3′,4′-Pentahidroksiisoflavon | C15H10O7 adalah | 12.466 | [M + H] + | 302.041 | 303.0483 | 303.0491 | 2.6 | 285, 257 | Bahasa Inggris: MS3 * |
| 19 | 6”- O -Malonilgenistin | C24H22O13 | 55.864 | [M + H] + | 518.1087 | 519.1160 | 519.1145 | -2,9 | 271 | MS2 * , BS1, BS2, HS2, TS2, DNS2, KS3 |
| 20 | 2′,7-Dihidroksi-4′,5′-dimetoksiisoflavon | C17H14O6 adalah | 65.442 | [M + H] + | 314.0808 | 315.0881 | 315.0878 | -1,0 | 300, 282 | Bahasa Inggris: BS1 * , KS1, TS2 |
| 21 | 6”-O-Malonildaizin | C24H22O12 | 66.150 | [M + H] + | Nomor telepon 502.1102 | 503.1175 | 503.1183 | 1.6 | 255 | Bahasa Inggris: MS3 * |
| Senyawa fenolik lainnya
Alkilmetoksifenol |
||||||||||
| 22 | 4-Vinilsiringol | C15H14O3 | 56.135 | [M + H] + | 242.0965 | 243.1038 | Nomor telepon 243.1030 | -3,3 | 225, 211, 197 | DNS3 * , HS1, KS2, MS2 |
| Kurkuminoid | ||||||||||
| 23 | Bisdemetoksikurkumin | C19H16O4 adalah | 25.928 | [M + H] + | 308.1044 | 309.1117 | 309.1125 | 2.6 | 291, 263 | TS2 * |
| Stilbenes | ||||||||||
| 24 | 3′-Hidroksi-3,4,5,4′-tetrametoksistilbena | C17H18O5 adalah | 58.472 | [M + H] + | Nomor telepon 302.1128 | Nomor telepon 303.1201 | 303.1210 | 3.0 | 229, 201, 187,
175 |
BS1 * , KS1, MS2 |
| 25 | 4-Hidroksi-3,5,4′-trimetoksistilbena | C17H18O4 adalah | 59.370 | [M + H] + | 286.1211 | 287.1284 | 287.1292 | 2.8 | 271, 241, 225 | KS2 * , BS2, DNS2 |
| Lignan | ||||||||||
| 26 | Konidendrin | C20H20O6 | 56.801 | [M + H] + | 356.1276 | 357.1349 | 357.1358 | 2.5 | 339, 221, 206 | MS1 * , HS1, BS2, HS3, MS3 |
| 27 | Enterolakton | C18H18O4 adalah | 56.839 | [M + H] + | 298.1219 | 299.1292 | 299.1288 | -1,3 | 281, 187, 165 | HS2 * |
| 28 | 7-Oksomatiresinol | C20H20O7 adalah | 63.957 | [M + H] + | 372.1208 | 373.1281 | 373.1271 | -2,7 | 358, 343, 328,
325 |
KS3 * , MS3, DNS3 |
* Senyawa terdeteksi di lebih dari satu sampel, dan data yang disajikan dalam tabel ini berasal dari sampel asterisk.
** Senyawa terdeteksi dalam mode ionisasi negatif [MH] − dan positif [M + H] + sementara hanya data mode tunggal yang disajikan. Singkatan didefinisikan dalam Gambar 1 .
3.4.1 Asam Fenolik
Keempat asam fenolik yang teridentifikasi meliputi 2 asam hidroksibenzoat, 1 asam hidroksi sinamat, dan 1 asam hidroksifenilpentanoat.
3.4.1.1 Asam Hidroksibenzoat
Senyawa 1 , yang diidentifikasi sementara sebagai asam 3,4-O-Dimetilgalat, hanya terdeteksi dalam mode ionisasi positif dalam sampel HS2. Senyawa ini juga diidentifikasi dalam mode positif dan negatif, dengan [M + H] + m/z yang ada sebesar 199,0609. Senyawa ini sebelumnya telah diidentifikasi dalam ekstrak pepaya yang difermentasi (Yücetepe et al. 2021 ). Asam hidroksibenzoat lain (Senyawa 2 ) diidentifikasi sementara sebagai asam 4- O -Metilgalat (waktu retensi = 51,955 menit, m/z 185,0422) dalam sampel MS2, DNS1, KS2, BS2, dan DNS2. Identifikasi ini selanjutnya didukung oleh keberadaan ion produk pada m/z 170 dan 142. Asam 4-O-Metilgalat sebelumnya telah terdeteksi dalam mangga dan produk sampingannya (Dorta et al. 2014 ).
3.4.1.2 Asam Hidroksinamat
Hanya satu asam hidroksisinamat yang diidentifikasi dalam penelitian ini, khususnya dari tahap Khalal dan Tamar dari kultivar Thoory. Senyawa 3 (waktu retensi = 56,910 menit dan m/z 387,1066) diidentifikasi sementara sebagai asam 5–5′-Dehidrodiferulat dan selanjutnya dikonfirmasi oleh keberadaan ion produk pada m/z 369.
3.4.1.3 Asam Hidroksifenilpentanoat
Satu asam hidroksifenilpentanoat diidentifikasi dalam mode positif dalam sampel HS1 dan KS2. Senyawa 4 diidentifikasi sementara sebagai 5-(3′-Methoxy-4′-hydroxyphenyl)-γ-valerolactone, dengan ion prekursor diamati pada m/z 223.0957 dan selanjutnya dikonfirmasi oleh ion produk pada m/z 205 dalam analisis MS/MS.
3.4.2 Flavonoid
Senyawa fenolik utama yang diidentifikasi adalah konjugat flavonoid. Ke-17 flavonoid yang diidentifikasi mencakup 6 subtipe: 2 antosianin, 1 dihidrokalkon, 2 flavanol, 1 flavanon, 5 flavon, 1 flavonol, dan 5 isoflavonoid. Secara khusus, isoflavonoid dan flavon merupakan subtipe yang paling melimpah.
3.4.2.1 Antosianin
Dua antosianin diidentifikasi dalam penelitian ini, yang sementara diidentifikasi sebagai 4- O -Methyldelphinidin 3- O -D-glukosa (Senyawa 5 ) dan Cyanidin 3- O -(2- O -(6- O -(E)-caffeoyl-D glukosida)-D-glukosa)-5- O -D-glukosa (Senyawa 6 ). 4- O -Methyldelphinidin 3- O -D-glukosa ditemukan hanya pada kultivar Thoory pada tahap Kimri . Cyanidin 3- O -(2- O -(6- O -(E)-caffeoyl-D glukosida)-D-glukosa)-5- O -D-glukosa diidentifikasi sementara dalam DNS2 dengan ion prekursor pada m/z 950,2677 dan waktu retensi 62,291 menit.
3.4.2.2 Dihidrokalkon
Hanya satu dihidrokalkon yang diidentifikasi dalam penelitian ini. Senyawa 7 , yang diidentifikasi sementara sebagai 3-Hidroksifloretin 2′-O-ksilosil-glukosa, terdeteksi dalam sampel TS2, KS1, dan TS3. Identifikasi ini didasarkan pada ion [MH] − pada m/z 583.1697 dan ion produk MS/MS pada m/z 289, yang dihasilkan dari hilangnya disakarida ksilosil-glukosa (Pignatelli et al. 2000 ).
3.4.2.3 Flavonol
Senyawa 8 , yang diidentifikasi sementara sebagai 4′-O-Methylepigallocatechin 3-O-gallate, terdeteksi dalam sampel HS2, TS1, KS2, dan BS2, dengan ion prekursor pada m/z 321.0974 dan ion produk pada m/z 319 dan 169. Senyawa 9 , yang diidentifikasi sementara sebagai 4′-O-methylepigallocatechin, terdeteksi dalam mode ionisasi positif dalam sampel DNS3, dengan ion prekursor [M + H] + pada m/z 341.1373. Senyawa ini sebelumnya telah diidentifikasi dalam Elaeodendron transvaalense , tanaman Afrika selatan, sebagaimana dilaporkan oleh Khumalo et al. ( 2019 ).
3.4.2.4 Flavanon
Senyawa 10 diidentifikasi sementara sebagai 8-Prenylnaringenin (waktu retensi = 57,621 menit dengan m/z 341,1373) dalam mode positif sampel HS3. Senyawa ini (8-Prenylnaringenin) terutama ditemukan dalam hop dan juga telah dilaporkan dalam polong Moringa oleifera (Xie et al. 2024 ). Senyawa ini telah menunjukkan potensi signifikan sebagai fitoestrogen dan telah terbukti menginduksi efek biologis (Pohjanvirta dan Nasri 2022 ).
3.4.2.5 Flavon
Flavon termasuk dalam kelompok flavonoid dominan yang diidentifikasi dalam sampel buah kurma, yang terdiri dari total 5 senyawa. Senyawa 11 diidentifikasi sementara sebagai Apigenin 7- O -apiosyl-glucoside dalam mode positif, sebagaimana dibuktikan oleh [M + H] + yang diamati pada m/z 565.1548. Identifikasi ini selanjutnya dikonfirmasi oleh keberadaan ion produk pada m/z 296. Senyawa 13 , yang diidentifikasi sementara sebagai Luteolin 7-O-(2-apiosyl-glucoside), diamati dalam 10 sampel buah kurma di ketiga tahap pematangan (lima dari tahap Kimri , dua dari tahap Khalal dan tiga dari tahap Tamar ). Thoory adalah satu-satunya kultivar di mana Senyawa 13 terdeteksi pada ketiga tahap pematangan. Senyawa 14 (waktu retensi = 58,839 menit dengan m/z 359,1132) diidentifikasi sementara sebagai Gardenin B. Senyawa ini, yang sebelumnya diidentifikasi dalam daun pepermin, telah menunjukkan sifat antivirus dan dianggap sebagai kandidat yang menjanjikan untuk pengembangan terapi antivirus (Al-Karmalawy et al. 2021 ; Areias et al. 2001 ).
3.4.2.6 Flavonol
Senyawa 16 diidentifikasi sementara sebagai 3-Methoxynobiletin pada kedua mode dan diamati dalam sampel KS1, BS1, DNS1, HS1, dan HS3, sebagaimana dibuktikan oleh nilai [M + H] + m/z yang diamati sebesar 433,1512. Identifikasi ini selanjutnya diverifikasi oleh ion produk yang dihasilkan pada m/z 403, 385, 373, dan 345. Senyawa ini sebagian besar ditemukan pada tahap Kimri dan jumlahnya menurun seiring dengan pematangan buah.
3.4.2.7 Isoflavonoid
Ada dua senyawa unik (Senyawa 18 dan 21 ) yang diamati hanya dalam sampel MS3. Pada modus positif, Senyawa 18 diidentifikasi sementara sebagai 5,6,7,3′,4′-Pentahydroxyisoflavone karena waktu retensi pada 12,466 menit dan nilai [M + H] + m/z yang diamati sebesar 303,0491. Senyawa 19 diidentifikasi sementara sebagai 6”-O-Malonyldaidzin karena waktu retensi pada 66,150 menit dan nilai [M + H] + m/z yang diamati sebesar 503,1183. Senyawa 19 ( waktu retensi = 55,863 menit dengan m/z 519,1145) diidentifikasi sementara sebagai 6”-O-Malonylgenistin. Senyawa ini dideteksi dalam sampel MS2, BS1, BS2, HS2, TS2, DNS2, dan KS3. 6”-O-Malonylgenistin terutama terdapat pada buah kurma pada tahap Khalal (MS2, BS2, HS2, TS2, dan DNS2) tetapi semuanya menghilang dari kultivar-kultivar ini setelah tahap Tamar . Senyawa 20 diidentifikasi sementara sebagai 2′,7-dihydroxy-4′,5′-dimethoxyisoflavone menggunakan mode ion positif, seperti yang ditunjukkan oleh m/z 315,0878 dan waktu retensi 65,442 menit. Senyawa ini, yang sebelumnya dilaporkan dalam Lepidium sativum seedcake oleh Kadam et al. ( 2018 ), terdeteksi dalam kultivar Barhee dan Khadrawy pada tahap Kimri dan kultivar Thoory pada tahap Khalal .
3.4.3 Senyawa Fenolik Lainnya
Senyawa fenolik lainnya termasuk satu Alkylmethoxyphenol, satu Curcuminoid, dua Stilbenes, dan tiga Lignans. Senyawa 22 , yang diidentifikasi sementara sebagai 4-Vinylsyringol, terdeteksi dalam sampel DNS3, HS1, KS2, dan MS2 dengan ion [M + H] + pada m/z 243.103. Senyawa 23 , yang diidentifikasi sementara sebagai Bisdemethoxycurcumin, terdeteksi dalam sampel TS2 dengan ion [M + H] + pada m/z 309.1125.
3.4.3.1 Stilbena
Dua senyawa stilbena diidentifikasi: 3′-Hidroksi-3,4,5,4′-tetrametoksistilbena (Senyawa 24 ), terdeteksi dalam sampel BS1, KS1, dan MS2 dengan waktu retensi 58,472 menit dan m/z 303,1210, dan 4-Hidroksi-3,5,4′-trimetoksistilbena (Senyawa 25 ), terdeteksi dalam mode positif pada m/z 287,1292 dalam sampel KS2, BS2, dan DNS2 (semuanya pada tahap Khalal ).
3.4.3.2 Lignan
Tiga senyawa lignan diidentifikasi: Konidendrin (Senyawa 26 ), terdeteksi dalam mode positif pada m/z 357.1358 dalam beberapa sampel; Enterolactone (Senyawa 27 ), terdeteksi pada m/z 299.1288 dalam sampel HS2; dan 7-Oxomatairesinol (Senyawa 28 ), terdeteksi pada m/z 373.1271 dalam sampel KS3, MS3, dan DNS3.
3.5 Distribusi Senyawa Fenolik Dari LC–MS
Diagram Venn digunakan untuk memvisualisasikan tumpang tindih antara berbagai jenis senyawa fenolik dan tahap pematangan (Gambar 3 ). Sebanyak 388 senyawa fenolik diidentifikasi di seluruh sampel kurma (Gambar 3A ). Sebanyak 244 (62,9%) dari senyawa ini terbagi di seluruh tahap pematangan. Tahap Tamar memiliki jumlah senyawa unik tertinggi (16), tetapi jumlah keseluruhan senyawa fenolik terendah pada tahap ini.
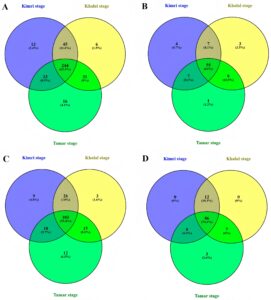
Gambar 3B menunjukkan bahwa 86 asam fenolik diidentifikasi di seluruh tahap pematangan, dengan tahap Kimri memiliki jumlah asam unik tertinggi (4,7%), diikuti oleh Khalal dan Tamar . Demikian pula, Gambar 3C menunjukkan 186 flavonoid di tiga tahap pematangan, dengan Tamar memiliki jumlah flavonoid unik tertinggi (12% atau 6,5%). Gambar 3D menunjukkan 86 senyawa fenolik lainnya, dengan 74,1% dibagikan di seluruh tahap pematangan. Kurma pada tahap Kimri dan Khalal tidak memiliki senyawa fenolik unik, sementara Tamar memiliki 3 (2,6%). Secara keseluruhan, tren penurunan kelimpahan senyawa fenolik diamati dengan pematangan buah, mirip dengan tren yang terlihat untuk asam fenolik dan flavonoid.
Flavonoid merupakan senyawa fenolik yang paling banyak ditemukan, dengan 186 senyawa yang teridentifikasi, diikuti oleh asam fenolik (86) dan senyawa fenolik lainnya (116). Tren umum penurunan senyawa fenolik diamati seiring dengan pematangan buah. Hal ini sesuai dengan penelitian sebelumnya yang menunjukkan penurunan aktivitas enzimatik seiring dengan pematangan (Bano et al. 2022 ).
3.6 Analisis Peta Panas dan Pengelompokan Hirarkis
Peta panas dibuat untuk memvisualisasikan pengelompokan hierarki senyawa fenolik yang dianalisis oleh LC-DAD dalam 18 sampel buah kurma (Gambar 4 ). Peta panas menggambarkan korelasi antara sampel dan senyawa, dengan baris dan kolom dikelompokkan berdasarkan konsentrasi rata-rata setiap senyawa. Sampel dan senyawa yang paling erat hubungannya dikelompokkan bersama.

Gambar 4A menunjukkan kandungan fenolik dalam buah kurma pada tahap Kimri , dengan kultivar Khadrawy memiliki konsentrasi quercetin tinggi pada tahap ini, sekitar dua kali lipat konsentrasi kultivar lainnya. Kultivar Mejhoul memiliki kandungan asam galat tertinggi, tetapi kultivar Deglet nour memiliki kandungan Procyanidin A2 tertinggi. Kultivar Barhee memiliki profil fenolik yang unik, dengan konstituen seperti asam trans-ferulat, asam kafeat, dan prosianidin A2 mencatat konsentrasi sekitar 1,5 kali lebih tinggi dari konsentrasi rata-rata, menyoroti profil fenolik yang berbeda dari kultivar ini. Seperti yang ditunjukkan pada Gambar 4B , kultivar Thoory pada tahap Khalal memiliki konsentrasi quercetin yang jauh lebih tinggi. Kultivar Mejhoul juga memiliki kandungan Procyanidin A2 yang tinggi, sekitar 2 kali lipat dari tingkat rata-rata. Kultivar kurma Halawi memiliki konsentrasi asam galat yang lebih tinggi, sekitar 1,5 kali lebih tinggi daripada konsentrasi rata-rata yang ditemukan pada kultivar kurma lainnya. Pada tahap Tamar (Gambar 4C ), ada perubahan cepat dalam kandungan senyawa fenolik di seluruh kultivar. Sebagian besar senyawa fenolik menurun secara signifikan pada tahap Tamar . Namun, Deglet nour mempertahankan konsentrasi tinggi Procyanidin A2, asam galat, dan asam kafeat. Kultivar Khadrawy juga memiliki konsentrasi Procyanidin A2 yang tinggi, sedangkan Mejhoul memiliki kandungan quercetin tertinggi. Kultivar Thoory mempertahankan konsentrasi asam trans-ferulat yang tinggi pada tahap pematangan ini.
4 Kesimpulan
Studi ini menyelidiki komposisi fenolik dan sifat antioksidan dari enam kultivar pohon kurma Australia pada tiga tahap pematangan. Analisis LC-ESI-QTOF-MS/MS mengidentifikasi 28 senyawa fenolik, yang banyak di antaranya dikenal karena manfaatnya bagi kesehatan. Temuan kami menunjukkan penurunan umum dalam kapasitas antioksidan dan kandungan fenolik saat buah kurma matang. Buah kurma pada tahap awal perkembangan, khususnya dari kultivar Thoory dan Deglet nour, dapat berfungsi sebagai sumber antioksidan alami yang kaya. Penelitian di masa mendatang harus menyelidiki potensi buah-buahan ini sebagai bahan makanan fungsional atau suplemen nutraseutika, yang mendorong pemanfaatan berkelanjutan buah yang dibuang dari tahap pematangan awal.

