ABSTRAK
Flavonoid alami dikonsumsi secara oral dan diketahui memiliki sifat antioksidan, antiradang, dan analgesik. Namun, pemahaman tentang peran gugus fungsional organik dalam memberikan sifat-sifat ini masih terbatas. Makalah tinjauan ini menunjukkan bahwa beberapa gugus fungsional organik, termasuk gugus hidroksil, metoksi, glikosil, terprenilasi, dan flavonoid, memainkan peran penting dalam menentukan kemampuan antioksidan, antiradang, dan analgesik flavonoid. Yang paling penting adalah kontribusi gugus terprenilasi, yang secara signifikan meningkatkan kemampuan antiradang dan analgesik flavonoid. Di antara isoflavon, gugus terprenilasi terutama terletak di C6. Meskipun penting, flavonoid terprenilasi belum mendapat perhatian yang cukup dari para peneliti. Kelas penting lain dari gugus fungsional organik adalah gugus glikosil, dengan C3 menjadi situs substitusi utama di antara antosianin karena monosakarida umumnya ditemukan pada posisi ini. Sebaliknya, keberadaan trisakarida atau kombinasi disakarida dan monosakarida dalam flavonoid tampaknya menghambat sifat antiradang dan analgesiknya. Selain itu, mayoritas biflavonoid, kecuali flavanol terpolimerisasi, menunjukkan kemampuan antiinflamasi atau analgesik. C8 memegang peranan terpenting di antara flavanol sebagai situs substitusi utama untuk substitusi flavonoid. Pemeriksaan signifikansi situs substitusi dalam flavanon, flavonol, flavon, dan kalkon, yang memiliki kemampuan antioksidan, antiinflamasi, dan analgesik, mengungkapkan pentingnya substitusi total dengan berbagai gugus fungsional organik. Wawasan dari tinjauan ini dapat memberikan petunjuk untuk penemuan flavonoid dengan kemampuan antioksidan, antiinflamasi, dan analgesik di masa mendatang.
Singkatan
PENGEMUDI
siklooksigenase
DPPH
2,2-Difenil-1-pikrilhidrazil
IL-1β
interleukin-1β
Pesawat IL-6
interleukin-6
Pesawat IL-8
interleukin-8
Bahasa Indonesia:
sintase oksida nitrat yang dapat diinduksi
asap
lipoksigenase
LPS
lipopolisakarida
NF-κβ
faktor nuklir-κβ
TNF-α
faktor nekrosis tumor-α
1 Pendahuluan
Nyeri didefinisikan sebagai “pengalaman sensorik dan emosional yang tidak menyenangkan yang terkait dengan kerusakan jaringan aktual atau potensial” (Lee dan Neumeister 2020 ). Biasanya, nyeri dan komplikasi inflamasi telah menimbulkan beban yang signifikan pada sistem sosial dan perawatan kesehatan, yang memengaruhi manusia selama berabad-abad. Secara global, 30% orang dewasa mengalami nyeri dan penyakit inflamasi, dengan 20% menerima diagnosis penyakit kronis setiap tahun (Javed et al. 2020 ). Meningkatnya insiden dan prevalensi nyeri dan gangguan terkait ini menambah tantangan yang kita hadapi.
Berdasarkan telaah pustaka yang ekstensif, korelasi yang kuat telah ditetapkan antara peradangan, nyeri, dan stres oksidatif (Adedapo et al. 2015 ). Peradangan menandakan mekanisme pertahanan yang rumit dan krusial yang ditunjukkan oleh inang, yang sering dipicu oleh infeksi mikroba dan sering disertai dengan nyeri. Khususnya, sitokin pro-inflamasi seperti TNF-α, IL-6, dan IL-1β dapat menginduksi sensitisasi atau aktivasi nosiseptor, yang mengarah pada persepsi nyeri (Ferraz et al. 2020 ; Kumar et al. 2015 ). Akibatnya, setiap penelitian yang berkaitan dengan peradangan juga harus mencakup analisis efek analgesiknya (Adedapo et al. 2015 ). Selain itu, cedera jaringan selama peradangan menimbulkan radikal bebas, termasuk radikal yang berasal dari oksigen atau spesies oksigen reaktif (ROS) dan radikal yang berasal dari nitrogen atau spesies nitrogen reaktif (RNS), yang memberikan efek merugikan pada fungsi sel (Adedapo et al. 2015 ).
Secara tradisional, nyeri dan peradangan dianggap sebagai gejala yang tidak menyenangkan dan tidak spesifik dari berbagai penyakit. Analgesik klasik yang berasal dari alam, seperti opiat dan obat antiinflamasi nonsteroid (NSAID), umumnya digunakan. Namun, obat-obatan ini sering kali disertai dengan efek samping seperti lesi lambung, toleransi obat, dan ketergantungan obat. Oleh karena itu, mengeksplorasi sumber alami alternatif untuk NSAID dan opiat menjadi suatu keharusan (Faujdar et al. 2016 ). Saat ini, flavonoid telah muncul sebagai alternatif potensial untuk sifat antiinflamasi dan analgesiknya, dan beberapa penulis telah mencoba untuk merangkum pentingnya gugus fungsi organik dalam menentukan kemampuan antioksidan dan antiinflamasi flavonoid (Hernández-Rodríguez et al. 2019 ; Wang et al. 2018 ). Namun, hingga saat ini, hanya sedikit penulis yang membahas subkelas flavonoid dengan sifat-sifat ini dan jarang berfokus pada pentingnya situs substitusi dalam subkelas flavonoid. Tinjauan ini bertujuan untuk melaporkan secara sistematis dan mempelajari secara komprehensif subkelas flavonoid dengan sifat antioksidan, antiinflamasi, dan analgesik (rangkuman flavonoid tercantum dalam Lampiran S1 dari makalah ilmiah). Lebih jauh, tinjauan ini merangkum pentingnya gugus fungsional organik dan situs substitusi flavonoid.
Yang terpenting, signifikansi gugus fungsi organik dan situs substitusinya diselidiki lebih lanjut menggunakan algoritma pembelajaran mesin. Algoritma pembelajaran mesin adalah proses komputasi yang menggunakan data input untuk mencapai hasil yang diinginkan tanpa diprogram secara eksplisit untuk tugas-tugas tertentu (El Naqa dan Murphy 2015 ). Di antara algoritma-algoritma ini, metode pemilihan fitur sangat berharga karena mereka mengidentifikasi fitur-fitur yang relevan dalam suatu dataset sambil menghilangkan yang berlebihan dan tidak relevan (Jie et al. 2018 ). Dalam studi ini, metode pemilihan fitur digunakan untuk menentukan situs substitusi organik paling kritis yang memengaruhi kemampuan antioksidan, anti-inflamasi, dan analgesik flavonoid. Selain itu, jenis-jenis gugus fungsi organik yang ada di situs-situs substitusi utama ini diperiksa untuk menjelaskan hubungannya dengan bioaktivitas.
2 Flavonoid dan Sifat-sifatnya
Flavonoid, kelompok besar senyawa fenolik yang tersebar luas di seluruh kingdom tumbuhan, diilustrasikan dengan cincin C6-C3-C6. Sebagai metabolit sekunder penting yang berasal dari alam, senyawa ini merupakan bagian penting dari makanan manusia. Di negara-negara Barat, diperkirakan sebanyak 200–500 mg flavonoid dikonsumsi setiap hari (Mascaraque et al. 2015 ). Flavonoid telah mendapatkan perhatian yang semakin meningkat dalam industri makanan karena manfaatnya yang berbeda dalam meningkatkan kualitas dan nilai gizi makanan. Selain itu, flavonoid telah didokumentasikan memiliki berbagai aktivitas farmakologis, seperti kemampuan antioksidan, antiinflamasi, dan analgesik (Chen et al. 2019 ; Jiménez-Aguilar dan Grusak 2017 ).
Penelitian tentang flavonoid terutama difokuskan pada eksplorasi potensi kapasitas antioksidannya. Flavonoid menunjukkan perilaku antioksidan melalui berbagai mekanisme, termasuk khelasi logam transisi yang terlibat dalam pembentukan radikal, penyingkiran langsung ROS, penghambatan enzim seperti xantin oksidase (XO) yang bertanggung jawab untuk menghasilkan anion superoksida, dan pencegahan proses peroksidasi dengan mengurangi radikal alkil dan peroksil (Silva et al. 2021 ). Oleh karena itu, flavonoid dengan aksi antioksidan memainkan peran penting dalam makanan atau tubuh manusia dengan menetralkan proses oksidasi dan mencegah penyakit kronis yang terkait dengan stres oksidatif.
Penting untuk dicatat bahwa sifat antioksidan flavonoid juga dapat berkontribusi pada efek anti-inflamasinya. Misalnya, flavonoid menunjukkan efek antioksidan dan pro-oksidan, menghambat ekspresi gen terkait inflamasi, berinteraksi dengan jalur pensinyalan, dan mengikat protein pro-inflamasi, termasuk penghambat enzim tertentu (Ballard dan Junior 2019 ). Khususnya, flavonoid dapat menghambat enzim pro-inflamasi utama, seperti siklooksigenase (COX), lipoksigenase (LOX), dan NO sintase (NOS), yang diketahui memediasi respons inflamasi, sehingga memberikan manfaat terapeutik (Ballard dan Junior 2019 ). Di antara ini, COX memainkan peran sentral dalam biosintesis prostaglandin, yang berkontribusi pada peradangan dan nyeri. Akibatnya, penghambatan COX oleh flavonoid dapat berkontribusi pada efek anti-inflamasi dan analgesik gandanya (Panche et al. 2016 ; Pinho-Ribeiro et al. 2016 ). Sebagai ilustrasi, naringenin telah terbukti menghambat perilaku seperti nyeri yang disebabkan oleh berbagai rangsangan inflamasi seperti fenil-p-benzoquinon, asam asetat, formalin, karagenan, anion superoksida, dan lipopolisakarida (LPS) (Komakech et al. 2019 ). LPS berfungsi sebagai sinyal aktivasi monosit poten yang secara signifikan memengaruhi produksi sitokin inflamasi, termasuk IL-1β, TNF-α, IL-6, IL-8, prostaglandin D 2 , prostaglandin E 2 , dan tromboksan B 2 (Mayer et al. 2011 ; Tajima et al. 2008 ). Selain itu, katekin telah menunjukkan aktivitas antiinflamasi dan analgesik potensial yang dikaitkan dengan modulasi stres oksidatif dan inflamasi melalui jalur pensinyalan sel seperti NF-κβ dan mitogen-activated protein kinase (Komakech et al. 2019 ). Pengamatan ini menyiratkan adanya hubungan yang kuat antara kemampuan antioksidan, antiinflamasi, dan analgesik yang ditunjukkan oleh flavonoid.
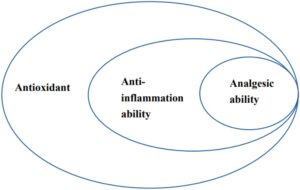
Ringkasan flavonoid yang menampilkan kemampuan antioksidan, antiinflamasi, dan analgesik dapat ditemukan di Tabel S1–S7 dari Lampiran S1 dengan referensi terkait. Perlu dicatat bahwa flavonoid tertentu dapat mengungkap potensi terapeutik tambahan, termasuk kemampuan antiinflamasi dan analgesik, dalam penelitian mendatang. Berdasarkan data yang disajikan dalam Tabel S1–S7 , hubungan hierarkis di antara sifat-sifat ini dapat disimpulkan: kemampuan analgesik → kemampuan antiinflamasi → kemampuan antioksidan. Dengan kata lain, flavonoid yang biasanya menunjukkan kemampuan analgesik, di samping aktivitas antioksidan dan antiinflamasi esensial. Sementara flavonoid biasanya menunjukkan kemampuan antiinflamasi, mereka juga secara konsisten menunjukkan efek antioksidan. Namun, penting untuk menyadari bahwa meskipun banyak flavonoid menunjukkan aktivitas antioksidan yang signifikan, ini tidak selalu berarti efek antiinflamasi atau analgesik. Khususnya, Gambar 1 menggarisbawahi sifat intrinsik flavonoid untuk memiliki atribut antiinflamasi dan antioksidan.
3 Kerangka Dasar Flavonoid dan Kemampuan Antioksidan, Anti-Inflamasi, dan Analgesiknya
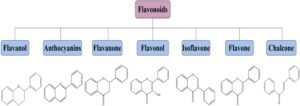
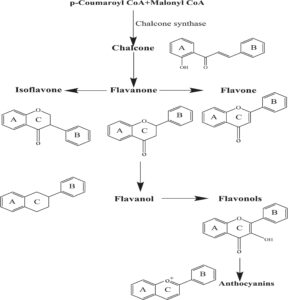
Berdasarkan strukturnya, flavonoid biasanya dikategorikan ke dalam tujuh subkelas: flavanol, flavon, isoflavon, antosianidin, flavanon, flavanol, dan kalkon. Metodologi klasifikasi ini didasarkan pada tingkat oksidasi heterosiklus sentral, yang berkembang dari rendah ke tinggi seperti yang digambarkan pada Gambar 2 (Nagula dan Wairkar 2019 ). Selain itu, Gambar 3 menggambarkan hubungan antara flavonoid yang termasuk dalam subkelas yang berbeda dalam biosintesis (Dias et al. 2021 ). Bagian ini membahas lebih mendalam tentang flavonoid yang memiliki sifat antioksidan, antiinflamasi, dan analgesik di berbagai subkelas.
3.1 Flavonol
Flavanol hadir dalam jumlah yang signifikan dalam makanan yang banyak dikonsumsi seperti teh, anggur, wine, kakao, dan cokelat. Namun, struktur kimia flavanol bervariasi di antara makanan-makanan ini. Misalnya, flavanol dalam teh sebagian besar ditemukan sebagai senyawa galoilasi dan oligomernya, sementara dalam anggur, mereka ada sebagai monomer atau dalam bentuk tanin (Perez-Vizcaino dan Fraga 2018 ). Dalam kakao, flavanol hadir sebagai monomer dan oligomer epikatekin, juga dikenal sebagai proantosianidin (tanin) (Perez-Vizcaino dan Fraga 2018 ). Katekin, sejenis flavanol, dikenal karena aktivitas antiinflamasi dan analgesiknya yang kuat, yang dikaitkan dengan kemampuannya untuk memodulasi peradangan dan stres oksidatif melalui jalur pensinyalan sel, termasuk NF-κβ dan mitogen-activated protein kinase (Komakech et al. 2019 ). Struktur kimia flavanol yang menunjukkan kemampuan antioksidan, anti-inflamasi, dan analgesik diilustrasikan pada Gambar S1 .
Gambar S1 menunjukkan bahwa gugus hidroksil adalah gugus fungsional organik yang paling umum dalam flavanol. Secara umum, flavanol menunjukkan jumlah total gugus hidroksil di atas lima, dengan setiap cincin aromatik biasanya mengandung setidaknya dua gugus hidroksil, yang berpotensi mengalami reaksi polimerisasi di masa mendatang. Tanin, yang merupakan flavanol terpolimerisasi, tidak hanya berkontribusi pada rasa pahit tetapi juga memiliki sifat antiinflamasi (Komakech et al. 2019 ). Namun, Gambar S1 menyiratkan bahwa flavanol terpolimerisasi individu (tanin terkondensasi) hanya memiliki kemampuan antioksidan. Kemampuan antiinflamasi dan analgesik tanin dapat muncul dari tanin terhidrolisis tertentu, seperti asam galat, yang telah terbukti memiliki kemampuan antiinflamasi dan analgesik (Bai et al. 2021 ; Kaur dan Muthuraman 2019 ).
3.2 Antosianin (dan Antosianidin)
Antosianin sebagian besar ditemukan dalam buah-buahan jenis beri dan anggur merah, berkontribusi pada warna biru, merah, dan ungu pada buah-buahan dan sayuran, sementara juga memiliki fungsi antioksidan dan anti-inflamasi (Ballard dan Junior 2019 ; Nagula dan Wairkar 2019 ; Zhang et al. 2016 ). Senyawa-senyawa ini menunjukkan aktivitas antioksidan dengan bertindak sebagai antioksidan eksogen atau intrinsik, yang mampu membersihkan ROS atau spesies nitrogen, sehingga mengurangi stres oksidatif dan mencegah kerusakan sel (Nagula dan Wairkar 2019 ; Zhang et al. 2016 ). Selain itu, antosianin yang diekstrak dari kacang kedelai hitam Korea telah ditemukan untuk mengurangi neuroinflamasi dengan menghambat penanda inflamasi spesifik dan NF-κβ (Spagnuolo et al. 2018 ). Properti-properti ini juga ditunjukkan oleh antosianidin dan tidak eksklusif untuk antosianin (antosianin berbentuk glikosida sementara antosianidin dikenal sebagai aglikon). Khususnya, antosianidin seperti sianidin dan delfinidin telah diidentifikasi karena kemampuannya untuk menghambat stres oksidatif dan aktivasi NF-κβ (Daveri et al. 2018 ). Properti antioksidan, anti-inflamasi, dan analgesik dari antosianin dan antosianidin ditampilkan dalam Gambar S2 .
Gambar S2 menunjukkan bahwa antosianidin dengan gugus hidroksil dapat menghasilkan efek analgesik. Biasanya, senyawa ini ada sebagai bentuk glikosilasi, dengan glikosilasi terjadi di situs substitusi C3 (Spagnuolo et al. 2018 ). Selain itu, senyawa dengan monosakarida mungkin memiliki sifat anti-inflamasi, seperti yang diamati pada Gambar S2 dan Tabel S2 . Temuan ini didukung oleh referensi yang relevan (Huang et al. 2014 ; Vezza et al. 2016 ; Zhao et al. 2019 ). Namun, ketika antosianin memiliki dua monosakarida, mereka lebih mungkin kehilangan efek anti-inflamasinya dan hanya menunjukkan sifat antioksidan. Pergeseran ini terjadi karena antosianidin secara inheren memiliki muatan positif, membuatnya lebih hidrofilik dibandingkan dengan aglikon flavonoid lainnya (Dudek et al. 2022 ). Ketika dua monosakarida dihubungkan ke antosianidin, mereka menjadi sangat hidrofilik dan, sebagai hasilnya, tidak dapat dengan mudah diserap secara oral oleh tubuh manusia.
3.3 Flavanon
Flavanon sebagian besar ditemukan dalam buah jeruk, seperti jeruk dan lemon, berkontribusi terhadap rasa pahitnya dan menawarkan berbagai manfaat kesehatan (Pinho-Ribeiro et al. 2015 ). Flavanon umum, seperti naringin dan naringenin, menunjukkan sifat antioksidan yang penting dan efek antiinflamasi yang potensial, mengurangi nyeri terkait (Dong et al. 2019 ; Ge et al. 2019 ; Hernández-Rodríguez et al. 2019 ; Khan et al. 2020 ; Komakech et al. 2019 ; Silva et al. 2021 ). Secara khusus, naringenin, flavanon monomerik yang pahit dan tidak berwarna, termasuk dalam kelas flavonoid dengan aktivitas antiinflamasi yang kuat karena kemampuannya untuk mengurangi sitokin proinflamasi (Komakech et al. 2019 ; Pinho-Ribeiro et al. 2015 ). Lebih jauh lagi, naringin mampu memodulasi aktivitas enzim antioksidan seperti katalase (CAT), superoksida dismutase (SOD), glutathione peroksidase (GPx), dan paraoxonase (PON), dan juga menunjukkan sifat antioksidan yang signifikan melalui kapasitasnya dalam membersihkan radikal bebas (Eom et al. 2021 ; Liu et al. 2017 ; Mamdouh and Monira 2004 ).
Ringkasan komprehensif flavanon yang menunjukkan kemampuan antioksidan, antiinflamasi, dan analgesik disajikan pada Gambar S3 . Menurut gambar tersebut, gugus prenilasi pada posisi C6 umumnya ditemukan dalam flavanon. Di antara ini, flavanon yang dicirikan oleh gugus prenilasi C6 telah menarik minat yang signifikan karena potensi bioaktifnya yang kuat, seperti menghambat pertumbuhan bakteri (Chen et al. 2012 ; Osorio et al. 2021 ). Selain itu, flavanon prenilasi telah dilaporkan menghambat produksi oksida nitrat (NO) dengan mengganggu ekspresi induksi oksida nitrat sintase (iNOS) (Chen et al. 2012 ).
3.4 Flavonol
Flavonol terutama ditemukan dalam sel epidermis jaringan tanaman dan berfungsi sebagai penghalang pelindung terhadap panjang gelombang matahari yang berbahaya, khususnya sinar UV, untuk menjaga integritas DNA (Nagula dan Wairkar 2019 ). Flavonol secara umum dapat diklasifikasikan menjadi beberapa jenis seperti kaempferol, quercetin, myricetin, dan galangin, yang banyak terdapat dalam sayuran dan buah-buahan tertentu seperti brokoli, bawang, asparagus, dan apel. Quercetin, anggota utama dari subkelas flavonol, mewakili proporsi yang signifikan (60%–75%) dari total asupan flavonoid dalam makanan (Spagnuolo et al. 2018 ). Ia menunjukkan efek menguntungkan dengan menghambat hepatokarsinogenesis yang dimediasi ROS melalui peningkatan antioksidan enzimatik seperti SOD, GPx, CAT, serta antioksidan nonenzimatik seperti glutathione tereduksi (GSH) dan glutathione total (Spagnuolo et al. 2018 ).
Flavonol yang dirangkum dengan kemampuan antioksidan, antiinflamasi, dan analgesik disajikan pada Gambar S4 . Seperti yang ditunjukkan pada Gambar S4 , keberadaan gugus C3-hidroksil (OH) dalam flavonol dikaitkan dengan potensi efek antiinflamasi. Misalnya, quercetin, yang dibedakan dengan gugus C3-OH, telah dilaporkan meningkatkan penghambatan sitokin yang terstimulasi LPS (Zaragozá et al. 2020 ). Signifikansi gugus hidroksil bebas pada situs substitusi C3 quercetin patut diperhatikan, berkontribusi pada penghambatan COX-2. Sebaliknya, quercetin-3-glukuronida, dengan glukuronida pada situs substitusi yang sama, menunjukkan efektivitas yang berkurang (Silva et al. 2021 ). Selain itu, modifikasi pada gugus hidroksil antara cincin memberikan wawasan tentang perubahan molekuler spesifik yang memengaruhi aktivitas mediator inflamasi (Chen et al. 2019 ). Kelompok hidroksil pada situs substitusi C3, C5, dan C6, misalnya, sangat penting untuk interaksi dengan fosfolipase A 2 (PLA 2 ), target penting dalam mediasi inflamasi. Selain itu, peran monosakarida dalam berkontribusi pada kemampuan analgesik flavonol patut diperhatikan. Quercitrin, yang diidentifikasi sebagai quercetin-3-rhamnoside, telah menunjukkan efek penghambatan yang signifikan pada nyeri viseral yang disebabkan oleh asam asetat pada tikus (Zhao et al. 2018 ).
3,5 Isoflavon
Sumber utama isoflavon adalah kedelai dan produk turunan kedelai, dengan genistein dan daidzein menjadi isoflavon utama yang ditemukan dalam sumber-sumber ini (Perez-Vizcaino dan Fraga 2018 ). Isoflavon menunjukkan sifat antioksidan yang kuat dengan membersihkan radikal bebas, melindungi terhadap peroksidasi lipid, dan mengurangi stres oksidatif yang disebabkan oleh kerusakan UV (Nagula dan Wairkar 2019 ). Untuk aktivitas anti-inflamasi, Yu et al. ( 2016 ) menunjukkan bahwa genistein efektif menghambat peradangan yang diinduksi LPS dan mengurangi produksi IL-1β, IL-6, dan PGE2. Lebih jauh lagi, genistein, isoflavon spesifik, telah ditemukan memiliki sifat anestesi lokal dan dapat menawarkan bantuan dari nyeri nociceptif trigeminal tanpa menyebabkan efek samping (Yamaguchi et al. 2021 ). Dukungan serupa diberikan oleh Xu et al. ( 2019 ), yang menunjukkan bahwa genistein dan daidzein menunjukkan kemampuan untuk memblokir saluran natrium yang bergantung pada tegangan, sehingga mengurangi nyeri akut yang disebabkan oleh bahan kimia dan panas. Gambar S5 memberikan ringkasan singkat tentang sifat antioksidan, antiinflamasi, dan analgesik isoflavon. Dengan merujuk pada Gambar S5 , mayoritas isoflavon yang teridentifikasi cenderung menunjukkan sifat antiinflamasi dan analgesik.
Menurut Gambar S5 , gugus terprenilasi dalam isoflavon umumnya ditemukan pada posisi C6 dan C8. Pengamatan ini sejalan dengan temuan van Dinteren et al. ( 2021 ), yang melaporkan bahwa gugus terprenilasi sering hadir dalam isoflavon. Jheng et al. ( 2023 ) selanjutnya menunjukkan bahwa gugus terprenilasi C8 menunjukkan sifat antiinflamasi yang lebih kuat dibandingkan dengan substitusi lainnya. Sementara itu, gugus terprenilasi C6 telah terbukti memiliki kemampuan bioaktif yang kuat, seperti kemampuan antibakteri (Kalli et al. 2020 ).
3.6 Flavon
Flavon, yang dikenal karena pigmentasi kuningnya yang khas, sebagian besar terdapat dalam buah jeruk (He et al. 2016 ). Luteolin, flavon yang paling melimpah dalam tumbuhan, banyak ditemukan dalam seledri, peterseli, paprika hijau, teh kamomil, dan daun perilla. Studi ilmiah telah menunjukkan efek antiinflamasinya yang kuat, yang ditandai dengan penekanan ekspresi inducible nitric oxide synthase (iNOS) dan cyclooxygenase-2 (COX-2). Selain itu, luteolin menurunkan regulasi sitokin proinflamasi dan mengurangi produksi nitrat oksida (NO) dan prostaglandin E 2 dalam sel mikroglia BV2 yang diinduksi oleh LPS (Spagnuolo et al. 2018 ). Gambar S3 menawarkan tinjauan komprehensif flavon yang menunjukkan sifat antioksidan, antiinflamasi, dan analgesik.
Gambar S6 menunjukkan bahwa aktivitas antiinflamasi flavonoid jeruk terkait erat dengan struktur flavonoid individualnya. Misalnya, flavon dengan gugus 4′-OH, atau dengan substituen 3′,4′-hidroksil pada cincin B, adalah penghambat lipoksigenase selektif, sementara flavon dengan lima atau lebih substituen metoksi menunjukkan aktivitas penghambatan yang lebih besar untuk fosfodiesterase (Chen et al. 2017 ). Contoh lain, apigenin, jenis flavon yang mengandung gugus metoksi, dikenal karena kemampuannya untuk membersihkan radikal bebas, yang merupakan molekul reaktif yang dapat merusak sel dan berkontribusi terhadap peradangan. Dengan bertindak sebagai pembersih radikal bebas, apigenin membantu mengurangi stres oksidatif dan melindungi sel pankreas dari kerusakan. Ia juga berperan dalam mengatur sistem pertahanan antioksidan dalam sel-sel ini, yang selanjutnya meningkatkan kemampuan mereka untuk melawan peradangan (Komakech et al. 2019 ). Dalam konteks neuroinflamasi, apigenin terbukti menghambat produksi sitokin proinflamasi seperti IL-1β dan TNF-α. Sitokin ini merupakan mediator utama inflamasi dan dapat berkontribusi terhadap perkembangan penyakit neurodegeneratif. Dengan menghambat produksinya, apigenin membantu mengurangi inflamasi dan berpotensi melindungi terhadap kondisi neuroinflamasi (Komakech et al. 2019 ).
3.7 Kalkon
Kalkon merupakan golongan senyawa dengan struktur cincin C terbuka, dan berfungsi sebagai prekursor untuk sintesis flavonoid dan isoflavon. Senyawa ini tersebar luas dalam tomat, pir, stroberi, bearberry, dan produk gandum tertentu (Panche et al. 2016 ). Gambar S7 merangkum kemampuan antioksidan, antiinflamasi, dan analgesik dari kalkon.
Seperti yang ditunjukkan pada Gambar S7 , mayoritas kalkon memiliki kemampuan antiinflamasi atau analgesik. Misalnya, 2′,4′-dihidroksikalkon, yang dicirikan oleh gugus hidroksil, telah diselidiki karena sifat antiinflamasinya. Penelitian menunjukkan kemampuannya untuk menghambat produksi NO, molekul proinflamasi yang penting dalam respons imun dan inflamasi. Efek antiinflamasi dari 2′,4′-dihidroksikalkon dikaitkan dengan tindakan penghambatannya pada produksi NO (Zhang et al. 2020 ). Selain itu, hesperidin metil kalkon (HMC), yang diklasifikasikan sebagai kalkon dan memiliki disakarida, telah terbukti menghambat produksi sitokin (IL-1β, IL-6, IL-10, dan TNF-α), mengurangi stres oksidatif, dan menahan aktivasi NF-κβ dalam inflamasi yang diinduksi karagenan. Selain itu, HMC menunjukkan kemampuan untuk meringankan nyeri inflamasi dengan memodulasi aktivitas reseptor TRPV1 (Pinho-Ribeiro et al. 2015 ).
4 Kelompok Fungsional Organik dalam Flavonoid
Gambar S1–S7 secara kolektif menunjukkan bahwa gugus hidroksil, metoksi, terprenilasi, glikosil, dan flavonoid berkontribusi pada kemampuan antioksidan, antiinflamasi, dan analgesik flavonoid. Tabel 1 merangkum berbagai gugus fungsi organik yang ditemukan dalam berbagai subkelas flavonoid dengan sifat-sifat bermanfaat ini. Di antara berbagai subkelas flavonoid, gugus hidroksil muncul sebagai gugus fungsi organik yang dominan, khususnya terlihat dalam flavanol (tidak termasuk bentuk terpolimerisasi). Gugus terprenilasi terdapat dalam lima dari tujuh subkelas flavonoid, dengan isoflavon menunjukkan proporsi senyawa terprenilasi tertinggi. Pentingnya gugus fungsi organik dalam menentukan sifat antioksidan, antiinflamasi, dan analgesik flavonoid dibahas dalam bagian berikut (Gambar 4 ).
| Subkelas flavonoid | Kelompok fungsional organik | Kelompok fungsional organik pada efek pengobatan | ||||
|---|---|---|---|---|---|---|
| Hidroksil | Metoksi | Prenilasi | Glikosil | Flavonoid | ||
| Flavonol adalah zat yang dapat menyebabkan alergi. | √ | √ |
|
|||
| Antosianin dan antosianidin | √ | √ | √ | |||
| Flavonon | √ | √ | √ | √ | √ | |
| Flavonol | √ | √ | √ | √ | √ | |
| isoflavon | √ | √ | √ | √ | ||
| Flavon | √ | √ | √ | √ | √ | |
| Kalkon | √ | √ | √ | √ | ||
Catatan: √ menunjukkan keberadaan gugus fungsional organik dalam subkelas flavonoid.
4.1 Kelompok Hidroksil
Flavonoid dicirikan oleh keberadaan dua atau lebih cincin aromatik, biasanya mengandung setidaknya satu gugus hidroksil aromatik yang terikat pada piran heterosiklik. Senyawa-senyawa ini menunjukkan struktur aromatik dan sistem yang sangat terkonjugasi, yang menampilkan beberapa gugus hidroksil. Konfigurasi ini memungkinkan mereka untuk berfungsi sebagai donor elektron atau atom hidrogen yang efisien, menetralkan radikal bebas dan ROS (Kim et al. 2020 ). Beberapa peneliti telah mengamati korelasi yang signifikan antara jumlah gugus hidroksil fenolik dan aktivitas antioksidan aglikon flavonoid (Parcheta et al. 2021 ). Korelasi yang diamati dapat dikaitkan dengan beberapa faktor: (1) peningkatan jumlah gugus hidroksil fenolik menyebabkan lebih banyak H + yang dikombinasikan dengan radikal bebas; (2) hidroksil fenolik memiliki efek donor elektron yang kuat, yang memfasilitasi reaksi dengan radikal bebas (3) jumlah gugus hidroksil fenolik yang lebih tinggi meningkatkan lebih banyak ikatan hidrogen, sehingga secara signifikan meningkatkan aktivitas antioksidan (Zuo et al. 2018 ). Meskipun demikian, korelasi antara jumlah gugus hidroksil dan aktivitas antioksidan tidaklah proporsional ketika gugus gula hadir dalam flavonoid. Kasus ilustratif terlihat pada quercetin 3-glikosida, di mana aktivitas antioksidan ditemukan lebih kuat daripada quercetin saja (Zhang et al. 2016 ). Dalam hal aktivitas antioksidan, hierarki dari tinggi ke rendah diamati sebagai berikut: sianidin 3-glikosida > sianidin 3,5-diglikosida > sianidin 3-(6″-malonil)-glukopiranosida > delphindin 3,5-glikosida (Zhang et al. 2016 ). Mengenai efek anti-inflamasi, flavonoid polihidroksilasi telah menunjukkan kemudahan yang lebih besar dalam menghambat COX dan LOX (Zuo et al. 2018 ). Quercetin dan luteolin, yang memiliki gugus hidroksilasi C3′ dan C4′, menunjukkan penghambatan TNF-α tertinggi, melampaui genistein, kaempferol, apigenin, diosmetin, dan hesperetin, yang hanya memiliki satu gugus hidroksil pada cincin B (Zeinali et al. 2017 ).
4.2 Kelompok Metoksi
Penggantian gugus hidroksil dengan gugus metoksi telah diamati dapat mengurangi sitotoksisitas. Namun, penting untuk menyoroti bahwa substitusi tersebut berpotensi mengurangi aktivitas antioksidan senyawa tersebut. Sebaliknya, proses metilasi secara signifikan meningkatkan sifat anti-inflamasi flavonoid, yang mungkin difasilitasi oleh ionisasi gugus hidroksil dan penghambatan jalur pensinyalan NF-κβ yang lebih jelas (Chen et al. 2018 ). O-metilasi krisin, misalnya, dapat menghasilkan flavonoid yang lebih stabil secara metabolik dengan bioavailabilitas yang meningkat dan distribusi jaringan yang lebih tinggi dibandingkan dengan bentuk yang tidak termetilasi (Chen et al. 2018 ). Yang penting, gugus metoksi di situs substitusi C3 mengurangi sitotoksisitas (Chen et al. 2019 ).
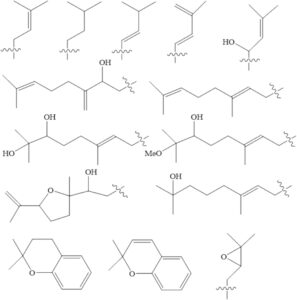
4.3 Kelompok Prenilasi
Flavonoid terprenilasi telah diabaikan oleh para peneliti karena jumlahnya yang sedikit dan keberadaannya yang terbatas pada spesies tanaman (Peng et al. 2024 ; Yang et al. 2015 ). Flavonoid ini sebagian besar terdapat dalam famili Moraceae, dengan kemunculan sporadis dalam famili tanaman lain seperti Fabaceae, Guttiferae, Canabaceae, Rutaceae, Umbelliferae, Euphorbiaceae Asteraceae, dan Thymelaeaceae. Flavonoid terprenilasi mengandung rantai samping terprenilasi lipofilik, yang menggabungkan gugus substituen alkil, seperti prenil, geranil, dan farnesil. Variasi gugus alkil ini bergantung pada hidroksilasi, siklisasi, dan oksidasinya (Shi et al. 2021 ). Penambahan gugus prenilasi ke situs substitusi karbon tertentu pada struktur molekul (prenilasi-C) sering diamati pada situs substitusi C-6/C-8 pada cincin A dan C-3′ dan C-5′ pada cincin B, biasanya situs substitusi orto terhadap gugus hidroksil fenolik. Pada flavonoid prenilasi alami, prenilasi-C pada cincin C relatif jarang (Yang et al. 2015 ).
Saat ini, gugus terprenilasi telah terdeteksi dalam berbagai subkelas flavonoid, termasuk flavanol, flavanon, isoflavon, isoflavon, kalkon, dan flavon. Flavonoid terprenilasi menunjukkan lipofilisitas yang lebih tinggi dibandingkan dengan flavonoid non-prenilasi (Chen et al. 2014 ). Lipofilisitas yang lebih tinggi ini meningkatkan afinitasnya terhadap membran sel, sehingga secara signifikan memperkuat aktivitas biologis dan efek farmakologisnya (Shi et al. 2021 ). Secara khusus, flavanon terprenilasi telah dilaporkan menunjukkan aktivitas antioksidan yang lebih unggul jika dibandingkan dengan flavonoid non-prenilasi (Chen et al. 2014 ).
Sebagian besar flavonoid terprenilasi menunjukkan aktivitas antiinflamasi sedang dalam sel RAW 264.7 yang terstimulasi LPS dengan menurunkan regulasi induksi COX-2 pada konsentrasi 10–25 μM (Shi et al. 2021 ). Karena kemampuannya untuk menghambat COX dan LOX, flavonoid terprenilasi telah menarik minat sebagai agen antiinflamasi yang potensial. Eksplorasi flavonon terprenilasi saat ini terbatas, namun penelitian menunjukkan bahwa prenilasi C-6 dari kerangka flavanon memainkan peran penting dalam potensi penghambatan in vitro terhadap COX-1 dan COX-2 (Hanáková et al. 2017 ).
4.4 Kelompok Glikosil (Bagian Gula)
Gula dihubungkan ke kerangka flavonoid melalui dua mekanisme utama, menghasilkan C atau O-glikosida. Pada C-glikosida, gugus gula secara langsung melekat pada nukleus melalui ikatan CC yang stabil yang tahan terhadap hidrolisis. Di sisi lain, O-glikosida melibatkan gugus gula yang terhubung ke aglikon melalui ikatan OC yang dapat dihidrolisis oleh asam. Secara umum, C-glikosida kurang lazim daripada O-glikosida dan ditemukan secara eksklusif pada kelompok tanaman tertentu, seringkali dengan substitusi tunggal atau ganda yang terjadi pada situs substitusi C-6 dan/atau C-8 (Seo et al. 2019 ). Gugus glikosil umum yang ditemukan dalam flavonoid meliputi monosakarida seperti glukosida, rhamnosida, glukuronida, dan arabinosida. Kehadiran residu gula yang berbeda pada aglikon telah diamati memengaruhi bioavailabilitas (Wang et al. 2018 ). Misalnya, tingkat penyerapan quercetin glukosida lebih dari 10 kali lebih cepat daripada quercetin rutinosida (Hollman 2004 ). Hal ini mengakibatkan konsentrasi quercetin dalam plasma sekitar 20 kali lebih tinggi dibandingkan dengan asupan quercetin rutinosida (Wang et al. 2018 ).
Glikosilasi flavonoid telah dilaporkan meningkatkan kelarutan dalam air, mengurangi toksisitas, dan dalam beberapa kasus, memodifikasi aktivitas farmakologis dan biologis asli (Seo et al. 2019 ). Contoh ilustrasi diamati pada quercetin 3-O-rhamnoside, yang menunjukkan efek penghambatan yang nyata pada pembentukan produk akhir glikasi lanjutan (AGEs). AGE terkenal karena hubungannya yang erat dengan proses inflamasi (Seo et al. 2019 ). Sementara itu, flavonoid O-glukosida telah ditemukan menunjukkan afinitas pengikatan yang sebanding dengan COX-2 jika dibandingkan dengan flavonoid C-glikosida (Chen et al. 2019 ). Selain itu, quercitrin, hyperoside, tiliroside, astragalin, dan kaempferol 3-O-rutinoside menunjukkan berbagai tingkat aktivitas anti-inflamasi, dengan tiliroside menunjukkan kemanjuran yang lebih kuat daripada yang lain. Efek anti-inflamasi tiliroside diduga dimediasi melalui pengurangan NO dan penekanan produksi sitokin pro-inflamasi (TNF-α, iNOS, dan IL-6) (Zhang et al. 2015 ).
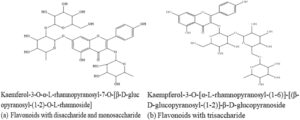
Penting untuk dicatat bahwa flavonoid dengan disakarida dan monosakarida, atau trisakarida, seperti yang ditunjukkan pada Gambar 5 (sampai saat ini, belum ada flavonoid dengan tiga monosakarida yang telah diidentifikasi), menghambat aktivitas anti-inflamasinya, sehingga tidak mampu memberikan penghambatan nyeri. Berkurangnya khasiat anti-inflamasi yang diamati pada flavonoid yang memiliki glikosida dengan lipofilisitas rendah dapat dikaitkan dengan berkurangnya sifat hidrofobisitasnya, yang menyebabkan berkurangnya permeabilitas membran (Wang et al. 2018 ).
4.5 Kelompok Flavonoid
Biflavonoid, yang dicirikan oleh struktur dimeriknya yang unik yang terbentuk melalui berbagai kombinasi kimia, seperti flavanon-flavon, flavon-flavon, dan flavon-flavonol, menunjukkan dua hubungan ikatan primer: ikatan CC atau ikatan COC (Kim et al. 2008 ). Biflavonoid menunjukkan sifat biologis yang beragam, termasuk kemampuan antikanker, antimikroba, antivirus, antiinflamasi, dan analgesik (Kim et al. 2008 ). Dengan merujuk pada Gambar S4 dan Gambar S6–S7 , dapat dilihat bahwa mayoritas biflavonoid (kecuali flavanol terpolimerisasi) menunjukkan kemampuan antiinflamasi dan analgesik. Senyawa-senyawa ini menunjukkan aktivitas antiinflamasinya melalui penghambatan fosfolipase A 2 atau regulasi ekspresi gen proinflamasi, baik in vitro maupun in vivo (Šamec et al. 2022 ).
5 Mengungkap Pentingnya Situs Substitusi dalam Flavonoid
Dibandingkan dengan produk kimia alami lainnya, flavonoid menunjukkan struktur kimia yang relatif serupa. Situs substitusi penting flavonoid (C2–C8 dan C’2–C’5), yang memengaruhi kemampuan antioksidan, antiinflamasi, dan analgesiknya, dapat diidentifikasi menggunakan metode pemilihan fitur dalam pembelajaran mesin (Silakan periksa Bagian Metodologi di Lampiran S1 untuk detailnya). Teknik-teknik ini mencakup pengklasifikasi pohon tambahan, pengklasifikasi peningkatan gradien, hutan acak, dan peningkatan gradien ekstrem. Implementasi metode-metode ini dilakukan menggunakan kode Python yang dikembangkan sendiri. Set data masukan terdiri dari gugus fungsi organik, termasuk gugus hidroksil, metoksi, glikosil (monosakarida, disakarida, dan trisakarida), terprenilasi, dan flavonoid. Data keluaran yang dihasilkan menggambarkan efek pengobatan flavonoid, khususnya dalam hal kemampuan antioksidan, antiinflamasi, atau analgesiknya. Signifikansi situs substitusi dalam flavonoid digambarkan secara visual dalam Gambar S8–S14 , sementara Tabel S8–S14 merangkum gugus fungsi organik dalam berbagai situs substitusi di berbagai flavonoid.
Berdasarkan wawasan dari Gambar S8–14 dan Tabel S8–S14 , dua faktor utama muncul sebagai penentu yang memengaruhi situs substitusi penting flavonoid dengan kemampuan antioksidan, antiinflamasi, dan analgesik. Faktor pertama berkisar pada banyaknya gugus fungsi organik biologis di situs substitusi tertentu. Misalnya, substitusi flavonoid sebagian besar terjadi pada C8 dalam flavanol, monosakarida sebagian besar ditemukan pada C3 dalam antosianin, dan gugus terprenilasi sebagian besar terletak pada C6 dalam isoflavon. Penelitian sebelumnya, termasuk karya Jing et al. ( 2015 ) telah menunjukkan bahwa glikosilasi pada C3 kerangka antosianin secara signifikan meningkatkan kapasitas absorbansi radikal oksigen, yang menandakan indikator antioksidan yang kuat. Bersamaan dengan itu, keberadaan gugus terprenilasi pada C6 diketahui menghasilkan isoflavon dengan aktivitas yang kuat. Sebaliknya, penelitian oleh Mukne et al. ( 2011 ) telah menunjukkan bahwa penghapusan gugus prenilasi atau relokasi mereka ke C8 menyebabkan penurunan aktivitas.
Faktor kedua melibatkan substitusi situs dengan gugus fungsi organik, yang menghasilkan keragaman gugus fungsi organik yang lebih besar, seperti yang dicontohkan oleh flavanon, flavonol, flavon, dan kalkon (Tabel 2 ). Dalam konteks flavanon, C7 muncul sebagai situs substitusi penting, dengan O-glikosilasi pada C7 menunjukkan afinitas yang kuat terhadap membran sel (Zhang et al. 2019 ).
| Subkelas flavonoid | Situs substitusi penting | Kelompok fungsional organik |
|---|---|---|
| Flavonon | C7 | Hidroksil, glikosil (termasuk monosakarida dan disakarida), dan prenilasi |
| Flavonol | C3 | Hidroksil, metoksi, glikosil (termasuk monosakarida, disakarida, trisakarida), dan prenilasi |
| Flavon | C7 | Hidroksil, metoksi, glikosil (termasuk monosakarida dan disakarida), dan prenilasi |
| Kalkon | C3′ | Hidroksil, glikosil (termasuk monosakarida dan disakarida), dan prenilasi |
Selain itu, C7-OH dikenal sebagai gugus hidroksil paling reaktif dalam flavanon (Khan et al. 2010 ). Untuk flavonol, gugus hidroksil pada C3 sangat penting untuk sifat antioksidannya, khususnya dalam menghambat H 2 O 2 , seperti dijelaskan dalam penelitian oleh Krol et al. ( 1994 ). Bagian 3.4 selanjutnya membahas peran penting yang dimainkan oleh C3-OH dalam menentukan kemampuan antioksidan dan anti-inflamasi dari flavonol. Dalam kasus flavon, glikosilasi C7 dalam luteolin telah terbukti secara nyata menurunkan aktivitas antiradikalnya dalam uji DPPH (Spiegel et al. 2020 ). Sebaliknya, flavon dengan C7-OH menunjukkan penghambatan kuat terhadap oksidasi xantin (Zhang et al. 2022 ). Sebuah penelitian oleh Zhou et al. ( 2021 ) menguatkan bahwa gugus prenilasi sebagian besar terikat pada C3′. Setelah mengamati Gambar S8 dan Tabel S14 dengan lebih saksama , menjadi bukti bahwa C3′ memiliki jumlah gugus prenilasi tertinggi.
6 Kesimpulan dan Tren Masa Depan
Makalah ini terutama berfokus pada gugus fungsi organik dan situs substitusi mereka dalam flavonoid daripada struktur stereokimia. Katekin dan epikatekin disajikan sebagai isomer, yang mengungkapkan bahwa mereka memiliki kemampuan antioksidan, anti-inflamasi, dan analgesik yang identik. Isomelacacidin dan melacacidin juga merupakan isomer. Isomer seperti astilibin, neoastilibin, neoisoastilibin, dan isoastilibin juga menunjukkan kemampuan antioksidan dan anti-inflamasi yang identik. Sementara astilibin menunjukkan kemampuan analgesik tambahan, ini tidak boleh ditafsirkan sebagai indikasi bahwa tiga senyawa alami lainnya tidak memiliki sifat analgesik karena data yang disajikan merupakan ringkasan berdasarkan literatur terkini. Penting untuk menyoroti bahwa, dalam konteks ini, struktur stereokimia tampaknya memberikan pengaruh minimal dibandingkan dengan dampak gugus fungsi organik dan situs substitusi mereka dalam menentukan kemampuan antioksidan, anti-inflamasi, dan analgesik flavonoid. Meskipun demikian, peneliti yang menarik dapat mengeksplorasi pentingnya struktur stereokimia lebih lanjut.
Hal penting lain yang perlu ditekankan dalam makalah ini adalah meningkatnya minat terhadap flavonoid terprenilasi, yang telah dianalisis secara ekstensif, yang menggarisbawahi pentingnya gugus fungsional organik ini dalam menentukan sifat anti-inflamasi dan analgesik flavonoid. Namun, karena terbatasnya penemuan flavonoid terprenilasi, penyelidikan lebih lanjut terhadap kemampuan biologisnya menjadi terbatas. Di masa mendatang, penting untuk mensintesis flavonoid terprenilasi atau meningkatkan metode ekstraksi. Ini dapat mencakup penggunaan teknik seperti ekstraksi fluida superkritis, ekstraksi berbantuan ultrasonik, ekstraksi berbantuan gelombang mikro, dan metode pemisahan seperti teknik pemisahan membran.

