
ABSTRAK
Ekstrak etanoat dari ampas kopi panas (HSCG) dan ampas kopi dingin (CSCG) disiapkan dengan ekstraksi berbantuan ultrasonik dan mengalami proses termal dan pencernaan in vitro sebelum menganalisis kemampuan penghambatan pembentukan produk akhir glikasi lanjut (AGE), faktor risiko potensial untuk penyakit Alzheimer. Ekstrak HSCG dan CSCG yang diperoleh sebagian besar mengandung turunan asam klorogenat, menurut kromatogram kromatografi cair-spektrometer massa. Proses glikasi dilakukan dengan menggunakan sistem bovine serum albumin (BSA)/glukosa dengan inkubasi 3 minggu. Dengan adanya ekstrak HSCG dan CSCG pada 250 μg/mL, setelah perlakuan termal (pasteurisasi dan sterilisasi) dan pencernaan in vitro, proses glikasi melalui pembentukan struktur fruktosamin, AGE, dan amiloid cross β dipantau, dan ekstrak ini menunjukkan sifat anti-glikasi pada tahap awal dan lanjut setelah pasteurisasi dan pencernaan in vitro dibandingkan dengan tanpa perlakuan termal. Namun, pada suhu sterilisasi yang tinggi, penekanan sifat anti-glikasi telah terjadi dan dikaitkan dengan jumlah antioksidan dan kemampuan antioksidan untuk membersihkan sebagaimana disajikan dalam dosis. Bioaksesibilitas kafein % yang dihitung dari ekstrak HSGC adalah 65,8%, 64,8%, dan 52,4% dalam sampel non-termal, dipasteurisasi, dan disterilkan sedangkan bioaksesibilitas yang lebih tinggi ditemukan dalam sampel CSCG masing-masing sebesar 67,4, 66,6, dan 63,1. Korelasi tinggi antara nilai TPC, perlakuan termal, dan pencernaan in vitro dengan AGE terdeteksi. Kandungan polifenol dan kafein dalam ekstrak ini ditemukan bertanggung jawab atas AGE dan penghambatan struktur silang β amiloid yang berpotensi mengurangi risiko penyakit Alzheimer.
1 Pendahuluan
Ampas kopi (SCG) adalah produk sampingan yang dihasilkan dari setiap teknik penyeduhan kopi (Yang et al. 2016 ). Ada banyak teknik penyeduhan di seluruh dunia yang terutama dirancang untuk mencocokkan preferensi dan kenyamanan pribadi (Alves et al. 2017 ). Untuk menghasilkan 1 ton kopi larut, SCG dihasilkan sekitar 2–4,5 ton. Kuantitas SCG telah dihasilkan sekitar 6 juta ton (basis basah) di seluruh dunia setiap tahunnya (Zhao et al. 2024 ). Selain itu, SCG dilaporkan sebagai sumber daya biomassa bernilai tinggi yang kaya akan senyawa bioaktif, misalnya, polifenol, polisakarida, protein, lipid, selulosa, dan lignin (Ahmed et al. 2024 ; Zhao et al. 2024 ). Valorisasi biomassa ini merupakan strategi yang efektif; Bahasa Indonesia: alih-alih tempat pembuangan sampah atau buang sebagai limbah, ekstraksi senyawa bioaktif untuk digunakan sebagai bahan fungsional dalam makanan, minuman, produk farmasi, dan kosmetik diusulkan untuk meningkatkan nilai dan mempromosikan pengurangan limbah dengan cara yang ramah lingkungan. Di antara berbagai teknik penyeduhan, salah satu teknik penyeduhan kopi yang baru-baru ini dikembangkan adalah proses penyeduhan dingin. Air dingin (4 °C) atau suhu ruangan (25 °C–30 °C) digunakan sebagai media pelarut untuk mengekstrak senyawa kopi yang larut dari bubuk kopi panggang (Fuller dan Rao 2017 ). Selama proses pemanggangan, senyawa fenolik alami yang ditemukan dalam kopi biji hijau hancur sebagian, tetapi senyawa antioksidan lainnya, seperti melanoidin terbentuk. Ini dapat memungkinkan untuk mempertahankan atau meningkatkan aktivitas antioksidan biji kopi panggang. Oleh karena itu, biji kopi panggang ringan memiliki antioksidan yang lebih tinggi daripada tingkat panggang lainnya karena kandungan polifenol yang lebih besar (Vignoli et al. 2016 ). Faktanya, proses seduh dingin membutuhkan waktu beberapa jam untuk mengekstrak kopi; Namun, rasa yang halus, sejumlah besar senyawa volatil, dan keasaman rendah dihasilkan, dan dilaporkan lebih kecil kemungkinannya untuk mengiritasi lambung jika dibandingkan dengan kopi yang diseduh panas (Mestdagh et al. 2017 ). Total kandungan fenolik (TPC) dan aktivitas antioksidan kopi yang diperoleh dari proses penyeduhan panas dan proses penyeduhan dingin dilaporkan (Rao dan Fuller 2018 ). Selain itu, laporan sebelumnya mengungkapkan bahwa SCG yang diperoleh dari proses penyeduhan dingin (CSCG) memiliki TPC dan kapasitas antioksidan yang lebih tinggi jika dibandingkan dengan ampas kopi seduh panas (HSCG) dari teknik penyeduhan tetes, Moka, dan espresso (Chongsrimsirisakhol dan Pirak 2022 ). Oleh karena itu, CSCG merupakan bahan baku utama yang masih mengandung senyawa fitokimia yang berharga seperti polifenol dan flavonoid.
Selama pemrosesan makanan, perlakuan termal penting untuk mengawetkan dan menjaga keamanan dan kualitas produk makanan. Proses ini dapat mengurangi kontaminasi patogen bawaan makanan, menonaktifkan enzim oksidatif endogen (PPD dan POD), dan mengubah sifat enzim pembusukan untuk memperpanjang masa simpan produk. Namun, aspek negatif juga telah dilaporkan melalui hilangnya, degradasi, atau disfungsi nutrisi tertentu yang diinginkan (senyawa sensitif termal) yang sebagian besar disebabkan oleh proses oksidasi (Choi et al. 2006 ; Kim et al. 2021 ; Peanparkdee et al. 2020 ; Rodríguez-Roque et al. 2015 ; Roy et al. 2007 ; Tomas et al. 2017 ). Selain itu, proses ini juga dapat memulai aktivitas pro-oksidan yang dapat mengurangi keseluruhan penurunan aktivitas antioksidan. Satu reaksi yang dapat terjadi selama pemanasan adalah reaksi Millard non-enzimatik yang menyebabkan efek positif dan negatif pada keseluruhan bioaktivitas dan aktivitas antioksidan (Tomas et al. 2017 ). Efeknya sebagian besar bergantung pada jenis makanan, sifat senyawa bioaktif, metode, dan intensitas proses termal yang dapat meningkatkan atau menurunkan atau bahkan menciptakan senyawa fenolik yang baru diidentifikasi (Peanparkdee et al. 2020 ; Rodríguez-Roque et al. 2015 ; Rohadi et al. 2021 ).
Karena glikasi menginduksi pembentukan AGE dan agregasi amiloid cross β dipercepat oleh ikatan silang yang dimediasi AGE. Agregasi amiloid cross β dapat menciptakan struktur fibrilar (agregasi protein) yang merupakan salah satu faktor yang berkontribusi terhadap perkembangan penyakit Alzheimer. AGE merupakan produk yang dihasilkan oleh reaksi non-enzimatik, lebih khusus lagi proses glikasi dengan adanya protein dan gula pereduksi. Proses glikasi terdiri dari 3 tahap utama, yaitu tahap awal, tahap intermediet, dan tahap lanjut. Pada tahap awal, terjadi interaksi antara gugus amino protein dengan gugus karboksi gula pereduksi dan menghasilkan struktur basa Schiff, yang tidak stabil dan berubah menjadi produk Amadori atau fruktosamin (tahap awal) (Miroliaei et al. 2011 ). Fruktosamin selanjutnya disusun ulang, didehidrasi, dioksidasi, dan dipolimerisasi menjadi AGE (tahap lanjut). Dengan adanya AGE, struktur protein dapat dimodifikasi lebih lanjut menjadi struktur β-sheet yang dapat diproses lebih lanjut menjadi oligomer dan akhirnya menjadi struktur β silang amiloid. Agregasi protein yang tidak biasa ini dapat menyebabkan kerusakan lebih lanjut atau menyebabkan hilangnya sinaps antara sel-sel neuron, yang menyebabkan risiko penyakit Alzheimer (Stefanello et al. 2019 ).
Sejumlah penelitian telah melaporkan banyak senyawa bioaktif dalam kopi sangrai seperti senyawa fenolik, kafein, dan melanoidin (Monente et al. 2015 ). Senyawa bioaktif dari biji kopi sangrai atau kopi, terutama asam klorogenat (CGA) dan turunannya, telah dilaporkan mengurangi akumulasi produk akhir glikasi lanjut (AGE), yang dapat disebut sebagai sifat anti-glikasi (Herawati et al. 2019 ). CGA dan turunannya mungkin masih ada dalam HSCG dan CSCG dan dengan demikian memberikan sifat anti-glikasi pada produk sampingan ini. Namun, perbandingan antara dampak perlakuan termal dan pencernaan in vitro terhadap aktivitas antioksidan dan sifat anti-glikasi ekstrak kasar antioksidan dari HSCG dan CSCG belum terungkap. Dengan demikian, dalam penelitian ini, pembentukan fruktosamin, AGE, dan struktur amiloid cross β ditentukan untuk mengevaluasi sifat anti-glikasi in vitro dari ekstrak kasar etanoat dari HSCG dan CSCG setelah perlakuan termal dan pencernaan in vitro.
2 Bahan dan Metode
CSCG dan HSCG diperoleh dari sebuah perusahaan swasta di Provinsi Chiang Mai, Thailand yang merupakan biji kopi organik yang tumbuh di tempat teduh ( Coffea arabica L.) yang dipanen antara bulan September dan Maret setiap tahun dan kemudian diinkubasi pada suhu ruangan sebelum dipanggang ringan. Biji kopi tersebut dipanggang dan diseduh dalam waktu 1 minggu sebelum dikirim ke lab untuk diekstraksi. CSCG diperoleh dari teknik seduh dingin (4°C, 24 jam) sedangkan HSCG diperoleh dari teknik espresso seduh panas menggunakan mesin espresso (Sage Espresso Machine, model: BES875UK, Italia). CSCG dan HSCG dikeringkan beku untuk mencegah pertumbuhan mikroba dan disimpan pada suhu −18°C sebelum ekstraksi. Ekstrak kasar antioksidan dari HSCG dan CSCG disiapkan menurut penelitian sebelumnya (Chongsrimsirisakhol dan Pirak 2022 ). Singkatnya, kedua SCG diekstraksi melalui proses ekstraksi berbantuan ultrasonik (UAE) menggunakan bak termosonikator dengan 40 kHz (seri D6, GT SONIC, Tiongkok) menurut Onamon dan Pirak, (Chongsrimsirisakhol dan Pirak 2022 ) pada suhu 50°C, rasio etanol 95% 1:20 g/mL selama 40 menit untuk memperoleh ekstrak kasar antioksidan dari HSCG dan CSCG.
Sampel untuk analisis lebih lanjut disiapkan dengan melarutkan 250 μg/mL ekstrak kasar antioksidan dari HSCG dan CSCG dalam air suling, kemudian dicampur dengan pengaduk magnetik selama 3 jam sebelum mengumpulkan bagian supernatan setelah disentrifugasi pada 5000 rpm atau 1677 g (sentrifugasi Eppendorf, Thermo Scientific mySPIN 12, AS) selama 5 menit (proses non-termal/non-pencernaan in vitro). Sampel-sampel ini dikenai analisis dampak perlakuan termal dan pencernaan in vitro terhadap aktivitas antioksidan dan sifat anti-glikasi ekstrak kasar antioksidan.
2.1 Penentuan Profil Fenolik Ekstrak Kasar Antioksidan dari HSCG dan CSCG
HPLC-MS dilakukan pada Sistem Thermo Scientific Dionex UltiMateTM 3000 RSLC (Thermo Fisher Scientific, Jerman) yang dilengkapi dengan SCIEX QTRAP 6500+ High-Throughput Mass Spectrometer dengan IonDrive High Energy Detector (AB Sciex LLC, AS). Pemisahan kromatografi dilakukan pada kolom Acclaim RSLC 120 C18 (120 Å, 2,1 × 100 mm, 2,2 μm) (Thermo Fisher Scientific, Jerman). Hasilnya diperoleh dengan perangkat lunak SCIEX OS (1.2.6) (AB Sciex LLC, AS). Kondisi LC dilakukan pada suhu 30°C, dengan laju alir 0,4 mL/menit dan volume ejeksi 20 μL. Asam format dalam air pada 0,1% v/v (pelarut A) dan asam format dalam asetonitril pada 0,1% v/v (pelarut B) digunakan sebagai komposisi fase gerak pelarut. Profil elusi gradien pelarut B adalah sebagai berikut: 0,00–3,00 menit, 0,0%; 3,00–8,00 menit, 0,0%–18,0%; 8,00–15,00 menit, 18,0%–35%; 15,00–17,00 menit, 35%–90%; 17,00–20,00 menit, 90%–0,0%. Analisis MS dilakukan dalam mode ionisasi negatif. Penyetelan LC/MS dilakukan sebelum analisis menggunakan pengenceran serial senyawa target.
2.2 Penentuan TPC, Kafein, dan Aktivitas Antioksidan
TPC ditentukan oleh uji Folin-Ciocalteau sebagaimana dijelaskan oleh penelitian sebelumnya (Chongsrimsirisakhol dan Pirak 2022 ). Hasilnya dibandingkan dengan kurva standar asam galat dan dinyatakan sebagai mg ekuivalen asam galat (GAE)/ml. Larutan standar kafein dibuat dengan melarutkan kafein dalam 1-propanol (20 ppm). λ maks ditentukan dengan memindai larutan standar antara 250 dan 300 nm (spektrofotometer UV–Vis Thermo Scientific GENESYSTEM 10S, Hexion, Jepang). Pada λ maks ini, kurva standar kafein (5–50 ppm) digunakan untuk menentukan kandungan kafein dalam sampel yang ditentukan. Sebelum penentuan, kafein diekstraksi dari sampel yang ditentukan dengan menambahkan 2 mL natrium klorida jenuh (26%) dan 5 mL 1-propanol ke 1 g sampel yang ditentukan sebelum membiarkan larutan mengendap dan disaring dengan kertas saring (Whatman No. 1). Kafein yang diekstraksi ini diencerkan dengan 1-propanol (1:10 w/v) sebelum mengukur absorbansi pada λ maks, dan hasilnya dihitung dibandingkan dengan kurva standar kafein (dimodifikasi dari Murray dan Hansen ( 1995 )).
Aktivitas antioksidan sampel diukur melalui uji DPPH. Analisis dilakukan berdasarkan penelitian sebelumnya (Chongsrimsirisakhol dan Pirak 2022 ). Hasilnya dibandingkan dengan kurva standar Trolox untuk DPPH dan kemudian dinyatakan sebagai μM Trolox/mL.
2.3 Perlakuan Termal dan Proses Pencernaan In Vitro
Ekstrak kasar antioksidan (250 μg/mL) dari HSCG dan CSCG disiapkan dalam air suling di bawah pengaduk magnetik selama 3 jam dan kemudian disentrifugasi pada 5000 rpm atau 1677 g (sentrifugasi Eppendorf, Thermo Scientific mySPIN 12, AS.) selama 5 menit. Bagian supernatan dikumpulkan dan kemudian dipanaskan dalam penangas air (Memmert model WB14, Jerman) hingga mencapai 72°C selama 20 detik (pasteurisasi, Pas) dan dalam autoklaf pada 121°C selama 15 menit menggunakan (All American 25 Quart Pressure Canner model 925, AS.) (sterilisasi: Ster) dan kemudian dimasukkan ke dalam pencernaan gastrointestinal in vitro. Pencernaan diproses menurut metode standar INFOGEST (Brodkorb et al. 2019 ). Pertama, fase oral berlangsung dengan rasio standar 1:1 (b/b) sampel terhadap cairan oral tiruan dengan amilase saliva. Sampel campuran menjalani fase ini selama 2 menit pada suhu 37°C dalam bak air goyang. Setelah 2 menit, sampel dipindahkan ke fase lambung. Selama fase lambung, cairan lambung tiruan dipanaskan terlebih dahulu pada suhu 37°C sebelum ditambahkan ke bolus oral dalam rasio 1:1 (v/v) dengan larutan pepsin. pH disesuaikan menggunakan pH meter (Docu-pH, Satorius, Jerman) hingga pH 3,0 dengan menambahkan HCL (1,5 M) kemudian diinkubasi lebih lanjut pada suhu 37°C selama 2 jam dalam bak air goyang yang sama (Memmert model WB14, Jerman). Setiap sampel yang diambil segera disesuaikan dengan pH 7,0 dengan NaOH (1 M) untuk meminimalkan aktivitas enzim, kemudian disentrifugasi pada 5000 rpm atau 1677 g (sentrifugasi Eppendorf, Thermo Scientific mySPIN 12, AS) selama 10 menit. Supernatan dikumpulkan dan disimpan pada suhu -18°C untuk analisis lebih lanjut. Pada fase intestinal, cairan intestinal simulasi yang dihangatkan terlebih dahulu (37°C) ditambahkan ke chyme lambung dengan rasio akhir 1:1 (v/v) dengan larutan garam pankreas dan empedu (10 mM). pH disesuaikan menjadi 7,0 sebelum inkubasi akhir selama 2 jam (37°C) dalam penangas air goyang yang sama. Setiap sampel yang diambil segera disesuaikan ke pH 2,0 menggunakan HCl (1,5 M) untuk meminimalkan aktivitas enzim, kemudian disentrifugasi pada 5000 rpm atau 1677 g (sentrifugasi Eppendorf, Thermo Scientific mySPIN 12, AS.) selama 10 menit; kemudian supernatan dikumpulkan dan disimpan pada suhu −18°C untuk analisis selanjutnya.
2.4 Penentuan Sifat Anti-Glikasi Termasuk Kandungan Fruktosamin, AGE, dan Kandungan Struktur Amyloid Cross β
Pada percobaan ini, terdapat 13 sampel yang dilakukan analisis anti-glikasi, yaitu 6 sampel ekstrak CSCG yang diberi perlakuan berbagai kondisi, 6 sampel ekstrak HSCG yang diberi perlakuan berbagai kondisi, dan satu sampel kontrol, yaitu perlakuan tanpa ekstrak.
Perlakuan ekstrak CSCG yaitu (1) ekstrak CSCG tanpa pemanasan (BH), (2) ekstrak CSCG setelah pencernaan gastrointestinal in vitro (AD), (3) ekstrak CSCG dengan pasteurisasi HTST (Pas), (4) ekstrak CSCG dengan sterilisasi (Ster), (5) ekstrak CSCG dengan proses pasteurisasi dan mengalami pencernaan gastrointestinal in vitro (Pas_AD) dan (6) ekstrak CSCG dengan proses sterilisasi dan mengalami pencernaan gastrointestinal in vitro (Ster_AD). Ekstrak HSCG diperlakukan serupa dengan CHSCG, dan 6 sampel diterima sebagai (1) ekstrak HSCG tanpa perlakuan panas (BH), (2) ekstrak HSCG setelah pencernaan gastrointestinal in vitro (AD), (3) ekstrak HSCG yang diperlakukan dengan pasteurisasi HTST (Pas), (4) ekstrak HSCG yang diperlakukan dengan sterilisasi (Ster), 5) ekstrak HSCG yang diperlakukan dengan proses pasteurisasi dan mengalami pencernaan gastrointestinal in vitro (Pas_AD) dan (6) ekstrak HSCG yang diperlakukan dengan proses sterilisasi dan mengalami pencernaan gastrointestinal in vitro (Ster_AD). Sampel disiapkan dengan konsentrasi ekstrak yang sama (250 μg/mL) sebelum dimasukkan ke dalam proses glikasi. Reaksi glikasi disiapkan dalam sistem BSA-glukosa menurut Liu et al. (Liu et al. 2018 ) dengan sedikit modifikasi. Pertama, BSA (10 mg/mL) dan glukosa (0,5 M) disiapkan secara terpisah dalam larutan penyangga fosfat salin (PBS) (1 M, pH 7,4). Natrium azida (0,5 mM dalam 1 M PBS, pH 7,4) juga disiapkan sebagai reagen anti-mikroba. BSA, glukosa, PBS, dan natrium azida dicampur dalam rasio 1:1:2,5: 0,5 v/v, masing-masing, yang merupakan proses glikasi normal (kontrol). Ekstrak kasar antioksidan dari HSCG dan CSCG dicampur dalam sistem glikasi dengan mengganti PBS untuk mencapai konsentrasi akhir 71,43 μg/mL.
Pemulihan supernatan dari perlakuan pencernaan in vitro setelah fase intestinal selesai dilakukan, dan supernatan diuapkan sebelum diekstraksi dengan etanol 95% pada rasio 1:10 g/mL di bawah pengaduk magnetik pada suhu ruangan selama 1 jam. Ekstrak cair dipekatkan hingga kering melalui proses penguapan dan disimpan pada suhu −18°C sebelum dimasukkan ke dalam proses glikasi (dimodifikasi dari Spínola et al. ( 2020 )).
Sampel kosong disiapkan dengan mengencerkan supernatan ekstrak kasar antioksidan dengan PBS (1 M, pH 7,4) pada rasio 1:2,5 v/v. Sampel kosong kontrol hanya berisi larutan BSA. Semua perlakuan yang disiapkan diinkubasi pada suhu 37°C selama 21 hari di bawah penangas air goyang (100 rpm) (model Memmert WB14, Jerman) sebelum menentukan kandungan fruktosamin, AGE, dan kandungan struktur β silang amiloid.
2.4.1 Penentuan Kandungan Fruktosamin
Fruktosamin yang terbentuk selama proses glikasi dianalisis dengan uji Nitro-blue tetrazolium (NBT) (Islam et al. 2014 ). Secara singkat, pengujian dimulai dengan mencampur alikuot setelah 21 hari inkubasi dalam larutan NBT pada rasio 1:10 v/v, kemudian menginkubasi pada suhu 37°C selama 15 menit menggunakan inkubator (model NuAire NU-5810E, AS.) dan membaca absorbansi pada 530 nm (spektrofotometer UV–Vis Thermo Scientific GENESYSTEM 10S, Hexion, Jepang). Larutan tanpa penambahan NBT disiapkan sebagai sampel latar belakang. Kandungan fruktosamin dianalisis dibandingkan dengan kurva standar 1-deoksi-1-morfolino-fruktosa (1-DMF). Hasilnya dilaporkan sebagai IC50 sebesar %penghambatan setelah mengurangi absorbansi latar belakang (aliquot setelah 21 hari inkubasi tanpa penambahan larutan NBT).
2.4.2 Penentuan USIA
Alikuot setelah 21 hari inkubasi dikumpulkan dan kemudian diukur intensitas fluoresensi (FI) melalui panjang gelombang eksitasi (350 nm) dan emisi (450 nm) (spektroflurometer FluoroMax +, Horiba Scientific, AS) yang mengukur senyawa fluoresensi AGE (pentosidina). FI blanko dikurangi dari semua campuran reaksi, dan fluoresensi pembentukan AGE dievaluasi dan kemudian dihitung sebagai IC50 dari % inhibitor (Liu et al. 2018 ).
2.4.3 Penentuan Kandungan Struktur Silang β Amiloid
Thioflavin T adalah penanda untuk struktur amyloid cross β yang digunakan untuk mengevaluasi perubahan dalam struktur protein setelah proses glikasi. Pengujian disiapkan menurut Liu et al. ( 2018 ) dengan sedikit modifikasi dalam persiapan sampel. Singkatnya, larutan thioflavin T (64 μM) dicampur dengan sebagian sampel setelah 21 hari inkubasi dan kemudian dibiarkan bereaksi pada suhu kamar selama 1 jam. FI diukur setelah 1 jam pada 435 nm dan 485 nm untuk eksitasi dan emisi, masing-masing (FluoroMax + spektroflurometer, Horiba Scientific, AS). IC50 dihitung setelah mengurangi FI latar belakang (aliquot setelah 21 hari inkubasi tanpa penambahan thioflavin T) berdasarkan % inhibitor.
2.5 Analisis Statistik
Signifikansi statistik variabel ditentukan pada tingkat probabilitas 5% ( p ≤ 0,05). Analisis Varians (ANOVA) digunakan untuk menguji perbedaan nilai rata-rata sampel dengan Uji Rentang Berganda Baru Duncan pada tingkat keyakinan 95% menggunakan program SPSS Versi 12 (SPSS Inc., AS).
3 Hasil dan Pembahasan
3.1 Profil Fenolik Ekstrak Kasar Antioksidan Dari HSCG dan CSCG
Kromatogram LC–MS dari ekstrak kasar antioksidan dari HSCG dan CSCG ditunjukkan pada Gambar 1 , dan waktu retensi setiap senyawa fenolik ditafsirkan seperti yang ditunjukkan pada Tabel 1 dan 2. Ekstrak kasar antioksidan dari HSCG, 2 senyawa bioaktif, ditemukan sebagai asam neoklorogenat (5-CQA) dan asam 4-O-Feruloylquinic (4-FQA). Ekstrak kasar antioksidan dari kromatogram CSCG menunjukkan 4 jenis senyawa fenolik: asam quinic, 5-CQA, 4-FQA, dan asam caffeic, yang semuanya merupakan turunan dari CGA. Monente et al. ( 2015 ) melaporkan jenis CQA yang sama, dan turunan dapat diamati dalam jenis sampel SCG yang sama dari Arabica atau Robusta meskipun SCG diperoleh dari teknik penyeduhan yang berbeda (filter atau kapsul). Jumlah senyawa bioaktif yang lebih sedikit yang ditemukan dalam ekstrak HSCG dibandingkan dengan ekstrak CSCG dapat dikaitkan dengan teknik penyeduhan yang berbeda. Suhu yang lebih tinggi yang digunakan dalam penyeduhan panas dapat mengekstrak lebih banyak senyawa bioaktif dari kopi, sehingga senyawa bioaktif tetap berada dalam HSCG dibandingkan dengan CSCG.
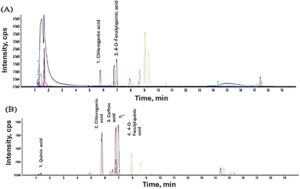
| Jumlah puncak | Waktu retensi | Senyawa |
|---|---|---|
| 1 | 5.77 | 5-CQA |
| 2 | 7.93 | 4- Tanya Jawab Umum |
| Jumlah puncak | Waktu retensi | Senyawa |
|---|---|---|
| 1 | 1.23 | Asam quinat |
| 2 | 5.77 | 5-CQA |
| 3 | 6.95 | Asam kafeat |
| 4 | 7.93 | 4- Tanya Jawab Umum |
CGA dan turunannya paling banyak diamati sebagai senyawa bioaktif dalam SCG sebagai 3 CQA, 5 CQA, 4 FQA, 5 FQA, asam kafeat, dan asam quinat. Boyadzhieva et al. ( 2018 ), Burniol-Figols et al. ( 2016 ), Mussatto et al. ( 2011 ), Panusa et al. ( 2013 ) melaporkan penemuan CGA dan turunannya dalam SCG, tetapi pada tingkat yang berbeda. Kemungkinan besar karena perbedaan asal SCG, teknik penyeduhan, dan tingkat pemanggangan, yang memengaruhi keberadaan CGA dalam SCG (Castaldo et al. 2021 ).
Temuan serupa dilaporkan oleh banyak peneliti yang mengamati bahwa CGA dan turunannya dalam kopi panggang (Liao et al. 2022 ), kulit perak (Nzekoue et al. 2020 ; Wen et al. 2019 ; Zhang et al. 2021 ), dan SCG (Acevedo et al. 2013 ; Angeloni et al. 2020 ; Bravo et al. 2012 ; Głowacka et al. 2019 ). Namun, penelitian lain menemukan lebih banyak senyawa bioaktif dalam SCG daripada temuan kami, yang dapat dikaitkan dengan perbedaan dalam tingkat pemanggangan, asal, dan jenis kopi, metode ekstraksi, pelarut ekstraksi, atau bahkan sensitivitas peralatan penentuan.
3.2 Pengaruh Pencernaan In Vitro terhadap Kandungan Total Fenolik dan Aktivitas Antioksidan Ekstrak Kasar Antioksidan dari HSCG dan CSCG
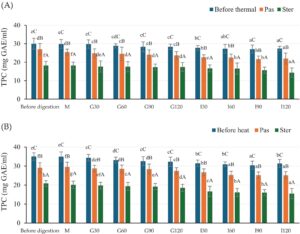
Hasil TPC sebelum dan sesudah kondisi gastrointestinal in vitro ditunjukkan pada Gambar 2. Sebelum proses pencernaan in vitro, TPC tertinggi ditemukan pada sampel yang tidak diberi perlakuan termal pada ekstrak HSCG dan CSCG. Pada fase oral, TPC semua sampel tidak menunjukkan perbedaan signifikan dari sampel yang tidak tercerna. Pada fase lambung, TPC terus menurun pada semua sampel. Penurunan TPC berlanjut hingga fase intestinal. Perlakuan termal menunjukkan TPC yang lebih rendah selama setiap fase kondisi gastrointestinal in vitro jika dibandingkan dengan sampel yang tidak diberi perlakuan dari kedua ekstrak kasar antioksidan. TPC terendah diamati pada sampel setelah perlakuan sterilisasi. Pada akhir kondisi gastrointestinal in vitro, % bioaksesibilitas TPC yang dihitung adalah 91,4%, 81,5%, dan 78,7% pada perlakuan non-termal, pasteurisasi, dan sterilisasi, masing-masing, untuk HSCG; dengan nilai yang sesuai masing-masing 89,6%, 86,4%, dan 74,2% untuk CSCG. Dengan demikian, perlakuan termal mengurangi kandungan TPC dan bioaksesibilitas yang diamati dalam ekstrak CSCG dan HSCG.
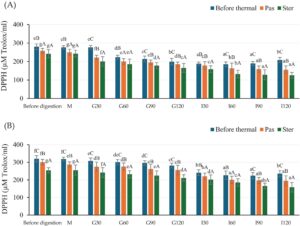
Aktivitas antioksidan dari ekstrak yang tidak dipanaskan dan yang dipanaskan, sebelum dan selama kondisi gastrointestinal in vitro, ditunjukkan pada Gambar 3. Mirip dengan TPC, nilai DPPH dari HSCG yang tidak tercerna lebih rendah daripada CSCG, dan tren yang sama dihasilkan. Karena fase oral tidak menunjukkan efek signifikan pada DPPH sementara selama fase lambung dan usus, nilai DPPH secara bertahap menurun di semua perlakuan. Selain itu, perlakuan termal menurunkan nilai DPPH jika dibandingkan dengan sampel yang tidak diberi perlakuan panas. DPPH dan TPC saling bergantung dan memiliki korelasi tinggi dalam penelitian ini; oleh karena itu, analisis aktivitas antioksidan berdasarkan uji DHHP mampu mengungkapkan efek perlakuan termal dan pencernaan in vitro.
Kandungan kafein dari ekstrak sebelum dan selama kondisi gastrointestinal in vitro disajikan dalam Gambar 4. Sebelum proses pencernaan in vitro, kandungan kafein tertinggi ditemukan dalam ekstrak CSCG. Lebih jauh, perlakuan panas mempengaruhi kandungan kafein dan mengakibatkan penurunan kandungan, khususnya dalam ekstrak HSCG. Semua sampel menunjukkan penurunan kandungan kafein setelah pencernaan gastrointestinal in vitro, yang serupa dengan hasil TPC dan DPPH (Gambar 2 dan 3 ). Tidak ada penurunan signifikan dalam fase oral. Kandungan kafein secara bertahap menurun seiring dengan waktu inkubasi untuk semua perlakuan. Sampel yang disterilkan dan diberi perlakuan panas menunjukkan penurunan kandungan kafein yang signifikan yang lebih tinggi daripada sampel yang dipasteurisasi. Ada laporan yang saling bertentangan tentang pengaruh pemrosesan termal pada TPC dan aktivitas antioksidan, karena perlakuan dapat meningkatkan atau menurunkan aktivitas (Guiné dan Barroca 2014 ). Menurut penelitian dari Su et al. ( 2019 ) dan Rakic et al. ( 2007 ) mereka menemukan peningkatan baik dalam TPC maupun aktivitas antioksidan dari sari buah leci dan ekstrak biji ek setelah pemrosesan termal. Hasil ini dapat disebabkan oleh reaksi Maillard yang mendorong pembentukan senyawa antioksidan seperti melanoidin (Choi et al. 2006 ; Rohadi et al. 2021 ; Su et al. 2019 ). Selain itu, degradasi enzim auto oksidatif dikombinasikan dengan pelepasan senyawa dari matriks sel yang dilunakkan (pelepasan fenolik terikat dari jaringan tanaman) atau pembentukan senyawa fenolik baru melalui reaksi yang diinduksi secara termal (Jeong et al. 2004 ; Liu et al. 2018 ). Sebaliknya, penelitian lain telah melaporkan penurunan baik dalam TPC maupun aktivitas antioksidan setelah perlakuan termal. Penurunan lebih besar dengan peningkatan suhu dan waktu (Roy et al. 2007 ). Tomas et al. ( 2017 ) dan Santhirasegaram et al. (2015) menemukan pengurangan TPC dan aktivitas antioksidan dari tomat yang dipanaskan (100°C selama 60 menit) dan jus mangga (90°C selama 60 detik) dibandingkan dengan sampel segar. Maghsoudlou dkk. ( 2019 ) menemukan pengurangan CGA yang signifikan setelah ekstrak buah quince yang diolah secara termal.
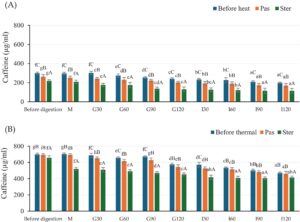
Dalam studi ini, bio-aksesibilitas kafein dihitung dan ditemukan sebesar 65,8%, 64,8%, dan 52,4% masing-masing dalam sampel non-termal, dipasteurisasi, dan disterilkan dari sampel HSCG; dengan nilai yang sesuai sebesar 67,4%, 66,6%, dan 63,1% untuk sampel CSCG. Pengurangan bio-aksesibilitas mungkin disebabkan oleh degradasi fenolik termolabil dan dengan demikian hilangnya aktivitas antioksidan (Roy et al. 2007 ; Santhirasegaram et al., 2015). Selain itu, perlakuan suhu tinggi memiliki dampak negatif pada TPC dan aktivitas antioksidan melalui penghancuran struktur polifenol dengan berat molekul lebih tinggi menjadi senyawa fenolik sederhana dan menginduksi degradasi aglikon monomerik untuk mengurangi aktivitas antioksidan (Rodríguez-Roque et al. 2021 ). Bahasa Indonesia: Setelah pemrosesan termal, beberapa senyawa bioaktif, khususnya CGA, telah dilaporkan diisomerisasi atau didehidrasi dan kemudian ditransformasikan menjadi senyawa pro-oksidan antara lainnya selama berbagai tahap reaksi Maillard (Braghini et al. 2019 ; Kataria et al. 2022 ; Wu et al. 2022 ). Selain itu, CGA mudah dioksidasi karena ikatan esterifikasi CGA memiliki kerentanan tinggi terhadap panas dan dekomposisi oleh hidrolisis CC dan kemudian membuang cincin lakton dari asam quinic yang mengurangi aktivitas antioksidan (Li et al. 2020 ; Maghsoudlou et al. 2019 ). Degradasi senyawa bioaktif juga dikaitkan dengan reaksi oksidasi enzimatik yang diaktifkan melalui oksigen atau auto-oksidasi yang mengkatalisis polimerisasi oksidatif asam fenolik atau degradasi termal basa dari senyawa antioksidan yang terjadi secara alami (Donado-Pestana et al. 2012 ; Kim et al. 2021 ).
Dalam penelitian ini, pengurangan TPC, kafein, dan DPPH diamati setelah pasteurisasi atau sterilisasi HTST pada ekstrak HSCG dan CSCG. Hasil ini menunjukkan bahwa efek dari lebih banyak senyawa bioaktif yang dilepaskan dari matriks yang diekstraksi atau pembentukan senyawa fenolik baru lebih kecil daripada degradasi atau isomerisasi senyawa fenolik yang disebabkan oleh panas yang mengakibatkan pengurangan bioaktivitas. Selain itu, proses panas, baik pasteurisasi atau sterilisasi, secara signifikan memengaruhi stabilitas dan bioaksesibilitas senyawa fenolik setelah pencernaan. Selama pencernaan in vitro, senyawa bioaktif mengalami berbagai modifikasi struktural dan degradasi, mirip dengan yang ditemukan untuk proses termal (Kumari dan Gunathilake 2020 ). Pengamatan serupa juga dilaporkan oleh Sęczyk et al. ( 2021 ), Rodríguez-Roque et al. ( 2015 ), Quan et al. ( 2020 ), Peanparkdee et al. ( 2020 ). Setelah memasukkan ekstrak fenolik yang diolah dengan panas (CGA) ke dalam pencernaan in vitro, kandungan fenolik secara keseluruhan menurun dibandingkan dengan sampel yang tidak diolah (Sęczyk et al. 2021 ). Bioaksesibilitas vitamin C % dari jus buah yang diolah dengan panas berkurang dibandingkan dengan keadaan aslinya (Rodríguez-Roque et al. 2015 ). Pengurangan bioaksesibilitas TPC dan aktivitas antioksidan dalam jus buah yang diolah dengan panas dan ekstrak bekatul beras Thailand juga telah dilaporkan oleh Quan et al. ( 2020 ) dan Peanparkdee et al. ( 2020 ), masing-masing. Ekstrak daun kopi juga memiliki bioaksesibilitas kafein dan CGA % yang lebih rendah saat berpindah dari fase lambung ke fase usus selama gastrointestinal in vitro (Siddhi 2022 ).
Dengan demikian, pengaruh kondisi ekstraksi awal, perlakuan panas berikutnya, dan pencernaan in vitro terungkap, dan penurunan progresif TPC, aktivitas antioksidan, dan kandungan kafein diakibatkan oleh degradasi termal dan kimia.
3.3 Sifat Anti-Glikasi Ekstrak Mentah Antioksidan Dari HSCG dan CSCG
Dalam percobaan ini, efek perlakuan termal dan pencernaan in vitro terhadap sifat anti-glikasi (kandungan fruktosamin, AGE, dan kandungan struktur β silang amiloid) dari 14 sampel diungkapkan pada Gambar 5. Sifat anti-glikasi ekstrak HSCG dan CSCG dievaluasi dan dinyatakan dalam bentuk kandungan fruktosamin, kandungan AGE, dan kandungan struktur β silang amiloid (uji tioflavin T) menggunakan sistem BSA-glukosa (Wu et al. 2011 ). Ditemukan bahwa semua sampel menunjukkan kandungan fruktosamin, kandungan AGE, dan kandungan struktur β silang amiloid yang secara signifikan lebih rendah jika dibandingkan dengan kontrol (tanpa ekstrak). Hasil ini menunjukkan bahwa ekstrak baik dari CSCG atau HSCG dapat menghambat pembentukan produk glikasi. Fruktosamin adalah produk glikasi tahap awal sementara AGE terbentuk selama tahap lanjut dari reaksi glikasi. Dalam hal struktur persilangan amiloid β, struktur protein ini dimodifikasi dari α-helix menjadi beta-sheet oleh AGE (Anis dan Sreerama 2020 ; Anwar dkk. 2021 ; Grzegorczyk-Karolak dkk. 2016 ; Uribarri dkk. 2015 ).

Meskipun penghambatan signifikan produk glikasi untuk ekstrak HSCG dan CSCG diamati, efek penghambatannya berkurang ketika mengalami perlakuan termal dan pencernaan in vitro seperti yang ditunjukkan pada Gambar 5a–c . Degradasi ekstrak kasar antioksidan dari sifat CSCG dalam reaksi glikasi terutama disebabkan oleh pengurangan TPC dan aktivitas antioksidan setelah proses termal seperti yang ditunjukkan dalam hasil korelasi (Tabel 3–6 ). Hasil pada Gambar 5 menunjukkan efek perlakuan panas pada pembentukan produk anti-glikasi setelah pencernaan gastrointestinal in vitro. Sampel ekstrak CSCG dan HSCG dengan dan tanpa perlakuan panas dikenakan analisis setelah 3 minggu inkubasi (21 hari). Kandungan fruktosamin dari sampel BH dan AD baik dari CSCG dan HSCG ditemukan lebih rendah daripada sampel yang diberi perlakuan panas (Pas, Ster, Pas_AD dan Ster_AD). Selain itu, kombinasi perlakuan termal dan pencernaan in vitro (Pas_AD dan Ster_AD) menghasilkan kandungan fruktosamin yang secara signifikan lebih tinggi ( p < 0,05) jika dibandingkan dengan sampel dengan proses termal saja (Pas dan Ster). Hasil ini mengungkapkan bahwa proses pemanasan dapat mendegradasi senyawa bioaktif dan menghasilkan penurunan efek penghambatan. Selain itu, ketika mengalami pencernaan in vitro untuk meniru sistem dalam tubuh manusia, degradasi lebih lanjut terjadi, dan jumlah produk glikasi meningkat (Gambar 5a ). Hasil serupa diamati pada kandungan AGE dan struktur β silang amiloid. Sampel yang diberi perlakuan panas dan pencernaan in vitro menunjukkan kandungan AGE dan struktur β silang amiloid yang lebih tinggi ( p < 0,05) dibandingkan dengan sampel yang tidak diberi perlakuan (BH) (Gambar 5b,c ). Hasil ini mungkin terjadi karena adanya senyawa bioaktif, khususnya polifenol, yang ditemukan dalam ekstrak CSCG dan HSCG. Senyawa-senyawa ini dapat menghambat atau menunda proses glikasi melalui banyak mekanisme, seperti sifat pemulungan untuk mengurangi pembentukan gugus karbonil, menghalangi gugus karbonil gula pereduksi, khelasi, menghalangi basa Schiff atau produk Amadori, dan memutus struktur ikatan silang AGE dari keberadaan polifenol. Selain itu, polifenol dapat mencegah molekul protein berubah dengan menghalangi permukaan hidrofobik protein di sisi substratnya dan mencegah struktur terlipat ulang menjadi fibril amiloid (Miroliaei et al. 2011 ; Tupe et al. 2016 ). Oleh karena itu, retardasi proses glikasi terungkap.
| Parameter | TPC | DPPH | Fruktosamin | USIA | Kandungan struktur silang amiloid β |
|---|---|---|---|---|---|
| TPC | 1 | — | — | — | — |
| DPPH | 0.641 | 1 | — | — | — |
| Fruktosamin | -0,700 * | -0,742 * | 1 | — | — |
| USIA | -0,456 | 0,908 ** | 0,955 ** | 1 | — |
| Kandungan struktur silang amiloid β | -0,993 ** | -0,591 | 0,779 * | 0,580 | 1 |
** p ≤ 0,01. * p ≤ 0,05.
Korelasi Pearson antara TPC, DPPH, fruktosamin, AGE, dan kandungan struktur β silang amiloid dari ekstrak kasar antioksidan dari HSCG setelah pasteurisasi HTST dianalisis (Tabel 3 dan 4 ). Ditemukan bahwa setelah pasteurisasi (Tabel 3 ), korelasi negatif yang signifikan ( p < 0,05) ditemukan antara kandungan fruktosamin dan nilai TPC dan DPPH. Oleh karena itu, peningkatan TPC atau DPPH tidak mempengaruhi pembentukan fruktosamin. Anehnya, TPC ditemukan berkorelasi negatif yang signifikan ( p < 0,09) dengan kandungan struktur β silang amiloid pada tingkat -0,993. Selain itu, korelasi positif yang signifikan ( p < 0,01) antara AGE dan DPPH dan AGE dan fruktosamin diamati pada tingkat 0,908 dan 0,955. Hasil ini menyiratkan bahwa kapasitas antioksidan memiliki dampak signifikan pada pembentukan AGE. Untuk sampel yang diolah dengan sterilisasi (Tabel 4 ), ditemukan dampak negatif ( p < 0,01) antara TPC dan DPPH dengan produk anti-glikasi. Hasil ini menunjukkan bahwa peningkatan TPC atau DPPH tidak mengubah perubahan produk anti-glikasi. Penekanan senyawa ini mungkin bergantung pada jenis senyawa bioaktif, bukan kuantitas senyawa.
| Parameter | TPC | DPPH | Fruktosamin | USIA | Kandungan struktur silang amiloid β |
|---|---|---|---|---|---|
| TPC | 1 | — | — | — | — |
| DPPH | 0,587 tahun | 1 | — | — | — |
| Fruktosamin | -0,808 ** | -0,884 ** | 1 | — | — |
| USIA | -0,840 ** | -0,752 ** | 0.664 | 1 | — |
| Kandungan struktur silang amiloid β | -0,630 | -0,666 | 0,937 ** | 0,883 ** | 1 |
** p ≤ 0,01.
Ketika mempertimbangkan korelasi ekstrak CSCG setelah pasteurisasi (Tabel 5 ), korelasi positif signifikan ( p < 0,01) antara TPC dan DPPH dihasilkan dengan level 0,990. Namun, TPC tidak berkorelasi dengan kandungan fruktosamin ( p < 0,05) dan kandungan AGE (p < 0,01). Ketika mempertimbangkan korelasi DPPH dengan produk anti-glikasi, hasilnya mirip dengan TPC dengan level signifikan p < 0,01. Selain itu, TPC ekstrak CSCG setelah sterilisasi disajikan dalam Tabel 6 yang menunjukkan korelasi positif signifikan ( p < 0,01) dari TPC dan DPPH, sedangkan korelasi negatif ( p < 0,01) diamati antara TPC dan AGE dan kandungan struktur amiloid cross β. Korelasi negatif ( p < 0,05) antara DPPH dan fruktosamin dan kandungan AGE juga terungkap. Berdasarkan hasil yang diperoleh, dapat diasumsikan bahwa penghambatan pembentukan struktur amiloid cross β merupakan hasil dari penekanan produksi fruktosamin dan AGE selama proses glikasi. Karena kadar fruktosamin yang rendah mengakibatkan reaksi pembentukan AGE, modifikasi struktur protein selanjutnya ditekan. Selain itu, perlakuan suhu tinggi ditemukan dapat mengurangi penghambatan produk glikasi yang mungkin disebabkan oleh hilangnya atau degradasi senyawa bioaktif, terutama untuk senyawa yang sensitif terhadap termal melalui oksidasi atau reaksi Maillard non-enzimatik (Choi et al. 2006 ; Kim et al. 2021 ; Peanparkdee et al. 2020 ). Lebih jauh lagi, reaksi Maillard non-enzimatik juga dapat menghasilkan senyawa pro-oksidan dalam zat antara reaksi yang selanjutnya mengurangi aktivitas antioksidan setelah pemrosesan termal. Namun, fenomena ini bergantung pada intensitas perlakuan panas, sifat senyawa bioaktif, dan matriks makanan (Rodríguez-Roque et al. 2015 ; Roy et al. 2007 ; Tomas et al. 2017 ). Selain itu, ada laporan yang menjelaskan hilangnya CGA dan turunan ekstrak buah quince setelah perlakuan termal (Maghsoudlou et al. 2019 ) karena senyawa ini terdegradasi tidak lengkap oleh proses termal yang diterapkan (Roy et al. 2007 ). Menurut pembahasan sebelumnya, reaksi Maillard dapat mengisomerisasi dan mendehidrasi CGA dan mengubah strukturnya menjadi senyawa pro-oksidan (Braghini et al. 2019 ; Wu et al. 2022 ). Ikatan esterifikasi CGA sangat rentan terhadap oksidasi yang merestrukturisasi cincin lakton asam quinic, mengurangi aktivitas antioksidan (Li et al. 2020). Karena CGA dan turunannya merupakan senyawa polifenol utama dalam ekstrak kasar antioksidan dari CSCG, maka hilangnya aktivitas antioksidan dan sifat anti-glikasi sebagian dapat disebabkan oleh ketidakstabilan atau disfungsi turunan CGA yang disebabkan oleh perlakuan termal.
| Parameter | TPC | DPPH | Fruktosamin | USIA | Kandungan struktur silang amiloid β |
|---|---|---|---|---|---|
| TPC | 1 | — | — | — | — |
| DPPH | 0,990 ** | 1 | — | — | — |
| Fruktosamin | -0,753 * | -0,801 ** | 1 | — | — |
| USIA | -0,988 ** | -0,894 ** | 0.640 | 1 | — |
| Kandungan struktur silang amiloid β | -0,680 | -0,568 | 0,817 ** | 0,756 * | 1 |
** p ≤ 0,01. * p ≤ 0,05.
| Parameter | TPC | DPPH | Fruktosamin | USIA | Kandungan struktur silang amiloid β |
|---|---|---|---|---|---|
| TPC | 1 | — | — | — | — |
| DPPH | 0,928 ** | 1 | — | — | — |
| Fruktosamin | -0,708 * | -0,792 * | 1 | — | — |
| USIA | -0,831 ** | -0,746 * | 0,798 * | 1 | — |
| Kandungan struktur silang amiloid β | -0,905 ** | -0,682 | 0,773 * | 0,795 * | 1 |
** p ≤ 0,01. * p ≤ 0,05.
4 Kesimpulan
CSCG mengandung lebih banyak senyawa bioaktif (asam quinic, 5-CQA, asam kafeat, dan 4-FQA) jika dibandingkan dengan HSCG (5-CQA dan 4-FQA) seperti yang dideteksi oleh HPLC-MS. Teknik penyeduhan secara langsung memengaruhi struktur dan kandungan CGA, yang mungkin menjadi keterbatasan untuk memperoleh limbah dari proses penyeduhan panas, yang merupakan aliran limbah utama dari perusahaan produksi kopi dan kedai kopi. Dalam penelitian ini, CSCG ditemukan sebagai bahan baku yang cocok untuk ekstraksi antioksidan. Untuk menekankan dampak pemanfaatan limbah, proses pengumpulan SCG, terutama dari teknik penyeduhan dingin (CSCG), sangat penting karena mengandung kadar air yang tinggi dan mudah rusak. Proses pengumpulan yang higienis, bersama dengan praperlakuan yang tepat, merupakan keharusan untuk menghambat pertumbuhan mikroba. Proses pengumpulan yang digunakan dalam penelitian ini dilakukan dan efektif menghambat pertumbuhan mikroba, memperpanjang umur simpan bahan baku, dan mengawetkan senyawa bioaktif dalam SCG, yang akan berguna untuk memperluas pemanfaatan limbah dengan dampak ramah lingkungan di masa mendatang.
Selain itu, ekstrak CSCG memiliki TPC, aktivitas antioksidan, dan kandungan kafein yang lebih tinggi jika dibandingkan dengan ekstrak HSCG. Perlakuan termal ekstrak mengurangi TPC, aktivitas antioksidan, dan kandungan kafein, dan efek ini lebih signifikan pada suhu tinggi selama proses sterilisasi. Pencernaan in vitro secara signifikan mengurangi TPC, aktivitas antioksidan, dan kandungan kafein ekstrak. Dengan kombinasi perlakuan termal dan pencernaan in vitro, pengurangan terbesar terdeteksi. Ekstrak CSCG dan HSCG menunjukkan efek penghambatan pada produk glikasi dan menunjukkan korelasi dengan nilai TPC. Meskipun efek negatif dari perlakuan termal dan pencernaan in vitro pada kemampuan ekstrak untuk menghambat pembentukan produk glikasi dan struktur β amiloid terdeteksi, ia masih menunjukkan penghambatan yang lebih baik daripada kontrol (tanpa ekstrak). Kandungan kafein dan polifenol spesifik (4-FQA dan 5-CQA) yang ditemukan dalam ekstrak merupakan respons terhadap efek penghambatan ini. Hasil-hasil ini menunjukkan potensi penggunaan SCG untuk membuat bahan makanan atau suplemen yang mampu memberikan manfaat kesehatan, khususnya ekstrak dari proses seduh dingin, dan menyarankan suhu pemrosesan termal optimal di bawah 75°C.

