
Abstrak
Kulit adalah organ tubuh yang terbesar dan menjalankan beberapa fungsi vital, seperti mengendalikan pergerakan zat-zat penting sekaligus melindungi dari ancaman eksternal. Meskipun sebagian besar terdiri dari keratinosit (KC), kulit juga mengandung jaringan sel imun kompleks yang memainkan peran penting dalam pertahanan tubuh dan menjaga homeostasis kulit. KC berkembang biak di lapisan basal epidermis dan mengalami diferensiasi, mengubah karakteristik fungsional dan fenotipiknya. Langkah-langkah diferensiasi ini penting untuk stratifikasi epidermis dan pembentukan stratum korneum, yang memastikan fungsi penghalang kulit. Paparan UV, polutan lingkungan, atau bahan kimia dapat menyebabkan produksi spesies oksigen reaktif (ROS) yang berlebihan, yang menyebabkan stres oksidatif. Untuk memastikan homeostasis redoks dan mencegah kerusakan akibat pembentukan ROS, kulit memiliki jaringan sistem pertahanan antioksidan yang luas, yang terutama diatur oleh jalur faktor nuklir erythroid-2-related factor 2 (Nrf2). Memang, Nrf2 menginduksi ekspresi enzim detoksifikasi dan antioksidan serta menekan induksi gen sitokin pro-inflamasi. Dalam konteks ini, Nrf2 sangat penting dalam menjaga fungsi kulit seperti diferensiasi epidermis, mengatur kekebalan kulit, dan mengelola stres lingkungan. Selain itu, jalur ini memainkan peran penting dalam patogenesis penyakit kulit inflamasi umum seperti dermatitis kontak alergi, dermatitis atopik, dan psoriasis. Oleh karena itu, tinjauan ini menyoroti peran penting Nrf2 dalam KC untuk menjaga homeostasis kulit dan mengatur kekebalan kulit, serta kontribusinya terhadap patofisiologi penyakit kulit inflamasi. Akhirnya, penekanan khusus akan diberikan pada potensi terapeutik dari penargetan jalur Nrf2 untuk meringankan gejala gangguan kulit inflamasi ini.
Singkatan
ACD
dermatitis kontak alergi
IKLAN
dermatitis atopik
AhR
reseptor hidrokarbon aril
ADALAH
Elemen Respon Antioksidan
DMF
dimetil fumarat
DNCB
2,4-dinitroklorobenzena
GSH
glutation
HO-1
heme oksigenase-1
Inggris
interleukin
pertanyaan umum
imikumod
KC
keratinosit
Keap1
protein yang berhubungan dengan ECH seperti kelch 1
NF-κB
faktor nuklir-kappa B
NQO1
NAD(P)H kuinon oksidoreduktase 1
Nrf2
faktor nuklir eritroid-2-faktor terkait 2
PBM
fotobiomodulasi
PRR
reseptor pengenalan pola
Bahasa Indonesia: RNS
spesies nitrogen reaktif
ROS
spesies oksigen reaktif
SFN
sulforafan
smaf
protein Maf kecil
TNF-a
faktor nekrosis tumor alfa
sinar ultraviolet
ultraungu
1. PENDAHULUAN
Keratinosit (KC), yang merupakan sel epidermis yang paling banyak, terus berkomunikasi dengan sel imun yang berada di kulit melalui produksi molekul sinyal terlarut seperti sitokin dan kemokin untuk mempertahankan homeostasis kulit. 1 KC memiliki respons dinamis tergantung pada jenis rangsangan dan dapat mengeluarkan berbagai set sitokin dan kemokin, termasuk Interleukin (IL)-1, IL-20, dan faktor nekrosis tumor-alfa (TNF-α) yang dapat mengoordinasikan respons peradangan kulit setiap kali dipicu. 2 Memang, peradangan kulit didorong oleh berbagai rangsangan eksternal, seperti cedera, radiasi UV, penyerapan alergen, tantangan mikroba, kontak dengan iritan, atau obat-obatan, atau dapat disebabkan oleh rangsangan intrinsik, yang tidak selalu terdefinisi dengan baik (misalnya, mutasi, autoantigen). Respon spesifik yang dicirikan oleh jenis sitokin dan sel imun yang terlibat serta tingkat keparahan reaksi tidak hanya bergantung pada pemicunya tetapi juga pada kecenderungan genetik individu dan gaya hidup sehari-hari, termasuk pola makan, konsumsi alkohol, dan merokok. 3 , 4
Terdapat dua bentuk peradangan kulit yang berbeda: akut dan kronis. Peradangan akut merupakan respons normal yang dapat sembuh sendiri terhadap agen infeksius tertentu, cedera internal/eksternal, bahan kimia, dan paparan sinar UV. Langkah pertama melibatkan pendeteksian sinyal bahaya, termasuk pola molekuler yang terkait dengan patogen dan kerusakan (PAMP dan DAMP) melalui sejumlah reseptor pengenalan pola (PRR) yang diekspresikan oleh sel-sel imun dan non-imun yang berada di kulit. Sebagai respons terhadap pengenalan sinyal-sinyal ini, PRR mengaktifkan kaskade pensinyalan spesifik hilir, yang mengakibatkan aktivasi faktor nuklir kappa-light-chain-enhancer of activated B (NF-κB) dan inflammasome. Jalur pro-inflamasi ini terutama berpuncak pada induksi beberapa sitokin pro-inflamasi, seperti TNF-α, IL-1, IL-6, dan interferon (IFN), serta limfopoietin stroma timus (TSLP) dan kemokin, termasuk IL-8, CXCL1, CXCL2, CXCL10, CCL2, dan CCL20. Berbagai kemokin yang disekresikan mendorong masuknya berbagai jenis subset sel imun seperti neutrofil, monosit, atau sel T yang direkrut ke tempat peradangan, sehingga meningkatkan respons imun yang efektif. 5 , 6 Peradangan akut bertujuan untuk menghilangkan penyebab kerusakan sel, membersihkan atau menyerap sel-sel nekrotik, dan memulai perbaikan jaringan. Namun, respons peradangan yang tidak diatur dalam waktu lama dapat menyebabkan peradangan kronis yang terus-menerus menyebabkan cedera jaringan, yang umumnya diamati pada banyak dermatitis kronis, seperti dermatitis atopik (AD) dan psoriasis. Banyak jalur sinyal pro-inflamasi diaktifkan di epidermis pasien dengan penyakit kulit inflamasi, yang menunjukkan bahwa KC memiliki peran penting dalam membentuk dan mengatur peradangan di kulit. 7 Bukti yang terkumpul menunjukkan bahwa KC memainkan peran aktif dalam patogenesis banyak, jika tidak semua, penyakit kulit inflamasi dengan berinteraksi secara aktif dengan sel-sel imun, sehingga memulai atau mempertahankan respons inflamasi. 8
Penyakit radang kulit sering dikaitkan dengan kelainan redoks yang harus diatur untuk memastikan homeostasis redoks dalam sel dan melindungi terhadap peradangan. 9 Untuk mencegah kerusakan oksidan, kulit memiliki jaringan antioksidan yang luas, terutama diatur oleh faktor transkripsi peka-redoks faktor nuklir erythroid-2-related factor 2 (Nrf2). 10 , 11 Di sini, kami meninjau peran penting jalur pensinyalan Nrf2 dalam patofisiologi penyakit kulit inflamasi yang paling umum seperti psoriasis, AD, dan dermatitis kontak alergi (ACD). Setelah tinjauan umum jalur pensinyalan Nrf2, kami melakukan tinjauan literatur dengan mengeksplorasi studi klinis dan eksperimental yang membahas peran ekspresi NRF2 dan efektivitas terapi yang menargetkan jalur NRF2 dalam pengaturan in vivo dan in vitro.
2 KULIT DAN STATUS REDOKS
Homeostasis kulit melibatkan penyempurnaan keseimbangan redoksnya. Dalam kondisi fisiologis, semua jenis sel kulit memproduksi, dengan cara yang terkendali, spesies reaktif yang berbeda, termasuk spesies oksigen reaktif (ROS) dan spesies nitrogen reaktif (RNS). 12 , 13 Spesies sulfur reaktif (RSS) juga telah diidentifikasi sebagai molekul yang ada di mana-mana dalam biologi redoks, memainkan peran penting dalam fungsi seluler dan homeostasis redoks. 14 Konsep “redoksom kulit” yang baru diperkenalkan mewakili lingkungan redoks kulit, termasuk pembentukan spesies reaktif, netralisasi mereka melalui antioksidan, dan jaringan pensinyalan yang bertanggung jawab untuk mengatur keseimbangan redoks. 15 Karena ROS dan molekul lain yang sangat reaktif—ketika diproduksi pada tingkat yang relatif rendah—terlibat dalam proses seluler fundamental pada kondisi stabil, homeostasis redoks sangat penting untuk memastikan fungsi biologis kulit. 16 Kontrol keseimbangan antara produksi spesies reaktif dan netralisasi dengan demikian sangat penting dan didasarkan pada berbagai sistem detoksifikasi. Selain itu, kulit, karena posisi strategisnya, sangat rentan terhadap agresi lingkungan. Integrasi berbagai tekanan ini oleh jaringan dapat menyebabkan keadaan ketidakseimbangan yang dikenal sebagai “stres oksidatif.” Jika terjadi stres berlebihan, sistem detoksifikasi ini dapat kewalahan dan gagal mempertahankan kendali kondisi stabil, sehingga mengakibatkan ketidakseimbangan status redoks kulit.
Penyakit radang kulit sering dikaitkan dengan kelainan redoks. Bukti menunjukkan peningkatan penanda stres oksidatif pada pasien psoriasis dan AD, terutama selama eksaserbasi AD, serta pertahanan antioksidan yang berubah. 17 – 21 Penelitian lain melaporkan peningkatan ekspresi produsen spesies reaktif seperti inducible nitric oxide synthase (iNOS) pada lesi kulit psoriasis, 22 dan aktivasi mieloperoksidase dan NADPH oksidase (NOX) pada ACD. 23 Temuan ini menunjukkan keterlibatan stres oksidatif dalam patogenesis dan perkembangan beberapa penyakit kulit inflamasi. 9 , 24 Memang, stres oksidatif dan peradangan adalah proses patofisiologis yang terkait erat yang sering muncul secara bersamaan dalam banyak kondisi kulit patologis. Proses inflamasi secara konstan menghasilkan stres oksidatif karena spesies reaktif diproduksi oleh sel-sel yang terlibat dalam respons pertahanan inang, terutama sel-sel fagosit. Oksidan, pada gilirannya, meningkatkan peradangan jaringan baik secara langsung dengan menginduksi kerusakan pada biomolekul dalam sel atau jaringan kulit, atau dengan mengaktifkan beberapa jalur pro-inflamasi, seperti jalur pensinyalan NF-κB, mitogen-activated protein kinase (MAPK), dan janus kinase-signal transducer and activator of transcription protein (JAK-STAT) yang terkait dengan respons inflamasi. 25
Spesies reaktif harus segera didetoksifikasi untuk memastikan homeostasis redoks yang dinamis di dalam sel dan melindungi dari peradangan. Untuk mencegah kerusakan oksidan, kulit memiliki jaringan antioksidan yang luas, termasuk enzim antioksidan dan antioksidan non-enzimatik yang menghambat, menunda, atau sepenuhnya membersihkan aksi radikal bebas dan oksidan. 13 Sudah diketahui dengan baik bahwa respons antioksidan terutama diatur oleh faktor transkripsi peka redoks Nrf2, komponen utama yang mengatur kaskade sinyal peradangan dan respons stres oksidatif. 10 , 11
2.1 Jalur Keap1–Nrf2
Nrf2, yang dikodekan oleh gen NFE2L2 , termasuk dalam subfamili cap’n’collar (CNC) mamalia dari faktor transkripsi basic leucine ritsleting (bZIP). Nrf2 adalah pengatur utama ekspresi gen antioksidan dalam respons terhadap stres oksidatif. 26 Ia juga merupakan faktor transkripsi sitoprotektif dan dapat mendorong mekanisme detoksifikasi dan ekskresi xenobiotik organik dan logam beracun dengan mengatur ekspresi enzim fase II. 27 , 28 Nrf2 diatur secara negatif pada tingkat protein melalui interaksi langsung dengan protein asosiasi ECH dimerik kaya sisteina, mirip Kelch 1 (Keap1). 29 Residu sisteina dari Keap1 adalah sensor stres yang penting dan merupakan target untuk berbagai bahan kimia dan oksidan. Residu sistein yang sangat reaktif, Cys-151, terutama mendeteksi senyawa elektrofilik, termasuk aktivator kuat Nrf2 , seperti sulforafan (SFN) yang ditemukan dalam sayuran silangan dan dimetil fumarat (DMF).30 – 32 Diasumsikan bahwa sistein lain, termasuk tetapi tidak terbatas pada Cys-273 dan Cys-288, juga berperan dalam kemampuan Keap1 untuk mendeteksi dan merespons stres.33
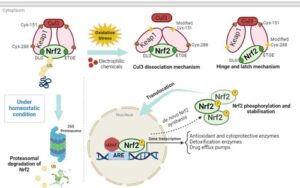
Bahasa Indonesia: Dalam kondisi basal normal, Nrf2 terutama berada di sitoplasma, di mana ia membentuk kompleks dengan Keap1. Asosiasi ini terus-menerus mengarah pada poliubikuitinasi Nrf2 melalui ligase ubikuitin Cullin 3 (Cul3)-E3 dan mengarahkannya ke degradasi oleh proteasom 34 (Gambar 1 ). Dengan demikian, Nrf2 adalah protein yang tidak stabil dengan waktu paruh pendek sekitar 10–30 menit dan pergantian yang tinggi, memungkinkan pemeliharaan kadar basal Nrf2 yang rendah dalam kondisi normal dan menyediakan kumpulan protein yang baru diterjemahkan yang tersedia dengan mudah yang dapat dengan cepat distabilkan sebagai respons terhadap stres. 35 Setelah terpapar bahan kimia elektrofilik atau spesies reaktif, modifikasi terjadi pada tiol sisteina dari Keap1, mengganggu kompleks Keap1–Nrf2, sehingga menstabilkan Nrf2 36 , 37 (Gambar 1 ). Sementara modifikasi Cys151 dianggap mengganggu interaksi Keap1–Cul3, sistein lain juga memainkan peran penting dalam regulasi Nrf2. Secara khusus, modifikasi sistein, seperti Cys-288 dalam Daerah Intervensi (IVR) Keap1, mengganggu interaksi Keap1–Nrf2 melalui mekanisme “engsel dan kait”. 35 Modifikasi sistein dianggap menginduksi perubahan konformasi dalam Keap1, menghambat kemampuannya untuk secara efisien menargetkan Nrf2 untuk ubikuitinasi dan degradasi, dengan demikian meningkatkan akumulasi Nrf2 (Gambar 1 ). Akumulasi Nrf2 neo-sintesis selanjutnya difasilitasi oleh fosforilasinya melalui berbagai kinase, termasuk PKC, CK2, PERK, CDK5, dan MAPK. Fosforilasi ini dapat meningkatkan stabilitas Nrf2 dan bergantung pada konteks, terjadi di bawah stimulasi tertentu dan/atau dalam jaringan tertentu. 38 Nrf2 yang terfosforilasi selanjutnya bermigrasi ke inti sel, di mana Nrf2 membentuk kompleks dengan salah satu protein Maf kecil (sMaf) yang penting untuk mengaktifkan transkripsi gen target Nrf2. 39 , 40 Kompleks Nrf2/sMaf mengaktifkan ekspresi sekitar 200 gen dengan mengikat motif pengikat DNA spesifik yang dikenal sebagai elemen respons antioksidan (ARE) 27 , 34 (Gambar 1 ).
2.2 Target hilir diatur oleh Nrf2 di kulit
Meskipun awalnya dikaitkan dengan stres oksidatif, kini secara luas diakui bahwa Nrf2 merespons berbagai stresor dan berpartisipasi dalam berbagai proses biologis. 26 Ekspresi gen target Nrf2 sangat bergantung pada kadar protein Nrf2 dalam sel kulit. Bergantung pada sifat dan intensitas rangsangan, Nrf2 dapat mengatur transkripsi sejumlah gen target dengan cara yang bergantung pada dosis. Target Nrf2 yang diekspresikan dalam kondisi normal terlibat dalam fisiologi dan biogenesis mitokondria, proteostasis, dan pemrograman ulang metabolik karena mereka mengatur metabolisme zat besi dan heme. Sebaliknya, target Nrf2 yang diinduksi stres lebih terlibat dalam pertahanan antioksidan, detoksifikasi xenobiotik, regulasi peradangan dan kekebalan, perbaikan DNA, dan pencegahan apoptosis. 26 , 41
Untuk melawan efek merugikan dari spesies reaktif dalam menanggapi stres seluler, sel-sel kulit mengaktifkan mekanisme pertahanan antioksidan mereka, terutama dikoordinasikan oleh aktivitas Nrf2 melalui ARE. Nrf2 menginduksi jalur antioksidan dengan mengatur ekspresi gen dari spektrum luas enzim antioksidan (Tabel 1 ) yang terutama terlibat dalam netralisasi ROS, seperti superoksida dismutase (SOD) dan katalase, dan dalam sintesis dan regenerasi glutathione (GSH). 26 , 34 Selain itu, mekanisme pertahanan yang dimediasi Nrf2 juga melibatkan penghapusan xenobiotik yang berpotensi berbahaya melalui aktivasi enzim metabolisme obat seperti NAD(P)H quinone oksidoreduktase 1 (NQO1) dan transporter efluks obat. 42 – 44 Proses ini membantu menghilangkan molekul yang dapat menghasilkan ROS melalui siklus redoks atau menguras antioksidan endogen dengan menghilangkan elektrofil. 45 Secara keseluruhan, ekspresi gen terkoordinasi yang dimediasi oleh Nrf2 membentuk jaringan enzim yang terlibat dalam detoksifikasi xenobiotik dan eliminasi pro-oksidan, yang membantu menjaga homeostasis kulit, seperti yang dijelaskan secara rinci dalam Tabel 1. Beberapa penelitian telah mengaitkan kekurangan enzim antioksidan atau perubahan fungsi enzim dengan kondisi peradangan kulit, yang menunjukkan peran penting stres oksidatif dalam penuaan kulit dan patogenesis penyakit kulit inflamasi kronis (Tabel 1 ). Disregulasi keseimbangan oksidoredukatif ini dapat meningkatkan dan memperburuk peradangan, yang berkontribusi pada kondisi seperti dermatitis kontak, psoriasis, dan bahkan kanker kulit. 9 , 24 , 46
| Fungsi antioksidan | Enzim target Nrf2 (singkatan enzim) | Fungsi utama enzim | Implikasi pada penyakit atau kondisi kulit inflamasi |
|---|---|---|---|
| Netralisasi ROS | Superoksida dismutase (SOD) | Metalloenzim yang mengubah O 2 •− menjadi air dan H 2 O 2 | Lesi ulkus kulit (luka bakar, luka) 49 , 50
Dermatitis kontak alergi terhadap para-fenilendiamin 51 Jerawat vulgaris 53 Kanker kulit 54 |
| Katalase (CAT) | Mengubah H 2 O 2 menjadi air dan oksigen | Penuaan kulit 57
Dermatitis atopik 21 Psoriasis vulgaris 58 |
|
| Glutation peroksidase (GPx) | Mengurangi H 2 O 2 dan lipid hidroperoksida menggunakan glutathione sebagai kofaktor | Dermatitis kontak alergi terhadap nikel 60
Psoriasis vulgaris 58 Penyembuhan luka 50 |
|
| Peroksiredoksin (PRDX) | Mengurangi peroksida secara langsung | Psoriasis 62 – 64 | |
| Tioredoksin 1 (Trx1) | Mengurangi tiol protein teroksidasi dan memecah ikatan disulfida | Dermatitis kontak alergi 65
Dermatitis kontak iritan 66 Penyakit Psoriasis 67 Dermatitis akibat sinar UVB 68 |
|
| Detoksifikasi elektrofil | NAD(P)H kuinon oksidoreduktase 1 (NQO1) | Mengurangi kuinon dan membersihkan O 2 •− | Dermatitis kontak iritan 69 |
| Glutathione S-transferase (GST) | Meningkatkan serangan nukleofilik oleh glutathione pada molekul elektrofilik | Dermatitis atopik 70 – 72
Penyakit Psoriasis 73 |
|
| Produksi glutathione dan daur ulang antioksidan | Subunit katalitik glutamat-sistein ligase (GCLC) dan modulator (GCLM) | Mengkatalisis langkah pertama dan pembatas laju biosintesis glutathione | Penyakit Psoriasis 74 |
| Glutathione sintetase | Mengkatalisis langkah terakhir dalam biosintesis glutathione | Tidak tersedia | |
| Glutation reduktase (GSR) | Mengkatalisis reduksi glutathione teroksidasi (GSSG) kembali ke bentuk tereduksi (GSH) menggunakan NADPH sebagai kofaktor | Tidak tersedia | |
| Tioredoksin reduktase 1 (TXNRD1) | Enzim kunci yang bertanggung jawab untuk mengurangi dan meregenerasi Trx1 teroksidasi menggunakan NADPH | Dermatitis kontak alergi terhadap 1-kloro-2,4-dinitrobenzena 75 | |
| Regenerasi NADPH | Glukosa 6-fosfat dehidrogenase (G6pd), 6-fosfoglukonat dehidrogenase (Pgd), isositrat dehidrogenase 1 (IDH1), dan enzim malat (Me1) | Mempromosikan produksi NADPH melalui jalur pentosa fosfat, NADPH menjadi kofaktor untuk sistem GSR dan tioredoksin | Tidak tersedia |
| Metabolisme heme | Heme oksigenase-1 (HO-1) | Mengkatalisis degradasi heme menjadi karbon monoksida | Dermatitis atopik 76
Penyakit Psoriasis 77 |
3 FUNGSI NRF2 DI KULIT
3.1 Peran Nrf2 dalam diferensiasi epidermis
Menurut protein Atlas manusia, Nrf2 diekspresikan di mana-mana di semua sel kulit. 78 Menariknya, Nrf2 juga berperan dalam mendorong diferensiasi KC. Peningkatan akumulasi Nrf2 selama diferensiasi yang diinduksi kalsium telah diamati, dan percobaan dengan Nrf2 yang diekspresikan secara berlebihan pada KC manusia normal telah menunjukkan peningkatan ekspresi penanda diferensiasi, seperti loricrin dan keratin-10, bahkan tanpa adanya kalsium. 79 Gradien Nrf2 bertepatan dengan apoptosis KC yang merupakan karakteristik lapisan atas epidermis, khususnya sebagai respons terhadap radiasi ultraviolet (UV) dan faktor lingkungan lainnya. Tingkat ekspresi Nrf2 yang lebih tinggi dan enzim antioksidan di lapisan atas kulit memperkuat kapasitas antioksidan dan detoksifikasi epidermis, khususnya karena lapisan superfisial lebih rentan terhadap faktor eksternal yang berbahaya. 80
3.2 Peran Nrf2 dalam fungsi penghalang
Nrf2 berperan langsung dalam fungsi barier epidermis, yang memengaruhi stabilitas desmosom, kerapuhan korneosit, dan proliferasi KC. Hiperkeratosis pada esofagus dan lambung depan tikus yang kekurangan Keap1 merupakan penyebab malnutrisi yang mengakibatkan kematian mereka. Data biokimia menunjukkan bahwa tanpa adanya Keap1, Nrf2 terakumulasi secara konstitutif di dalam nukleus untuk merangsang transkripsi gen sitoprotektif. Perkawinan dengan tikus yang kekurangan Nrf2 membalikkan defisiensi fenotipik pada Keap1. 81
Telah ditunjukkan pula bahwa tikus transgenik dengan Nrf2 yang aktif secara konstitutif menunjukkan fenotipe yang dicirikan oleh hiperkeratosis, penebalan epidermis, dan peradangan yang menyerupai iktiosis lamelar. Fenotipe ini dikaitkan dengan peningkatan regulasi penanda diferensiasi, termasuk loricrin, involucrin, dan keratin 10, bersama dengan deskuamasi korneosit yang terganggu, yang menyebabkan hiperkeratosis. 82 Nrf2 dapat meningkatkan fungsi penghalang kulit dengan mengaktifkan gen-gen tertentu dalam jaringan epitel sebagai respons terhadap stres. Misalnya, Hebner dkk. menunjukkan bahwa tidak adanya Loricrin menyebabkan keterlambatan dalam pembentukan penghalang epidermis dalam rahim pada tikus. Namun, keterlambatan ini diatasi dengan aktivasi Nrf2. Selain itu, anggota keluarga gen protein kaya prolin kecil 2 (Sprr2), khususnya sprr2d dan sprr2h, telah diidentifikasi sebagai target hilir langsung Nrf2 melalui urutan ARE. 83 Investigasi lebih lanjut mengidentifikasi anggota keluarga selubung kornifikasi akhir 1 (Lce1) sebagai gen target Nrf2 yang berfungsi dalam mekanisme kompensasi untuk melawan hilangnya loricrin. 84
Selain itu, kadar tinggi Nrf2 yang mengalami hipofosforilasi ditemukan pada jaringan lesi pasien dengan pachyonychia congenita, penyakit kulit langka yang ditandai dengan keratoderma palmoplantar dan disebabkan oleh mutasi gen keratin 16. Nrf2 yang tidak berfungsi ini berkorelasi dengan sintesis GSH yang tidak memadai pada KC. Sebaliknya, aplikasi topikal SFN, aktivator farmakologis Nrf2, mencegah lesi klinis dan menormalkan keseimbangan redoks pada tikus knockout keratin 16 , yang menunjukkan peran potensial Nrf2 dalam diferensiasi epidermis dan integritas kulit. 85 Dengan cara yang sama, penelitian sebelumnya telah menunjukkan bahwa SFN dapat memprogram ulang ekspresi keratin 16 dan 17, yang mengarah pada pemulihan integritas epidermis pada tikus yang dimodifikasi secara genetik dengan epidermolisis bulosa simpleks. 86 Memang, Nrf2 dapat mengatur ekspresi keratin 6, 16, dan 17, yang terkait dengan hiperproliferasi KC. 87 Nrf2 juga meningkatkan ekspresi mi-RNA 29 yang menargetkan desmocollin-2, komponen desmosomal utama. 88
Pemahaman lebih lanjut mengenai peran Nrf2 dalam barier kulit diperoleh dari penelitian tikus dengan delesi gen loricrin . Loricrin, komponen penting dari selubung sel yang mengalami kornifikasi, sangat penting dalam mempertahankan fungsi barier kulit. Pada tikus yang kekurangan loricrin, aktivasi Nrf2 terjadi di epidermis, yang menyebabkan ekspresi gen Lce1 yang berlebihan. Gen-gen ini mengode protein kaya glisin/serin yang strukturnya mirip dengan loricrin, yang berpotensi mengompensasi defisiensi loricrin. 84 Temuan terbaru telah mengonfirmasi tindakan terkoordinasi dari Nrf2 dan loricrin dalam memastikan kornifikasi barier kulit. Dengan tidak adanya loricrin, kekurangan protein kaya sulfur (thiol) di epidermis mengganggu keseimbangan redoks lokal, yang selanjutnya memobilisasi jalur Nrf2 untuk menghasilkan granula lamelar. 89 Aktivasi genetik Nrf2 di KC model murine sindrom Netherton juga memperbaiki cacat penghalang kulit dengan mengurangi ekspresi sitokin pro-inflamasi dan meningkatkan penghambat peptidase leukosit sekretori (SLPI), yang pada gilirannya menghambat kallikrein 7 dan elastase 2 dan meningkatkan perlekatan stratum korneum dengan menstabilkan desmosom. 90 Bukti ini menggarisbawahi peran Nrf2 dalam memperkuat keratinisasi dan meningkatkan kohesi penghalang epidermis.
Jalur pensinyalan reseptor hidrokarbon aril (AhR) memainkan peran penting dalam memutus lingkaran setan peradangan kronis dengan meningkatkan fungsi sawar kulit pada dermatitis atopik, dan ini terkait dengan jalur Nrf2. Pada tingkat molekuler, Nrf2 berinteraksi dengan AhR, faktor transkripsi yang diaktifkan oleh ligan kimia tertentu seperti dioksin dan hidrokarbon aromatik polisiklik. AhR mengatur ekspresi enzim metabolisme fase I (misalnya, sitokrom P450 (CYP)) dan protein yang terlibat dalam diferensiasi epidermis (misalnya, filaggrin, loricrin, involucrin). 91 Interaksi antara Nrf2 dan AhR memengaruhi fungsi sawar, terutama dalam kondisi stres atau pada penyakit kulit yang ditandai dengan gangguan sawar kulit, seperti AD atau psoriasis. Hingga saat ini, bahan aktif seperti tapinarof (pengobatan psoriasis topikal yang disetujui FDA), tar batubara, dan gliter (tar kedelai) dilaporkan memberikan aktivitas manfaat ganda ini dengan menginduksi jalur AhR–Nrf2. 92 – 95
3.3 Peran Nrf2 dalam penuaan (foto) kulit dan fotoproteksi
Aktivasi jalur Nrf2 telah ditemukan untuk melindungi terhadap efek akut radiasi UVB dan UVA. 78 Tikus yang dimodifikasi secara genetik dengan peningkatan ekspresi Nrf2 menunjukkan resistensi terhadap eritema yang disebabkan oleh UV dan perkembangan lesi prakanker dan karsinoma sel skuamosa. Sementara itu, defisiensi Nrf2 memperburuk efek negatif radiasi UV pada kulit. 96 , 97 Aktivator Nrf2, seperti SFN atau bixin, juga telah menunjukkan efek perlindungan terhadap eritema dan pigmentasi yang disebabkan oleh UV dalam studi klinis dengan manusia. 98 – 100
Fotopenuaan yang diinduksi UV, yang dicirikan oleh kerusakan kulit dan produksi berlebih dari metaloproteinase matriks (MMP), dikaitkan dengan stres oksidatif. 101 Jalur Nrf2 menawarkan keuntungan dalam konteks ini dengan menetralkan ROS, mengurangi “peradangan,” 101 dan meringankan fibrosis dan produksi metaloproteinase. 102 , 103 Efek fotopenuaan yang lebih nyata, termasuk kerutan, yang diinduksi oleh UVB pada tikus yang kekurangan Nrf2 juga telah dilaporkan. 104 Analisis molekuler telah memberikan wawasan tentang mekanisme yang digunakan Nrf2 untuk memberikan fotoproteksi, termasuk modulasi produksi enzim antioksidan, netralisasi aldehida toksik, perbaikan lesi DNA oksidatif, dan penghambatan sitokin pro-inflamasi. 78 Mempertimbangkan temuan ini, aktivator Nrf2 adalah molekul yang menjanjikan untuk produk matahari dan setelah matahari. 99 , 105 Bukti dari model kulit 3D menunjukkan bahwa perlindungan terhadap kerusakan yang dimediasi UV dengan menggunakan sel prekursor yang berasal dari kulit terutama dimediasi oleh aktivasi jalur Nrf2/heme oxygenase-1 (HO-1) melalui fosfatidilinositol 3-kinase/protein kinase B (PI3K/AKT). 106 Menariknya, Nrf2 juga berperan dalam penuaan kulit kronologis, seperti yang diamati pada model hewan untuk umur panjang. 107 , 108
Lebih jauh lagi, aktivasi Nrf2 dapat menurunkan risiko inisiasi dan promosi tumor dengan mengurangi lesi DNA mutagenik dan meredam peradangan yang disebabkan oleh sinar UV. Akan tetapi, kehati-hatian diperlukan saat memodulasi Nrf2 dalam pengobatan kanker, karena sel kanker sering kali bergantung pada Nrf2 untuk bertahan hidup dan resistensi terhadap apoptosis. Hiperaktivasi Nrf2 dalam sel kanker telah dikaitkan dengan proliferasi agresif, 109 metastasis, 110 dan resistensi terhadap kemoterapi. 111
4 NRF2 SEBAGAI PENGATUR UTAMA PERADANGAN KULIT
Bahasa Indonesia: Selain fungsi utama Nrf2 sebagai pengatur utama detoksifikasi xenobiotik dan homeostasis redoks di dalam sel, investigasi terkini mengungkapkan bahwa Nrf2 juga memainkan peran penting dalam pengendalian respons inflamasi. 10 , 112 , 113 Peradangan persisten adalah karakteristik umum dari semua patofenotipe yang diamati dalam “diseasome” Nrf2. 114 Secara khusus, Nrf2 adalah pengatur respons imun inflamasi kulit, karena beberapa studi eksperimental secara konsisten menunjukkan bahwa defisiensi Nrf2 terkait dengan peningkatan peradangan. 115 – 117 Data lain juga mendukung peran Nrf2 dalam memodulasi respons imun. 115 Penghambatan Nrf2 pada tikus mengubah fenotipe sel dendritik yang berasal dari sumsum tulang. Faktanya, sel dendritik yang kekurangan Nrf2 memiliki kadar GSH yang terganggu, aktivitas fagositosis yang berkurang, peningkatan ekspresi kompleks histokompatibilitas mayor (MHC) kelas II, dan ekspresi reseptor ko-stimulasi CD86 dan CD80, sehingga meningkatkan kapasitas stimulasi sel T. 118 Lebih jauh lagi, gangguan Nrf2 telah dikaitkan dengan penyakit kulit inflamasi kronis, seperti psoriasis dan AD. 119
Penyembuhan luka merupakan proses kompleks yang melibatkan KC dan Nrf2, khususnya dalam mengelola peradangan dan memulihkan homeostasis. Aktivator Nrf2 telah dilaporkan sebagai pendekatan terapeutik yang efektif untuk meningkatkan penyembuhan luka. 120 KC mengatur fase peradangan awal melalui jaringan kaskade sinyal peradangan yang terkoordinasi secara ketat, 121 sementara Nrf2 meredakan peradangan dan mengurangi kadar ROS setelah regenerasi jaringan. 122 Namun, ekspresi faktor-faktor utama yang terlibat dalam penyembuhan luka secara signifikan lebih rendah pada tahap awal luka pada hewan yang tidak memiliki Nrf2, yang menyebabkan peradangan yang berkepanjangan pada fase penyembuhan selanjutnya. Menariknya, perubahan dalam ekspresi gen ini tidak menghasilkan kelainan histologis yang dapat diamati. Tingkat penyembuhan normal ini sebagian disebabkan oleh peningkatan ekspresi Nrf3, faktor transkripsi yang merupakan target faktor pertumbuhan keratinosit (KGF) dan diekspresikan bersama dengan Nrf2 dalam penyembuhan luka kulit. 123 Selain itu, tioredoksin bekerja secara independen dari glutathione untuk melindungi KC dari kerusakan oksidatif. Ini mengimbangi kekurangan glutathione, memungkinkan KC bertahan hidup dan dengan demikian menjaga integritas kulit dan meningkatkan proses penyembuhan. 124
Meskipun defisiensi Nrf2 memperpanjang peradangan, hal itu tidak secara serius mengganggu durasi atau kualitas penyembuhan pada luka non-diabetes. Namun, pada hewan diabetes, ekspresi Nrf2 yang berkurang menyebabkan peningkatan stres oksidatif dan apoptosis di area perilesional kulit, yang menghambat penyembuhan luka. 125 , 126 Induktor Nrf2 yang poten seperti SFN, asam sinamat, DMF, dan triterpenoid RTA-408 menawarkan terapi yang menjanjikan untuk mempercepat penyembuhan luka diabetes dengan menangkal efek negatif ini. 127 Pensinyalan Nrf2 juga telah terbukti menjadi peristiwa kunci dalam penyembuhan luka yang diinduksi plasma fisik, yang mendorong granulasi dan re-epitelialisasi melalui respons antioksidan dan inflamasi yang seimbang. 128 Lebih jauh, Nrf2 disarankan untuk merangsang produksi kemokin CCL2 oleh sel induk epitel, yang memobilisasi makrofag, dan khususnya sekresi faktor pertumbuhan epidermal (EGF), yang mendorong proliferasi keratinosit dan akhirnya meningkatkan regenerasi epidermis. 129
Mekanisme tidak langsung untuk menangkal peradangan melibatkan modulasi ROS dan RNS oleh Nrf2. Peran Nrf2 dalam mengurangi peradangan juga perlu dipertimbangkan dengan memodulasi jalur peradangan utama yang sensitif terhadap redoks, termasuk inflammasome yang mengandung domain pirin 3 (NLRP3) dan NF-κB, 130 dan merangsang ekspresi HO-1, yang memiliki sifat anti-inflamasi dan imunomodulatori yang kuat. 10
5 IMPLIKASI NRF2 PADA PENYAKIT RADANG KULIT
5.1 Nrf2 pada dermatitis kontak alergi
ACD merupakan reaksi hipersensitivitas tipe lambat yang berkembang dalam dua fase setelah kulit terpapar alergen. Fase sensitisasi awal, yang asimtomatik, terjadi pada kontak pertama kulit dengan alergen dan bergantung pada dosis. Paparan ulang berikutnya terhadap alergen yang sama mengawali fase elisitasi, yang ditandai dengan manifestasi klinis yang muncul 24–96 jam setelah kontak. 131 – 133 Reaksi ini dimediasi oleh sel T CD8 + sitotoksik dan sel efektor CD4 + Th17 dan Th22 spesifik alergen . 134 , 135
Studi yang menggunakan model tikus hipersensitivitas kontak menunjukkan bahwa Nrf2 mengatur fase sensitisasi dan fase elisitasi ACD. Paparan terhadap zat kimia sensitizer 2,4-dinitrochlorobenzene (DNCB) menyebabkan respons inflamasi yang lebih parah pada tikus yang kekurangan Nrf2 dibandingkan dengan tikus tipe liar, yang menyoroti peran protektif Nrf2 dalam ACD. 136 Nrf2 memainkan peran penting dalam imunitas kulit bawaan yang disebabkan oleh bahan kimia, khususnya selama fase sensitisasi, dengan memodulasi perekrutan dan akumulasi neutrofil. 137 Memang, Nrf2 mengatur produksi kemokin, seperti CCL-2, CCL-4, dan CCL-11, dan meningkatkan fagositosis makrofag, terutama melalui peningkatan ekspresi reseptor pemulung CD36, suatu proses yang independen dari fungsi antioksidan Nrf2. Peningkatan fagositosis makrofag mendorong pembersihan neutrofil yang efisien, dan penyelesaian inflamasi. 137 Lebih lanjut mendukung peran anti-inflamasi Nrf2, penelitian lain menunjukkan bahwa Nrf2 mengendalikan produksi sitokin pro-inflamasi pada sel kanker manusia yang terpapar cinnamaldehyde, suatu zat pemicu sensitisasi kulit yang terkenal. 138
5.2 Nrf2 pada dermatitis atopik
AD adalah penyakit kulit inflamasi kronis yang digerakkan oleh Th2 yang memengaruhi sebagian besar populasi. 139 , 140 Ditandai dengan lesi eksim yang berulang dan gatal, AD biasanya mudah didiagnosis secara klinis. 141 Penyakit ini multifaktorial, yang melibatkan predisposisi genetik, gangguan integritas sawar kulit, paparan lingkungan, dan gangguan mikrobioma. 142 Cacat pada gen filaggrin FLG dan FLG2, serta pada loricrin dan involucrin, adalah mutasi gen paling umum yang dikaitkan dengan AD, yang mengakibatkan perubahan amplop dan masalah pelembapan. 143 , 144 Gen cacat yang melibatkan protein kecil kaya prolin 3 (SPRR3), tight junction (CLDN1), dan inhibitor protease (SPINK5) juga telah dicatat pada AD. 142 Mutasi gen ini menyebabkan terganggunya penghalang kulit, sehingga memungkinkan masuknya alergen lingkungan alami (misalnya, tungau debu rumah, serbuk sari) dan polutan, yang dilaporkan memicu eksaserbasi AD. 145
Beberapa studi penelitian menyoroti peran Nrf2 dalam patogenesis dan pengobatan AD. Defisiensi loricrin pada tikus memicu aktivasi Nrf2, yang menyebabkan ekspresi berlebihan gen late cornified envelope 1 (Lce1), yang mengkode protein mirip loricrin, yang kemungkinan mengompensasi hilangnya loricrin dan memulihkan keseimbangan redoks yang terganggu oleh kurangnya komponen loricrin yang kaya sulfur. Data ini mengonfirmasi peran terkoordinasi Nrf2 dan loricrin dalam integritas sawar kulit. 146
Nrf2 telah terbukti memperbaiki manifestasi kulit seperti AD dan eksaserbasi imunitas tipe 2 melalui efek antioksidan dan anti-inflamasinya. 119 , 147 Sebuah studi proteomik kuantitatif baru-baru ini mengidentifikasi aktivitas Nrf2 yang berkurang dan disfungsi mitokondria pada kulit AD lesional dan non-lesional, bersama dengan profil protein yang mencerminkan peradangan dan gangguan diferensiasi KC dan stratifikasi epidermis. 148 Faktanya, kulit AD mengalami stres oksidatif, yang mengakibatkan respons imunitas tipe 2 yang terkait dengan perbaikan 149 dan gangguan aktivitas Nrf2 karena kerusakan fisik pada epidermis. 148 Yang pertama mencerminkan upaya kulit untuk pulih dari trauma ringan, sedangkan yang terakhir dikaitkan dengan gangguan respons jaringan dan kematian sel KC dalam reaksi eksim. Data ini mendukung penggunaan penginduksi Nrf2, seperti bixin (apocarotenoid) dalam pengobatan AD. 99 , 119 Senyawa alami bioaktif juga telah menunjukkan kemanjuran dalam mengurangi gejala AD. Misalnya, ekstrak Veronica persica (EEVP) memperbaiki gejala pada model tikus mirip AD yang diinduksi DNCB dengan mengurangi kadar sitokin inflamasi seperti IFN-γ, IL-4, IL-5, dan IL-13. Juga telah ditunjukkan bahwa EEVP memiliki afinitas tinggi untuk mengikat Keap1, yang mengarah pada aktivasi Nrf2, yang pada gilirannya menginduksi ekspresi NQO1 dan HO-1. 150 Demikian pula, asam ursolat, senyawa triterpenoid yang ditemukan pada tanaman, meringankan gejala AD yang diinduksi DNCB pada tikus, mengurangi skor dermatitis dan ketebalan telinga, dan menghambat proliferasi kulit dan infiltrasi sel mast. Asam ursolat ditemukan menghambat jalur reseptor Toll-like 4/NF-κB sementara secara bersamaan mengaktifkan jalur Nrf2/HO-1. 151 Fototerapi, termasuk fotobiomodulasi (PBM) telah menunjukkan kemampuan untuk memodulasi respons imun dan mengurangi penanda stres oksidatif. 152 , 153 PBM, menggunakan tingkat rendah cahaya merah tampak (660 nm) atau radiasi inframerah dekat (520 nm), secara efektif menurunkan ekspresi mRNA TNF-α, IL-6, dan IL-8 sambil meningkatkan aktivasi jalur Nrf2 pada KC manusia yang terstimulasi DNCB. 154 Studi ini menyoroti mekanisme antiinflamasi PBM yang bergantung pada Nrf2, yang menunjukkan potensinya sebagai pengobatan AD komplementer.
Namun, peran Nrf2 dalam AD sangatlah kompleks. Dalam model tikus yang meniru gejala AD, aktivasi Nrf2 farmakologis jangka pendek memberikan perlindungan ringan, tetapi aktivasi genetik Nrf2 yang berkepanjangan dalam sel KC tikus memperburuk peradangan kulit, menyebabkan hiperkeratosis, penebalan epidermis, peningkatan apoptosis sel KC, kerusakan DNA, dan perubahan komposisi sel imun, yang menyoroti perlunya aktivasi Nrf2 yang dikontrol secara cermat dalam pengobatan AD. 155
5.3 Nrf2 pada psoriasis
Psoriasis adalah penyakit kulit kronis yang memengaruhi sekitar 120 juta orang di seluruh dunia, dengan prevalensi pada orang dewasa berkisar antara 0,2% hingga 2,3%, tergantung pada wilayahnya. 156 Meskipun tergolong sebagai penyakit auto-inflamasi dan autoimun, mekanisme pasti perkembangannya masih belum jelas. 157 Secara umum diterima bahwa faktor lingkungan dan internal, seperti stres dan infeksi Streptococcus , 158 serta cedera fisik 159 dan obat-obatan tertentu seperti beta-blocker atau litium 160 , 161 dapat memicu atau memperburuk proses imun psoriasis pada individu yang rentan secara genetik, terutama mereka yang membawa antigen leukosit manusia (HLA) kelas 1, alel HLA-C*06:02. 162
Patogenesis psoriasis melibatkan dua gangguan kulit utama. Di satu sisi, psoriasis terutama didorong oleh disregulasi penghalang imun kulit dengan infiltrasi sel imun yang padat ke dalam kulit. Telah ditetapkan dengan baik bahwa KC bertanggung jawab atas kejadian patogenik imun dini psoriasis dengan memproduksi autoantigen seperti LL-37 dan keratin 17, yang memicu peradangan kulit. 8 , 163 KC juga mempotensiasi peradangan sebagai respons terhadap rangsangan atau kerusakan dengan mengaktifkan imunitas bawaan dan adaptif. Telah ditunjukkan bahwa KC dapat menginduksi diferensiasi sel T menjadi sel Th1 dan Th17 melalui kontak sel-ke-sel langsung tanpa adanya sel penyaji antigen. 164 Lebih jauh lagi, KC memperkuat peradangan melalui aktivasi PRR dan produksi peptida antimikroba dan sitokin serta kemokin pro-inflamasi, seperti famili IL-1, TNF-α, IL-6, IL-8, CXCL1, CXCL10, dan CCL20. 165 Sel imun bawaan juga berkontribusi terhadap peradangan psoriasis dengan memproduksi sitokin seperti TNF-α, IL-17, IL-22, dan IL-23 yang memicu proliferasi KC, mempertahankan lingkungan pro-inflamasi, dan menyebabkan aktivasi sel T berikutnya. Di sisi lain, patogenesis psoriasis juga melibatkan disfungsi barier fisik yang timbul dari hiperproliferasi KC (hiperkeratosis dan akantosis), diferensiasi KC yang tidak lengkap dalam stratum korneum , dan gangguan sambungan antar sel dan matriks kaya lipid. 166
Peran Nrf2 dalam psoriasis masih kontroversial. Beberapa penelitian menunjukkan bahwa aktivasi Nrf2 mendorong hiperproliferasi KC yang awalnya diamati pada sel HaCaT dan kemudian dikonfirmasi dalam model tikus. Faktanya, sel HaCat yang distimulasi oleh sitokin proinflamasi, IL-17 dan IL-22, menunjukkan peningkatan akumulasi Nrf2 dan induksi ekspresi keratin berikutnya seperti keratin 6, 16, dan 17, yang berkontribusi terhadap hiperkeratinisasi yang dapat diamati pada psoriasis. Sedangkan pada model tikus mirip psoriasis yang diinduksi IMQ, peneliti menemukan bahwa menghambat Nrf2 menggunakan siRNA (small interfering RNA) menghapuskan ekspresi keratin 6, 16, dan 17, sehingga memperbaiki lesi hiperplasia epidermis. 87 , 167
Sebaliknya, bukti lain menunjukkan peran protektif Nrf2 pada psoriasis. Aplikasi aktivator Nrf2, DMF, melemahkan lesi psoriasis dan memulihkan diferensiasi epidermis pada tikus Nrf2 +/+ , efek yang tidak ada pada tikus yang kekurangan Nrf2. 168 Mekanisme DMF kemungkinan melibatkan peningkatan regulasi GSH dan NQO1, dan modifikasi residu sistein Keap1 untuk mengaktifkan Nrf2. 157 , 169 Senyawa alami bioaktif lainnya juga telah menunjukkan hasil yang menjanjikan dalam meredakan psoriasis. SFN diketahui memiliki sifat antiinflamasi, antibakteri, dan antioksidan. 170 Sebuah penelitian menunjukkan potensi terapeutik SFN dalam model praklinis penyakit inflamasi dan autoimun, termasuk tikus mirip psoriasis yang diinduksi IMQ dan tikus MRL/Lpr mirip lupus. Efek yang diamati, seperti mengurangi sel-sel inflamasi dan yang berhubungan dengan autoimun dan mengurangi stres oksidatif, menunjukkan kemungkinan mekanisme yang melibatkan aktivasi Nrf2, mengingat peran SFN yang diketahui sebagai penginduksi Nrf2 yang poten. 63 Ma et al. telah menunjukkan defisiensi Nrf2 pada model tikus psoriasis yang diinduksi IMQ. Namun, SFN tampaknya memulihkan ekspresi Nrf2 sambil mengurangi ekspresi keratin (K6/K16/K17), sehingga meringankan fenotipe psoriasis. 171 Selain itu, galangin, ekstrak flavonoid aktif dari Propolis, Alpinia officinarum dan Alpina galanga , tampaknya memiliki potensi terapeutik pada psoriasis dengan sifat anti-inflamasi dan antioksidan. 172 Telah ditunjukkan bahwa galangin meningkatkan jalur Nrf2 dan melemahkan kerusakan oksidatif dan inflamasi pada sel-sel hati tikus dengan meningkatkan ekspresi enzim antioksidan NQO1 dan HO-1. 173 Molekul 3H-1,2-dithiole-3-thione (D3T) juga telah menunjukkan dampak yang efektif dalam mengurangi penebalan dan pengelupasan pada tikus psoriasis yang diinduksi IMQ. 174
5.4 Nrf2 pada klorakne
Klorakne, kondisi kulit parah yang ditandai dengan erupsi dan kista mirip jerawat, sering dikaitkan dengan paparan hidrokarbon aromatik terhalogenasi seperti dioksin. Menariknya, sementara aktivasi Nrf2 umumnya dianggap bermanfaat bagi kulit karena efek antioksidan dan anti-inflamasinya, aktivasi Nrf2 yang berlebihan atau berkepanjangan secara paradoks dapat berkontribusi pada patologi kulit yang menyerupai klorakne. Penelitian telah menunjukkan bahwa aktivasi Nrf2 genetik dan farmakologis pada KC murine menginduksi akantosis dan hiperkeratosis yang nyata, yang menyerupai iktiosis lamelar. 82 Hal ini didorong oleh ekspresi berlebihan yang dimediasi Nrf2 dari inhibitor peptidase leukosit sekretori (Slpi) dan protein kaya prolin kecil 2d (Sprr2d). Meskipun protein-protein ini biasanya dikaitkan dengan fungsi anti-inflamasi Nrf2, peningkatan regulasinya juga menyebabkan ketidakstabilan selubung korneifikasi dan mengganggu deskuamasi korneosit. Lebih jauh lagi, aktivasi Nrf2 yang berkelanjutan di kulit dapat menyebabkan hipertrofi kelenjar sebasea, seborea, dan hiperkeratosis folikel, yang pada akhirnya mengakibatkan infundibula yang melebar, rambut rontok, dan pembentukan kista—fenotipe yang mirip dengan yang diamati pada klorakne. 175 Hal ini disebabkan oleh peningkatan ekspresi gen target Nrf2, khususnya epigen (faktor pertumbuhan), Slpi, dan Sprr2d. Protein-protein ini juga diregulasi oleh dioksin dalam KC manusia dengan cara yang bergantung pada Nrf2, yang selanjutnya melibatkan Nrf2 dalam patogenesis klorakne. Patogenesis klorakne yang diinduksi dioksin melibatkan aktivasi sistem AhR-sitokrom P450 1A1 (CYP1A1), pembentukan stres oksidatif, dan hiperkeratinisasi KC dan sebosit. 176 , 177 Yang penting, hubungan timbal balik ada antara AhR dan Nrf2, yang melibatkan interaksi langsung dan tidak langsung. Nrf2 dapat langsung mengikat promotor AhR, meningkatkan transkripsi mRNA AhR, sementara AhR dapat mengikat XRE dalam promotor Nrf2, meningkatkan transkripsi mRNA Nrf2. 178 , 179 Secara tidak langsung, ligan AhR yang dimetabolisme oleh CYP yang diinduksi AhR menghasilkan perantara stres oksidatif, yang selanjutnya mengaktifkan Nrf2. 180 , 181 Pada pasien Yusho yang keracunan dengan tingkat dioksin yang tinggi, obat herbal Kampo yang mengandung sinamaldehida telah menunjukkan kemanjuran dalam memperbaiki klorakne, kemungkinan dengan mengaktifkan jalur Nrf2 dan menghambat pensinyalan AhR-CYP1A1, yang menyoroti interaksi kompleks antara jalur-jalur ini dalam patologi kulit. 182
6 KESIMPULAN
Kulit, organ kompleks yang sebagian besar terdiri dari KC, bergantung pada jaringan sel imun dan jalur pensinyalan yang rumit untuk mempertahankan homeostasis dan bertahan melawan ancaman eksternal. KC memainkan peran ganda, membentuk penghalang fisik dan berpartisipasi aktif dalam respons imun kulit. Gangguan pada keseimbangan yang rapuh ini, baik karena predisposisi genetik atau agresi lingkungan, dapat berkontribusi pada kondisi kulit inflamasi seperti ACD, AD, dan psoriasis. Seperti yang dijelaskan dalam tinjauan ini, faktor transkripsi Nrf2 muncul sebagai pemain penting dalam kesehatan dan penyakit kulit. Ia mengatur respons antioksidan, mendetoksifikasi zat berbahaya dalam kondisi stres, memodulasi diferensiasi epidermis, dan mengatur fungsi imun kulit. Defisiensi Nrf2 sering dikaitkan dengan keadaan inflamasi patologis dan peningkatan kerentanan terhadap stresor, sementara aktivasi Nrf2, melalui senyawa alami atau sintetis, menawarkan potensi terapeutik yang menjanjikan untuk mengurangi peradangan dan meringankan gejala pada berbagai gangguan inflamasi kulit. Namun, sifat Nrf2 yang kompleks dan bergantung pada konteks menyoroti aspek penting: meskipun secara umum bermanfaat, aktivasi Nrf2 yang berlebihan secara paradoks dapat menyebabkan patologi seperti klorakne karena peningkatan regulasi beberapa gen targetnya. Oleh karena itu, penelitian lebih lanjut diperlukan untuk sepenuhnya memahami mekanisme ini dan mengembangkan strategi terapi yang menargetkan Nrf2 yang aman dan efektif. Menitrasi aktivitas Nrf2 secara hati-hati akan memaksimalkan manfaat terapi sekaligus meminimalkan risiko.

