
ABSTRAK
Polisakarida Cordyceps militaris (CMP) yang kaya ion logam diperoleh melalui biotransformasi dan sintesis kimia. Sifat fisikokimia dan bioaktivitas CMP yang diperkaya selenium (Se-CMP) yang diperoleh menggunakan biotransformasi masih belum jelas. Di sini, nanopartikel selenium digunakan untuk menghasilkan Se-CMP. Total gula, berat molekul, komposisi monosakarida, dan kandungan asam galakturonat dan Se dari Se-CMP dan CMP ditentukan. Kandungan Se dari Se-CMP adalah 5,11 ± 0,81 μg/g. Se-CMP terdiri dari glukosamin hidroklorida, xilosa, arabinosa, galaktosa, manosa, dan glukosa dalam rasio molar 0,001: 0,036: 0,022: 0,133: 0,150: 0,659. Se-CMP dikarakterisasi secara struktural menggunakan spektroskopi inframerah transformasi Fourier dan spektroskopi dikroisme sirkuler. Se-CMP menghambat aktivitas α-glukosidase (konsentrasi penghambatan setengah maksimal 0,474 mg/mL). Se-CMP juga meningkatkan penyerapan glukosa dan sintesis glikogen pada sel HepG2 yang resistan terhadap insulin dengan mengaktifkan jalur pensinyalan PI3K/AKT/GLUT4. Obat ini juga secara efektif mengurangi tingkat spesies oksigen reaktif pada sel HepG2 yang resistan terhadap insulin sekaligus meningkatkan aktivitas enzim antioksidan, termasuk katalase, glutation peroksidase, dan superoksida dismutase, yang mengurangi kerusakan oksidatif. Se-CMP secara signifikan telah mengurangi sifat resistan terhadap insulin dan dapat menjadi sumber anti-IR alami untuk mengelola diabetes melitus Tipe II.
1 Pendahuluan
Diabetes melitus (DM) adalah penyakit kronis yang prevalen secara global. DM terutama disebabkan oleh resistensi insulin (IR) atau insulin yang tidak mencukupi (Zhang et al. 2019a ). Data terkini dari Federasi Diabetes Internasional menunjukkan bahwa populasi global dengan diabetes akan mencapai 537 juta pada tahun 2023, dengan proyeksi yang menunjukkan peningkatan sekitar 1,31 miliar pada tahun 2050. Lebih dari 90% pasien didiagnosis dengan diabetes melitus Tipe II (T2DM) (Qian et al. 2020 ). IR merupakan faktor signifikan dalam timbulnya T2DM. IR umumnya terjadi pada individu dengan gangguan metabolik (Cook et al. 2015 ). Lanskap terapeutik untuk T2DM terutama mencakup obat-obatan biguanida, tiazolidinedion, dan sulfonilurea. Tantangan yang terkait dengan agen farmakologis ini meliputi jadwal dosis yang kompleks, efek samping, biaya tinggi, dan potensi toksisitas. Dengan demikian, fokus penelitian telah bergeser ke arah mengidentifikasi produk-produk makanan alami dengan toksisitas rendah dan khasiat tinggi sebagai alternatif potensial untuk mengelola T2DM (Zhang et al. 2019b ). Sejumlah penelitian telah menunjukkan bahwa banyak bahan homologi makanan obat memiliki khasiat hipoglikemik preventif atau terapeutik dan tidak beracun, dengan sedikit atau tanpa efek samping (Xia dan Xiao 2021 ). Contohnya termasuk Cordyceps militaris (Zhang et al. 2006 ), Polygonatum sibiricum (Luo et al. 2020 ), dan Astragalus (Zhu et al. 2016 ). Lebih jauh lagi, penggabungan elemen jejak, terutama selenium (Se) (Duan et al. 2022 ; Xiao et al. 2019 ), ke dalam produk makanan melalui metode biotransformasi atau sintesis lebih lanjut meringankan IR dan meningkatkan efek hipoglikemik ini. Pendekatan sinergis ini menyoroti potensi menggabungkan makanan obat tradisional dengan elemen jejak untuk mengembangkan intervensi diet yang efektif untuk pengelolaan glukosa darah. Se merupakan elemen jejak yang sangat diperlukan bagi hewan dan manusia. Ia memainkan peran penting dalam pertahanan tubuh terhadap berbagai kondisi kesehatan, termasuk penuaan, diabetes, stres oksidatif (OS), dan peningkatan fungsi imun (Hou et al. 2016 ). Sebagai peniru insulin, Se memiliki efek antidiabetik (Ogawa-Wong et al. 2016 ). Namun, Se tidak dapat disintesis secara endogen dan harus diperoleh dari sumber makanan. Khususnya, miliaran orang di seluruh dunia tinggal di wilayah dengan defisiensi Se, khususnya di Tiongkok, Selandia Baru, dan Eropa (Chen et al. 2021)). Mengingat kekurangan ini, suplementasi dengan Se eksogen sangat penting untuk memenuhi kebutuhan tubuh. Suplemen Se dapat dikategorikan secara luas menjadi bentuk anorganik dan organik. Karena tingkat penyerapannya yang tinggi, toksisitasnya yang rendah, dan kesesuaiannya untuk penggunaan jangka panjang, Se organik menawarkan keuntungan yang signifikan dibandingkan Se anorganik. Di antara senyawa Se organik, polisakarida Se dibedakan berdasarkan stabilitas dan aktivitas biologisnya yang ditingkatkan (Zhou et al. 2018 ). Perbedaan ini menekankan pentingnya memilih suplementasi Se yang tepat untuk mengoptimalkan manfaat kesehatan.
C. militaris , juga dikenal sebagai C. sinensis Utara , adalah jamur yang dapat dimakan dan obat yang telah disetujui oleh Kementerian Kesehatan Republik Rakyat Tiongkok sebagai sumber makanan baru pada tahun 2009. Saat ini, C. militaris dibudidayakan secara artifisial dan memiliki pangsa pasar yang signifikan di Tiongkok untuk jamur yang dapat dimakan dan obat (Zhao et al. 2024 ). Jamur ini mengandung spektrum komponen bioaktif, termasuk cordycepin, polisakarida, protein, dan asam cordycepic, yang menunjukkan sifat antikanker (Tuli et al. 2013 ), imunomodulator (Fan et al. 2021 ), pengatur mikrobiota usus (Jiang et al. 2024 ), antiinflamasi (Guo et al. 2024 ), dan hipoglikemik (Ni et al. 2024 ). Polisakarida merupakan komponen bioaktif yang sangat penting dari C. militaris dan memiliki beragam sifat farmakologis (Miao et al. 2022 ). Penelitian terkini telah mengeksplorasi secara ekstensif selenilasi kimia dari polisakarida ini untuk meningkatkan efektivitas biologisnya (Liu et al. 2017 ). Meskipun ada kemajuan substansial dalam teknik modifikasi kimia, penerapan proses biotransformasi untuk menghasilkan CMP yang diperkaya Se (Se-CMP) dan sifat fisikokimia serta kemampuannya untuk mengurangi IR masih belum dieksplorasi.
Penelitian ini dilakukan untuk menentukan karakteristik fisikokimia dan struktural CMP dan Se-CMP serta untuk mengidentifikasi sel hepatoma manusia IR (HepG2) guna mengeksplorasi mekanisme potensial anti-IR dari Se-CMP. Tujuan utamanya adalah untuk membantu individu dengan IR dengan merancang alternatif diet alami dengan efek samping minimal, sehingga membantu menurunkan kadar glukosa darah.
2 Bahan dan Metode
2.1 Bahan dan Reagen
Proses pengayaan untuk memperoleh Se-CMP dari nanopartikel Se telah dijelaskan sebelumnya (Hu et al. 2019 ). Sel HepG2 diperoleh dari Cell Bank of the Chinese Academy of Sciences (Shanghai, Tiongkok). Medium glukosa tinggi Eagle yang dimodifikasi Dulbecco dibeli dari HyClone (Logan, Utah, AS). Serum sapi janin (FBS), 0,25% triptase-EDTA, dan standar berat molekul protein yang telah diwarnai sebelumnya dibeli dari Thermo Fisher Scientific (Tiongkok) Ltd. (Shanghai, Tiongkok). Dimetil sulfoksida (tingkat kultur sel) dan insulin manusia rekombinan dibeli dari Beijing Priority Genetic Technology Co. Ltd. (Beijing, Tiongkok). Kit persiapan gel elektroforesis gel poliakrilamid-natrium dodecyl sulfate (SDS-PAGE) (Nomor Kat. WLA013), cairan luminescent ECL (Nomor Kat. WLA003), dan kit 3-(4, 5-dimetiltiazolil-2)-2, 5-difeniltetrazolium bromida (MTT, No. Kat. WLA021) dibeli dari Wanlianbio (Shenyang, Tiongkok). Buffer PBS (10×, pH 7,2–7,4) dibeli dari Collins (Shanghai, Tiongkok). Standar monosakarida, α-Glukosidase, dan metformin (Met) dibeli dari Sigma-Aldrich (St. Louis, MO, AS). Susu Skim Bubuk dibeli dari Yili Co. (Mongolia Dalam, Tiongkok). Membran PVDF dibeli dari Millipore (MA, AS) Semua bahan kimia dan reagen lain yang digunakan bermutu analitis.
2.2 Ekstraksi dan Isolasi Polisakarida
Ekstraksi CMP dan Se-CMP dilakukan seperti yang dijelaskan sebelumnya (Hu et al. 2019 ), dengan sedikit modifikasi. Secara singkat, sampel diekstraksi dengan air suling pada rasio 1:10 (g/v), disonikasi (26 menit), dimaserasi (80°C, 120 menit), dan disentrifugasi (50°C, 15 menit, 4000 rpm). Ekstrak disentrifugasi, dipekatkan, diendapkan dengan etanol anhidrat, dan dikeringkan dalam keadaan beku-kering. Protein dideproteinisasi dengan metode Sevage (Malinowska et al. 2018 ), dan pelarut organik dihilangkan dengan penguapan spin pada suhu 60°C. CMP dan Se-CMP diperoleh dengan dialisis dalam kantong dialisis dengan kapasitas retensi 3,5 kDa pada suhu 4°C selama 72 jam.
2.3 Karakterisasi CMP dan Se-CMP
2.3.1 Penentuan Kemurnian dan Kandungan Total Gula, Se, dan Asam Galakturonat
Total kandungan gula dari CMP dan Se-CMP ditentukan menggunakan metode fenol-asam sulfat, dengan glukosa sebagai standar. Kandungan Se ditentukan seperti yang dijelaskan sebelumnya (Luo et al. 2021 ) dengan sedikit modifikasi menggunakan praperlakuan pencernaan gelombang mikro, diikuti oleh spektrometri massa plasma yang digabungkan secara induktif (ICP-MS). Untuk memastikan kandungan asam galakturonat, 1 mL sampel (50 μg/mL) dikumpulkan, dan kerapatan optik pada 523 nm ditentukan dengan menambahkan larutan natrium tetraborat-asam sulfat dan larutan karbazol (Zayed et al. 2020 ). Kemurnian polisakarida ditentukan oleh spektroskopi ultraviolet (UV) dalam rentang bilangan gelombang 200–400 nm.
2.3.2 Penentuan Berat Molekul
Kromatografi permeasi gel berkinerja tinggi menggunakan instrumen model 1515 (Waters, AS) digunakan untuk mengukur berat molekul CMP dan Se-CMP (Hongxia 2017 ). Fase bergeraknya adalah larutan NaCl 0,05 M. Dekstran dengan berat molekul yang berbeda (1, 5, 12, 25, 50, 80, dan 670 kDa) digunakan sebagai standar untuk membuat kurva kalibrasi berat molekul.
2.3.3 Analisis Komposisi Monosakarida
Kromatografi pertukaran anion kinerja tinggi menggunakan instrumen ICS5000 (Thermo Fisher Scientific, AS) digunakan untuk menentukan komposisi monosakarida CMP dan Se-CMP (Zhang et al. 2018b ).
2.3.4 Spektroskopi Inframerah Transformasi Fourier (FT-IR)
CMP dan Se-CMP (masing-masing 2 mg) dicampur dengan 200 mg bubuk KBr dan ditekan menjadi tablet. Spektrum inframerah dikumpulkan pada panjang gelombang berkisar antara 4000 hingga 400 cm −1 .
2.3.5 Dikroisme Sirkular (CD)
CMP dan Se-CMP masing-masing dikonfigurasikan menjadi larutan 1 mg/mL, dan larutan sampel diukur menggunakan spektrometer CD pada 100 nm/menit, dan data dikumpulkan dalam kisaran 195–260 nm.
2.4 Uji In Vitro Se-CMP untuk Mengurangi IR
2.4.1 Analisis Aktivitas Penghambatan α-Glukosidase
Aktivitas penghambatan α-glukosidase dari Se-CMP ditentukan seperti yang dijelaskan sebelumnya (Ou et al. 2023 ).
2.4.2 Kultur Sel dan Perawatan
Sel HepG2 dikulturkan dengan medium Eagle yang dimodifikasi Dulbecco yang mengandung 10% FBS pada suhu 37°C dalam atmosfer 5% CO 2 . Sel diobati dengan insulin pada konsentrasi 10 −6 mol/L selama 24 jam untuk membentuk model sel IR. Kelompok kontrol normal terdiri dari sel HepG2 yang tidak terpapar insulin. Pada kelompok kontrol positif, sel IR diobati dengan metformin 10 mM untuk sel IR. Pada kelompok eksperimen, sel IR diobati dengan Se-CMP (1000, 800, 600, 400, 200, atau 100 μg/mL).
2.4.3 Analisis Viabilitas Sel dan Morfologi Sel
Sel IR HepG2 diinkubasi dengan Se-CMP (1000, 800, 600, 400, 200, atau 100 μg/mL) dan Met (10 mM) selama 48 jam. Viabilitas sel ditentukan menggunakan metode MTT seperti yang dijelaskan sebelumnya (Wang et al. 2020 ). Morfologi sel diamati dengan mikroskop fluoresensi terbalik pada perbesaran 200x.
2.4.4 Konsumsi Glukosa (Glu)
Sel IR HepG2 diinkubasi dengan Se-CMP (1000, 800, 600, 400, 200, atau 100 μg/mL) dan Met (10 mM) selama 48 jam. Sel dikumpulkan (300 g ) dan disentrifugasi (10 menit) untuk menghilangkan endapan. Kandungan Glu ditentukan menggunakan kit uji glukosa (Nomor Cat. WLA134, Wanleibio, Shenyang, Tiongkok) sesuai dengan petunjuk pabrik pembuatnya.
2.4.5 Kandungan Glikogen Intraseluler
Sel IR HepG2 diinkubasi dengan Se-CMP (1000 μg/mL) dan Met (10 mM) selama 48 jam. Sel dikumpulkan (5 × 10 6 –1 × 10 7 ) dalam tabung sentrifus. Setelah sentrifugasi, supernatan dibuang. Sel disuspensikan kembali dalam 0,75 mL larutan ekstraksi dalam tabung reaksi 10 mL, dipecah dengan ultrasonikasi, ditempatkan dalam penangas air mendidih, dan direbus selama 20 menit. Selama perebusan, tabung dikocok setiap 5 menit sekali untuk memastikan pencampuran yang cukup. Sampel didinginkan lalu diencerkan hingga 5 mL dengan air suling, diaduk rata, dan disentrifugasi (25°C, 10 menit, 8000 × g ). Supernatan diekstraksi, dan kandungan glikogen hati ditentukan menggunakan alat uji konsentrasi protein BCA (Nomor Kat. WLA004, wanleibio, Shenyang, Cina) dan alat uji kandungan glikogen (Nomor Kat. BC 0340, Solarbio, Cina) sesuai dengan petunjuk produsen.
2.4.6 Spesies Oksigen Reaktif (ROS)
Tingkat ROS intraseluler ditentukan seperti yang dijelaskan sebelumnya (Lv et al. 2025 ). Secara singkat, sel IR HepG2 diinkubasi dengan Se-CMP (1000 μg/mL) dan Met (10 mM) selama 48 jam. Satu mililiter pengenceran 1:000 dalam medium DCFH-DA ditambahkan dan dicampur, dan sel diinkubasi pada suhu 37°C selama 20 menit. Tabung dibalik setiap 5 menit. Sel dicuci tiga kali menggunakan PBS. Setelah pencucian terakhir, sel disuspensikan kembali dalam PBS, dan uji flow cytometry dilakukan.
2.4.7 Pengukuran Aktivitas Superoxide Dismutase (SOD), Catalase (CAT), dan Glutathione Peroxidase (GSH-Px)
Sel IR HepG2 diinkubasi dengan Se-CMP (1000 μg/mL) dan Met (10 mM) selama 48 jam. Sel-sel tersebut disuspensikan kembali dalam PBS, dilisiskan dengan sonikasi dalam penangas es, dan disentrifugasi pada 1500 × g selama 10 menit. Setiap supernatan dikumpulkan untuk pengujian. Protein ditentukan, dan aktivitas intraseluler CAT, GSH-Px, dan SOD ditentukan menggunakan kit pengujian konsentrasi protein BCA (Nomor Kat. WLA004, Wanleibio, Shenyang, Cina), kit pengujian SOD (Nomor Kat. WLA110, Wanleibio, Shenyang, Cina), kit pengujian CAT (Nomor Kat. A007, Nanjing Built, Nanjing, Cina), dan kit pengujian GSH-Px (Nomor Kat. WLA107, Wanleibio, Shenyang, Cina) sesuai dengan petunjuk pabrik.
2.4.8 Western Blot
Sel IR HepG2 diinkubasi dengan Se-CMP (1000 μg/mL) dan Met (2 mM) selama 48 jam. Western blotting dilakukan seperti yang dijelaskan sebelumnya dengan sedikit modifikasi (Qian et al. 2020 ). Protein dipisahkan dengan 10% SDS-PAGE. Protein target dideteksi menggunakan antibodi primer terhadap fosfatidilinositol 3-kinase terfosforilasi (p-PI3K) (Nomor Kat. AF3241, Affinity, AS), protein kinase B (AKT, No. Kat. WL0003b), fosfatidilinositol 3-kinase (PI3K, No. Kat. WL02240), protein kinase B terfosforilasi (p-AKT, No. Kat. WLP001a), transporter glukosa 4 (GLUT4, No. Kat. WL02425), dan β-aktin (No. Kat. WL01372) (semuanya dari Wanlianbio, Shenyang, Tiongkok).
2.4.9 Pewarnaan Imunofluoresensi untuk Transporter Glukosa Tipe 4 (GLUT4)
Sel IR HepG2 diinkubasi dengan Se-CMP (1000 μg/mL) dan Met (2 mM) selama 48 jam. Sel difiksasi dalam 4% paraformaldehida (15 menit). Triton X-100 (0,1%) ditambahkan tetes demi tetes untuk menutupi seluruh sel, diikuti dengan inkubasi (25°C, 30 menit). Bovine serum albumin (1%) kemudian ditambahkan tetes demi tetes, diikuti dengan inkubasi (25°C, 15 menit). Selama 16 jam pada suhu 4°C inkubasi antibodi primer, sel-sel tersebut diberi perlakuan tetes demi tetes dengan antibodi sekunder fluoresen dalam gelap (1 jam). Inti sel diwarnai dengan DAPI, dan efek pewarnaan diamati di bawah mikroskop fluoresensi.
2.5 Analisis Statistik
Setidaknya tiga kali percobaan kultur sel dilakukan secara independen. Setiap nilai dinyatakan sebagai
± s. Analisis varians digunakan untuk menilai data eksperimen, dengan p < 0,05 dan dianggap signifikan secara statistik. SPSS Statistics for Windows, versi 27.0 (IBM, AS), digunakan untuk analisis statistik.
3 Hasil
3.1 Jumlah Gula, Se, Kandungan Asam Galakturonat, dan Kemurnian CMP dan Se-CMP
Kandungan gula total adalah 70,82% ± 2,46% untuk CMP dan 72,63% ± 1,77% untuk Se-CMP (Gambar 1A ). Analisis ICP-MS mengungkapkan bahwa kandungan Se dari Se-CMP secara signifikan lebih tinggi daripada kandungan dalam CMP (5,11 ± 0,81 vs. 0,43 ± 0,22 μg/g; p < 0,05), yang mengonfirmasi keberhasilan pengayaan Se dalam CMP (Gambar 1B ). Demikian pula, CMP dan eCMP yang diproduksi melalui biotransformasi menunjukkan pola yang sama 0,10 ± 0,01 versus 5,14 ± 0,06 μg/g Se, masing-masing (Yu et al. 2021 ). Temuan ini menunjukkan bahwa Se dapat secara efektif dimasukkan ke dalam polisakarida melalui biotransformasi.
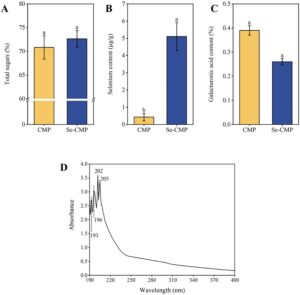
Kandungan asam galakturonat dalam CMP dan Se-CMP masing-masing adalah 0,39% ± 0,46% dan 0,26% ± 0,54%. Nilai-nilai ini menunjukkan bahwa CMP dan Se-CMP adalah polisakarida netral karena konsentrasi asam galakturonatnya rendah (Gambar 1C ). Selain itu, spektrum UV Se-CMP tidak menunjukkan puncak serapan (AP) pada 260 dan 280 nm (Gambar 1D ), yang menunjukkan tidak adanya asam nukleat dan protein dalam polisakarida yang diperkaya Se. Tidak adanya kontaminasi asam nukleat dan protein semakin menegaskan kemurnian sediaan Se-CMP.
3.2 Berat Molekul dan Komposisi Monosakarida CMP dan Se-CMP
Hasil distribusi berat molekul, digambarkan pada Gambar 2A,B , mengungkapkan bahwa tiga fraksi berat molekul untuk CMP: 26.881 Da (67,12% dari total), 12.749 Da (24,85%), dan 3185 Da (8,03%). Sebaliknya, Se-CMP menunjukkan rentang yang lebih luas, dengan lima distribusi berat molekul: 2.979.189 Da (23,66%), 903.802 Da (21,24%), 287.081 Da (3,16%), 21.968 Da (46,41%), dan 2878 Da (5,53%). Jumlah fraksi dan berat molekul polisakarida meningkat dengan pengayaan Se (persamaan regresi, lgMw = −0.1663x + 11.054; R 2 = 0.9950; Tabel S1 dan S2 ), menunjukkan bahwa jumlah fraksi dan berat molekul polisakarida meningkat dengan pengayaan selenium.
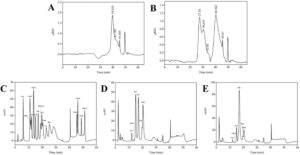
Analisis lebih lanjut dari komposisi monosakarida, yang disajikan dalam Gambar 2C–E , menunjukkan bahwa CMP dan Se-CMP terdiri dari enam monosakarida: glukosamin hidroklorida, xilosa, arabinosa, galaktosa, manosa, dan glukosa. Rasio molar masing-masing untuk CMP adalah 0,001: 0,059: 0,041: 0,313: 0,360: 0,226. Rasio molar masing-masing untuk Se-CMP adalah 0,001: 0,036: 0,022: 0,133: 0,150: 0,659 (Tabel S3 ). Temuan menunjukkan bahwa meskipun jenis monosakarida yang ada dalam CMP dan Se-CMP konsisten, rasionya bervariasi secara signifikan. Baik dalam Se-CMP maupun CMP, galaktosa, manosa, dan glukosa merupakan monosakarida utama, yang sesuai dengan hasil ringkasan Jixian Zhang et al. tentang komposisi monosakarida CMP (Zhang et al. 2019c ). Perbedaan dalam komposisi monosakarida dan rasio molarnya dalam polisakarida mungkin terkait erat dengan faktor-faktor seperti spesies bahan baku, metode isolasi, dan pemurnian. Khususnya, manosa merupakan komponen dominan CMP, sedangkan glukosa merupakan komponen utama Se-CMP. Pergeseran ini menunjukkan bahwa Se memengaruhi jalur biosintesis metabolit polisakarida dalam C. militaris , yang menyebabkan perubahan dalam komposisi struktural.
3.3 FT-IR
Spektrum FT-IR CMP dan Se-CMP diamati dari 4000 hingga 400 cm −1 (Gambar 3A ). Secara umum, profil spektral kedua polisakarida sangat mirip, dengan penyelarasan AP CMP dan Se-CMP yang erat. Namun, intensitas penyerapan kedua senyawa ini sedikit berbeda. Pengamatan ini menunjukkan bahwa kerangka struktural CMP dan Se-CMP tetap serupa meskipun pengayaan Se. AP CMP dan Se-CMP yang luas dan kuat pada 3400 cm −1 dihasilkan dari vibrasi peregangan OH (Ji et al. 2018 ). AP pada 2920 dan 2930 cm −1 dikaitkan dengan vibrasi peregangan CH dari gugus −CH 2 (Zhang et al. 2018a ); yang dekat 1644 dan 1654 cm −1 berkorespondensi dengan penyerapan gugus karbonil C=O sebagai bagian dari glikosida, dan yang pada 1401 dan 1417 cm −1 berkorespondensi dengan vibrasi tekukan CH (Liu et al. 2016 ). Lebih jauh lagi, keberadaan puncak tajam spesifik yang tersebar di seluruh rentang 1000–1200 cm −1 menunjukkan keberadaan bentuk piranosa dari residu gula (Xu et al. 2018 ). Polisakarida Se ada dalam berbagai bentuk, termasuk Se = O, O-Se-O, CO-Se, dan lainnya (Gao et al. 2016 ). AP yang khas pada 601 dan 1035 cm −1 berkorespondensi dengan vibrasi peregangan ikatan ester selenium Se-OC dan O-Se-O. Berdasarkan hasil ini, Se dan polisakarida berhasil dihubungkan melalui ikatan O-Se-O dan Se-OC.
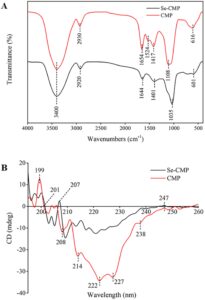
3.4 tahun lalu
Spektrum CD menunjukkan bahwa CMP dan Se-CMP menunjukkan puncak negatif dan positif dalam rentang panjang gelombang 195–260 nm, yang menunjukkan keberadaan struktur rangkap tiga yang kompak (Gambar 3B ). Pengurangan yang nyata pada area puncak positif dan negatif diamati untuk Se-CMP. Perubahan ini menunjukkan bahwa penambahan Se membuat polisakarida lebih fleksibel dan mengurangi simetri rantai gula dalam molekul polisakarida (Yan et al. 2012 ).
3.5 Se-CMP Mengurangi IR In Vitro
3.5.1 Aktivitas Penghambat α-Glukosidase
Gambar S1 mengilustrasikan efek penghambatan Se-CMP pada aktivitas α-glukosidase. Se-CMP memengaruhi aktivitas α-glukosidase dengan cara yang bergantung pada dosis. Konsentrasi penghambatan setengah maksimal (IC50 ) Se-CMP pada α-glukosidase adalah 0,474 mg/mL, yang menunjukkan penghambatan kuat α-glukosidase.
3.5.2 Efek pada Viabilitas dan Morfologi Sel
Efek sitotoksik Se-CMP pada sel IR HepG2 diselidiki menggunakan uji MTT. Perlakuan Se-CMP pada sel IR HepG2 tidak mengubah viabilitas sel secara signifikan dibandingkan dengan kelompok model ( p > 0,05), yang mengonfirmasi bahwa Se-CMP aman untuk sel IR HepG2 (Gambar 4A ). Dibandingkan dengan kelompok kontrol normal (Gambar 4B ), sel-sel dalam kelompok model pecah dan menyusut, dengan jumlah sel yang berkurang dan bentuk yang tidak teratur, menunjukkan morfologi khas kerusakan pulau. Saat konsentrasi sampel meningkat, jumlah sel secara bertahap meningkat, tingkat pecahnya sel berkurang, dan bentuk sel secara bertahap menjadi teratur, kembali ke keadaan sel normal. Pada konsentrasi tertinggi 1000 μg/mL, tidak ada perbedaan yang jelas antara kelompok eksperimen dan kelompok kontrol normal dan Met. Temuan menunjukkan bahwa Se-CMP memiliki efek reparatif pada sel IR HepG2.

3.5.3 Konsumsi Glukosa dan Kandungan Glikogen Intraseluler pada Sel IR HepG2
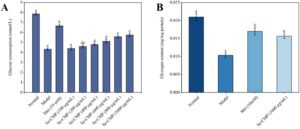
Konsumsi glukosa pada kelompok model yang diobati dengan insulin secara signifikan lebih rendah daripada kelompok kontrol ( p < 0,05), yang mengonfirmasi validitas model eksperimen (Gambar 5A ). Sel HepG2 yang diobati dengan Se-CMP menunjukkan peningkatan konsumsi glukosa yang bergantung pada konsentrasi. Pengobatan dengan 1000 μg/mL Se meningkatkan konsumsi glukosa sel IR HepG2 menjadi 5,87 ± 0,20 mg/mg, yang menunjukkan bahwa Se-CMP melemahkan IR pada sel HepG2 ( p < 0,05). Berdasarkan hasil Se-CMP pada konsumsi glukosa dan morfologi sel IR HepG2, 1000 μg/mL Se-CMP dipilih untuk analisis selanjutnya dalam penelitian ini. Se-CMP secara signifikan meningkatkan kandungan glikogen pada sel IR HepG2 dibandingkan dengan kelompok model ( p < 0,05). Kandungan glikogen serupa dengan yang ada pada kelompok Met ( p > 0,05) (Gambar 5B ). Hasil ini menunjukkan bahwa Se-CMP mengurangi IR dengan mendorong sel IR-HepG2 untuk menyerap dan memanfaatkan glukosa.
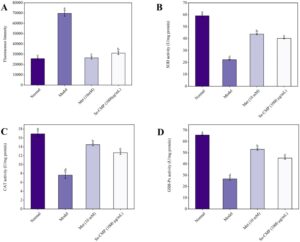
3.5.4 Tingkat ROS, SOD, CAT, dan GSH-Px dalam Sel IR HepG2
Dibandingkan dengan kelompok kontrol, kelompok model menunjukkan peningkatan signifikan dalam pembentukan ROS ( p < 0,05; Gambar 6A ). Sebaliknya, pembentukan ROS secara signifikan lebih rendah pada kelompok yang diobati dengan Se-CMP dibandingkan dengan kelompok model ( p < 0,05). Lebih jauh lagi, aktivitas SOD, CAT, dan GSH-Px berkurang secara signifikan pada kelompok model dibandingkan dengan kelompok kontrol normal ( p < 0,05; Gambar 6B,C,D ). Pengobatan dengan Se-CMP meringankan pengurangan ini ( p < 0,05), yang menunjukkan efektivitasnya dalam mengurangi stres oksidatif (OS) pada sel IR HepG2.
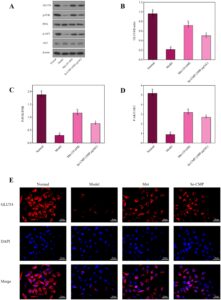
3.5.5 Se-CMP Mengaktifkan Jalur Sinyal PI3K/AKT/GLUT4 di Sel IR HepG2
Ekspresi GLUT4, p-PI3K, dan p-AKT mengalami penurunan regulasi pada kelompok model dibandingkan dengan kelompok kontrol normal (semua p < 0,05), yang menunjukkan keberadaan IR pada sel HepG2 (Gambar 7A–D ). Perlakuan Se-CMP secara signifikan meningkatkan ekspresi p-AKT, GLUT4, dan p-PI3K dibandingkan dengan kelompok model (semua p < 0,05). Ekspresi GLUT4 diperiksa dengan pewarnaan imunofluoresensi untuk memvalidasi keterlibatannya dalam penyerapan glukosa yang diinduksi oleh Se-CMP. Perlakuan Se-CMP meningkatkan ekspresi GLUT4 pada sel dan mendorong translokasi GLUT4 dari vesikel ke membran sel dibandingkan dengan kelompok model (Gambar 7E ). Hasil ini menunjukkan bahwa perlakuan Se-CMP mengurangi IR pada sel HepG2, yang mungkin berkorelasi dengan jalur pensinyalan PI3K/AKT.
4 Diskusi
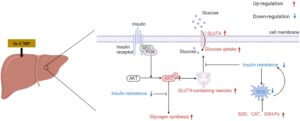
Dalam studi ini, sifat fisikokimia CMP dan Se-CMP dibandingkan, dan mekanisme yang mendasari pengurangan IR yang dimediasi Se-CMP diselidiki. Kandungan Se, berat molekul, komposisi monosakarida, analisis UV, FT-IR, dan CD mengonfirmasi Se-CMP sebagai polisakarida netral dan non-homogen. Se-CMP secara efektif mengurangi efek samping yang diinduksi insulin pada metabolisme glukosa dengan meningkatkan ekspresi dan translokasi GLUT4, berpotensi melalui aktivasi jalur pensinyalan PI3K/AKT/GLUT4. Selain itu, Se-CMP mengurangi OS dan meningkatkan pensinyalan insulin normal dengan mengurangi kadar ROS dan meningkatkan aktivitas enzim antioksidan SOD, CAT, dan GSH-Px (Gambar 8 ). Sifat-sifat ini menyoroti potensi terapeutik Se-CMP dalam pengelolaan gangguan metabolisme glukosa.
Ion logam dapat digunakan sebagai intervensi suplementasi nutrisi untuk memainkan peran tambahan dalam pengobatan farmakologis T2DM (Ye et al. 2019 ). Se, sebagai mimetik insulin, dapat mengaktifkan protein kunci dalam respons kaskade pensinyalan insulin (Stapleton 2000 ). Se juga memiliki sifat antioksidan, membersihkan radikal bebas dan mengurangi kerusakan oksidatif. Oleh karena itu, suplementasi Se dalam jumlah yang tepat dapat meringankan IR dan menurunkan glukosa darah (Ogawa-Wong et al. 2016 ). Dalam penelitian ini, nanopartikel Se digunakan sebagai bahan baku yang diperkaya dalam Cordyceps militaris untuk menyelidiki efek anti-IR dari Se-CMP. Namun, masih harus dijelaskan apakah perbedaan sumber Se akan menyebabkan perbedaan bioaktivitas Se-CMP.
α-Glukosidase, yang utamanya terletak di brush border sel mukosa usus halus, menghidrolisis ikatan glikosidik dan mendegradasi oligosakarida menjadi monosakarida (Sun et al. 2021 ). Penghambatan aktivitas enzim ini memengaruhi konversi glukosa dan menurunkan glukosa darah (Cao et al. 2019 ; Kim et al. 2010 ). Uji aktivitas penghambatan α-glukosidase banyak digunakan untuk menilai aksi hipoglikemik zat bioaktif in vitro. Misalnya, eksopolisakarida III C. militaris menghambat α-glukosidase, dengan korelasi positif laju penghambatan dengan konsentrasi sampel, mencapai puncak pada 55,94% ± 1,34% pada 3 mg/mL (Sun et al. 2021 ). Dalam penelitian ini, penghambatan α-glukosidase oleh CMP meningkat seiring dengan peningkatan konsentrasi, dengan IC 50 sebesar 0,474 mg/mL, yang jauh lebih rendah daripada IC 50 yang dilaporkan di tempat lain (Zhu et al. 2014 ). Temuan ini menunjukkan bahwa CMP memiliki efek penghambatan pada α-glukosidase dan bahwa pengayaan Se dalam polisakarida dapat meningkatkan efek penghambatan pada α-glukosidase.
Sebagai pengatur metabolisme terbesar dalam tubuh manusia, hati memainkan peran penting dalam homeostasis glukosa melalui penyerapan dan penggunaan glukosa untuk menurunkan kadar glukosa darah dan mengubah glukosa menjadi glikogen hati untuk penyimpanan. HepG2 adalah garis sel hepatoma manusia dengan sifat hati seperti metabolisme lipid, sintesis glikogen, dan pensinyalan insulin (Wang et al. 2025 ). Oleh karena itu, sel HepG2 dianggap sebagai model sel yang cocok untuk mempelajari fungsi IR dan antioksidan (Cai et al. 2015 ; Wang et al. 2025 ). Dalam penelitian ini, model sel IR HepG2 dibuat dengan membudidayakan sel HepG2 dengan insulin. Model ini berperan penting dalam memahami disregulasi metabolik hepatosit, yang sangat penting untuk timbulnya IR.
Glikogen adalah polisakarida glukosa bercabang banyak dan merupakan bentuk utama penyimpanan energi pada manusia. Glukoneogenesis dan glikogenolisis adalah jalur utama yang terlibat dalam metabolisme glukosa hati (Deng et al. 2020 ). Mengatur kadar glikogen dan enzim utama dalam metabolisme glukosa membantu meningkatkan fungsi metabolisme glukosa sel IR HepG2, yang secara efektif dapat meringankan gejala hiperglikemia dan mengurangi kejadian diabetes melitus dan komplikasinya (Tang et al. 2015 ). Dalam penelitian ini, pengobatan Se-CMP secara signifikan meningkatkan konsumsi glukosa sel IR HepG2 dan kandungan glikogen intraseluler, sehingga mengurangi IR. Mirip dengan karya ini, heteropolisakarida Anemarrhena asphodeloides dan polisakarida Sargassum pallidum secara nyata meningkatkan aktivitas piruvat kinase dan heksokinase, serta konsumsi glukosa dan kandungan glikogen dalam sel IR HepG2, yang menunjukkan potensinya dalam aplikasi terapeutik (Cao et al. 2019 ; Sun et al. 2021 ).
Keluarga GLUT terdiri dari serangkaian protein transmembran yang memiliki peran penting dalam mengatur transpor glukosa melintasi membran sel. Dari 14 anggota GLUT yang teridentifikasi, GLUT4 adalah satu-satunya transporter yang sensitif terhadap insulin. Dengan adanya insulin, GLUT4 dimobilisasi secara dinamis dari vesikel intraseluler ke permukaan sel, meningkatkan penyerapan glukosa seluler. Jalur pensinyalan PI3K/AKT juga penting untuk memediasi efek insulin. Jalur ini mengatur berbagai aspek metabolisme glukosa, termasuk transpor glukosa, sintesis glikogen, dan penghambatan glukoneogenesis (He et al. 2007 ). PI3K mengikat substrat reseptor insulin terfosforilasi 1 (IRS1) pada permukaan membran sel dan mengaktifkan AKT hilir, yang mentranslokasi GLUT4 ke membran plasma dari vesikel penyimpanan intraseluler untuk transpor glukosa melalui kaskade pensinyalan hilir. Proses ini memiliki peran sentral dalam pemeliharaan homeostasis glukosa (Xu et al. 2018 ). Dalam kondisi IR, aktivasi jalur PI3K/AKT terganggu. Kerusakan ini ditandai dengan penurunan fosforilasi dan aktivasi AKT. Ketidakefisienan yang dihasilkan dalam translokasi GLUT4 menyebabkan penurunan penyerapan glukosa oleh sel dan, akibatnya, peningkatan kadar glukosa darah. Dengan demikian, memahami mekanisme pengaturan dan gangguan dalam jalur pensinyalan ini sangat penting untuk pengembangan terapi yang ditargetkan untuk diabetes dan gangguan metabolik lainnya yang ditandai dengan IR. Studi ini mengungkapkan bahwa pengobatan Se-CMP secara signifikan meningkatkan ekspresi p-AKT, GLUT4, dan p-PI3K sambil mempromosikan translokasi GLUT4 dari vesikel intraseluler ke membran plasma pada sel IR HepG2. Ini dapat meningkatkan penggunaan glukosa dan meringankan IR. Glukan dari Euryale ferox Salisb . Biji meningkatkan penyerapan glukosa dan meringankan IR dengan meningkatkan ekspresi GLUT4, p-AKT, AKT, PI3K, dan IRS (Zhang et al. 2019b ). Polisakarida C. cicadae meningkatkan pemanfaatan glukosa dan IR dengan mengaktifkan jalur pensinyalan PI3K/AKT, yang melibatkan GLUT4, AKT, IRS-1, dan PI3K (Wang et al. 2023 ). Nitraria tangutorum Bobr . memperbaiki sensitivitas insulin dan gangguan metabolisme glukosa dengan mengatur jalur pensinyalan IRS1/PI3K/AKT dan ekspresi target hilirnya GLUT4, FOXO1, dan GSK3β (Jiang et al. 2023 ).
OS semakin diakui sebagai hal yang penting dalam patogenesis diabetes dan komplikasinya (Ježek et al. 2019 ). Hal ini terjadi akibat ketidakseimbangan antara pembentukan ROS dan kemampuan sistem antioksidan untuk membuang zat-zat (Li et al. 2024 ), yang menyebabkan serangkaian reaksi patologis. Secara khusus, dalam keadaan IR, OS merusak kemampuan fosforilasi oksidatif mitokondria sel hati. Kerusakan ini terkait dengan peningkatan β-oksidasi asam lemak dalam hepatosit, yang berkontribusi terhadap kelebihan lipid dan peningkatan produk peroksidasi (Rehman dan Akash 2017 ; Wang et al. 2025 ). Perubahan tersebut berdampak negatif pada fosforilasi reseptor insulin dan substrat reseptor insulin, mengurangi pengaruhnya terhadap PI3K hilir, dan mengganggu jalur pensinyalan insulin normal. Akibatnya, gangguan ini dapat memperburuk gejala DM dan mengabadikan siklus yang merugikan (Huang et al. 2018 ). Biasanya, SOD mitokondria mendegradasi superoksida anionik menjadi hidrogen peroksida, yang kemudian diubah menjadi air dan oksigen oleh CAT (Yaribeygi et al. 2019 ). GSH-Px adalah enzim penting lainnya yang memfasilitasi katabolisme peroksida dan ada di mana-mana dalam organisme. SOD, CAT, dan GSH-Px bekerja sama untuk melindungi sel dari OS dengan mengubah ROS menjadi zat yang tidak berbahaya. Oleh karena itu, membersihkan ROS dalam tubuh dan meningkatkan aktivitas enzim CAT, GSH-Px, dan SOD penting untuk mengurangi kerusakan yang disebabkan oleh OS, sehingga memperlambat timbulnya dan perkembangan DM dan komplikasi terkaitnya. Dalam penelitian ini, pengobatan Se-CMP secara nyata menurunkan kadar ROS dan secara signifikan meningkatkan aktivitas CAT, GSH-Px, dan SOD dalam sel IR HepG2. Demikian pula, penelitian lain melaporkan bahwa Momordica charantia L yang diselenilasi . polisakarida secara signifikan meningkatkan aktivitas SOD, CAT, dan GSH-Px dan secara signifikan mengurangi kadar MDA di hati, sehingga melemahkan OS pada tikus diabetes yang diinduksi streptozotocin (Ru et al. 2020 ). Namun, penelitian saat ini hanya mengonfirmasi peran Se-CMP dalam meningkatkan IR pada tingkat seluler. Penelitian selanjutnya perlu memvalidasi lebih lanjut kemanjurannya pada tingkat model hewan dan menggabungkannya dengan pendekatan multi-omik untuk mengungkap secara mendalam mekanisme molekuler dan jaringan jalur pensinyalan Se-CMP dalam mengurangi IR.
5 Kesimpulan
Dalam penelitian ini, Se-CMP diproduksi melalui biotransformasi, dan fungsi fisikokimia serta IR yang dikuranginya diperiksa. Tindakan IR yang dikurangi dari Se-CMP diusulkan terjadi melalui aktivasi jalur pensinyalan PI3K/AKT/GLUT4 dan pengurangan kadar OS. Namun, efek IR yang dikurangi dari Se-CMP dan mekanisme yang mendasarinya harus diverifikasi lebih lanjut secara in vivo. Temuan awal ini menunjukkan potensi Se-CMP sebagai suplemen makanan fungsional untuk pengelolaan T2DM, yang menawarkan tambahan alami untuk modalitas pengobatan tradisional.

