ABSTRAK
Oat ( Avena sativa ) adalah makanan yang meningkatkan kesehatan dengan menunjukkan sifat prebiotik. Kami menciptakan postbiotik berbasis oat (Oat_PB) yang difermentasi dengan probiotik (terutama Lactobacillus dan Bifidobacterium ) dan secara komprehensif membandingkan konstitusi kimianya dengan bentuk sinbiotik (Oat_SB). Oat_PB mengakumulasi β- glukan, avenanthramides (2c, 2p, dan 2f) serta asam amino bebas, misalnya, treonin, valin, arginin, aspartat, sitrulin, dan taurin, sekaligus mengurangi total fenol, flavon, dan protein. Oat_PB memperkaya metabolit yang memengaruhi metabolisme lipid dan glukosa. Makanan oat yang berasal dari probiotik mengurangi obesitas yang disebabkan oleh sukrosa tinggi, kerusakan hati, dan memperbaiki metabolisme lipid dan glukosa pada tikus, dengan Oat_PB menunjukkan efek yang paling menonjol. Oat_PB membalikkan profil asam lemak hati yang terganggu oleh sukrosa tinggi, dan mengatur gen dan protein yang terlibat dalam homeostasis lipid. Oat_PB memperbaiki disbakteriosis usus dengan meningkatkan Alloprevotella , Prevotella , dan Akkermansia sambil menghambat bakteri berbahaya. Secara kolektif, penelitian kami menunjukkan nilai tambah dari makanan oat yang berasal dari probiotik di luar bahan oat mentah dalam mencegah homeostasis metabolik dan disbakteriosis usus.
Ringkasan
- Kami menemukan postbiotik dan sinbiotik berbahan dasar gandum dengan karakteristik metabolik yang baik.
- Fermentasi probiotik memperkaya β -glukan, avenanthramide 2c, dan avenanthramide 2f.
- Metabolit fungsional yang melimpah dalam postbiotik berbasis oat dikaitkan dengan metabolisme lipid dan peradangan.
- Postbiotik berbahan dasar gandum meringankan kerusakan hati dan dislipidemia akibat konsumsi sukrosa tinggi.
- Postbiotik berbahan dasar gandum meringankan disbakteriosis usus yang berhubungan dengan obesitas dan disfungsi hati.
1 Pendahuluan
Ketersediaan luas makanan yang praktis dan tinggi sukrosa (HS) mengganggu homeostasis energi dan memiliki efek buruk pada perkembangan penyakit tidak menular, termasuk obesitas, hiperglikemia, dislipidemia, dan gangguan metabolik lainnya (Calcaterra et al. 2023 ; Hannou et al. 2018 ). Oat ( Avena sativa ) terkenal karena khasiatnya yang meningkatkan kesehatan (Rasane et al. 2015 ). Uji coba pada manusia dan studi pada hewan telah menunjukkan bahwa komponen bioaktif inti dari produk oat, termasuk β -glukan, avenanthramides, dan asam fenolik telah terbukti berhasil mencegah dan membalikkan gangguan metabolik yang disebabkan oleh diet tidak sehat (misalnya, obesitas, hiperglikemia, dan dislipidemia) dan disbakteriosis usus terkait (Ms Wolever et al. 2021 ; Smulders et al. 2018 ; Xue et al. 2021 ; Yin et al. 2023 ).
Probiotik, seperti Limosilactobacillus reuteri , Lactiplantibacillus plantarum , Lacticaseibacillus rhamnosus , serta beberapa spesies yang termasuk dalam Bifidobacterium telah digunakan untuk fermentasi makanan guna meningkatkan bioavailabilitas fitokimia dalam sereal dan menjaga kesehatan usus serta melindungi terhadap penyakit metabolik (Mårtensson et al. 2005 ). Beberapa penelitian telah melaporkan bahwa sinbiotik berbasis oat, seperti kombinasi optimal prebiotik dan probiotik, dapat mengungguli komponen individu dalam menunjukkan potensi anti-inflamasi dan antioksidan, serta memperbaiki akumulasi lipid dan mengatur disbakteriosis usus (Tang et al. 2020 ; Yau et al. 2020 ).
Selain itu, minuman fermentasi berbasis oat dimulai lebih dari 30 tahun yang lalu karena permintaan untuk makanan fungsional terutama di pasar Eropa dan Amerika Serikat (Djorgbenoo et al. 2023 ). Sereal oat merupakan substrat fermentasi yang menjanjikan untuk pertumbuhan mikroorganisme probiotik, termasuk Lactobacillus , Streptococcus , Lacticaseibacillus , dan Bifidobacterium (Akan et al. 2023 ; Djorgbenoo et al. 2023 ; Gawkowski dan Chikindas 2013 ). Ulasan terbaru memberikan gambaran komprehensif tentang produk oat fermentasi yang tersedia secara komersial, rincian proses fermentasi yang digunakan untuk berbagai organisme starter (bakteri, jamur, atau khamir) dan dampak potensialnya pada komposisi kimia bahan oat, serta berbagai manfaat kesehatan dari produk oat fermentasi (Djorgbenoo et al. 2023 ; Yu et al. 2023 ). Karena peningkatan bioavailabilitas nutrisi dan peningkatan kadar senyawa bermanfaat (Gohari et al. 2019 ; Hole et al. 2012 ; J. Wang et al. 2021 ).
Meskipun demikian, perlu dicatat bahwa dalam sebagian besar penelitian, fungsi biologis bakteri hidup yang mengandung oat yang difermentasi dengan probiotik diselidiki, dan jumlah bakteri hidup selama fermentasi oat sebagian besar berkorelasi kuat dengan aktivitas peningkatan kesehatan sampel (Alharbi et al. 2022 ; Klajn et al. 2021 ). Postbiotik mencakup komponen sel dari probiotik yang diinaktifkan dan produk metaboliknya selama fermentasi dengan manfaat kesehatan inang, yang memiliki keamanan, stabilitas, dan kekayaan intelektual yang lebih besar daripada bakteri hidup selama proses industri dan penyimpanan (Park et al. 2022 ; Salminen et al. 2021 ; Swanson et al. 2020 ). Penelitian terbaru kami menekankan nilai besar oat yang difermentasi sebagai terapi nutrisi untuk memerangi disfungsi metabolik yang disebabkan oleh diet tidak sehat (Song et al. 2024 ). Penelitian sebelumnya telah melaporkan efek postbiotik yang dihasilkan dengan memfermentasi ampas jeruk dan muramyl dipeptida, serta probiotik yang diinaktifkan (termasuk beberapa galur Lactobacillus dan Bifidobacterium ) dalam mengurangi obesitas, resistensi insulin, dan hiperkolesterolemia, sebagian melalui pengaturan mikrobiota usus (Cavallari et al. 2017 ; Youn et al. 2022 ). Produk postbiotik yang efektif mungkin memiliki potensi besar untuk melampaui efek menguntungkan dari bahan mentah atau sinbiotik (Ferrari et al. 2023 ; Salminen et al. 2021 ; Schwarzer et al. 2023 ). Namun, penelitian yang secara bersamaan berfokus pada konstituen kimia dan khasiat nutrisi dari bentuk simbiotik dan postbiotik produk oat masih langka.
Tujuan utama dari penelitian ini adalah untuk melakukan analisis komprehensif pada konstitusi nutrisi, termasuk total fenol, total flavon, β -glukan, asam amino bebas, dan avenanthramida dari postbiotik oat terpasteurisasi yang diproduksi dengan memfermentasi tepung oat dan dedak sebagai substrat dengan lima strain, termasuk L. reuteri , L. plantarum , Lactobacillus acidophilus , L. rhamnosus , dan Bifidobacterium lactis , dan bentuk sinbiotiknya (mengandung bakteri hidup). Strain bakteri ini telah banyak digunakan dalam industri makanan, menunjukkan bioaktivitas seperti antiinflamasi, imunomodulator, antioksidan, dan antimikroba (Borshchev et al. 2022 ; D. Gao et al. 2021 ; Mulla et al. 2021 ). Kami menerapkan metabolomik untuk menambang bukti multimode untuk mengungkap kemungkinan aksi senyawa yang diperkaya fermentasi pada jalur fungsional utama. Kami selanjutnya menyelidiki efek substrat oat mentah, simbiotik, dan postbiotik dalam mengurangi cedera hati akibat HS dan disbakteriosis usus untuk memvalidasi manfaat produk oat. Penelitian kami menekankan bahwa mengonsumsi makanan oat yang berasal dari probiotik dapat menjadi strategi yang efektif untuk mengatasi gangguan metabolisme akibat gula tinggi.
2 Bahan dan Metode
2.1 Reagen dan Bahan Kimia
Strain probiotik, termasuk L. reuteri PB-LR09, L. plantarum (L. plantarum) HH-LP56, L. acidophilus (L. acidophilus) HH-LA26, L. rhamnosus (L. rhamnosus) BP-LR76, dan B. lactis (B. lactis) HH-BA68 disediakan oleh Mixianer Biotechnology Company (Shannxi, Tiongkok). Natrium sitrat, laktosa, dan protein whey dibeli dari Boyuan Food Ingredients Ltd. (Zhengzhou, Tiongkok). Folin-fenol dibeli dari Biotopped Life Sciences Co. Ltd. (Beijing, Tiongkok). Natrium karbonat, etanol, natrium nitrit, aluminium nitrat, natrium hidroksida, rutin, dan asam galat dibeli dari Tianli Chemical Reagent Co. Ltd. (Tianjin, Tiongkok). Sukrosa dibeli dari supermarket lokal (Xi’an, Tiongkok). Kit uji komersial untuk mengukur kolesterol total (TC, A111-1-1), trigliserida (TG, A110-1-1), alanine aminotransferase (ALT, C009-2-1), aspartate aminotransferase (AST, C010-2-1), malondialdehid (MDA, A003-1-2), glutation peroksidase (GSH-PX, A005-1-2), dan protein total (TP, A045-2-1) dibeli dari Nanjing Jiancheng Bioengineering Institute (Nanjing, Tiongkok). Peroxisome proliferator-activated receptor-alpha (PPAR-α) dan fatty acid transposase (FAT/CD36) dideteksi menggunakan kit ELISA (Shanghai Xinle Biotechnology Co. Ltd. Shanghai, Tiongkok). Glukometer komersial untuk pengukuran glukosa darah dibeli dari Sinocare (Hunan, Tiongkok).
2.2 Persiapan Sampel
Bahan oat yang dihidrolisis secara enzimatis digunakan sebagai substrat utama untuk memproduksi postbiotik dan sinbiotik berbasis oat, yang disediakan oleh Guobang Food & Beverage Ingredients Company (Xi’an, Tiongkok). Singkatnya, seluruh tepung oat dicampur secara menyeluruh dengan air keran (1:15 w: v), diaduk pada 15.000 rpm selama 1 menit, dan diinkubasi dalam penangas air 55°C selama 20 menit. Kemudian, 0,1% α -amilase tahan panas ditambahkan ke sampel, dan campuran dipertahankan pada suhu 80°C dalam penangas air selama 60 menit, diikuti dengan penambahan 0,1% enzim sakarifikasi tahan panas. Campuran yang dihasilkan kemudian diinkubasi pada suhu 60°C selama 70 menit tambahan. Setelah inkubasi, sampel yang dihidrolisis secara enzimatis menjalani pasteurisasi pada suhu 80°C selama 10 menit. Sampel dikeringkan beku untuk penyimpanan dan penggunaan fermentasi (Song et al. 2024 ).
Substrat untuk fermentasi probiotik meliputi tepung gandum yang dihidrolisis secara enzimatis dan dedak gandum (1:2, b: b). Substrat dicampur secara menyeluruh dengan air suling (1:10, m: v), diikuti dengan penambahan 3% (b: v) laktosa dan 1% (b: v) protein whey, dan dipasteurisasi pada suhu 70°C selama 30 menit dan didinginkan hingga suhu ruangan sebelum fermentasi. Substrat yang dipasteurisasi diinokulasi dengan bakteri probiotik yang tersedia secara komersial, termasuk L. reuteri PB-LR09, L. plantarum HH-LP56, L. acidophilus HH-LA26, L. rhamnosus BP-LR76, dan B. lactis HH-BA68, dengan dosis masing-masing 2 × 107 CFU /mL pada suhu 37°C selama 12 jam. Strain bakteri ini telah banyak digunakan dalam industri makanan karena sifat anti-inflamasi, imunomodulatori, antioksidan, dan antimikrobanya (Mårtensson et al. 2005 ). Pada akhir proses fermentasi, pH diukur menggunakan pH meter (Leici PHS25, Shanghai, Tiongkok). Produk fermentasi dipasteurisasi pada suhu 70°C selama 30 menit untuk menghasilkan bentuk postbiotik (Oat_PB). Bentuk sinbiotik (Oat_SB) mengandung gabungan substrat terpasteurisasi dan gabungan probiotik hidup pada dosis yang sama seperti di atas. Substrat oat terpasteurisasi dianggap sebagai kelompok Oat.
Setelah pasteurisasi, kandungan β -glukan dalam supernatan sampel ditentukan oleh kit komersial (Shanghai Fankew Company, LOT. NO.22050191 P, Shanghai, Tiongkok). Total kandungan fenol ditentukan menggunakan metode Folin-Ciocalteu dan total kandungan flavon diukur menggunakan metode kolorimetri AlCl3 ( Z. Wang et al. 2022 ). Total kandungan protein ditentukan menggunakan kit uji komersial. Total gula dan gula reduksi ditentukan menggunakan metode asam 3,5-dinitrosalisilat. Semua analisis dilakukan dalam rangkap tiga.
2.3 Kuantifikasi Asam Amino Bebas
Sampel yang tercampur rata (50 μL), 400 μL metanol asetonitril (1: 1, v/v), dan 50 μL larutan dengan standar internal 50 μm dicampur pada suhu 4°C dan diaduk selama 60 detik. Larutan campuran diendapkan pada suhu -20°C selama 1 jam untuk menghilangkan protein, kemudian disentrifugasi pada suhu 4°C pada 14.000 rcf. Kromatografi cair kinerja sangat tinggi (UHPLC, Agilent 1290, AS) yang dilengkapi dengan spektrometer massa (6500/5500 SCIEX/QTRAP, AS) digunakan. Fase gerak A adalah larutan amonium format 25 Mm 0,1% asam format; fase gerak B adalah larutan asetonitril format 0,1%. Gradiennya adalah 85% B selama 1 menit, dikurangi secara linear menjadi 50% dalam 10 menit, dipertahankan selama 1 menit pada 40%, dan ditingkatkan menjadi 75% dan dipertahankan selama 7 menit. Kondisi sumber ESI adalah: suhu sumber: 5005, Gas Sumber Ion1 (Gas1) sebagai 55, Gas Sumber Ion2 (Gas2) sebagai 50, gas tirai (CUR) sebagai 30, Tegangan Semprotan Ion Mengambang ± 4500 V. Pemindaian ion produk diperoleh menggunakan pemantauan reaksi berganda (Hussain et al. 2023 ). Pengukuran analitis dilakukan oleh Applied Protein Technology Biotechnology Company (Shanghai, Tiongkok).
2.4 Kuantifikasi Avenanthramides
Kami menerapkan metode ekstraksi berbantuan ultrasonik untuk memperoleh avenanthramides menurut metode yang dilaporkan sebelumnya (Călinoiu et al. 2019 ). Secara singkat, sampel yang tidak difermentasi dan difermentasi (20 mL) dikeringkan pada suhu 60°C selama 24 jam, digiling dalam penggiling listrik, dan dihilangkan lemaknya dengan heksana (rasio 1:5 b/v, 5 menit, tiga kali) pada suhu ruangan. Sampel yang dihilangkan lemaknya dikeringkan dengan udara pada suhu ruangan selama 24 jam, dan kemudian diekstraksi secara ultrasonik dengan 80% metanol pada rasio 1:5 (b/v) pada suhu 40°C selama 1 jam. Setelah sentrifugasi pada 2.000× g selama 10 menit, supernatan disaring dan dipekatkan hingga kering dengan rotary evaporator pada suhu 40°C. Ekstrak kering dilarutkan kembali dalam metanol (5 mL), disaring melalui filter jarum suntik 0,45 μm untuk analisis. Kuantifikasi avenantramid 2c, 2p, dan 2f dideteksi dengan menggunakan kromatografi cair kinerja tinggi (HPLC-DAD-ESI-MS, Agilent Technologies, Santa Clara, CA, AS). Pemisahan dilakukan pada 25°C pada XDB C18 (4,6 × 150 mm, 5 µm). Fase mobil ditunjukkan sebagai berikut: 0,1% asam asetat dalam air suling (v/v) (pelarut A) dan 0,1% asam asetat dalam asetonitril (v/v) (pelarut B). Elusi gradien (dinyatakan dalam % B) yang digunakan adalah: 0 menit, 5% B; 0–2 menit, 5% B; 2–18 menit, 5%–40% B; 18–20 menit, 40%–90% B; 20–24 menit; 90% B; 24–25 menit, 90%–5% B; 25–30 menit, 5% B. Sampel (25 μL) disuntikkan ke dalam kolom. Untuk fragmentasi MS, modul ESI (+) diterapkan, dengan rentang pemindaian antara 100 dan 1200 m/z, tegangan kapiler 3000 V, pada suhu 300°C, dan dengan aliran nitrogen 7 L/menit.
2.5 Metabolomik Berbasis UPLC-MS/MS dan Analisis Farmakologi Jaringan
Sampel (100 mg) dicampur dengan 1 mL metanol 70% dan dihancurkan dengan penggiling cepat sampel otomatis (jxfstprp-48, 70 Hz) selama 3 menit (Zhou et al. 2023 ). Setelah pendinginan, sampel disonikasi kriogenik (40 kHz) selama 10 menit, diikuti oleh sentrifus 12.000 rpm pada 4 °C selama 10 menit. Supernatan diencerkan 2–100 kali dan disaring melalui politetrafluoroetilen 0,22 μm. Profil metabolit Oat_PB dan Oat_SB dianalisis menggunakan LC-MS (Thermo, Ultimate 3000 LC, Q Exactive HF) dengan kolom C18 (Zorbax Eclipse C18, 1,8 μm × 2,1 mm × 100 mm). Suhu kolom dijaga pada 30 °C; laju alirnya adalah 0,3 mL/menit. Fase mobil A adalah larutan asam format 0,1%, sedangkan fase mobil B adalah asetonitril murni dalam mode positif dan negatif. Gradiennya adalah 95% A selama 2 menit dan berkurang secara linear menjadi 70% dalam 4 menit, dipertahankan selama 1 menit, dan berkurang menjadi 22% dalam 5 menit, dipertahankan selama 2 menit, dan berkurang menjadi 5% dalam 3 menit, dipertahankan selama 3 menit, dan kemudian meningkat menjadi 95% dalam 1 menit, dengan periode re-equilibrasi selama 4 menit. Mode pemindaian: pemindaian penuh (pemindaian penuh, m / z 100–1500) dan spektrometri massa bergantung data (dd-MS2, TopN = 10); resolusi: 120.000 (MS1) dan 60.000 (MS2). Disosiasi tumbukan berenergi tinggi diterapkan. Pengukuran analitis dilakukan oleh Beijing Tsingke Biotech Co. Ltd. (Beijing, Cina).
Metabolit diferensial antara Oat_PB dan Oat_SB ditentukan ( uji- t Student p < 0,05, dan perubahan lipat Oat_PB/Oat_SB ≥ 2). Basis data Farmakologi Sistem Pengobatan Tradisional Tiongkok ( https://old.tcmsp-e.com/tcmsp.php ), PharmMapper ( http://lilab-ecust.cn/pharmmapper/index.html ), dan Prediksi Target Swiss ( http://swisstargetprediction.ch/ ) digunakan untuk memprediksi target metabolit diferensial dengan organisme “Homo sapiens.” Target umum dinormalisasi ke simbol resmi menggunakan basis data UniProt ( https://www.uniprot.org/ ). Target gabungan diunggah ke Metascape ( https://metascape.org/gp/index.html#/main/step1 ) untuk analisis pengayaan Ensiklopedia Gen dan Genom Kyoto (KEGG). Target yang diperkaya pada jalur inti diunggah ke basis data STRING ( https://cn.string-db.org/ ) untuk analisis interaksi protein-protein (PPI). 20 target teratas disaring berdasarkan jaringan PPI menggunakan plugin CytoHubba dari cytoscape. Jaringan interaksi senyawa-target-jalur dibuat menggunakan cytoscape untuk memberikan informasi tentang interaksi antara senyawa aktif, target, dan jalur.
2.6 Percobaan Hewan
Tikus Sprague–Dawley (SD) jantan yang sehat (berusia 4 minggu) ditempatkan di Laboratory Animal Center, Shaanxi Normal University (Xi’an, Tiongkok). Mereka dipelihara dalam lingkungan yang konstan (siklus terang 12 jam-gelap 12 jam, 22°C ± 1°C, kelembapan relatif 55% ± 5%). Setelah seminggu aklimatisasi, tikus dibagi secara acak menjadi kelompok kontrol normal (NC, diet chow normal, n = 5) dan kelompok konsumsi HS (diet chow normal + air sukrosa 20%, n = 30) selama 8 minggu. Setelah itu, kecuali empat tikus yang masih diberi konsumsi HS, tikus yang tersisa dalam kelompok HS dibagi secara acak menjadi empat kelompok dan diberikan Oat, Oat_PB, Oat_SB, dan saline (RE) melalui gavage setiap hari dengan dosis 10 mL/kg tikus selama 4 minggu. Berat badan, asupan makanan, dan air dicatat. Pada akhir minggu ke-12, sampel feses dikumpulkan, dan tikus dibunuh setelah berpuasa semalaman. Serum dan jaringan dikumpulkan untuk dianalisis. Glukosa darah puasa diukur menggunakan glukometer. TC, TG, ALT, AST, GSH-PX, MDA, BUN, dan CRE dalam serum ditentukan menggunakan kit komersial sesuai dengan petunjuk.
2.7 Analisis Histologi
Jaringan hati dicuci dengan larutan penyangga fosfat dan difiksasi dengan larutan formalin 10%. Jaringan tersebut ditanamkan dalam parafin dan dipotong menjadi irisan jaringan dengan ketebalan 5 μm. Sampel diwarnai dengan hematoksilin dan eosin (H&E) dan difoto di bawah mikroskop optik untuk pengamatan morfologi umum (×50) (X. Zhang et al. 2020 ).
2.8 Analisis RT-qPCR
Ekspresi adenosine 5′-monophosphate-activated protein kinase (AMPK), nuclear factor-κB (NF-κB), PPAR-α, interleukin-10 (IL-10), sterol regulatory element-binding protein-1c (SREBP-1c), fatty acid synthase (FAS), stearoyl-CoA desaturase-1 (SCD-1), carnitine palmitoyltransferase (CPT-1) dan leptin (LEP) di hati ditentukan menggunakan RT-qPCR. Total RNA diekstraksi menggunakan M5 Universal RNA Mini Kit (Mei5bio, Beijing, Tiongkok). cDNA disintesis menggunakan M5 Super plus QPCR RT kit dengan gDNA remover (Mei5bio, Beijing, Tiongkok). 2× M5 HiPer STBR Premix EsTaq (dengan TIi RNaseH) (Mei5bio, Beijing, Tiongkok) digunakan untuk menentukan tingkat ekspresi mRNA. Urutan primer disajikan dalam Tabel S1 (dengan GAPDH sebagai gen referensi). Metode 2 −ΔΔCT digunakan untuk menghitung ekspresi relatif mRNA (Zhou et al. 2024 ).
2.9 Penilaian Profil Asam Lemak di Hati
Selain itu, 34 konsentrasi asam lemak, termasuk 6 asam lemak tak jenuh tunggal (MUFA), 13 asam lemak tak jenuh ganda (PUFA), dan 15 asam lemak jenuh (SFA) di hati, diukur secara akurat (Q. Wang et al. 2023 ). Sampel hati (30 mg) dicampur dengan 5 mL larutan diklorometana-metanol (2:1, v: v), diaduk, dan dicuci dengan 2 mL air. Lapisan bawah diambil dan dikeringkan dengan nitrogen. Residu kering dengan 2 mL heksana dan standar internal dicampur selama 0,5 jam metil-esterifikasi, kemudian 2 mL air ditambahkan. Singkatnya, 1000 μL supernatan dikeringkan dengan nitrogen. Heksana ditambahkan untuk melarutkan kembali sampel untuk deteksi. Sistem kromatografi gas kolom kapiler (Agilent 190915-433UI: HP-5 ms, 30 × 250 × 0,25 μm; Agilent, CA, AS) yang dilengkapi dengan spektrometer massa (Agilent 5977B MSD) digunakan. Suhu awal adalah 80°C dan meningkat menjadi 180°C pada 20°C/menit, dipertahankan selama 8 menit; kemudian meningkat menjadi 280°C pada 5°C/menit, dipertahankan selama 3 menit. Kondisi spektrometri massa adalah sebagai berikut: suhu masuk 280°C; suhu sumber ion 230°C; dan suhu saluran transmisi 250°C. Spektrometer massa menggunakan mode SCAN/SIM untuk akuisisi data dalam mode kejut elektronik 70 eV. Pengukuran analitis dilakukan oleh Applied Protein Technology Biotechnology Company (Shanghai, Tiongkok).
2.10 Analisis Mikrobiota Usus
Ekstraksi DNA dan sekuensing gen dilakukan oleh Applied Protein Technology (Shanghai, Tiongkok) (C. Wang et al. 2024 ). Secara khusus, metode cetyltrimethylammonium bromide digunakan untuk mengekstraksi DNA genom feses tikus. DNA yang diekstraksi diencerkan menjadi 1 ng/μL menggunakan air steril sesuai dengan konsentrasinya. Kualitas DNA ditentukan menggunakan elektroforesis gel agarosa 1%. Langkah-langkah reaksi berantai polimerase (PCR) ditetapkan sebagai berikut: denaturasi awal selama 1 menit pada suhu 98°C, diikuti oleh 30 siklus denaturasi selama 10 detik pada suhu 98°C, annealing selama 30 detik pada suhu 50°C, elongasi selama 60 detik pada suhu 72°C, dan akhirnya ekstensi selama 5 menit pada suhu 72°C. Produk PCR digabungkan dengan volume yang sama dari buffer pemuatan 1X (yang mengandung SYB green), dan gel agarosa 2% digunakan untuk deteksi. Pembacaan berpasangan dari fragmen DNA asli digabungkan menggunakan FLASH dan ditetapkan ke setiap sampel sesuai dengan kode batang unik. Analisis sekuens dilakukan menggunakan paket perangkat lunak UPARSE dengan algoritma UPARSE-OTU dan UPARSE-OUTref. Kelompok taksonomi OTU dilakukan pada tingkat kesamaan 97% untuk analisis selanjutnya.
2.11 Analisis Statistik
Semua analisis statistik dilakukan menggunakan R (V4.2.2). Semua percobaan dilakukan dalam rangkap tiga dan variabel kontinu dinyatakan sebagai mean ± SD (simpangan baku). Dalam analisis statistik kami, metabolit dan bakteri dengan lebih dari 80% nilai yang tercatat sebagai nol dikeluarkan dari set data untuk memastikan keandalan hasil. Setelah ini, analisis plot gunung berapi dilakukan untuk memvisualisasikan signifikansi dan besarnya perubahan kadar metabolit. Paket R “stats” digunakan untuk melakukan analisis komponen utama dan membandingkan metabolit dalam Oat_SB dan Oat_PB. Paket R ‘mixOmics’ digunakan untuk melakukan analisis diskriminasi kuadrat parsial jarang untuk menemukan perbedaan dalam komposisi mikrobiota usus antara kelompok (Reyrolle et al. 2022 ), paket “Mfuzz” dan Fuzzy C-Means Clustering diadopsi untuk mengelompokkan perubahan mikrobiota usus selama intervensi (Y. Gao et al. 2017 ). Uji- t siswa diterapkan untuk menilai perbedaan metabolit Oat_SB dan Oat_PB. Analisis varians dengan perbedaan signifikansi terkecil diterapkan untuk menilai signifikansi dampak dari berbagai intervensi. Selain itu, analisis korelasi spearman diterapkan untuk menunjukkan korelasi antara parameter sindrom metabolik, gen yang berhubungan dengan metabolisme lipid, tingkat ekspresi protein, komposisi asam lemak, dan mikroba usus. Jaringan korelasi dibuat menggunakan Cytoscape.
3 Hasil
3.1 Konstitusi Kimia Produk Oat yang Berasal dari Probiotik
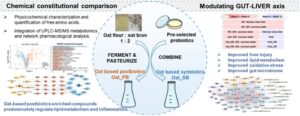
Oat_SB mengandung bakteri hidup, termasuk L. reuteri PB-LR09, L. plantarum HH-LP56, L. acidophilus HH-LA26, L. rhamnosus BP-LR76, dan B. lactis HH-BA68, dengan dosis masing-masing 2 × 107 CFU /mL. Dibandingkan dengan Oat_SB, Oat_PB (mengandung probiotik yang diinaktivasi panas) memiliki pH yang lebih rendah (Gambar 1A ), total fenol (Gambar 1B , perubahan lipat Oat_PB/Oat_SB = 0,64), total flavon (Gambar 1C , perubahan lipat Oat_PB/Oat_SB = 0,43), total protein (Gambar 1D , perubahan lipat Oat_PB/Oat_SB = 0,74) dan total gula (perubahan lipat Oat_PB/Oat_SB = 0,78), sementara memiliki peningkatan kadar β -glukan (Gambar 1F , perubahan lipat Oat_PB/Oat_SB = 1,34), avenantramid 2c, 2p dan 2f (Gambar 1G–I , perubahan lipat Oat_PB/Oat_SB = 1,67, 1,54, 1,18, berturut-turut), serta gula pereduksi (Gambar 1J) . , lipat perubahan Oat_PB/Oat_SB = 1,24). Kami mengukur konsentrasi 29 asam amino bebas dalam Oat_SB dan Oat_PB (Tabel 1 ). Oat_PB sangat memperkaya asam amino esensial treonin dan valin (FC = 1,35 dan 1,59, p < 0,05, berturut-turut), serta arginin, asparagin, aspartat, sitrulin, ornitin, prolin, dan taurin. Sebaliknya, konsentrasi asam amino esensial isoleusin, leusin, lisin, metionin, fenilalanin, dan triptofan yang lebih rendah ditemukan dalam Oat_PB daripada yang ada dalam Oat_SB. Selain itu, kami tidak mengamati perbedaan dalam konsentrasi glutamat.
| Asam amino | Postbiotik berbahan dasar gandum | Sinbiotik berbahan dasar gandum | Makna |
|---|---|---|---|
| Alanin/sarkosin | 83,32 ± 1,62 | 131,86 ± 4,49 | ** |
| Asam aminoadipat | 4,90 ± 0,11 | 6,39 ± 0,33 | ** |
| Arginin | 35,66 ± 0,80 | 6,03 ± 0,22 | ** |
| Asparagin | 375,97 ± 8,37 | 133,13 ± 1,83 | ** |
| Aspartat | 194,23 ± 7,74 | 137,25 ± 3,15 | ** |
| Kolin | 5627,17 ± 283,39 | 6896,01 ± 47,68 | ** |
| Sitrulin | 103,59 ± 2,79 | 27,14 ± 0,45 | ** |
| Kreatin | 17,79 ± 0,45 | 54,83 ± 0,22 | ** |
| Kreatinin | 6,94 ± 0,17 | 27,56 ± 0,33 | ** |
| Sistein | 0,13 ± 0,05 | 0,34 ± 0,04 | ** |
| Sistin | 1,09 ± 0,08 | 1,29 ± 0,07 | ** |
| Glutamat | 468,99 ± 28,44 | 515,93 ± 15,63 | NS |
| Glutamin | 1,64 ± 0,18 | 13,34 ± 0,38 | ** |
| Glisin | 49,27 ± 1,92 | 101,55 ± 8,45 | ** |
| Histidin | 79,17 ± 2,45 | 138,42 ± 6,15 | ** |
| Hidroksiprolin | 2,09 ± 0,14 | 2,78 ± 0,14 | ** |
| Isoleusin | 14,76 ± 0,97 | 34,21 ± 0,78 | ** |
| Leusin | 28,84 ± 0,34 | 43,52 ± 1,04 | ** |
| Lisin | 3,70 ± 0,17 | 28,60 ± 0,51 | ** |
| Metionina | 0,39 ± 0,00 | 2,43 ± 0,13 | ** |
| Ornitin | 31,23 ± 2,29 | 2,55 ± 0,44 | ** |
| Fenilalanin | 3,12 ± 0,15 | 21,45 ± 0,31 | ** |
| Prolin | 99,87 ± 0,92 | 87,43 ± 2,72 | ** |
| Serin | 43,83 ± 2,20 | 64,96 ± 3,07 | ** |
| taurin | 2,09 ± 0,21 | 1,12 ± 0,01 | ** |
| Treonin | 67,87 ± 1,65 | 50,74 ± 0,55 | ** |
| Triptofan | 25,34 ± 0,35 | 37,33 ± 1,67 | ** |
| Tirosin | 5,20 ± 0,42 | 28,42 ± 0,44 | ** |
| Valin | 107,97 ± 3,71 | 67,86 ± 1,97 | ** |
Catatan: Nilai adalah rata-rata ± simpangan baku ( n = 3). Singkatan: NS, tidak ada perbedaan signifikan yang diamati melalui uji- t Student . ** p <0,01.
3.2 Profil Metabolit dan Analisis Farmakologi Jaringan
Sebanyak 725 metabolit diidentifikasi oleh metabolomik UPLC-MSMS (Tabel S2 ). Perbedaan substansial dalam profil metabolit antara Oat_PB dan Oat_SB diamati (Gambar 1K ). Fermentasi meningkatkan 110 metabolit termasuk berbagai zat aktif dengan fungsi fisiologis, seperti karbohidrat dan turunannya ( n = 11), glikosida ( n = 10), lipid ( n = 9), flavonoid ( n = 6). Di antara mereka, glutamilprolin, asam indol-3-laktat, asam indol-3-propanoat, asam homovanilat, genistein, asam galat, katekol, kaempferol dan asam laktat setidaknya lima kali lebih tinggi dalam Oat_PB daripada dalam Oat_SB (Gambar 1L ), yang telah menunjukkan sifat anti-inflamasi, antioksidan dan anti-hiperglikemia (Chua 2013 ; Sharifi-Rad et al. 2021 ; Q. Zhang et al. 2023 ).
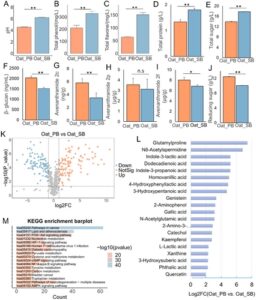
Metabolit yang diperkaya Oat_PB ( n = 110) dikenakan analisis farmakologis jaringan, dan 383 gen target diidentifikasi, yang terlibat dalam kanker, lipid dan aterosklerosis, PI3K-Akt, HIF-1, serta metabolisme tirosin dan metabolisme triptofan (Gambar 1M ). Analisis jaringan PPI dilakukan untuk menyelidiki target inti oleh basis data STRING dan menganalisis hubungan antara target yang diprediksi basis data dan target yang melibatkan jalur KEGG (Gambar 2A ). 20 target teratas, termasuk AKT1, GRB2, RAC1, TP53, HSP90AA1, dan RHOH, disaring berdasarkan jaringan PPI (Gambar 2B ), yang terutama terkait dengan asam 4-hidroksifenilaktatik, sitrulin, asam dodekadienoat, gamma-aminobutirat, genistein, glutamilprolin, guanosin, asam galat, dan kaempferol. Gambar 2C menggambarkan jaringan jalur target-senyawa dan mekanisme biologis penting dari genistein, asam galat, dan kaempferol pada metabolisme lipid abnormal dan respons inflamasi.
Selain itu, proses fermentasi menurunkan kandungan 107 metabolit, terutama termasuk asam amino dan turunannya (misalnya, asam 2-aminopalmitic, valylglycyl-leucine, valylvaline, metionine, threonylleucine, isoleucylglutamate, dan isoleucylisoleucine), serta fosforilkolin, indole-3-karboksaldehida, triptofan, dan asam linoleat, yang lebih rendah dalam Oat_PB dibandingkan dalam Oat_SB (Tabel S2 ).
3.3 Mengurangi Efek Produk Oat yang Berasal dari Probiotik terhadap Obesitas dan Kerusakan Hati yang Disebabkan oleh Konsumsi HS
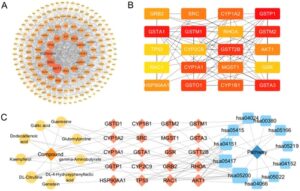
Kami menyelidiki efek pengurangan oat, Oat_PB, dan Oat_SB pada gangguan metabolik yang diinduksi HS (Gambar 3A ). Seperti yang digambarkan dalam Gambar 3B , konsumsi HS menghasilkan berat badan lebih dari 35,9% lebih tinggi pada tikus daripada kelompok NC ( p < 0,05) setelah pemberian 8 minggu, yang menunjukkan keberhasilan pembentukan model. Intervensi 4 minggu Oat, Oat_SB, dan Oat_PB mengurangi berat badan, glukosa darah puasa, dan kadar serum TG, AST, ALT, dan MDA (Gambar 3C–H ). Selain itu, Oat_SB dan Oat_PB menurunkan regulasi TC serum sambil meningkatkan aktivitas T-SOD (Gambar 3I–J ). Khususnya, dibandingkan dengan Oat dan Oat_SB, Oat_PB menunjukkan efek yang lebih unggul dalam membalikkan perubahan abnormal yang disebabkan HS pada glukosa darah puasa, TC, dan T-SOD, dan secara unik menyebabkan peningkatan signifikan dalam GSH-PX (Gambar 3K ) dan pengurangan kreatin serum (Gambar 3L ).
Hasil histopatologi menunjukkan bahwa oat, Oat_PB, dan Oat_SB melindungi akumulasi abnormal yang disebabkan oleh konsumsi HS dalam tetesan lipid dan vakuola lemak sampel hati (Gambar 3M ), dengan Oat_PB menunjukkan efek yang paling signifikan. Selain itu, kami menemukan bahwa menghentikan konsumsi HS itu sendiri (yaitu, tikus dalam kelompok RE) menurunkan berat badan, glukosa darah puasa, dan kadar MDA, tetapi tidak berdampak pada indikator biokimia lainnya. Aktivitas T-SOD bahkan ditemukan lebih rendah dalam RE dibandingkan dengan kelompok HS.
3.4 Produk Oat yang Berasal dari Probiotik Meringankan Metabolisme Asam Lemak yang Terganggu oleh HS
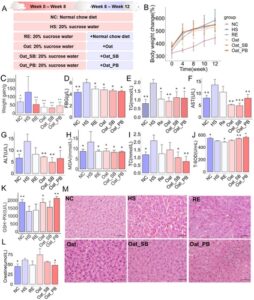
Untuk menyelidiki lebih lanjut mekanisme yang mendasari penghambatan lipogenesis, kami menilai ekspresi gen di hati yang terlibat dalam metabolisme asam lemak dan respons inflamasi. HS secara signifikan meningkatkan level ekspresi mRNA AMPK, PPAR-α, NF-κB, FAS, SREBP-1c, dan SCD-1, sedangkan menurunkan regulasi IL-10 dibandingkan dengan NC, sehingga memulihkan dengan pemberian Oat, Oat_SB, atau Oat_PB selama 4 minggu (Gambar 4A,B ). Hasil ekspresi protein FAT dan PPAR-α menunjukkan bahwa Oat_PB secara signifikan meningkatkan fungsi transpor asam lemak (Gambar 4C,D ). Tidak ada perbedaan signifikan pada semua gen yang diukur antara Oat_SB dan Oat_PB yang diamati. RE juga meringankan dislipidemia yang diinduksi HS sampai batas tertentu, tetapi efek ini kurang efektif dibandingkan produk oat.
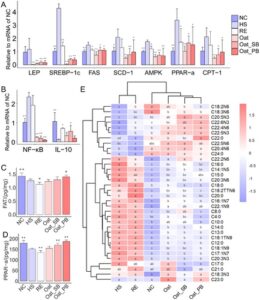
Kami mengukur 13 PUFA, 6 MUFA, dan 15 SFA di hati tikus (Gambar 4E , Tabel 2 ). HS meningkatkan kadar MUFA dan sebagian besar SFA, kecuali metil behenat (C22:0), metil trikosat (C23:0), dan metil tetrakosanoat (C24:0). Untuk PUFA, HS secara signifikan menurunkan kadar metil linoleat (C18:2N6) (LA), metil γ-linolenat (C18:3N6) (GLA), metil arakidonat (C20:4N6) (ARA), metil ester asam cis-5,8,11,14,17-eicosapentaenoic (C20:5N3) (EPA), metil dokosatetraenoat (C22:4N6), metil dokosapentaenoat (C22:5N6), metil dokosapentaenoat (C22:5N3) (DPA), dan metil ester asam cis-4,7,10,13,16,19-docosahexaenoic (C22:6N3) (DHA), dibandingkan dengan kelompok NC. Oat, Oat_SB, dan Oat_PB secara signifikan membalikkan penurunan PUFA yang disebabkan HS sekaligus meningkatkan MUFA dan SFA. Oat_PB khususnya menghasilkan kadar metil docosatetraenoate (C22:4N6), DPA (C22:5N3), dan DHA (C22:6N3) yang lebih tinggi daripada Oat dan Oat_SB. RE menunjukkan peningkatan kandungan asam lemak hati hingga beberapa kandungan, tetapi tidak sebanyak Oat, Oat_SB, dan Oat_PB.
| Asam lemak | NC | SMA | ULANG | Haver | Gandum_SB | Gandum_PB | Makna |
|---|---|---|---|---|---|---|---|
| Metil butirat (C4:0) | 0,38 ± 0,01 satu | 0,22 ± 0,01 detik | 0,27 ± 0,01 miliar | 0,21 ± 0,00c | 0,26 ± 0,03 miliar | 0,35 ± 0,05 per menit | ** |
| Metil oktanoat (C8:0) | 0,18 ± 0,01 satu | 0,04 ± 0,02 b | 0,07 ± 0,05 b | 0,05 ± 0,01 b | 0,13 ± 0,03 satu | 0,18 ± 0,04 satu | ** |
| Metil dekanoat (C10:0) | 0,13 ± 0,01 pon | 0,02 ± 0,01 | 0,08 ± 0,02 SM | 0,03 ± 0,02 detik | 0,07 ± 0,02 cd | 0,13 ± 0,05 satu | ** |
| Metil dodekanoat (C12:0) | 4,83 ± 0,88 per menit | 0,15 ± 0,01c | 1,85 ± 0,68 miliar | 1,81 ± 1,01 miliar | 1,51 ± 0,34 miliar | 4,80 ± 0,99 per menit | ** |
| Metil tridecanoate (C13:0) | 0,44 ± 0,03 satu | 0,04 ± 0,01c | 0,22 ± 0,06 miliar | 0,19 ± 0,01b | 0,19 ± 0,04 miliar | 0,41 ± 0,08 satu | ** |
| Metil miristat (C14:0) | 410,41 ± 37,00 per tahun | 12,94 ± 1,05 hari | 189,58 ± 32,38 SM | 242,89 ± 7,14 miliar | 163,01 ± 23,07 detik | 466,86 ± 89,17 tahun | ** |
| Metil miristoleat (C14:1N5) | 61,70 ± 9,29 per menit | 8,37 ± 0,18 hari | 20,62 ± 5,87 detik | 20,73 ± 6,66 detik | 28,52 ± 1,57 detik | 49,48 ± 2,10 miliar | ** |
| Metil pentadekanoat (C15:0) | 56,18 ± 3,31 detik | 24,13 ± 4,08 hari | 33,53 ± 8,06 kDa | 39,77 ± 4,42 SM | 36,82 ± 5,90 SM | 47,18 ± 12,18 inci | ** |
| Metil palmitat (C16:0) | 8192,94 ± 444,72 tahun | 3607,40 ± 398,96 hari | 4851,70 ± 1441,33 bcd | 4235,47 ± 228,40 kd | 5448,61 ± 454,42 SM | 5781,80 ± 928,79 miliar | ** |
| Metil palmitoleat (C16:1N7) | 3117,58 ± 117,85 miliar | 106,26 ± 18,01 hari | 2203,31 ± 150,55 detik | 1555,36 ± 157,44 hari | 2000,16 ± 119,27 kd | 3636,56 ± 591,19 tahun | ** |
| Metil heptadekanoat (C17:0) | 63,95 ± 3,48 jam | 49,49 ± 3,26 detik | 59,42 ± 10,99 inci | 43,79 ± 1,89 detik | 44,47 ± 4,06 detik | 52,68 ± 2,87 SM | ** |
| Metil cis-10-heptadecenoate (C17:1N7) | 141,95 ± 31,26 jam | 4,10 ± 0,49 hari | 23,10 ± 3,70 kd | 37,91 ± 8,42 detik | 18,87 ± 1,41 kDa | 106,38 ± 6,67 miliar | ** |
| Metil stearat (C18:0) | 3667,66 ± 365,26 satu | 2806,19 ± 86,70 miliar | 2950,47 ± 254,65 miliar | 2594,28 ± 173,70 miliar | 2624,89 ± 308,72 miliar | 4024,47 ± 59,81 satuan | ** |
| Metil elaidat (C18:1TN9) | 48,34 ± 6,28 jam | 14,44 ± 0,89 detik | 27,16 ± 5,49 miliar | 24,66 ± 1,41 SM | 27,43 ± 2,17 miliar | 51,95 ± 15,04 per jam | ** |
| Metil oleat (C18:1N9) | 9603,92 ± 1707,86 per tahun | 889,78 ± 109,56 detik | 3398,79 ± 506,30 miliar | 3881,55 ± 706,30 miliar | 2978,51 ± 641,41 miliar | 9273,60 ± 1577,92 tahun | ** |
| Metil linoleat (C18:2TTN6) | 19,90 ± 2,50 miliar | 2,95 ± 1,06 hari | 12,99 ± 2,00 sen | 8,62 ± 0,75 kDa | 12,19 ± 2,70 detik | 29,19 ± 8,27 jam | ** |
| Metil linoleat (C18:2N6) | 2436,28 ± 387,76 hari | 5379,62 ± 186,13 tahun | 4431,20 ± 612,29 miliar | 3516,67 ± 341,11 detik | 4166,77 ± 175,98 SM | 4167,58 ± 316,44 SM | ** |
| Metil γ-linolenat (C18:3N6) | 17,94 ± 4,84 hari | 107,66 ± 23,61 jam | 55,39 ± 1,64 SM | 61,27 ± 7,60 miliar | 65,26 ± 5,72 miliar | 41,78 ± 6,80 detik | ** |
| Metil linolenat (C18:3N3) | 58,28 ± 2,47 menit | 25,69 ± 12,47 miliar | 63,11 ± 6,36 jam | 60,91 ± 8,04 jam | 50,75 ± 9,99 per bulan | 62,67 ± 10,06 per menit | ** |
| Metil arakidat (C20:0) | 10,96 ± 2,32 miliar | 5,84 ± 0,79 detik | 7,48 ± 1,65 detik | 6,40 ± 1,31 detik | 8,18 ± 0,80 SM | 16,45 ± 2,64 jam | ** |
| Metil heneikosanoat (C21:0) | 0,11 ± 0,02 abjad | 0,09 ± 0,01 SM | 0,12 ± 0,03 pon | 0,09 ± 0,00 abjad | 0,07 ± 0,03 detik | 0,13 ± 0,01 satu | * |
| metil ester asam eikosatrienoat cis-8,11,14 (C20:3N6) | 458,43 ± 18,46 per tahun | 101,72 ± 13,05 hari | 210,95 ± 73,26 detik | 227,18 ± 55,13 detik | 212,40 ± 45,92 detik | 311,57 ± 14,26 miliar | ** |
| Metil arakidonat (C20:4N6) | 2503,52 ± 12,47 detik | 3295,92 ± 116,79 inci | 3393,43 ± 129,67 tahun | 3104,06 ± 227,69 miliar | 3415,35 ± 254,73 tahun | 2077,81 ± 62,91 hari | ** |
| cis-11,14,17-Eicosatrienoic asam metil ester (C20:3N3) | 77,99 ± 4,75 per bulan | 20,99 ± 0,33 miliar | 28,03 ± 4,84 miliar | 29,33 ± 3,03 miliar | 23,00 ± 2,31 miliar | 81,39 ± 8,53 per menit | ** |
| Metil behenat (C22:0) | 1,06 ± 0,02 detik | 1,40 ± 0,09 miliar | 1,39 ± 0,13 miliar | 1,76 ± 0,02 satuan | 1,17 ± 0,14 detik | 0,82 ± 0,17 hari | ** |
| cis-5,8,11,14,17-Eicosapentaenoic asam metil ester (C20:5N3) | 40,65 ± 7,29 hari | 68,23 ± 3,44 kDa | 86,23 ± 18,94 SM | 111,60 ± 5,82 inci | 125,51 ± 27,26 jam | 59,54 ± 16,47 kd | ** |
| Metil erukat (C22:1N9) | 2,68 ± 0,27 per menit | 0,69 ± 0,11 detik | 1,86 ± 0,82 miliar | 1,80 ± 0,10 miliar | 1,70 ± 0,19 miliar | 2,37 ± 0,51 inci | ** |
| metil ester asam dokosadienoat cis-13,16 (C22:2N6) | 0,88 ± 0,09 | 0,50 ± 0,22 | 0,63 ± 0,02 | 0,75 ± 0,07 | 0,80 ± 0,15 | 0,76 ± 0,27 | NS |
| Metil trikosanoat (C23:0) | 0,32 ± 0,05 miliar | 0,33 ± 0,07 miliar | 0,55 ± 0,19 per menit | 0,49 ± 0,04 ab | 0,36 ± 0,06 miliar | 0,34 ± 0,05 miliar | * |
| Metil dokosatetraenoat (C22:4N6) | 35,40 ± 4,85 detik | 75,32 ± 3,43 miliar | 106,36 ± 5,59 detik | 120,21 ± 8,12 jam | 113,67 ± 8,69 per menit | 79,21 ± 15,58 miliar | ** |
| Metil dokosapentaenoat (C22:5N6) | 22,76 ± 1,96 detik | 38,32 ± 8,81 miliar | 52,20 ± 14,69 inci | 44,25 ± 3,25 inci | 53,99 ± 6,00 per bulan | 18,17 ± 6,74 detik | ** |
| Metil tetrakosanoat (C24:0) | 1,26 ± 0,08 | 1,70 ± 0,03 | 1,67 ± 0,27 | 1,54 ± 0,37 | 1,57 ± 0,28 | 1,15 ± 0,19 | NS |
| Metil dokosapentaenoat (C22:5N3) | 60,21 ± 9,56 detik | 149,24 ± 39,57 miliar | 212,51 ± 16,87 jam | 224,48 ± 23,65 jam | 216,95 ± 21,71 tahun | 130,70 ± 10,45 miliar | ** |
| cis-4,7,10,13,16,19-Metil ester asam dokosaheksaenoat (C22:6N3) | 546,21 ± 51,13 detik | 973,30 ± 52,76 miliar | 1030,87 ± 3,41 miliar | 1291,17 ± 103,75 tahun | 1240,89 ± 104,73 tahun | 924,82 ± 101,25 miliar | ** |
Catatan: Nilai adalah rata-rata ± simpangan baku ( n = 4). Nilai dengan huruf yang berbeda menunjukkan signifikansi statistik ( p < 0,05) sebagaimana ditentukan oleh analisis ANOVA dengan uji LSD. Singkatan: HS, diet dengan konsumsi sukrosa tinggi; NC, diet normal; NS, tidak ditemukan perbedaan signifikan; Oat, konsumsi sukrosa tinggi selama 8 minggu diikuti diet tepung oat dan dedak oat selama 4 minggu; Oat_PB, konsumsi sukrosa tinggi selama 8 minggu diikuti diet postbiotik berbahan oat selama 4 minggu; Oat_SB, konsumsi sukrosa tinggi selama 8 minggu diikuti diet sinbiotik berbahan oat selama 4 minggu; RE, konsumsi sukrosa tinggi selama 8 minggu diikuti diet normal selama 4 minggu. * nilai p < 0,05 ** p <0,01.
3.5 Produk Oat yang Berasal dari Probiotik Memperbaiki Mikrobioma Usus yang Terganggu HS
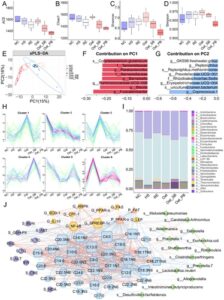
Kami tidak mengamati perbedaan signifikan dalam keanekaragaman mikrobiota usus antara HS dan NC, tetapi Oat_PB mengurangi α -keragaman mikrobiota usus, sebagaimana dibuktikan oleh indeks ACE, Chao1, Shannon, dan Simpson yang lebih rendah dibandingkan dengan tikus HS (Gambar 5A–D ). Konsumsi HS dan produk oat menyebabkan struktur mikroba berbeda yang terpisah dari tikus yang diberi makan makanan normal (Gambar 5E ). Kontributor utama PC1 dan PC2 adalah Fusicatenibacter , Blautia , Ruminococcaceae UCG-008 dan Coprococcus 1, bakteri rumen yang tidak dikultur dan Erysipelotrichaceae UCG-004, masing-masing (Gambar 5F–G ). Kami menguji perbedaan dalam kelompok taksonomi dan OTU tunggal untuk menyelidiki apakah perbedaan yang diamati pada tingkat keanekaragaman dikaitkan dengan perubahan pada mikroba tertentu. Analisis pengelompokan tren menghasilkan enam kluster berbeda yang mencerminkan perubahan pola dalam kelimpahan relatif respons mikrobiota usus terhadap perlakuan yang berbeda (Gambar 5H ). Firmicutes, Bacteroidetes, Spirochetes, dan Patescibacteria mendominasi struktur mikrobiota usus pada tingkat filum (Gambar 5I ). Dubosiella dan Alloprevotella berkurang secara signifikan, sementara Shuttleworthia meningkat oleh HS pada tingkat genus. Oat_PB secara signifikan meningkatkan kekayaan relatif Prevotella 1, Akkermansia , Candidatus Arthromitus , dan Alloprevotella pada tikus yang diberi HS sambil mengurangi Romboutsia dan Shuttleworthia . Akkermansia , Prevotella 1, Prevotella 7, dan Candidatus Arthromitus ditugaskan dalam klaster 1, yang sebagian besar dikumpulkan dalam kelompok Oat dan Oat_PB, sementara Klebsiella dan Shuttleworthia berlimpah dalam HS. Pada tingkat spesies, kekayaan relatif Klebsiella pneumonia terutama ditingkatkan oleh HS dan dipulihkan oleh produk oat (Gambar S1 ).
3.6 Hubungan Kuat Antara Indeks Biokimia Terkait Efektivitas Hepatoprotektif, Mikrobiota Usus, dan Asam Lemak Diferensial Hepatik
Kami menentukan korelasi signifikan antara perubahan yang diinduksi produk oat yang berasal dari probiotik dalam parameter biokimia, asam lemak di hati, senyawa utama yang terlibat dalam metabolisme lipid, dan kelimpahan mikrobiota usus tertentu. Misalnya, Prevotella -1 berkorelasi positif dengan konsentrasi PUFA di hati, termasuk DHA, EPA, metil docosatetraenoate (C22:4N6), dan metil docosapentaenoate (C22:5N3), sementara berkorelasi negatif dengan ekspresi gen NF-κB, LEP, dan SREBP-1c. Dubosiella dan Romboutsia menunjukkan korelasi negatif dengan MUFA dan gen terkait lipogenesis. Akkermansia berkorelasi negatif dengan kadar TC dan ALT serum, serta ekspresi NF-κB di hati (Gambar 5J ). Secara keseluruhan, manfaat penyembuhan dari khasiat hepatoprotektif dikaitkan dengan modulasi mikrobiota usus dan jalur metabolisme melalui pengaruh perubahan genera dan metabolit ini.
4 Diskusi
Oat banyak dikonsumsi karena manfaat multifungsinya untuk peningkatan kesehatan (Rasane et al. 2015 ). Meskipun beberapa penelitian melaporkan dampak fermentasi probiotik pada nutrisi oat yang memberikan manfaat kesehatan, profil kimia terperinci dan fungsionalitas biologis oat, sinbiotik berbasis oat, dan postbiotik, sejauh pengetahuan kami, belum banyak dibandingkan. Hal baru dari penelitian ini mencakup pengembangan postbiotik berbasis oat dan perbandingan terperinci antara profil kimia dari postbiotik berbasis oat yang dikembangkan dan bentuk sinbiotiknya, dengan fokus khusus pada identifikasi atribut fungsional menggunakan farmakologi jaringan. Temuan kami juga menunjukkan nilai tambah dari sinbiotik dan postbiotik berbasis oat dalam mengurangi cedera hati akibat konsumsi HS, dislipidemia, dan disbakteriosis usus di luar asupan oat, yang menunjukkan potensi besar mereka untuk menjadi makanan fungsional dalam memerangi penyakit kronis yang disebabkan oleh pola makan tidak sehat dan meningkatkan kesehatan manusia.
Probiotik, terutama Lactobacillus dan Bifidobacterium , meningkatkan homeostasis metabolik dan fungsi intestinal melalui kompetisi niche dan produksi berbagai metabolit (Schroeder et al. 2018 ; van Baarlen et al. 2013 ). Fermentasi probiotik merupakan teknik efektif untuk meningkatkan bioavailabilitas zat bioaktif dalam sereal (Singh et al. 2015 ). Studi kami menunjukkan bahwa makanan postbiotik berupa tepung gandum dan dedak gandum yang difermentasi dengan L. reuteri, L. plantarum, L. acidophilus, L. rhamnosus , dan B. lactis mengurangi kandungan fenolik dan flavonoid total tetapi memperkaya β -glukan dan avenanthramides (2c, 2f). Temuan yang sama dilaporkan dalam karya terbaru yang difokuskan pada minuman gandum yang difermentasi oleh L. rhamnosus , L. gasseri , dan B. breve , yang menunjukkan bahwa aktivitas enzim mikroba dapat membantu melepaskan fenol yang terikat, menghasilkan peningkatan yang sederhana dalam avenamide 2c dan bioaksesibilitas senyawa fenolik (Bai et al. 2021 ). Dalam studi serupa menunjukkan variasi rendah dalam kandungan β -glukan dalam gandum yang difermentasi oleh bakteri, mempertahankan kekuatan prebiotiknya (Akan et al. 2023 ; Bocchi et al. 2021 ). Khususnya, Oat_PB, yang mengandung L. reuteri , L. plantarum , L. acidophilus , L. rhamnosus, dan B. lactis yang diinaktivasi dengan panas , menunjukkan kandungan protein total yang lebih rendah dibandingkan dengan Oat_SB, formulasi sinbiotik yang terdiri dari strain probiotik yang sama dalam bentuk yang layak. Pengamatan ini sejalan dengan temuan kami tentang penurunan pH, total gula, dan kandungan fenol total dalam Oat_PB. Banyak penelitian telah menunjukkan bahwa protein sensitif terhadap lingkungan asam, yang dapat menyebabkan denaturasi (Eazhumalai et al. 2023 ; Gupta et al. 2020 ; Witkowski et al. 2018 ). Denaturasi ini terutama disebabkan oleh perubahan muatan rantai samping asam amino, terutama yang memiliki gugus asam atau basa pada pH4 (Bose et al. 2017 ). Selain itu, selama fermentasi dalam Oat_PB, gula dan senyawa fenolik yang diproduksi oleh strain mikroba dapat terlibat dalam reaksi kovalen, seperti glikosilasi (Eichler 2019 ; Q. Zhang et al. 2019 ), dengan protein.
Selain itu, kami menemukan bahwa fermentasi probiotik meningkatkan gula pereduksi dan asam amino esensial tertentu, mungkin karena pemanfaatan polisakarida dan protein yang dipromosikan oleh strain fermentasi, konsisten dengan penelitian sebelumnya yang menunjukkan fermentasi meningkatkan kandungan asam amino bebas dan nilai gizi (Hwang et al. 2021 ). Valin adalah asam amino rantai cabang esensial yang terkait dengan asupan dan pertumbuhan makanan hewani (Jian et al. 2021 ). Ornitin dan arginin telah dikaitkan dengan laju fraksional sintesis protein otak (Suzumura et al. 2015 ), yang penting untuk pertumbuhan dan perkembangan hewan. Selain itu, fermentasi secara drastis meningkatkan banyak metabolit, terutama genistein, asam indol-3-laktat, gamma-aminobutirat, asam galat, dan kaempferol, dibandingkan dengan sinbiotik. Konsisten dengan analisis farmakologis jaringan kami, genistein adalah isoflavon untuk menggugurkan jalur lipogenesis de novo melalui penekanan aktivasi SREBP-1c dan SCD-1 (Qin et al. 2021 ). Asam galat dan kaempferol dapat mengurangi respons peradangan imun dan melindungi hati melalui berbagai mekanisme antioksidan dan antiapoptotik, yang dianggap sebagai agen kanker (Bai et al. 2021 ; Xiao et al. 2022 ). Secara kolektif, kami membandingkan unsur kimia dari Oat_PB yang inovatif dengan sinbiotik berbasis oat dan menemukan potensinya yang besar dalam meningkatkan stres oksidatif dan metabolisme lipid melalui analisis farmakologis jaringan.
Studi eksperimental telah menunjukkan bahwa konsumsi HS mendorong penyakit metabolik, seperti stres oksidatif, inflamasi, resistensi insulin, dan hiperglikemia (Calcaterra et al. 2023 ; Hannou et al. 2018 ), konsisten dengan temuan kami. Akumulasi lipid hati merupakan hasil dari kombinasi peningkatan lipogenesis de novo hati, esterifikasi asam lemak preformed yang berasal dari makanan atau simpanan adiposa, penurunan sekresi lipoprotein densitas sangat rendah, dan penurunan oksidasi asam lemak hati (Hannou et al. 2018 ). Leptin, hormon yang diproduksi dan disekresikan oleh jaringan adiposa yang berhubungan langsung dengan obesitas, resistensi insulin, dan hiperlipemia, meningkat pada subjek obesitas, yang mencerminkan keadaan resistensi leptin (Izquierdo et al. 2019 ). mengungkapkan bahwa pensinyalan AMPKα/STAT3 yang dimediasi leptin sangat penting untuk perubahan hubungan silang mikrobiota-lemak pada obesitas yang disebabkan oleh pola makan (Xu et al. 2020 ). SREBP-1c, SCD-1, dan FAS adalah faktor transkripsi utama dalam regulasi transkripsi lipogenesis de novo dan dalam jalur biosintesis asam lemak, yang juga dapat mengatur β -oksidasi asam lemak melalui ACC dan CPT-1 (Hannou et al. 2018 ). Selain itu, PPAR-α diekspresikan secara melimpah di hati dan mengatur metabolisme asam lemak dan β -oksidasi asam lemak (Xu et al. 2020 ). Sebagai kesimpulan, konsumsi HS sangat memengaruhi gen terkait lipogenesis dan β -oksidasi asam lemak , sehingga menyebabkan dislipidemia.
Selain itu, kami menemukan peningkatan MUFA dan SFA serta penurunan PUFA dalam HS, bertepatan dengan temuan sebelumnya pada tikus yang diberi diet tinggi lemak/tinggi gula (Nagumalli et al. 2022 ), dan dibalikkan oleh produk oat yang berasal dari probiotik, yang selanjutnya mendukung manfaat hepatoprotektifnya, khususnya, postbiotik berbasis oat. Manfaat tersebut dapat dikaitkan dengan peningkatan kandungan komponen bioaktif dari postbiotik berbasis oat, termasuk β -glukan dan avenanthramida. Secara khusus, asam lemak omega-3 PUFA, termasuk cis-5,8,11,14,17-eicosapentaenoic acid methyl ester (C20:5N3) (EPA), cis-4,7,10,13,16,19-docosahexaenoic acid methyl ester (C22:6N3) (DHA), dan methyl docosapentaenoate (C22:5N3) (DPA), meredakan gangguan inflamasi (Calder 2013 ), meningkatkan metabolisme seluruh tubuh (Binia et al. 2017 ), dan mengurangi risiko penyakit kardiovaskular (Jain et al. 2015 ). Keluarga Omega-6 sangat penting untuk aterosklerosis terutama karena peningkatan metil linoleat (C18:2N6) (LA) dan metil γ-linolenat (C18:3N6) (GLA), yang menurunkan konsentrasi kolesterol lipoprotein densitas rendah dan kadar SFA (Shramko et al. 2020 ). Bukti klinis menyatakan potensi tindakan peningkatan kolesterol dari asam miristat (C14:0) dan asam palmitat (C16:0) dapat meningkatkan sinyal terkait peradangan untuk meningkatkan peradangan dan mengembangkan penyakit kardiovaskular, yang menunjukkan efek buruk SFA pada metabolisme asam lemak (Bradbury et al. 2010 ). Sejalan dengan penelitian kami, Julius W et. al. diamati bahwa β -glukan oat menunjukkan efek hepatoprotektif yang kuat pada penyakit hati steatotik yang terkait dengan disfungsi metabolik melalui peningkatan SCFA dan butirat yang diproduksi oleh Lachnospiraceae, Ruminococcaceae, dan Lactobacillus (Jaeger et al. 2024 ). Yu et al. juga mengamati suplementasi β -glukan memiliki efek restoratif pada n-6 PUFA di hati melalui aksis usus-hati (Yau et al. 2020 ). Selain itu, peneliti lain melaporkan efek avenanthramides dalam memodulasi gen kunci yang terlibat dalam metabolisme glukosa dan lipid (Xochitl et al. 2021 ; M et al. 2018 ).
Selain itu, gangguan metabolisme lipid mempercepat degenerasi inflamasi (Huang et al. 2022 ), konsisten dengan temuan kami dalam ekspresi mRNA NF-κB dan IL-10 pada tikus HS, yang dibalikkan oleh produk oat. Studi kami menunjukkan efek menguntungkan dari produk oat pada fungsi hati, metabolisme asam lemak, dan status inflamasi yang terkait erat dengan kesehatan manusia.
Lebih jauh lagi, penelitian telah menunjukkan bahwa mikrobiota usus dapat mengatur metabolisme lipid hewan dengan mengatur sintesis lipid, oksidasi asam lemak, dan endokrin intestinal (Aron-Wisnewsky et al. 2021 ; Brown et al. 2023 ). Postbiotik dapat mengatur komposisi mikrobiota usus, menghambat deposisi lipid serum dan akumulasi lemak hati (Cavallari et al. 2017 ; Youn et al. 2022 ). Produk oat mengurangi keragaman mikroba usus dan meningkatkan kekayaan dengan mempromosikan bakteri menguntungkan, termasuk Alloprevotella , Candidatus Arthromitus , Prevotella , dan Akkermansia , yang berkorelasi dengan sitokin pro-inflamasi tertentu, asam lemak, dan gen yang terlibat dalam metabolisme asam lemak. Akkermansia adalah bakteri menguntungkan yang telah diteliti dengan baik dan memiliki kemampuan yang terkenal untuk mendegradasi musin, mendorong pemeliharaan penghalang usus dan mencegah permeabilitas usus, mengatur sistem imun usus (Rao et al. 2021 ; Rodrigues et al. 2022 ; Yoon et al. 2021 ; Zheng et al. 2022 ). Individu dengan metabolisme glukosa yang membaik setelah intervensi diet tinggi serat memiliki mikrobiota usus yang kaya Prevotella (Kovatcheva-Datchary et al. 2015 ), sedangkan kandungannya menurun pada pasien steatohepatitis nonalkohol dan fibrosis yang parah (Boursier et al. 2016 ). Alloprevotella telah dikaitkan dengan degradasi serat makanan, yang memainkan peran penting dalam produksi SCFA dan pengurangan risiko sindrom metabolik (Han et al. 2024 ; Pietrucci et al. 2022 ; Xie et al. 2022 ). Dubosiella , genus yang menunjukkan korelasi positif dengan SREBP-1c dan LEP, telah diperkaya pada tikus obesitas yang diinduksi oleh diet tinggi lemak (Lan et al. 2022 ). Sebaliknya, kami menemukan bahwa Romboutsia , Desulfovibrio fairfieldensis , dan K. pneumonia diturunkan oleh Oat_PB pada tikus HS. D. fairfieldensis dan K. pneumonia adalah patogen oportunistik (Li et al. 2014 ; Nie et al. 2022 ). Romboutsia telah dianggap sebagai penanda mikrobiota usus untuk mengklasifikasikan obesitas yang terkait dengan TG dan asam lemak bebas pada tikus yang diberi diet tinggi lemak, bertepatan dengan temuan kami (Zeng et al. 2019 ). Shuttleworthiatelah ditemukan secara signifikan lebih tinggi pada subjek obesitas dalam studi cross-sectional (Khocht et al. 2023 ). Bakteri yang berubah ini menunjukkan bahwa produk oat, terutama Oat_PB, dapat mengatur metabolisme lipid melalui regulasi mikrobiota usus.
5 Kesimpulan
Studi kami mengembangkan sinbiotik dan postbiotik berbasis oat, dengan karakteristik metabolik yang baik dan fungsi memperbaiki cedera hati akibat konsumsi HS, dislipidemia, dan disbakteriosis usus (Gambar 6 ). Menurut farmakologi jaringan, postbiotik berbasis oat meningkatkan asam amino esensial bentuk bebas dan memperkaya metabolit yang dapat mengatur metabolisme lipid dan glukosa, serta status peradangan. Memang, hasil kami menunjukkan efek yang cukup besar dari makanan oat yang berasal dari probiotik dalam mengurangi kenaikan berat badan abnormal dan konsentrasi glukosa darah, cedera hati, dan gangguan metabolisme asam lemak yang disebabkan oleh konsumsi HS pada tikus melalui perubahan gen yang terlibat dalam homeostasis lipid dan perombakan mikrobiota usus. Perlu dicatat bahwa temuan terkini dari studi ini terbatas pada model tikus obesitas akibat HS. Di masa mendatang, kami akan meningkatkan penelitian kami dengan melakukan validasi eksperimental pada model hewan lain dan kelompok manusia. Secara kolektif, temuan kami menekankan potensi besar sinbiotik dan postbiotik berbasis oat yang dapat digunakan sebagai makanan yang menjanjikan untuk peningkatan kesehatan.