
Abstrak
Perak (E 174) adalah pewarna makanan yang dievaluasi ulang oleh Panel ANS EFSA (2016). Panel ANS menyimpulkan bahwa informasi yang tersedia saat itu tidak cukup untuk menilai keamanan perak sebagai bahan tambahan makanan. Masalah utamanya termasuk karakterisasi terbatas perak E 174 (misalnya jumlah nanopartikel) dan pelepasan perak ionik. Setelah Komisi Eropa meminta data lebih lanjut untuk mengisi kesenjangan data, Panel Aditif Makanan dan Perasa (FAF) diminta untuk menilai keamanan perak (E 174). Satu operator bisnis yang berminat (IBO) menyerahkan data terbatas tentang distribusi ukuran partikel dan morfologi, dua studi genotoksisitas, dan satu studi subkronis. Panel menyimpulkan bahwa data teknis yang diserahkan tentang karakterisasi fisikokimia semua jenis perak yang digunakan sebagai bahan tambahan makanan E 174 tidak memadai. Akibatnya, Panel tidak dapat mengusulkan perubahan pada spesifikasi UE E174 pada ukuran partikel dan morfologi. Karena informasi tambahan yang diminta tidak diberikan, penilaian hanya didasarkan pada data yang diserahkan. Meskipun demikian, mengingat data yang diberikan dan sifat tidak larutnya perak dalam air, Panel menyimpulkan bahwa E174 memerlukan penilaian risiko pada skala nano mengikuti Panduan EFSA tentang Penilaian risiko nanomaterial yang akan diterapkan dalam rantai makanan dan pakan, untuk melengkapi penilaian risiko konvensional. Panel menganggap bahwa data genotoksisitas dan data toksisitas subkronis tidak memadai. Akibatnya, Panel tidak dapat menyimpulkan tentang keamanan aditif makanan perak E 174.
RINGKASAN
Pendapat saat ini membahas tindak lanjut atas masalah yang telah diungkapkan dalam kesimpulan dan rekomendasi pendapat Ilmiah tentang evaluasi ulang perak (E 174) sebagai bahan tambahan pangan (Panel ANS EFSA, 2016 ).
Perak (E 174) adalah pewarna makanan yang dievaluasi ulang oleh Panel ANS pada tahun 2016 (Panel ANS EFSA, 2016 ). Panel ANS EFSA (Panel ANS EFSA, 2016 ) menyimpulkan bahwa data yang tersedia tidak cukup untuk menyimpulkan tentang keamanan perak yang digunakan sebagai bahan tambahan makanan E174. Masalah utama yang diidentifikasi mencakup karakterisasi perak E 174, khususnya kuantitas nanopartikel dan pelepasan perak ionik, serta kurangnya informasi yang sebanding untuk bahan yang digunakan dalam studi toksisitas yang tersedia, yang menghambat penentuan relevansi studi toksikologi yang tersedia dengan evaluasi keamanan perak sebagai bahan tambahan makanan.
Sebagai tindak lanjut dari pendapat evaluasi ulang tersebut, EC mengeluarkan seruan publik untuk mengumpulkan data dari IBO yang dapat mengurangi ketidakpastian dan kesenjangan dalam kumpulan data yang sebelumnya diidentifikasi oleh Panel ANS.
Menanggapi permintaan data EC, seorang operator bisnis (IBO) yang berminat memberikan informasi tentang karakterisasi, proses manufaktur, ukuran partikel dan morfologi perak yang digunakan sebagai bahan tambahan makanan (E 174).
Menurut informasi yang diberikan kepada EFSA, E 174 diproduksi melalui dua proses berbeda: (i) ‘proses atomisasi’ untuk menghasilkan bubuk perak dan (ii) ‘proses daun’ untuk menghasilkan daun atau bubuk perak.
IBO memberikan informasi terbatas tentang ukuran partikel E 174. Hanya satu gambar SEM kualitatif yang disediakan untuk E 174 yang diproduksi oleh ‘proses atomisasi’ dan tidak ada data yang diberikan untuk E 174 yang diproduksi sebagai daun oleh ‘proses daun’. Informasi kuantitatif yang tidak lengkap tentang ukuran partikel hanya diberikan untuk dua sampel E 174 yang diproduksi sebagai bubuk oleh ‘proses daun’. Panel mencatat bahwa jumlah sampel yang terbatas yang diperiksa dari satu proses manufaktur mungkin tidak mewakili semua perak yang digunakan sebagai E 174 di pasar UE. Ketebalan rata-rata dan median keping perak dilaporkan sama: 170 nm untuk satu sampel dan 182 nm untuk sampel lainnya. Fraksi partikel (berdasarkan jumlah) dengan ketebalan kurang dari 100 nm masing-masing adalah 0% dan 3% untuk kedua sampel. IBO memberikan proposal tentang cara mengkarakterisasi E 174 dalam spesifikasi UE mengenai ukuran partikel, yang tidak didukung oleh data analitis yang diberikan.
Panel mengidentifikasi ketidakpastian yang signifikan dalam data tentang distribusi ukuran partikel dan morfologi yang diberikan oleh IBO. Meskipun EFSA meminta informasi tambahan untuk mengklarifikasi ketidakpastian ini, IBO tidak memberikan klarifikasi. Akibatnya, informasi yang diberikan oleh IBO dianggap tidak cukup untuk sepenuhnya mengkarakterisasi bahan yang digunakan sebagai bahan tambahan pangan E 174. Oleh karena itu, Panel tidak dapat mengusulkan spesifikasi untuk perak (E 174) terkait dengan morfologi dan ukuran partikel, seperti yang diminta dalam Kerangka Acuan.
Dengan mempertimbangkan data yang diberikan mengenai distribusi ukuran partikel untuk perak (E 174) yang diproduksi sebagai bubuk dalam ‘proses daun’ dan bahwa perak tidak larut dalam air, sejalan dengan Panduan EFSA tentang Persyaratan Teknis Partikel, Panel mempertimbangkan bahwa E174 memerlukan penilaian risiko pada skala nano mengikuti Panduan EFSA tentang Penilaian Risiko Nano, untuk melengkapi penilaian risiko konvensional yang dilakukan sesuai dengan panduan sektoral yang berlaku.
Tidak ada data yang diberikan tentang pelepasan ion perak dari bahan tambahan makanan seperti yang diminta dalam permintaan data EC.
Karena kurangnya informasi dan ketidakpastian yang tersisa tentang sifat-sifat utama E 174 (misalnya seperti distribusi ukuran partikel, bentuk, komposisi, dan pelepasan ion perak), Panel menganggap bahwa melakukan penelusuran literatur untuk mengidentifikasi bukti tambahan dari literatur terbuka guna mengevaluasi keamanan E 174 tidaklah layak. Akibatnya, penilaian saat ini hanya didasarkan pada data yang diserahkan sebagai tanggapan atas permintaan data EC.
Untuk penilaian genotoksisitas, IBO menyediakan satu studi in vitro dan satu studi in vivo menggunakan uji Prediscreen, yang tidak divalidasi untuk penilaian risiko regulasi, juga tidak direkomendasikan oleh EFSA atau pedoman Organization for Economic Co-operation and Development (OECD). Panel menemukan kedua studi tersebut tidak dapat diandalkan, dengan persiapan sampel yang tidak memadai untuk penilaian skala nano, sehingga data tersebut tidak relevan untuk penilaian genotoksisitas E 174. Akibatnya, Panel berpendapat bahwa studi tersebut tidak memenuhi persyaratan untuk pengujian genotoksisitas menurut pedoman EFSA yang relevan.
IBO mengajukan satu studi toksisitas subkronis pada makanan dengan E 174, yang diproduksi sebagai bubuk melalui ‘proses daun’, pada tikus. Panel menganggap studi tersebut terbatas dalam menilai perubahan inflamasi pada sejumlah kecil organ yang diperiksa. Selain itu, informasi yang tidak memadai tentang penggabungan dan agregasi/penggumpalan perak E174 dalam pakan dibandingkan dengan makanan komersial, Panel menganggap bahwa relevansi hasil studi toksisitas subkronis untuk menilai partikel/agregat berukuran nano tidak dapat diverifikasi. Oleh karena itu, Panel berpendapat bahwa data yang diperoleh dari studi toksisitas subkronis tidak cukup untuk menyimpulkan keamanan bahan tambahan makanan tersebut.
Secara keseluruhan, Panel menganggap data yang disampaikan sebagai tanggapan atas permintaan data EC tidak mencukupi. Data tersebut tidak memiliki karakterisasi fisikokimia yang memadai dari semua jenis perak yang digunakan sebagai E 174 di pasar UE dan tidak menyertakan data tentang pelepasan ion perak. Data genotoksisitas tidak memadai untuk menilai bahaya genotoksik, dan data toksisitas yang tersedia tidak cukup untuk mengevaluasi keamanan perak (E 174) berdasarkan panduan EFSA yang relevan (Panel ANS EFSA, 2012 ; Komite Ilmiah EFSA, 2021a ). Oleh karena itu, Panel tidak dapat menyimpulkan tentang keamanan perak yang digunakan sebagai bahan tambahan pangan E 174.
1. PENDAHULUAN
Pendapat saat ini membahas tindak lanjut atas masalah yang telah diungkapkan dalam kesimpulan dan rekomendasi pendapat Ilmiah tentang evaluasi ulang perak (E 174) sebagai bahan tambahan pangan (Panel ANS EFSA, 2016 ).
1.1 Latar Belakang dan Kerangka Acuan sebagaimana disediakan oleh EC
Latar belakang
Penggunaan bahan tambahan pangan diatur berdasarkan Peraturan Parlemen dan Dewan Eropa (EC) No 1333/2008 1 tentang bahan tambahan pangan. Hanya bahan tambahan pangan yang tercantum dalam daftar Uni, khususnya dalam Lampiran II Peraturan tersebut, yang boleh dipasarkan dan digunakan dalam pangan dengan ketentuan penggunaan yang ditetapkan di dalamnya. Selain itu, bahan tambahan pangan harus mematuhi spesifikasi sebagaimana dimaksud dalam Pasal 14 Peraturan tersebut dan ditetapkan dalam Peraturan Komisi (UE) No 231/2012. 2
Perak (E 174) diizinkan untuk digunakan sebagai bahan tambahan makanan di Uni Eropa. Karena perak (E 174) diizinkan di Uni Eropa sebelum 20 Januari 2009, maka perak termasuk dalam kelompok bahan tambahan makanan yang tunduk pada penilaian risiko baru oleh Otoritas Keamanan Pangan Eropa (EFSA), menurut Peraturan Komisi (UE) No 257/2010, 3 dan sejalan dengan ketentuan Peraturan (EC) No 1333/2008.
EFSA menyelesaikan evaluasi ulang perak (E 174) sebagai bahan tambahan pangan dan menerbitkan opini ilmiah pada tanggal 21 Januari 2016. 4 Dalam opini tersebut, EFSA menyimpulkan bahwa informasi yang tersedia tidak cukup untuk menilai keamanan perak sebagai bahan tambahan pangan. EFSA juga membuat rekomendasi mengenai spesifikasi untuk E 174.
Oleh karena itu, Komisi Eropa menerbitkan pada tanggal 6 Maret 2018 panggilan untuk data 5 yang meminta operator bisnis untuk menyerahkan data yang membahas kesimpulan dan rekomendasi dari evaluasi ulang EFSA tentang keamanan perak (E 174) sebagai bahan tambahan pangan. Secara khusus, panggilan untuk data tersebut meminta:
- Data ukuran partikel dan distribusi ukuran partikel untuk E 174;
- Data toksikologi: basis data toksikologi harus dibuat dengan bahan tambahan pangan perak (E 174), dan sejalan dengan pendekatan berjenjang yang dijelaskan dalam “Panduan untuk pengajuan evaluasi bahan tambahan pangan” EFSA (Panel ANS EFSA, 2012 );
- Data pelepasan ion perak dari perak unsur dalam E 174.
Pada bulan September 2021, seorang operator bisnis tunggal mengirimkan data sebagai tanggapan atas panggilan tersebut.
Kerangka Acuan
Sesuai dengan Pasal 29(1)(a) Peraturan (EC) No 178/2002, 6 Komisi Eropa meminta Otoritas Keamanan Pangan Eropa (EFSA) untuk memberikan pendapat ilmiah terkini tentang keamanan bahan tambahan pangan perak (E 174) dan spesifikasinya:
- Mengonfirmasi bahwa data analitis yang diberikan oleh operator bisnis yang berkepentingan cukup mendukung usulan perubahan spesifikasi bahan tambahan pangan perak (E 174) termasuk, namun tidak terbatas pada, parameter tambahan yang terkait dengan ukuran partikel dan distribusi ukuran partikel.
- Menilai basis data toksisitas untuk mendukung keamanan usulan amandemen spesifikasi aditif makanan perak (E 174). Secara khusus, EFSA diminta untuk mengevaluasi ulang basis data untuk aditif makanan perak (E 174) dengan mempertimbangkan data yang diajukan oleh operator bisnis sebagai tanggapan terhadap permintaan data yang dikeluarkan oleh Komisi Eropa, serta data relevan baru yang diambil dari literatur yang diterbitkan.
- Sejalan dengan “Panduan persyaratan teknis untuk aplikasi produk makanan dan pakan yang diatur untuk menetapkan keberadaan partikel kecil termasuk nanopartikel” (Komite Ilmiah EFSA, 2021a ), EFSA juga harus mempertimbangkan apakah bahan tersebut, atau sebagian darinya, memerlukan penilaian sifat spesifik pada skala nano.
1.2 Ringkasan Evaluasi Ulang EFSA terhadap perak E 174 sebagai bahan tambahan pangan dan penilaian relevan lainnya terhadap perak
Perak (E 174) dievaluasi ulang oleh Panel ANS EFSA (Panel ANS EFSA, 2016 ) yang menyimpulkan bahwa: ‘informasi yang tersedia tidak cukup untuk menilai keamanan perak sebagai bahan tambahan pangan. Isu-isu utama meliputi identifikasi dan karakterisasi kimia perak E 174 (misalnya jumlah nanopartikel dan pelepasan perak ionik) dan informasi serupa tentang bahan yang digunakan dalam studi toksisitas yang tersedia. Oleh karena itu, Panel menyimpulkan bahwa relevansi studi toksikologi yang tersedia dengan evaluasi keamanan perak sebagai bahan tambahan pangan E 174 tidak dapat dipastikan’.
Panel ANS menyoroti kesenjangan data dan kekhawatiran berikut sehubungan dengan perak (E 174) saat digunakan sebagai bahan tambahan pangan:
- Data dari studi toksisitas pada unsur perak atau bahan tambahan makanan (E 174) tidak tersedia.
- Data tentang distribusi ukuran partikel bahan tambahan makanan (E 174) tidak tersedia.
- Ada bukti pelepasan ion perak dari unsur perak, yang menjadi perhatian. Namun, tingkat pelepasan ion perak, yang bergantung pada beberapa faktor seperti pH dan ukuran partikel, tidak diketahui dalam kasus perak (E 174) saat digunakan sebagai bahan tambahan makanan.
Panel ANS EFSA (2016) merekomendasikan bahwa:
- Spesifikasi untuk E 174 harus mencakup ukuran partikel rata-rata dan distribusi ukuran partikel (± SD), serta persentase (berdasarkan jumlah) partikel dalam skala nano (dengan setidaknya satu dimensi di bawah 100 nm), yang terdapat dalam bentuk bubuk perak (E 174) yang digunakan sebagai bahan tambahan pangan. Metodologi yang diterapkan harus mematuhi dokumen Panduan EFSA (Komite Ilmiah EFSA, 2011 ), misalnya SEM atau TEM.
- Panel merekomendasikan bahwa data tambahan sejalan dengan dokumen Panduan terkini tentang evaluasi bahan tambahan pangan (Panel EFSA ANS, 2012 ) akan diperlukan.
1.3 Informasi tentang penilaian lain terhadap perak sejak evaluasi ulang EFSA tahun 2016
Informasi dari penilaian keamanan EFSA 2021 tentang nanopartikel perak dalam bahan kontak makanan
Pada tahun 2021, Panel EFSA tentang Bahan Kontak Makanan, Enzim, dan Alat Bantu Pemrosesan (CEP) mengevaluasi keamanan nanopartikel perak yang digunakan hingga 0,025% b/b dalam plastik nonpolar yang dimaksudkan untuk bersentuhan dengan berbagai makanan (Panel EFSA CEP, 2021 ). Nanopartikel perak dicirikan oleh rentang ukuran 1–100 nm dengan diameter rata-rata sekitar 15 nm dan dengan 99% partikel berukuran di bawah 20 nm. Ketika dimasukkan ke dalam plastik, nanopartikel tetap dalam bentuk partikulat, meskipun beberapa agregasi dan penggumpalan diamati. Data dari studi migrasi dan uji abrasi bersama dengan pertimbangan teoritis berdasarkan pemodelan migrasi, menunjukkan bahwa nanopartikel perak tetap tertanam dalam plastik, tidak bermigrasi dan menahan pelepasan melalui abrasi. Tingkat migrasi yang rendah (hingga 6 μg/kg makanan) perak dalam bentuk ionik terlarutnya terdeteksi, jauh di bawah batasan kelompok makanan 50 μg/kg untuk migrasi perak (Panel EFSA AFC, 2004 ) dan perkiraan paparan berada di bawah ADI sebesar 0,9 μg ion perak/kg bb per hari (ECHA dan EFSA, 2020 ). Panel CEP menyimpulkan bahwa penggunaan nanopartikel perak (hingga 0,025% b/b) dalam plastik khusus yang ditujukan untuk kontak dengan makanan tidak menimbulkan masalah keamanan.
Informasi dari opini ECHA RAC 2022 tentang klasifikasi perak CLH
Pada tahun 2022, Komite Penilaian Risiko (RAC) Badan Kimia Eropa (ECHA) menerbitkan pendapatnya tentang klasifikasi perak (CAS 7440-22-4) (ECHA RAC, 2022 ). Pendapat RAC membahas perak dalam berbagai bentuk yang dijelaskan sebagai: (i) bentuk massal dengan partikel berukuran > 100 nm termasuk: (i) bentuk ‘masif’ (partikel dengan ukuran diameter ≥ 1 mm) dan bentuk ‘bubuk’ perak (partikel dengan ukuran > 100 nm dan < 1 mm) dan (ii) bentuk ‘nano perak’ dengan partikel berukuran > 1 nm dan ≤ 100 nm. Tidak ada rincian lebih lanjut terkait bentuk partikel perak yang diberikan dalam pendapat RAC.
Pendapat RAC menyatakan bahwa ‘data dari penelitian yang menggunakan nanopartikel perak yang mendukung klasifikasi bahaya kesehatan manusia juga harus digunakan untuk mewakili bentuk massal perak unsur seperti bubuk masif dan perak (termasuk debu perak berukuran mikron). Untuk alasan praktis, nanopartikel perak dipertimbangkan bersama-sama, meskipun pada tingkat individu, karakteristik fisikokimia seperti ukuran, bentuk, muatan permukaan, fungsionalisasi permukaan atau komposisi inti mungkin berbeda dan dapat memengaruhi interaksinya dengan sistem biologis dan memengaruhi penyerapan, toksikokinetik, dan toksikodinamikanya’. Akibatnya, tidak ada perbedaan yang dibuat antara berbagai bentuk perak dalam skala nano dalam penilaian RAC. RAC tidak mendukung penggunaan data read-across dari garam perak terlarut atau senyawa perak lainnya ke perak metalik karena perbedaan yang signifikan dalam sifat fisikokimia dan bioavailabilitasnya. RAC menekankan perlunya penilaian bahaya yang bergantung pada data khusus untuk bentuk perak yang dipertimbangkan, daripada mengasumsikan kesetaraan antara berbagai zat yang mengandung perak. 7
Berdasarkan data yang diberikan RAC mengklasifikasikan perak dalam bentuk curah (masif dan bubuk) dan bentuk nano sebagai zat yang berpotensi menyebabkan kerusakan pada sistem saraf (STOT RE 2; H373 (sistem saraf)) dan diduga mengganggu kesuburan (Repr. 2; H361f).
Informasi dari penilaian keamanan SCCS EC 2024 tentang penggunaan perak dalam produk kosmetik
Komite Ilmiah EC tentang Keamanan Konsumen (SCCS) mengevaluasi bubuk perak yang digunakan dalam produk kosmetik yang sangat berpori (85%–90%; luas permukaan spesifik hingga 5 m 2 /g) (SCCS, 2024 ). Dalam pendapatnya disebutkan bahwa ‘Pencitraan SEM mengungkapkan bahwa substruktur (tidak ada sebagai entitas individu tetapi sebagai bagian yang tidak dapat dipisahkan dari unit-unit individu yang lebih besar yang tidak terikat) kira-kira berbentuk bulat’. Ukuran ‘partikel-substruktur’ berbasis angka 8 dari zat yang dievaluasi berkisar antara 42,2 dan 320 nm. Rata-rata (±SD) ukuran ‘partikel-substruktur’ yang diukur adalah 122,4 ± 37,7 nm (SD: 84,7–160,1 nm). Karakterisasi lebih lanjut mengenai distribusi ukuran ‘substruktur-partikel’ berbasis angka melalui SEM mengungkapkan persentil spesifik: D10 diukur pada 80,5 nm, D50 pada 116,2 nm, dan D90 pada 172,8 nm.
Karena tidak dapat dipastikan apakah jumlah perak yang terdeteksi dalam studi penetrasi dermal berhubungan dengan partikel atau ion, SCCS berasumsi bahwa partikel larut sepenuhnya untuk melepaskan ion. Penyerapan dermal diperkirakan sebesar 2,14%, berdasarkan studi in vitro dan perak yang diserap diasumsikan ada sebagai ion untuk penilaian keamanan.
SCCS mendasarkan evaluasinya terhadap toksisitas sistemik pada paparan ion perak, tidak termasuk penelitian pada nanopartikel perak karena karakteristik fisikokimia dan profil toksikologi potensialnya yang berbeda dibandingkan dengan perak yang sedang dinilai.
SCCS menyimpulkan bahwa perak, yang digunakan dalam produk kosmetik, tidak mengiritasi kulit atau mata dan menimbulkan risiko sensitisasi yang dapat diabaikan. Tingkat tidak ada efek buruk yang diamati (NOAEL) sebesar 0,0045 mg ion perak ekuivalen /kg bb per hari diidentifikasi berdasarkan efek pigmentasi organ dalam (hati, ginjal, pankreas, lambung dan kelenjar getah bening pleksus koroid) dalam studi toksisitas kronis yang melibatkan bubuk kristal zeolit seng perak, dikoreksi untuk bioavailabilitas oral (Takizawa, 1992 ). Sementara SCCS setuju dengan RAC (RAC, 2022 ) bahwa perak harus diklasifikasikan sebagai racun reproduksi Kategori 2 untuk efek buruk pada fungsi seksual dan kesuburan, data dari studi dengan bentuk nano tidak digunakan dalam penilaian SCCS. ‘SCCS sependapat dengan ECHA – RAC (2022) bahwa klasifikasi untuk mutagenisitas tidak diperlukan’. Lebih jauh, SCCS merujuk pada pendapatnya tentang bahan kemasan yang melepaskan perak (SCCS, 2016 ), di mana SCCS menyimpulkan bahwa data genotoksisitas/mutagenisitas yang diajukan tidak meyakinkan. SCCS menganggap bahwa mekanisme utama genotoksisitas ion perak adalah melalui produksi spesies oksigen reaktif (ROS), yang merupakan proses tidak langsung yang bergantung pada tingkat konsentrasi dan karena konsentrasi ion perak yang ada dalam produk kosmetik rendah, SCCS tidak memiliki kekhawatiran mengenai risiko manusia dari penggunaan perak yang sedang dinilai dalam produk kosmetik. Untuk karsinogenisitas, SCCS sependapat dengan pendapat RAC (RAC, 2022 ) bahwa tidak ada klasifikasi untuk karsinogenisitas yang dapat diusulkan karena data yang tidak meyakinkan. Lebih jauh, SCCS menyatakan dalam pendapatnya tentang zeolit seng perak (SCCS, 2023 ) bahwa ia setuju dengan Pendapat Komite Produk Biosida ECHA (ECHA BPC, 2021 ) bahwa zeolit seng perak tidak mungkin bersifat karsinogenik. Berdasarkan temuan ini, dengan mempertimbangkan NOAEL sebesar 0,0045 mg/kg bb per hari (dinyatakan sebagai ekuivalen ion perak), SCCS menghitung paparan sistemik dan faktor bioavailabilitas sebesar 0,01% untuk produk oral. SCCS menyimpulkan bahwa perak tidak aman pada konsentrasi 0,2% dalam produk bilas dan 0,3% dalam produk tanpa bilas. Penggunaannya dalam perona mata, pelembap bibir, pasta gigi, dan obat kumur pada kadar tertentu dianggap aman.
Panel mencatat bahwa perak yang dinilai oleh SCCS (SCCS, 2024 ) untuk digunakan dalam kosmetik berbeda secara signifikan dari perak yang digunakan sebagai E 174 sebagaimana dijelaskan dalam Bagian 3.2.1 .
Panel juga mencatat bahwa saat ini, perak sedang dievaluasi oleh ECHA sebagai pengganggu endokrin potensial.9
Lebih jauh lagi, ada proyek yang sedang berlangsung mengenai ‘Integrasi metodologi pendekatan baru menghasilkan penilaian risiko kimia: studi kasus yang membahas pertimbangan skala nano’ 10 yang didanai oleh EFSA di mana ‘perak konvensional dengan fraksi skala nano yang disahkan sebagai bahan tambahan makanan (E 174)’ 11 dianggap sebagai studi kasus’.
2 DATA DAN METODOLOGI
2.1 Data
Panel mendasarkan penilaiannya pada informasi yang disampaikan menyusul permintaan data Komisi Eropa. 12 Salah satu operator bisnis (IBO) yang berminat, Konsorsium Produsen Emas dan Perak yang Dapat Dimakan Eropa, menyampaikan informasi (Dokumentasi diberikan kepada EFSA No. 1).
2.2 Metodologi
Pendapat ini dirumuskan mengikuti prinsip-prinsip yang dijelaskan dalam Panduan Komite Ilmiah EFSA tentang transparansi terkait aspek ilmiah penilaian risiko (Komite Ilmiah EFSA, 2009 ) dan mengikuti dokumen Panduan yang relevan dari Komite Ilmiah EFSA. ‘Panduan untuk pengajuan evaluasi bahan tambahan pangan’ (Panel ANS EFSA, 2012 ) saat ini juga telah diikuti.
Istilah dan definisi terkait nanomaterial yang digunakan dalam dokumen ini sebagaimana dijelaskan oleh Pusat Penelitian Gabungan Komisi Eropa (Rauscher et al., 2023 ).
Panel mencatat bahwa dalam data yang diserahkan, IBO menggunakan berbagai istilah untuk menggambarkan morfologi partikel perak (misalnya pelat, foil, daun, lembaran). Menurut Panduan ECHA (ECHA, 2022 ), partikel dengan satu dimensi eksternal yang secara signifikan lebih kecil daripada dua dimensi eksternal lainnya, di mana dimensi yang lebih kecil ini mewakili ketebalan partikel, termasuk dalam kategori bentuk ‘platelet’. Panel menerapkan terminologi bentuk ECHA untuk menggambarkan morfologi partikel E 174 dalam penilaian ini sementara data yang dilaporkan yang diberikan oleh IBO mencakup terminologi yang digunakan oleh IBO itu sendiri.
Data yang diberikan oleh IBO sebagai tanggapan terhadap permintaan data menunjukkan bahwa partikel penyusun perak yang digunakan sebagai E 174 berada dalam kisaran ukuran nano dengan nilai dimensi eksternal minimal median dari 170 hingga 182 nm (lihat Bagian 3.2.1 dari Opini ini). Perak tidak larut dalam air (ECHA, 2022 ; SCCS, 2024 ) (lihat Bagian 1.2 ). Oleh karena itu, sejalan dengan Panduan EFSA tentang Partikel – Persyaratan Teknis (Komite Ilmiah EFSA, 2021a ), E 174 memerlukan penilaian risiko pada skala nano mengikuti Panduan EFSA tentang Nano – Penilaian Risiko (Komite Ilmiah EFSA, 2021b ), untuk melengkapi penilaian risiko konvensional yang dilakukan sesuai dengan panduan sektoral yang berlaku.
Karena informasi yang tidak memadai dan ketidakpastian tentang sifat-sifat utama perak (E 174) sebagai bahan tambahan pangan (lihat Bagian 3.3 ), seperti ukuran partikel, bentuk, komposisi, dan pelepasan ion perak, Panel menganggap tidak layak untuk melakukan penelusuran literatur yang diterbitkan guna mengidentifikasi bukti tambahan untuk mengevaluasi keamanan E 174, sebagaimana diminta dalam Kerangka Acuan (lihat Bagian 1.1 ). Akibatnya, Panel melakukan penilaian hanya dengan mengandalkan data yang diserahkan oleh IBO sebagai tanggapan atas permintaan data EC.
3 PENILAIAN
3.1 Identitas dan spesifikasi
Spesifikasi untuk perak (E 174) telah ditetapkan dalam Peraturan Komisi (UE) No 231/2012 tentang spesifikasi untuk bahan tambahan makanan (Tabel 1 ).
| Peraturan Komisi (UE) No 231/2012 | |
|---|---|
| Pengujian | Kandungan tidak kurang dari 99,5% Ag |
| EINECS | Nomor telepon 231-131-3 |
| Keterangan | Bubuk berwarna perak atau lembaran kecil |
| Identifikasi | Tidak ada informasi |
| Kemurnian | Tidak ada informasi |
3.2 Data teknis yang diserahkan
Berikut ini adalah hal-hal yang diminta dalam seruan Komisi Eropa untuk data ke-13 :
- Informasi tentang ukuran partikel dan distribusi ukuran partikel untuk bahan tambahan makanan perak (E 174) yang didukung oleh data analitis, sejalan dengan rancangan ‘pedoman EFSA tentang penilaian risiko penerapan nanosains dan nanoteknologi dalam rantai makanan dan pakan: Bagian 1, kesehatan manusia dan hewan’.
- Spesifikasi usulan yang terperinci dan komprehensif untuk karakterisasi fraksi nanopartikel yang ada dalam bahan tambahan pangan perak (E 174).
Satu IBO, sebuah konsorsium Produsen Emas dan Perak yang Dapat Dimakan di Eropa, memberikan informasi sebagai tanggapan atas permintaan data.
3.2.1 Karakterisasi perak yang digunakan sebagai E 174
Menurut informasi yang disampaikan oleh IBO, perak yang digunakan sebagai bahan tambahan makanan dideskripsikan sebagai ‘bahan logam berbentuk lembaran dan bubuk kecil’. IBO selanjutnya melaporkan bahwa komposisi E 174 mengandung perak tidak kurang dari 99,5% (b/b), dan hingga 0,5% (b/b) emas dan/atau tembaga (Dokumentasi diberikan kepada EFSA No. 1).
3.2.2 Proses manufaktur
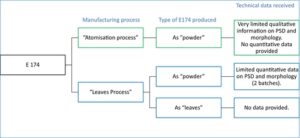
IBO melaporkan bahwa perak yang digunakan sebagai E 174 diproduksi melalui dua proses berbeda (lihat Gambar 1 ) yang dijelaskan sebagai:
- ‘ Proses atomisasi ‘ untuk menghasilkan bubuk perak . Dalam proses ini, logam (perak) dicairkan dan diatomisasi menjadi tetesan. Proses penggulungan kemudian digunakan untuk membuat tetesan lebih tipis dan hanya memperoleh bubuk yang terdiri dari partikel dalam bentuk pelat (‘tetesan yang dihancurkan oleh penggulungan ‘ ). IBO menyatakan bahwa partikel tersebut ‘homogen dan tidak berpori’ (Dokumentasi diberikan kepada EFSA No. 1).
- ‘ Proses daun ‘ untuk menghasilkan daun perak atau bubuk . Dalam proses ini, setelah peleburan dan pengecoran awal, beberapa proses mekanis deformasi yaitu penggulungan dan pemukulan, menghasilkan perak dalam bentuk daun yang sangat tipis. Langkah terakhir dari proses pembuatan yaitu pemotongan, pencabikan atau penggilingan, menghasilkan lembaran atau bubuk. IBO menyatakan bahwa ‘partikel-partikel ini homogen, tidak berpori, tidak menggumpal dan tidak teragregasi’ (Dokumentasi diberikan kepada EFSA No. 1).
IBO lebih lanjut menyatakan bahwa dalam kedua proses manufaktur, partikel biasanya memiliki penampilan khas pecahan daun perak, dengan dua dimensi yang relatif besar dan tidak teratur dan satu dimensi kecil dan teratur yang mewakili ketebalan daun.
3.2.3 Distribusi ukuran partikel dan morfologi
IBO memberikan informasi tentang ukuran partikel dan morfologi E 174 dalam bentuk serbuk yang diproduksi melalui ‘proses atomisasi’ dan ‘proses daun’. Tidak ada informasi tentang E 174 yang diproduksi sebagai daun melalui ‘proses daun’ yang diberikan (lihat Gambar 1 ), (Dokumentasi diberikan kepada EFSA No. 1).
Perak E 174, proses atomisasi
Untuk perak E 174 yang diproduksi sebagai bubuk melalui proses atomisasi, hanya deskripsi kualitatif dari satu sampel berdasarkan satu gambar SEM yang disediakan dan disajikan di sini sebagai Gambar 2. Metode analisis hanya dijelaskan secara singkat. Panel mencatat bahwa data kuantitatif tentang distribusi ukuran partikel (dimensi lateral dan ketebalan) tidak disediakan. Gambar tersebut menunjukkan pelat dengan ukuran lateral mikrometrik. IBO melaporkan bahwa beberapa ‘pelat’ atau ‘bagian pelat’ dengan ukuran lateral submikrometrik diamati, tetapi tidak ada partikel dengan dimensi lateral di bawah 100 nm yang terdeteksi. IBO menyatakan bahwa karena rentang ukuran ‘pelat’ yang luas dalam bubuk yang dianalisis, tidak mungkin untuk membuat histogram distribusi ukuran partikel berbasis angka menggunakan analisis SEM.
IBO melengkapi analisis SEM dengan analisis spektroskopi sinar-X dispersif energi (EDX), yang mengonfirmasi bahwa partikel yang divisualisasikan dalam mikrograf elektron mengandung perak (Dokumentasi diberikan kepada EFSA No.1).

Panel mencatat dari gambar SEM yang diberikan, bahwa material tersebut memiliki tepi yang kasar. Panel mempertimbangkan bahwa pelat submikrometrik yang terpisah secara jelas dapat berupa aglomerat dan/atau agregat partikel yang lebih kecil tetapi hal ini tidak dapat dipastikan secara tegas berdasarkan gambar tunggal yang diberikan. Pembesaran (resolusi) gambar (lihat Gambar 2 ) tidak memungkinkan visualisasi partikel penyusun dalam rentang nano, sebagaimana ditunjukkan sebagai persyaratan dalam Panduan EFSA (Komite Ilmiah EFSA, 2021a ; Komite Ilmiah EFSA, 2021b ).
Selain itu, untuk sampel perak ini (E 174), IBO memberikan informasi tentang luas permukaan spesifik volume (VSSA) yang diukur dengan metode BET. Panel mencatat bahwa metode BET tidak dianggap sesuai untuk menyelidiki keberadaan partikel berukuran nano karena metode ini tidak memungkinkan untuk mengukur secara akurat ukuran partikel penyusun seperti yang dipersyaratkan oleh Guidance on Particle-TR (EFSA Scientific Committee, 2021a ) dan Guidance on nano RA (EFSA Scientific Committee, 2018 ; EFSA Scientific Committee, 2021b ) dan rentan terhadap bias untuk bahan polidispersi (Mech, Rauscher, et al., 2020 ; Mech, Wohlleben, et al., 2020 ; Rauscher et al., 2019 , 2023 ).
Perak E 174, proses daun
IBO memberikan data tentang ukuran partikel dan morfologi partikel berdasarkan analisis SEM untuk dua sampel perak E 174 yang diproduksi sebagai bubuk melalui ‘proses daun’ dan menganggapnya sebagai ‘kasus partikel terkecil’ yang diproduksi. Metode analisis dijelaskan, data kuantitatif tentang ukuran partikel (ditentukan dengan mengukur dimensi minimal Feret (ketebalan)) diberikan dan analisis statistik dilakukan (lihat Tabel 2 ) (Dokumentasi diberikan kepada EFSA No. 1).
Berdasarkan gambar SEM, IBO melaporkan bahwa fragmen ‘foil’ 14 memiliki dimensi lateral berkisar dari beberapa mikrometer hingga beberapa ratus mikrometer, tanpa partikel yang memiliki satu atau dua dimensi lateral di bawah 100 nm (Dokumentasi diberikan kepada EFSA No. 1).
Pengukuran ketebalan 100 fragmen ‘foil’ yang berbeda (lihat Gambar 3 ) dilakukan pada gambar dari kedua sampel bubuk perak. Pengukuran ketebalan dilakukan pada tiga titik tepi foil yang berbeda. Parameter yang ditentukan dari pengukuran ketebalan rata-rata setiap fragmen foil ditunjukkan pada Tabel 2 .

| Lot bubuk perak | Contoh 1 | Contoh 2 |
|---|---|---|
| Ukuran rata-rata | 170,2nm ± 20,6nm | 182,4nm ± 9,7nm |
| Lebar distribusi (deviasi standar (SD)) | 44,3 nanometer | 63,5 nanometer |
| Ukuran rata-rata | 170,2 nanometer | 182,4 nanometer |
| Modus b | 170,2 nanometer | 182,4 nanometer |
| Fraksi fragmen (berdasarkan nomor) dengan ketebalan < 100 nm | 3% | 0% |
a Panel berasumsi bahwa data yang diberikan dalam tabel sesuai dengan distribusi normal yang sesuai dengan rata-rata ketebalan foil. b Modus distribusi dijelaskan oleh IBO sebagai ukuran rata-rata kelas yang paling umum (Dokumentasi diberikan kepada EFSA No. 1).
Panel mencatat bahwa identitas variasi (yaitu ± 20,6 nm, 9,7 nm) yang dilaporkan untuk ukuran rata-rata tidak dijelaskan. Panel berasumsi bahwa hal itu merupakan kesalahan standar statistik.
Panel mencatat bahwa partikel perak yang diperoleh dalam bentuk bubuk melalui proses daun menunjukkan morfologi platelet 14 dengan satu dimensi reguler kecil (ketebalan partikel) dan dua dimensi tidak teratur besar. IBO melaporkan bahwa partikel-partikel ini homogen, tidak teragregasi dan tidak berpori. Panel mencatat bahwa IBO tidak menjelaskan fitur partikel mana yang dimaksud dengan istilah ‘homogen’; namun Panel berasumsi bahwa IBO berarti bahwa partikel-partikel tersebut menunjukkan morfologi yang serupa. Panel selanjutnya mencatat bahwa material tersebut menunjukkan tepi yang lebih halus dibandingkan dengan material yang diperoleh melalui proses atomisasi. Panel mencatat bahwa ketebalan platelet minimum dan maksimum yang diamati di seluruh pengukuran untuk kedua sampel tidak diberikan (Dokumentasi diberikan kepada EFSA No. 1).
IBO juga memberikan hasil analisis Atomic Force Microscopy (AFM) yang dilakukan pada satu sampel E 174 yang diproduksi sebagai bubuk melalui ‘proses daun’, yang bertujuan untuk menentukan ketebalan lapisan perak. Semua nilai ketebalan yang diukur dilaporkan di atas 100 nm (Dokumentasi diberikan kepada EFSA No. 1).
Panel mencatat bahwa berdasarkan data yang diberikan oleh IBO (Median (D50), 170,2–182,4 nm) lebih dari 10% partikel perak yang digunakan sebagai E 174 yang diproduksi sebagai bubuk melalui ‘proses leaves’ memiliki setidaknya satu dimensi lebih kecil dari 250 nm. Oleh karena itu, dengan mempertimbangkan fitur ini dan mengikuti Panduan EFSA tentang Particle-TR (Komite Ilmiah EFSA, 2021a ), Panel berpendapat bahwa perak yang digunakan sebagai E 174 mengandung partikel kecil termasuk nanopartikel.
3.2.4 Spesifikasi yang diusulkan oleh IBO
IBO mengusulkan spesifikasi berikut untuk karakterisasi fraksi nanopartikel yang ada dalam bahan tambahan pangan perak (E 174) (Dokumentasi diberikan kepada EFSA No. 1):
- ‘10% maksimum partikel (berdasarkan jumlah) dengan satu dimensi di bawah 100 nm’;
- ‘1% partikel (berdasarkan jumlah) dengan satu dimensi di bawah 50 nm’.
Untuk perak yang diproduksi melalui ‘proses daun’ IBO memberikan informasi mengenai perhitungan ketebalan rata-rata kepingan perak yang diperkirakan dari parameter produksi berdasarkan ‘berat daun’ yang dinyatakan sebagai ‘ketebalan = berat/permukaan/kepadatan (10,5)’ untuk kisaran sampel dengan berat 10 hingga 35 g/1000 daun (Dokumentasi diberikan kepada EFSA No. 1).
IBO selanjutnya menyatakan bahwa ‘menurut kisaran ketebalan daun perak yang diproduksi oleh produsen dan hasil analisis yang dilakukan pada beberapa batch E 174’ yang diproduksi melalui ‘proses daun’, perkiraan tingkat maksimum partikel dengan satu dimensi di bawah 100 nm adalah 10% (dalam jumlah) untuk batch E 174 yang mengandung ‘daun perak paling tipis’ (beratnya 10 gram, dihitung menjadi 149 nm) (Dokumentasi diberikan kepada EFSA No. 1).
Namun, Panel mencatat bahwa tidak ada penjelasan tentang bagaimana parameter yang digunakan dalam perhitungan ketebalan ditentukan, juga tidak ada data analitis yang disajikan untuk mendukung estimasi ini. Panel selanjutnya mengamati bahwa analisis kuantitatif SEM dilakukan pada dua sampel dengan berat ’12 gram’ dengan ketebalan trombosit rata-rata terukur sebesar 170 nm dalam satu sampel dan 182 nm dalam sampel lainnya, dan tidak pada sampel yang ‘lebih tipis’ dengan berat ’10 gram’.
Selain itu, Panel mencatat bahwa spesifikasi yang diberikan oleh IBO hanya didasarkan pada data untuk perak yang diproduksi melalui ‘proses daun’ dan bukan untuk E 174 yang diproduksi melalui proses atomisasi.
Panel mencatat bahwa justifikasi terbatas (data analitis untuk dua sampel) untuk kandungan maksimum yang diusulkan sebesar 10% (berdasarkan jumlah) partikel di bawah 100 nm dalam perak telah diberikan. Panel juga mempertimbangkan bahwa data tersebut tidak mendukung usulan 1% (berdasarkan jumlah) partikel dengan satu dimensi di bawah 50 nm. Lebih lanjut, Panel mencatat bahwa IBO tidak memberikan usulan untuk deskripsi morfologi yang akan dimasukkan dalam spesifikasi UE untuk E 174.
3.3 Penilaian data teknis yang disampaikan
IBO menyatakan bahwa perak yang digunakan sebagai bahan tambahan makanan E 174 diproduksi melalui dua proses manufaktur: ‘proses atomisasi’ yang menghasilkan E 174 dalam bentuk bubuk, dan ‘proses daun’ yang menghasilkan perak dalam bentuk daun atau bubuk (Dokumentasi diberikan kepada EFSA No. 1).
Komposisi
IBO menyatakan bahwa E 174 mengandung tidak kurang dari 99,5% perak (w/w) dan hingga 0,5% (w/w) emas dan/atau tembaga. Panel mencatat bahwa kemurnian yang dilaporkan (tidak kurang dari 99,5%) memenuhi batas yang ditunjukkan untuk E 174 dalam spesifikasi UE yang ditetapkan dalam Peraturan Komisi (UE) No 231/2012. Namun, keberadaan emas dan/atau tembaga hingga 0,5% (w/w) dalam bahan tambahan pangan tidak ditunjukkan dalam spesifikasi UE untuk E 174. Panel selanjutnya mencatat bahwa asal emas dan/atau tembaga dalam E 174 tidak jelas. IBO tidak menanggapi permintaan tambahan EFSA untuk klarifikasi tentang aspek ini.
Morfologi dan ukuran partikel
IBO memberikan informasi tentang morfologi dan ukuran partikel perak (E 174) yang diproduksi sebagai bubuk melalui ‘proses atomisasi’ dan ‘proses daun’. Dalam kedua kasus, gambar SEM menunjukkan bahwa partikel berbentuk keping, dengan satu dimensi (ketebalan keping) secara signifikan lebih kecil daripada dua dimensi (lateral) lainnya. IBO melaporkan bahwa tidak ada lapisan perak dengan dimensi lateral di bawah 100 nm yang diamati. Informasi kuantitatif tentang ukuran partikel disediakan untuk dua sampel E 174 yang diproduksi sebagai bubuk melalui ‘proses daun’ saja. Ketebalan rata-rata dilaporkan sama dengan ketebalan median dan sebesar 170 nm untuk satu sampel dan 182 nm untuk sampel lainnya. Fraksi partikel (berdasarkan jumlah) dengan ketebalan kurang dari 100 nm adalah 0 dan 3% untuk kedua sampel (Dokumentasi diberikan kepada EFSA No. 1).
IBO mengusulkan amandemen spesifikasi UE E 174 untuk menetapkan bahan tambahan pangan yang mengandung maksimum 10% partikel (berdasarkan jumlah) dengan satu dimensi di bawah 100 nm dan 1% partikel (berdasarkan jumlah) dengan satu dimensi di bawah 50 nm (Dokumentasi diberikan kepada EFSA No. 1). Panel mencatat bahwa ambang batas dan kandungan maksimum partikel berdasarkan jumlah ini tidak didukung oleh data analitis yang diajukan. Lebih jauh, IBO tidak memberikan usulan apa pun untuk deskripsi morfologi yang akan dimasukkan dalam Spesifikasi UE untuk E 174.
Berdasarkan informasi yang diberikan oleh IBO bahwa variasi dimensi terkecil partikel terkait dengan variabilitas proses manufaktur dan parameter produksi yang berbeda dari daun perak yang diproduksi oleh produsen, Panel mencatat bahwa jumlah sampel yang diperiksa terbatas yang diproduksi oleh ‘proses daun’ mungkin tidak mewakili semua jenis perak yang digunakan sebagai E 174 yang tersedia di pasaran.
Selain itu, Panel mencatat bahwa:
–IBO tidak memberikan informasi kuantitatif tentang dimensi lateral keping perak yang diproduksi dalam proses daun. Partikel kecil dengan dimensi lateral dalam kisaran nano diduga berdasarkan gambar SEM. Namun, perbesaran/resolusi rendah dari gambar ini tidak memungkinkan penilaian menyeluruh. IBO tidak menanggapi permintaan tambahan EFSA untuk klarifikasi tentang aspek ini.
–IBO memperkirakan bahwa dalam E 174 fraksi maksimum partikel dengan satu dimensi di bawah 100 nm adalah 10% (berdasarkan jumlah). Namun, informasi dari literatur (De Vos et al., 2020 ; Waegeneers et al., 2019 ) menunjukkan bahwa nanopartikel dilepaskan dari produk kembang gula yang mengandung E 174 ketika produk tersebut dimasukkan ke dalam air. Dalam kondisi ini, dalam semua sampel dan terlepas dari pilihan teknik analisis (TEM atau SP-ICP-MS), partikel berukuran nano mewakili lebih dari 97% (berdasarkan jumlah) dengan ukuran median (D50) 11 nm (TEM) dan dengan morfologi bulat, meskipun fraksi terbesar (99,45%) dari massa perak hadir sebagai serpihan dengan tepi yang sangat kasar (De Vos et al., 2020 ). Oleh karena itu, seperti yang dilaporkan dalam penelitian ini, persentase berdasarkan jumlah nanopartikel dari E 174 bisa lebih tinggi daripada yang dilaporkan oleh IBO. Klarifikasi mengenai aspek ini telah diminta, tetapi IBO tidak menanggapi permintaan EFSA.
–Untuk perak yang diproduksi sebagai bubuk melalui ‘proses atomisasi’, IBO tidak memberikan data kuantitatif apa pun dan hanya satu gambar SEM dengan perbesaran (resolusi) yang tidak memungkinkan visualisasi partikel penyusun dalam rentang nano dan tidak memungkinkan untuk memperkirakan ketebalan partikel. Klarifikasi tentang aspek tersebut telah diminta, tetapi IBO tidak menanggapi permintaan EFSA. Oleh karena itu, Panel tidak dapat mengecualikan bahwa E 174 yang diperoleh melalui proses atomisasi mengandung persentase yang jauh lebih tinggi daripada 10% (berdasarkan jumlah) partikel dengan satu dimensi di bawah 100 nm, sebagaimana diusulkan dalam spesifikasi oleh IBO.
–Data yang dikirimkan tidak memberikan informasi tentang dimensi eksternal minimal (ketebalan terendah yang diukur) dari pelat perak yang diproduksi oleh kedua proses tersebut. Klarifikasi tentang aspek ini telah diminta, tetapi IBO tidak menanggapi permintaan EFSA.
–Tidak jelas apakah perak yang digunakan sebagai bahan tambahan makanan dilapisi atau difungsikan. Klarifikasi tentang aspek tersebut telah diminta, tetapi IBO tidak menanggapi permintaan EFSA.
Kesimpulan keseluruhan tentang data teknis
Dengan mempertimbangkan data yang diajukan sebagai tanggapan atas permintaan data EC untuk tindak lanjut evaluasi ulang perak (E 174), Panel menganggap bahwa data yang diberikan oleh IBO mengenai karakterisasi perak yang digunakan sebagai E 174 tidak cukup untuk mengkarakterisasi bahan yang digunakan sebagai bahan tambahan pangan ini. Oleh karena itu, Panel tidak dapat mengusulkan perubahan pada spesifikasi UE saat ini untuk perak (E 174) terkait morfologi dan ukuran partikel, seperti yang diminta dalam Kerangka Acuan (lihat Bagian 1.1 ).
3.4 Data biologi dan toksikologi yang diserahkan
Berikut ini adalah hal-hal yang diminta dalam panggilan untuk data ke-15 :
- Basis data toksikologi yang dibuat dengan bahan tambahan makanan perak (E 174), dan sejalan dengan pendekatan berjenjang yang dijelaskan dalam panduan EFSA saat ini untuk pengajuan evaluasi bahan tambahan makanan (Panel ANS EFSA, 2012 ).
Menanggapi permintaan data, IBO hanya menyediakan data tentang genotoksisitas dan toksisitas subkronis, yang dijelaskan di bawah ini.
3.4.1 Genotoksisitas
Tidak ada studi genotoksisitas seperti yang direkomendasikan dalam Panduan EFSA (Panel ANS EFSA, 2012 ) yang diserahkan oleh IBO sebagai tanggapan terhadap permintaan data EC.
IBO menyediakan studi in vitro dan in vivo menggunakan uji Prediscreen. Uji ini mendeteksi perubahan status fosforilasi histon H2AX (γH2AX) dan tingkat ekspresi protein fosfo-H3 (p-H3) sebagai penanda peristiwa klastogenik dan aneugenik.
Panel mencatat bahwa uji Prediscreen, baik in vitro maupun in vivo, tidak divalidasi untuk penilaian risiko regulasi; bukan merupakan uji yang direkomendasikan dalam dokumen panduan EFSA terkini (Komite Ilmiah EFSA, 2011 , 2017 ), dan tidak termasuk dalam panduan pengujian OECD yang direkomendasikan untuk penilaian potensi genotoksisitas (OECD, 2017 ). Panel juga mencatat bahwa persiapan sampel dalam studi Prediscreen in vitro dan in vivo tidak memadai untuk penilaian pada skala nano sebagaimana dijelaskan dalam Panduan EFSA (Komite Ilmiah EFSA, 2021b ).
3.4.1.1 Uji pra-penyaringan in vitro
IBO memberikan laporan tentang genotoksisitas E 174 secara in vitro menggunakan uji Prediscreen. (Dokumentasi diberikan kepada EFSA No. 2).
Uji PrediScreen dilakukan pada tiga lini sel manusia, yaitu HepG2 (hati), LS-174T (usus besar) dan ACHN (ginjal) (untuk rincian lihat Lampiran A ). Sel-sel tersebut diekspos selama 24 jam ke: (i) E 174 (bubuk) sebagai sampel yang tidak disonikasi atau disonikasi (larutan stok 2 mg/mL dalam air yang disonikasi selama 10 menit) pada 0, 20, 40, 80 dan 160 μg/mL atau (ii) ke nanopartikel perak 16 (AgNPs, bahan untuk perbandingan) dalam sampel yang disonikasi (larutan stok 2 mg/mL dalam air yang disonikasi 10 menit) pada 0, 80 dan 160 μg/mL. Panel mencatat bahwa informasi yang diberikan tentang persiapan sampel, termasuk rincian sonikasi, tidak memadai. Selain itu, Panel mencatat bahwa tidak ada justifikasi yang diberikan mengenai pemilihan konsentrasi tertinggi (160 μg/mL). Benzo[α]pyrene, etoposide atau nocodazole digunakan sebagai kontrol positif untuk γH2AX dan p-H3, masing-masing.
Tidak ada sitotoksisitas yang diamati pada konsentrasi yang diuji untuk kedua bahan yang diuji di ketiga lini sel. Paparan terhadap 80 dan 160 μg/mL E 174 yang disonikasi menyebabkan peningkatan yang bergantung pada konsentrasi dan signifikan secara statistik ( p < 0,01) dalam γH2AX pada sel HepG2, tetapi tidak pada sel LS-174T dan ACHN, dibandingkan dengan kontrol negatif. Tidak ada efek E 174 yang disonikasi yang diamati pada p-H3 untuk salah satu dari empat konsentrasi yang diuji, di lini sel mana pun. Tidak ada efek E 174 yang tidak disonikasi terlihat pada γH2AX dan p-H3, untuk salah satu dari empat konsentrasi yang diuji, di lini sel mana pun. AgNP yang disonikasi menyebabkan peningkatan yang signifikan secara statistik pada γH2AX, tetapi tidak ada perubahan pada kadar p-H3, pada sel HepG2 pada konsentrasi tertinggi yang diuji saja (160 μg/mL).
Uji stres oksidatif dilakukan dengan E 174 yang disonikasi dan N-asetilsistein sebagai antioksidan, dan secara paralel dengan butionin sulfoksimin sebagai pro-oksidan untuk menguji hipotesis bahwa induksi γH2AX yang diamati pada sel HepG2 yang diobati dikaitkan dengan peningkatan stres oksidatif. Penulis studi melaporkan bahwa E 174 yang disonikasi menyebabkan peningkatan yang signifikan secara statistik ( p < 0,01) dalam stres oksidatif pada 160 μg/mL setelah 4 jam paparan in vitro pada sel HepG2, dan peningkatan yang signifikan secara statistik ( p < 0,05) dan bergantung pada konsentrasi pada 80 dan 160 μg/mL setelah 24 jam paparan.
Penulis studi menyimpulkan bahwa E 174 yang disonikasi menimbulkan efek klastogenik dengan peningkatan yang signifikan secara statistik dan bergantung pada konsentrasi dalam induksi fosforilasi γH2AX pada 80 dan 160 μg/mL setelah paparan 24 jam tanpa efek sitotoksik pada sel HepG2. Efeknya tidak tampak pada sel LS-174T dan pada lini sel ACHN, yang menunjukkan bahwa E 174 memiliki mode aksi klastogenik pada sel HepG2 (Dokumentasi diberikan kepada EFSA No. 2).
Mengingat bahwa penelitian tersebut dilakukan menurut metode yang tidak tervalidasi (tidak ada Pedoman yang tersedia dan bukan penelitian GLP), penelitian tersebut dinilai tidak dapat diandalkan menurut pendekatan Harmonisasi EFSA untuk keandalan pelaporan dan relevansi penelitian genotoksisitas (EFSA, 2023 ). Selain itu, dalam laporan teknis EFSA (EFSA, 2023 ), uji γH2AX dianggap sebagai ‘uji dengan relevansi yang lebih rendah yang hanya dapat digunakan sebagai informasi pendukung untuk identifikasi bahaya’.
3.4.1.2 Uji pra-penyaringan in vivo
IBO mengirimkan data dari uji PrediScreen yang dilakukan pada jaringan usus besar (segmen jaringan usus) dan hati (lobus median kanan) tikus jantan dan betina C57BL/6J (Dokumentasi diberikan kepada EFSA No. 3) dari studi toksisitas oral dosis berulang selama 90 hari (lihat Bagian 3.4.2 ) . Rincian lebih lanjut tentang deskripsi studi dapat ditemukan di Lampiran A.
Empat kelompok tikus (10 tikus/jenis kelamin/kelompok) diberi E 174 (bubuk) (0, 1, 10, 100 μg/kg bb per hari) atau AgNPs 17 (100 μg/kg bb per hari) dalam makanan selama 90 hari (lihat bab 3.4.2 untuk pertimbangan dalam persiapan pakan) (Dokumentasi diberikan kepada EFSA No. 4).
Para penulis studi membenarkan pemilihan dosis yang diuji berdasarkan paparan makanan manusia terhadap E 174 yang diperkirakan oleh Panel ANS EFSA ( 2016 ).
Hasilnya menunjukkan bahwa E 174 menyebabkan peningkatan yang signifikan secara statistik ( p < 0,01) dalam fosforilasi biomarker H2AX (γH2AX) di kolon tikus betina pada semua dosis yang diuji (1, 10 dan 100 μg/kg bb per hari) dan pada tikus jantan pada 10 dan 100 μg/kg bb per hari. Pada tikus betina, efeknya dianggap bergantung dosis, sedangkan pada tikus jantan peningkatannya tidak bergantung dosis. Demikian pula, AgNP menyebabkan peningkatan γH2AX yang signifikan secara statistik pada dosis tunggal yang diuji sebesar 100 μg/kg bb per hari ( p < 0,01) di kolon jantan dan betina. Baik E 174 maupun AgNP tidak menyebabkan efek pada biomarker H3 (p-H3) pada sampel kolon dan hati pada tikus jantan atau betina.
Penulis studi menyimpulkan bahwa temuan ini menunjukkan potensi efek klastogenik E 174 dan AgNPs pada usus besar tikus C57BL/6J, sebagaimana dibuktikan oleh induksi γH2AX.
Panel mencatat bahwa IBO memberikan ringkasan analisis BMD dari respons untuk γH2AX yang diperoleh dalam usus besar tikus betina dan jantan, meskipun laporan BMD tidak diserahkan.
Mengingat bahwa penelitian tersebut dilakukan menurut metode yang tidak tervalidasi (tidak ada Pedoman yang tersedia dan bukan penelitian GLP), maka penelitian tersebut dinilai tidak dapat diandalkan menurut laporan teknis EFSA (EFSA, 2023 ). Selain itu, dalam laporan teknis EFSA (EFSA, 2023 ), uji γH2AX dianggap sebagai ‘uji yang kurang relevan yang hanya dapat digunakan sebagai informasi pendukung untuk identifikasi bahaya’.
3.4.1.3 Ringkasan keseluruhan data genotoksisitas
Panel menilai bahwa data yang disajikan oleh IBO memiliki relevansi rendah untuk penilaian genotoksisitas E 174. Studi genotoksisitas pada E 174 yang disediakan oleh IBO sebagai respons terhadap permintaan data EC tidak memenuhi persyaratan untuk pengujian genotoksisitas yang ditetapkan dalam panduan Panel EFSA ANS (Panel EFSA ANS, 2012 ). Mengingat adanya partikel kecil termasuk nanopartikel dalam E 174, data genotoksisitas seharusnya dibuat dengan mempertimbangkan pertimbangan khusus yang berlaku untuk kasus ini dan dijelaskan dalam dokumen Panduan EFSA tentang penilaian risiko nanomaterial (EFSA Scientific Committee et al., 2018 , 2021b ).
3.4.2 Toksisitas subkronis
IBO mengajukan studi toksisitas oral subkronis pada tikus (Dokumentasi diberikan kepada EFSA No. 4).
Tikus C57BL/6J jantan dan betina berumur lima minggu (10/jenis kelamin/kelompok) diberi E 174 (bubuk, ‘proses daun’) (0, 1, 10 atau 100 μg/kg bb per hari) atau partikel nano perak (AgNP) (0 atau 100 μg/kg bb per hari) dalam makanan selama 90 hari sebagai pembanding. Informasi lebih lanjut tentang karakterisasi bahan yang diuji diberikan dalam Lampiran B. Penulis studi membenarkan pemilihan dosis yang diuji berdasarkan paparan E 174 dalam makanan manusia yang diperkirakan oleh Panel EFSA ANS (Panel EFSA ANS, 2016 ).
Pakan disiapkan satu kali, dengan pencampuran dan formulasi pelet dengan pemadatan dan disimpan dalam kondisi penyimpanan yang sesuai selama durasi penelitian. Bahan uji E 174 dan AgNP ditambahkan ke pakan ternak dalam bentuk bubuk. Tidak ada informasi lebih lanjut yang diberikan tentang persiapan pakan dengan E 174 atau AgNP dan tingkat agregasi/penggumpalan partikel perak di dalamnya. Lebih jauh, tidak ada perbandingan antara agregasi/penggumpalan E 174 dalam pakan dengan agregasi/penggumpalan E 174 seperti yang ada dalam makanan yang dipasarkan. Panel mencatat bahwa juga tidak ada informasi tentang homogenitas E 174 dan AgNP dalam pakan yang diberikan.
Barang-barang uji dapat ditoleransi dengan baik, tidak ada tanda-tanda klinis yang diamati selama penelitian dan tidak ada kelainan morfologi (makroskopis) yang diamati pada hari pengorbanan di organ perut dan panggul. Tidak ada kematian selama penelitian dan tidak ada perbedaan signifikan dalam asupan makanan dan berat badan (ringkasan terperinci penelitian tersedia di Lampiran B ).
Semua hewan pada akhir penelitian diperiksa untuk mengetahui perubahan mikrobiota usus (berdasarkan analisis tinja); kadar lipokalin-2 feses; permeabilitas ileum dan ekspresi sitokin mukosa kolon tertentu. Namun, analisis partikel (jejunum, bercak Peyer, kolon, hati, dan limpa) dan skor inflamasi (usus halus, kolon, hati, dan limpa) pada potongan jaringan yang diwarnai dengan hematoksilin dan eosin (H&E) dibatasi hingga tiga hewan per jenis kelamin (data dari semua 6 hewan digabungkan) dalam kelompok kontrol dan kelompok E 174 dosis tinggi serta AgNPs.
Beberapa perubahan dalam aktivitas metabolisme mikrobiota usus (berdasarkan analisis tinja) telah diamati. Akan tetapi, pemahaman yang jelas tentang signifikansi perubahan dalam struktur dan fungsi mikrobiota usus pada hewan laboratorium dan relevansinya terhadap kesehatan manusia belum dijelaskan; penelitian lebih lanjut masih berlangsung dan saat ini Panel belum dapat membuat kesimpulan apa pun tentang masalah ini.
Di jejunum, partikel hanya jarang terlihat di bercak Peyer pada tikus yang diobati dengan E 174 dan AgNPs. Keberadaan perak dikonfirmasi oleh TEM-EDX pada tikus yang diobati dengan E 174 dan AgNPs, tetapi tidak ada perubahan yang terdeteksi pada permeabilitas ileum dan tidak ada perubahan pada skor inflamasi pada potongan jaringan usus halus yang diwarnai H&E pada tikus yang diobati dengan E 174 atau AgNPs.
Di kolon, partikel jarang terlihat pada tikus yang diobati dengan E 174 tetapi ada pada tikus yang diobati dengan AgNPs. Namun, pada semua partikel yang diperiksa di jaringan kolon dengan SEM–EDX, perak tidak terdeteksi. Tidak ada perubahan dalam skor patologi inflamasi pada potongan jaringan terbatas yang diwarnai H&E yang diperiksa dari tikus yang diobati dengan E 174 tetapi ada peningkatan skor pada tikus yang diobati dengan AgNPs.
Ekspresi dan produksi sitokin pro- dan anti-inflamasi oleh mukosa kolon dievaluasi menggunakan qPCR (pengujian RNA) dan ELISA (pengujian protein). Informasi terbatas diberikan tentang bagaimana mukosa kolon dipersiapkan untuk pengujian.
Secara keseluruhan, pada hewan betina yang terpapar E 174, terjadi penurunan sitokin pro- dan anti-inflamasi. Sementara pada hewan jantan, sitokin anti-inflamasi IL-10 dapat secara selektif menghambat ekspresi IL-1β tanpa memengaruhi produksi faktor nekrosis tumor-α (TNF-α), yang kadarnya meningkat pada hewan yang diberi E 174 pada semua dosis.
Pada hewan yang diobati dengan AgNPs, efek supresif pada profil imun di usus tikus jantan dan betina diamati. Kesimpulan ini didasarkan pada pengurangan sitokin pro-inflamasi (IL-1β dan TNF-α) dan anti-inflamasi (IL-10). Perbedaan antara skor inflamasi usus pada potongan jaringan yang diwarnai H&E dari hewan yang diobati dengan AgNPs dan penurunan kadar sitokin dalam jaringan usus besar dapat dijelaskan oleh sifat inflamasi yang terlokalisasi, waktu, inefisiensi transportasi sitokin, atau proses degradasi.
Mengenai kadar Lcn-2 feses, tidak ada perubahan yang diamati pada tikus jantan yang diobati dengan AgNPs dan E 174. Pada tikus betina, peningkatan kadar Lcn-2 feses yang sedikit tetapi tidak signifikan secara statistik dicatat pada tikus yang diobati dengan AgNPs dibandingkan dengan kontrol. Tidak ada perubahan yang diamati pada tikus betina yang diobati dengan E 174.
Di hati, partikel hanya jarang terlihat pada tikus yang diobati dengan E 174 tetapi ada pada tikus yang diobati dengan AgNPs. Keberadaan perak hanya dikonfirmasi oleh TEM-EDX dalam partikel pada tikus yang diobati dengan AgNPs. Tidak ada perubahan dalam skor inflamasi pada potongan jaringan terbatas yang diwarnai H&E yang diperiksa dari tikus yang diobati dengan E 174 tetapi ada peningkatan skor pada tikus yang diobati dengan AgNPs.
Pada limpa, partikel hanya jarang terlihat pada tikus yang diobati dengan E 174 dan AgNPs. Namun, perak tidak terdeteksi oleh TEM-EDX pada partikel apa pun yang diperiksa. Tidak ada perubahan skor inflamasi pada potongan jaringan terbatas yang diwarnai H&E yang diperiksa dari tikus yang diobati dengan E 174, tetapi bukti cedera dan perubahan patologis pada tikus yang diobati dengan AgNPs.
Penulis studi tersebut menyatakan bahwa ‘desain studi didasarkan pada pedoman berikut: pengujian toksisitas oral subkronis berdasarkan Pedoman OECD No. 408, Studi Toksisitas Oral Dosis Berulang 90 Hari pada Hewan Pengerat (OECD, 2018 ); Panduan EFSA tentang penilaian risiko penerapan nanosains dan nanoteknologi dalam rantai makanan dan pakan: Bagian 1, kesehatan manusia dan hewan’. 18 Panel mencatat beberapa batasan utama, dengan yang paling penting adalah: (i) data tentang berat organ tidak diserahkan; (ii) pengawetan jaringan untuk histologi hanya dilakukan pada beberapa jaringan (usus halus, bercak Peyer, usus besar, hati, limpa); (iii) parameter hematologi dan biokimia klinis tidak dilakukan; (iv) pemeriksaan mikroskopis hanya dilakukan pada usus (jejunum dan usus besar), hati dan limpa; (v) perubahan histomorfologi hanya dievaluasi di hati dan limpa, dan evaluasi ini hanya dilakukan pada 3 dari 10 hewan per kelompok per jenis kelamin dalam kelompok AgNPs dan dalam kelompok dosis tertinggi E 174; (vi) kadar hormon tidak ditentukan; (vii) parameter yang menunjukkan efek endokrin tidak dievaluasi. Panel juga mencatat bahwa penulis menyatakan bahwa penelitian tersebut tidak dilakukan mengikuti prinsip GLP.
Secara keseluruhan, Panel menganggap penelitian ini terbatas kemampuannya untuk menilai perubahan inflamasi pada sejumlah kecil organ yang diperiksa. Dengan mempertimbangkan bahwa tingkat ekspresi hanya sejumlah kecil sitokin yang relevan dengan inflamasi diperiksa pada mukosa kolon semua hewan, Panel menganggap perubahan tersebut bersifat insidental atau – dalam hal apa pun – adaptif dan tidak selalu menunjukkan efek samping.
Selain itu, Panel mencatat bahwa relevansi hasil untuk menilai potensi toksisitas partikel/agregat/aglomerat berukuran nano tidak dapat diverifikasi (yaitu relevansinya tidak dapat dikonfirmasi atau dapat dikecualikan) karena persiapan sampel; kurangnya informasi tentang tingkat aglomerasi aditif makanan murni dan kurangnya informasi tentang tingkat aglomerasi saat dimasukkan ke dalam pakan. Situasi ini menciptakan ketidakpastian mengenai kapasitas hasil studi untuk menyelidiki potensi toksisitas partikel/agregat/aglomerat berukuran nano.
3.5 Pelepasan ion perak
Berikut ini adalah hal-hal yang diminta dalam panggilan data EC ke-19 :
- Data tentang pelepasan ion perak dari unsur perak dalam E 174: perak dalam bahan tambahan pangan E 174 hadir dalam bentuk unsurnya. Ada bukti pelepasan ion perak dari unsur perak, yang mungkin perlu diperhatikan. Namun, tingkat pelepasan ion perak, yang bergantung pada beberapa faktor seperti pH dan ukuran partikel, tidak diketahui dalam kasus perak (E 174) yang digunakan sebagai bahan tambahan pangan. Oleh karena itu, data tentang pelepasan ion perak dari bahan tambahan (dengan ukuran partikel yang sepenuhnya dikarakterisasi), dalam media penyangga berair dalam kisaran pH (1,5–7,4) pada suhu 37°C dan pada konsentrasi dan waktu yang relevan, diminta.
Tidak ada data yang diberikan oleh IBO tentang pelepasan ion perak dari bahan tambahan pangan E 174 (dengan ukuran partikel yang dikarakterisasi sepenuhnya) seperti yang diminta dalam permintaan data.
4 DISKUSI
Perak (E 174) adalah pewarna makanan yang dievaluasi ulang oleh Panel ANS pada tahun 2016 (Panel ANS EFSA, 2016 ). Sebagai tindak lanjut dari opini evaluasi ulang tersebut, EC mengeluarkan seruan publik untuk mengumpulkan data dari IBO yang dapat mengurangi ketidakpastian dan kesenjangan dalam kumpulan data yang sebelumnya diidentifikasi oleh Panel ANS.
Menanggapi permintaan data EC, satu IBO memberikan informasi tentang karakterisasi, proses manufaktur, ukuran partikel dan morfologi perak yang digunakan sebagai bahan tambahan makanan (E 174).
Berdasarkan data yang disampaikan, perak (E 174) mengandung tidak kurang dari 99,5% (b/b) perak dan hingga 0,5% (b/b) emas dan/atau tembaga. E 174 digambarkan sebagai ‘material metalik dalam bentuk lembaran dan bubuk kecil’. Menurut informasi yang diberikan kepada EFSA, E 174 diproduksi melalui dua proses yang berbeda: (i) ‘proses atomisasi’ untuk menghasilkan bubuk perak dan (ii) ‘proses daun’ untuk menghasilkan daun atau bubuk perak (lihat Bagian 3.2.1 ). IBO menyatakan bahwa E 174 yang dihasilkan dari kedua proses tersebut terdiri dari ‘partikel homogen, tidak berpori’ yang berbentuk keping-keping dengan dua dimensi yang relatif besar dan tidak teratur dan dengan satu dimensi kecil dan teratur yang mewakili ketebalan.
IBO memberikan informasi terbatas tentang ukuran partikel E 174. Hanya satu gambar SEM kualitatif yang disediakan untuk E 174 yang diproduksi oleh ‘proses atomisasi’ dan tidak ada data yang disediakan untuk E 174 yang diproduksi sebagai daun melalui ‘proses daun’.
Informasi kuantitatif yang tidak lengkap tentang ukuran partikel diberikan untuk dua sampel E 174 yang diproduksi sebagai bubuk melalui ‘proses daun’. Ketebalan rata-rata dan ketebalan median dari 100 keping perak dilaporkan sama: 170 nm untuk satu sampel dan 182 nm untuk sampel lainnya. Fraksi partikel (berdasarkan jumlah) dengan ketebalan kurang dari 100 nm adalah 0% dan 3% untuk kedua sampel.
IBO mengusulkan karakterisasi berikut untuk E 174 dalam spesifikasi UE: maksimum 10% partikel (berdasarkan jumlah) dengan satu dimensi di bawah 100 nm dan 1% partikel (berdasarkan jumlah) dengan satu dimensi di bawah 50 nm.
IBO selanjutnya menyatakan bahwa variasi dimensi terkecil partikel terkait dengan variabilitas proses manufaktur dan parameter produksi yang berbeda dari daun perak yang diproduksi oleh produsen. Panel mencatat bahwa jumlah terbatas sampel yang diperiksa yang diproduksi sebagai bubuk oleh satu proses manufaktur mungkin tidak mewakili semua perak yang digunakan sebagai E 174 yang tersedia di pasar UE. Panel selanjutnya mencatat bahwa ambang batas dan kandungan maksimum partikel berdasarkan jumlah yang diusulkan oleh IBO untuk spesifikasi E 174 tidak didukung oleh data analitis. Lebih lanjut, Panel mengidentifikasi ketidakpastian yang signifikan dalam data yang diberikan oleh IBO, yaitu:
–IBO tidak memberikan informasi kuantitatif tentang dimensi lateral lempengan perak yang diproduksi oleh ‘proses daun’.
–IBO memperkirakan bahwa dalam E 174 tingkat maksimum partikel dengan satu dimensi di bawah 100 nm adalah 10%. Namun, informasi dari literatur (De Vos et al., 2020 ; Waegeneers et al., 2019 ) menunjukkan bahwa nanopartikel dilepaskan dari produk kembang gula yang mengandung E 174 ketika produk tersebut dimasukkan ke dalam air. Studi-studi ini menemukan bahwa 97% (berdasarkan jumlah) partikel memiliki setidaknya satu dimensi lebih kecil dari 100 nm dan ukuran median (D50) 11 nm (TEM). Partikel perak yang dilepaskan sebagian besar berbentuk bulat, meskipun massa perak terbesar hadir sebagai serpihan dengan tepi yang sangat kasar (De Vos et al., 2020 ). Oleh karena itu, berdasarkan hasil penelitian tersebut, Panel menilai bahwa persentase jumlah nanopartikel yang dilepaskan dari E 174 dalam produk kembang gula lebih tinggi daripada yang diharapkan berdasarkan hasil yang dilaporkan untuk bahan murni sebagaimana diselidiki oleh IBO.
–Untuk bubuk perak yang diperoleh melalui ‘proses atomisasi’, IBO tidak memberikan data kuantitatif apa pun tentang distribusi ukuran partikel dan hanya satu gambar SEM yang tersedia yang resolusinya tidak memungkinkan visualisasi partikel penyusun dalam rentang nano. Atas permintaan, tidak ada klarifikasi lebih lanjut tentang aspek tersebut yang diberikan oleh IBO dan oleh karena itu Panel tidak dapat mengecualikan bahwa E 174 yang diperoleh dalam proses ini mengandung persentase yang jauh lebih tinggi daripada 10% partikel dengan satu dimensi di bawah 100 nm, seperti yang diusulkan dalam spesifikasi oleh IBO.
–Data yang diserahkan tidak memberikan informasi tentang dimensi eksternal minimal (ketebalan terendah yang diukur) dari lempengan perak yang diproduksi oleh kedua proses.
–Tidak jelas apakah perak yang digunakan sebagai bahan tambahan makanan E 174 dilapisi atau difungsikan.
Klarifikasi mengenai semua aspek ini tidak diberikan oleh IBO dalam menanggapi permintaan EFSA untuk informasi tambahan.
Berdasarkan data yang disajikan di atas, Panel berpendapat bahwa data yang diberikan oleh IBO mengenai karakterisasi perak (E 174) tidak cukup untuk mengkarakterisasi bahan yang digunakan sebagai bahan tambahan pangan secara menyeluruh. Akibatnya, Panel tidak dapat mengusulkan spesifikasi untuk perak (E 174) terkait morfologi dan ukuran partikel, seperti yang diminta dalam Kerangka Acuan (lihat Bagian 1.1 ).
Meskipun demikian, Panel mencatat bahwa berdasarkan data yang diberikan (median (D50) 170,2–182,4 nm), lebih dari 10% partikel perak yang digunakan sebagai bahan tambahan pangan E 174 yang diproduksi sebagai bubuk dalam ‘proses leaves’ memiliki setidaknya satu dimensi yang lebih kecil dari 250 nm. Oleh karena itu, dengan mempertimbangkan fitur ini dan mengikuti Panduan EFSA tentang Particle-TR (Komite Ilmiah EFSA, 2021 ), Panel berpendapat bahwa perak (E 174) mengandung partikel kecil termasuk nanopartikel.
Lebih jauh, Panel mencatat bahwa perak (kawat perak, masif 20 ) dianggap tidak larut dalam air (maks 0,03 μg/L) (ECHA, 2024 ) dan kelarutan perak bervariasi tergantung pada ukuran dan bentuk partikel. Partikel perak yang dinilai oleh SCCS terdiri dari partikel bulat dengan ukuran partikel median sekitar 120 nm larut dalam larutan penyangga air pada 22,8, 1,13 dan 0,15 mg/L pada pH 5, 7 dan 9, masing-masing dan dianggap tidak larut dalam air (SCCS, 2024 ).
Oleh karena itu, sejalan dengan Panduan EFSA tentang Partikel -TR (Komite Ilmiah EFSA, 2021a ), dengan mempertimbangkan kelarutan perak dan keberadaan partikel kecil termasuk nanopartikel dalam E 174, Panel berpandangan bahwa perak yang digunakan sebagai bahan tambahan pangan E 174 memerlukan penilaian risiko pada skala nano mengikuti Panduan EFSA tentang Penilaian Risiko Nano (Komite Ilmiah EFSA, 2021b ), untuk melengkapi penilaian risiko konvensional yang dilakukan sesuai dengan panduan sektoral yang berlaku (Panel ANS EFSA, 2012 ).
Panel selanjutnya mencatat bahwa tidak ada data yang diberikan oleh IBO tentang pelepasan ion perak dari bahan tambahan makanan (dengan ukuran partikel yang dikarakterisasi sepenuhnya), seperti yang diminta dalam permintaan data.
Oleh karena itu, karena kurangnya informasi dan ketidakpastian yang tersisa mengenai sifat-sifat utama perak (E 174) (misalnya distribusi ukuran partikel, bentuk, komposisi, pelepasan ion perak), yang penting untuk menentukan apakah bahan-bahan perak yang diuji dalam studi toksisitas yang dipublikasikan dalam literatur terbuka relevan untuk penilaian E 174, Panel menganggap bahwa melakukan penelusuran literatur untuk mengidentifikasi bukti tambahan dari literatur terbuka untuk mengevaluasi keamanan E 174, tidaklah layak. Akibatnya, tidak ada penelusuran literatur yang dilakukan seperti yang diminta dalam Kerangka Acuan mandat saat ini dan penilaian saat ini hanya mempertimbangkan data yang diajukan oleh satu IBO sebagai tanggapan terhadap permintaan data EC. 21
Dalam evaluasi ulang perak (E 174) pada tahun 2016, Panel ANS mengevaluasi studi yang dilakukan dengan AgNP tanpa membedakan ukuran dan bentuk berbagai bahan yang diuji dan menyimpulkan bahwa studi yang tersedia pada saat itu memberikan bukti yang jelas tentang potensi genotoksis dalam berbagai sistem uji in vitro (Panel ANS EFSA, 2016 ). Data genotoksisitas oral in vivo memberikan bukti yang kurang meyakinkan, dan tidak memungkinkan penilaian definitif tentang kemungkinan bahaya genotoksis yang terkait dengan paparan oral terhadap AgNP.
Informasi toksikologi yang sejalan dengan pendekatan berjenjang yang dijelaskan dalam panduan terkini EFSA untuk pengajuan evaluasi bahan tambahan pangan (Panel EFSA ANS, 2012 ) diminta dalam permintaan data untuk perak yang digunakan sebagai bahan tambahan pangan E 174. IBO hanya menyediakan data tentang genotoksisitas dan toksisitas subkronis.
Mengenai genotoksisitas, IBO hanya menyediakan satu studi in vitro dan satu studi in vivo menggunakan uji Prediscreen. Panel mencatat bahwa uji Prediscreen, baik in vitro maupun in vivo, tidak divalidasi untuk penilaian risiko regulasi, tidak termasuk dalam pengujian yang direkomendasikan dalam dokumen panduan EFSA saat ini, dan tidak termasuk dalam pedoman pengujian OECD yang direkomendasikan untuk penilaian potensi genotoksisitas (OECD, 2017 ).
Selain itu, Panel menganggap bahwa kedua studi tersebut tidak dapat diandalkan, dan persiapan sampel tidak memadai untuk penilaian partikel pada skala nano. Panel menganggap data yang disajikan oleh IBO memiliki relevansi rendah untuk penilaian genotoksisitas E 174. Oleh karena itu, Panel menganggap bahwa studi genotoksisitas pada E 174 yang disediakan oleh IBO sebagai tanggapan terhadap permintaan data EC tidak memenuhi persyaratan untuk pengujian genotoksisitas yang ditentukan dalam panduan Panel ANS EFSA (Panel ANS EFSA, 2012 ). Mengingat adanya partikel kecil termasuk nanopartikel dalam data genotoksisitas E 174 seharusnya dihasilkan mengikuti Panduan EFSA (Komite Ilmiah EFSA, 2018 ; Komite Ilmiah EFSA, 2021b ).
Studi toksisitas subkronis diet dengan E 174 pada tikus diajukan oleh IBO. Tidak ada perubahan klinis, tidak ada perbedaan signifikan dalam asupan makanan atau berat badan di semua kelompok selama studi. Partikel perak hanya diamati di bercak Peyer yang ada di jejunum, bukan di kolon. Tidak ada perubahan yang konsisten dan koheren dalam skor inflamasi di daerah jejunum atau kolon yang diamati dibandingkan dengan kelompok kontrol pada hewan yang diobati dengan E 174. Namun, analisis partikel kualitatif dan skor inflamasi dibatasi pada tiga hewan dari setiap jenis kelamin dalam kelompok kontrol dan dosis tinggi E 174. Semua hewan diperiksa untuk mengetahui perubahan lipocalin-2 feses dan perubahan ekspresi sitokin tertentu di mukosa kolon. Tidak ada perubahan lipocalin-2 feses di semua kelompok. Pada wanita yang terpapar E 174, penurunan sitokin pro- dan anti-inflamasi diamati di mukosa kolon. Pada laki-laki, terjadi peningkatan IL-10 dan TNF-α tetapi tidak ada peningkatan IL-1β. Panel menganggap sitokin anti-inflamasi IL-10 dapat secara selektif menghambat ekspresi IL-1β tanpa memengaruhi produksi TNF-α. Secara keseluruhan, Panel menganggap penelitian ini terbatas kemampuannya untuk menilai perubahan inflamasi karena terbatasnya jumlah organ yang diperiksa. Dengan mempertimbangkan bahwa pemilihan terbatas tingkat ekspresi sitokin yang relevan dengan inflamasi diperiksa pada mukosa kolon semua hewan, Panel menganggap perubahan tersebut bersifat insidental atau dalam hal apa pun adaptif dan tidak selalu menunjukkan efek samping.
Karena informasi yang tidak memadai tentang penambahan perak (E 174) dalam pakan dan tingkat agregasi/penggumpalan di dalamnya dibandingkan dengan E 174 dalam makanan komersial, Panel menganggap bahwa relevansi hasil studi toksisitas subkronis untuk menilai partikel/agregat berukuran nano tidak dapat diverifikasi (yaitu relevansinya tidak dapat dikonfirmasi, juga tidak dapat dikecualikan). Secara khusus, tidak adanya efek mungkin disebabkan oleh kurangnya paparan terhadap partikel/agregat berukuran nano. Situasi ini menimbulkan ketidakpastian mengenai kapasitas studi untuk menyelidiki potensi toksisitas partikel/agregat/aglomerat berukuran nano yang ada dalam makanan yang tersedia di pasaran.
Oleh karena itu, Panel berpandangan bahwa data yang diperoleh dari studi toksisitas sub-kronis tidak cukup untuk menyimpulkan keamanan bahan tambahan pangan.
Lebih jauh lagi, Panel mempertimbangkan bahwa perak (E 174) yang diuji dalam kedua uji genotoksisitas dan dalam studi toksisitas sub-kronis, diproduksi dalam bentuk bubuk melalui ‘proses daun’, yang mungkin tidak mewakili semua jenis perak yang digunakan sebagai bahan tambahan pangan E 174 yang tersedia di pasaran.
Secara keseluruhan, Panel menganggap bahwa data yang disampaikan dalam tanggapan terhadap permintaan data EC tidak mencukupi. Mereka tidak memiliki karakterisasi fisikokimia yang memadai dari semua jenis perak yang digunakan sebagai E 174 yang tersedia di pasar UE, menghalangi penilaian pelengkap menggunakan data dari literatur terbuka. Tidak ada data tentang pelepasan ion perak yang disampaikan. Panel juga menganggap bahwa data genotoksisitas yang tersedia tidak memadai untuk mengevaluasi bahaya genotoksik yang terkait dengan penggunaan perak (E 174). Lebih lanjut, Panel menganggap bahwa data toksisitas yang tersedia tidak cukup untuk menilai keamanan perak yang digunakan sebagai bahan tambahan pangan E 174 menurut Panduan EFSA sektoral (Panel EFSA ANS, 2012 ) dan panduan pelengkap dan berlaku untuk penilaian risiko nanomaterial yang akan diterapkan dalam rantai pangan dan pakan (Komite Ilmiah EFSA, 2021b ).
5 KESIMPULAN
Panel menyimpulkan bahwa data teknis yang disampaikan oleh IBO mengenai karakterisasi fisikokimia semua jenis perak yang digunakan sebagai bahan tambahan pangan E 174 di pasaran UE tidak memadai, oleh karena itu, Panel tidak dapat mengusulkan perubahan terhadap spesifikasi UE saat ini untuk perak (E 174) terkait dengan morfologi dan ukuran partikel.
Karena kurangnya karakterisasi fisikokimia yang memadai dari perak (E 174), tidak adanya data tentang pelepasan ion perak dari E 174 dan data yang tidak memadai tentang toksisitas dan genotoksisitas, Panel tidak dapat menyimpulkan tentang keamanan bahan tambahan pangan perak (E 174).
6 DOKUMENTASI SEBAGAIMANA DISEDIAKAN KEPADA EFSA
- Pengajuan data sebagai tanggapan atas permintaan Komisi Eropa untuk data teknis tentang aditif makanan yang diizinkan, yaitu perak (E 174). Diserahkan oleh Or A DÉCOR (Konsorsium Produsen Emas dan Perak yang Dapat Dimakan di Eropa) pada tanggal 8 Februari 2023.
- PrediTox SAS, 2020, uji genotoksisitas PrediScreen in vitro (uji γH2AX/p-H3) dengan E 174 dan AgNP (perbandingan), Diserahkan oleh Or A DÉCOR (Konsorsium Produsen Emas dan Perak yang Dapat Dimakan Eropa) pada tanggal 8 Februari 2023.
- PrediTox SAS, 2021, uji genotoksisitas PrediScreen in vivo (uji γH2AX/p-H3) dengan E 174 dan AgNP (perbandingan) (jaringan dari penelitian: INREA, UMR 1331, Toxalim, 2021), Diserahkan oleh Or A DÉCOR (Konsorsium Produsen Emas dan Perak yang Dapat Dimakan di Eropa) pada tanggal 8 Februari 2023.
- INREA, UMR 1331 Toxalim, (Pusat Penelitian Toksikologi Pangan) 2021. Studi toksisitas selama 13 minggu melalui rute oral (senyawa uji yang dimasukkan ke dalam pelet makanan) pada tikus jantan dan betina. Diserahkan oleh Or A DÉCOR (Konsorsium Produsen Emas dan Perak yang Dapat Dimakan di Eropa) pada tanggal 8 Februari 2023.
SINGKATAN
AFM
mikroskopi gaya atom
Pertanian +
ion perak
Taman Nasional AgNP
nanopartikel perak
Panel ANS
Panel EFSA tentang Bahan Tambahan Pangan dan Sumber Nutrisi yang Ditambahkan ke Makanan
BERTARUH
Brunauer, Emmett dan Teller
BPC
Komite Produk Biocidal
Bahasa Indonesia: CAS
Layanan Abstrak Kimia
CLH
Klasifikasi dan Pelabelan yang Diharmonisasikan
ECHA
Badan Kimia Eropa
EDX
Spektroskopi Sinar-X Penyebaran Energi
EFSA
Otoritas Keamanan Pangan Eropa
Tes ELISA
Uji Imunosorben Terkait Enzim
GI
saluran pencernaan
GLP
Praktik Laboratorium yang Baik
DIA
Hematoksilin dan Eosin
IBO
operator bisnis yang berminat
Pesawat IL-10
interleukin-10
IL-1β
interleukin-1 beta
LCN-2
lipokain-2
Bahasa Inggris
bahan nano
TIDAK
Nomor
NOAEL
tidak ada tingkat efek samping yang diamati
Organisasi untuk Kerjasama Ekonomi dan Pembangunan (OECD)
Organisasi untuk Kerjasama Ekonomi dan Pembangunan
qPCR
Reaksi Rantai Polimerase Kuantitatif
Bahasa Inggris
Komite Penilaian Risiko
MENCAPAI
Registrasi, Evaluasi, Otorisasi dan Pembatasan Regulasi Bahan Kimia
ROS
spesies oksigen reaktif
SCCS
Komite Ilmiah tentang Keamanan Konsumen
SD
simpangan baku
SEJARAH
mikroskop elektron pemindaian
SP-ICP-Kedokteran
spektrometri massa plasma induktif partikel tunggal
TEMPUR
mikroskop elektron transmisi
TNF-α
faktor nekrosis tumor alfa
VSSA
volume luas permukaan spesifik
minggu minggu
Berat per berat

